A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש pHluorin כדי להעריך את הדינמיקה של קולטני הדרכה אקסון בתרבות התא בעובר אפרוח
* These authors contributed equally
In This Article
Summary
אנו מתארים כאן את השימוש בגרסת חלבון פלואורסצנטי ירוק רגיש pH, pHluorin, כדי לחקור את הדינמיקה המרחבית-זמנית של קולטני הדרכה אקסון סחר על פני התא. הקולטן pHluorin מתויג מתבטא הן בתרבות התא in vivo, באמצעות electroporation של העובר אפרוח.
Abstract
במהלך הפיתוח, קולטני הדרכה אקסון לשחק תפקיד מכריע בוויסות רגישות אקסונים רמזים אטרקטיביים ודוחה כאחד. ואכן, הפעלת קולטני ההנחיה היא הצעד הראשון של מנגנוני האיתות המאפשרים לאקסון טיפים, קונוסים לצמיחה, להגיב לליגנדים. ככזה, אפנון הזמינות שלהם על פני התא הוא אחד המנגנונים המשתתפים בקביעת רגישות חרוט הצמיחה. אנו מתארים כאן שיטה כדי לדמיין במדויק את הדינמיקה פני השטח של תא spatio-temporal של קולטן הדרכה אקסון הן במבחנה in vivo בחוט השדרה אפרוח המתפתח. ניצלנו את מאפיין הפלואורסצנטיות תלוי ה- pH של וריאנט חלבון פלואורסצנטי ירוק (GFP) כדי לזהות באופן ספציפי את השבר של קולטן ההנחיה של האקסון הממוען לקרום הפלזמה. אנו מתארים לראשונה את אימות במבחנה של מבנים תלויי pH כאלה ואנו מפרטים עוד יותר את השימוש בהם ב- vivo, באקורד עמוד השדרה של הגוזל, כדי להעריך את הדינמיקה המרחבית-טמפורלית של קולטן ההדרכה של האקסון.
Introduction
במהלך הניווט שלהם, אקסונים משלבים רמזים סביבתיים מרובים המנחים אותם לעבר המטרה שלהם. רמזים אלה להפעיל קולטני הדרכה על פני השטח של מסופי אקסון, קונוסים הצמיחה, אשר בתורו ליזום מסלול איתות מתאים. לכן, הרגולציה הזמנית והמרחבית של התפלגות פני התא של הקולטנים היא קריטית כדי להגדיר את הרגישות של חרוט הצמיחה1. בהקשר זה, חציית קו האמצע על ידי אקסונים קומיסרים היא מודל מצוין לחקור את הרגולציה של רמות פני התא הקולטן. בחוט השדרה המתפתח, אקסונים קומיסרים נמשכים בתחילה לכיוון צלחת הרצפה הגחונית שבה הם חוצים את קו האמצע. לאחר חציית הגבול, הם מאבדים את ההיענות שלהם למשיכת צלחת הרצפה ולקבל תגובה דוחי צלחת הרצפה, כך שהם יכולים לצאת צלחת הרצפה לנווט לכיוון היעד הסופי שלהם בצד הנגדי של מערכת העצבים2,3. ויסות זמינות הקולטן על משטח חרוט הצמיחה הוא אחד המנגנונים שבבסיס המתג של היענות רמזים קו האמצע4,5. לכן, ניטור סלקטיבי של הקולטנים נוכח קרום הפלזמה של קונוסים צמיחה הוא בעל חשיבות עליונה. אנו מתארים כאן שיטה המבוססת על מאפיין פלואורסצנטי תלוי pH של חלבון פלואורסצנטי ירוק (GFP) גרסה כדי לדמיין באופן ספציפי את קולטני הדרכה אקסון הממוענים קרום פלזמה במבחנה in vivo, בחוט השדרה אפרוח המתפתח.
רוטמן ועמיתיו מהונדסים על ידי מוטציות נקודתיות גרסאות רגישות pH של GFP כולל pHluorin האקליפטי6. pHluorin האקליפטי יש את המאפיין של להיות nonfluorescent כאשר נחשף pH חומצי (<6), תוך היותו פלואורסצנטי ב- pH ניטרלי. זה מאפשר להבחין קולטנים שאינם פלואורסצנטיים מקומיים בתאים חומציים תאיים(כלומר אנדוזומים, סחר בשלפוחיות) מקולטנים פלואורסצנטיים המשולבים בקרום הפלזמה ובכך נחשפים ל- pH ניטרלי חוץ-תאי7. ניצלנו זאת כדי לנטר את לוקליזציית קרום הפלזמה של plexinA1, קולטן הדרכה אקסון המתווך את תגובת חרוט הצמיחה לסמפורין דוחה קו האמצע 3B5 (איור 1A). אנו מתארים כאן אפיון במבחנה של מבנה pHluorin-plexinA1, יחד עם ב- ovo electroporation8-10 של מבנה זה בחוט השדרה אפרוח המתפתח ואחריו ניתוח מיקרוסקופי של cryosections המאפשרים לעקוב אחר הדינמיקה קולטן הדרכה אקסון ב vivo עם רזולוציות מרחביות וטמפורליות כאחד.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. אסטרטגיית שיבוט לתיוג קולטן PlexinA1 עם pHluorin
- בחר וקטור ביטוי מתאים כעמוד שדרה(למשל, קולטן העכבר plexinA1 מבטא וקטור, מתנה מעין של ד"ר אנדריאס פושל11).
הערה: וקטור plexinA1 זה תוכנן כדי להשיג החדרת קולטן יעילה HA- או VSV מתויג בקרום הפלזמה. - להגביר על ידי PCR את רצף קידוד pHluorin האקליפטי באמצעות פלסמיד נאותה כתבנית(למשל pHluorin מתויג GABA A קולטן, מתנה מסוג של ד"ר יעקב2). במידת הצורך, הוסף אתר הגבלה לקצה 5 'של פריימר על מנת להקל על שלב השיבוט עמוד השדרה.
- הכנס את רצף ה- pHluorin למסגרת בין פפטיד האות לרצף קידוד הקולטן באמצעות אתרי הגבלה(למשל אתרי הגבלה של NruI/Kpn2I כמתואר באיור 1B).
הערה: מכיוון שפפטיד האות המבטיח את המיקוד הנכון של הקולטנים הוא cleaved, pHluorin צריך להיות ממוקם אחריו. זה מצדיק את ההכרה של פפטיד האות ומונע מחשוף של pHluorin מן הקולטן של עניין. - רצף המבנים שהושגו כדי להבטיח כי אין מוטציה הוצגה על ידי PCR.
2. אפיון של קולטן pHluorin מתויג במבחנה בתאי COS7
היכולת של חלבון היתוך להגיע קרום הפלזמה ואובדן הפיך של פלואורסצנטיות כמו pH הוא הוריד ניתן לאשר באמצעות ההליך הבא.
- היום הראשון. צלחת 1.5 x 105 תאי COS7 בצלחת 35 מ"מ תחתית זכוכית ב 2 מ"ל של מלא של Dulbecco של הנשר שונה בינוני (DMEM - 10% סרום שור עוברי - 1 מ"מ נתרן פירובט - 25 U /ml פניצילין/סטרטומיצין - 2.5 מיקרוגרם/מ"ל אמפוטריצין B - pH 7.4).
- היום הראשון. תאי תעתיק:
הערה: תאים צריכים להיות 70-80% מפגש.- הכן 200 μl NaCl 150 מ"מ ולהוסיף 3 מיקרוגרם DNA כלומר קולטן קידוד וקטור pHluorin מתויג. בעדינות מערבולת לסובב למטה בקצרה.
הערה: מפה של וקטור pHluorin-plexinA1 המשמש בניסויים אלה מוצגת באיור 1B. - הוסף 10 μl של מגיב transfection (או את הכמות המתאימה של ריאגנט בשימוש). וורטקס מיד.
- דגירה 10 דקות ב RT.
- הוסף 200 μl של תערובת reagent / DNA transfection לתאים.
- להזיז את הצלחת בעדינות כדי להשיג חלוקה מחדש של התערובת ומניחים את התאים בחזרה לאינקובטור 37 מעלות צלזיוס.
- הכן 200 μl NaCl 150 מ"מ ולהוסיף 3 מיקרוגרם DNA כלומר קולטן קידוד וקטור pHluorin מתויג. בעדינות מערבולת לסובב למטה בקצרה.
- יום 3. הסר מדיום transfection והחלף אותו ב- 2 מ"ל של DMEM שלם טרי.
- יום 4. בצע הדמיית תאים חיים של COS7 pHluorin-plexinA1 תאים transfected:
- הכן שני aliquots של DMEM להשלים בינוני ולהתאים pH ל 3.5 ו 9.5, בהתאמה.
הערה: עבור צלחת אחת של 35 מ"מ, יש צורך ב-1.5 מ"ל מכל פתרון כדי לבצע את הניסוי. - הסר את מדיום התא והחלף אותו ב- 1 מ"ל של DMEM pH בינוני מלא 7.4.
- הכינו מזרק 5 מ"ל עם סוג מתאים של צינורות על מנת להזריק רכיבים שונים ישירות לתוך מדיום תרבות התא מבלי לפתוח את תא המיקרוסקופ.
- השתמש במודול המאפשר תחזוקה של 37 °C (70 °F), 5% CO2 אווירת עבודה לחה.
הערה: גישה חלופית לשימוש בתא CO2 היא להשתמש במדיום עם אגירת HEPES (בדרך כלל בטווח של 10-25 מ"מ בהתאם לסוג התא). - מניחים תאים בתא ומתאימים את הצינור ואת המזרק.
הערה: יש להשוות את המיקרוסקופ לפני שמתחילים להימנע מסחף מכני במהלך ההקלטה. - פתח את תוכנת ההדמיה ובחר את תוכנית הרכישה הרב-ממדית.
- מצא תאי COS7 שעברו חוצה עם המטרה 40X וסמן מיקום בתוכנה עבור כל אחד מהם.
- הגדר מחסנית Z כדי לקבל רכישת עומק 15 מיקרומטר (המוקד יכול להשתנות בעת הוספת מדיה בלוח).
- הגדר חשיפה עבור מסנן GFP והשלב.
- קבע תצורה של תזמון רכישה.
הערה: עבור כל הניסוי עם 5 תחומי עניין, רכישה כל 20 שניות במשך 10 דקות צריכה להספיק. - התחל ברכישה וצלם 5 תמונות בקרה במדיום DMEM pH 7.4.
- השהה רכישה, להזריק 1.25 מ"ל של pH 3.5 DMEM מלא כדי להשיג pH של 5.5 במדיום התרבות, לסמן אירוע בתוכנה ולחדש את הרכישה עבור 5 נקודות זמן נוספות.
הערה: פלואורסצנטיות ירוקה צריכה להיעלם בהדרגה. - השהה את הרכישה, הזרק 1.2 מ"ל של PH 9.5 DMEM מלא כדי להשיג pH 7.4 במדיום התרבות, לסמן אירוע בתוכנה ולחדש את הרכישה עבור 5 נקודות זמן נוספות.
הערה: פלואורסצנטיות ירוקה צריכה להופיע שוב בקרום הפלזמה. - לנתח תמונות.
איור 2 מציג תמונות מייצגות שהושגו באמצעות פרוטוקול כזה עם מבנה pHluorin-plexinA1.
- הכן שני aliquots של DMEM להשלים בינוני ולהתאים pH ל 3.5 ו 9.5, בהתאמה.
3. ב אובו אלקטרופורציה של pHluorin-plexinA1 בנייה
- טיפול בביצים לפני אלקטרופורציה:
- יש לאחסן ביצים מופרות במקרר ב-14 מעלות צלזיוס עד שבוע לפני הדגירה.
- דגירה ביצים ב 38 °C (101 °F) באינקובטור עם לחות רוויה במשך 50-52 שעות עד העוברים להגיע לשלב HH1412.
הערה: הביצים חייבות להיות ממוקמות אופקית במהלך הדגירה, כך העובר ממוקם כראוי עבור electroporation, צף על החלק העליון של החלמון. שלב HH14 מתאים לקבל ביטוי של פלסמידים בנוירונים מובחנים בחוט השדרה ובגנגליון השורש הגבי עם שיעור הישרדות מתאים.
- עוברי אלקטרופורט8-10:
- הכן אלקטרופורציה:
- הכן פלסמידים DNA ללא אנדוטוקסין עם ריכוז עדיף על 2 מיקרוגרם / μl, כדי להיות מסוגל לדלל אותו כריכוז הרצוי.
- משוך מספיק נימי זכוכית כדי להזריק את פתרונות הדנ"א השונים.
- הכינו PBS סטרילי (-Ca2+; -Mg2+) - 100 U/ml פניצילין/סטרפטומיצין ושווי משקל ב-38°C.
- לעקר את מכסה המנוע, מספריים מעוגלות ומלקחיים עדינים.
- לשלוט בריווח האלקטרודה.
הערה: רווח של 4 מ"מ בין האלקטרודות משמש בדרך כלל.
- חלון הביצה13 (איור 3A):
- השתמש במספריים מעוגלים כדי לנקב את הקליפה בצד הקהה של הביצה.
- הסר 2 מ"ל של אלבומן באמצעות מחט 0.9 מ"מ x 25 מ"מ ומזרק 5 מ"ל. לכוון את המחט אנכית על מנת למנוע פגיעה בשק החלמון.
- מכסים את החלק העליון של הביצה עם קלטת כדי לשמור על שלמות הקליפה.
- באמצעות מספריים מעוגלות, לנקב את הקליפה באמצע הסרט כדי להשוות את הלחץ בעת הסרת 2 מ"ל של אלבומן מהביצה. לאחר מכן, לחתוך חלון גדול מספיק כדי לדמיין את העובר ולהיות מסוגל לעבוד על זה.
- הוסף ~ 2 מ"ל PBS חם סטרילי (-Ca2 +; -Mg2+) - 100 U / ml פניצילין / סטרפטומיצין כדי למנוע התייבשות של העובר ולהפוך אותו לנגיש יותר למניפולטור.
- להזריק דנ"א ולאלקטרופורט את העובר
- לדלל פלסמיד PBS ( -Ca2 +; -Mg2 +) לריכוז בין 0.5-2 מיקרוגרם / μl ולהוסיף צבע ירוק מהיר כדי להגיע סופי 0.025% ריכוז. טען את תערובת הדנ"א ב נימי. מומלץ להשתמש במזרק.
הערה: בדוק כי ההתנגדות נימי הוא לא גדול מדי (כלומר יכול להיות קשיים בעת הזרקת עוברים) ולא קטן מדי (כלומר נימי יכול להיות גדול מדי ועלול לגרום נזק לעובר). כמו כן, ריכוז של חומצות גרעין גבוה מ 2 מיקרוגרם / μl עלול לגרום להשפעות לא ספציפיות צריך להיות נשלט. - לנקב את שק החלמון ואת הצינור העצבי בצד caudal עם נימי טעון. הזן את הצינור העצבי בזווית רדודה ומלא את הלומן מהזנב לראש בתמהיל הדנ"א(איור 3B).
הערה: ירוק מהיר מאפשר שליטה על דיוק ההזרקה. - מקם במהירות את אלקטרודות הפלטינה של 4 מ"מ משני צדי הצינור העצבי ברמה שברצונך לאלקטרופורט ולהחיל 3 פולסים ב- 31 וולט למשך 50 מ"ר עם מרווחים של 500 msec (איור 3C).
הערה: הימנע מהנחת האלקטרודות על הלב או על כלי עובר גדולים נוספים כדי למנוע פגיעה בעובר המתפתח. בועות צריכות להיווצר על האלקטרודות. - עם המחט, להסיר 2 מ"ל של אלבומן כדי להקטין את הרמה בקליפה.
- לאטום את החלון ואת הצד הקהה הרמטית עם קלטת.
- מחזירים את הביצים ב-38.5 מעלות צלזיוס לאינקובטור עד שהן מגיעות לשלב הרצוי.
- לדלל פלסמיד PBS ( -Ca2 +; -Mg2 +) לריכוז בין 0.5-2 מיקרוגרם / μl ולהוסיף צבע ירוק מהיר כדי להגיע סופי 0.025% ריכוז. טען את תערובת הדנ"א ב נימי. מומלץ להשתמש במזרק.
- הכן אלקטרופורציה:
4. הטמעה והקפאה של עוברים
- 48 שעות לאחר electroporation, בזהירות לקצור עוברים electroporated (שלב HH24). חותכים את הקלטת וחצי של קרום chorioallantoid. כדי למנוע מעוברים לשקוע לתוך החלמון, מקם מסננת מתחת לעובר וחתך את החצי השני של קרום chorioallantoid.
- מעבירים את העובר לצלחת ניתוח מלאה ב-PBS קר כקרח.
- בדוק את יעילות האלקטרופורציה על-ידי חיפוש פלואורסצנטיות בצינור העצבי באמצעות מיקרוסקופ סטריאו פלואורסצנטי.
הערה : Coelectroporation של קידוד פלסמיד פקד RFP עשוי לעזור לדמיין את האזור electroporated. - לנתח עוברים באמצעות microscalpel על מנת לבחור את האזור electroporated של חוט השדרה.
- העבר עוברים מנותחים לצלחת של 24 באר ותקן ב- pH 7.4 4% Paraformaldehyde (PFA) - מלוחים מאגר פוספט (PBS), O / N ב 4 °C (69 °F).
הערה: שלב קיבוע הוא חיוני כדי לאפשר את הייצוב של pHluorin שלה "לחיות" קונפורמציה ובכך להיות מסוגל להשתמש pHluorin ברקמה קבועה / חדירה. למרות הקיבעון מאט באופן דרסטי pH תלוי שינוי של פלואורסצנטיות, יש לקחת בחשבון כי שינויים קונפורמציה / פרוטוניה עדיין יכול להתרחש לאחר קיבעון. לכן, הפרוטוקול הבא (הטבעה, cryosections ותצפית) יש לבצע בתוך 3 ימים לאחר שלב הקיבעון, עם כל המאגרים ב pH 7. אם אין צורך בתיקון, מומלץ לבצע תצפית על מקטעי רקמה חיה. - הסר 4% PFA ולשטוף עוברים ב- pH 7.4 PBS.
- דגירה עוברים PBS-15% סוכרוז ולשמור על 4 מעלות צלזיוס עד העוברים לשקוע.
- דגירה עוברים קבועים ב- pH 7.4 7.5% ג'לטין- 15% סוכרוז במשך 45 דקות ב 37 מעלות צלזיוס כך העוברים מוטבעים לחלוטין.
- מניחים תבניות הטמעה על קרח ומוסיפים 400 μl של pH 7.4 7.5% ג'לטין- 15% סוכרוז כדי להשיג בסיס מוצק 2 מ"מ.
- שואפים את העובר המוטבע עם קצה חתוך ומניחים את העובר על בסיס הג'לטין המוצק.
- מכסים ב-pH 7.4 7.5% ג'לטין- 15% סוכרוז וממקם את העובר במלקחיים לפני שהג'לטין מתמצק.
- לאחר הג'לטין הוא מוצק, להכין -40 מעלות צלזיוס isopropanol אמבטיה (להשתמש קרח יבש או חנקן נוזלי) ולהקפיא את בלוק ג'לטין במשך 5 דקות.
- שמור על בלוקים קפואים ב -80 מעלות צלזיוס.
- מניחים את הבלוק הקפוא ב -20 מעלות צלזיוס למשך שעה.
- הסר את התבנית ולתקן את הבלוק על צ'אק עם מדיום גליקול פוליאתילן.
- לאחר הבלוק הוא קבוע בחוזקה, למקם את צ'אק במערכת cryostat.
הערה: השתמש בשקופיות מצופות כדי למנוע אובדן רקמות במהלך הכתמתם. - בצע cryosections סדרתי (20 μm cryosections מבוצעים בדרך כלל).
- תן את cryosections להתייבש במשך 15 דקות ב RT.
הערה: יש להגן מפני חשיפה מיותרת לאור על מנת למנוע הלבנה של פלואורסצנטיות GFP.
5. ניתוח מיקרוסקופי של קריוסקציות
- התלכדות מחדש ב- pH 7.4 PBS ב- RT למשך 10 דקות.
הערה: במידת הצורך, גרעינים יכולים להיות מוכתמים Hoechst. - השתמש 0.5 מיקרוגרם / מיליליטר הויסט פתרון PBS ו cryosections דגירה במשך 15 דקות.
- שטף את השקופיות 3x עם pH 7.4 PBS במשך 5 דקות.
- המשך להרכבת שקופיות. pH 7.4 (או בסיסי יותר) פתרון הרכבה אלכוהול פוליוויניל כי מתקשה O / N ניתן להשתמש: בזהירות למקם את הכיסוי כדי למנוע היווצרות של בועות אוויר בין השקופית ואת כיסוי.
- תן למדיום ההרכבה להקשיח O/N ב 4 מעלות צלזיוס בחושך.
- השתמש במיקרוסקופ קונפוקל הפוך כדי לדמיין במדויק את חלבון ההיתוך pHluorin-plexinA1: בצע מחסנית z ברזולוציה האופטית האופטית של חור הסיכה האופטי והשתמש בעדשות 20X (NA 0.75) או 40X (NA 1.3).
הערה: pHluorin ניתן לגילוי עם אותם פרמטרים המשמשים לגילוי GFP(כלומר שיא פליטה ב 509 ננומטר). הגדרות מסנן עירור וזיהוי אורך גל מוגדרות בצורה אופטימלית על-ידי תוכנת הדימות. Hoechst מזוהה בין 425-460 ננומטר (עירור הוא ב 405 ננומטר), GFP או pHluorin מזוהה בין 485-545 ננומטר (עירור הוא ב 473 ננומטר) ו RFP מזוהה בין 575-675 ננומטר (עירור הוא ב 559 ננומטר).
תמונות מייצגות של ביטוי pHluorin-plexinA1 ו-eGFP בחוט השדרה של העובר מוצגות באיור 4.
Access restricted. Please log in or start a trial to view this content.
תוצאות
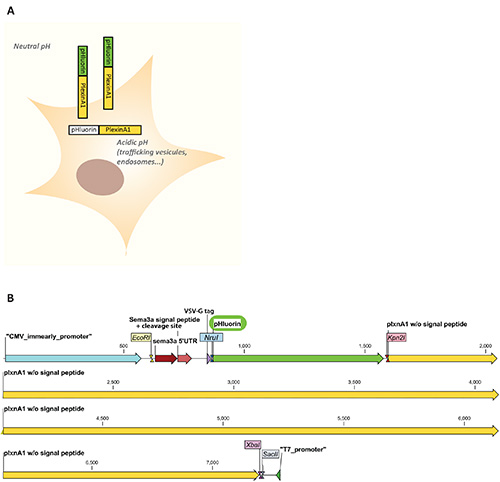
איור 1. א. ערכת תכונות הפלואורסצנטיות pHluorin-plexinA1 בהקשר סלולרי. PHluorin הוא nonfluorescent בתאים תאיים שבהם ה- pH הוא חומצי (<6) כגון בסחר בשלסים או באנדוזומים והוא פלואורסצנטי כאשר נחשף ...
Access restricted. Please log in or start a trial to view this content.
Discussion
פרוטוקול זה מספק הליך שלב אחר שלב כדי לעקוב אחר הדינמיקה של קולטן הדרכה אקסון הן בתרבות התא והן בהקשר ההתפתחותי של חוט השדרה עובר אפרוח.
כדי לעצב חלבון מתויג דה נובו pHluorin, שתי נקודות צריך להילקח בחשבון לגבי אסטרטגיית השיבוט. ראשית, תג pHluorin צריך להיחשף לומן של אנדוזומים ח...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים להומאירה נוואבי, פרדריק מורט ואיזבל סניאס על עזרתם. עבודה זו נתמכת על ידי CNRS, האגודה פרנסיס contre les מיופתיות (AFM), ANR YADDLE, Labex DevWeCan, Labex Cortex, ERC YODA כדי V.C.; C.D-B ו- A.J נתמכים על ידי מלגות לה ליגה קונטרה לה סרטן Labex DevWeCan, בהתאמה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| COS7 cells | ATCC | CRL-1651 | |
| DMEM GlutaMAX | GIBCO | 61965-026 | |
| Sodium pyruvate | GIBCO | 11360-039 | |
| Amphotericin B | Sigma | A2942 | |
| Fetal bovine serum | GIBCO | 10270-106 | |
| Penicillin/Streptomycin | GIBCO | 15140-122 | |
| Exgen500 reagent | Euromedex Fermentas | ET0250 | |
| PBS -Ca2+ -Mg2+ | GIBCO | 14190-094 | |
| Fast green dye | Sigma | F7252 | |
| 32% Paraformaldehyde aqueous solution | Electron Microscopy | 15714-S | Dilute extemporaneously in PBS to achieve a 4% solution |
| Gelatin from cold water fish skin | Sigma | G7041 | |
| Sucrose | Sigma | S0389 | |
| Cryomount | Histolab | 00890 | |
| Hoechst 34580 | Invitrogen | H21486 | |
| Mowiol 4-88 | Fluka | 81381 | |
| Consumables | |||
| Bottom-glass 35 mm dish | MatTek | P35G-1.5-14-C | |
| 5 ml Syringe | Terumo | SS-05S | |
| Needles 0.9 mm x 25 mm | Terumo | NN-2025R | |
| Capillaries | CML | PP230PO | capillaries are stretched manually in the flame |
| Superfrost Plus Slides | Thermo Scientific | 4951PLUS | |
| Material | |||
| Curved scissors | FST | 129-10 | |
| Microscalpel | FST | 10316-14 | |
| Forceps | FST | Dumont #5 REF#11254 | |
| Equipment/software | |||
| Time lapse microscope | Zeiss | Observer 1 | |
| Temp module S | PECON for Zeiss | ||
| CO2 module S | PECON for Zeiss | ||
| Metamorph software | Metamorph | ||
| Eggs incubator | Sanyo | MIR154 | |
| Electroporator apparatus | Nepa Gene CO., LTD | CUY21 | |
| Electrodes | Nepa Gene CO., LTD | CUY611P7-4 | 4 mm platinum electrodes |
| Fluorescence stereomicroscope | LEICA | MZ10F | |
| Cryostat | MICROM | HM550 | |
| Confocal microscope | Olympus | FV1000, X81 | |
| Fluoview software | Olympus | ||
| CLC Main Workbench software | CLC Bio |
References
- Winckler, B., Mellman, I. Trafficking guidance receptors. Cold Spring Harb. Perspect. Biol. 2, (2010).
- Jacob, T. C., et al. J. Neurosci. 25, 10469-10478 (2005).
- Nawabi, H., Castellani, V. Axonal commissures in the central nervous system: how to cross the midline. Cell Mol. Life Sci. 68, 2539-2553 (2011).
- Keleman, K., Ribeiro, C., Dickson, B. J. Comm function in commissural axon guidance: cell-autonomous sorting of Robo in vivo. Nat. Neurosci. 8, 156-163 (2005).
- Nawabi, H., et al. A midline switch of receptor processing regulates commissural axon guidance in vertebrates. Genes Dev. 24, 396-410 (2010).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Miesenbock, G. Synapto-pHluorins: genetically encoded reporters of synaptic transmission. Cold Spring Harb. Protoc.. 2012, 213-217 (2012).
- Avraham, O., Zisman, S., Hadas, Y., Vald, L., Klar, A. Deciphering axonal pathways of genetically defined groups of neurons in the chick neural tube utilizing in ovo electroporation. J. Vis. Exp. (39), 1792-17 (2010).
- Blank, M. C., Chizhikov, V., Millen, K. J. In ovo electroporations of HH stage 10 chicken embryos. J. Vis. Exp. (9), (2007).
- Wilson, N. H., Stoeckli, E. T. In ovo electroporation of miRNA-based plasmids in the developing neural tube and assessment of phenotypes by DiI injection in open-book preparations. J. Vis. Exp. (68), (2012).
- Rohm, B., Ottemeyer, A., Lohrum, M., Puschel, A. W. Plexin/neuropilin complexes mediate repulsion by the axonal guidance signal semaphorin 3A. Mech. Dev. 93, 95-104 (2000).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev. Dyn.. 195, 231-272 (1992).
- Korn, M. J., Cramer, K. S. Windowing chicken eggs for developmental studies. J. Vis. Exp. (8), (2007).
- Alberts, P., et al. Cdc42 and actin control polarized expression of TI-VAMP vesicles to neuronal growth cones and their fusion with the plasma membrane. Mol. Biol. Cell. 17, 1194-1203 (2006).
- Perret, E., Lakkaraju, A., Deborde, S., Schreiner, R., Rodriguez-Boulan, E. Evolving endosomes: how many varieties and why. Curr. Opin. Cell Biol. 17, 423-434 (2005).
- Li, Y., et al. Imaging pHluorin-tagged receptor insertion to the plasma membrane in primary cultured mouse neurons. J. Vis. Exp. (69), (2012).
- Tojima, T., Itofusa, R., Kamiguchi, H. Asymmetric clathrin-mediated endocytosis drives repulsive growth cone guidance. Neuron. 66, 370-377 (2010).
- Matsui, A., Yoshida, A. C., Kubota, M., Ogawa, M., Shimogori, T. Mouse in utero electroporation: controlled spatiotemporal gene transfection. J. Vis. Exp. (54), 3024-30 (2011).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7 (107), (2007).
- Holzhausen, L. C., Lewis, A. A., Cheong, K. K., Brockerhoff, S. E. Differential role for synaptojanin 1 in rod and cone photoreceptors. J. Comp. Neurol. 517, 633-644 (2009).
- Shang, Y., Claridge-Chang, A., Sjulson, L., Pypaert, M., Miesenbock, G. Excitatory local circuits and their implications for olfactory processing in the fly antennal lobe. Cell. 128, 601-612 (2007).
- Dittman, J. S., Kaplan, J. M. Factors regulating the abundance and localization of synaptobrevin in the plasma membrane. Proc. Natl. Acad. Sci. U.S.A. 103, 11399-11404 (2006).
- Bozza, T., McGann, J. P., Mombaerts, P., Wachowiak, M. In vivo imaging of neuronal activity by targeted expression of a genetically encoded probe in the mouse. Neuron. 42, 9-21 (2004).
- Sankaranarayanan, S., Ryan, T. A. Real-time measurements of vesicle-SNARE recycling in synapses of the central nervous system. Nat. Cell. Biol. 2, 197-204 (2000).
- Stark, D. A., Kasemeier-Kulesa, J. C., Kulesa, P. M. Photoactivation cell labeling for cell tracing in avian development. CSH Protoc.. 2008, (2008).
- Hildick, K. L., Gonzalez-Gonzalez, I. M., Jaskolski, F., Henley, J. M. Lateral diffusion and exocytosis of membrane proteins in cultured neurons assessed using fluorescence recovery and fluorescence-loss photobleaching. J. Vis. Exp. (60), (2012).
- Hanson, G. T., et al. Green fluorescent protein variants as ratiometric dual emission pH sensors. 1. Structural characterization and preliminary application. Biochemistry. 41, 15477-15488 (2002).
- Rose, T., Schoenenberger, P., Jezek, K., Oertner, T. G. Developmental refinement of vesicle cycling at schaffer collateral synapses. Neuron. 77, 1109-1121 (2013).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat. Neurosci. 15, 1047-1053 (2012).
- de Wit, J., Toonen, R. F., Verhage, M. Matrix-dependent local retention of secretory vesicle cargo in cortical neurons. J. Neurosci. 29, 23-37 (2009).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved