Method Article
נחישות של אינטראקציות חלבון ליגנד שימוש דיפרנציאל סריקת Fluorimetry
In This Article
Summary
Differential scanning fluorimetry is a widely used method for screening libraries of small molecules for interactions with proteins. Here, we present a straightforward method to extend these analyses to provide an estimate of the dissociation constant between a small molecule and its protein partner.
Abstract
מגוון רחב של שיטות זמינים כעת לקביעת הניתוק המתמיד בין חלבון ואינטראקציה מולקולות קטנות. עם זאת, רוב אלה דורשים גישה לציוד מומחה, ולעתים קרובות דורש מידה מסוימת של מומחיות להקים ביעילות ניסויים אמינות ולנתח נתונים. fluorimetry סריקת ההפרש (DSF) נמצא בשימוש יותר ויותר כשיטת חזקה לסינון ראשוני של חלבונים לאינטראקצית מולקולות קטנות, או לזיהוי שותפים פיסיולוגיים או לגילוי להיט. טכניקה זו יש יתרון בכך שהיא דורשת רק מכונה PCR מתאימה לPCR כמותי, וכל כך מתאימה מכשור זמין ברוב המוסדות; מגוון מצוין של פרוטוקולים זמינים כבר; ויש תקדימים חזקים בספרות לשימושים מרובים של השיטה. העבודה האחרונה הציעה מספר דרכי חישוב קבועי דיסוציאציה מנתוני DSF, אבל אלה הם מבחינה מתמטית תובעניים. כאן, אנו DEMonstrate שיטה להערכת קבועי דיסוציאציה מכמות מתונה של נתונים ניסיוניים DSF. בדרך כלל יכולים להיות שנאספו נתונים אלה וניתחו בתוך יום אחד. אנו מדגימים כיצד שונים מודלים יכולים לשמש כדי להתאים את הנתונים שנאספו מאירועים המחייבים פשוטים, ובו אתרי קישור או עצמאיים מחייב שיתופיים נוכחים. לבסוף, אנו מציגים דוגמא לניתוח נתונים במקרה שבו מודלים סטנדרטיים אינם חלים. שיטות אלו מאוירות עם נתונים שנאספו על חלבוני שליטה זמינים מסחרי, ושני חלבונים מתכנית המחקר שלנו. בסך הכל, השיטה שלנו מספקת דרך פשוטה לחוקרים כדי לקבל תובנה נוספת לתוך אינטראקציות חלבון ליגנד באמצעות DSF במהירות.
Introduction
כל החלבונים יהיו לאגד, עם זיקות שונות, למגוון רחב של מולקולות אחרות מיונים פשוטים למקרומולקולות הגדולה אחרת. במקרים רבים, חלבונים נקשרים לשותפי מולקולה קטנים, כחלק מהתפקוד התקין שלהם (למשל, קינאז מחייב ATP). אינטראקציות אחרות עשויות להיות קשורות לתפקוד, אך בניסוי שימושי כמו כלים (לדוגמא, מולקולות קטנות שמייצבות חלבונים כדי לשפר את הצלחת גיבוש, או לסייע בשמירה על חלבונים בפתרון); בעוד מולקולות קטנות אשר נקלטות על ידי אתרים פעילים ואתרי allosteric של חלבונים יכול לשמש כמעכבים, וכך לווסת את הפעילות של אנזימים.
יש מגוון רחב של טכניקות שיכולים לשמש כדי לקבוע את הזיקה של חלבונים למולקולות שותף. calorimetry טיטרציה בידוד התרמי 1 נתפס נרחב כמו "תקן זהב", כפי שהוא מספק מידע עשיר על תגובות, הוא תווית חופשית, והגביל הזדמנויות לrtifacts של הניסוי. עם זאת, למרות השיפורים אחרונים ברגישות של המכשור והאוטומציה של הגדרה ניסיונית, זה עדיין יקר יחסית במונחים של דרישות חלבון, יש במקרה הטוב תפוקה נמוכה עד בינוני, ומתאים ביותר לאינטראקציות עם בינוני עד זיקות גבוהות (10 ננומטר לד K 100 מיקרומטר) 2. שיטות תווית אחרות ללא תשלום, כגון תהודת plasmon פני השטח או הצעת אינטרפרומטריה 3 bilayer תפוקה גבוהה יותר, והשיג הרגישות לזיהוי מולקולות קטנות יותר נמוכות כמו 100 Da. עם זאת, מכשירי תפוקה גבוהים לשיטות אלה הם יחסית יקרים, מוצדקים רק בו יהיו תפוקה מתמשכת של פרויקטים רלוונטיים, ולכן הם עלולים להיות בלתי נגישים לרבים מעבדות אקדמיות.
fluorimetry ההפרש הסריקה (DSF, או thermofluor) תואר לראשונה בשנת 2001 4 כשיטה לגילוי סמים. בmetho זהד, חלבונים מודגרת עם צבע פלואורסצנטי (צבעים תחילה נפטלין-sulfonic שמשו), המשנה הקרינה שלה על כריכה לאזורים הידרופובי של החלבונים. מדגם חלבון צבען הוא מחומם ואז, והקרינה במעקב כחום עולה. התגלגלות של החלבון, וחשיפה של חלקים ההידרופובי של החלבון, מולידה דפוס אופייני בקרינה כפונקציה של הטמפרטורה (איור 1 א). הניסוי יכול להתבצע בכמויות קטנות בכל מכשיר PCR כמו מסחרי, וכן בניסוי אחד, מספר גדול של דגימות ניתן לבדוק בו זמנית (בדרך כלל 48, 96 או 384 דגימות, בהתאם לדגם המכשיר). בדרך כלל ניתן לבצע ניסויים ברחבי שעה, מתן האפשרות לניתוח תפוקה הגבוה של הדגימות 5.
שיפורים נוספים למתודולוגיה שראו אימוץ של צבעים עם תכונות ספקטרליות טובות יותר 6,7 , כלים גנריים לניתוח נתונים, והציעו פרוטוקולים לסינון ראשוני 8,9. מגוון רחב של יישומים של השיטה הורחב, עם דגש מיוחד על קביעת תנאים אופטימליים לעריכה ולאחסון של חלבונים 10, ועל זיהוי שותפים המחייבים פוטנציאל לסייע התגבשות 11. התפוקה גבוהה יחסית של השיטה, עלות נמוכה יחסית בחלבון (~ 2 מיקרוגרם לתגובה), והתחולה ללימוד מולקולות מחייבות חלשות הפכה DSF כלי רב ערך עבור עיצוב סמים בר מבוסס, במיוחד בהקשר אקדמי 12-14.
למרות היישום הרחב של DSF לחקר אינטראקציות חלבון ליגנד, כמה מחקרים שתיארו את נחישות של קבועי דיסוציאציה ממחקרים אלה. עם זאת, אלה נוטים לייצר משוואות מפורטות המתארות את התגלגלות של החלבון, עם פרמטרים רבים שצריכה להיות מצוידת לנתונים דלילים או בחלק דואר המקריםstimated 7,15-17. שיטות אלה הן רלוונטיים במיוחד במקרים מאתגרים, כגון תרכובות בחוזקה מחייבות, או חלבונים בו מוצגות מעברים יוצאות דופן. עם זאת, למעבדות רבות, ניתוחים מפורטים אלה הם מסורבלים מדי לשימוש שיגרתי. לפיכך, אנו מציעים טיפולים אלטרנטיביים לתרחישים שונים, ולהדגים כיצד אלה יכולים לשמש כדי להתאים נתונים כתוצאה מאינטראקציות חלבון ליגנד שונות. השיטה שלנו משתמשת במכשיר StepOne qPCR, שלתוכנת ניתוח הנתונים העידו זמינה; בעוד זו מאיצה את ניתוח הנתונים, תוצאות ממכשירים אחרים יכולות להיות מעובד בשיטות שפורסמו בעבר 9, ואת אותו הניתוח במורד הזרם יכול להתבצע.
Protocol
.1 קביעת ערך משוער לקבוע דיסוציאציה (כלומר, בתוך להזמין גודל אחד)
- מכין את תערובת מפורט בטבלה 1.
- הכן מניות של ליגנד של ריבית בריכוז הגבוה ביותר הזמינים, ולאחר מכן בשעה שש עשרה דילולים קפל זה. איפה ד K משוער ידוע מהנתונים קודמים, שואף להיות לפחות שני ריכוזים מעל ומתחת לד K.
- Aliquot 18 μl של התערובת לשמונה בארות בצלחת qPCR. הוסף 2 μl של ממס לבאר הראשונה. הוסף 2 μl של כל אחד מחברי סדרת דילול יגנד (שלב 1.2) לאחד של כל אחד משבע בארות שנותרו.
- טבעת חותם qPCR על הצלחת. כדי להשיג חותם טוב של הצלחת, להניח את ידו המוליך (ראה טבלאות של חומרים כימיים מסוימים) באמצע הצלחת. להחליק במורד החותם לצד אחד, ולאחר מכן לחזור בחצי השני שלהצלחת.
- צנטריפוגה הצלחת ב XG 500 לשתי דקות כדי להסיר בועות אוויר.
- מניחים את הצלחת במכשיר StepOne qPCR. בחר באפשרות "עקומת ממיסים", מסנני רוקס, ולבחור את מהירות רמפה מהירה (זה מספק הפסקה 2 דקות ב25 ° C, ואחריו כבש ל99 ° C מעל 40 דקות, ולאחר מכן הפסקה 2 דקות). הפעל denaturation תרמית.
הערה: קבצי Script לביצוע ריצה זמינים באופן מקוון בכתובת http: // www.exeter.ac.uk/biosciences/capsular. - בסיום של ריצת המכשיר, לחץ על הכפתור "נתח" על המסך. שמור את קובץ התוצאה.
- פתח את תוכנת Shift תרמית חלבון.
- צור מחקר חדש; בכרטיסיית המאפיינים, לתת את זה שם, ובכרטיסיית התנאים, פרט הליגנדים.
- לעבור לכרטיסיית קבצי הניסוי, ולייבא את קובץ תוצאות שנשמר (XXX.eds), ולהגדיר את התוכן של כל טוב (fil תבניתes זמין מהמחברים).
- עבור אל כרטיסיית ניתוח, ולחץ על הכפתור "נתח".
הערה: זה יהיה לנתח את התוצאות. ניתן לייצא את התוצאות לחקירה נוספת עם Excel באמצעות כרטיסיית היצוא. התוצאות מיוצאות בפורמט כרטיסייה שמסומן. זה הכי טוב כדי לפתוח את הקובץ המיוצא בExcel, ומייד לשמור בפורמט Excel.
- בדוק שהחלבון בנוכחות הממס לבד נותן תוצאה דומה לזו שמוצגת באיור 1 א. בשלב בא, לבדוק את טמפרטורות ההיתוך שנצפו בתוצאות בחלונית "לשכפל". ודא שזה מראה עלייה ברורה בטמפרטורת התכה עם ריכוז ליגנד הגדלת.
הערה: באופן אידיאלי, זה יספק טמפרטורה ברורה מרבי היתוך (בהנחה שהחלבון מלא מחויב ליגנד), וד K משוער שבו טמפרטורת ההתכה היא במחצית דרך בין החלבון וללא יגנדהמקסימום.
.2 הניסויי Set-up לקביעה קבוע דיסוציאציה
- מכין את התערובת המפורטת בטבלה 2 כתערובת מאסטר.
- הכן מניות של ליגנד בחמישה עשרה ריכוזים שונים, שיהיה מדולל פי עשרה בניסוי האחרון. באופן אידיאלי, כוללים ריכוזים לפחות שני סדרי גודל מעל ומתחת לד K המוערך, ולמרכז את הריכוזים בד K המוערך. להתמקד בשבע הנקודות בתוך סדר הגודל של ד K המוערך, עם עוד ארבע נקודות בכל צד של זה; אם יש בחירה, כוללים יותר נקודות בערכים הלהרוות.
הערה: במידת צורך, זה אפשרי לשנות את תנאי הניסוי, כך שמניות יגנד נמצאות בכפולות הריכוז הניסיוני, שבו מסיסות יגנד מגבילה. - הוספת 120 μl של האדוןלערבב עד שמונה בארות בצלחת גם 96 תחתית-U, לפעול כמאגר לניפוק נוח של מיקס מאסטר. השתמש בפיפטה 8 ערוץ לוותר 18 μl לעמודה אחת של צלחת PCR. חזור על פעולה עבור חמש עמודות נוספות, לתת כולל של 48 בארות מולא בדפוס 6 x 8 על הצלחת.
- הוסף 20 μl של המניות ליגנד, או הממס, כדי להפריד בין בארות בצלחת גם 96 תחתית-U. באמצעות פיפטה 8 ערוץ, לשאוב 2 μl של שמונה מניות שונות ליגנד (או ממס). הוספה אלה לעמודה אחת של צלחת PCR שהיה מלא בתערובת שני בשלב 2.3. חזור עם שמונה יגנד / מניות ממס זהות עבור שתי עמודות נוספות. לשאוב 2 μl של המניות ליגנד או ממס שמונה שנותרו, ולהוסיף האלה לעמודה רביעית בצלחת. חזור על פעולה זו עבור שתי עמודות נוספות. זה ייתן לי דגימות בשלושה עותקים עבור כל יגנד 16 ודגימות ממס.
- טבעת חותם qPCR על הצלחת (ראה שלב 1.4).
- צנטריפוגה הצלחת ב XG 500 לשתי דקות.
- מניחים את הצלחת במכשיר qPCR. הפעל denaturation תרמי באמצעות הפרמטרים שצוינו בשלב 1.6.
- בסיום של ריצת המכשיר, לחץ על הכפתור "נתח" על המסך. שמור את קובץ התוצאה.
- פתח את תוכנת Shift תרמית חלבון. צור מחקר חדש; בכרטיסיית המאפיינים, לתת את זה שם, ובכרטיסיית התנאים, פרט הליגנדים.
- לעבור לכרטיסיית קבצי הניסוי, ולייבא את קובץ תוצאות שנשמר (XXX.eds), ולהגדיר את התוכן של כל טוב.
הערה: קבצי תבנית זמינים באופן מקוון בכתובת http: // www.exeter.ac.uk/biosciences/capsular. - עבור אל כרטיסיית ניתוח, ולחץ על הכפתור "נתח".
- בחר בכרטיסייה "משכפל" מהתפריט בצד השמאל של המסך כדי להציג את התוצאות כtriplicates. להעריך את האמינות של נתונים המבוססים על איך הדוק triplicates הם. שאולד triplicates להראות שחזור עני, לבחון את הנתונים הגולמיים באופן הדוק.
- לנתח את הנתונים באמצעות שני בולצמן או שיטות נגזרים להעריך את טמפרטורת ההתכה. בחר בכרטיסייה "לחזור על תוצאות מחקרים", וב" לחזור עלילת תוצאות ", לעבור" מגרש על ידי: "לחצן בין" TM - בולצמן "ו" TM - נגזר ". בחר את השיטה שנותנת את שחזור הגדול יותר עבור המדגם. לייצא את התוצאות לחקירה נוספת עם Excel באמצעות כרטיסיית היצוא.
הערה: לקבלת דגימות שמראות מעברים מרובים, זה כמעט תמיד עדיף להשתמש בשיטה הנגזרת במצב נמס מרובה. התוצאות מיוצאות בפורמט כרטיסייה שמסומן. זה הכי טוב כדי לפתוח את הקובץ המיוצא בExcel, ומייד לשמור בפורמט Excel. - חזור על הניסוי לפחות פעמיים, כולל חוזר ביום נפרד, כדי להבטיח שחזור של התוצאות. צריך ניתוח נתונים (ראה שלב 3 בהמשך)מצביע על כך שהערך של ד K הוא שונה באופן משמעותי לאומדן המקורי, לשנות את הריכוזים ליגנד בהתאם (ראה שלב 2.2) כדי להבטיח מגוון טוב של ערכים סביב ד K.
.3 ניתוח נתונים לקביעת דיסוציאציה קבוע תחת Denaturation התרמי
- ליצור טבלה באקסל של הריכוזים ליגנד וטמפרטורת ההתכה.
- פתח את תוכנת GraphPad פריזמה, וליצור שולחן XY. הזן את הנתונים, תוך שימוש בעמודת X לריכוזים ליגנד וטור Y להתכת תוצאות טמפרטורה.
הערה: דוגמא המוצגת היא איור 1 ב. תסריט עם משוואות שנטענו מראש, והוראות חלופיות לשימוש בחבילה הסטטיסטית SPSS, זמין באופן מקוון בכתובת http: // www.exeter.ac.uk/biosciences/capsular. - בכרטיסיית ניתוח, בחר באפשרות לשינוי פרמטר ניתוחs (Ctrl + T). כדי להזין את המודל הנכון, בחר "חדש", ועל "צור משוואה חדשה". הכנס את המשוואה המפורטת בטבלה 3 בשם "ליגנד אתר יחיד מחייב".
הערה: דוגמא לצעדים אלה מוצגת באיור 1 ג. בעת השימוש בתסריט עם משוואות שנטענו מראש, המשוואה הרלוונטית יכולה להיות מופנה בחרה מהרשימה ולא נכנס. גזירת משוואה זו ניתנת בנספח. - בחר את "הכללים לערכים ראשוניים" תיבה, והזן כללים לערכים ראשוניים, כמפורט בטבלה 3.
- להגביל P הפרמטר, כמו "שווה קבוע ל" ולהיכנס לריכוז הסופי של חלבון (באותן יחידות כמו ליגנד ניתן ב).
- בחר אישור כדי לבצע את הניתוח.
הערה: דוגמא לצעדים אלה מוצגת באיור 1D. תוכנת גרפים מייצרת דמות המציגה את הנתונים ואת ההתאמה למודל. דוגמאות לtניתוחי hese מוצגים בנתונים המייצגים.
.4 נתוני התאמה למודלים שיתופיים
כדי שיתאים לנתונים למודל שיתופי, לבחור בין שני מודל פשוט שיתופי, או מודל שבו שני קבועי הדיסוציאציה נפרדים מוגדרים. הגישה הראשונה היא מועדפת במקרה של cooperativity השלילי, או כחקירה ראשונית. עם זאת, באופן עקרוני עדיף במקרים של cooperativity החיובי למודל שני ניתוק שונה קבועי 18. במקרה זה, דוגמנות יכולה להמשיך בהנחה או מחייב רציף של הליגנדים, או עצמאי מחייב של הליגנדים.
- בצע את השלבים ראשוניים כמו בפרוטוקול 3 עם זאת, בשלב 3.3, הכנסה אחד מהמשוואות בטבלה 3 מופיעה בתור "מודל שיתופי פשוט", "מחייב סדרתית של שני הליגנדים", או "עצמאי מחייבת של שני הליגנדים" 18.
- בחר את הכללים הרלוונטיים לערכים ראשונייםהקשורים לכל אחד ממשוואות אלה בטבלה 3.
- לבחון את ההתאמה של המודל לנתונים. הנתונים צריכים להתאים בצורה גרועה, לשקול מודל אחר.
הערה: חשוב גם לבחון את ההתאמה של טמפרטורת ההתכה לנתונים על ידי תוכנת החלבון תרמית Shift (שלב 2.9) זהירות: לפעמים יש צורך לשנות את הפרמטרים כאן כדי לקבל את התוצאות הטובות ביותר. שיקול נוסף הוא האם בטווח של נקודות נתונים הוא אידיאלי, ואם ישנן נקודות חריגות: או סדרה מוגבלת של נתונים בכל צד של ד K, או נקודה אחת חריגה (במיוחד בריכוזים הגבוהים ביותר ליגנד), יכול להשפיע באופן משמעותי התוצאות. - חזור על הניסוי לפחות פעמיים (ראה שלב 2.12) כדי להבטיח שחזור.
.5 נתונים התאמה לעקומות מציג משמרות בינארי בטמפרטורת התכה
מדי פעם, ולא תגובה מדורגת ליגנד, חלבונים היונצפה לאמץ תגובה בינארי, שבו מדגם כרוך בבירור מופרד ממדגם מאוגד. דוגמא מסופקת בתוצאות הנציג (איור 4). במקרה זה, ראוי של טמפרטורות ההתכה לא יספק בכושר טוב לד K.
- לייצא את פלט הנתונים הגולמי מהתוכנה Shift תרמי חלבון. עבור כל נקודת טמפרטורה, לחשב את הקרינה הממוצעת ליגנד אפס, והריכוזים הגבוהים ביותר ליגנד. לווח תוצאות מכל נקודה בסמוך לאלה הנתונים.
הערה: השגיאה שנוצרה כאן היא פחות מהשגיאה בטמפרטורות ההתכה המצויד. - פתח את החבילה הסטטיסטית SPSS. העתק את הטמפרטורות, שני מערכי נתונים ממוצעים, ונתונים עבור כל ניסוי לחלון נתונים בSPSS. בכרטיסייה משתנה, להגדיר את בסיס הנתונים הממוצעים לשום יגנד כמו "נמוך", ומתכוון במערך לריכוז ליגנד הגבוה ביותר כמו "גבוה".
- הורד את קובץ התחביר זמיןבאופן מקוון בכתובת http: // www.exeter.ac.uk/biosciences/capsular. בחר באפשרות "הפעלת → כל הפעלה".
- העתק את השיעור תוצאות קשורות לחוברת עבודה של Excel חדשה, עם הריכוזים ליגנד הרלוונטיים.
- פתח את תוכנת GraphPad, וליצור שולחן XY. הזן את הנתונים, תוך שימוש בעמודת X לריכוזים ליגנד וטור Y להתכת תוצאות טמפרטורה. בכרטיסיית הניתוח, בחר באפשרות "פרמטרים שינוי ניתוח". כדי להזין את המודל הנכון, בחר "חדש", ועל "צור משוואה חדשה". הזן את משוואת נתונה בטבלה 3, מופיעה בתור "ניתוח של משמרות בינארי בטמפרטורת התכה".
- בחר בתיבת "כללים לערכים ראשוניים", ולהיכנס לכללים לערכים ראשוניים המפורטים בטבלה 3. הגבל P הפרמטר, כמו "קבוע שווה" ולהיכנס לריכוז הסופי של חלבון (באותן יחידות כמו ligand ניתן ב).
הערה: דוגמאות להשלמת תיבות אלה לפרוטוקול בסעיף 3 מוצגות באיור 1 ג, ד. - אם יש התאמה טובה, ניתן לשפר את התוצאות באמצעות אקסטרפולציה של לתוצאות הצפויות בריכוז ליגנד אינסופי. מהמודל של השיעור מחויב בכל ריכוז ליגנד, לבחון את הערך עבור הערך הגבוה ביותר של ריכוז ליגנד. אם זה 0.99 או גדול יותר, ניתוח נוסף אינו צפוי לשפר את התוצאות.
- אם היחס הוא פחות מ 0.99, נדרש צעד נוסף על מנת לתקן את ההשפעות של החלבון מאוגד במדגם הריכוז ליגנד הגבוה ביותר. בצעד 5.2, לכתוב את חלקם של יגנד קשור בנקודת הריכוז ליגנד הגבוהה ביותר (משלב 5.7) לתוך תא R2 (תא שונה יכול לשמש, וR2 הוחלף כראוי במשוואה בטבלה 3). צור עמודה נוספת לאחר הממוצע של תוצאות הריכוז ליגנד הגבוהות ביותר. בעצי האשוחתא t, להעתיק את המשוואה מפורטת בטבלה 3 כ" חיוץ לאינסופיים ריכוז ליגנד ". העתק את הנוסחה הזאת לתאים שנותרו בטור זה.
הערה: חישוב זה מסיר את ההשפעה של חלבון מאוגד בריכוז ליגנד הגבוה ביותר. ההבדל בין החלבון החופשי ליגנד והריכוז ליגנד הגבוה ביותר מוכפל בגומלין של השיעור מחויב בריכוז ליגנד הגבוה ביותר כדי לספק את ההבדל הצפוי בין מדינות חלבון כבולות ומאוגדות באופן מלא בכל נקודה בטמפרטורה. הבדל זה נוספו או נגרע מהמדינה מאוגד לתת את הקרינה הצפויה לחלבון מלא מחויב ליגנד. - החלף את העמודה לריכוז ליגנד מרבי בגיליון הנתונים של SPSS עם טור חדש זה, וחזור על הולם נתונים.
הערה: שלבים 5.7-5.9 ייתכן שיהיו צורך חוזרים ונשנים אם המודל מציע שינוי משמעותי נוסף בשיעור מחויב בconcentrati יגנד המרבי(אם זה המקרה, זה כנראה יהיה אידיאלי לחזור על הניסוי עם נקודת ריכוז ליגנד גבוהה הכלולה). - במקרים בהם חלבון תערוכות שיתופיות התנהגות משמרת ומציג בינארי, המשוואה הציעה בשלב 5.5 צריכים להחליף עם אלה משלב 4.1. יש להחליף "למעלה" ופרמטרים "תחתונים" על ידי 1 ו -0 בהתאמה.
- חזור על הניסוי לפחות פעמיים (ראה שלב 2.12) כדי להבטיח שחזור.
תוצאות
מצע מבחן מצוין לשיטה זו הוא hexokinase. זה מביא את היתרונות של להיות בקלות זמינה באופן מסחרי, ויש להם שני מצעים הנמצאים ברוב המעבדות, ואשר מספקים תוצאות ברורות, לשחזור בassay. מסך ריכוז ראשוני (פרוטוקול 1), תוך שימוש בhexokinase וגלוקוז (איור 2 א), עולה כי ד K הצפוי להיות בטווח 0.2-1.7 מ"מ. לכן, מסך גדול יותר (פרוטוקול 2) בוצע, תוך שימוש בריכוזים מוצגים בלוח 4: התוצאות (איור 2) מראה על התאמה טובה למשוואה מחייבת ליגנד אתר היחיד (סעיף הפרוטוקול 3.3) [9], ונתן לי K ד של 1.2 ± 0.1 מ"מ.
Transferase heptose-guanyl המשוער WcbM 19,20 תערוכות משמרת תרמית חזקה על הכריכה לGTP (איור 3 א). מסך ראשוני הציע כי Kד יהיה בטווח של כ 100 מיקרומטר. לכן, מסך מלא הוקם, באמצעות הריכוזים מוצגים בטבלה 5 התאמה של התוצאות למשוואת 3.3 הראה בכושר סביר (R 2 של 0.981; איור 3 ב). עם זאת, יש הבדל ברור בין הנתונים ו מודל, המצביע על כך יש צורך במשוואה שונה. חיפוש של מאגר החלבון 21 עם רצף WcbM הראה כי homologues הקרוב ביותר שלמבנים נקבעו הדימרים טופס. הנתונים היו לכן נותח באמצעות שלוש המשוואות לשיתוף פעולה, רציף, ובלתי תלוי מחייב של שני הליגנדים (פרוטוקול 4). הסטטיסטיקה המתאימה למודל שיתופי נתנה R 2 ערך של 0.998 וסטיית התקן של שאריות (Sy.x) של 0.215, בעוד שני מודלים המחייבים רציפים ובלתי תלויים נתנו R 2 ערך של 0.992 וSy.x של 0.480 ו0.461 בהתאמה. הדבר מצביע על כך שהמודלנותן בכושר הטוב ביותר לנתונים שהמודל השיתופי: כאן, K ½ של 230 ± 10 מיקרומטר נצפה, עם ערך n של 0.52 ± 0.02 (איור 3 ג). זה היה הרמז לcooperativity שלילי למחייב. שים לב ש½ K שימש במקרה זה ולא ד K, כיחידות לד K תהיה מיקרומטר ולא משביעת רצון 0.52.
התמ"ג-6-deoxy-β-D-המשוער'אף כי -heptopyranose 2 O -acetylase, 22 WcbI, מראה תוצאה חריגה למדי בfluorimetry סריקת ההפרש. בהעדר כל הליגנדים, זה מראה denaturation ברור ופשוט (איור 4 א). אנזים (CoA) זוהה כיגנד של חלבון זה באמצעות DSF, והזיקה של החלבון לשותף זה נחקר כמתואר בפרוטוקול. בנוכחות ריכוזים גבוהים של CoA, ים חזקhift לטמפרטורה גבוהה יותר הוא ציין, עם שינוי בטמפרטורת ההתכה של 15 C °. עם זאת, בריכוזים ביניים, ולא מעבר להתכת monophasic בטמפרטורת התכת ביניים, WcbI הראה היתוך biphasic, עם החלבון המופיע כדי להמס באו הטמפרטורה ללא יגנד, או את טמפרטורת התכה מחויבת באופן מלא (איור 4 א) . הפרופורציות של שני המינים שונים באופן תלוי מינון, עם עלייה בריכוזי מצע הגדלת החלק שנמס בטמפרטורה גבוהה יותר (איור 4). הניתוח ישיר של נתונים אלה היה מאתגר: התאמה למשוואת בולצמן נתן התקפים רעים מאוד, בעוד שיטות נגזרות הדגישו כי שני אירועי היתוך היו מתרחשים, אך לא לסייע בהוכחת שינוי בריכוז ליגנד הגדלת.
גישה פחות קונבנציונלית כדי לנתח את הנתונים הללו ולכן אימצה (פרוטוקול 5). ד הקרינהתוצאות erivative ללא יגנד ובריכוז ליגנד הגבוה ביותר נלקחו כמייצג למעשה את כל החלבון בטמפרטורת ההתכה נמוכה יותר, או מדינת טמפרטורת התכה גבוהה יותר. נתונים הנגזרים שנותרו היו מצוידים בכל נקודה כסכום של חלקם יחסי של כל אחד משני המצבים הללו, עם השיעור סיכם לאחדות (איור 4C). הנתונים שהתקבלו לאחר מכן היו מצוידים כמו קודם להשיג ד K לכאורה, תוך שימוש באותה המשוואות כמו קודם. זה הדגיש כי הנקודה "גבוהה" ליגנד עשויה להיות יגנד רק 95% מחויבים. הנתונים אז היו להסיק לחיזוי של התוצאה ל100% חלבון קשור, ואת הנתונים מתאימים חזרו לתת ד K לכאורה של 58 ± 2 מיקרומטר. זה בתנאי בכושר מצוין של תוצאות הניסוי למודל המחייב (איור 4D).
fo: תוכן width = "5in" src = "/ קבצים / ftp_upload / 51809 / 51809fig1highres.jpg" width = "500" />
איור 1 דוגמאות להתקנת ניסוי וניתוח. (א) דוגמא של הצורה הצפויה של פרופיל denaturation תרמית (לקוחים מנתונים לשמרים hexokinase). הצורה האופיינית של הנתונים הגולמיים מצביעה על עלייה הדרגתית בקרינה עד למקסימום, ואחריו ירידה רדודה (שנדון ביתר פירוט ב9). זו מלווה בשיא יחיד בנגזרת הראשונה של הקרינה. (ב) דוגמא של הזנת נתונים לתוך GraphPad. ריכוז ליגנד הוא נתון על ציר X, ונצפה טמפרטורת היתוך על ציר Y. דוגמא (C) של הגדרת משוואה בGraphPad. דוגמאות (ד ') בדרך נכונה הגדרת הערכים הראשוניים של משתנים, ולתקן את ריכוז החלבון, כדי לאפשר קביעה נכונה של קבוע דיסוציאציה.מ '/ קבצים / ftp_upload / 51809 51809fig1highres.jpg "target =" / _blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
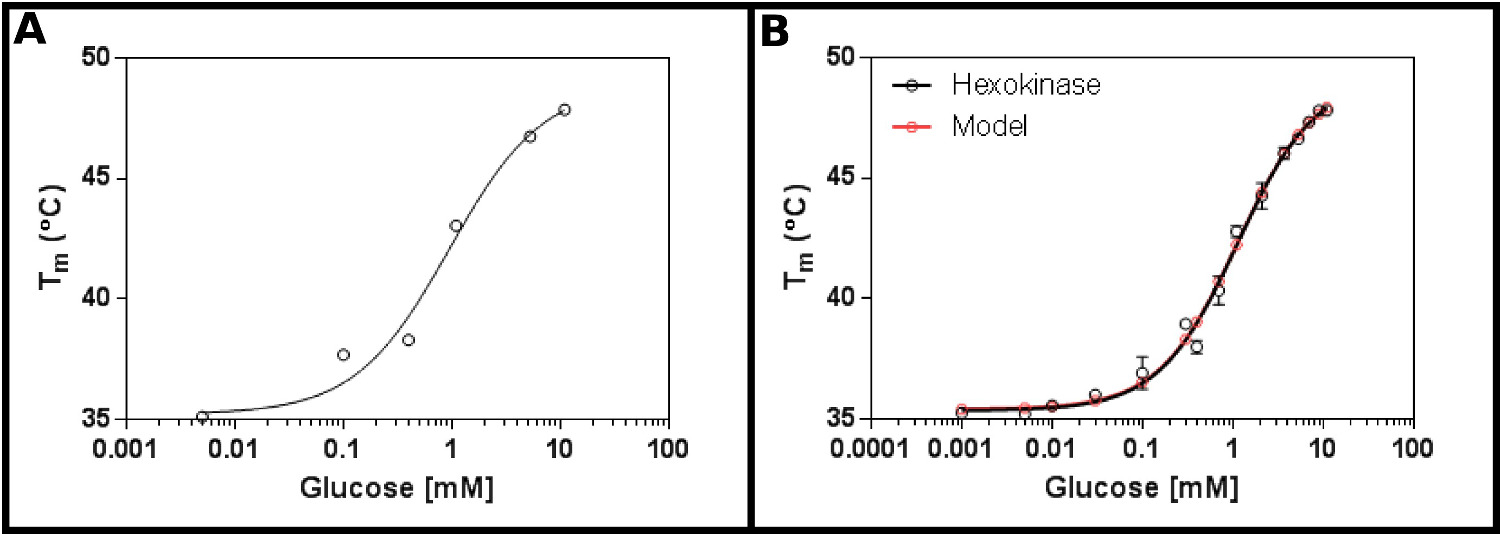
. האינטראקציה איור 2 של hexokinase עם גלוקוז שנמדד על ידי fluorimetry סריקת ההפרש () ניסוי ראשוני בודק טווח רחב של ריכוזי גלוקוז מצביע על כך שד K הוא צפוי להיות בטווח של 0.2 -. 1.7 מ"מ (B) מפורט ניסוי, בדיקת 16 ריכוזים של גלוקוז, מאפשר קביעה של ד K לכאורה כ1.12 ± 0.05 מ"מ. נתונים מתאים מאוד גם למודל לאירוע מחייב יחיד (עם התחתית (T1) והעליון (T2) הטמפרטורות המתאימה ל35.4 ± 0.2 ºC ו49.3 ± 0.5 ºC בהתאמה). שים לב שנתונים אלה נאספו בנוכחות 10 מ"מ MgCl 2. תמונות אלה נערכו על בסיס GraphPad. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
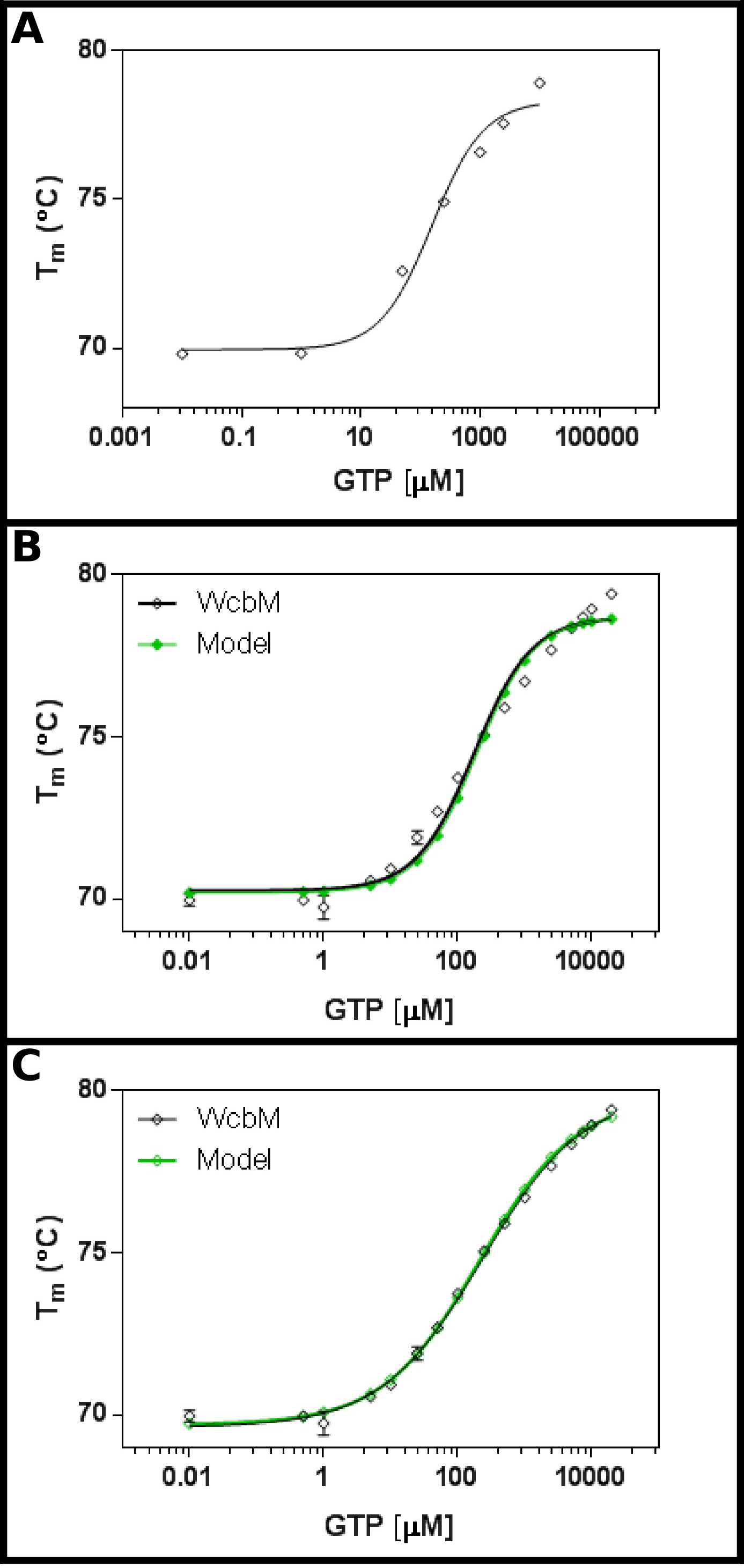
אינטראקציה איור 3 של WcbM עם GTP מגלה מחייבת אנטי שיתופי. (א) ניסוי ראשוני בודק טווח רחב של ריכוזי GTP עולה כי ד K הוא צפוי להיות בטווח של 200 -. 500 מיקרומטר (ב ') ניסוי מפורט, בדיקת 16 ריכוזים של GTP, מציע ערך עבור נראית לעין ד K של 120 ± 20 מיקרומטר. עם זאת, כאשר סולם לוגריתמים משמש לציר x, יש discre משמעותיpancy בין המודל ונתונים. (C) ניתוח של אותם נתונים עם מודל שיתופי תערוכות בכושר מצוין לנתונים שבו מודל שיתופי פשוט משמש. כאן, K ½ של 230 ± 20 מיקרומטר נקבע, עם מקדם cooperativity n = 0.52 ± 0.02 (עם התחתית (T1) והעליון (T2) הטמפרטורות המתאימה ל69.63 ± 0.06 ºC ו79.9 ± 0.1 ºC בהתאמה). כWcbM נראה dimeric, זה מרמז על כך שהאנזים הוא anticooperative בצורה מושלמת בה מחייב GTP. תמונות אלה נערכו על בסיס GraphPad. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
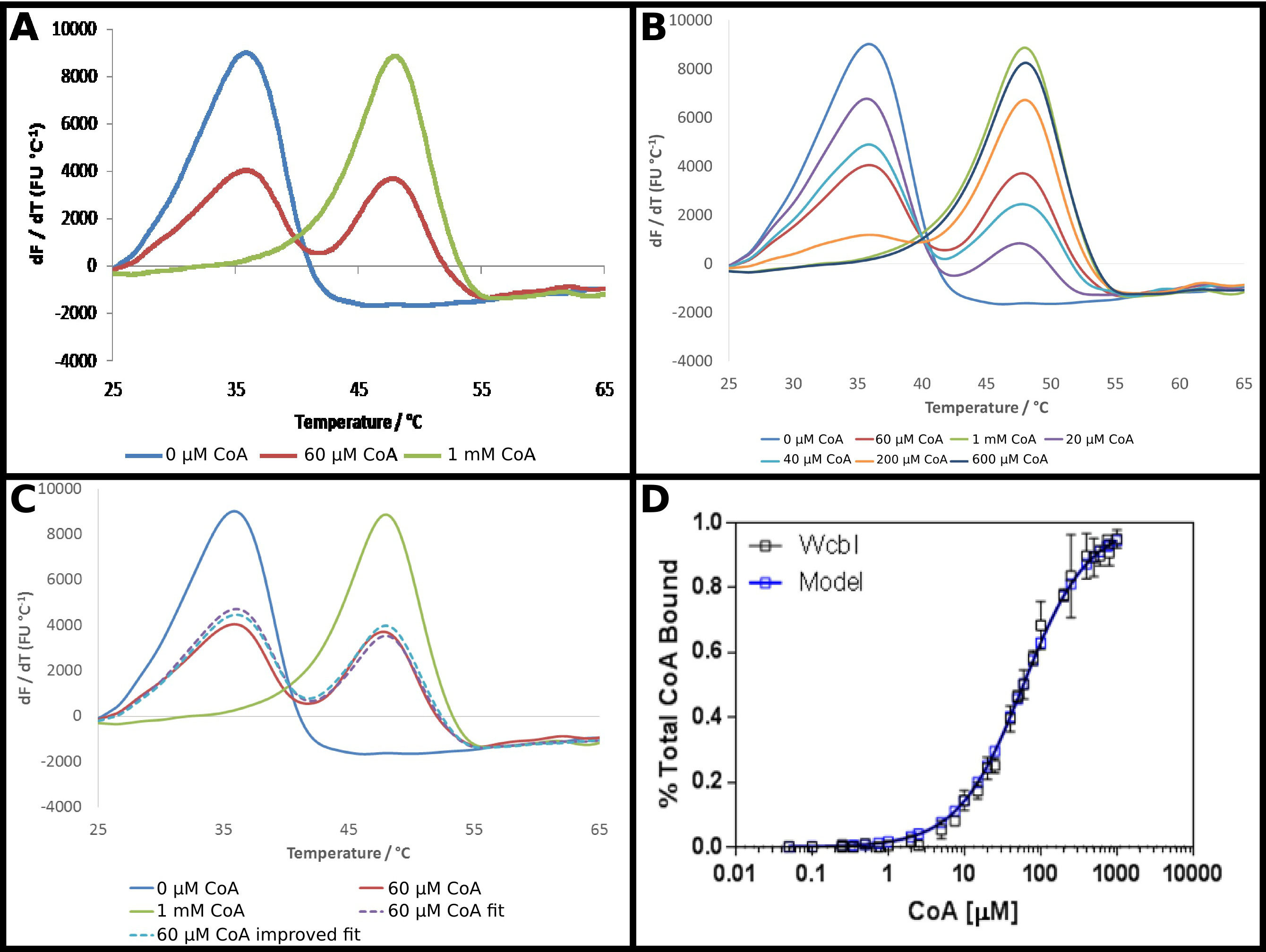
איור 4 WcbI מציג דפוס היתוך biphasicבנוכחותו של אנזים ליגנד (CoA). () WcbI, בהעדר ליגנד (כחול), מראה דפוס היתוך monophasic פשוט. בריכוזים גבוהים ליגנד (1 מ"מ; קו ירוק), דפוס דומה נצפה. עם זאת, בריכוזים ביניים ליגנד. (60 מיקרומטר; קו אדום), שני שיאי היתוך ייחודיים, מתאים למדינות ליגנד חופשי ומאוגד ליגנד הם נצפו (ב) המעבר בין שני הסטים של פסגות הוא תלוי מינון על פני מלא טווח ריכוזים. (C) מידול של היתוך biphasic כסכום של חלקם יחסי של התוצאות ליגנד חופשיות וגבוהות יגנד נותן בכושר טוב לנתונים (קו סגול מקווקו, בהשוואה לקו אדום). בכושר הזה הוא השתפר באמצעות אקסטרפולציה של התוצאה שנצפתה לריכוז הגבוה ליגנד (שבו המודל מציע ~ תפוסת 95%) לתפוסה מלאה (קו כחול מקווקו). (ד ') נתונים המתקבלים לשיעור WcbI חייב CoA sho ws בכושר מצוין למודל מחייב פשוט, עם ד K של 58 ± 2 מיקרומטר (נתונים אלה מייצגים נתונים שנאספו בשני ימים נפרדים, עם ריכוזים ליגנד מעט שונים שנבחרו ליום השני המבוססים על הסט הראשון של תוצאות). פנלים. (- ג) הוכנו באמצעות Excel, ומציג (D) באמצעות GraphPad אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
שולחן מתכון 1 לניסויים ראשוניים.
| מגיב | נפח בתמהיל (μl) |
| חלבון | לריכוז סופי של 0.11 מ"ג / מ"ל |
| 0.3 | |
| 0.5 M HEPES pH 7.0 | 3.7 |
| 5 M NaCl | 5.6 |
| מים | ל180 μl |
זה מתאר את "תערובת מאסטר" של חלבון, מגיב זיהוי ומאגר עבור ניסוי צופיות ראשוני כדי לספק הערכה של ד K, כפי שתואר בסעיף פרוטוקול 1 תערובת חיץ זה מתאים לחלבונים גנריות. איפה תוצאות קודמות מציעות אמורים לשמש מאגרים אחרים, אלה צריכים להיות תחליף. אם מניית החלבון היא בריכוז נמוך (כלומר, פחות מ -0.3 מ"ג / מ"ל), ייתכן שיהיה צורך להפחית את הכמות של חיץ נוסף הוסיף כדי לפצות על חיץ שכבר קיים במדגם החלבון.
לוח מתכון .2 לקביעת ד K.| מגיב | נפח בתמהיל (μl) |
| חלבון | לריכוז סופי של 0.11 מ"ג / מ"ל |
| 5,000X SYPRO אורנג | 1.78 |
| 0.5 M HEPES pH 7.0 | 22.2 |
| 5 M NaCl | 33.3 |
| מים | ל180 μl |
זה מתאר את "תערובת מאסטר" של חלבון, מגיב זיהוי, וbuffer לנחישות מלאה של ד K למדגם חלבון, כפי שתואר בסעיף פרוטוקול .2 תערובת חיץ זה מתאים לחלבונים גנריות. איפה תוצאות קודמות מציעות אמורים לשמש מאגרים אחרים, אלה צריכים להיות תחליף. אם מניית החלבון היא בריכוז נמוך (כלומר, פחות מ -0.3 מ"ג / מ"ל), ייתכן שיהיה צורך להפחית את הכמות של חיץ נוסף הוסיף כדי לפצות על חיץ שכבר קיים במדגם החלבון.
משוואות לוח 3 ופרמטרים לניתוח נתונים.
ד| שלב בפרוטוקול ניסוי | משוואה הנדרשת | פרמטרים הנדרשים | תיאור של משתנים ופרמטרים |
| 3.3 | |||
| ליגנד אתר אחד מחייב | Y = תחתון + ((Top-Bottom) * (1 - ((PK ד -X sqrt + (((P + X + ד K) ^ 2) - (4 * P * X))) / (2 * P )))) | P: ריכוז חלבון. KD: ניתוק קבוע. ניתנים P וKd באותן היחידות ששמשו לריכוזים ליגנד. למעלה, למטה: טמפרטורת היתוך בריכוז ליגנד אינסופי ולא ריכוז ליגנד בהתאמה. | |
| 3.4 | תחתון = * YMIN | YMIN: ערך מינימאלי של Y (החלבון הניסיוני הנמוך ביותר TM, במקרה זה) | |
| למעלה = *-YMAX | -YMAX: ערך מקסימאלי של Y (החלבון הניסיוני הגבוה ביותר Tm) | ||
| ד K = * X בYMID | YMID: ערך של Y שמתאים לממוצע של YMIN ו- YMAX. X הוא הערך המתאים של X (כאן, הריכוז ליגנד הרלוונטי) | ||
| P = (ערך ראשוני, כדי להיות בכושר) | |||
| 4.1 | |||
| מודל שיתופי פשוט | Y = + תחתון ((Top-Bottom) * (((X / Kd) ^ n) / (1 + ((X / Kd) n ^)))) | n: Hמקדם חולה. זה מתאר את cooperativity, או תכונות הביוכימיות אחרות, של החלבון, ואינו בהכרח אומדן מספר האתרים ליגנד מחייב בחלבון. מקדם Hill של אחד מהם מייצג לא cooperativity; ערכים נמוכים מאחד מצביעים cooperativity השלילי, והערכים cooperativity גדול מאחד חיובי. | |
| תחתון = * YMIN | |||
| למעלה = *-YMAX | |||
| ד K = * X בYMID | |||
| P = (ערך ראשוני, כדי להיות בכושר ) | |||
| n = (ערך ראשוני, כדי להיות בכושר) | |||
| סדרתית מחייבת של שני הליגנדים | Y = תחתון + ((Top-Bottom) * ((X ^ 2) / (ד * K2 K)) / (1 + (X / ד K) + ((X ^ 2) / (K2 * ד K))) ) | K2: ניתוק קבוע לאירוע מחייב שני. | |
| תחתון = * YMIN | |||
| למעלה = *-YMAX | |||
| K2 = * X בYMID | |||
| P = (ערך ראשוני, כדי להיות בכושר) | |||
| עצמאי מחייב של שני הליגנדים | Y = תחתון + ((Top-Bottom) * ((X ^ 2) / (ד * K2 K)) / (1 + (ד 2 * X / K) + ((X ^ 2) / (K * ד K2) ))) | ||
| תחתון = * YMIN | |||
| ד K = * X בYMID | |||
| K2 = * X בYMID | |||
| P = (ערך ראשוני, כדי להיות בכושר) | |||
| 5.5 | |||
| ניתוח של משמרות בינארי בטמפרטורת התכה | Y = 1 - ((PK -X ד + sqrt (((P + X + K ד) ^ 2) - (4 * P * X))) / (2 * P)) | ||
| תחתון = * YMIN | |||
| למעלה = *-YMAX | |||
| ד K = * X בYMID | |||
| P = (ערך ראשוני, כדי להיות בכושר) | |||
| 5.8 | |||
| אקסטרפולציה לריכוז ליגנד אינסופי | (C2 - ((1 $ R $ 2) * B2)) / R $ 2 $ | B2: תא המכיל את התוצאה ללא יגנד. C2: תא המכיל את התוצאה עם ליגנד המרבי. R $ 2: $ תא המכיל את השיעור מחויב בריכוז ליגנד מרבי. |
שלבי 3, 4 ו -5 דורשים תוספת של משוואות מפורטות לתוכנת הניתוח, והגדרה מדויקת של הפעלת פרמטרים לניתוח נתונים. משוואות לכל שלב רלוונטי מוצגות, עם הבחירות הנכונות של הפרמטרים. הסבר של המשמעות של משתנים ופרמטרים מסופק להתייחסות.
לוח 4: ריכוזים להקרנה של אינטראקציה של hexokinase עם גלוקוז.
| נקודות לדוגמא | ליגנד (glucosה) ריכוז (מ"מ) |
| 1 | 0 |
| 2 | 0.001 |
| 3 | 0.005 |
| 4 | 0.01 |
| 5 | 0.03 |
| 6 | 0.1 |
| 7 | 0.3 |
| 8 | 0.4 |
| 9 | 0.7 |
| 10 | 1.1 |
| 11 | 2.1 |
| 12 | 3.7 |
| 13 | 5.3 |
| 14 | 7 |
| 15 | 9 |
| 16 | 11 |
Hexokinase מcerevisiae השמרים Saccharomyces ניצנים התווסף לתערובת ההורים כפי שתואר בפרוטוקול, בתוספת 10 מ"מ MgCl 2 כמגנזיום הוא cofactor ידוע. האומדן הראשוני של ד K היה בין 0.5 ו2 מ"מ. ניסויים הוקמו על מנת לספק את הריכוזים סופיים המצוינות של גלוקוז.
לוח 5: ריכוזים להקרנה של אינטראקציה של WcbM עם תוצר.
| נקודות לדוגמא | ליגנד ריכוז (GTP) (מיקרומטר) |
| 1 | 0 |
| 2 | 0.5 |
| 3 | 1 |
| 4 | 5 |
| 5 | 10 |
| 6 | 25 |
| 7 | 50 |
| 8 | 100 |
| 9 | 250 |
| 10 | |
| 11 | 1,000 |
| 12 | 2,500 |
| 13 | 5,000 |
| 14 | 7,500 |
| 15 | 10,000 |
| 16 | 20,000 |
WcbM מBurkholderia pseudomallei התווסף לתערובת ההורים כפי שתואר בפרוטוקול. האומדן הראשוני של ד K היה בסביבות 100 מיקרומטר. ניסויים הוקמו על מנת לספק את הריכוזים סופיים מצויינים של GTP, במטרה לכסות לפחות שני סדרי הגודל מעל ומתחת ד K.
Discussion
fluorimetry סריקת ההפרש הוכיח את כוחה כשיטת חזקה ותכליתית לאפיון חלבונים, וזיהוי ligands חלבון הפוטנציאלי. ההצלחות המתועדות היטב בזירוז ייצוב חלבון, גילוי תרופות (במיוחד במעבדות פחות מימנו גם) והתגבשות 10,23-25 עשו את זה בשיטה אטרקטיבית לסינון ראשוני של תרכובות. תרכובות הוסיפו לחלבונים מצביעות על עלייה ברורה במינון תלויה ב7,9 טמפרטורת התכה לכאורה. עם זאת, יש כבר כמה ניסיונות להשתמש בתוצאות מהניסויים אלה כדי לקבוע קבועים המחייבים לכאורה כדי לסייע בדירוג תרכובות לזיקה שלהם. כאן, אנו מציגים שיטה לקביעה באופן שיטתי קבוע דיסוציאציה לכאורה לחלבונים בנוכחות ליגנד.
התוצאות שהוצגו כאן מראות כי DSF במהירות ובאופן עמיד יכול לספק הערכות של קבוע דיסוציאציה לשילוב חלבון ליגנד. ניתן להשפיע נתונים נצפו עם כלים זמינים מסחרי כדי לספק נחישות מהירה של ד K, ללא הצורך להניח הנחות באשר לערך הצפוי של פרמטרים. יש שיטת יתרון משמעותי על פני כמה בשיטות דומות של להיות חסכן בשני חלבונים וזמן הנדרשים. הניסוי המתואר כאן יצרוך 0.13 מ"ג חלבון לכל ניסוי (כ 0.4 מ"ג לניסויים חוזרים ונשנים בשלושה עותקים). זה משווה לטובה עם calorimetry טיטרציה בידוד התרמי (ITC), שבו ניסוי יחיד עם חלבון kDa 40 ממוצע יצרוך כמות דומה. הסט המלא של ניסויים הנדרשים לפרוטוקול זה היה לצרוך כ -4 שעות, כולל הכנה, לסט אחד של ניסויים. שוב, זו עשויה להיות משמעותי יותר מהר מאשר שיטות כגון ITC או תהודת plasmon פני השטח, אשר לעתים קרובות תוך עוצמה דורש אופטימיזציה ניכרת כדי להשיג נתונים הטובים ביותר.
התוצאות שלנו מראות כי יש עדיין דרישה לבחון בזהירות את הנתונים הגולמיים, בכושר של נתונים אלה כדי לקבוע את טמפרטורת ההתכה, ואת ההתאמה של נתוני טמפרטורת התכה כדי לקבוע את קבוע דיסוציאציה. אתגר ראשון הוא הצורה של נתונים הגולמיים המופקים בהיתוך החלבון. בחלק מהמקרים, את הצורה לא להתקרב לזה שנצפה באיור 1 א. נושאים משותפים כוללים משמרות בטמפרטורה נמוכות על יגנד מחייבים, הקרינה רקע גבוהה, ומעברים מרובים יוצא דופן בטמפרטורה. משמרות טמפרטורה נמוכה נתפסות על כריכת מספר הליגנדים. לשיטה זו, הפרמטר הקריטי ביותר הוא השגיאה במדידת T מ ', בהשוואה לשינוי הטמפרטורה. נתונים בדרך כלל יכולים להיות מצוידים בצורה סבירה כאשר סטיית התקן של מדידות בשלושה עותקים לא תעלה על 10% שינוי טמפרטורת ההתכה בין חלבון מאוגד וכרוך באופן מלא. הניסיון שלנו הוא שבו זמני כגוןמשמרות erature רק 2 מעלות צלזיוס, זה יכול להיות מספיק עבור התאמת הנתונים, אם נקודות נתוני הפרט הן מאוד מדויקות. נושא שני הוא בצורה יוצאת דופן עקום. אלה נבדלים לעתים קרובות בין חלבון החופשי וטפסים ליגנד קשורים, כיגנד המחייב משפיע התגלגלות מצבים של החלבון. במקרים אלה, המשתמש חייב לשקול אם הנתונים ניתן להשתמש עם התחשבות הולמת במודלים שישמשו לקביעת טמפרטורת התכה וקבועה דיסוציאציה. בעיה נפוצה נוספת היא כי תוספת של cofactor לחלבון (לדוגמא, MgCl 2 בדוגמא שלנו עם hexokinase) נדרש כדי להשיג את הנתונים אמינות ביותר. הניסיון שלנו היה ששיקול דעת של כל הגורמים צפויים בניסוי בשלב של לקיחת קריאות ראשוניות היא חיונית להשגת התוצאות הטובות ביותר. יתר על כן, טיפולים תיאורטי חלופיים יכולים לחשוף תכונות של נתונים אלה 15,17. לבסוף, אין זה נדיר עבור חלבונים מסוימים שגontain מקורי נחשף אזורים הידרופובי להראות הקרינה רקע גבוהה. ישנם מספר פתרונות לבעיות אלה, שנסקרו בהרחבה במקומות אחרים 6,9.
בפרט, המשתמש חייב לשקול אם להשתמש בולצמן או מודלים נגזרים (למשל, איור 4), ובמקרה של שימוש בנגזרים, אם חייב להיות מודל נמס מרובה. שתי השיטות למידול תרמית התגלגלות שונות שבשיטה בולצמן מתאימה את נתוני ניסוי למשוואת בולצמן, בהנחת צורת sigmoidal רגילה לעקומת התגלגלות. בניגוד לכך, השיטה הנגזרת לוקחת הנגזרת הראשונה של נתוני ניסוי בכל נקודה (פנל תחתון באיור 1 א), ורואה את טמפרטורת ההתכה להיות הנקודה נגזרת הראשון הגבוה ביותר. השיטה הנגזרת, בדרך כלל, חוזרת טמפרטורת התכה גבוהה יותר בכ 2 - 3 מעלות צלזיוס. רוב החלבונים יחזרו עקביים יותרתוצאה (כלומר, סטיית ההתקן של טמפרטורת ההתכה לניסויים בשלושה עותקים הוא נמוכה יותר) לאחת משתי השיטות. זה בדרך כלל בצורה אינטימית הקשורים לצורה המדויקת של חלבון התגלגלות עקומה, ויש צורך לקבוע את השיטה הטובה ביותר בכל מקרה ומקרה באופן אמפירי. איפה המודל הנגזר משמש, חשוב גם לקחת בחשבון אירועי היתוך מרובים. חלק מהנתונים מראים בבירור ראיות למעברים מרובים, ובמקרים אלה התוצאות צפויות להיות קל יותר לפרש אם אירועי היתוך המרובים אלה הם מודל. בהקשר של פרוטוקול זה, הוא לעתים קרובות את המקרה כי התוספת של ליגנד יכולה לגרום לחלבון לעבור מיש מעברי היתוך מרובים למעבר בודד (למשל, על ידי ייצוב המשנה ביותר תרמית השבירה), או להיפך. היינו אפוא עו"ד שהנתונים הגולמיים נבחנים יחד לפני שוקל גישה אשר יהיה הטוב ביותר לשימוש.
בעקבות מ 'odelling של טמפרטורות התכה בודדות, נושאים נוספים יכולים להתעורר בהתאמה אלה לדגמים שהוצגו בסעיף בפרוטוקול. זה הכרחי כדי לבחון היטב את ההתאמה למשוואה הקבועה דיסוציאציה באמצעות סולם לוגריתמים, כמו ניתוח זה לעתים קרובות מדגיש פערים בין הנתונים שנצפו והמודל (ה .g., איור 3). בעוד התוצאות שהתקבלו הן בדרך כלל חזקות, טיפול בפרשנות מציע את ההזדמנות כדי לחלץ תוצאות טובות יותר, והמשמעות ביותר, מן הנתונים.
נושא מסוים שהועלה על ידי נתונים אלה הוא הפרשנות שצריכה להיות ממוקם על חלבונים שמראים cooperativity, או אירועים המחייבים מרובים, בDSF. יש לנו, עד היום, רק בתופעה זו, בחלבונים שצפויים להיות להם אירועים המחייבים ספציפיים מרובים (למשל, WcbM, חלבון שטוב ביותר homologue הוא multimer 26, ואשר משמש כmultimer על כרומטוגרפיה הדרת גודל [נתונים לאמוצג]). זה בכלל לא ברור שcooperativity השלילי שנצפה בdenaturation DSF מצביע על כך שאנזים סופו של דבר להראות cooperativity השלילי: ולא, זה עשוי להיות סימן למחייב מורכבים שחייבים להיחקר באופן יסודי יותר באמצעות מגוון רחב יותר של שיטות. אין זה מרמז לנו, עם זאת, כי מחקרים מקיפים יותר של חלבונים כאלה עשויים לזהות תופעות מעניינות.
ערכי הנתונים עבור קבוע דיסוציאציה שימוש בשיטה זו הם בדרך כלל באותו סדר כמו אלה המסופקים על ידי שיטות אחרות, כגון calorimetry טיטרציה הבידוד התרמי ותהודה plasmon פני השטח. עם זאת, הערכים מוחלטים שנצפו גבוהים יותר בתדירות גבוהה יותר מאשר נצפה באמצעות שיטות אלה. זה לפחות בחלקו מעובדה שקבוע דיסוציאציה הוא ציין בטמפרטורת ההתכה של החלבון עם ליגנד. ד K זה גבוה בדרך כלל מזו בטמפרטורות פיסיולוגיות. Dissociation קבוע קשור לטמפרטורה של התגובה על ידי המשוואות:
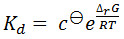 [1]
[1]
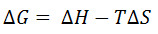 [2]
[2]
(שבו θ c הוא ריכוז ההתייחסות הסטנדרטי, Δ r G הוא השינוי באנרגיה החופשי של גיבס של התגובה, R הוא קבוע גזים הטוחנות, Δ H הוא השינוי באנתלפיה בתגובה, וΔ S הוא שינוי אנטרופיה בתגובה .)
תגובות עם קבועי דיסוציאציה בטווח המדידה של שיטה זו, בדרך כלל, יש לי G r Δ שלילי, ולכן ההשפעה של עלייה בטמפרטורה במשוואה [1] תהיה להגדיל את הניתוק מתמיד. שני מונחי Δ H וΔ S המהווים את האנרגיה החופשית של גיבס (משוואה [2]) הם temperaturדואר 27 תלויים, וההשפעה על קבוע דיסוציאציה יהיו תלוי בגודל ובסימן של תלות הטמפרטורה אלה, ובהכרח יהיו אינטראקציה תלויה. כתוצאה מכך, זה לא בלתי צפוי שקבועי דיסוציאציה נקבעו על ידי שיטה זו הם לעתים גדולים יותר מאלה שנקבעו על ידי שיטות הפועלות על RT. תלות בטמפרטורה גם היא, כמובן, אזהרה של שיטות רבות אחרות, שנוטים לספק את קבוע דיסוציאציה בטמפרטורות נמוכות מהטמפרטורה הפיזיולוגית.
אזהרה נוספת של שיטת DSF היא שזה שיטה שכותרתו, בניגוד לITC. תווית הניאון משמשת (SYPRO Orange) היא הידרופובי, ולכן במקרים מסוימים יכולה להתחרות עם הכריכה של ליגנד הידרופובי לחלבונים. כתוצאה מכך, סביר להניח כי במקרים מסוימים, קבוע דיסוציאציה הושג יועלו באופן מלאכותי בשל תחרות עם התווית. עם זאת, לשם ההשוואה של הליגנדים מגוונים, (השימוש העיקרי שלDSF), ההבדלים צפויים להיות משמעותי מספיק כדי להשפיע על הדירוג של תרכובות על ידי זיקה.
חסרון פוטנציאלי של שיטה זו הוא המגבלה של זיהוי שניתן להשיג. בעיקרון, זה לא אמור להיות אפשרי באופן מדויק למדידת ערך עבור ד K שאינו עולה על 50% מריכוז החלבון, ואפילו ערכים בטווח זה עשויים להיות דיוק מפוקפק. בעוד המגבלה של זיהוי בקצה הזה של הטווח ניתן להאריך מעט על ידי הפחתת הריכוזים של חלבון וצבע, הרגישות של המכשיר תהיה למנוע ירידה נוספת בריכוז חלבון. בדומה לכך, הקצה העליון של הרגישות שייקבע על ידי המסיסות של ליגנד. לקבלת אומדן מתמטי חזק לד K, חשוב ביותר לקבל נתונים עם 90% מהחלבון הנוכחי בצורה הנכנס ליגנד, אשר דורש ריכוז ליגנד להיות מקורבly עשר פעמים ד K (בהנחה שאין cooperativity). המגבלה של זיהוי ולכן תהיה בהכרח להיות עשירית מהמסיסות של ליגנד במאגר הרלוונטי. משמעות דבר היא כי גבולות זיהוי של השיטה ינועו בדרך כלל בין 1 מיקרומטר ובין 1 ו100 מ"מ, בהתאם לחלבון ויגנד.
לסיכום, fluorimetry סריקת ההפרש הוא טכניקה תכליתית החלים על מגוון רחב של חלבונים. שימוש בשיטות שהוצגו כאן, זה אפשרי במהירות ובזול כדי לקבוע את הזיקה של חלבון לליגנד שונה. זה יש פוטנציאל גדול לשימוש בטיהור חלבונים וייצוב, הבהרת הפונקציה או ספציפי של אנזימים מmetagenomes, ובגילוי תרופות, במיוחד במעבדות קטנות.
Disclosures
The authors declare that they have nothing to disclose.
Acknowledgements
This work was funded by grant from the BBSRC (grant number BB/H019685/1 and BB/E527663/1) to the University of Exeter.
Materials
| Name | Company | Catalog Number | Comments |
| StepOne real time PCR instrument | Life Technologies | 4376357 | DSF can be performed with many other instruments. The StepOne instrument has very convenient software for data analysis. |
| Protein thermal shift software v1.0 | Life Technologies | 4466037 | |
| MicroAmp Fast optical 48-well plates | Life Technologies | 4375816 | |
| Optical sealing tape | Life Technologies | 4375323 | Bio-rad part no. 223-9444 is an alternative supplier |
| U-bottomed 96-well plates | Fisher | 11521943 | |
| SYPRO Orange | Life Technologies | S6650 | For a smaller volume supplier, use Sigma part no. S5692 |
| SPSS statistics version 20 | IBM | Other statistics packages will provide similar functionality | |
| GraphPad Prism 6.02 | GraphPad | Other statistics packages will provide similar functionality | |
| Hand applicator (PA1) | 3M | 75-3454-4264-6 | |
| Hexokinase from Saccharomyces cerevisiae | Sigma-Aldrich | H5000 | |
| Glucose | Fisher scientific | 10141520 |
References
- Freyer, M. W., Lewis, E. A. Isothermal titration calorimetry: experimental design, data analysis, and probing macromolecule/ligand binding and kinetic interactions. Methods Cell Biol. 84, 79-113 (2008).
- Ladbury, J. E. Calorimetry as a tool for understanding biomolecular interactions and an aid to drug design. Biochem Soc Trans. 38, 888-893 (2010).
- Abdiche, Y., Malashock, D., Pinkerton, A., Pons, J. Determining kinetics and affinities of protein interactions using a parallel real-time label-free biosensor, the Octet. Anal Biochem. 377, 209-217 (2008).
- Pantoliano, M. W., et al. High-density miniaturized thermal shift assays as a general strategy for drug discovery. J Biomol Screen. 6, 429-440 (2001).
- Senisterra, G., Chau, I., Vedadi, M. Thermal denaturation assays in chemical biology. Assay Drug Dev Technol. 10, 128-136 (2012).
- Ericsson, U. B., Hallberg, B. M., Detitta, G. T., Dekker, N., Nordlund, P. Thermofluor-based high-throughput stability optimization of proteins for structural studies. Anal Biochem. 357, 289-298 (2006).
- Lo, M. C., et al. Evaluation of fluorescence-based thermal shift assays for hit identification in drug discovery. Anal Biochem. 332, 153-159 (2004).
- Nettleship, J. E., Brown, J., Groves, M. R., Geerlof, A. Methods for protein characterization by mass spectrometry, thermal shift (ThermoFluor) assay, and multiangle or static light scattering. Methods Mol Biol. 426, 299-318 (2008).
- Niesen, F. H., Berglund, H., Vedadi, M. The use of differential scanning fluorimetry to detect ligand interactions that promote protein stability. Nat Protoc. 2, 2212-2221 (2007).
- Geders, T. W., Gustafson, K., Finzel, B. C. Use of differential scanning fluorimetry to optimize the purification and crystallization of PLP-dependent enzymes. Acta Crystallogr Sect F Struct Biol Cryst Commun. 68, 596-600 (2012).
- Vedadi, M., et al. Chemical screening methods to identify ligands that promote protein stability, protein crystallization, and structure determination. Proc Natl Acad Sci USA. 103, 15835-15840 (2006).
- Davis, B. J., Erlanson, D. A. Learning from our mistakes: the 'unknown knowns' in fragment screening. Bioorg Med Chem Lett. 23, 2844-2852 (2013).
- Larsson, A., Jansson, A., Aberg, A., Nordlund, P. Efficiency of hit generation and structural characterization in fragment-based ligand discovery. Curr Opin Chem Biol. 15, 482-488 (2011).
- Scott, D. E., et al. Using a fragment-based approach to target protein-protein interactions. Chembiochem. 14, 332-342 (2013).
- Cimmperman, P., et al. A quantitative model of thermal stabilization and destabilization of proteins by ligands. Biophys. J. 95, 3222-3231 (2008).
- Matulis, D., Kranz, J. K., Salemme, F. R., Todd, M. J. Thermodynamic stability of carbonic anhydrase: measurements of binding affinity and stoichiometry using ThermoFluor. Biochemistry. 44, 5258-5266 (2005).
- Zubriene, A., et al. Measurement of nanomolar dissociation constants by titration calorimetry and thermal shift assay - radicicol binding to Hsp90 and ethoxzolamide binding to CAII. Int J Mol Sci. 10, 2662-2680 (2009).
- Weiss, J. N. The Hill equation revisited: uses and misuses. FASEB J. 11, 835-841 (1997).
- Cuccui, J., et al. Characterization of the Burkholderia pseudomallei K96243 capsular polysaccharide I coding region. Infect Immun. 80, 1209-1221 (2012).
- DeShazer, D., Waag, D. M., Fritz, D. L., Woods, D. E. Identification of a Burkholderia mallei polysaccharide gene cluster by subtractive hybridization and demonstration that the encoded capsule is an essential virulence determinant. Microb Pathog. 30, 253-269 (2001).
- Berman, H., Henrick, K., Nakamura, H. Announcing the worldwide Protein Data Bank. Nat Struct Biol. 10, 980(2003).
- Vivoli, M., Ayres, E., Beaumont, E., Isupov, M., Harmer, N. Structural insights into WcbI, a novel polysaccharide biosynthesis enzyme. IUCr Journal. 1 (1), 28-38 (2014).
- Sorrell, F. J., Greenwood, G. K., Birchall, K., Chen, B. Development of a differential scanning fluorimetry based high throughput screening assay for the discovery of affinity binders against an anthrax protein. J Pharm Biomed Anal. 52, 802-808 (2010).
- Uniewicz, K. A., et al. Differential scanning fluorimetry measurement of protein stability changes upon binding to glycosaminoglycans: a screening test for binding specificity. Anal Chem. 82, 3796-3802 (2010).
- Wan, K. F., et al. Differential scanning fluorimetry as secondary screening platform for small molecule inhibitors of Bcl-XL. Cell Cycle. 8, 3943-3952 (2009).
- Koropatkin, N. M., Holden, H. M. Molecular structure of alpha-D-glucose-1-phosphate cytidylyltransferase from Salmonella typhi. J Biol Chem. 279, 44023-44029 (2004).
- Paleskava, A., Konevega, A. L., Rodnina, M. V. Thermodynamics of the GTP-GDP-operated conformational switch of selenocysteine-specific translation factor SelB. J Biol Chem. 287, 27906-27912 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved