Method Article
Определение белков-лиганд с использованием дифференциальной сканирующей флуориметрии
В этой статье
Резюме
Differential scanning fluorimetry is a widely used method for screening libraries of small molecules for interactions with proteins. Here, we present a straightforward method to extend these analyses to provide an estimate of the dissociation constant between a small molecule and its protein partner.
Аннотация
Широкий спектр методов в настоящее время доступны для определения константы диссоциации между белком и взаимодействующих небольших молекул. Тем не менее, большинство из них требуют доступа к специализированным оборудованием, и часто требуют степень экспертизы, чтобы эффективно создать надежные эксперименты и анализировать данные. Дифференциальная сканирующая флуориметрия (DSF) все чаще используется в качестве надежного способа первичного скрининга белков для взаимодействия малых молекул, либо для выявления физиологических партнеров или для открытия хит. Этот метод имеет то преимущество, что она требует только машину, подходящую для ПЦР количественной ПЦР, и таким образом, подходящие приборы доступна в большинстве учреждений; превосходный диапазон протоколов уже доступны; и есть все основания прецеденты в литературе для многократного использования метода. Прошлая работа предложил несколько способов расчета константы диссоциации из данных DSF, но это математически требовательный. Здесь мы деммонстрировать метод оценки константы диссоциации с умеренным количеством DSF экспериментальных данных. Эти данные, как правило, могут быть собраны и проанализированы в течение одного дня. Мы показываем, как разные модели могут быть использованы, чтобы соответствовать данные, полученные от простых обязательных мероприятий, и где кооперативного связывания или независимые сайты связывания присутствуют. Наконец, мы приведем пример анализа данных в случае, когда стандартные модели не применяются. Эти методы иллюстрируются по данным на коммерчески доступных белков управления, и двух белков из нашей исследовательской программы. В целом, наш метод обеспечивает простой способ для исследователей быстро получить дальнейшее понимание белка-лиганд с использованием DSF.
Введение
Все белки связываются с разной сродства, для широкого круга других молекул из простых ионов в других крупных макромолекул. Во многих случаях, белки связываются с малых партнеров молекул в рамках своей нормальной функции (например, киназа связывания с АТФ). Другие взаимодействия может быть не связан с функцией, но экспериментально полезны в качестве инструментов (например, малых молекул, которые стабилизируют белки улучшить успех кристаллизации, или оказания помощи в поддержании белки в растворе); в то время как малые молекулы, которые связываются с активными центрами и аллостерическими сайтами белков могут действовать как ингибиторы, так и модулируют активность ферментов.
Есть широкий спектр методов, которые могут быть использованы для определения аффинности белков для молекул-партнеров. Изотермический титрования калориметрии 1 широко рассматривается как «золотой стандарт», так как он обеспечивает богатую информацию о реакциях, является этикетка бесплатно, и ограниченные возможности дляrtifacts эксперимента. Тем не менее, несмотря на недавние улучшения в чувствительности измерительных приборов и автоматизации экспериментальной установки, это все еще относительно дорогим с точки зрения потребностей в белке, в лучшем случае низкого и среднего пропускную способность, и лучше всего подходит для взаимодействия с умеренной высокое сродство (10 нм до 100 мкм K D) 2. Другие этикеток бесплатных методы, такие как поверхностного плазмонного резонанса или двухслойной интерферометрии 3 предложения более высокой производительности, и добились чувствительность для обнаружения молекул меньшего размера, как низкие, как 100 Da. Тем не менее, высокие пропускная инструменты для этих методов сравнительно дорого, оправданы только там, где будет постоянное пропускная соответствующих проектов, и так, вероятно, будут недоступны для многих академических лабораториях.
Дифференциальная сканирующая флуориметрия (DSF, или thermofluor) был впервые описан в 2001 году 4 в качестве метода для обнаружения наркотиков. В этом метод, белки инкубировали с флуоресцентным красителем (первоначально были использованы нафталин-сульфоновой красители), который изменяет свое флуоресценции при связывании с гидрофобными участками белков. Образец белка с красителем затем нагревают, а также мониторинг флуоресценции по мере возрастания температуры. Разворачивание белка, а также воздействие гидрофобных частей белка, приводит к характерным рисунком в флуоресценции в зависимости от температуры (фиг.1А). Эксперимент может быть выполнена в небольших объемах в любом коммерческом количественной ПЦР инструмента, и таким образом, в одном эксперименте, большое количество образцов одновременно могут быть проверены (обычно 48, 96 или 384 образцов, в зависимости от модели прибора). Опыты, как правило, могут быть выполнены в вокруг часов, что обеспечивает возможность высокопроизводительного анализа образцов 5.
Дальнейшее совершенствование методологии видели принятие красителей с лучшими спектральными свойствами 6,7 , генетические методы для анализа данных, и предложил протоколы для первичного скрининга 8,9. Область применения метода была расширена, с особым акцентом на создание оптимальных условий для подготовки и хранения белков 10, и на выявлении потенциальных партнеров по связыванию, чтобы помочь кристаллизации 11. Относительно высокая пропускная способность метода, относительно низкая стоимость белком (~ 2 мкг на реакции), и применимость к изучению слабых связывающие молекулы сделал DSF собой ценный инструмент для фрагмента на основе разработки лекарств, особенно в академическом контексте 12-14.
Несмотря на широкое применение DSF к изучению белок-лиганд, несколько исследований описано определение констант диссоциации этих исследований. Тем не менее, эти, как правило, производят подробные уравнения, описывающие развертывание белка, по многим параметрам, которые должны быть установлены в разреженных данных или в некоторых случаях еstimated 7,15-17. Эти методы имеют особое значение в сложных случаях, например, плотно обязательных соединений, или белков отображаются необычные переходы. Тем не менее, для многих лабораториях, эти подробный анализ слишком громоздки для повседневного использования. Поэтому мы предлагаем альтернативные методы лечения для различных сценариев, и продемонстрировать, как они могут быть использованы, чтобы соответствовать данные, вытекающие из различных белковых-лиганд. Наш метод использует инструмент StepOne КПЦР, для которых программное обеспечение для анализа на заказ данные доступны; пока это ускоряет анализ данных, результаты других инструментов могут быть обработаны с использованием ранее опубликованных методов 9, и то же самое после анализ может быть проведен.
протокол
1 Определение приближенное значение для константы диссоциации (т.е. в течение одного порядка величины)
- Подготовьте смесь указанных в таблице 1.
- Подготовьте запасы интересующих лигандов на самом высоком имеющейся концентрации, а затем на шесть десять кратные разведения этого. Где приблизительная Уб известно из предыдущих данных, стремиться к тому, по крайней мере, две концентрации выше и ниже Уб.
- Алиготе 18 мкл смеси на восемь скважин в тарелке КПЦР. Добавить 2 мкл растворителя в первую лунку. Добавить 2 мкл каждого члена ряда разбавления лиганд (шаг 1.2) в одной скважине каждой из оставшихся семи скважин.
- Поместите уплотнение КПЦР над пластиной. Для достижения хорошего уплотнения пластины, разместить аппликатор для рук (см таблицы конкретных реагентов) в середине пластины. Гладкая вниз уплотнение с одной стороны, а затем повторить на другой половинеПластина.
- Центрифуга пластины при 500 мкг в течение двух минут, чтобы удалить пузырьки воздуха.
- Место пластины в приборе StepOne КПЦР. Выберите опцию «Melt кривой", The Rox фильтры, и выбрать быструю скорость разгона (это обеспечивает 2 мин пауза при 25 ° С, а затем рампе до 99 ° С в течение 40 мин, а затем на 2 минуты паузы). Запустите тепловой денатурации.
ПРИМЕЧАНИЕ: Файлы сценариев для выполнения пробег доступны онлайн по адресу: // www.exeter.ac.uk/biosciences/capsular. - По завершении приборной перспективе, нажмите на кнопку "Анализ" на экране. Сохраните файл результата.
- Откройте Protein Thermal программное обеспечение Shift.
- Создать новое исследование; на вкладке свойств, дать этому название, и в вкладке Условия, подробно лиганды.
- Переход к закладке Эксперимент Files, и импорта сохраненного файл результатов (XXX.eds), и установить содержимое каждой лунки (шаблон филES доступны из авторов).
- Переход к закладке Analysis, и нажмите кнопку "Анализ".
ПРИМЕЧАНИЕ: Это будет анализировать результаты. Можно экспортировать результаты для дальнейшего расследования с Excel с помощью вкладки Export. Результаты экспортируются в закладке очерчены формате. Лучше всего, чтобы открыть экспортированный файл в Excel, и необходимо немедленно сохранить в формате Excel.
- Убедитесь, что белок в присутствии растворителя само по себе дает результат, аналогичный тому, который показан на фиг.1А. Далее, рассмотрим температуры плавления наблюдаемые в результатах в "репликации" панели. Убедитесь, что это показывает явное увеличение температуры плавления с увеличением концентрации лиганда.
ПРИМЕЧАНИЕ: В идеале, это обеспечит четкое максимальную температуру плавления (при условии, что белок полностью лиганд, связанный), и приблизительное Уб где температура плавления полпути между лиганда без белка имаксимальная.
2 Экспериментальная установка для определения Константа диссоциации
- Готовят смесь, описанную в таблице 2 в качестве мастер-смеси.
- Подготовьте запасы лиганда в пятнадцати различных концентраций, которые будут разбавлены в десять раз в конечном эксперименте. В идеале, включают концентраций, по крайней мере, на два порядка выше и ниже расчетной Уб, и в центре концентрации на расчетной Уб. Сосредоточьтесь на семи из пунктов по порядку величины расчетной Уб, еще с четырьмя точками по обе стороны от этого; если есть выбор, включают больше очков при значениях, которые насыщающих.
ПРИМЕЧАНИЕ: При необходимости, целесообразно изменить условия эксперимента такие, что запасы лиганд в двойном экспериментальной концентрации, где лиганд растворимость предельной. - Добавить 120 мкл мастерасмешать до восьми скважин в луночного планшета U-дном 96, чтобы действовать в качестве резервуара для удобного дозирования мастер-смеси. Используйте 8 канала пипетки обойтись 18 мкл в одну колонку пластины ПЦР. Повторите еще на пять столбцов, чтобы дать в общей сложности 48 заполненных скважин в 6 х 8 узор на тарелке.
- Добавить 20 мкл запасов лиганд или растворитель, чтобы отделить скважин в луночного планшета U-дном 96. Использование пипетки 8 каналов, аспирации 2 мкл восьми различных акций лигандов (или растворителя). Добавьте их в одну колонку пластины ПЦР, которая была заполнена с мастер-микс в шаге 2.3. Повторите те же восемь лигандов / акций растворителей для дальнейших двух столбцов. Аспирируйте 2 мкл остальных восьми лигандов или растворителей запасов, и добавить их к четвертой колонке в пластине. Повторите эту процедуру для двух других столбцов. Это даст три образца для всех 16 лиганда и образцов растворителей.
- Поместите уплотнение КПЦР над пластиной (см шаг 1,4).
- Центрифуга пластину при 500 мкг в течениедве мин.
- Место пластины в приборе КПЦР. Запустите тепловой денатурации с параметрами, заданными в шаге 1.6.
- По завершении приборной перспективе, нажмите на кнопку "Анализ" на экране. Сохраните файл результата.
- Откройте Protein Thermal программное обеспечение Shift. Создать новое исследование; на вкладке свойств, дать этому название, и в вкладке Условия, подробно лиганды.
- Переход к закладке Эксперимент Files, и импорта сохраненного файл результатов (XXX.eds), и установить содержимое каждой лунки.
ПРИМЕЧАНИЕ: файлы шаблонов доступны онлайн по адресу: // www.exeter.ac.uk/biosciences/capsular. - Переход к закладке Analysis, и нажмите кнопку "Анализ".
- Выберите "репликантов" вкладку в меню на левой стороне экрана, чтобы показать результаты в виде трех экземплярах. Оценка достоверности данных, основанную на насколько прочно трех экземплярах. Shoulд в трех экземплярах показать плохую воспроизводимость, изучить исходные данные тесно.
- Анализ данных с использованием как Больцмана или производное методов оценки температуры плавления. Выберите вкладку "Перенос результатов", и в "Перенос результаты заговор», переключите "Участок по:" кнопку между "Tm - Больцмана» и «Tm - производного". Выбор способа, который дает большую воспроизводимость для образца. Экспорт результатов для дальнейшего расследования с Excel с помощью вкладки Export.
ПРИМЕЧАНИЕ: Для образцов, которые показывают множественные переходы, это почти всегда лучше использовать производную метод в режиме многократного расплава. Результаты экспортируются в закладке очерчены формате. Лучше всего, чтобы открыть экспортированный файл в Excel, и необходимо немедленно сохранить в формате Excel. - Повторите эксперимент, по крайней мере в два раза, в том числе повторения на отдельный день, чтобы обеспечить воспроизводимость результатов. Если анализ данных (см шаг 3 ниже)указывают, что значение K D существенно отличается от первоначальной сметы, изменять концентрации лигандов соответственно (см шаг 2,2), чтобы обеспечить хороший диапазон значений вокруг Уб.
3 Анализ данных для определения константы диссоциации под тепловой денатурации
- Создание таблицы в Excel концентраций лиганда и температуру плавления.
- Откройте программное обеспечение GraphPad Prism, и создать таблицу XY. Введите данные, с помощью колонки X для концентрации лиганда и колонны Y для плавления результаты температуры.
ПРИМЕЧАНИЕ: Пример приведен Рисунок 1B. Сценарий с уравнениями предустановленной и альтернативные инструкции по использованию статистического пакета SPSS, доступны в режиме онлайн по адресу: // www.exeter.ac.uk/biosciences/capsular. - На вкладке Analysis, выберите опцию, чтобы изменить параметр анализас (Ctrl + T). Чтобы ввести правильную модель, выберите "Новый", и "Создать новое уравнение". Вставьте уравнение, указанные в таблице 3, как "Single сайт связывание лиганда".
ПРИМЕЧАНИЕ: Пример из этих шагов показан на рисунке 1С. При использовании сценария с уравнениями предварительно, соответствующее уравнение может быть направлен выбирается из списка, а не введен. Вывод этого уравнения приведен в Приложении. - Выберите «Правила начальные значения" окна, и введите правила начальных значений, как указано в таблице 3.
- Ограничивать параметр P, как "Постоянное равно" и введите конечную концентрацию белка (в тех же единицах, лиганд дается в).
- Выберите OK для выполнения анализа.
ПРИМЕЧАНИЕ: Пример из этих шагов показан на рисунке 1D. Программное обеспечение графического производит фигуру, показывая данные и подгонку к модели. Примеры тHESE анализов показаны в репрезентативных данных.
4. Установка данных в кооперативных моделей
Для установки данных на кооперативной модели, выбор между либо простой кооперативной модели, или модели, где два отдельных константы диссоциации определены. Первый подход предпочтителен в случае отрицательного кооперативности, или в качестве исходного исследования. Тем не менее, в принципе, лучше в случае положительного кооперативности моделировать два различных констант диссоциации 18. В этом случае, моделирование может протекать при условии, либо последовательное связывание лигандов, или независимо связывания лигандов.
- Выполните те же первые шаги как в протоколе 3. Однако, на этапе 3.3, вставьте одно из уравнений в таблице 3 указан как "Simple кооперативной модели", "Последовательное связывание двух лигандов", или "Независимый связывания двух лигандов" 18.
- Выберите соответствующие правила для начальных значенийсвязаны с каждой из этих уравнений в таблице 3.
- Изучите подгонки модели к данным. Если данные соответствуют плохо, рассмотреть другую модель.
ПРИМЕЧАНИЕ: важно также внимательно изучить установку температуры плавления к данным белком теплового программного обеспечения Shift (шаг 2.9): иногда надо изменять параметры здесь, чтобы получить лучшие результаты. Еще одно соображение, является ли диапазон точек данных идеально подходит, и есть ли какие аномальные точки: либо ограниченный набор данных в обе стороны от Уб, ни одного аномального точку (особенно на самых высоких концентраций лигандов), может существенно повлиять на результаты. - Повторите эксперимент, по крайней мере в два раза (см шаг 2,12), чтобы обеспечить воспроизводимость.
5. Установка данных в кривые, показывающие двоичных сдвигов в температуры плавления
Иногда вместо того, градуированного ответ на лиганд, белки былинаблюдается принять двоичный ответ, где связан образец четко отделяется от несвязанного образца. Примером может служить в представительных результатов (рисунок 4). В этом случае, фитинг температур плавления не будет соответствовать форме для Уб.
- Экспорт сырой данные, выводимые из белка теплового программного обеспечения Shift. Для каждой температурной точке, вычислить среднее флуоресценции для нуля лиганда, и высокие концентрации лигандов. Составьте таблицу результатов от каждой точки данных рядом с этим.
Примечание: Эта ошибка создается здесь меньше погрешности в встроенными температур плавления. - Откройте статистического пакета SPSS. Скопируйте температуры, два средних наборы данных и данных для каждого эксперимента к окну данных в SPSS. На вкладке переменной, установить среднее набора данных для не лиганда как "низкий", и среднее набора данных для наибольшей концентрации лиганда как "высокий".
- Скачать файл синтаксиса доступнуюна сайте по адресу: // www.exeter.ac.uk/biosciences/capsular . Выберите "Выполнить → Выполнить все".
- Скопируйте доля связанных результаты в новую книгу Excel, с соответствующими концентрациях лигандов.
- Откройте программу Graphpad, и создать таблицу XY. Введите данные, с помощью колонки X для концентрации лиганда и колонны Y для плавления результаты температуры. На вкладке анализа, выберите "параметры анализа изменений". Чтобы ввести правильную модель, выберите "Новый", и "Создать новое уравнение". Введите уравнения, приводимого в таблице 3, представленные как "Анализ двоичных сдвигов в температуре плавления".
- Установите флажок "Правила для начальных условий", и ввести правила для начальных значений, указанных в таблице 3. Constrain параметр P, как "Постоянное равно" и введите конечную концентрацию белка (в тех же единицах, чемпионате Испаниий дано в).
ПРИМЕЧАНИЕ: примеры выполнения этих ящики для протокола в разделе 3, показаны на рис 1С, D. - Если есть хорошо подходит, то результаты могут быть улучшены путем экстраполяции к ожидаемому результату при бесконечной концентрации лиганда. От модели пропорционально связан при каждой концентрации лиганда, проверьте значение для самого высокого значения концентрации лиганда. Если это 0,99 или более, дальнейший анализ вряд ли, чтобы улучшить результаты.
- Если доля меньше 0,99, дополнительный шаг необходим для коррекции последствий несвязанного белка в высоком образце концентрации лиганда. На этапе 5.2, написать доли лиганда, связанного в самой высокой точке концентрации лиганда (со стадии 5.7) в ячейке R2 (может быть использован другой ячейке, и R2 заменен соответствующим образом в уравнении в таблице 3). Создать дополнительный столбец после среднего из самых высоких результатов концентрации лиганда. В елейТ-клеток, скопируйте уравнение, перечисленных в таблице 3 как "Экстраполяция к бесконечному лиганда концентрацию". Скопируйте эту формулу для остальных ячеек в этом столбце.
Примечание: Этот расчет удаляет эффект несвязанного белка в самой высокой концентрации лиганда. Разница между лигандом свободного белка и самой высокой концентрации лиганда, умножается на обратной пропорции, связанного при самой высокой концентрации лиганда, чтобы обеспечить достаточное различие между полностью связанных и несвязанных белков состояний в каждой точке температуры. Эта разница добавляется или вычитается из несвязанного состояния с получением ожидаемого флуоресценции для полностью лиганда, связанного белка. - Замените колонку для максимальной концентрации лиганда в данные SPSS с этой новой колонке, и повторить установку данных.
ПРИМЕЧАНИЕ: шаги 5.7 - 5.9, возможно, придется повторить, если модель предполагает дальнейшее значительное изменение в соотношении связанного при максимальных лигандов Концентрац(если это так, то это, вероятно, будет идеальным повторить эксперимент с более высокой точки концентрации лиганда в комплекте). - В случаях, когда белок показывает кооперативную поведение двоичного сдвига и отображает, уравнение предложил в шаге 5,5 должны быть заменены с теми, с шага 4.1. "Топ" и "низ" параметры должны быть заменены 1 и 0 соответственно.
- Повторите эксперимент, по крайней мере в два раза (см шаг 2,12), чтобы обеспечить воспроизводимость.
Результаты
Отличный тест субстратом для этого метода является гексокиназа. Это имеет преимущества быть легко в продаже, и с двух подложек, которые находятся в большинстве лабораторий, и которые обеспечивают четкие, воспроизводимые результаты в тесте. Начальный экран концентрации (Протокол 1), с помощью гексокиназу и глюкозу (Фиг.2А), предполагает, что, вероятно, K D будет находиться в диапазоне от 0,2 до 1,7 мм. Таким образом, больший экран (Протокол 2) проводили, используя концентраци х, показанных в таблице 4 результаты (Фигура 2В) показывают хорошую подгонку к одной лиганда сайт связывания уравнения (Протокол раздел 3.3) [9], и дали К д 1,2 ± 0,1 мм.
Предполагаемый heptose-гуанил трансферазы WCBM 19,20 показывает сильную термическую сдвиг на связывание с ГТФ (Рисунок 3А). Начальный экран предположил, что KD будет в диапазоне от около 100 мкм. Поэтому полный экран был создан, с использованием концентраций, указанных в таблице 5 Место результатов для уравнения 3,3 показали разумное посадку (R 2 из 0,981; Рисунок 3B). .however, Существует очевидная разница между данными и Модель, предполагая, что разные уравнение необходимости. Поиск белка банке данных 21 с последовательностью WCBM показал, что ближайшими гомологов, для которых структуры были определены формы димеров. Данные были поэтому анализируются с помощью трех уравнений для кооператива, последовательный, и независимый связывания двух лигандов (протокол4). Установочные статистика для кооперативной модели дал значение R 2 0,998 и стандартное отклонение остатков (Sy.x) от 0,215, в то время как оба последовательные и независимые обязательные модели дал значение R 2 из 0,992 и Sy.x из 0,480 и 0,461 соответственно. Это говорит о том, что моделидавая лучшую подгонку к данным был кооператива модель: здесь, наблюдалось K ½ из 230 ± 10 мкм, с н стоимости 0,52 ± 0,02 (Рисунок 3C). Это указывает на негативное кооперативности к связывания. Обратите внимание, что K ½ была использована в данном случае, а не Уб, поскольку единицы для Уб будет скорее неудовлетворительной мкМ 0,52.
Предполагаемый ВВП-6-дезокси-β-D-манно -heptopyranose 2 O -acetylase, WcbI 22, показывает довольно необычный результат в дифференциальной сканирующей флуориметрии. В отсутствие любых лигандов, это показывает четкий и простой денатурации (фиг.4А). Коэнзим А (КоА) был идентифицирован в качестве лиганда этого белка с использованием DSF, и сродства белка для этого партнера исследовали, как описано в протоколе. В присутствии высоких концентраций КоА, сильные секhift до более высокой температуры наблюдается, с изменением температуры плавления 15 ° С. Тем не менее, в промежуточных концентраций, а не перехода к однофазной плавления при промежуточной температуре плавления, WcbI показал двухфазную плавление, с белком, чтобы расплавить появляться на любом лиганда, свободной от температуры или полностью связаны температуры плавления (фиг.4А) . Пропорции двух видов измененные в зависимости от дозы, с увеличением концентрации субстрата увеличения доли, что плавится при более высокой температуре (фиг.4В). Прямая анализ этих данных была сложной: подходящая для уравнения Больцмана дал очень плохие припадки, в то время как производные методы подчеркнул, что два события плавления происходили, но не помощь в демонстрации изменения с увеличением концентрации лиганда.
Поэтому менее традиционный подход для анализа этих данных был принят (протокол 5). Флуоресценции гРезультаты erivative без лиганда и при самой высокой концентрации лиганда были приняты как представляющие по существу, все белки в более низкой температурой плавления или более высокой температуры плавления состояние. Остальные производные данные были установлены в каждой точке в виде суммы пропорции каждого из этих двух состояний, при этом доля подведены к единице (фиг.4С). Полученные данные затем были установлены, как и раньше, чтобы получить кажущуюся Уб, используя те же самые уравнения, как и раньше. Это отмечено, что "высокий" лиганд точка, вероятно, будет только 95% лиганд, связанный. Затем данные были экстраполированы на предсказание результата для 100% связанного белка в, и данные фитинг повторяли с получением кажущуюся Уб из 58 ± 2 мкм. Это дало отличную посадку экспериментальных результатов со связывающей модели (Рисунок 4D).
FO: контент-ширина = "5 дюймов" SRC = "/ файлы / ftp_upload / 51809 / 51809fig1highres.jpg" ширина = "500" />
Рисунок 1.Примеры эксперимента по настройке и анализу. () Пример ожидаемого форме профиль тепловой денатурации (взята из данных для дрожжей гексокиназой). Характерная форма исходных данных показывает прогрессивный рост флуоресценции до максимума, а затем мелкой снижения (более подробно обсуждается в 9). Это сопровождается одного пика в первой производной флюоресценции. (B), Пример ввода данных в GraphPad. Концентрация лиганда дается на оси Х, и наблюдается температуры плавления на Y-оси. (C) Пример определения уравнения в Graphpad. (D) Примеры правильной настройке начальные значения переменных, и фиксации концентрации белка, для того, чтобы правильно определить константы диссоциации.м / файлы / ftp_upload / 51809 / 51809fig1highres.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
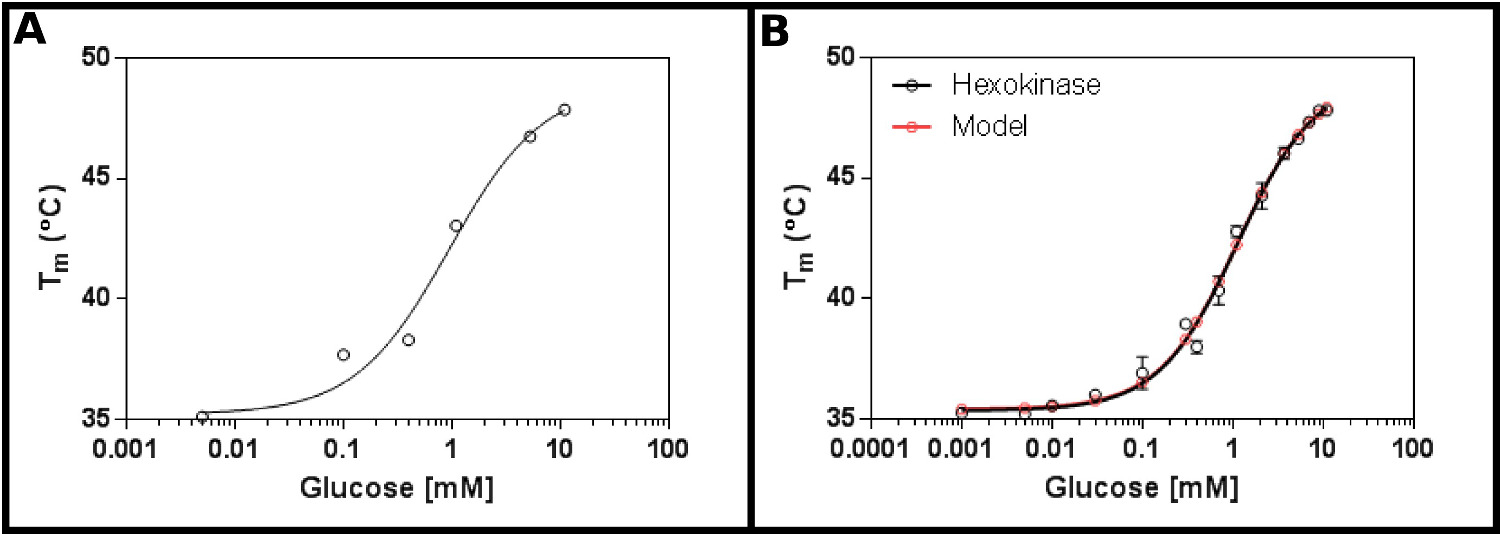
. Рисунок 2 Взаимодействие гексокиназы с глюкозой, измеренной с помощью дифференциальной сканирующей флуориметрии (А) Первоначальный эксперимент тестирования широкого спектра концентраций глюкозы показывает, что K D, вероятно, будет в диапазоне от 0,2 -. 1,7 мм (В) подробное Эксперимент, испытания 16 концентрации глюкозы, позволяет определить кажущуюся Уб как 1,12 ± 0,05 мм. Данные подходит очень хорошо для модели для одного события связывания (с нижней (Т1) и верхней (T2) температуры фитинга к 35,4 ± 0,2 ° С и 49,3 ± 0,5 ° С соответственно). Обратите внимание, чтоЭти данные были собраны в присутствии 10 мМ MgCl 2. Эти изображения были получены с использованием GraphPad. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
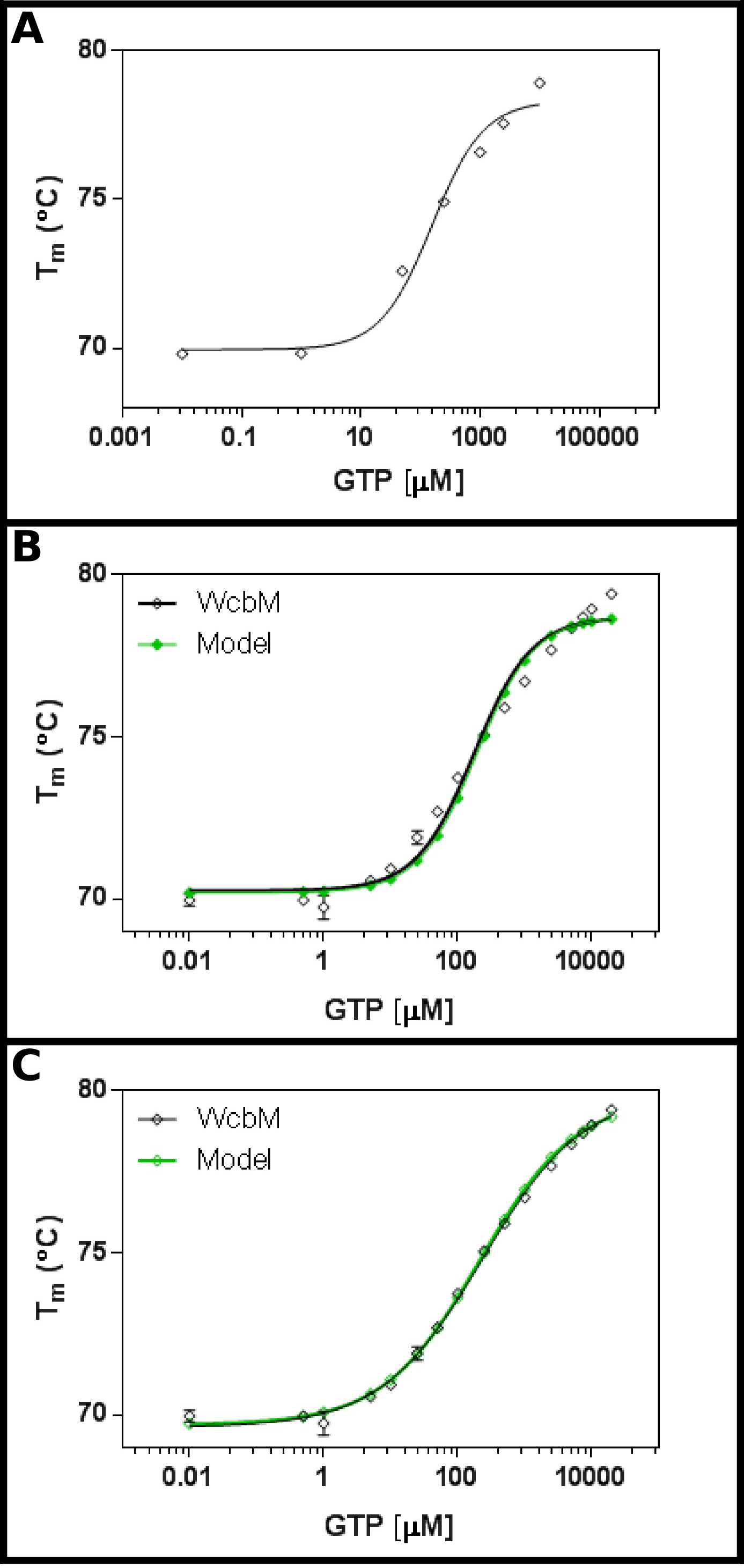
Рисунок 3 Взаимодействие WCBM с ГТФ показывает анти-кооперативного связывания. (А) Первоначальный эксперимент тестирования широкий диапазон концентраций ГТФ предполагает, что Уб, вероятно, будет в диапазоне от 200 -. 500 мкм (B) Подробное эксперимент, тестирование 16 концентрации ГТФ, предлагает значение для кажущаяся К г из 120 ± 20 мкм. Однако, когда логарифмической шкале используется для оси х, существует значительный discrePancy между моделью и данными. (C) Анализ и тех же данных с кооперативной модели показывает отличную посадку к данным, где используется простая кооператив модель. Здесь K ½ из 230 ± 20 мкм определяли, с коэффициентом кооперативности н = 0,52 ± 0,02 (с нижней (Т1) и верхней (T2) температуры фитинга до 69,63 ± 0,06 ° С и 79,9 ± 0,1 ° С соответственно). Как видно WCBM быть димерный, это означает, что фермент совершенно anticooperative в его связывания с GTP. Эти изображения были получены с использованием GraphPad. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
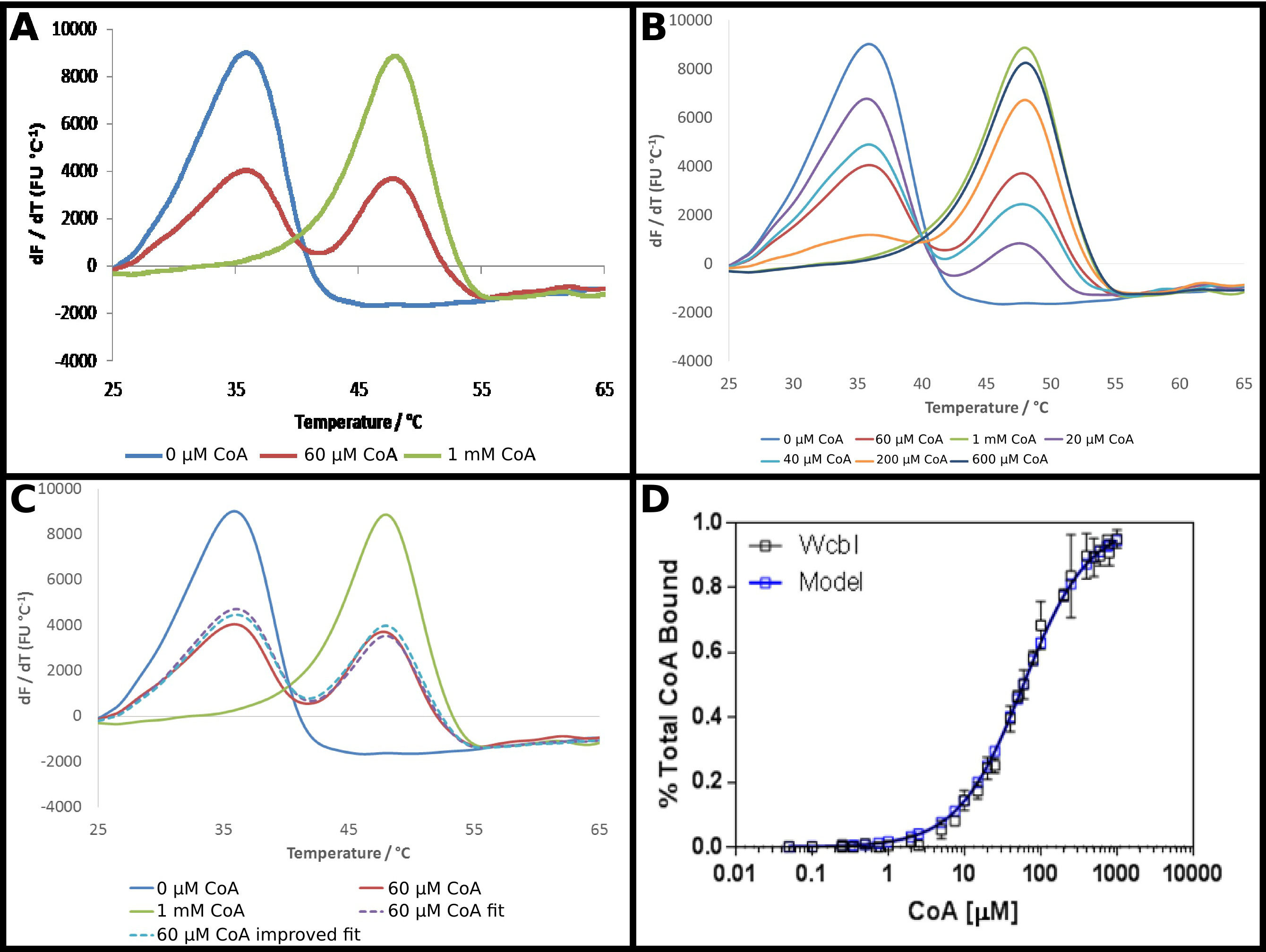
Рисунок 4 WcbI показывает двухфазный характер плавленияв присутствии лиганда его кофермента А (КоА). (А) WcbI, в отсутствие лиганда (синий), показан простой монофазный образец плавления. При высоких концентрациях лигандов (1 мм; зеленая линия), аналогичная картина наблюдается. Тем не менее, в промежуточных концентраций лигандов. (60 мкМ; красная линия), два различных пиков плавления, соответствующий лиганд-свободными и лиганд-связанных состояний наблюдается (В) Переход между двумя наборами пиков зависит от дозы по всей Диапазон концентраций. (С) Моделирование двухфазного плавления в виде суммы пропорции свободных лигандов и лигандов высоких результатов дает хорошую подгонку к данным (пунктирная линия фиолетовый, по сравнению с красной линии). Это подходит улучшается путем экстраполяции результат наблюдается для высокой концентрации лиганда (где модель предполагает ~ 95% заполняемости) к полной занятости (пунктирная синяя линия). (D) полученного на долю WcbI связанного с КоА шо данных WS отлично подходит для простого связывания модели, с K D 58 ± 2 мкм (эти данные представляют собой данные, собранные на двух отдельных дней, со слегка различными концентрациями лигандов, выбранных на второй день на основе первого набора результатов). Панели. (- C) были получены с использованием Excel и панели (D) с использованием Graphpad Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Таблица 1 Рецепт для начальных экспериментов.
| Реагент | Объем в смеси (мкл) |
| Белок | До конечной концентрации 0,11 мг / мл |
| 0.3 | |
| 0,5 М HEPES рН 7,0 | 3.7 |
| 5 М NaCl | 5.6 |
| Вода | Для 180 мкл |
Это описывает "мастер смеси" белка, реагента для детекции и буфер на первоначальный эксперимента разведку, чтобы обеспечить оценку Уб, как описано в разделе протокола 1 Этот буфер смесь которая подходит для общих белков. Где предыдущие результаты позволяют предположить, другие буферы должны использоваться, они должны быть заменены. Если белок запас при низкой концентрации (то есть, менее 0,3 мг / мл), это может быть необходимо, чтобы уменьшить количество дополнительного буфера добавили для компенсации буфера, уже присутствующего в образце белка.
Таблица 2 Рецепт для определения Уб.| Реагент | Объем в смеси (мкл) |
| Белок | До конечной концентрации 0,11 мг / мл |
| 5,000X SYPRO Оранжевый | 1.78 |
| 0,5 М HEPES рН 7,0 | 22.2 |
| 5 М NaCl | 33.3 |
| Вода | Для 180 мкл |
Это описывает "мастер смеси" белка, реагента для детекции и бuffer для полного определения Уб для образца белка, как описано в разделе протокола 2 Этот буфер смесь подходит для общих белков. Где предыдущие результаты позволяют предположить, другие буферы должны использоваться, они должны быть заменены. Если белок запас при низкой концентрации (то есть, менее 0,3 мг / мл), это может быть необходимо, чтобы уменьшить количество дополнительного буфера добавили для компенсации буфера, уже присутствующего в образце белка.
Таблица 3 уравнения и параметры для анализа данных.
д| Шаг в протоколе | Требуется Уравнение | Обязательные параметры | Описание переменных и параметров |
| 3.3 | |||
| Одноместный сайт связывания лиганда | Y = Bottom + ((верх-низ) * (1 - ((PK д -X + SQRT (((P + X + K г) ^ 2) - (4 * Р * Х))) / (2 * P )))) | Р: концентрация белка. Кд: константа диссоциации. Р и Kd приведены в тех же единицах, которые были использованы для концентраций лиганда. Сверху, снизу: температура плавления при бесконечной концентрации лиганда и не лиганда концентрации соответственно. | |
| 3.4 | Нижняя = * Ymin | Ymin: Минимальное значение Y (низкая экспериментальная белка Tm, в данном случае) | |
| Топ = * YMAX | YMAX: Максимальное значение Y (высокая экспериментальная белок Tm) | ||
| К д = * X в YMID | YMID: значение Y, что соответствует среднему Ymin и YMAX. Х представляет собой соответствующий Х значение (здесь, соответствующее концентрации лиганда) | ||
| P = (Начальное значение, чтобы быть в хорошей форме) | |||
| 4.1 | |||
| Простой кооператив модель | Y = Bottom + ((верх-низ) * (((X / Кд) ^ п) / (1 + ((X / Кд) ^ п)))) | н: Hплохо коэффициент. Это описывает кооперативности или другие биохимические свойства, белка, и не обязательно оценка числа связывания лиганда сайтов в белке. Коэффициент Хилла одного не представляет кооперативности; значения ниже, чем одной указывают отрицательное кооперативности, и ценит больше, чем один положительный кооперативности. | |
| Нижняя = * Ymin | |||
| Топ = * YMAX | |||
| К д = * X в YMID | |||
| P = (Начальное значение, чтобы быть в хорошей форме ) | |||
| п = (Начальное значение, чтобы быть в хорошей форме) | |||
| Последовательное связывание двух лигандов | Y = Bottom + ((верх-низ) * ((X ^ 2) / (К д * K2)) / (1 + (Х / К д) + ((X ^ 2) / (К д * K2))) ) | K2: константа диссоциации второго связывающего события. | |
| Нижняя = * Ymin | |||
| Топ = * YMAX | |||
| К2 = * X в YMID | |||
| P = (Начальное значение, чтобы быть в хорошей форме) | |||
| Независимый связывания двух лигандов | Y = Bottom + ((верх-низ) * ((X ^ 2) / (К д * K2)) / (1 + (2 * X / K г) + ((X ^ 2) / (К д * K2) ))) | ||
| Нижняя = * Ymin | |||
| К д = * X в YMID | |||
| К2 = * X в YMID | |||
| P = (Начальное значение, чтобы быть в хорошей форме) | |||
| 5.5 | |||
| Анализ двоичных сдвигов в температуре плавления | Y = 1 - ((PK д -X + SQRT (((P + X + K г) ^ 2) - (4 * Р * Х))) / (2 * P)) | ||
| Нижняя = * Ymin | |||
| Топ = * YMAX | |||
| К д = * X в YMID | |||
| P = (Начальное значение, чтобы быть в хорошей форме) | |||
| 5.8 | |||
| Экстраполяция к бесконечной концентрации лиганда | (C2 - ((1-$ R $ 2) * B2)) / $ R $ 2 | B2: клетка, содержащая результат с не лиганда. C2: клетка, содержащая результат с максимальной лиганда. $ R $ 2: клетка, содержащая долю связанного с максимальной концентрации лиганда. |
Шаги 3, 4 и 5 требуют добавления подробных уравнений в программное обеспечение анализа и точное определение начиная параметры для анализа данных. Уравнения для каждого соответствующего шага показаны, с правильными выборов параметров. Объяснение смысла переменных и параметров для справки.
Таблица 4 Концентрации для скрининга взаимодействия гексокиназой с глюкозой.
| Точка Образец | Лиганда (glucosе) Концентрация (мМ) |
| 1 | 0 |
| 2 | 0.001 |
| 3 | 0.005 |
| 4 | 0.01 |
| 5 | 0.03 |
| 6 | 0.1 |
| 7 | 0.3 |
| 8 | 0.4 |
| 9 | 0.7 |
| 10 | 1.1 |
| 11 | 2.1 |
| 12 | 3.7 |
| 13 | 5.3 |
| 14 | 7 |
| 15 | 9 |
| 16 | 11 |
Гексокиназа от начинающего дрожжей Saccharomyces CEREVISIAE был добавлен в мастер-смеси, как описано в протоколе, с добавлением 10 мМ MgCl 2, как магний является известным кофактора. Первоначальная оценка Уб был между 0,5 и 2 мМ. Эксперименты были созданы, чтобы обеспечить указанных конечных концентрациях глюкозы.
Таблица 5. Концентрации для скрининга взаимодействия WCBM с ВВП.
| Точка Образец | Лиганд (ГТФ) Концентрация (мкМ) |
| 1 | 0 |
| 2 | 0.5 |
| 3 | 1 |
| 4 | 5 |
| 5 | 10 |
| 6 | 25 |
| 7 | 50 |
| 8 | 100 |
| 9 | 250 |
| 10 | |
| 11 | 1000 |
| 12 | 2500 |
| 13 | 5000 |
| 14 | 7500 |
| 15 | 10000 |
| 16 | 20000 |
WCBM от Burkholderia pseudomallei был добавлен в мастер-микс, как описано в протоколе. Первоначальная оценка Уб было около 100 мкм. Эксперименты были созданы, чтобы обеспечить указанные конечные концентрации ГТФ, с целью охватить как минимум на два порядка выше и ниже Уб.
Обсуждение
Дифференциальная сканирующая флуориметрия продемонстрировала свою силу в качестве надежной и универсальной метода для характеристики белков, и выявления потенциальных лигандов белка. Хорошо задокументированные успехи в ускорении стабилизации белка, лекарств (особенно в менее финансируемых лабораторий) и кристаллизация 10,23-25 сделали его привлекательным методом для начального скрининга соединений. Соединения, добавленные к белкам показывают четкое зависимое от дозы увеличение кажущейся температурой плавления 7,9. Тем не менее, не было сделано попытки использовать результаты этих экспериментов, чтобы определить, кажущиеся константы связывания, чтобы помочь в рейтинге соединений на их сродство. Здесь мы представляем метод для определения систематически кажущуюся константу диссоциации белков в присутствии лиганда.
Представленные здесь результаты показывают, что DSF могут быстро и решительно дают оценки константы диссоциации дляСочетание белок-лиганд. Наблюдаемые данные можно манипулировать с коммерчески доступных инструментов, чтобы обеспечить быстрое определение Уб, без необходимости делать предположения относительно вероятной стоимости параметров. Этот метод имеет существенное преимущество по сравнению с сопоставимыми некоторых методов быть экономной в белка и времени, необходимого. Эксперимент, описанный здесь будет потреблять 0,13 мг белка на эксперименте (приблизительно 0,4 мг для экспериментов повторяются в трех экземплярах). Это выгодно отличает изотермический титрования калориметрии (ITC), где один эксперимент со средним 40 кДа белка будет потреблять такое же количество. Полный набор экспериментов, необходимых для этого протокола будет потреблять около 4 ч, в том числе подготовки, для одного набора экспериментов. Опять же, это, вероятно, будет значительно быстрее, чем методы, такие как ITC или поверхностного плазмонного резонанса, который, пока мощная часто требуют существенной оптимизации для достижения наилучших данных.
Наши результаты показывают, что остается требование, чтобы внимательно изучить исходные данные, пригодный этих данных для определения температуры плавления, и подходят данных температуры плавления, чтобы определить константу диссоциации. Первая задача заключается в форме исходных данных, полученных при плавлении белка. В некоторых случаях, форма не может приблизиться к тому, что наблюдалось на фиг.1А. Общие вопросы включают низкие сдвиги температуры на связывание лиганда, высокий фоновой флуоресценции и необычные множественные переходы температуры. Низкие сдвиги температуры наблюдаются на связывание ряд лигандов. Для этого метода, наиболее важным параметром является ошибка в измерении Т м, по сравнению со сдвигом температуры. Данные могут быть установлены, как правило, достаточно хорошо, когда стандартное отклонение трех измерений не превышает 10% от температуры плавления сдвигом между несвязанного и полностью связанного белка. Наш опыт показывает, что там, где такие температурыратуре сдвиги только 2 ° С, это может быть достаточным для подгонки данных, если отдельные точки данных с высокой точностью. Второй вопрос заключается в необычной формы кривых. Они часто отличаются от свободного белка и лиганда, связанного форм, как связывания лиганда влияет на раскрытие режимы белка. В этих случаях, пользователь должен рассмотреть вопрос о том, что данные могут быть использованы с соответствующим учетом моделей, которые будут использоваться для определения температуры плавления и константу диссоциации. Еще одна распространенная проблема в том, что добавление кофактора к белку (например, MgCl 2 в нашем примере с гексокиназой) требуется для получения наиболее достоверных данных. Наш опыт показывает, что тщательное рассмотрение всех вероятных факторов в эксперименте на стадии принятия начальные показания необходимо получение наилучших результатов. Кроме того, альтернативные теоретические методы лечения могут выявить особенности этих данных 15,17. Наконец, это не редкость для некоторых белков, которые сontain изначально подвергается гидрофобные участки, чтобы показать высокий фоновой флуоресценции. Есть ряд решений этих проблем, которые были широко отзывы других 6,9.
В частности, пользователь должен рассмотреть вопрос о том, чтобы использовать Больцмана или его производные модели (например, фиг.4), и в случае использования производных, независимо от того, должны быть смоделированы несколько расплавов. Эти два метода моделирования тепловой разворачивается отличаются тем, что метод Больцмана подходит экспериментальные данные для уравнения Больцмана, предполагая регулярное сигмоидального форму к разворачивающейся кривой. В отличие от этого, производное метод принимает первую производную экспериментальных данных в каждой точке (нижняя панель на фиг.1А), и считает температуру плавления, чтобы быть самой высокой точкой первой производной. Производное метод возвращает как правило, более высокую температуру плавления примерно на 2 - 3 ° С. Большинство белков вернется более последовательнымРезультат (то есть, стандартная ошибка температуры плавления для тройных опытах ниже) для одного из двух методов. Это, как правило, тесно связаны с точной формы разворачивания белка кривую, и надо эмпирически определить наилучший метод в каждом конкретном случае. Там, где используется производная модель, важно также рассмотреть несколько событий плавления. Некоторые данные ясно показывают доказательства для нескольких переходов, и в этих случаях результаты, скорее всего, будет легче определить, если эти несколько событий плавления моделируются. В контексте этого протокола, то это часто бывает, что добавление лиганда может вызвать белок перейти от наличия нескольких переходов плавления к одному перехода (например, путем стабилизации наиболее термически хрупкий субдомен), или наоборот. Поэтому мы бы посоветовали, что исходные данные рассматриваются вместе, прежде чем рассматривать, какой подход будет лучше всего использовать.
После мodelling отдельных температур плавления, дальнейшие проблемы могут возникнуть в связи с настройкой их на модели, представленные в разделе протокола. Крайне важно, чтобы внимательно изучить подгонку к константы диссоциации уравнения, используя логарифмическую шкалу, как этот анализ часто подчеркивает расхождения между данными наблюдений и модели (е .g., Рисунок 3). Хотя полученные результаты, как правило, надежные, уход в интерпретации дает возможность извлекать лучшие результаты, а самое значение, в соответствии с данными.
Особым вопросом поднят этих данных является интерпретация, что должен быть сделан на белки, которые показывают кооперативности или нескольких обязательных мероприятий, в DSF. Мы, на сегодняшний день, только наблюдали это явление в белках, которые, как ожидается, несколько специфических связывающих события (например, WCBM, белок, лучше гомолог является мультимер 26, и который выступает в качестве мультимера на гель-фильтрации [данных неПоказано]). Это не совсем понятно, что отрицательный кооперативности наблюдается в DSF денатурации указывает на то, что фермент будет в конечном счете, показывают отрицательную кооперативность: а, это может быть показателем комплекс связывания, которые должны быть изучены более детально с использованием широкого спектра методов. Это позволяет предположить, к нам, однако, что более обширные исследования таких белков, вероятно, определить интересные эффекты.
Значения, приведенные для константы диссоциации, используя этот метод, как правило, из того же порядка, предоставленные другими методами, такими как изотермический титрования калориметрии и поверхностного плазмонного резонанса. Тем не менее, абсолютные значения, наблюдаемые часто выше, чем наблюдаемые с помощью этих методов. Это, по меньшей мере, частично является следствием того факта, что константа диссоциации наблюдается при температуре плавления белка с лигандом. Это Уб как правило, выше, чем при физиологических температурах. DissociatioN константа в зависимости от температуры реакции с помощью уравнений:
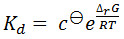 [1]
[1]
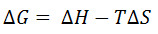 [2]
[2]
(Где с θ является стандартной ссылкой концентрация, Δ г G является Гиббс изменение свободной энергии реакции, R является газовая постоянная, Δ H является изменение энтальпии в реакции, и Δ S является изменение энтропии в реакции .)
Реакции с константы диссоциации в измеряемого диапазона этого метода, как правило, имеют отрицательный Δ R G, и поэтому эффект увеличения температуры на уравнения [1] будет увеличить константу диссоциации. Оба Δ H и Δ S термины, которые составляют свободную энергию Гиббса (уравнение [2]) являются TEMPERATURе зависит 27, и эффект от константы диссоциации будет зависеть от величины и знака этих температурных зависимостей, и обязательно будет зависеть взаимодействие. Следовательно, это не является неожиданным, что константы диссоциации, определенные с помощью этого метода, иногда больше, чем те, которые определены с помощью методов, которые работают при комнатной температуре. Температурная зависимость, конечно, также предостережение многих других методов, которые, как правило, чтобы обеспечить константу диссоциации при температурах более низких, чем физиологической температуре.
Другой предостережение метода DSF является то, что меченый метод, в отличие от ITC. Флуоресцентной метки использовали (SYPRO оранжевый) является гидрофобным, и поэтому в некоторых случаях может конкурировать со связыванием гидрофобных лигандов с белками. Следовательно, вполне вероятно, что в некоторых случаях, константа диссоциации получены будет поднят искусственно вследствие конкуренции с меткой. Однако, для сравнения различных лигандов, (основное применениеDSF), различия вряд ли достаточно значимы, чтобы влиять на ранжирование соединений близостью.
Потенциальным недостатком этого способа является пределом обнаружения, что может быть достигнуто. В принципе, это не должно быть возможным точно измерить значение K D, которая ниже, чем 50% от концентрации белка, и даже значения в этом диапазоне может быть сомнительной точности. В то время как предел обнаружения на этом конце диапазона может быть продлен немного за счет снижения концентрации белка и красителя, чувствительность прибора позволит предотвратить дальнейшее снижение концентрации белка. Кроме того, верхний конец чувствительности будет определяться растворимости лиганда. Для получения математически надежную оценку для K D, очень важно, чтобы получить данные с 90% белка, присутствующего в лиганд-связанной форме, которая требует концентрации лиганда с приблизительнолы в десять раз Уб (при условии отсутствия кооперативности). Предел обнаружения будет поэтому обязательно одна десятая растворимости лиганда в соответствующем буфере. Это означает, что пределы обнаружения метода, как правило, в диапазоне от 1 мкм и от 1 до 100 мм, в зависимости от белка и лиганда.
В заключение, дифференциальная сканирующая флуориметрия является универсальным метод применим к широкому диапазону белков. Используя методы, представленные здесь, можно быстро и недорого определить сродство белка при различных лигандов. Это имеет большой потенциал для применения в очистке белков и стабилизации, выяснения функции или специфичности ферментов из метагеномов, и в разработке лекарств, особенно в небольших лабораториях.
Раскрытие информации
The authors declare that they have nothing to disclose.
Благодарности
This work was funded by grant from the BBSRC (grant number BB/H019685/1 and BB/E527663/1) to the University of Exeter.
Материалы
| Name | Company | Catalog Number | Comments |
| StepOne real time PCR instrument | Life Technologies | 4376357 | DSF can be performed with many other instruments. The StepOne instrument has very convenient software for data analysis. |
| Protein thermal shift software v1.0 | Life Technologies | 4466037 | |
| MicroAmp Fast optical 48-well plates | Life Technologies | 4375816 | |
| Optical sealing tape | Life Technologies | 4375323 | Bio-rad part no. 223-9444 is an alternative supplier |
| U-bottomed 96-well plates | Fisher | 11521943 | |
| SYPRO Orange | Life Technologies | S6650 | For a smaller volume supplier, use Sigma part no. S5692 |
| SPSS statistics version 20 | IBM | Other statistics packages will provide similar functionality | |
| GraphPad Prism 6.02 | GraphPad | Other statistics packages will provide similar functionality | |
| Hand applicator (PA1) | 3M | 75-3454-4264-6 | |
| Hexokinase from Saccharomyces cerevisiae | Sigma-Aldrich | H5000 | |
| Glucose | Fisher scientific | 10141520 |
Ссылки
- Freyer, M. W., Lewis, E. A. Isothermal titration calorimetry: experimental design, data analysis, and probing macromolecule/ligand binding and kinetic interactions. Methods Cell Biol. 84, 79-113 (2008).
- Ladbury, J. E. Calorimetry as a tool for understanding biomolecular interactions and an aid to drug design. Biochem Soc Trans. 38, 888-893 (2010).
- Abdiche, Y., Malashock, D., Pinkerton, A., Pons, J. Determining kinetics and affinities of protein interactions using a parallel real-time label-free biosensor, the Octet. Anal Biochem. 377, 209-217 (2008).
- Pantoliano, M. W., et al. High-density miniaturized thermal shift assays as a general strategy for drug discovery. J Biomol Screen. 6, 429-440 (2001).
- Senisterra, G., Chau, I., Vedadi, M. Thermal denaturation assays in chemical biology. Assay Drug Dev Technol. 10, 128-136 (2012).
- Ericsson, U. B., Hallberg, B. M., Detitta, G. T., Dekker, N., Nordlund, P. Thermofluor-based high-throughput stability optimization of proteins for structural studies. Anal Biochem. 357, 289-298 (2006).
- Lo, M. C., et al. Evaluation of fluorescence-based thermal shift assays for hit identification in drug discovery. Anal Biochem. 332, 153-159 (2004).
- Nettleship, J. E., Brown, J., Groves, M. R., Geerlof, A. Methods for protein characterization by mass spectrometry, thermal shift (ThermoFluor) assay, and multiangle or static light scattering. Methods Mol Biol. 426, 299-318 (2008).
- Niesen, F. H., Berglund, H., Vedadi, M. The use of differential scanning fluorimetry to detect ligand interactions that promote protein stability. Nat Protoc. 2, 2212-2221 (2007).
- Geders, T. W., Gustafson, K., Finzel, B. C. Use of differential scanning fluorimetry to optimize the purification and crystallization of PLP-dependent enzymes. Acta Crystallogr Sect F Struct Biol Cryst Commun. 68, 596-600 (2012).
- Vedadi, M., et al. Chemical screening methods to identify ligands that promote protein stability, protein crystallization, and structure determination. Proc Natl Acad Sci USA. 103, 15835-15840 (2006).
- Davis, B. J., Erlanson, D. A. Learning from our mistakes: the 'unknown knowns' in fragment screening. Bioorg Med Chem Lett. 23, 2844-2852 (2013).
- Larsson, A., Jansson, A., Aberg, A., Nordlund, P. Efficiency of hit generation and structural characterization in fragment-based ligand discovery. Curr Opin Chem Biol. 15, 482-488 (2011).
- Scott, D. E., et al. Using a fragment-based approach to target protein-protein interactions. Chembiochem. 14, 332-342 (2013).
- Cimmperman, P., et al. A quantitative model of thermal stabilization and destabilization of proteins by ligands. Biophys. J. 95, 3222-3231 (2008).
- Matulis, D., Kranz, J. K., Salemme, F. R., Todd, M. J. Thermodynamic stability of carbonic anhydrase: measurements of binding affinity and stoichiometry using ThermoFluor. Biochemistry. 44, 5258-5266 (2005).
- Zubriene, A., et al. Measurement of nanomolar dissociation constants by titration calorimetry and thermal shift assay - radicicol binding to Hsp90 and ethoxzolamide binding to CAII. Int J Mol Sci. 10, 2662-2680 (2009).
- Weiss, J. N. The Hill equation revisited: uses and misuses. FASEB J. 11, 835-841 (1997).
- Cuccui, J., et al. Characterization of the Burkholderia pseudomallei K96243 capsular polysaccharide I coding region. Infect Immun. 80, 1209-1221 (2012).
- DeShazer, D., Waag, D. M., Fritz, D. L., Woods, D. E. Identification of a Burkholderia mallei polysaccharide gene cluster by subtractive hybridization and demonstration that the encoded capsule is an essential virulence determinant. Microb Pathog. 30, 253-269 (2001).
- Berman, H., Henrick, K., Nakamura, H. Announcing the worldwide Protein Data Bank. Nat Struct Biol. 10, 980 (2003).
- Vivoli, M., Ayres, E., Beaumont, E., Isupov, M., Harmer, N. Structural insights into WcbI, a novel polysaccharide biosynthesis enzyme. IUCr Journal. 1 (1), 28-38 (2014).
- Sorrell, F. J., Greenwood, G. K., Birchall, K., Chen, B. Development of a differential scanning fluorimetry based high throughput screening assay for the discovery of affinity binders against an anthrax protein. J Pharm Biomed Anal. 52, 802-808 (2010).
- Uniewicz, K. A., et al. Differential scanning fluorimetry measurement of protein stability changes upon binding to glycosaminoglycans: a screening test for binding specificity. Anal Chem. 82, 3796-3802 (2010).
- Wan, K. F., et al. Differential scanning fluorimetry as secondary screening platform for small molecule inhibitors of Bcl-XL. Cell Cycle. 8, 3943-3952 (2009).
- Koropatkin, N. M., Holden, H. M. Molecular structure of alpha-D-glucose-1-phosphate cytidylyltransferase from Salmonella typhi. J Biol Chem. 279, 44023-44029 (2004).
- Paleskava, A., Konevega, A. L., Rodnina, M. V. Thermodynamics of the GTP-GDP-operated conformational switch of selenocysteine-specific translation factor SelB. J Biol Chem. 287, 27906-27912 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены