A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיקום כירורגי של קטטרים לטווח ארוך בדיקת תרגיל לב וכלי דם ב חזירים
In This Article
Summary
Here we present a protocol to assess cardiopulmonary function in awake swine, at rest and during graded treadmill exercise. Chronic instrumentation allows for repeated hemodynamic measurements uninfluenced by cardiodepressive anesthetic agents.
Abstract
פרוטוקול זה מתאר את ההליך כירורגי כדי חזירי מכשיר כרוניים ההליך לממש חזירים על הליכון מונע במנוע. תפקוד לב-ריאה מוקדם קשה לאבחן, במיוחד במודלים של בעלי חיים, כמו פונקצית לב-ריאה לעתים קרובות נמדדת פולשני, בהרדמה. כסוכני הרדמה רבים הם cardiodepressive, שינויים קלים בתפקוד לב וכלי דם עשויים להיות רעול פנים. לעומת זאת, מכשור כרוני מאפשר למדידת תפקוד לב-ריאה במדינה הערה, כך מדידות ניתן להשיג בתנאי מנוחה שקטים, ללא תופעות של הרדמת טראומה כירורגית חריפה. יתר על כן, כאשר חיות מאומנות כראוי, מדידות ניתן להשיג במהלך פעילות גופנית על הליכון מדורג.
בדיקות זרימה ממוקמות סביב האאורטה או בעורק הריאה למדידת תפוקת הלב ומסביב הקדמי העורק הכלילי השמאלי היורד למדידת קורוןזרימת דם האר"י. צנתרים מלאות נוזל מושתלים אבי העורקים, עורק הריאה, אטריום שמאל, החדר השמאלי ואת החדר הימני למדידת לחץ ובדיקות דם. בנוסף, קטטר 20 G ממוקם בתוך וריד interventricular הקדמי כדי לאפשר דגימת דם ורידים כלילית.
אחרי שבוע של התאוששות, חזירים מונחים על הליכון מונע במנוע, את הצנתרים מחוברים מטרים לחץ וזרימה, וחזירים חשופים פרוטוקול תרגיל המתקדם חמישה שלבים, כאשר בכל השלב שנמשך 3 דקות. אותות המודינמי נרשמים ברציפויות דגימות דם נלקחות במהלך 30 השניות האחרונות של כל שלב מימוש.
היתרון העיקרי של לימוד חיות מאובזרות כרוני הוא שהיא מאפשר הערכת סדרה של תפקוד לב-ריאה, לא רק במנוחה, אלא גם במהלך מאמץ פיזי כמו התעמלות. יתר על כן, פונקצית לב-ריאה ניתן להעריך שוב ושוב במהלך התפתחות מחלהnd במהלך טיפול כרוני, ובכך להגדיל כוח סטטיסטי ולכן להגביל את מספר בעלי החיים הדרושים למחקר.
Introduction
פונקצית לב-ריאה נאותה חיונית כדי לספק את הגוף עם חמצן וחומרים מזינים, במיוחד במהלך תנאי ביקוש מטבולית מוגבר כגון במהלך תרגיל 1. התגובה לב-ריאה לתרגיל מאופיין במספר עיבודים בתפקוד הלב, כלומר., עלייה בקצב הלב, נפח contractility ושבץ, ותפקוד כלי הדם, כלומר, התרחבות בערוגות וסקולרית באספקת לשרירים כמו גם ב ריאתי כלי דם, ועל vasoconstriction בערוגות וסקולרית לספק את מערכת עיכול וכן 1 שרירים פעילים. יכולת הגופנית פגומה היא סימן היכר מוקדם של תפקוד לב-ריאה, ובדיקה גופנית לב-ריאה משמשת כשיטה יעילה להתוות בין תפקוד לקוי של לב, תפקוד כלי דם ו / או תפקוד לקוי ריאתי בחולים עם קיבולת 2 תרגיל פגום. תפקוד לב-ריאה מוקדם דifficult לאבחן, במיוחד במודלים של בעלי חיים, כמו פונקצית לב-ריאה לעתים קרובות נמדדת פולשני, בהרדמה, בחומרי הרדמה רבים בעלי תכונות cardiodepressive 3.
מכשור כרוני מאפשר למדידת תפקוד לב-ריאה במדינה הערה, וכאשר החיות מותאמות באופן מלא את מידות בתנאי המעבדה ניתן להשיג בתנאי מנוחה שקטים ללא תופעות של הרדמת טראומה כירורגית חריפה. יתר על כן, כאשר חיות מאומנים כראוי, מדידות ניתן להשיג במהלך פעילות גופנית על הליכון מדורגת 4,5. באופן ספציפי יותר, עזב ותפקוד החדר הימני ניתן להעריך הקשורים זלוף שריר הלב, בעוד הסדרת הטון וזומוטוריים ב בזרימת הדם הכליליים, מערכתיות ריאתי ניתן לקבוע. שימוש צנתרים מלאים נוזלות מאפשר מדידה לחץ, כמו גם דגימות דם שנטל ללא הטלת מודעהמתח ditional על החיות. יתרון נוסף של לימוד חיות מאובזרות כרוני הוא בדיקת מאמץ לב-ריאה ניתן לחזור המאפשרות שימוש של חית כשליטה משלה, או במהלך התפתחות מחלה או במהלך טיפול כרוני, ובכך להגדיל כוח סטטיסטי ולכן להגביל את מספר בעלי החיים הנדרשים מחקר .
האנטומיה לב-ריאה של חזירים דומה לזו של בני אדם ולא מן הנמנע לגרום צורות שונות של מחל לב-ריאה, כגון סוכרת 6, אוטם שריר לב 7, יתר לחץ דם ריאתי 8,9 ואי ספיקת לב הנגרמת צעדה 10,11. יתר על כן, את הגודל של חזירים מאפשר מכשור כרוני, ובדיקות דם חוזרות ונשנות של כמות מספקת כדי לנתח לא רק גזים בדם, אלא גם לבצע מדידות neurohumoral ו / או לחפש סמנים של מחלה.
פרוטוקול זה מתאר את הניתוח משמש chronicalחזירי מכשיר ly וכן הפרוטוקול למימוש החזירים על הליכון ממונע.
Protocol
הנהלים הקשורים בנושאים בעלי חיים אושרו על ידי ועדת טיפול בבעלי חיים בבית ארסמוס המרכז הרפואי רוטרדם (NL). חזירים עם משקולות בין 6 ל 80 קילו כבר מאובזרים בהצלחה באמצעות פרוטוקול זה.
1. הסתגלות של בעלי החיים כדי טיפול אנוש
- לאחר ההגעה במתקן, לשכן את החיות solitarily אבל לאפשר להם לתקשר אחד עם השני.
- Accustomize החזירים טיפול ותחבורה אדם ממתקן חיה למעבדה ניסיונית, על ידי טיפול בבעלי חיים לפחות פעם ביום למשך שבוע.
- לאמן את החיות כראוי לניסויים פעילות גופנית על הליכון מונע במנוע ידי פעילות גופנית אותם על הליכון למשך תקופה מינימלית של שלוש פעמים לפני הניתוח.
- בעלי חיים צריכים להיות צם O / N לפני הניתוח, כדי למנוע בחילות, הקאות השאיפה פוטנציאל ובכך נוזלים בבטן.
2. הכנה לכירורגיה
- הַרגָעָה
- הכן תרופות הרגעה בתוך מזרק 10 מ"ל. Premedication מורכב tiletamine / zolazepam (5 מ"ג / ק"ג), xylazine, (2.25 מ"ג / ק"ג) ו אטרופין (1 מ"ג).
- להזריק את לשריר תרופות בשריר הטרפז עם מחט '19 G 1.5' להרדים את החזיר.
- המתן כ 10 דקות ולבדוק להרפיית שרירים ואובדן הכרה לאשר רמה מתאימה ויציבה של הרגעה.
- מניח קטטר בטיחות היקפית 20 G ב וריד אוזן העירוי לווריד הבא של הרדמה ו / או נוזלים.
- אינטובציה אוורור
- מניח את החיה על השולחן ו / או עגלה במצב שכיבה.
- פתח את הפה של חיה עם מפזר אוראלי.
- במקרה של הרפיה מספקת של הלסתות או נוכחות של בליעה רפלקסים, אשר לעכב אינטובציה, לנהל thiopental (10 מ"ג / ק"ג) לווריד דרך צנתר וריד האוזן. לחלופין, חזיר יכול להיות רעול פניםעם isoflurane להשרות הרגעה.
- השתמש לרינגוסקופ קונבנציונלי עם אור ולהב מילר לאפשר laryngoscopist כדי להציג את הגרון ישירות. אם יש laryngospasm, להחיל 2% לידוקאין אל המייתרים והגרון להפחית את ההתכווצות ולאפשר אינטובציה.
- הכנס stylet intubating לתוך הטובוס לעשות הצינור להתאים טוב יותר את האנטומיה של דרכי האוויר העליונות ולהעביר את הצינור דרך הפה בין מיתרי הקול לתוך קנה הנשימה.
- לנפח את שרוול בלון עם מזרק 10 מיליליטר כדי לעזור לאבטח אותו במקומו, כדי למנוע דליפה של גזי נשימה, וכדי להגן על דרך הנשימה מפני שאיפה אפשרית של נוזל בבטן.
- חבור את הצינור מסנן נשימה (מחליף חום ולחות) וכדי ההנשמה המכאנית.
- מניחים את חיה על צידו הימני על שולחן הניתוחים.
- כדי להשיג רמות PO2 של 100-120 מ"מ כספית, לאוורר את חיה עם תערובת של חמצן וחנקן (1: 2 V / V), using גדרות ההנשמה הבאה: המצב לשלוט בלחץ: לחץ קצה נשיפה חיובי (PEEP) 4 CMH 2 O; לחץ inspiratory שיא 16 - 18 CMH 2 O; נשימה תדירות בהתאם לגודל של החיה (עבור חיית 20 ק"ג, להקטין את התדירות עם משקל גוף גדל והולך) זה אמור לגרום נפח גאות של ~ 10 מ"ל / ק"ג, לפקח אוורור עם capnography.
- צג הטמפרטורה באמצעות מד חום רקטלי ולשמור הטמפרטורה בין 37 - 39 מעלות צלזיוס באמצעות מנורת חום או מחצלת חום. יתר על כן, לעקוב אחר קצב הלב עם electrocardiography.
- הַרדָמָה
- להשרות ולשמור הרדמה רצוי על ידי הוספת 2.0% של isoflurane (v / v) לגז-תערובת אוורור או לחילופין על ידי עירוי לוריד של פנטניל (10 מיקרוגרם / ק"ג / שעה) באמצעות קטטר וריד האוזן.
- בדוק עומק נאותה של הרדמה על ידי בדיקות רפלקסים הכאב עם קמצוץ הבוהן ברגלו האחורית לפני תחילת הניתוח. כאשר יש צורך, מוסיפיםהרדמה נוספת או להמתין כמה דקות. בדוק רפלקסים הכאב באופן קבוע לאורך כל הניתוח.
- נוזלים ואנטיביוטיקה
- לנהל את המנה הראשונה של אמוקסיצילין (25 מ"ג / ק"ג) לווריד דרך צנתר וריד האוזן.
- חבר מערכת עירוי כדי קטטר וריד האוזן לאפשר עירוי איטי של גלוקוז 10% (500 מ"ל) במהלך הניתוח.
- עיקור של אתר כירורגי
- לגלח ולנקות את העור של החיה על פני שטח של כ 25 ס"מ רוחב מעמוד השדרה כל הדרך עד לבית השחי השמאלי.
- שפשפו את העור בלחות עם לשפשף povidone-יוד (75 מ"ג / מ"ל) במשך כ 5 דקות.
- הסר את הסבון povidone- יוד מהעור עם gauzes סטרילי רטוב, לפני חיטוי העור עם קרם povidone-יוד (100 מ"ג / מ"ל).
- כסה את בעל חיים עם וילאות כירורגי סטרילי כדי להפחית העברת חיידקים וזיהום הבא של אתר כירורגית.
3. כירורגיה
- פתיחת בית החזה (פתיחת בית החזה)
- עושים חתך בעור, החל מיום 1 ס"מ הזנב לזווית השמאלית התחתונה של עצם השכמה למטה כדי השחי שמאלה (איור 1). השתמש דיאתרמיה כדי לצרוב כלי דם בעור כדי למנוע דימום יתר.
- חותך את שריר serratus ו שריר החזה הגדול, באמצעות שיטת החיתוך של דיאתרמיה. כמו כן להשתמש דיאתרמיה כדי לצרוב כלי דם בתוך שכבת השריר כדי למנוע דימום יתר.
- השתמש דיסקציה קהה לחלק את שריר צלעי בקפידה של מרחב צלעי שמאל הרביעי עם מלחציים יתוש. עכשיו שטח costal של הריאה השמאלית מכוסית הצדר קרבי הקודקודית צריך להיחשף.
- כדי להזין את חלל פלאורלי, בזהירות לנקב שתי השכבות של הצדר ולקרוע אותן פתוחות.
- השתמש מפשק החזה להפריד את שולי הפצע ואת הצלעות לנהוג בתקיפות רקמותזו מזו כדי להשיג חשיפה טובה של חלל פלאורלי.
- דוחקים הצדה את הריאה השמאלית לכיוון הזנב ולשמור אותו במקום עם גזה רטוב. עכשיו הלב וכלי גדול צריך להיות חשוף בבירור.
- המיקום של קטטרים בדיקות זרימה (איור 1)
- השתמש דיסקציה קהה כדי להסיר ~ 2 ס"מ 2 של רקמת חיבור המקיפה של אבי העורקים החזי יורד.
- בצע תפר ארנק מייתר, מורכב משלושה תפרים, בקיר אאורטלי עם תפר קלוע משי USP3-0 שאינו נספג (Ø0.2 מ"מ).
- לחדור את דופן כלי אבי העורקים עם מחט נירוסטה 16 G באמצע תפר הארנק מיתרים.
- הכנס את קצה הצנתר המלא נוזל (עד הטבעת) לתוך אב עורקים, ומשוך תפר הארנק מייתר בחוזקה יחד ולקשור שתי המחרוזות של התפר.
- כדי לשמור את הקטטר במקום, בסופו של תפר 3 פעמים סביב הקטטר מעל הטבעת ושוב tכלומר שתי המחרוזות של התפר. בהמשך לאבטח את הקטטר עם תפר חדש כ 1 סנטימטר גולגולתי ממקום הכניסה.
- חבר את הקטטר מלא נוזל כדי מתמר לחץ המכויל, אשר מחוברים למחשב, לפקח על לחץ הדם הממוצע במהלך ניתוח. קבל גז דם עורקים לאמת או להתאים הגדרות אוורור נכונות.
- פתח את קרום הלב עם חתך חצה. שים לב לשמור על עצב הסרעפת שיוצא על קרום הלב ללא פגע.
- זהה את עורק הריאה ולמשוך אותו מעט לכיוון הזנב עם מפשק Farabeuf. עכשיו האאורטה עולה קשת אבי העורקים צריך להיחשף. צג ממוצע לחץ דם תוך חוזר בה עורק ריאה.
- ביצוע חתך קטן (~ 1 ס"מ) ברקמות החיבור בין האאורטה עולה ואת עורק הריאה באמצעות מספריים מצנבאום, להיות מסוגל לנתח או האאורטה עולה או עורק הריאה עם גדול ומעוקלמהדק יתוש למקם את חללית הזרימה.
- מניח את הגומייה של חללית הזרימה סביב הספינה. כדי להקל, למקם תפר דרך קצה אחד של הגומייה, למקם תפר זה סביב כלי ולמשוך אותו עד הגומייה המקיפה את כלי השיט.
- תקן את מכשיר מדידת זרימת בדיקה על הגומייה. חבר את חללית זרימת למחשב ולבדוק את אות תפוקת לב במחשב כדי לאשר הקצאה נכונה של חללית הזרימה.
- מניח צנתרים מלאי נוזל בעורק ריאה, נכון חדר, חדר שמאליים אטריום שמאל באותו אופן כפי שתואר עבור קטטר מלאת נוזל אב העורקים (3.2.2 - 3.2.5). שימו לב כי אין צורך להסיר רקמות חיבור לפני ביצוע תפר ארנק מייתר במבנים אלה.
- לחשוף לנתח את החלק הפרוקסימלי של השמאלי הקדמי היורד לב כלילית על ידי הרמת הרקמה הראשונה עם מלקחיים ועושה קטן (2 - 3 מ"מ) לגזור במספריים מצנבאום, ואחריו מתגרה הרקמה מן העורק בזהירות עם מקלון צמר גפן. ודא לנתיחה מלאה של העורק הכלילי ידי העברת מהדק יתוש זוויתי ישר קטן מתחת.
- הפוך תפר מקביל הווריד כלילית interventricular הקדמי עם תפר, אשר מחובר אל צנתר ורידי כלילית.
- לנקב את הווריד כלילית עם מחט 20 G של צנתר ורידי כלילית והכניסו את הצינורית של הקטטר לווריד.
- הסר את המחט ולאבטח את הקטטר עם תפר ביצע כבר (3.2.14). בהמשך לאבטח את הקטטר עם תפר חדש כ 1cm ממקום ניקור ראשוני.
- מניחים את החללית זרימה כלילית ברחבי הקדמי השמאלי גזור בעבר יורד עורקים כליליים. כאשר העורק הוא מכווץ כמעט גלוי, להשתמש לידוקאין 10% תרסיס להרפות את הכלי כדי לקבל חשיפה טובה יותר של כלי שיט. בדוק את האות של זרימה כלילית במחשב כדי confIRM הקצאה נכונה של חללית הזרימה (איור 2).
- תיעול
- מנהרת בדיקות הזרימה בנפרד בחלל צלע השמאלי השלישי מתחת לשריר ומעל הצלע באמצעות מהדק יתוש מעוקל גדול.
- מנהרה את הצנתרים המלאים נוזל הדרך או השלישי או במרחב צלעי השמאל החמישי על ידי פירסינג שריר צלעי. הצמד את צנתרים מלאות נוזל ולהסיר את שסתום משולשת כדי לצמצם את שטח פירסינג ולמנוע דליפה של צנתרים מלאות נוזל במהלך מנהור.
- תקן חלליות הזרימה ואת הצנתרים מלאי נוזל עם משי הקלוע USP2-0 שאינו נספג (Ø0.3 מ"מ) באמצעות תפר ארנק מחרוזת על שריר צלעי. תפר זה משמש גם כדי למנוע דליפת אוויר אחרי מחדש בתארים לחצו intrathoracic שלילי.
- הפוך שלושה חתכים בעור כ 2 ס"מ מרושע ובמקביל עמוד השדרה, כ 3 ס"מאורך 3 ס"מ זה מזה של אחד את השני.
- פירס trochar מתחת שריר הגב הרחיב שמאל מאתר חתך מקורי החתכים על הגב. מנהרת בדיקות זרימת צנתרים נוזל לחלק האחורי בתוך trochar זה.
- מניחים את והברזים למיניהם על צנתרים מלאות נוזל ולהסיר את מהדק. לסגת דם להסיר קרישי ובועות אוויר ולמלא את צנתרים מלאות נוזל עם 1,000 הפרין IU / ml. צנתרים ורידיים כלילית צריכים להיות מלא 5,000 הפרין IU / ml.
- סגירת Thorax
- עושים חתך באורך של כ 1.5 ס"מ, 8 ס"מ הזנב ובמקביל את החתך הראשון.
- עופרת לטמיון מחלל פלאורלי דרך שרירי צלע השישי מתחת לעור כדי החתך הזה עם מלחציים יתוש מעוקל גדול. חבר לטמיון למכשיר שאיבה כדי להסיר כל נוזל הנותרים ולהחזיר לחץ שלילי בחלל פלאורלי במהלך הסגירה של בית החזה.
- להקל לנפחהריאה עם אחיזת קצה שאיפה. ודא מילוי נאות של הריאות על ידי ניטור ויזואלי.
- סגור את בית החזה על ידי משייכת הצלעות של מרחב צלע הרביעי יחד בשני אתרים נפרדים עם פוליאסטר הקלוע USP6 שאינו נספג (Ø0.8 מ"מ).
- סגור את שריר serratus ו שריר החזה גדול עם תפר ריצת העור עם תפר subcuticular פועל באמצעות משי קלוע USP2-0 שאינו נספג (Ø0.3 מ"מ)
- לתפור את החתכים בצד הגבי עם פוליאסטר קלוע USP2-0 שאינם נספגים (Ø0.3 מ"מ) בין צנתרים. ראשית לקשור קשר ישירות על העור כדי לסגור את החתך, ואז לקבע את צנתרים אל תפר עם פקעת 1 ס"מ מהעור. עבור בדיקות הזרימה, השתמש polyglactin הקלוע USP2-0 נספג (Ø0.3 מ"מ) תפר למנוע חיתוך של תפר בחוט בדיקת הזרימה (איור 1).
- מוציאים בזהירות לטמיון תוך הפעלת לחץ על הצד גולגולתי שלהחתך כדי לשמור על לחץ שלילי בחלל פלאורלי. סגירת החתך עם תפר מחרוזת הארנק באמצעות פוליאסטר קלוע USP2-0 שאינם נספגים (Ø0.3 מ"מ) ולאטום את הפצע עם וזלין.
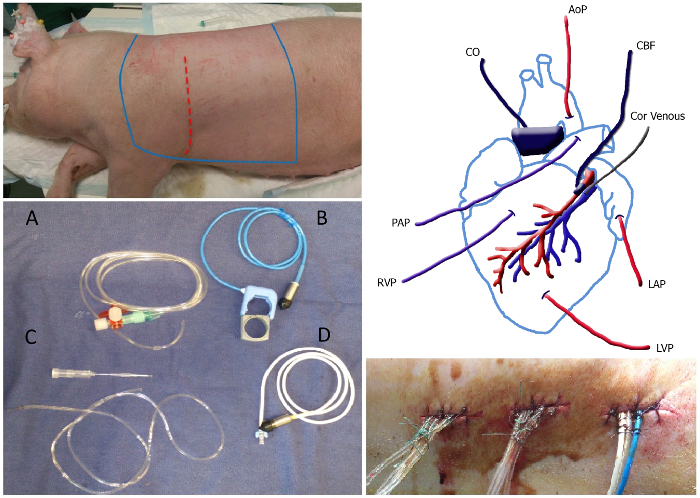
סקירה כללית באיור 1. לכירורגיה בחלונית הימנית העליונה:. אזור סטרילי של החיה, אשר אמור להיות מגולח מעוקר שקרים בין השורות bleu. אתר החתך מתואר כקו המקווקו האדום. בחלונית שמאלית תחתונה: תמונה של צנתרי בדיקות זרימה: קטטר מלא נוזל (א), חללית זרימת האאורטה / ריאתי כולל גומייה (B), צנתר ורידים כלילית כוללים 20 G מחט (C) ואת חללית הזרימה כלילית (D). פנל ממני למעלה: סקירה סכמטי של מיקום של צנתרי בדיקות זרימה. MAP, מתכוון בלחץ העורקי; ורידי Cor, צנתר ורידים כליליים; LAP, עזב לחץ פרוזדורים; LVPהלחץ של החדר השמאלי; RVP, לחץ החדר הימני; PAP, הלחץ בעורק הריאה; CO, תפוקת לב; CBF, זרימת הדם הכליליים. פנל ימני תחתונים:. צנתרי מנהרת יציאה האחורית מאובטח עם תפר וקשר בכ 1 המרחק סנטימטר לאורך התפר אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- הפסקת הרדמה והתאוששות מניתוח
- עצור הרדמה כאשר כל אתרי החתך סגורים.
- לספק שיכוך כאבים באמצעות מתן עצירות (0.015 מ"ג / ק"ג) im ב השריר העדין.
- עצור את אוורור כאשר החיה נושמת באופן עצמאי ונתקו את צינור לקנה הנשימה ממכונת ההנשמה. בדקו מעת לעת אם חיה נושמת מספיק.
- מניחים פדי גזה בין אתרים החצנה של צנתרים לספוג נוזל הפצע.
- כדי להגן על חיצוניים segments של צנתרים, לתת את החיה אפוד אלסטי ואורזים את צנתרים בין שתי פיסות עור כבש מלאכותית.
- להוציא אוויר הבלון של צינור לקנה הנשימה ואת extubate כאשר החיה חוזר רפלקס הבליעה שלה.
- לספק שיכוך כאבים לטווח ארוך באמצעות תיקון שחרור איטי פנטניל (12 מיקרוגרם / hr עבור חזיר 20 ק"ג; להתאים את הכוח שלך על פי משקל גוף). מניחים את המדבקה על חלק דק של העור (כגון בבטן התחתונה), כדי להבטיח אספקה של שיכוך כאבים הולם.
- בית החיה בנפרד לתקופה שלאחר הניתוח כולו. ספק מנורת חימום במשך השבוע הראשון לאחר הניתוח כדי לשמור על חומו של בעלי חיים.
- לספק iv מספיק נוזלים אם החיה אינה שותה באופן עצמאי.
- שטוף את צנתרים מלאות נוזל יומי, על ידי משיכת הדם הראשונה להסיר קרישי, אז מילוי עם מי מלח ולבסוף עם מלח heparinized (1,000 - 5,000 IU / ml) כדי למנוע היווצרות קריש דם. יש להיזהר שלא להחדיר כל האוויר bubbles תוך שטיפת הצנתרים.
- נהל אמוקסיצילין (25 מ"ג / ק"ג) iv יומי במשך 6 ימים לאחר הניתוח, כדי למנוע זיהומים לאחר ניתוח.
- אפשר החיה להתאושש במשך שבוע לפני תחילת הניסויים הליכון.
4. ניסוי הליכון (איור 2)
- שטוף את הצנתרים מלאי נוזל כמתואר (3.5.10) ולצרף את הצנתרים הסמוקים אל מתמר ללחץ. מדוד את טמפרטורת רקטלי כדי להיות מסוגלת להשיג ערכי גז דם תיקן טמפרטורה.
- שטוף את מתמר ללחץ עם תמיסת מלח כדי למנוע הדעיכה של האותות עקב בועות אוויר. צרף מתמר לחץ לחזה אלסטי בצד הגבי.
- חבר את מתמרי לחץ בדיקות זרימה למגבר. להתחיל למדוד בתוכנת מחשב ולכייל התמר לחץ בדיקות זרימה עם 0 mmHg להיות פתוח לאוויר (וסגורות חיה) ו -100 מ"מ כספי באמצעות מנומטר.
- החליפי את השסתום המשולש בצורה כי הצנתרים הנוזלים יש חיבור פתוח עם המתמרים ללחץ. ראוי לציין, כי לחץ הדם ניתן להשיג עכשיו. בדקו אותות עבור צורה משרעת (איור 2).
- במידת הצורך, לחבר קו רחב או של צנתרי נוזל הדגימה של דם ורידי עורקים מעורבים.
- מדוד ופרמטרים המודינמיים כאשר החיה שוכבת כמו גם עומד בשקט על ההליכון. לחצי דם ממוצע נמדדים לאורך פרק זמן של 10 שניות.
- השג עורקי דגימות דם ורידי מעורב ידי הראשון למשיכת 5 מ"ל של דם באמצעות מזרק 10 מ"ל, כך 1 מ"ל של דם טהור ניתן להשיג באמצעות מזרק 1 מ"ל heparinized. לקבלת דגימות דם ורידי כלילית, מזרק 2 מ"ל משמש במקום של מזרק 10 מ"ל ונסיגה של 1 מ"ל מספיקה כדי להשיג דם טהור.
- תחזיקי את המזרקים 1 מ"ל חתום על הקרח לפני עיבוד דגימות דם עם מנתח גז דם כדי לקבועתנאי מטבוליות נשימתית של חיה.
- נושא החזירים כדי פרוטוקול תרגיל לחמש שלב על ההליכון, 3 דק 'לכל מהירות, 1 - 5 ק"מ / שעה (~ 85% מהדופק המקסימאלי). השג ופרמטרים המודינמיים וגזים בדם לאחר 1.5 - 2 דקות לכל מהירות בכל מהירות כמו תנוחת מנוחה.
- לאחר פרוטוקול תרגיל לסגור את והברזים למיניהם ולבדוק אם להיסחף שחל כיול 0 mmHg, ורשום כיול זה. הסר את מתמר ללחץ של צנתרים מלאי נוזל וניתקת את בדיקות הזרימה.
- שטוף את צנתרים מלאות נוזל עם מליחים הפרין (1,000 - 5,000 IU / ml). הגן על צנתרי בדיקות זרימה ידי לשים אותם מתחת הגופייה אלסטית בין שתי פיסות עור כבש מלאכותי. החיה כעת ניתן חזרה לכלוב שלה.

איור 2. ניסוי הליכון. בחלונית הימניתls: מאובזרת חזירים על ההליכון. צנתרים מלאים נוזל מחובר מתמר ללחץ, דגש על החלק האחורי של החזירים. פנל ממני למעלה: סקירה של ניסוי הגדרת הכל, כולל הליכון, מגבר ומחשב הקלטה. פנל ימני תחתון: דוגמא אופיינית נתונים המודינמי מוקלט. מלמעלה למטה; הלחץ אבי העורקים (AOP, כחול) ובלחץ של החדר השמאלי (LVP, אדום); לחץ פרוזדורי שמאל (LAP, כחול) ובלחץ של חדר שמאלי (אדום); לחץ בעורק ריאה (PAP, כחול) ולחץ חדר ממני (RVP, אדום); זרימת אבי העורקים / תפוקת הלב (aof, כחול); זרימת הדם הכליליים (CBF, אדום). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
תוצאות
תרגיל עד 5 ק"מ / שעה הביא להכפלת תפוקת הלב מ -4.3 ± 0.3 ל 8.5 ± 0.7 ליטר / דקה אשר הושג בעיקר על ידי גידול בקצב הלב מן 137 ± 7 ל 256 ± 8 פעימות לדקה בשילוב עם עלייה קטנה בנפח הפעימה מ -32 ± 2 כדי 36 ± 3 מ"ל (איור 3). הגידול בהיקף שבץ התאפשרה על ידי גידול התכווצו?...
Discussion
המחקר הנוכחי מתאר את הניתוח עבור מכשור chronical של חזירים וכן הפרוטוקול למימוש חזירים המאובזרת על הליכון מונע במנוע תוך מדידה ופרמטרים המודינמיים ולקיחת דגימות דם למדידת תכולת חמצן העורקי, ורידים מעורבים ודם ורידים כלילית.
צעדים ק?...
Disclosures
החוקרים אין לי מה לחשוף.
Acknowledgements
מחקר זה נתמך על ידי קרן הלב הולנד מענק 2000T038 (אל DJ Duncker) מענק 2000T042 (ד Merkus), FP7-בריאות-2010 הנציבות האירופית מענק MEDIA-261,409 (אל DJ Duncker וד Merkus), יוזמת מחקר לב וכלי דם הולנד: קרן הלב ההולנדית, הפדרציה הולנדית עבור מרכזים רפואיים האוניברסיטה, ארגון הולנד למחקר בריאות ופיתוח והאקדמיה המלכותית ההולנדית למדעים CVON- ARENA CVON 2011-11 (אל DJ Duncker), CVON-פדרה CVON2012-08 (ד Merkus) ו CVON-חבר מחדש CVON 2014-11 (אל DJ Duncker וד Merkus), סופיה קרן (ד דה Wijs-Meijler, ד Merkus ו IKM רייס).
Materials
| Name | Company | Catalog Number | Comments |
| 3-way stopcocks | B. Braun | 16496 | |
| Perfusor lines PVC (DEHP-free) 150 cm/2.6 ml | B. Braun | 8722960 | Used for fluid filled catheters |
| “python “ silicontubing | Rubber BV | 1757 ID 1 mm, OD 2 mm | Used for fluid filled catheters |
| Sodium Chloride 0.9% | Baxter | TKF7124 | |
| Glucose 10% | Baxter | WE0163 | |
| Suction device | |||
| Slim-Line electrosurgical pencil with 2 buttons | ERBE ELEKTROMEDIZIN GMBH | 20190-066 | |
| Servo Ventilator SV900C | Siemens-Elema AB | ||
| Laryngoscoop | Vererinary Technics Int. | 11.02.47 | |
| Sterile surgical gloves | |||
| tie-on surgical mask | 3M | 1818FS | |
| surgical hat | Klinidrape | 621301 | |
| Procedure pack | Molnlycke Health Care | 97027809 | Surgical drape, gauze pads, syringes, beaker etc |
| Droptears | Alcon | 288-28282-01 | |
| Betadine scrub 75 mg/ml Povidone-iodine | Meda Pharma BV | RVG08939 | |
| Betadine solution 100 mg/ml Povidone-iodine | Meda Pharma BV | RVG01331 | |
| Cuffed Endotracheal tube | Emdamed | size depends on animal size | |
| Breathing filter Hyrdo therm 3HME | Intersurgical | 1560000 | |
| Laryngoscope Handle+ Miller blade size 4 | Kawe Germany | ||
| Manual resuscitator- Combibag | Weinmann | 6515-12-313-5596 | |
| Perivascular flow probe 3PS | Transonic | For coronary artery; Size 2.5 - 4 mm depending on animal size | |
| Confidence flow probe | Transonic | For aorta/pulmonary artery, 16 - 20 mm; size depends on animal size | |
| Venflon-Venisystem 20 G x 32 mm | BD | 393224 | For coronary venous catheter |
| Blunt Needle 18 G | For coronary venous catheter | ||
| Tygon Tubing | Rubber BV | 2802 ID 0.8 mm (1/32’’), OD 2.4 mm (3/32’’) | For coronary venous catheter |
| Suction Handle 17 cm 6 6/8 " Coupland 18/8 martinit with tube connector | KLS Martin Group | 18-575-24 | |
| Scalple blade | |||
| Scalpel Handle 13.5 cm 5 3/8 " Stainless Steel solid | KLS Martin Group | 10-100-04 | |
| Vascular Forceps 20.2 cm 8 " De Bakey Stainless Stee | KLS Martin Group | 24-388-20 | ± 14 cm |
| Dressing Forceps 17 cm 6 6/8 " Cushing Stainless Steel | KLS Martin Group | 12-189-17 | ± 18 cm |
| halsted-musquito straight 12.5 cm - 5" | Rudolf Medical | RU-3100-13 | ± 12 cm |
| halsted-musquito curved 12.5 cm - 5" | Rudolf Medical | RU-3101-12 | ± 12 cm |
| Dissecting and Ligature Forceps 13 cm 5 1/8 " Gemini Stainless Steel | KLS Martin Group | 13-451-13 | ± 12 cm |
| Dissecting and Ligature Forceps 18.5 cm 7 2/8 " Schnidt Stainless Steel | KLS Martin Group | 13-363-18 | |
| Rib Retractor Finochietto, Baby Aluminium - | KLS Martin Group | 24-162-01 | |
| suture forceps Mayo-Hegar 3 mm 18 cm - 7" | Rudolf Medical | RU-6050-18 | |
| Metchenbaum blunt curved 14.5 cm - 5(3/4)" | Rudolf Medical | RU-1311-14M | |
| Retrector farabeuf 12 cm - 4 (3/4)" | Rudolf Medical | RU-4497-12 | |
| Towel forceps schrädel curved 9cm - 3,5" | Rudolf Medical | RU-3550-09 | |
| surgical scissors blunt 13 cm - 5" | Rudolf Medical | RU-1001-13 | |
| Gauzes Cutisoft 10 x 10 cm 4-ply | BSN Medical | 45846-00 | |
| Gauzes Cutisoft 5 x 5 cm 4-ply | BSN Medical | 45844-00 | |
| Flowmeter -CM2 / SF2 - 2gas (O2 and Air) | UNO BV | 180000008 | |
| Tec 7 Vaporizer | Datex-Ohmeda | ||
| Acederm wound spay | Ecuphar NV | ||
| Vaseline Album | Bufa | 165313 | |
| silkam 3-0 Natural silk, non-absorbable | B. Braun | F 1134043 | sutures for placement of catheters |
| silkam 2-0 Natural silk, non-absorbable | B. Braun | F 1134051 | sutures for muscular approximation |
| dagrofil 3-0 Polyester, non-absorbable | B. Braun | C 0842478 | sutures for fluid fille catheters after tunneling |
| Vicryl rapide 3-0, 1 x 45 cm FS2, V2930G | Daxtrio medische producten | 15560 | sutures for electrical catheters after tunneling |
| Vitafil 6 USP | SMI | 6080 | Ties |
| Syringes | 10 ml and 2.5 ml | ||
| Heparin LEO (heparin sodium) | LEO Pharma A/S | ||
| Zoletil | Virbac | tiletamine / zolazepam | |
| Sedazine | AST farma | 108855 | xylazine |
| Temgesic | RB Pharmaceuticals | 5429 | buprenorphine |
| Tensogrip | BSN Medical | 71522-00 | elastic vest |
References
- Laughlin, M. H., et al. Peripheral circulation. Compr Physiol. 2, 321-447 (2012).
- Datta, D., Normandin, E., ZuWallack, R. Cardiopulmonary exercise testing in the assessment of exertional dyspnea. Ann Thorac Med. 10, 77-86 (2015).
- Vatner, S. F., Braunwald, E. Cardiovascular control mechanisms in the conscious state. N Engl J Med. 293, 970-976 (1975).
- Duncker, D. J., Bache, R. J. Regulation of coronary blood flow during exercise. Physiol Rev. 88, 1009-1086 (2008).
- Tune, J. D., Gorman, M. W., Feigl, E. O. Matching coronary blood flow to myocardial oxygen consumption. J Appl Physiol. 97 (1985), 404-415 (2004).
- van den Heuvel, M., et al. Coronary microvascular dysfunction in a porcine model of early atherosclerosis and diabetes. Am J Physiol Heart Circ Physiol. 302, H85-H94 (2012).
- Zhou, Z., et al. Pulmonary vasoconstrictor influence of endothelin in exercising swine depends critically on phosphodiesterase 5 activity. Am J Physiol Lung Cell Mol Physiol. 306, L442-L452 (2014).
- Pereda, D., et al. Swine model of chronic postcapillary pulmonary hypertension with right ventricular remodeling: long-term characterization by cardiac catheterization, magnetic resonance, and pathology. J Cardiovasc Transl Res. 7, 494-506 (2014).
- Mercier, O., et al. Endothelin A receptor blockade improves regression of flow-induced pulmonary vasculopathy in piglets. J Thorac Cardiovasc Surg. 140, 677-683 (2010).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259, H218-H229 (1990).
- Yarbrough, W. M., Spinale, F. G. Large animal models of congestive heart failure: a critical step in translating basic observations into clinical applications. J Nucl Cardiol. 10, 77-86 (2003).
- Duncker, D. J., Stubenitsky, R., Verdouw, P. D. Autonomic control of vasomotion in the porcine coronary circulation during treadmill exercise: evidence for feed-forward beta-adrenergic control. Circ Res. 82, 1312-1322 (1998).
- Stubenitsky, R., Verdouw, P. D., Duncker, D. J. Autonomic control of cardiovascular performance and whole body O2 delivery and utilization in swine during treadmill exercise. Cardiovasc Res. 39, 459-474 (1998).
- Zhou, Z., et al. Phosphodiesterase-5 activity exerts a coronary vasoconstrictor influence in awake swine that is mediated in part via an increase in endothelin production. Am J Physiol Heart Circ Physiol. 306, H918-H927 (2014).
- Gross, D. R. . Animal Models in Cardiovascular Research. , (2009).
- Merkus, D., Duncker, D. J. Perspectives: Coronary microvascular dysfunction in post-infarct remodelled myocardium. Eur Heart J Suppl. 16, A74-A79 (2014).
- de Beer, V. J., de Graaff, H. J., Hoekstra, M., Duncker, D. J., Merkus, D. Integrated control of pulmonary vascular tone by endothelin and angiotensin II in exercising swine depends on gender. Am J Physiol Heart Circ Physiol. 298, H1976-H1985 (2010).
- Lautt, W. W. Resistance or conductance for expression of arterial vascular tone. Microvasc Res. 37, 230-236 (1989).
- Merkus, D., et al. Phosphodiesterase 5 inhibition-induced coronary vasodilation is reduced after myocardial infarction. Am J Physiol Heart Circ Physiol. 304, H1370-H1381 (2013).
- Heusch, G. The paradox of alpha-adrenergic coronary vasoconstriction revisited. J Mol Cell Card. 51, 16-23 (2011).
- Merkus, D., Houweling, B., van den Meiracker, A. H., Boomsma, F., Duncker, D. J. Contribution of endothelin to coronary vasomotor tone is abolished after myocardial infarction. Am J Physiol Heart Circ Physiol. 288, H871-H880 (2005).
- Haitsma, D. B., et al. Minimal impairment of myocardial blood flow responses to exercise in the remodeled left ventricle early after myocardial infarction, despite significant hemodynamic and neurohumoral alterations. Cardiovasc Res. 52, 417-428 (2001).
- Bender, S. B., van Houwelingen, M. J., Merkus, D., Duncker, D. J., Laughlin, M. H. Quantitative analysis of exercise-induced enhancement of early- and late-systolic retrograde coronary blood flow. J Appl Physiol. 108 (3), 507-514 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved