Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Chirurgische Platzierung von Kathetern für die langfristige Herz-Kreislauf und Sportmedizin in Swine
In diesem Artikel
Zusammenfassung
Here we present a protocol to assess cardiopulmonary function in awake swine, at rest and during graded treadmill exercise. Chronic instrumentation allows for repeated hemodynamic measurements uninfluenced by cardiodepressive anesthetic agents.
Zusammenfassung
Dieses Protokoll beschreibt die chirurgische Prozedur chronisch Instrument Schweine und Schweine dem Verfahren auf einer motorgetriebenen Laufband auszuüben. Frühe kardiopulmonaler Dysfunktion ist schwer zu diagnostizieren, insbesondere in Tiermodellen, wie Herz-Lungen-Funktion oft invasiv gemessen wird, erfordert Anästhesie. Wie viele Anästhetika kardiodepressiven, subtile Veränderungen in der Herz-Kreislauf-Funktion sind, können maskiert werden. Im Gegensatz dazu ermöglicht chronischen Instrumentierung zur Messung der Herz-Lungen-Funktion in den Wachzustand, so dass Messungen unter ruhigen Ruhebedingungen erhalten werden, ohne die Auswirkungen der Anästhesie und akuten chirurgischen Trauma. Darüber hinaus, wenn die Tiere entsprechend geschult sind, Messungen auch während abgestuften Laufband erhalten werden.
Strömungssonden sind rund um die Aorta oder Lungenarterie zur Messung des Herzzeitvolumens und um den linken vorderen absteigenden Koronararterie zur Messung von coron platziertary Blutung. Flüssigkeitsgefüllte Katheter in die Aorta, Lungenarterie implantiert, linker Vorhof, linker Herzkammer und der rechten Herzkammer zur Druckmessung und Blutabnahme. Zusätzlich wird eine 20 G-Katheter in der vorderen interventrikulären Vene positioniert koronare venöse Blutentnahme ermöglichen.
Nach einer Woche der Erholung, sind Schweine werden auf einer motorgetriebenen Laufband gelegt, die Katheter zur Druck- und Durchflussmesser verbunden sind, und Schweinen zu einer progressiven fünfstufigen Bewegung Protokoll unterzogen, wobei jede Stufe einer Dauer von 3 min. Hämodynamischen Signale werden kontinuierlich aufgezeichnet und Blutproben werden während der letzten 30 Sekunden von jeder Übung Bühne gemacht.
Der große Vorteil von chronisch instrumentierten Tiere zu studieren ist, dass es serielle Beurteilung der Herz-Lungen-Funktion, nicht nur in Ruhe, sondern auch bei körperlicher Belastung wie Bewegung ermöglicht. Darüber hinaus kann Herz-Lungen-Funktion mehrmals während der Krankheitsentwicklung eine beurteilt werdennd während Langzeitbehandlung, wodurch sich die statistische Aussagekraft und damit die Begrenzung der Anzahl der Tiere, für eine Studie erforderlich.
Einleitung
Angemessene Herz-Lungen-Funktion ist wichtig, um den Körper mit Sauerstoff und Nährstoffen zu versorgen, insbesondere während Bedingungen eines erhöhten Stoffwechselbedarf wie während des Trainings ein. Die Herz-Lungen-Reaktion auf Bewegung wird durch eine Reihe von Anpassungen der Herzfunktion gekennzeichnet, dh., Einen Anstieg der Herzfrequenz, Kontraktilität und Schlagvolumen und mikrovaskulären Funktion, dh, Vasodilatation in den Gefäßbetten Zuführen Muskeln sowie in den Lungen Ausübung Gefäße und Gefäßverengung in den Gefäßbetten, die Magen-Darm-System sowie die inaktiven Muskeln liefert ein. Beeinträchtigte körperliche Belastbarkeit ist ein frühes Merkmal der Herz-Lungen-Dysfunktion und Spiroergometrie wird als eine effektive Methode verwendet, um zwischen Herzfunktionsstörungen, Gefäßstörungen und / oder Lungenfunktionsstörungen bei Patienten mit eingeschränkter körperlichen Leistungsfähigkeit 2 abzugrenzen. Frühe kardiopulmonale Funktionsstörung ist difficult zu diagnostizieren, insbesondere in Tiermodellen, wie Herz-Lungen-Funktion oft invasiv gemessen wird, Anästhesie erfordert, mit vielen Anästhetika kardiodepressiven Eigenschaften 3 besitzen.
Chronische Instrumentierung ermöglicht die Messung der Herz-Lungen-Funktion in den Wachzustand, und wenn die Tiere vollständig angepasst werden an die Laborbedingungen Messungen können unter ruhigen Ruhebedingungen ohne die Auswirkungen der Anästhesie und akuten chirurgischen Trauma erhalten werden. Darüber hinaus, wenn die Tiere angemessen ausgebildet werden, Messungen auch während abgestuften Laufband 4,5 erhalten werden. Genauer gesagt, linke und rechte Herzfunktion bewertet und zu Myokardperfusion Beziehung gesetzt werden kann, während Tonusregulation vasomotorischer in den koronaren, systemische und pulmonale Mikrozirkulation festgestellt werden kann. Die Verwendung von flüssigkeitsgefüllten Katheter ermöglicht die Messung von Druck sowie Entnahme von Blutproben ohne Anzeige zur Einführungsätzliche Belastung für die Tiere. Ein weiterer Vorteil der chronisch instrumentierten Tiere zu studieren ist, dass Spiroergometrie wiederholt werden, um die Verwendung eines Tieres als seine eigene Kontrolle ermöglicht, entweder während der Krankheitsentwicklung oder bei der Langzeitbehandlung, wodurch die statistische Aussagekraft zu erhöhen und damit die Zahl der Tiere, für eine Studie erforderlich Begrenzung .
Cardiopulmonary Anatomie von Schweinen sehr ähnlich dem des Menschen, und es ist möglich, verschiedene Formen von Herz-Lungen-Krankheiten, wie Diabetes 6, Myokardinfarkt 7, pulmonale Hypertonie und 8,9 Pacing-induzierte Herzinsuffizienz 10,11 zu induzieren. Darüber hinaus erlaubt die Größe der Schweine chronischen Instrumentierung, und wiederholte Blutentnahme in ausreichender Menge zur Analyse nicht nur Blutgase, aber auch neurohumoralen Messungen und / oder zur Suche nach Biomarkern der Krankheit durchzuführen.
Dieses Protokoll beschreibt die Operation zu chronischen verwendetly Instrument Schwein auf einem motorgetriebenen Laufband in die Schweine sowie das Protokoll für die Ausübung.
Protokoll
Verfahren unter Verwendung tierischer Probanden wurden von der Animal Care Committee an der Erasmus Medical Center Rotterdam (NL) genehmigt. Schwein mit Gewichten zwischen 6 und 80 kg wurden mit Hilfe dieses Protokoll erfolgreich instrumentiert.
1. Anpassung der Tiere an Menschen Handhabung
- Nach der Ankunft in der Anlage, beherbergen die einsam Tiere, sondern es ihnen ermöglichen, miteinander zu interagieren.
- Accustomize Schweine für die menschliche Behandlung und den Transport von der Tierhaltung zu Versuchslabor, um das Tier mindestens einmal am Tag für eine Woche behandeln.
- Trainieren Sie die Tiere in geeigneter Weise für die Ausübung Versuche an einem motorgetriebenen Laufband, indem sie auf dem Laufband für mindestens drei Mal vor der Operation wahrnehmen.
- Die Tiere sollten O / N vor der Operation fasten Übelkeit zu vermeiden, Erbrechen und dadurch mögliche Aspiration von Magensaft.
2. Vorbereitung für Chirurgie
- Beruhigung
- Bereiten Sie Medikamente zur Sedierung in einem 10-ml-Spritze. Prämedikation besteht aus Tiletamin / Zolazepam (5 mg / kg), Xylazin (2,25 mg / kg) und Atropin (1 mg).
- Spritzen Sie das Medikament intramuskulär in den Trapezmuskel mit einer 19 G 1,5 '' Nadel das Schwein zu sedieren.
- Warten Sie ca. 10 Minuten und überprüfen Sie die Muskelentspannung und Bewusstlosigkeit angemessenen und stabilen Niveau der Sedierung zu bestätigen.
- Legen Sie eine 20 G peripheren Sicherheitskatheter in eine Ohrvene für nachfolgende intravenöse Verabreichung von Anästhesie und / oder Flüssigkeiten.
- Intubation und Beatmung
- Legen Sie das Tier auf einem Tisch und / oder Wagen in Rückenlage.
- Öffnen Sie den Mund des Tieres mit einem oralen Treuer.
- Bei unzureichender Erholung der Backen oder Anwesenheit Reflexe des Schluckens, die Intubation behindern, zu verwalten Thiopental (10 mg / kg) intravenös über die Ohrvenenkatheter. Alternativ könnte das Schwein maskiertmit Isofluran Sedierung zu induzieren.
- Verwenden Sie ein herkömmliches Laryngoskop mit einer leichten und einer Miller Messer die laryngoscopist zu ermöglichen, direkt in den Kehlkopf zu sehen. Wenn es Laryngospasmen ist, gelten 2% Lidocain zu den Korden und Kehlkopf, um den Krampf zu reduzieren und Intubation zu ermöglichen.
- Legen Sie eine Intubation Stilett in den Endotrachealtubus das Rohr entsprechen besser an die oberen Atemwege Anatomie und passieren die Röhre durch den Mund und zwischen den Stimmbändern in die Luftröhre zu machen.
- Den Ballon Manschette mit einem 10-ml-Spritze befestigen, an Ort und Stelle, um ein Austreten von Atemgasen zu verhindern, und die Atemwege von möglichen Aspiration von Magenflüssigkeit zu schützen.
- Verbinden des Rohres mit einer Atemfilter (Wärme- und Feuchtigkeitsaustauscher) und mit dem mechanischen Ventilator.
- Legen Sie das Tier auf seiner rechten Seite auf dem OP-Tisch.
- , Usin: pO2 Ebenen von 100-120 mmHg, lüften Sie das Tier mit einem Gemisch aus Sauerstoff und Stickstoff (2 V / V 1) zu erreichen,g die folgenden Einstellungen des Beatmungsgerätes: Drucksteuerungsmodus: positiv endexspiratorischen Druck (PEEP) 4 cm H 2 O; Inspirationsspitzendruck von 16 bis 18 cm H 2 O; Atemfrequenz von der Größe des Tieres abhängig (für einen 20 kg Tier, Verringerung der Frequenz mit zunehmender Körpergewicht) diese in einem Atemvolumen von ca. 10 ml / kg führen sollte, Lüftung mit Kapnografie überwachen.
- Überwachung der Temperatur eine rektale Thermometer und halten Temperatur zwischen 37 bis 39 ° C einer Wärmelampe oder Wärmematte. Außerdem Herzfrequenz mit EKG überwachen.
- Anästhesie
- Induzieren und aufrechtzuerhalten Anästhesie vorzugsweise durch Zugabe von 2,0% Isofluran (v / v) zu dem Lüftungsgasgemisch oder alternativ durch intravenöse Verabreichung von Fentanyl (10 ug / kg / h) über die Ohrvene Katheters.
- Prüfen ausreichende Narkosetiefe durch Testen Schmerzreflexe mit einem Hinterbein Zehe Prise vor der Operation beginnen. Wenn nötig, fügenzusätzliche Anästhesie oder für ein paar Minuten warten. Prüfen Schmerz Reflexe regelmäßig während der Operation.
- Flüssigkeiten und Antibiotika
- Verwalten der ersten Dosis von Amoxicillin (25 mg / kg) intravenös über die Ohrvene Katheters.
- Anschließen eines Transfusionssystem für das Ohr Venenkatheter langsame Infusion von Glucose 10% (500 ml) während der Operation zu ermöglichen.
- Sterilisation von Operationsstelle
- Rasur und reinigen Sie die Haut des Tieres auf einer Fläche von ca. 25 cm Breite von der Wirbelsäule den ganzen Weg zur linken Achselhöhle.
- Scrub die Haut mit Feuchtigkeit versorgt mit PVP-Jod-Peeling (75 mg / ml) für ca. 5 min.
- Entfernen Sie die PVP-Jod Seife von der Haut mit feuchten sterilen Gazen, bevor die Haut mit PVP-Jod Lotion Sterilisierung (100 mg / ml).
- Decken Sie das Tier mit einem sterilen OP-Abdeckungen bakterieller Übernahme und Weiter Verunreinigung der Operationsstelle zu verringern.
3. Chirurgie
- Öffnen des Thorax (Thorakotomie)
- Einen Einschnitt in der Haut ab 1 cm kaudal der linken unteren Winkel des Schulterblattes nach unten an der linken Achselhöhle (Abbildung 1). Verwenden Diathermie Blutgefäße in der Haut zu verätzen starke Blutungen zu verhindern.
- Schnitt durch das serratus Muskeln und großen Brustmuskel, den Schneid Modalität der Diathermie verwendet wird. Nutzen Sie auch Diathermie Blutgefäße in der Muskelschicht zu ätzen starke Blutungen zu verhindern.
- Verwenden stumpf zu vorsichtig die Zwischenrippenmuskel des vierten linken Zwischenrippenraum mit einem Moskitoklemme unterteilen. Nun ist die Rippenfläche der linken Lunge bedeckt mit viszeralen und parietalen Pleura sollte ausgesetzt werden.
- Um die Brusthöhle betreten, durchbohren sorgfältig beide Schichten von Brust- und reißen ihnen offen.
- Benutzen Sie einen Brust Aufroller die Wundränder und die Rippen zu trennen und mit Nachdruck Gewebe fahrenabgesehen gute Belichtung der Brusthöhle zu erhalten.
- Drücken Sie den linken Lungenflügel in der Schwanzrichtung weg und halten sie an Ort und Stelle mit einem feuchten Gaze. Jetzt das Herz und die großen Gefäße sollte klar ausgesetzt werden.
- Platzierung von Kathetern und Strömungssonden (Abbildung 1)
- Verwenden stumpf zu entfernen ~ 2 cm 2 des umgebenden Bindegewebes der absteigenden Brustaorta.
- Führen Sie eine Tabaksbeutelnaht, bestehend aus drei Stichen in der Aortenwand mit einem nicht resorbierbaren USP3-0 geflochtenen Seidenfaden (A0.2 mm).
- Dringen in die Aorta-Gefäßwand mit einem Edelstahl-16 G-Nadel in der Mitte der Tabaksbeutelnaht.
- Legen Sie die Spitze des flüssigkeitsgefüllten Katheter (bis zum Ring) in die Aorta, ziehen Sie den Tabaksbeutelnaht fest zusammen und binden die beiden Saiten der Naht.
- Um den Katheter an Ort und Stelle zu halten, Wind den Faden 3-mal um den Katheter über dem Ring und wieder tdh die beiden Saiten der Naht. sichern weiterhin den Katheter mit einer neuen Masche etwa 1 cm Schädel von der Einführungs Ort.
- Schließen Sie den mit Flüssigkeit gefüllten Katheter zu dem kalibrierten Druckwandler, der mit dem Computer verbunden ist, den mittleren arteriellen Druck während der Operation zu überwachen. Erhalten arterielle Blutgas zu überprüfen oder für die korrekte Belüftung Einstellungen anpassen.
- Öffnen Sie den Herzbeutel mit einem gekreuzten Schnitt. Beachten Sie die Zwerchfellnerv zu halten, die unversehrt über den Herzbeutel läuft.
- Identifizieren Sie die Lungenarterie und ziehen Sie sie leicht in der Schwanzrichtung mit einer Farabeuf Aufroller. Jetzt ist der aufsteigenden Aorta und Aortenbogen sollte ausgesetzt werden. Überwachen Sie den mittleren arteriellen Druck, während die Lungenarterie zurückgezogen wird.
- Machen Sie einen kleinen Schnitt (~ 1 cm) im Bindegewebe zwischen der aufsteigenden Aorta und der Lungenschlagader mit Metzenbaum Schere, um entweder den aufsteigenden Aorta oder der Lungenarterie mit einem großen gebogenen sezierenMoskitoklemme die Strömungssonde zu platzieren.
- Legen Sie das Gummiband der Strömungssonde um das Gefäß. Um dies zu erleichtern, legen Sie einen Faden durch ein Ende des Gummibandes, bringen Sie diesen Faden um das Gefäß und ziehen Sie sie bis das Gummiband, das Schiff umgibt.
- Befestigen Sie die Fluss-Sonde Messeinrichtung auf dem Gummiband. Verbinden Sie die Fluss-Sonde an den Computer und überprüfen Sie die Herzausgangssignal auf dem Computer eine korrekte Platzierung des Strömungssonde zu bestätigen.
- Platzieren fluidgefüllten Katheter in die Lungenarterie, rechten Ventrikel und linken Ventrikel linken Vorhof in der gleichen Weise wie für die Aorta mit Flüssigkeit gefüllten Katheter beschrieben (3.2.2 - 3.2.5). Beachten Sie, dass es nicht notwendig ist, das Bindegewebe zu entfernen, bevor eine Tabaksbeutelnaht in diesen Strukturen durchzuführen.
- Expose und den proximalen Teil der linken vorderen sezieren absteigenden Koronararterie, indem zuerst das Gewebe mit einer Pinzette Heben und machen eine kleine (2-3 mm) geschnitten mit Metzenbaum Schere, Gefolgt von sorgfältig das Gewebe entfernt von der Arterie mit einem Wattestäbchen zu necken. Stellen Sie sicher, komplette Dissektion der Koronararterie durch eine kleine gerade gewinkelt Moskitoklemme unterhalb vorbei.
- Machen eine Masche parallel zu der vorderen interventrikulären Koronarvene mit einer Naht, die an die koronare Venenkatheter verbunden ist.
- Punktion der koronaren Vene mit dem 20 G Nadel der koronaren Venenkatheter und legen Sie die Kanüle aus dem Katheter intravenös.
- Entfernen Sie die Nadel und sichern Sie den Katheter mit dem bereits durchgeführten Stich (3.2.14). sichern weiterhin den Katheter mit einer neuen Masche etwa 1 cm vom Ort der ursprünglichen Punktion.
- Legen Sie die koronare Flusssonde um den zuvor linken vorderen seziert absteigenden Koronararterie. Wenn die Arterie eingeengt wird und ist kaum sichtbar, Lidocain 10% Spray verwenden, das Schiff zu entspannen eine bessere Belichtung des Schiffes zu bekommen. Prüfen Sie das Signal des koronaren Flusses auf dem Computer confIRM eine korrekte Platzierung des Strömungssonde (Abbildung 2).
- Tunneling
- Tunnel die Strömungssonden individuell durch den dritten linken Zwischenrippenraum unter dem Muskel und oberhalb der Rippe durch eine große gebogene Moskitoschelle.
- Tunnel die flüssigkeitsgefüllten Katheter durch entweder der dritten oder fünften linken Zwischenrippenraum durch die Zwischenrippenmuskel Piercing. Spannen Sie aus, die mit Flüssigkeit gefüllte Katheter und entfernen Sie den Dreiwegehahn des Stechfläche zu minimieren und verhindern das Entweichen der Flüssigkeit gefüllte Katheter im Tunnelbau.
- Befestigen Sie die Strömungssonden und die flüssigkeitsgefüllten Katheter mit nicht-resorbierbaren USP2-0 geflochtenen Seide (A0.3 mm) mittels einer Tabaksbeutelnaht an der Zwischenrippenmuskulatur. Das Nahtmaterial dient auch Luftverlust nach wieder eingesetzt negativen intrathorakalen Druck zu verhindern.
- Machen drei Einschnitte in der Haut von etwa 2 cm sinister und parallel zu der Wirbelsäule, ca. 3 cm inLänge 3 cm Abstand voneinander.
- Durchbohren einen Trokar unter dem linken Latissimus Muskel von rostral Einschnittstelle zu den Einschnitten auf der Rückseite. Tunnel die Strömungssonden und Flüssigkeit Katheter an der Rückseite in diesem Trokar.
- Legen Sie die Hähne auf den flüssigkeitsgefüllten Katheter und die Klemme entfernen. Ziehen Sie Blut zu entfernen Klumpen und Luftblasen und füllen Sie die mit Flüssigkeit gefüllte Katheter mit 1.000 IU / ml Heparin. Koronare Venenkatheter sollte mit 5000 IU / ml Heparin gefüllt.
- Schließen des Thorax
- Einen Einschnitt mit einer Länge von etwa 1,5 cm, 8 cm kaudal und parallel zum ersten Schnitt.
- Führen Sie den Ablauf aus der Pleurahöhle durch den sechsten Zwischenrippenmuskeln subkutan zu diesen Einschnitt mit einem großen gebogenen Moskitoklemme. Verbinden der Drain mit der Saugvorrichtung jegliches verbleibende Flüssigkeit zu entfernen und wieder einzusetzen Unterdruck in der Pleurahöhle beim Schließen des Thorax.
- Entlasten und aufblasendie Lunge mit einem endinspiratorische halten. Für ausreichende Füllung der Lunge durch visuelle Überwachung.
- Schließen Sie den Brustkorb durch die Rippen des vierten Zwischenrippenraum zusammen an zwei getrennten Standorten mit nicht-resorbierbaren USP6 geflochtenen Polyester ziehen (Ø0.8 mm).
- Schließen Sie die serratus Muskeln und großen Brustmuskel mit einer Laufstich und die Haut mit einer Lauf subkutikuläre Naht mit nicht-resorbierbaren USP2-0 geflochtenen Seide (A0.3 mm)
- Naht die Einschnitte auf der Rückenseite mit nicht resorbierbaren USP2-0 geflochtene Polyester (A0.3 mm) zwischen den Katheter. Zunächst macht einen Knoten direkt auf die Haut den Schnitt zu schließen, befestigen dann die Katheter in die Naht mit einem Knoten 1 cm von der Haut. Für die Strömungssonden verwenden, um ein resorbierbares geflochtenes USP2-0 Polyglactin (A0.3 mm) Fadenschneid des Nahtmaterials in den Strömungssondendraht (1) zu verhindern.
- Vorsichtig den Abfluss zu entfernen, während der Druck auf die Schädelseite Anwendung vonder Einschnitt Unterdruck in der Pleurahöhle zu halten. Schließen Sie den Einschnitt mit einer Tabaksbeutelnaht mit nicht-resorbierbaren USP2-0 geflochtenen Polyester (A0.3 mm) und verschließen die Wunde mit Vaseline.
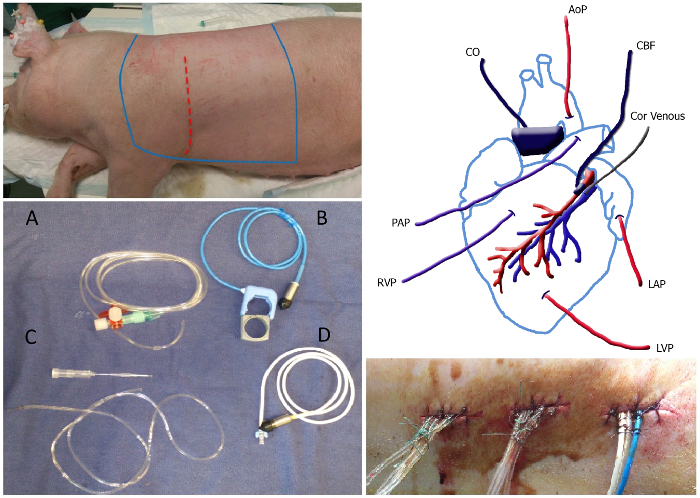
Abbildung 1. Übersicht über die Chirurgie Top linken Seite. Die Sterilbereich des Tieres, die rasiert werden und liegt zwischen den bleu Linien sterilisiert. Die Einschnittstelle wird als rot gestrichelte Linie dargestellt. Unten links Panel: Bild von Kathetern und Strömungssonden: flüssigkeitsgefüllte Katheter (A), der Aorta / Lungenströmungssonde mit Gummiband (B), koronaren Venenkatheter einschließlich 20 G-Nadel (C) und die koronare Fluss Sonde (D). Feld rechts oben: Schematische Darstellung der Platzierung der Katheter und Strömungssonden. MAP, den mittleren arteriellen Druck; Cor Venen, koronare Venenkatheter; LAP, linker Vorhofdruck; LVPlinksventrikulärer Druck; RVP, Rechtsherzdruck; PAP, Lungenarteriendrucks; CO, das Herzminutenvolumen; CBF, koronaren Blutflusses. Unten rechts Platte:. Getunnelte Katheter den Rücken gesichert mit einem Stich und einem Knoten bei etwa 1 cm Abstand entlang der Naht Verlassen Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
- Beendigung der Narkose und Erholung von der Operation
- Stopp Anästhesie, wenn alle Inzisionsstellen geschlossen sind.
- Liefern Analgesie durch Buprenorphin (0,015 mg / kg) im in den M. gracilis Verabreichung.
- Stoppen Sie die Lüftung, wenn das Tier atmet selbständig und ziehen Sie den Trachealtubus vom Beatmungsgerät. Überprüfen Sie regelmäßig, ob das Tier ausreichend atmet.
- Zeigen Gazekompressen zwischen Exteriorisation Stellen der Katheter Wundflüssigkeit zu absorbieren.
- Zum Schutz des externen segments der Katheter, dem Tier eine elastische Weste geben und die Katheter zwischen zwei Stücken aus Kunstlammfell verpacken.
- Entlüften des Ballons des Trachealtubus und extubieren, wenn das Tier seine Schluckreflex wiedererlangt.
- Analgesie bereitzustellen langfristig durch ein Fentanyl slow-release-Patch (12 & mgr; g / h für einen 20 kg Schwein; justieren Festigkeit nach Körpergewicht). Setzen Sie den Patch auf einem dünnen Teil der Haut (wie zB den Unterleib) angemessene Bereitstellung von Analgesie zu gewährleisten.
- Haus das Tier separat für den gesamten postoperativen Phase. Geben Sie eine Wärmelampe in der ersten Woche nach der Operation das Tier warm zu halten.
- Versorgen Sie genügend Flüssigkeit iv, wenn das Tier ist nicht unabhängig zu trinken.
- Reinigen Sie den flüssigkeitsgefüllten Katheter täglich, nach ersten Blutentnahme Blutgerinnsel zu entfernen, dann mit Kochsalzlösung Nachfüllen und schließlich mit heparinisierter Kochsalzlösung (1.000 - 5.000 IE / ml) die Bildung von Blutgerinnseln zu verhindern. Achten Sie darauf, keine Luft bubb ziehen lassenles während Spülen der Katheter.
- Verwalten Amoxicillin (25 mg / kg) iv täglich für 6 Tage nach der Operation postoperative Infektionen zu verhindern.
- Lassen Sie das Tier für eine Woche zu erholen, bevor die Laufband Experimente starten.
4. Laufband Experiment (Figur 2)
- Reinigen Sie den flüssigkeitsgefüllten Katheter, wie beschrieben (3.5.10) und bringen Sie die gespülten Kathetern zu den Druckwandlern. Messen der Rektaltemperatur in der Lage sein Temperatur korrigiert Blutgaswerte zu erhalten.
- Reinigen Sie den Druckwandler mit Kochsalzlösung zu verhindern, der Signale Blasen aufgrund von Luftdämpfung. Bringen Sie die Druckwandler an der elastischen Weste auf der Rückenseite.
- Schließen Sie die Druckwandler und Strömungssonden an den Verstärker. Starten Sie in dem Computerprogramm Messen und Kalibrieren der Druckwandler und Strömungssonden mit 0 mmHg in die Luft offen ist (und geschlossen zu Tier) und 100 mmHg ein Manometer verwenden.
- Schalten Sie den Dreiwegehahn in einer Weise, dass die Flüssigkeit Katheter eine offene Verbindung mit den Druckwandlern haben. Man beachte, dass der Blutdruck kann nun erhalten werden. Prüfsignale für Form und Amplitude (Abbildung 2).
- Falls erforderlich, eine Verbindung zu einem der Fluid Katheter zur Entnahme von gemischten venösen und arteriellen Blut eine Hilfslinie.
- Messen Sie die Hämodynamik, wenn das Tier ebenso liegt so ruhig auf dem Laufband stehen. Durchschnittliche Blutdrücke werden über einen Zeitraum von 10 Sekunden gemessen.
- Erhalten arteriellen und gemischt-venöse Blutproben von zunächst 5 ml Blut Abziehen eines 10 ml-Spritze, so dass 1 ml reines Blut kann unter Verwendung einer Heparin-1-ml-Spritze erhalten werden. Für den Herzkranz Blutproben wird ein 2-ml-Spritze anstelle der 10-ml-Spritze und Entnahme von 1 ml ist ausreichend zu erhalten, reines Blut verwendet.
- Halten Sie die versiegelte 1 ml Spritzen auf Eis vor der Verarbeitung der Blutproben mit einem Blutgasanalysegerät zur Bestimmungdie metabolische und Atmungszustand des Tieres.
- Betreff die Schweine auf einer fünfstufigen Trainingsprotokoll auf dem Laufband, 3 min pro Geschwindigkeit, 1 - 5 km / h (~ 85% der maximalen Herzfrequenz). Erhalten Hämodynamik und Blutgase nach 1,5 bis 2 min pro Geschwindigkeit auf jeder Geschwindigkeit wie in der Ruheposition.
- Nach der Übung Protokoll, um die Hähne schließen und prüfen, ob Drift in der 0 mmHg Kalibrierung stattgefunden hat, eine Notiz von dieser Kalibrierung machen. Entfernen Sie die Druckwandler der fluidgefüllten Katheter und die Strömungssonden trennen.
- Reinigen Sie den flüssigkeitsgefüllten Katheter mit Kochsalzlösung und Heparin (1000 - 5000 IU / ml). Schützen Sie die Katheter und Strömungssonden von ihnen unterhalb der elastischen Weste zwischen zwei Stücken aus Kunstlammfell bringen. Das Tier kann nun in seinen Käfig zurückgebracht werden.

Abbildung 2. Laufband Experiment. Linken Bereichls: Mit Instrumenten Schweine auf dem Laufband. Flüssigkeitsgefüllten Katheter sind mit den Druckwandlern, auf der Rückseite der Schweine platziert. Feld rechts oben: Übersicht der gesamten Versuchsaufbau, einschließlich Laufband, Verstärker und Aufnahme Computer. Unten rechts Platte: Typisches Beispiel der aufgezeichneten hämodynamische Daten. Von oben nach unten; Aortendruck (AOP, blau) und die linksventrikuläre Druck (LVP, rot); linksatrialen Druck (LAP, blau) und die linksventrikuläre Druck (rot); Lungenarteriendrucks (PAP, blau) und der rechten Herzkammer Druck (RVP, rot); Aortenfluß / Herzzeitvolumen (AoF, blau); koronaren Blutflusses (CBF, rot). Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
Ergebnisse
Übung bis zu 5 km / h führte zu einer Verdoppelung der Herzleistung von 4,3 ± 0,3 auf 8,5 ± 0,7 L / min, die hauptsächlich durch eine Erhöhung der Herzfrequenz von 137 ± 7-256 ± 8 Schlägen pro min in Kombination mit einem geführt wurde kleine Erhöhung des Schlagvolumens von 32 ± 2 bis 36 ± 3 ml (Abbildung 3). Die Erhöhung der Schlagvolumen wurde durch eine Zunahme der linksventrikulären Kontraktilität erleichtert, da durch eine Erhöhung des Maximums der ...
Diskussion
Die vorliegende Studie beschreibt die Operation für chronische Instrumentierung von Schweinen sowie das Protokoll über eine motorgetriebene Laufband die instrumentierte Schweine für die Ausübung während Hämodynamik und Entnahme von Blutproben zur Messung der Sauerstoffgehalt im arteriellen, venösen gemischt und koronare venöse Blut zu messen.
Kritische Schritte in dem Protokoll
Es gibt mehrere wichtige Schritte im Protokoll, das bereits bei der Intubation Verfahren zu starten....
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Studie wurde von Niederlande Heart Foundation Zuschuss unterstützt wurde 2000T038 (DJ Duncker) Zuschuss 2000T042 (D. Merkus), Europäische Kommission FP7-HEALTH-2010 Erteilung MEDIA-261409 (DJ Duncker und D. Merkus), Niederlande Cardiovascular Research Initiative: der niederländischen Herzstiftung, die niederländische Vereinigung für Universitätskliniken, der niederländischen Organisation für Gesundheitsforschung und -entwicklung und der Königlichen niederländischen Akademie der Wissenschaften CVON- ARENA CVON 2011-11 (DJ Duncker), CVON-PHAEDRA CVON2012-08 (D. Merkus) und CVON-RECONNECT CVON 2014-11 (DJ Duncker und D. Merkus), Sophia-Stiftung (bis D. de Wijs-Meijler, D. Merkus und IKM Reiss).
Materialien
| Name | Company | Catalog Number | Comments |
| 3-way stopcocks | B. Braun | 16496 | |
| Perfusor lines PVC (DEHP-free) 150 cm/2.6 ml | B. Braun | 8722960 | Used for fluid filled catheters |
| “python “ silicontubing | Rubber BV | 1757 ID 1 mm, OD 2 mm | Used for fluid filled catheters |
| Sodium Chloride 0.9% | Baxter | TKF7124 | |
| Glucose 10% | Baxter | WE0163 | |
| Suction device | |||
| Slim-Line electrosurgical pencil with 2 buttons | ERBE ELEKTROMEDIZIN GMBH | 20190-066 | |
| Servo Ventilator SV900C | Siemens-Elema AB | ||
| Laryngoscoop | Vererinary Technics Int. | 11.02.47 | |
| Sterile surgical gloves | |||
| tie-on surgical mask | 3M | 1818FS | |
| surgical hat | Klinidrape | 621301 | |
| Procedure pack | Molnlycke Health Care | 97027809 | Surgical drape, gauze pads, syringes, beaker etc |
| Droptears | Alcon | 288-28282-01 | |
| Betadine scrub 75 mg/ml Povidone-iodine | Meda Pharma BV | RVG08939 | |
| Betadine solution 100 mg/ml Povidone-iodine | Meda Pharma BV | RVG01331 | |
| Cuffed Endotracheal tube | Emdamed | size depends on animal size | |
| Breathing filter Hyrdo therm 3HME | Intersurgical | 1560000 | |
| Laryngoscope Handle+ Miller blade size 4 | Kawe Germany | ||
| Manual resuscitator- Combibag | Weinmann | 6515-12-313-5596 | |
| Perivascular flow probe 3PS | Transonic | For coronary artery; Size 2.5 - 4 mm depending on animal size | |
| Confidence flow probe | Transonic | For aorta/pulmonary artery, 16 - 20 mm; size depends on animal size | |
| Venflon-Venisystem 20 G x 32 mm | BD | 393224 | For coronary venous catheter |
| Blunt Needle 18 G | For coronary venous catheter | ||
| Tygon Tubing | Rubber BV | 2802 ID 0.8 mm (1/32’’), OD 2.4 mm (3/32’’) | For coronary venous catheter |
| Suction Handle 17 cm 6 6/8 " Coupland 18/8 martinit with tube connector | KLS Martin Group | 18-575-24 | |
| Scalple blade | |||
| Scalpel Handle 13.5 cm 5 3/8 " Stainless Steel solid | KLS Martin Group | 10-100-04 | |
| Vascular Forceps 20.2 cm 8 " De Bakey Stainless Stee | KLS Martin Group | 24-388-20 | ± 14 cm |
| Dressing Forceps 17 cm 6 6/8 " Cushing Stainless Steel | KLS Martin Group | 12-189-17 | ± 18 cm |
| halsted-musquito straight 12.5 cm - 5" | Rudolf Medical | RU-3100-13 | ± 12 cm |
| halsted-musquito curved 12.5 cm - 5" | Rudolf Medical | RU-3101-12 | ± 12 cm |
| Dissecting and Ligature Forceps 13 cm 5 1/8 " Gemini Stainless Steel | KLS Martin Group | 13-451-13 | ± 12 cm |
| Dissecting and Ligature Forceps 18.5 cm 7 2/8 " Schnidt Stainless Steel | KLS Martin Group | 13-363-18 | |
| Rib Retractor Finochietto, Baby Aluminium - | KLS Martin Group | 24-162-01 | |
| suture forceps Mayo-Hegar 3 mm 18 cm - 7" | Rudolf Medical | RU-6050-18 | |
| Metchenbaum blunt curved 14.5 cm - 5(3/4)" | Rudolf Medical | RU-1311-14M | |
| Retrector farabeuf 12 cm - 4 (3/4)" | Rudolf Medical | RU-4497-12 | |
| Towel forceps schrädel curved 9cm - 3,5" | Rudolf Medical | RU-3550-09 | |
| surgical scissors blunt 13 cm - 5" | Rudolf Medical | RU-1001-13 | |
| Gauzes Cutisoft 10 x 10 cm 4-ply | BSN Medical | 45846-00 | |
| Gauzes Cutisoft 5 x 5 cm 4-ply | BSN Medical | 45844-00 | |
| Flowmeter -CM2 / SF2 - 2gas (O2 and Air) | UNO BV | 180000008 | |
| Tec 7 Vaporizer | Datex-Ohmeda | ||
| Acederm wound spay | Ecuphar NV | ||
| Vaseline Album | Bufa | 165313 | |
| silkam 3-0 Natural silk, non-absorbable | B. Braun | F 1134043 | sutures for placement of catheters |
| silkam 2-0 Natural silk, non-absorbable | B. Braun | F 1134051 | sutures for muscular approximation |
| dagrofil 3-0 Polyester, non-absorbable | B. Braun | C 0842478 | sutures for fluid fille catheters after tunneling |
| Vicryl rapide 3-0, 1 x 45 cm FS2, V2930G | Daxtrio medische producten | 15560 | sutures for electrical catheters after tunneling |
| Vitafil 6 USP | SMI | 6080 | Ties |
| Syringes | 10 ml and 2.5 ml | ||
| Heparin LEO (heparin sodium) | LEO Pharma A/S | ||
| Zoletil | Virbac | tiletamine / zolazepam | |
| Sedazine | AST farma | 108855 | xylazine |
| Temgesic | RB Pharmaceuticals | 5429 | buprenorphine |
| Tensogrip | BSN Medical | 71522-00 | elastic vest |
Referenzen
- Laughlin, M. H., et al. Peripheral circulation. Compr Physiol. 2, 321-447 (2012).
- Datta, D., Normandin, E., ZuWallack, R. Cardiopulmonary exercise testing in the assessment of exertional dyspnea. Ann Thorac Med. 10, 77-86 (2015).
- Vatner, S. F., Braunwald, E. Cardiovascular control mechanisms in the conscious state. N Engl J Med. 293, 970-976 (1975).
- Duncker, D. J., Bache, R. J. Regulation of coronary blood flow during exercise. Physiol Rev. 88, 1009-1086 (2008).
- Tune, J. D., Gorman, M. W., Feigl, E. O. Matching coronary blood flow to myocardial oxygen consumption. J Appl Physiol. 97 (1985), 404-415 (2004).
- van den Heuvel, M., et al. Coronary microvascular dysfunction in a porcine model of early atherosclerosis and diabetes. Am J Physiol Heart Circ Physiol. 302, H85-H94 (2012).
- Zhou, Z., et al. Pulmonary vasoconstrictor influence of endothelin in exercising swine depends critically on phosphodiesterase 5 activity. Am J Physiol Lung Cell Mol Physiol. 306, L442-L452 (2014).
- Pereda, D., et al. Swine model of chronic postcapillary pulmonary hypertension with right ventricular remodeling: long-term characterization by cardiac catheterization, magnetic resonance, and pathology. J Cardiovasc Transl Res. 7, 494-506 (2014).
- Mercier, O., et al. Endothelin A receptor blockade improves regression of flow-induced pulmonary vasculopathy in piglets. J Thorac Cardiovasc Surg. 140, 677-683 (2010).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259, H218-H229 (1990).
- Yarbrough, W. M., Spinale, F. G. Large animal models of congestive heart failure: a critical step in translating basic observations into clinical applications. J Nucl Cardiol. 10, 77-86 (2003).
- Duncker, D. J., Stubenitsky, R., Verdouw, P. D. Autonomic control of vasomotion in the porcine coronary circulation during treadmill exercise: evidence for feed-forward beta-adrenergic control. Circ Res. 82, 1312-1322 (1998).
- Stubenitsky, R., Verdouw, P. D., Duncker, D. J. Autonomic control of cardiovascular performance and whole body O2 delivery and utilization in swine during treadmill exercise. Cardiovasc Res. 39, 459-474 (1998).
- Zhou, Z., et al. Phosphodiesterase-5 activity exerts a coronary vasoconstrictor influence in awake swine that is mediated in part via an increase in endothelin production. Am J Physiol Heart Circ Physiol. 306, H918-H927 (2014).
- Gross, D. R. . Animal Models in Cardiovascular Research. , (2009).
- Merkus, D., Duncker, D. J. Perspectives: Coronary microvascular dysfunction in post-infarct remodelled myocardium. Eur Heart J Suppl. 16, A74-A79 (2014).
- de Beer, V. J., de Graaff, H. J., Hoekstra, M., Duncker, D. J., Merkus, D. Integrated control of pulmonary vascular tone by endothelin and angiotensin II in exercising swine depends on gender. Am J Physiol Heart Circ Physiol. 298, H1976-H1985 (2010).
- Lautt, W. W. Resistance or conductance for expression of arterial vascular tone. Microvasc Res. 37, 230-236 (1989).
- Merkus, D., et al. Phosphodiesterase 5 inhibition-induced coronary vasodilation is reduced after myocardial infarction. Am J Physiol Heart Circ Physiol. 304, H1370-H1381 (2013).
- Heusch, G. The paradox of alpha-adrenergic coronary vasoconstriction revisited. J Mol Cell Card. 51, 16-23 (2011).
- Merkus, D., Houweling, B., van den Meiracker, A. H., Boomsma, F., Duncker, D. J. Contribution of endothelin to coronary vasomotor tone is abolished after myocardial infarction. Am J Physiol Heart Circ Physiol. 288, H871-H880 (2005).
- Haitsma, D. B., et al. Minimal impairment of myocardial blood flow responses to exercise in the remodeled left ventricle early after myocardial infarction, despite significant hemodynamic and neurohumoral alterations. Cardiovasc Res. 52, 417-428 (2001).
- Bender, S. B., van Houwelingen, M. J., Merkus, D., Duncker, D. J., Laughlin, M. H. Quantitative analysis of exercise-induced enhancement of early- and late-systolic retrograde coronary blood flow. J Appl Physiol. 108 (3), 507-514 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten