Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Хирургическое Размещение Катетеры для долгосрочного сердечно-сосудистой тестирования физических упражнений у свиней
В этой статье
Резюме
Here we present a protocol to assess cardiopulmonary function in awake swine, at rest and during graded treadmill exercise. Chronic instrumentation allows for repeated hemodynamic measurements uninfluenced by cardiodepressive anesthetic agents.
Аннотация
Этот протокол описывает хирургическую процедуру хронически приборной свиней и процедуры осуществлять свиней на приводом от двигателя беговой дорожке. Раннее сердечно дисфункция трудно диагностировать, особенно на животных моделях, а сердечно-функция часто измеряется Инвазивно, требуя анестезии. Как и многие анестетики являются кардиодепрессивное, тонкие изменения в сердечно-сосудистой функции могут быть замаскированы. В противоположность этому, хроническое приборы позволяет для измерения сердечной функции в бодрствующем состоянии, так что измерения могут быть получены в спокойных условиях покоя, без последствий анестезии и острой хирургической травмы. Кроме того, когда животные были должным образом подготовлены, измерения могут быть также получены в ходе градуированных беговой дорожке упражнения.
Зонды Flow размещены вокруг аорты или легочной артерии для измерения сердечного выброса и вокруг левой передней нисходящей коронарной артерии для измерения Coronичных кровоток. Заполненные жидкостью катетеры имплантирован в аорте, легочной артерии, левого предсердия, левого желудочка и правого желудочка для измерения давления и отбора проб крови. Кроме того, в 20 G катетер позиционируется в передней межжелудочковой вены, чтобы позволить коронарную венозный забор крови.
После недели восстановления, свиной размещены на приводом от двигателя беговой дорожке, катетеры соединены давления и расхода метров, и свиной подвергают пяти этапов протокола в прогрессивной тренировки, с каждой стадией прочного 3 мин. Гемодинамические сигналы непрерывно записываются и берут образцы крови в течение последних 30 сек каждого этапа тренировки.
Основным преимуществом изучения хронически Instrumented животных является то, что она позволяет серийный оценку сердечной функции, не только в состоянии покоя, но и при физической нагрузке, таких как упражнения. Кроме того, сердечно-функция может быть оценена повторно в течение развития заболевания ай во хроническом лечении, тем самым увеличивая статистическую мощность и, следовательно, ограничение количества животных, необходимых для исследования.
Введение
Адекватное сердечно функция имеет важное значение для снабжают организм кислородом и питательными веществами, особенно во условиях повышенной метаболической спроса, таких как во время физических упражнений 1. Сердечно ответ на упражнения характеризуется рядом адаптаций в сердечной функции, т.е.., Увеличение частоты сердечных сокращений, сократимость и ударный объем, и функции микрососудов, т.е. вазодилатации в сосудистых бассейнах снабжающих осуществляющих мышцы, а также в легких сосудистую и сужение сосудов в сосудистых бассейнах снабжающих желудочно-кишечного тракта, а также неактивные мышцы 1. Нарушение физической нагрузке является ранним признаком сердечно дисфункции, и сердечно-нагрузочное тестирование используется в качестве эффективного метода для разграничения между сердечной дисфункции, сосудистой дисфункции и / или легочной дисфункции у пациентов с нарушенной упражнений емкостью 2. Раннее сердечно дисфункция Difficult для диагностики, особенно в моделях на животных, а сердечно-функция часто измеряется Инвазивно, требуя анестезии, при этом многие анестетики, обладающие кардиодепрессивное свойства 3.
Хронический приборы позволяет для измерения сердечной функции в бодрствующем состоянии, и когда животные полностью адаптирована к измерениям лабораторных условиях могут быть получены в спокойных условиях покоя без последствий анестезии и острой хирургической травмы. Кроме того, когда животные были надлежащим образом обучены, измерения могут быть также получены в ходе градуированных беговой дорожке упражнения 4,5. Более конкретно, влево и вправо желудочковая функция может быть оценена и связанные с перфузии миокарда, а регулирование вазомоторный тонус в коронарном, системного и легочного микроциркуляции может быть определена. Использование заполненных жидкостью катетеров позволяет измерять давление, а также взятие проб крови без наложения объявлениеНАЯ нагрузка на животных. Другим преимуществом изучения хронически инструментованного животных является то, что сердечно-тестирование упражнение можно повторить позволяя использовать животного в качестве его собственного контроля, либо в процессе развития заболевания или при хроническом лечении, тем самым увеличивая статистическую мощность и, следовательно, ограничение количества животных, необходимых для исследования ,
Сердечно-анатомия свиней близко напоминает людям и можно индуцировать различные формы сердечно болезни, такие как диабет 6, инфаркта миокарда 7, легочной гипертензии 8,9 и стимуляции индуцированного сердечной недостаточности 10,11. Более того, размер свиней позволяет хроническую приборы и повторный отбор крови достаточном количестве, чтобы анализировать не только газов крови, но также и для выполнения измерений нейрогуморальные и / или для поиска биомаркеров болезни.
Этот протокол описывает операцию, используемую для хроническихLY инструментом свиной, а также протокол для осуществления свиней на приводом от двигателя беговой дорожке.
протокол
Процедуры, связанные с предметов животного были одобрены Комитетом Уход за животными в Erasmus Medical Center Rotterdam (NL) от. Свиной с весами от 6 до 80 кг были успешно инструментальной использованием этого протокола.
1. Адаптация животных к человеческому обращению
- После прибытия на объекте, размещения животных благотворно но дать им возможность взаимодействовать друг с другом.
- Accustomize свиней к человеческому воздействию и транспортировке от вивария в экспериментальной лаборатории, обрабатывая животное, по крайней мере один раз в день в течение одной недели.
- Поезд животных соответствующим для экспериментов упражнений на приводом от двигателя беговой дорожке, осуществляя их на беговой дорожке в течение как минимум в три раза до операции.
- Животные должны быть постился O / N до операции, чтобы предотвратить тошноту, рвоту и тем самым потенциал Применение жидкостей желудка.
2. Подготовка к хирургии
- успокоение
- Подготовьте лекарства для седации в шприц объемом 10 мл. Премедикация состоит из tiletamine / zolazepam (5 мг / кг), ксилазина, (2.25 мг / кг) и атропин (1 мг).
- Вводят лекарства внутримышечно в трапециевидной мышцы с 19 г 1,5 '' иглы степенный свинью.
- Подождите примерно 10 минут и проверьте мышечной релаксации и бессознательного, чтобы подтвердить надлежащее и стабильный уровень седации.
- Поместите 20 г периферических безопасности катетер в ушную вену для последующего внутривенного введения анестезии и / или жидкостей.
- Интубации и вентиляции
- Место животное на столе и / или тележки в положении лежа на спине.
- Откройте рот животного при пероральном распределителю.
- В случае недостаточной релаксации челюстей или присутствии глотательные рефлексы, которые препятствуют интубации, администрирование тиопентал (10 мг / кг) внутривенно через ушную вену катетер. Альтернативно, свинья может быть замаскированс изофлуран для индукции седативный эффект.
- Используйте обычный ларингоскоп с осветительным устройством и специальными лезвия Miller, чтобы позволить laryngoscopist напрямую просматривать гортань. Если есть ларингоспазм, применяются 2% лидокаин с связок и гортани, чтобы уменьшить спазмы и позволяют интубации.
- Вставка интубирование стилет в интубационной трубке, чтобы сделать трубу соответствовать лучше верхней анатомии дыхательных путей и передать трубку через рот и между голосовых связок в трахею.
- Раздуть баллон манжеты с 10 мл шприц, чтобы помочь закрепить ее на месте, чтобы предотвратить утечку дыхательных газов, а также для защиты дыхательных путей от возможного стремления желудка жидкости.
- Подключите трубку к дыхание фильтра (тепла и влаги теплообменник) и механической вентиляции легких.
- Место животное на правом боку на операционном столе.
- Для достижения уровня РО2 100-120 мм рт.ст., вентилировать животное смесью кислорода и азота (1: 2 об / об), USINг следующие настройки вентилятора: режим управления давлением: положительное давление в конце выдоха (ПДКВ) 4 КМЗ 2 O; пиковое давление на вдохе 16 - 18 КМЗ 2 O; частота дыхания в зависимости от размера животного (на 20 кг животного в, уменьшить частоту, с увеличением массы тела), это должно привести к дыхательным объемом ~ 10 мл / кг, контролировать вентиляцию с капнографией.
- Монитор температуры с помощью ректального термометра и поддерживать температуру между 37 - 39 ° С с использованием тепла лампы или тепла мат. Кроме того, мониторинг частоты сердечных сокращений с ЭКГ.
- анестезия
- Вызвать и поддерживать анестезию предпочтительно путем добавления 2,0% изофлуран (об / об) к вентиляционной газовой смеси или, альтернативно путем внутривенного введения фентанила (10 мкг / кг / ч) через ушную вену катетер.
- Проверьте адекватной глубины анестезии путем тестирования боли рефлексы с задних ног пальца щепоткой перед началом операции. При необходимости добавьтеДополнительное обезболивание или ждать в течение нескольких минут. Проверьте болевые рефлексы регулярно в течение хирургии.
- Жидкости и антибиотики
- Администрирование первая доза амоксициллина (25 мг / кг) внутривенно через ушную вену катетер.
- Подключение системы переливания в ушную вену катетер, чтобы позволить медленной инфузии глюкозы 10% (500 мл) во время операции.
- Стерилизация хирургического участка
- Бритье и протереть кожу животного на площади примерно 25 см в ширину от позвоночного столба на всем пути до левого подмышечной.
- Скраб увлажненной кожи с повидон-йода скраб (75 мг / мл) в течение примерно 5 минут.
- Извлеките повидон-йода мыло с кожи влажной стерильных сеток, Перед стерилизацией кожу повидон-йода лосьона (100 мг / мл).
- Накройте животное стерильным хирургических простыней для снижения бактериальной передачи и последующего загрязнения места операции.
3. Хирургическое
- Открытие грудной клетки (Thoracotomy)
- Сделайте надрез в коже, начиная с 1 см каудально к левой нижней углу лопатки вниз к левому подмышечной (Рисунок 1). Используйте диатермию прижигать кровеносные сосуды в коже, чтобы предотвратить чрезмерное кровотечение.
- Разрезать на зубчатой мышцы и грудной мышцей, используя режущую модальность диатермией. Кроме того, использование диатермию прижигать кровеносные сосуды в мышечный слой, чтобы предотвратить чрезмерное кровотечение.
- Используйте тупым тщательно разделить межреберной мышцы четвертом левом межреберье с зажимом комаров. Теперь костальное поверхность левого легкого, покрытого висцеральных и париетальных плевры должна подвергаться воздействию.
- Чтобы войти в плевральную полость, тщательно проколоть оба слоя плевры и разорвать их открытыми.
- Используйте грудной втягивающим отделить края раны, а также ребер и насильно водить тканейкроме получения правильной экспозиции плевральной полости.
- Оттолкнуть левое легкое в каудальном направлении и держать его на месте с мокрым марли. Теперь сердце и крупные сосуды должны быть четко подвергается.
- Размещение Катетеры и зонды расхода (Рисунок 1)
- Используйте тупым удалить ~ 2 см 2 окружающей соединительной ткани нисходящей грудной аорты.
- Выполните кошелек-строку шов, состоящий из трех строчек, в стенке аорты с нерассасывающегося USP3-0 плетеные шелковой нити (Ø0.2 мм).
- Проникают в стенку аорты сосудов с нержавеющей стали 16 G иглу в середине кошелек-струнной шва.
- Вставьте кончик катетера, заполненного жидкостью (до кольца) в аорте, вытащить кошелек-строку шов прочно скрепленных между собой и связать две строки шва.
- Чтобы сохранить катетер на месте, ветер шовного 3 раза вокруг катетера над кольцом и снова тт.е. две строки шва. Далее закрепить катетер с новой строчки примерно на 1 см черепной из установочной месте.
- Подключение катетер заполненный жидкостью с калиброванным датчиком давления, который соединен с компьютером, чтобы следить за среднее артериальное давление во время операции. Получить артериальное газов крови, чтобы проверить или отрегулировать для правильных настроек вентиляции.
- Откройте перикарда с перечеркнутой разреза. Учтите, чтобы держать диафрагмального нерва, который работает по перикарда неповрежденной.
- Определить легочную артерию и поднимите их слегка в каудальном направлении с втягивающим фарабеф. Теперь восходящей аорты и дуги аорты должны подвергаться. Монитор среднее артериальное давление во время втягивания легочную артерию.
- Сделать небольшой надрез (~ 1 см) в соединительной ткани между восходящей аортой и легочной артерией, используя Metzenbaum ножницы, чтобы иметь возможность анализировать либо восходящую аорту или легочную артерию с большой изогнутыйкомаров зажим, чтобы поместить зонд потока.
- Установите резиновую ленту зонда потока вокруг судна. Для облегчения этой задачи, место шва через один конец резиновой ленты, поместите этот шов вокруг судна и вытащить его, пока резинка не окружает судно.
- Закрепить устройство измерительного зонда потока на резинке. Подключите датчик расхода к компьютеру и проверить сердечную выходной сигнал на компьютере, чтобы подтвердить правильное размещение зонда потока.
- Поместите заполненные жидкостью катетеры в легочной артерии, правый желудочек, левый желудочек и левое предсердие в то же образом, как описано для катетеру аорты заполненной жидкостью (3.2.2 - 3.2.5). Обратите внимание, что это не нужно снимать соединительную ткань перед выполнением кошелек-строку шва в этих структурах.
- Expose и анализировать проксимальной части левой передней нисходящей коронарной артерии сначала поднимая ткань с пинцетом и, сделав небольшой (2 - 3 мм) разрезают ножницами MetzenbaumС последующим тщательно дразнить ткани от артерии с помощью ватного тампона. Обеспечить полную рассечение коронарной артерии путем пропускания небольшой прямой наклонный зажим комаров внизу.
- Делают стежка, параллельную передней межжелудочковой коронарной вены с швом, который соединен с ишемической венозного катетера.
- Прокол коронарной вены с 20 г иглу коронарной венозного катетера и вставки канюли катетера внутривенно.
- Удалите иглу и закрепить катетер с уже выполненной стежком (3.2.14). Далее закрепить катетер с новой строчки примерно 1см от места первоначального прокола.
- Поместите зонд коронарного кровотока вокруг ранее рассеченной левой передней нисходящей коронарной артерии. Когда артерии стягивается и едва заметен, использовать лидокаин 10% спрей для отдыха судно, чтобы получить лучшее воздействие на судне. Проверьте сигнал коронарного потока на компьютере, чтобы ConfIRM правильного размещения зонда потока (рисунок 2).
- туннелирование
- Туннель зонды потока индивидуально через третью левой межреберье под мышцей и над ребром, используя большой изогнутый зажим комаров.
- Туннель заполненные жидкостью катетеры через либо третьей или пятой левой межреберье путем прокалывания межреберной мышцы. Зажим от заполненных жидкостью катетеров и удалить трехходовой кран, чтобы минимизировать площадь пронзительный и предотвратить утечку заполненных жидкостью катетеров во время туннелирования.
- Закрепить зондов потока и заполненные жидкостью катетеры с нерассасывающегося USP2-0 плетеной шелка (Ø0.3 мм) с помощью кошелька струн шва на межреберной мышцы. Это шов также служит для предотвращения утечки воздуха после повторного замещение негативное внутригрудного давления.
- Сделайте три надреза в коже примерно на 2 см зловещие и параллельно позвоночнику, примерно 3 см вДлина 3 см друг от друга друг от друга.
- Проколоть троакар под левой широчайшей мышцы спины от ростральной месте разреза на разрезы на спине. Туннель зонды потока и жидкости катетеры в спину в этом троакар.
- Поместите краны на заполненных жидкостью катетеров и снять хомут. Вывод кровь, чтобы удалить сгустки и пузырьки воздуха и заполнить заполненные жидкостью катетеры с 1000 МЕ / мл гепарина. Коронарные венозные катетеры должны быть заполнены 5000 МЕ / мл гепарина.
- Закрытие грудной клетки
- Сделать надрез длиной примерно 1,5 см, 8 см каудально и параллельно первой разрез.
- Свинец в канализацию из плевральной полости через шестой межреберных мышц подкожно этот разрез с большим изогнутым зажимом комаров. Подключите дренажа всасывающего устройства для удаления остатков жидкости и восстановить отрицательное давление в плевральной полости во время закрытия грудной клетки.
- Сбросьте и раздуватьлегких на конец вдоха удержание. Обеспечить достаточную заполнение легких при визуальном мониторинге.
- Закройте грудную клетку, потянув за ребра четвертом межреберье вместе на двух отдельных участках с нерассасывающегося USP6 плетеной полиэфира (Ø0.8 мм).
- Закройте зубчатой мышцы и грудная мышца с управлением строчки и кожи с управлением субкутикулярных шва с использованием нерассасывающегося USP2-0 плетеный шелк (Ø0.3 мм)
- Шовный надрезы на спинной стороне с нерассасывающегося USP2-0 плетеной полиэфира (Ø0.3 мм) между катетеров. Во-первых связать узел непосредственно на кожу, чтобы закрыть разрез, затем фиксируют катетеры для шовного материала с узлом 1 см от кожи. Для зондов потока, использовать рассасывающиеся USP2-0 плетеный полиглактином (Ø0.3 мм) шва, чтобы предотвратить вырубку шва в зонда потока проволоки (рис 1).
- Осторожно снимите слив, прилагая давление на краниальной сторонеразрез для поддержания отрицательного давления в плевральной полости. Закрыть разрез с кисетный шов с использованием нерассасывающегося USP2-0 плетеный полиэстер (Ø0.3 мм) и запечатать рану вазелином.
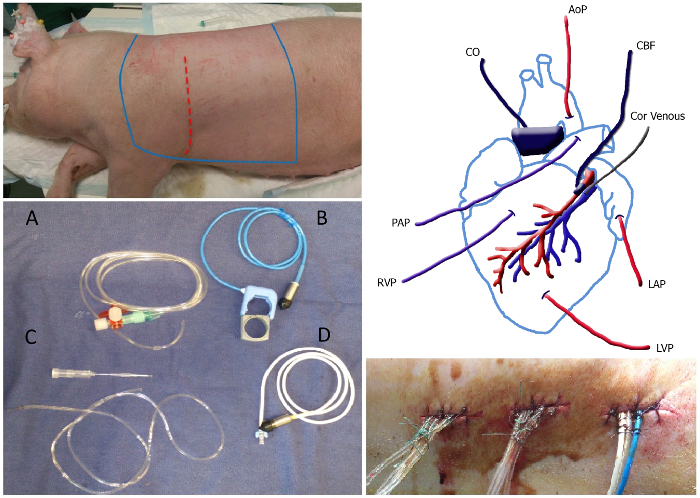
Рисунок 1. Обзор хирургии левой верхней части экрана:. Стерильной зоне животного, которое должно быть бритой и стерилизуют лежит между Bleu линий. Место разреза изображен как красной пунктирной линией. Нижняя левая панель: Изображение катетеров и зондов потока: заполненный жидкостью катетер (а), аорты / зонда легочной потока включая резинкой (B), ишемическая венозный катетер включая 20 G иглы (C) и зондом коронарного кровотока (D). Вверху справа панели: Схема размещения катетеров и зондов потока. MAP, среднее артериальное давление; Кор венозной, ишемическая венозный катетер; LAP, давления в левом предсердии; ППЖдавления в левом желудочке; РВП, право давление в желудочке; PAP, давление в легочной артерии; CO, сердечный выброс; CBF, коронарный кровоток. Внизу справа панели:. Туннелированная катетеры, выходящие спину крепится с стежка и узлом примерно 1 см расстояния вдоль шва Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
- Прекращение анестезии и восстановления после операции
- Остановка анестезии, когда все сайты разреза закрыты.
- Обеспечить обезболивание путем введения бупренорфина (0,015 мг / кг) им в тонкая мышца.
- Остановить вентиляцию, когда животное независимо дыхания и отсоедините трахеи трубку от вентилятора. Регулярно проверяйте, если животное достаточно дыхание.
- Поместите марлевые тампоны между экстериоризации участков катетеров поглощать жидкость из раны.
- Чтобы защитить внешний SEgments катетеров, дать животному эластичный жилет и упаковать катетеры между двумя кусками искусственного овчины.
- Дефлятируем шарик с интубационной трубки и экстубации, когда животное восстанавливает свою глотательный рефлекс.
- Обеспечить долгосрочную анальгезию с помощью медленного высвобождения пластыря фентанила (12 мкг / ч в течение 20 кг свиньи в; отрегулировать силу в соответствии с веса). Поместите пятно на тонком участке кожи (например, нижней части живота), чтобы обеспечить надлежащую доставку обезболивания.
- Дом животное отдельно для всей послеоперационном периоде. Обеспечить нагревательную лампу в течение первой недели после операции, чтобы сохранить животный тепло.
- Поставлять достаточно инфузионную терапию, если животное не пьет самостоятельно.
- Флеш заполненные жидкостью катетеры ежедневно, сначала снятия кровь, чтобы удалить сгустки, то заправка физиологическим раствором и, наконец, с гепаринизированной физиологического раствора (1,000 - 5,000 МЕ / мл), чтобы предотвратить образование сгустков крови. Заботьтесь, чтобы не вдохнуть весь воздух Bubbле при промывке катетеров.
- Администрирование амоксициллин (25 мг / кг) IV ежедневно в течение 6 дней после операции, чтобы предотвратить послеоперационные инфекции.
- Разрешить животное, чтобы восстановить в течение одной недели перед началом экспериментов беговой дорожке.
4. Беговая дорожка Эксперимент (рисунок 2)
- Флеш заполненные жидкостью катетеры, как описано (3.5.10) и приложить раскрасневшиеся катетеров с датчиками давления. Измерьте ректальную температуру, чтобы иметь возможность получить коррекцией температуры значения газов крови.
- Флеш датчики давления с физиологическим раствором, чтобы предотвратить затухание сигналов из-за воздушных пузырьков. Прикрепите датчики давления в упругой жилет на спинной стороне.
- Подключите датчики давления и зонды потока к усилителю. Начало измерения в компьютерной программе и калибровки датчиков давления и датчиков расхода с 0 мм рт.ст. быть открытым для воздуха (и закрыта для животного) и 100 мм рт.ст. с помощью манометра. Переключатель трехпозиционный кран таким образом, что жидкость катетеры имеют открытую связь с датчиками давления. Следует отметить, что давление крови в настоящее время могут быть получены. Проверьте сигналы для формы и амплитуды (рис 2).
- При необходимости, подключить дополнительный линию к любому из жидкости катетеров для отбора проб смешанной венозной и артериальной крови.
- Измерьте гемодинамики, когда животное лежит, а также стоя спокойно на беговой дорожке. Средние давление крови измеряется в течение периода времени от 10 сек.
- Получить артериальное и смешанной венозной образцы крови сначала снятия 5 мл крови с использованием 10-мл шприц так, чтобы 1 мл чистой крови может быть получена с использованием гепаринизированной 1 мл шприц. Для коронарных венозных пробах крови, в 2 мл шприц используется вместо 10 мл шприц и вывода 1 мл достаточна для получения чистого кровь.
- Хранить запечатанные 1 мл шприцы на льду перед обработкой образцов крови с помощью анализатора газов крови, чтобы определить,метаболический и вентиляторной состояние животного.
- Тема свиней к протоколу упражнений в пяти этапов на беговой дорожке, 3 мин на скорости, 1 - 5 км / ч (~ 85% максимальной частоты сердечных сокращений). Получить гемодинамики и газов крови через 1,5 - 2 мин на скорости на каждой скорости, как в состоянии покоя.
- После протокола упражнений закрыть краны и проверить, если дрейф произошло в калибровке 0 мм рт.ст., запишите этой калибровки. Удалить датчики давления жидкости заполнены катетеров и отсоедините щупы потока.
- Флеш заполненные жидкостью катетеры физиологическим раствором и гепарином (1000 - 5000 МЕ / мл). Защита катетеры и зонды потока, поместив их под упругой жилет между двумя кусками искусственного овчины. Животное может теперь быть возвращен в его клетке.

Рисунок 2. Беговая дорожка Эксперимент. Левая панельлс Instrumented свиней на беговой дорожке. Заполненной жидкостью катетеры соединяются с датчиками давления, которые размещены на задней части свиньи. Вверху справа панели: Обзор общей экспериментальной установки, в том числе на беговой дорожке, усилителем и записи компьютера. Нижняя правая панель: Типичный пример записываемые гемодинамические данных. Сверху вниз; Давление в аорте (AOP, синий) и давление в левом желудочке (LVP, красный); давления в левом предсердии (LAP, синий) и давления в левом желудочке (красный); давление в легочной артерии (РАР, синий) и правый давление в желудочке (РВП, красный); аорты поток / сердечный выброс (АОП, синий); коронарный кровоток (CBF, красный). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуре.
Результаты
Осуществление до 5 км / час привело к удвоению сердечного выброса от 4,3 ± 0,3 до 8,5 ± 0,7 л / мин, который был главным проделанной увеличению частоты сердечных сокращений от 137 ± 7 256 ± 8 ударов в мин в комбинации с небольшое увеличение ударного объема с 32 ± 2 до 36 ± 3 мл (рисун?...
Обсуждение
Настоящее исследование описывает операцию по хроническим аппаратуры свиней, а также протокол для осуществления инструментальным свиней на приводом от двигателя беговой дорожке при измерении гемодинамики и взятия проб крови для измерения содержания кислорода в артериальной, смешан?...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Это исследование было поддержано Нидерланды сердца гранта Фонда 2000T038 (к DJ Дункер) гранта 2000T042 (Д. Merkus), Европейская комиссия FP7-здоровье-2010 грант МЕДИА-261409 (с DJ Дункер и Д. Merkus), Нидерланды инициативы сердечно-сосудистых исследований: голландский Heart Foundation, голландский Федерации университетских медицинских центрах, Нидерландская организация по исследованиям в области здравоохранения и развития и Королевства Нидерландов академии наук CVON- АРЕНА CVON 2011-11 (с DJ Дункер), CVON-Федра CVON2012-08 (к Д. Merkus) и CVON-RECONNECT CVON 2014-11 (с DJ Дункер и Д. Merkus), София фонда (Д. де Wijs-Meijler, Д. Merkus и ИКМ Reiss).
Материалы
| Name | Company | Catalog Number | Comments |
| 3-way stopcocks | B. Braun | 16496 | |
| Perfusor lines PVC (DEHP-free) 150 cm/2.6 ml | B. Braun | 8722960 | Used for fluid filled catheters |
| “python “ silicontubing | Rubber BV | 1757 ID 1 mm, OD 2 mm | Used for fluid filled catheters |
| Sodium Chloride 0.9% | Baxter | TKF7124 | |
| Glucose 10% | Baxter | WE0163 | |
| Suction device | |||
| Slim-Line electrosurgical pencil with 2 buttons | ERBE ELEKTROMEDIZIN GMBH | 20190-066 | |
| Servo Ventilator SV900C | Siemens-Elema AB | ||
| Laryngoscoop | Vererinary Technics Int. | 11.02.47 | |
| Sterile surgical gloves | |||
| tie-on surgical mask | 3M | 1818FS | |
| surgical hat | Klinidrape | 621301 | |
| Procedure pack | Molnlycke Health Care | 97027809 | Surgical drape, gauze pads, syringes, beaker etc |
| Droptears | Alcon | 288-28282-01 | |
| Betadine scrub 75 mg/ml Povidone-iodine | Meda Pharma BV | RVG08939 | |
| Betadine solution 100 mg/ml Povidone-iodine | Meda Pharma BV | RVG01331 | |
| Cuffed Endotracheal tube | Emdamed | size depends on animal size | |
| Breathing filter Hyrdo therm 3HME | Intersurgical | 1560000 | |
| Laryngoscope Handle+ Miller blade size 4 | Kawe Germany | ||
| Manual resuscitator- Combibag | Weinmann | 6515-12-313-5596 | |
| Perivascular flow probe 3PS | Transonic | For coronary artery; Size 2.5 - 4 mm depending on animal size | |
| Confidence flow probe | Transonic | For aorta/pulmonary artery, 16 - 20 mm; size depends on animal size | |
| Venflon-Venisystem 20 G x 32 mm | BD | 393224 | For coronary venous catheter |
| Blunt Needle 18 G | For coronary venous catheter | ||
| Tygon Tubing | Rubber BV | 2802 ID 0.8 mm (1/32’’), OD 2.4 mm (3/32’’) | For coronary venous catheter |
| Suction Handle 17 cm 6 6/8 " Coupland 18/8 martinit with tube connector | KLS Martin Group | 18-575-24 | |
| Scalple blade | |||
| Scalpel Handle 13.5 cm 5 3/8 " Stainless Steel solid | KLS Martin Group | 10-100-04 | |
| Vascular Forceps 20.2 cm 8 " De Bakey Stainless Stee | KLS Martin Group | 24-388-20 | ± 14 cm |
| Dressing Forceps 17 cm 6 6/8 " Cushing Stainless Steel | KLS Martin Group | 12-189-17 | ± 18 cm |
| halsted-musquito straight 12.5 cm - 5" | Rudolf Medical | RU-3100-13 | ± 12 cm |
| halsted-musquito curved 12.5 cm - 5" | Rudolf Medical | RU-3101-12 | ± 12 cm |
| Dissecting and Ligature Forceps 13 cm 5 1/8 " Gemini Stainless Steel | KLS Martin Group | 13-451-13 | ± 12 cm |
| Dissecting and Ligature Forceps 18.5 cm 7 2/8 " Schnidt Stainless Steel | KLS Martin Group | 13-363-18 | |
| Rib Retractor Finochietto, Baby Aluminium - | KLS Martin Group | 24-162-01 | |
| suture forceps Mayo-Hegar 3 mm 18 cm - 7" | Rudolf Medical | RU-6050-18 | |
| Metchenbaum blunt curved 14.5 cm - 5(3/4)" | Rudolf Medical | RU-1311-14M | |
| Retrector farabeuf 12 cm - 4 (3/4)" | Rudolf Medical | RU-4497-12 | |
| Towel forceps schrädel curved 9cm - 3,5" | Rudolf Medical | RU-3550-09 | |
| surgical scissors blunt 13 cm - 5" | Rudolf Medical | RU-1001-13 | |
| Gauzes Cutisoft 10 x 10 cm 4-ply | BSN Medical | 45846-00 | |
| Gauzes Cutisoft 5 x 5 cm 4-ply | BSN Medical | 45844-00 | |
| Flowmeter -CM2 / SF2 - 2gas (O2 and Air) | UNO BV | 180000008 | |
| Tec 7 Vaporizer | Datex-Ohmeda | ||
| Acederm wound spay | Ecuphar NV | ||
| Vaseline Album | Bufa | 165313 | |
| silkam 3-0 Natural silk, non-absorbable | B. Braun | F 1134043 | sutures for placement of catheters |
| silkam 2-0 Natural silk, non-absorbable | B. Braun | F 1134051 | sutures for muscular approximation |
| dagrofil 3-0 Polyester, non-absorbable | B. Braun | C 0842478 | sutures for fluid fille catheters after tunneling |
| Vicryl rapide 3-0, 1 x 45 cm FS2, V2930G | Daxtrio medische producten | 15560 | sutures for electrical catheters after tunneling |
| Vitafil 6 USP | SMI | 6080 | Ties |
| Syringes | 10 ml and 2.5 ml | ||
| Heparin LEO (heparin sodium) | LEO Pharma A/S | ||
| Zoletil | Virbac | tiletamine / zolazepam | |
| Sedazine | AST farma | 108855 | xylazine |
| Temgesic | RB Pharmaceuticals | 5429 | buprenorphine |
| Tensogrip | BSN Medical | 71522-00 | elastic vest |
Ссылки
- Laughlin, M. H., et al. Peripheral circulation. Compr Physiol. 2, 321-447 (2012).
- Datta, D., Normandin, E., ZuWallack, R. Cardiopulmonary exercise testing in the assessment of exertional dyspnea. Ann Thorac Med. 10, 77-86 (2015).
- Vatner, S. F., Braunwald, E. Cardiovascular control mechanisms in the conscious state. N Engl J Med. 293, 970-976 (1975).
- Duncker, D. J., Bache, R. J. Regulation of coronary blood flow during exercise. Physiol Rev. 88, 1009-1086 (2008).
- Tune, J. D., Gorman, M. W., Feigl, E. O. Matching coronary blood flow to myocardial oxygen consumption. J Appl Physiol. 97 (1985), 404-415 (2004).
- van den Heuvel, M., et al. Coronary microvascular dysfunction in a porcine model of early atherosclerosis and diabetes. Am J Physiol Heart Circ Physiol. 302, H85-H94 (2012).
- Zhou, Z., et al. Pulmonary vasoconstrictor influence of endothelin in exercising swine depends critically on phosphodiesterase 5 activity. Am J Physiol Lung Cell Mol Physiol. 306, L442-L452 (2014).
- Pereda, D., et al. Swine model of chronic postcapillary pulmonary hypertension with right ventricular remodeling: long-term characterization by cardiac catheterization, magnetic resonance, and pathology. J Cardiovasc Transl Res. 7, 494-506 (2014).
- Mercier, O., et al. Endothelin A receptor blockade improves regression of flow-induced pulmonary vasculopathy in piglets. J Thorac Cardiovasc Surg. 140, 677-683 (2010).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259, H218-H229 (1990).
- Yarbrough, W. M., Spinale, F. G. Large animal models of congestive heart failure: a critical step in translating basic observations into clinical applications. J Nucl Cardiol. 10, 77-86 (2003).
- Duncker, D. J., Stubenitsky, R., Verdouw, P. D. Autonomic control of vasomotion in the porcine coronary circulation during treadmill exercise: evidence for feed-forward beta-adrenergic control. Circ Res. 82, 1312-1322 (1998).
- Stubenitsky, R., Verdouw, P. D., Duncker, D. J. Autonomic control of cardiovascular performance and whole body O2 delivery and utilization in swine during treadmill exercise. Cardiovasc Res. 39, 459-474 (1998).
- Zhou, Z., et al. Phosphodiesterase-5 activity exerts a coronary vasoconstrictor influence in awake swine that is mediated in part via an increase in endothelin production. Am J Physiol Heart Circ Physiol. 306, H918-H927 (2014).
- Gross, D. R. . Animal Models in Cardiovascular Research. , (2009).
- Merkus, D., Duncker, D. J. Perspectives: Coronary microvascular dysfunction in post-infarct remodelled myocardium. Eur Heart J Suppl. 16, A74-A79 (2014).
- de Beer, V. J., de Graaff, H. J., Hoekstra, M., Duncker, D. J., Merkus, D. Integrated control of pulmonary vascular tone by endothelin and angiotensin II in exercising swine depends on gender. Am J Physiol Heart Circ Physiol. 298, H1976-H1985 (2010).
- Lautt, W. W. Resistance or conductance for expression of arterial vascular tone. Microvasc Res. 37, 230-236 (1989).
- Merkus, D., et al. Phosphodiesterase 5 inhibition-induced coronary vasodilation is reduced after myocardial infarction. Am J Physiol Heart Circ Physiol. 304, H1370-H1381 (2013).
- Heusch, G. The paradox of alpha-adrenergic coronary vasoconstriction revisited. J Mol Cell Card. 51, 16-23 (2011).
- Merkus, D., Houweling, B., van den Meiracker, A. H., Boomsma, F., Duncker, D. J. Contribution of endothelin to coronary vasomotor tone is abolished after myocardial infarction. Am J Physiol Heart Circ Physiol. 288, H871-H880 (2005).
- Haitsma, D. B., et al. Minimal impairment of myocardial blood flow responses to exercise in the remodeled left ventricle early after myocardial infarction, despite significant hemodynamic and neurohumoral alterations. Cardiovasc Res. 52, 417-428 (2001).
- Bender, S. B., van Houwelingen, M. J., Merkus, D., Duncker, D. J., Laughlin, M. H. Quantitative analysis of exercise-induced enhancement of early- and late-systolic retrograde coronary blood flow. J Appl Physiol. 108 (3), 507-514 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены