É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cirurgia de colocação de cateteres para Cardiovascular Testes exercício de longo prazo em Suínos
Neste Artigo
Resumo
Here we present a protocol to assess cardiopulmonary function in awake swine, at rest and during graded treadmill exercise. Chronic instrumentation allows for repeated hemodynamic measurements uninfluenced by cardiodepressive anesthetic agents.
Resumo
Este protocolo descreve o procedimento cirúrgico para suínos instrumento cronicamente eo procedimento para exercer suína em uma escada rolante motorizado. disfunção cardiopulmonar precoce é difícil de diagnosticar, especialmente em modelos animais, como função cardiopulmonar é frequentemente medida invasiva, exigindo anestesia. Como muitos agentes anestésicos são cardiodepressive, mudanças sutis na função cardiovascular pode ser mascarada. Em contraste, a instrumentação permite que crónica para medição da função cardiopulmonar no estado de vigília, de modo que as medições possam ser obtidas sob condições de repouso tranquilas, sem os efeitos da anestesia e trauma cirúrgico aguda. Além disso, quando os animais são adequadamente treinados, as medições podem também ser obtidos durante graduada exercício em esteira.
sondas de fluxo são colocados ao redor da aorta ou artéria pulmonar, para a medição do débito cardíaco e ao redor da artéria descendente anterior coronária para a medição de coronfluxo sanguíneo ary. cateteres cheios de fluido são implantados na aorta, artéria pulmonar, átrio esquerdo, ventrículo esquerdo e do ventrículo direito para medição de pressão e recolha de amostras de sangue. Além disso, um cateter de 20 G está posicionado na veia interventricular anterior para permitir amostragem de sangue venoso coronário.
Após uma semana de recuperação, suína são colocados em uma escada rolante com motor, os cateteres são conectados aos medidores de pressão e fluxo, e os suínos são submetidos a um de cinco estágios protocolo de exercício progressivo, com cada estágio com duração de 3 min. sinais hemodinâmicos são continuamente gravadas e amostras de sangue são tomadas durante os últimos 30 segundos de cada estágio de exercício.
A principal vantagem de estudar animais cronicamente instrumentadas é que ele permite a avaliação de série da função cardiopulmonar, não só em repouso, mas também durante o esforço físico, tais como exercício. Além disso, a função cardiopulmonar pode ser avaliada repetidamente durante a doença o desenvolvimento de umaND durante o tratamento crónico, aumentando, assim, poder estatístico e, consequentemente, limitar o número de animais necessários para um estudo.
Introdução
Função cardiopulmonar adequada é essencial para abastecer o corpo com oxigênio e nutrientes, particularmente durante condições de aumento da demanda metabólica, como durante o exercício 1. A resposta cardiopulmonar para exercício é caracterizada por um número de adaptações em função cardíaca, por exemplo., Um aumento na taxa de coração, contractilidade e acidente vascular cerebral volume e função microvascular, ou seja, a vasodilatação nos leitos vasculares que fornecem músculos que exercem, assim como na pulmonar vasculatura, e vasoconstrição nos leitos vasculares que abastecem o sistema gastrointestinal, bem como músculos inactivos 1. Capacidade de exercício diminuída é uma característica precoce de disfunção cardiopulmonar e teste cardiopulmonar é usado como um método eficaz para delinear entre a disfunção cardíaca, disfunção vascular e / ou disfunção pulmonar em pacientes com capacidade de exercício diminuída 2. disfunção cardiopulmonar início é difficult para diagnosticar, particularmente em modelos animais, como função cardiopulmonar é frequentemente medido de forma invasiva, requerendo anestesia, com muitos agentes anestésicos possuindo propriedades cardiodepressive 3.
instrumentação crônica permite a medição da função cardiopulmonar no estado acordado, e quando os animais estão totalmente ajustados às medições condições de laboratório podem ser obtidos em condições de repouso tranqüilo, sem os efeitos da anestesia e trauma agudo cirúrgico. Além disso, quando os animais são adequadamente formados, as medições podem também ser obtidos durante a esteira graduada exercício 4,5. Mais especificamente, para a esquerda e função ventricular direita pode ser avaliada e relacionada com a perfusão miocárdica, enquanto a regulação do tônus vasomotor na microcirculação coronária, sistêmica e pulmonar pode ser determinada. A utilização de cateteres cheios de líquido permite a medição da pressão, bem como de amostras de sangue que se verifica sem a imposição de anúncioestresse adicional sobre o dos animais. Outra vantagem de se estudar animais cronicamente instrumentadas é que o teste cardiopulmonar pode ser repetido permitindo que a utilização de um animal como o seu próprio controlo, tanto durante o desenvolvimento da doença ou durante o tratamento crónico, aumentando, assim, poder estatístico e, consequentemente, limitar o número de animais necessários para um estudo .
Cardiopulmonar anatomia de suínos é bastante semelhante à dos seres humanos e é possível induzir vários tipos de doença cardiopulmonar, tais como diabetes 6, 7, enfarte do miocárdio, hipertensão pulmonar 8,9 e insuficiência cardíaca induzida por estimulação 10,11. Além disso, o tamanho de instrumentação permite suína crónica, e a amostragem de sangue repetidas de quantidade suficiente para analisar não apenas gases de sangue, mas também para realizar medições de neuro-humorais e / ou para pesquisar biomarcadores da doença.
Este protocolo descreve a cirurgia usadas para crónicaly suína instrumento, bem como o protocolo para o exercício do suína em uma escada rolante motorizado.
Protocolo
Procedimentos envolvendo indivíduos animais foram aprovados pela Comissão de Cuidados com Animais em Erasmus Medical Center Rotterdam (NL). Suínos com pesos entre 6 e 80 kg foram instrumentados com sucesso usando esse protocolo.
1. adaptação dos animais ao manuseio humano
- Após a chegada na instalação, abrigar os animais solitariamente, mas permitir que interajam uns com os outros.
- Accustomize suína à manipulação humana e transporte do biotério para o laboratório experimental, pela manipulação do animal, pelo menos uma vez por dia durante uma semana.
- Treinar os animais de forma adequada para experiências de exercício em uma esteira motorizada de exercitando-os na esteira por um mínimo de três vezes antes da cirurgia.
- Os animais devem estar em jejum O / N antes da cirurgia para prevenir náuseas, vómitos e assim o potencial de aspiração de fluidos estomacais.
2. preparação para a cirurgia
- sedação
- Prepare medicamento para sedação em uma seringa de 10 ml. A pré-medicação consiste de tiletamina / zolazepam (5 mg / kg), xilazina (2,25 mg / kg) e atropina (1 mg).
- Injectar a intramuscular medicação no músculo trapézio com um 19 G 1.5 '' agulha para sedar o porco.
- Esperar por cerca de 10 minutos e verifique se o relaxamento muscular e perda de consciência para confirmar nível adequado e estável de sedação.
- Coloque um cateter de segurança periférica 20 G numa veia da orelha para administração intravenosa subsequente de anestesia e / ou fluidos.
- Intubação e ventilação
- Colocar o animal em uma mesa e / ou de bonde em posição supina.
- Abra a boca do animal com um propagador oral.
- No caso de relaxamento insuficiente das mandíbulas ou presença de reflexos de engolir, que dificultam a intubação, administrar tiopental (10 mg / kg) por via intravenosa através do cateter da veia da orelha. Alternativamente, o porco pode ser mascaradocom isoflurano para induzir sedação.
- Use um laringoscópio convencional com um uma lâmina Miller luz e para permitir que o laryngoscopist para visualizar diretamente a laringe. Se houver laringoespasmo, aplicar lidocaína a 2% para os fios e laringe para reduzir o espasmo e permitir a intubação.
- Inserir um estilete intubating para dentro do tubo endotraqueal para fazer o tubo conformar-se melhor à anatomia das vias aéreas superiores e passar o tubo através da boca e entre as cordas vocais na traqueia.
- Inflar o manguito balão com uma seringa de 10 ml para ajudar a fixá-lo no lugar, para evitar fugas de gases respiratórios, e para proteger as vias respiratórias de uma possível aspiração de líquido do estômago.
- Ligue o tubo a um (permutador de calor e humidade) filtro de respiração e ao ventilador mecânico.
- Colocar o animal em seu lado direito na mesa cirúrgica.
- Para alcançar níveis de pO2 de 100-120 mmHg, ventilar o animal com uma mistura de oxigênio e nitrogênio (1: 2 v / v), using as seguintes configurações do ventilador: modo de controle de pressão: pressão expiratória final positiva (PEEP) de 4 cm H 2 O; pressão inspiratória pico de 16-18 cmH 2 O; frequência, dependendo do tamanho do animal a respirar (para um animal de 20 kg, diminuir a frequência com o aumento do peso corporal), este deve resultar em um volume corrente de ~ 10 mL / kg, monitorizar a ventilação com capnografia.
- Monitorar a temperatura usando um termômetro retal e manter a temperatura entre 37-39 ºC utilizando uma lâmpada de calor ou calor mat. Além disso, monitorar a freqüência cardíaca com eletrocardiografia.
- Anestesia
- Induzir e manter anestesia de preferência por adição de 2,0% de isoflurano (v / v) para o gás mistura-ventilação ou, alternativamente por administração intravenosa de fentanilo (10 ug / kg / h) através do catéter da veia da orelha.
- Verifique a profundidade adequada da anestesia, testando os reflexos da dor com uma pitada perna dedo do pé traseiro antes de iniciar a cirurgia. Quando necessário, adicioneanestesia adicional ou esperar por alguns minutos. Verifique reflexos dor regularmente durante toda a cirurgia.
- Líquidos e Antibióticos
- Administrar a primeira dose de amoxicilina (25 mg / kg) por via intravenosa através do cateter da veia da orelha.
- Conectar um sistema de transfusão para o cateter da veia da orelha para permitir a infusão lenta de glicose a 10% (500 ml) durante a cirurgia.
- Esterilização de Sítio Cirúrgico
- Raspar e limpar a pele do animal por uma área de aproximadamente 25 cm de largura a partir da coluna vertebral até à axila esquerda.
- Esfregar a pele hidratada com esfrega iodopovidona (75 mg / ml) durante aproximadamente 5 min.
- Remover o sabão povidona-iodo a partir da pele com gazes esterilizadas molhadas, antes da esterilização a pele com loção povidona-iodo (100 mg / ml).
- Cobrir o animal com campos cirúrgicos estéreis para reduzir a transferência de bactérias e subsequente contaminação do sítio cirúrgico.
3. Cirurgia
- Abrindo a Thorax (toracotomia)
- Realizar uma incisão na pele, a partir de 1 centímetro caudal em relação ao ângulo inferior esquerdo da escápula para baixo para a axila esquerda (Figura 1). Use diatermia para cauterizar os vasos sanguíneos na pele para prevenir o sangramento excessivo.
- Cortar o músculo serrátil e músculo peitoral maior, utilizando a modalidade de corte da diatermia. Também usar diatermia para cauterizar os vasos sanguíneos na camada muscular para evitar o sangramento excessivo.
- Use dissecção romba para dividir cuidadosamente o músculo intercostal do quarto espaço intercostal esquerdo com uma braçadeira de mosquito. Agora, a superfície costal do pulmão esquerdo coberto com a pleura visceral e parietal deve ser exposto.
- Para entrar na cavidade pleural, perfurar cuidadosamente ambas as camadas da pleura e rasgá-los abertos.
- Usar um afastador torácica para separar as bordas da ferida e as costelas e para conduzir vigorosamente tecidospara além de se obter uma boa exposição da cavidade pleural.
- Afastar o pulmão esquerdo na direção caudal e mantê-lo no lugar com uma gaze molhada. Agora o coração e grandes vasos devem ser claramente expostos.
- Colocação de cateteres e fluxo de sondas (Figura 1)
- Use dissecção romba para remover ~ 2 cm2 do tecido conjuntivo em torno da aorta torácica descendente.
- Executar uma sutura em bolsa, que consiste em três pontos, na parede da aorta com um USP3-0 sutura trançada de seda não absorvível (Ø0.2 mm).
- Penetrar a parede do vaso da aorta com o aço de 16 agulha G inoxidável no meio da sutura em bolsa.
- Insira a ponta do cateter cheio de líquido (até que o anel) para a aorta, puxar a sutura em bolsa com firmeza e amarre as duas cadeias da sutura.
- Para manter o cateter no lugar, enrole o fio de sutura 3 vezes ao redor do cateter acima do anel e novamente tou seja, as duas cadeias da sutura. Além disso proteger o cateter com um novo ponto de aproximadamente 1 cm cranial do local de inserção.
- Ligue o cateter cheio de fluido para o transdutor de pressão calibrada, que está ligado ao computador, para monitorizar a pressão arterial média durante a cirurgia. Obter um gás de sangue arterial para verificar ou ajustar para as configurações de ventilação corretos.
- Abra o pericárdio com um corte cruzado. Esteja ciente para manter o nervo frênico que corre ao longo do pericárdio intacto.
- Identificar a artéria pulmonar e puxe-o ligeiramente no sentido caudal com uma válvula Farabeuf. Agora, a aorta ascendente e arco aórtico deve ser exposto. Monitorizar a pressão arterial média enquanto que a retracção da artéria pulmonar.
- Fazer um pequeno corte (~ 1 cm) no tecido conjuntivo entre a aorta ascendente e da artéria pulmonar com uma tesoura Metzenbaum, para ser capaz de dissecar quer a aorta ascendente ou da artéria pulmonar com uma grande curvaBraçadeira de mosquitos para colocar a sonda de fluxo.
- Coloque a banda de borracha da sonda de fluxo em torno do vaso. Para tornar mais fácil este, colocar um fio de sutura através de uma extremidade da banda de borracha, colocar este fio de sutura em torno do vaso e puxá-lo até que a banda de borracha rodeia o navio.
- Fixe o dispositivo de medição de sonda de fluxo na faixa de borracha. Ligue a sonda de fluxo para o computador e verificar o sinal de débito cardíaco no computador para confirmar a colocação correta da sonda de fluxo.
- Coloque cateteres cheios de fluido na artéria pulmonar, do ventrículo direito, ventrículo esquerdo e do átrio esquerdo da mesma maneira como descrito para o cateter cheio de fluido aórtica (3.2.2 - 3.2.5). Note-se que não é necessário para remover o tecido conjuntivo antes de executar uma sutura em bolsa nestas estruturas.
- Exponha dissecar e a parte proximal da artéria coronária descendente anterior da artéria coronária, levantando primeiro o tecido com uma pinça e fazendo um pequeno (2-3 mm) cortado com tesoura Metzenbaum, Seguido por provocações cuidadosamente o tecido afastado da artéria com um cotonete. Certifique-se de dissecção completa da artéria coronária por meio de um pequeno grampo de mosquito em ângulo reto baixo.
- Fazer um ponto paralelo à veia coronária interventricular anterior com um fio de sutura, o qual está ligado ao cateter venoso coronário.
- Punção da veia coronária com a agulha de 20 G do cateter venoso coronário e inserir a cânula do cateter por via intravenosa.
- Remova a agulha e prenda o cateter com o ponto já realizado (3.2.14). Além disso fixar o cateter com um novo ponto de aproximadamente 1 cm a partir do local de punção inicial.
- Coloque a sonda de fluxo coronário em torno da anterior esquerda previamente dissecada artéria coronária descendente. Quando a artéria é constrito e é dificilmente visível, usar lidocaína 10% de pulverização para relaxar o vaso para obter uma melhor exposição do navio. Verificar o sinal do fluxo coronário no computador para confIRM um posicionamento correcto da sonda de fluxo (Figura 2).
- tunneling
- Túnel as sondas de fluxo individualmente através do terceiro espaço intercostal esquerdo, abaixo do músculo e acima da nervura usando um grande braçadeira mosquito curvo.
- Túnel os cateteres cheios de fluido, quer através do terceiro ou do quinto espaço intercostal esquerdo, perfurando o músculo intercostal. Braçadeira fora dos cateteres cheios de líquido e remova a torneira de três vias para minimizar a área de piercing e evitar o vazamento dos cateteres cheios de líquido durante o tunelamento.
- Fixar as sondas de fluxo e os cateteres cheios de líquido com não-absorvível de seda trançada USP2-0 (Ø0.3 mm) por meio de uma sutura em bolsa no músculo intercostal. Esta sutura também serve para evitar fugas de ar após a re-estabelecendo a pressão negativa intratorácica.
- Adicione três incisões na pele aproximadamente 2 cm de sinistro e paralelas à coluna vertebral, aproximadamente 3 cm decomprimento de 3 cm de distância um do outro.
- Perfurar um trocarte sob o latissimus dorsi músculo esquerdo do local da incisão rostral para as incisões nas costas. Túnel as sondas de fluxo e cateteres fluido para a parte de trás dentro deste trocarte.
- Coloque as torneiras nos cateteres cheios de líquido e retirar a braçadeira. Retirar sangue para remover coágulos e bolhas de ar e encher os cateteres cheios de líquido com 1.000 UI / ml de heparina. cateteres venosos coronárias deve ser preenchido com 5.000 UI / ml de heparina.
- Fechando o Thorax
- Realizar uma incisão com um comprimento de aproximadamente 1,5 cm, 8 cm de caudal e paralela à primeira incisão.
- Levar a drenagem da cavidade pleural ao sexto músculos intercostais subcutaneamente a esta incisão com uma pinça mosquito grande curva. Ligue o dreno para o dispositivo de sucção para remover qualquer líquido restante e restabelecer a pressão negativa na cavidade pleural durante o fechamento do tórax.
- Aliviar e inflaro pulmão com uma espera ao final da inspiração. Certifique-se de preenchimento adequado do pulmão por um acompanhamento visual.
- Feche o tórax puxando as nervuras do quarto espaço intercostal em conjunto em dois locais separados, com não-absorvível USP6 poliéster entrançado (Ø0.8 mm).
- Feche o músculo serrátil e músculo peitoral maior com um ponto corrido e a pele com uma sutura subcuticular execução usando não absorvível USP2-0 trançado de seda (Ø0.3 mm)
- Suturar as incisões na face dorsal com os não-absorvível poliéster USP2-0 trançado (Ø0.3 mm) entre os cateteres. Primeiro um nó directamente sobre a pele para fechar a incisão, em seguida, fixar-se os cateteres para a sutura com um nó de 1 cm a partir da pele. Para as sondas de fluxo, usar um poliglactina absorvível USP2-0 entrançada (Ø0.3 mm) de sutura para prevenir o corte do fio de sutura no fio sonda de fluxo (Figura 1).
- Remova cuidadosamente o dreno enquanto aplica pressão no lado craniala incisão para manter a pressão negativa na cavidade pleural. Fechar a incisão com uma sutura em bolsa usando não absorvível poliéster trançado USP2-0 (Ø0.3 mm) e selar a ferida com vaselina.
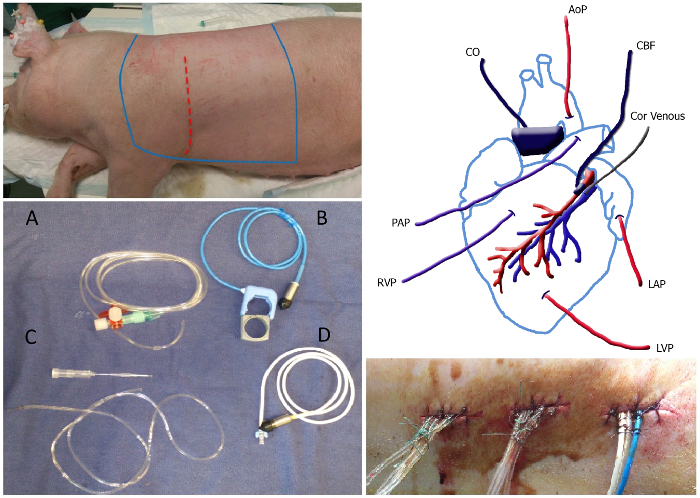
Figura 1. Visão geral do Serviço de Cirurgia do painel superior esquerdo:. A área estéril do animal, que deve ser raspada e situa-se entre as linhas bleu esterilizado. O local da incisão é representado como a linha a tracejado vermelho. Painel inferior esquerdo: Retrato de cateteres e sondas de fluxo: cheio de líquido cateter (A), sonda de fluxo pulmonar aorta / incluindo faixa de borracha (B), cateter venoso coronária incluindo agulha de 20 G (C) e a sonda de fluxo coronário (D). Painel superior direito: esquema do posicionamento dos cateteres e sondas de fluxo. MAP, pressão arterial média; Cor venoso, cateter venoso coronária; LAP, a pressão atrial esquerda; LVPpressão do ventrículo esquerdo; RVP, a pressão do ventrículo direito; PAP, pressão da artéria pulmonar; CO, débito cardíaco; CBF, o fluxo sanguíneo coronário. Painel inferior direito:. Tunneled cateteres que retiram a parte de trás fixada com um ponto e um nó em cerca de 1 cm de distância ao longo da sutura Por favor clique aqui para ver uma versão maior desta figura.
- Rescisão de anestesia e recuperação da cirurgia
- Pare de anestesia quando todos os locais de incisão são fechados.
- Proporcionar analgesia por administração de buprenorfina (0,015 mg / kg) im no músculo gracile.
- Parar a ventilação quando o animal está respirando de forma independente e desconectar o tubo traqueal do ventilador. Verifique regularmente se o animal está respirando suficientemente.
- Coloque compressas de gaze entre os locais de exteriorização do cateter para absorver o líquido da ferida.
- Para proteger o externo SEgments dos cateteres, dar ao animal um colete elástico e embalar os cateteres entre dois pedaços de pele de carneiro artificial.
- Desinflar o balão do tubo traqueal e extubação quando o animal recupera o seu reflexo de deglutição.
- Proporcionar analgesia a longo prazo por meio de um adesivo de libertação lenta de fentanilo (12 ug / h durante um porco 20 kg; ajustar a força de acordo com o peso corporal). Coloque o adesivo sobre uma parte fina da pele (como a parte inferior do abdômen) para garantir a entrega adequada de analgesia.
- Casa do animal separadamente para todo o período pós-operatório. Fornecer uma lâmpada de aquecimento durante a primeira semana após a cirurgia para manter o animal aquecido.
- Fornecer o suficiente iv fluido se o animal não está bebendo de forma independente.
- Lave os cateteres cheios de líquido diariamente, em primeiro lugar retirando o sangue para remover coágulos, em seguida, reenchimento com solução salina e finalmente com solução salina heparinizada (1000 - 5000 UI / ml) para evitar a formação de coágulos de sangue. Tome cuidado para não infundir qualquer bubb arles ao liberar os cateteres.
- Administrar amoxicilina (25 mg / kg) IV diariamente durante 6 dias após a cirurgia para evitar infecções pós-cirúrgicas.
- Permitir que o animal possa recuperar durante uma semana antes de iniciar os experimentos de esteira.
4. Esteira Experiment (Figura 2)
- Lave os cateteres cheios de líquido, como descrito (3.5.10) e anexar os cateteres liberado para os transdutores de pressão. Medir a temperatura rectal de ser capaz de obter valores de temperatura dos gases sanguíneos corrigidos.
- Lave os transdutores de pressão com solução salina para evitar que o amortecimento dos sinais devido a bolhas de ar. Anexar os transdutores de pressão do colete elástica no lado dorsal.
- Ligar os transdutores de pressão e sondas de fluxo para o amplificador. Inicie a medição no programa de computador e calibrar os transdutores de pressão e sondas de fluxo com 0 mmHg estar aberto para o ar (e fechada para animais) e 100 mm Hg utilizando um manómetro.
- Desligue a torneira de três vias de forma que os cateteres de fluido tiver uma conexão aberta com os transdutores de pressão. Note-se que as pressões sanguíneas pode agora ser obtida. Verificar sinais para a forma e amplitude (Figura 2).
- Se necessário, ligar uma linha de extensão de qualquer um dos cateteres de fluido para a amostragem de sangue arterial e venoso misto.
- Medir a hemodinâmica quando o animal está deitado, bem como em pé, parado na esteira. pressões médias de sangue são medidos durante um período de tempo de 10 seg.
- Obter arterial e amostras de sangue venoso misto, em primeiro lugar retirando 5 ml de sangue utilizando uma seringa de 10 ml para que 1 ml de sangue puro pode ser obtido utilizando uma seringa de 1 ml heparinizada. Para as amostras de sangue venoso coronário, uma seringa de 2 ml é utilizada em vez da seringa de 10 mL e retirada de 1 ml é suficiente para se obter sangue puro.
- Mantenha as selados seringas de 1 ml em gelo antes de processar as amostras de sangue com um analisador de gases de sangue para determinara condição metabólica e ventilatória do animal.
- Sujeitar os porcos a um protocolo de exercício de cinco estágios na esteira, 3 min por velocidade, 1-5 km / hr (~ 85% da frequência cardíaca máxima). Obter hemodinâmica e gases sanguíneos após 1,5-2 min por velocidade em cada velocidade que na posição de repouso.
- Após o protocolo de exercício fechar as torneiras e verificar se deriva ocorreu na calibração 0 mmHg, fazer uma nota desta calibração. Remover os transdutores de pressão dos cateteres cheios de fluido e desligue as sondas de fluxo.
- Lave os cateteres cheios de líquido com solução salina e heparina (1000 - 5000 UI / ml). Proteger os cateteres e sondas de fluxo, colocando-os sob o colete elástico entre dois pedaços de pele de carneiro artificial. O animal pode agora ser devolvido à sua gaiola.

Figura 2. esteira Experiment painel esquerdo.ls: suínos instrumentada na esteira. cateteres cheios de fluido estão ligados aos transdutores de pressão, colocado na parte traseira do porco. painel superior direita: Visão Geral do total set-up experimental, incluindo esteira, amplificador e computador de gravação. Painel inferior direita: Exemplo típico dos dados hemodinâmicos registrados. De cima para baixo; pressão aórtica (AoP, azul) e pressão ventricular esquerda (LVP, vermelho); pressão do átrio esquerdo (LAP, azul) e pressão ventricular esquerda (vermelho); pressão arterial pulmonar (PAP, azul) e pressão do ventrículo direito (RVP, vermelho); fluxo aórtico / débito cardíaco (AoF, azul); o fluxo sanguíneo coronário (FSC, vermelho). Por favor clique aqui para ver uma versão maior desta figura.
Resultados
Exercício até 5 km / h resultou na duplicação do débito cardíaco a partir de 4,3 ± 0,3 para 8,5 ± 0,7 L / min que foi realizado principalmente por um aumento na frequência cardíaca a partir de 137 ± 7 256 ± 8 batidas por minuto, em combinação com um pequeno aumento no volume de curso de 32 ± 2 para 36 ± 3 ml (Figura 3). O aumento no volume da pulsação foi facilitado por um aumento da contractilidade do ventrículo esquerdo, como evidenciado por um aumen...
Discussão
O presente estudo descreve a cirurgia para instrumentação crônica de suínos, bem como o protocolo para o exercício do suína instrumentada em uma escada rolante motorizado enquanto mede a hemodinâmica e tomando amostras de sangue para a medição do teor de oxigênio no sangue arterial, venoso misto e sangue venoso coronário.
Passos críticos dentro do Protocolo
Há vários passos críticos no âmbito do protocolo que já começam durante o procedimento de intubação. Tiopenta...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este estudo foi apoiado pela Holanda Coração subsídio da Fundação 2000T038 (para DJ Duncker) concessão 2000T042 (a D. Merkus), europeu FP7-Health-2010 A Comissão concessão MEDIA-261409 (para DJ Duncker e D. Merkus), Iniciativa de Pesquisa Cardiovascular Países Baixos: a Fundação do coração holandês, a Federação holandesa de centros médicos universitários, a Organização holandesa para Pesquisa em Saúde e Desenvolvimento e da Academia Real holandesa de Ciências CVON- ARENA CVON 2011-11 (para DJ Duncker), CVON-PHAEDRA CVON2012-08 (a D. Merkus) e CVON-RECONNECT CVON 2014-11 (para DJ Duncker e D. Merkus), Fundação Sophia (a D. de Wijs-Meijler, D. Merkus e IKM Reiss).
Materiais
| Name | Company | Catalog Number | Comments |
| 3-way stopcocks | B. Braun | 16496 | |
| Perfusor lines PVC (DEHP-free) 150 cm/2.6 ml | B. Braun | 8722960 | Used for fluid filled catheters |
| “python “ silicontubing | Rubber BV | 1757 ID 1 mm, OD 2 mm | Used for fluid filled catheters |
| Sodium Chloride 0.9% | Baxter | TKF7124 | |
| Glucose 10% | Baxter | WE0163 | |
| Suction device | |||
| Slim-Line electrosurgical pencil with 2 buttons | ERBE ELEKTROMEDIZIN GMBH | 20190-066 | |
| Servo Ventilator SV900C | Siemens-Elema AB | ||
| Laryngoscoop | Vererinary Technics Int. | 11.02.47 | |
| Sterile surgical gloves | |||
| tie-on surgical mask | 3M | 1818FS | |
| surgical hat | Klinidrape | 621301 | |
| Procedure pack | Molnlycke Health Care | 97027809 | Surgical drape, gauze pads, syringes, beaker etc |
| Droptears | Alcon | 288-28282-01 | |
| Betadine scrub 75 mg/ml Povidone-iodine | Meda Pharma BV | RVG08939 | |
| Betadine solution 100 mg/ml Povidone-iodine | Meda Pharma BV | RVG01331 | |
| Cuffed Endotracheal tube | Emdamed | size depends on animal size | |
| Breathing filter Hyrdo therm 3HME | Intersurgical | 1560000 | |
| Laryngoscope Handle+ Miller blade size 4 | Kawe Germany | ||
| Manual resuscitator- Combibag | Weinmann | 6515-12-313-5596 | |
| Perivascular flow probe 3PS | Transonic | For coronary artery; Size 2.5 - 4 mm depending on animal size | |
| Confidence flow probe | Transonic | For aorta/pulmonary artery, 16 - 20 mm; size depends on animal size | |
| Venflon-Venisystem 20 G x 32 mm | BD | 393224 | For coronary venous catheter |
| Blunt Needle 18 G | For coronary venous catheter | ||
| Tygon Tubing | Rubber BV | 2802 ID 0.8 mm (1/32’’), OD 2.4 mm (3/32’’) | For coronary venous catheter |
| Suction Handle 17 cm 6 6/8 " Coupland 18/8 martinit with tube connector | KLS Martin Group | 18-575-24 | |
| Scalple blade | |||
| Scalpel Handle 13.5 cm 5 3/8 " Stainless Steel solid | KLS Martin Group | 10-100-04 | |
| Vascular Forceps 20.2 cm 8 " De Bakey Stainless Stee | KLS Martin Group | 24-388-20 | ± 14 cm |
| Dressing Forceps 17 cm 6 6/8 " Cushing Stainless Steel | KLS Martin Group | 12-189-17 | ± 18 cm |
| halsted-musquito straight 12.5 cm - 5" | Rudolf Medical | RU-3100-13 | ± 12 cm |
| halsted-musquito curved 12.5 cm - 5" | Rudolf Medical | RU-3101-12 | ± 12 cm |
| Dissecting and Ligature Forceps 13 cm 5 1/8 " Gemini Stainless Steel | KLS Martin Group | 13-451-13 | ± 12 cm |
| Dissecting and Ligature Forceps 18.5 cm 7 2/8 " Schnidt Stainless Steel | KLS Martin Group | 13-363-18 | |
| Rib Retractor Finochietto, Baby Aluminium - | KLS Martin Group | 24-162-01 | |
| suture forceps Mayo-Hegar 3 mm 18 cm - 7" | Rudolf Medical | RU-6050-18 | |
| Metchenbaum blunt curved 14.5 cm - 5(3/4)" | Rudolf Medical | RU-1311-14M | |
| Retrector farabeuf 12 cm - 4 (3/4)" | Rudolf Medical | RU-4497-12 | |
| Towel forceps schrädel curved 9cm - 3,5" | Rudolf Medical | RU-3550-09 | |
| surgical scissors blunt 13 cm - 5" | Rudolf Medical | RU-1001-13 | |
| Gauzes Cutisoft 10 x 10 cm 4-ply | BSN Medical | 45846-00 | |
| Gauzes Cutisoft 5 x 5 cm 4-ply | BSN Medical | 45844-00 | |
| Flowmeter -CM2 / SF2 - 2gas (O2 and Air) | UNO BV | 180000008 | |
| Tec 7 Vaporizer | Datex-Ohmeda | ||
| Acederm wound spay | Ecuphar NV | ||
| Vaseline Album | Bufa | 165313 | |
| silkam 3-0 Natural silk, non-absorbable | B. Braun | F 1134043 | sutures for placement of catheters |
| silkam 2-0 Natural silk, non-absorbable | B. Braun | F 1134051 | sutures for muscular approximation |
| dagrofil 3-0 Polyester, non-absorbable | B. Braun | C 0842478 | sutures for fluid fille catheters after tunneling |
| Vicryl rapide 3-0, 1 x 45 cm FS2, V2930G | Daxtrio medische producten | 15560 | sutures for electrical catheters after tunneling |
| Vitafil 6 USP | SMI | 6080 | Ties |
| Syringes | 10 ml and 2.5 ml | ||
| Heparin LEO (heparin sodium) | LEO Pharma A/S | ||
| Zoletil | Virbac | tiletamine / zolazepam | |
| Sedazine | AST farma | 108855 | xylazine |
| Temgesic | RB Pharmaceuticals | 5429 | buprenorphine |
| Tensogrip | BSN Medical | 71522-00 | elastic vest |
Referências
- Laughlin, M. H., et al. Peripheral circulation. Compr Physiol. 2, 321-447 (2012).
- Datta, D., Normandin, E., ZuWallack, R. Cardiopulmonary exercise testing in the assessment of exertional dyspnea. Ann Thorac Med. 10, 77-86 (2015).
- Vatner, S. F., Braunwald, E. Cardiovascular control mechanisms in the conscious state. N Engl J Med. 293, 970-976 (1975).
- Duncker, D. J., Bache, R. J. Regulation of coronary blood flow during exercise. Physiol Rev. 88, 1009-1086 (2008).
- Tune, J. D., Gorman, M. W., Feigl, E. O. Matching coronary blood flow to myocardial oxygen consumption. J Appl Physiol. 97 (1985), 404-415 (2004).
- van den Heuvel, M., et al. Coronary microvascular dysfunction in a porcine model of early atherosclerosis and diabetes. Am J Physiol Heart Circ Physiol. 302, H85-H94 (2012).
- Zhou, Z., et al. Pulmonary vasoconstrictor influence of endothelin in exercising swine depends critically on phosphodiesterase 5 activity. Am J Physiol Lung Cell Mol Physiol. 306, L442-L452 (2014).
- Pereda, D., et al. Swine model of chronic postcapillary pulmonary hypertension with right ventricular remodeling: long-term characterization by cardiac catheterization, magnetic resonance, and pathology. J Cardiovasc Transl Res. 7, 494-506 (2014).
- Mercier, O., et al. Endothelin A receptor blockade improves regression of flow-induced pulmonary vasculopathy in piglets. J Thorac Cardiovasc Surg. 140, 677-683 (2010).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259, H218-H229 (1990).
- Yarbrough, W. M., Spinale, F. G. Large animal models of congestive heart failure: a critical step in translating basic observations into clinical applications. J Nucl Cardiol. 10, 77-86 (2003).
- Duncker, D. J., Stubenitsky, R., Verdouw, P. D. Autonomic control of vasomotion in the porcine coronary circulation during treadmill exercise: evidence for feed-forward beta-adrenergic control. Circ Res. 82, 1312-1322 (1998).
- Stubenitsky, R., Verdouw, P. D., Duncker, D. J. Autonomic control of cardiovascular performance and whole body O2 delivery and utilization in swine during treadmill exercise. Cardiovasc Res. 39, 459-474 (1998).
- Zhou, Z., et al. Phosphodiesterase-5 activity exerts a coronary vasoconstrictor influence in awake swine that is mediated in part via an increase in endothelin production. Am J Physiol Heart Circ Physiol. 306, H918-H927 (2014).
- Gross, D. R. . Animal Models in Cardiovascular Research. , (2009).
- Merkus, D., Duncker, D. J. Perspectives: Coronary microvascular dysfunction in post-infarct remodelled myocardium. Eur Heart J Suppl. 16, A74-A79 (2014).
- de Beer, V. J., de Graaff, H. J., Hoekstra, M., Duncker, D. J., Merkus, D. Integrated control of pulmonary vascular tone by endothelin and angiotensin II in exercising swine depends on gender. Am J Physiol Heart Circ Physiol. 298, H1976-H1985 (2010).
- Lautt, W. W. Resistance or conductance for expression of arterial vascular tone. Microvasc Res. 37, 230-236 (1989).
- Merkus, D., et al. Phosphodiesterase 5 inhibition-induced coronary vasodilation is reduced after myocardial infarction. Am J Physiol Heart Circ Physiol. 304, H1370-H1381 (2013).
- Heusch, G. The paradox of alpha-adrenergic coronary vasoconstriction revisited. J Mol Cell Card. 51, 16-23 (2011).
- Merkus, D., Houweling, B., van den Meiracker, A. H., Boomsma, F., Duncker, D. J. Contribution of endothelin to coronary vasomotor tone is abolished after myocardial infarction. Am J Physiol Heart Circ Physiol. 288, H871-H880 (2005).
- Haitsma, D. B., et al. Minimal impairment of myocardial blood flow responses to exercise in the remodeled left ventricle early after myocardial infarction, despite significant hemodynamic and neurohumoral alterations. Cardiovasc Res. 52, 417-428 (2001).
- Bender, S. B., van Houwelingen, M. J., Merkus, D., Duncker, D. J., Laughlin, M. H. Quantitative analysis of exercise-induced enhancement of early- and late-systolic retrograde coronary blood flow. J Appl Physiol. 108 (3), 507-514 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados