Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mise en place chirurgicale de cathéters pour épreuve d'effort cardiovasculaire à long terme chez le porc
Dans cet article
Résumé
Here we present a protocol to assess cardiopulmonary function in awake swine, at rest and during graded treadmill exercise. Chronic instrumentation allows for repeated hemodynamic measurements uninfluenced by cardiodepressive anesthetic agents.
Résumé
Ce protocole décrit la procédure chirurgicale à la peste de l'instrument de façon chronique et la procédure à exercer porcine sur un tapis roulant motorisé. Un dysfonctionnement cardio-pulmonaire précoce est difficile à diagnostiquer, en particulier dans des modèles animaux, que la fonction cardio-pulmonaire invasive est souvent mesurée, ce qui nécessite une anesthésie. Comme de nombreux agents anesthésiques sont cardiodépresseur, des changements subtils dans la fonction cardiovasculaire peuvent être masqués. En revanche, l'instrumentation chronique permet la mesure de la fonction cardio-respiratoire à l'état éveillé, de sorte que les mesures peuvent être obtenues dans des conditions de repos, sans les effets de l'anesthésie et de traumatisme chirurgical aiguë. En outre, lorsque les animaux sont correctement formés, les mesures peuvent également être obtenus au cours graduelle effort sur tapis roulant.
Les sondes de débit sont placés autour de l'aorte ou de l'artère pulmonaire pour la mesure du débit cardiaque et autour de l'artère interventriculaire antérieure coronaire pour la mesure de Coronle flux sanguin aire. cathéters remplis de liquide sont implantées dans l'aorte, l'artère pulmonaire, l'oreillette gauche, le ventricule gauche et le ventricule droit pour la mesure de pression et d'échantillonnage de sang. En outre, un cathéter G 20 est positionné dans la veine interventriculaire antérieure coronaire pour permettre le prélèvement de sang veineux.
Après une semaine de la reprise, les porcs sont placés sur un tapis roulant motorisé, les cathéters sont connectés à pression et de débitmètres, et les porcs sont soumis à un protocole d'exercice progressif en cinq étapes, à chaque étape une durée de 3 min. signaux hémodynamiques sont enregistrées en continu et des échantillons de sang sont prélevés au cours des 30 dernières secondes de chaque étape de l'exercice.
L'avantage principal de l'étude des animaux chroniquement instrumentés est qu'il permet l'évaluation de série de la fonction cardiorespiratoire, non seulement au repos, mais aussi lors d'un stress physique comme l'exercice. En outre, la fonction cardio-pulmonaire peut être évaluée à plusieurs reprises pendant la maladie le développement d'une au cours du traitement chronique, ce qui augmente la puissance statistique et donc de limiter le nombre d'animaux requis pour une étude.
Introduction
La fonction cardiorespiratoire adéquate est essentielle pour fournir le corps avec de l'oxygène et des nutriments, en particulier dans des conditions de l'augmentation de la demande métabolique telles que cours de l'exercice 1. La réponse cardiorespiratoire à l'exercice se caractérise par un certain nombre d'adaptations de la fonction cardiaque, ie., Une augmentation de la fréquence cardiaque, la contractilité et la course le volume et la fonction microvasculaire, à savoir, la vasodilatation dans les lits vasculaires alimentant muscles exerçant ainsi que dans la pulmonaire vasculaire, et la vasoconstriction dans les lits vasculaires alimentant le système gastro-intestinal ainsi que des muscles inactifs 1. La capacité d'exercice avec facultés affaiblies est une caractéristique précoce de dysfonctionnement cardio-pulmonaire, et l'épreuve d'effort cardio-respiratoire est utilisé comme une méthode efficace pour délimiter entre la dysfonction cardiaque, de dysfonction vasculaire et / ou d'un dysfonctionnement pulmonaire chez les patients atteints de la capacité d'exercice avec facultés 2. Début dysfonctionnement cardio-pulmonaire est difficult à diagnostiquer, en particulier dans des modèles animaux, que la fonction cardio-pulmonaire invasive est souvent mesurée, ce qui nécessite une anesthésie, avec de nombreux agents anesthésiques possédant des propriétés cardiodépresseurs 3.
instrumentation chronique permet la mesure de la fonction cardio-respiratoire à l'état éveillé, et quand les animaux sont entièrement adaptés aux conditions de laboratoire mesures peuvent être obtenues en vertu des conditions de repos, sans les effets de l'anesthésie et de traumatisme chirurgical aiguë. En outre, lorsque les animaux sont formés de manière appropriée, les mesures peuvent également être obtenus au cours de l'exercice sur tapis roulant graduée 4,5. Plus précisément, la gauche et la fonction ventriculaire droite peut être évaluée et liée à la perfusion myocardique, alors que la régulation du tonus vasomoteur dans la microcirculation coronaire, systémique et pulmonaire peut être déterminée. L'utilisation de cathéters remplis de fluide permet de mesurer la pression ainsi que le prélèvement d'échantillons de sang sans imposer annoncele stress conditionnelle sur les animaux. Un autre avantage de l'étude les animaux chroniquement instrumentés est que l'épreuve d'effort cardio-pulmonaire peut être répété en permettant l'utilisation d'un animal étant son propre témoin, que ce soit au cours du développement de la maladie ou au cours du traitement chronique, ce qui augmente la puissance statistique et donc de limiter le nombre d'animaux requis pour une étude .
Anatomie cardio de la peste ressemble beaucoup à celle de l'homme et il est possible d'induire diverses formes de maladies cardio-pulmonaires, telles que le diabète 6, infarctus du myocarde 7, l'hypertension pulmonaire 8,9 et l'insuffisance cardiaque induite par stimulation à 10,11. En outre, la taille de la peste permet instrumentation chronique, et des prélèvements sanguins répétés en quantité suffisante pour analyser non seulement les gaz du sang, mais aussi d'effectuer des mesures neurohumoraux et / ou pour rechercher des marqueurs biologiques de la maladie.
Ce protocole décrit la chirurgie utilisée pour chroniquely instrument porcine ainsi que le protocole d'exercice du porcine sur un tapis roulant motorisé.
Protocole
Procédures impliquant des sujets animaux ont été approuvés par le Comité de soins des animaux au Centre médical Erasmus de Rotterdam (NL). Porcine avec des poids entre 6 et 80 kg ont été instrumenté avec succès en utilisant ce protocole.
1. L'adaptation des animaux à la manipulation humaine
- Après l'arrivée dans l'établissement, loger les animaux solitaires, mais de leur permettre d'interagir les uns avec les autres.
- Accustomize porcine humaine à une manipulation et le transport de l'animalerie du laboratoire expérimental, par la manipulation de l'animal au moins une fois par jour pendant une semaine.
- Former les animaux de manière appropriée pour des expériences d'exercice sur un tapis roulant motorisé en les exerçant sur le tapis roulant pour un minimum de trois fois avant la chirurgie.
- Les animaux doivent être à jeun O / N avant la chirurgie pour prévenir les nausées, les vomissements et d'aspiration ainsi le potentiel des fluides de l'estomac.
2. Préparation pour la chirurgie
- Sédation
- Préparer un médicament pour la sédation dans une seringue de 10 ml. Prémédication consiste en tilétamine / zolazepam (5 mg / kg), de xylazine (2,25 mg / kg) et de l'atropine (1 mg).
- Injecter la voie intramusculaire de médicament dans le muscle trapèze avec un 19 G 1.5 '' aiguille pour endormir le cochon.
- Attendez environ 10 min et vérifier pour la relaxation musculaire et l'inconscience de confirmer le niveau de sédation adéquate et stable.
- Placer un cathéter de sécurité périphérique 20 G dans une veine de l'oreille pour l'administration intraveineuse ultérieure de l'anesthésie et / ou des liquides.
- Intubation et la ventilation
- Placez l'animal sur une table et / ou un chariot en position couchée.
- Ouvrez la bouche de l'animal avec un épandeur orale.
- En cas de détente insuffisante des mâchoires ou présence d'avaler des réflexes, qui entravent l'intubation, administrer thiopental (10 mg / kg) par voie intraveineuse via le cathéter oreille de la veine. Alternativement, le porc peut être masquéeavec de l'isoflurane à induire la sédation.
- Utiliser un laryngoscope classique avec une lumière et une lame Miller pour permettre à l'laryngoscopiste de visualiser directement le larynx. S'il y a un laryngospasme, appliquer lidocaïne 2% pour les cordons et les larynx pour réduire le spasme et de permettre l'intubation.
- Insérez un stylet d'intubation dans la sonde endotrachéale pour faire le tube conforme mieux à l'anatomie des voies aériennes supérieures et de passer le tube par la bouche et entre les cordes vocales dans la trachée.
- Gonfler le brassard de ballon avec une seringue de 10 ml pour aider à sécuriser en place, pour éviter les fuites de gaz respiratoires, et de protéger les voies respiratoires d'une éventuelle aspiration de liquide gastrique.
- Se connecter à un tube (échangeur de chaleur et d'humidité) filtre de protection respiratoire et la ventilation mécanique.
- Placez l'animal sur son côté droit sur la table d'opération.
- Pour atteindre des niveaux de pO2 100-120 mmHg, ventiler l'animal avec un mélange d'oxygène et de l'azote (1: 2 v / v), using les paramètres suivants du ventilateur: le mode de régulation de pression: pression expiratoire positive (PEEP) 4 cmH 2 O; la pression inspiratoire de pointe de 16 à 18 cm H 2 O; la fréquence respiratoire en fonction de la taille de l'animal (pour 20 kg animal, diminuer la fréquence avec l'augmentation de poids corporel), ce qui devrait se traduire par un volume courant de ~ 10 ml / kg, suivi par capnographie ventilation.
- Surveiller la température avec un thermomètre rectal et maintenir la température entre 37-39 ° C en utilisant une lampe chauffante ou tapis chauffant. En outre, surveiller le rythme cardiaque avec électrocardiographie.
- Anesthésie
- Induire et maintenir une anesthésie de préférence en ajoutant 2,0% d'isoflurane (v / v) pour le mélange de gaz de ventilation, ou encore par l'administration intraveineuse de fentanyl (10 ug / kg / h) par l'intermédiaire du cathéter veineux oreille.
- Contrôler la profondeur de l'anesthésie adéquate en testant les réflexes de la douleur avec une biche jambe pincement de l'orteil avant de commencer la chirurgie. Si nécessaire, ajouteranesthésie supplémentaire ou attendre quelques minutes. Vérifiez réflexes de douleur régulièrement tout au long de la chirurgie.
- Fluides et antibiotiques
- Administrer la première dose d'amoxicilline (25 mg / kg) par voie intraveineuse via le cathéter oreille de la veine.
- Connecter un système de transfusion au cathéter oreille de veine pour permettre lente perfusion de glucose à 10% (500 ml) pendant la chirurgie.
- Stérilisation des site opératoire
- Raser et nettoyer la peau de l'animal sur une superficie d'environ 25 cm de largeur de la colonne vertébrale tout le chemin à l'aisselle gauche.
- Frotter la peau hydratée avec povidone-iode gommage (75 mg / ml) pendant environ 5 min.
- Enlever le savon de povidone-iode de la peau avec des gazes stériles humides, avant la stérilisation de la peau avec une lotion povidone-iode (100 mg / ml).
- Couvrir l'animal avec des champs opératoires stériles pour réduire le transfert de bactéries et la contamination ultérieure du site chirurgical.
3. Surgery
- Ouverture du thorax (thoracotomie)
- Faire une incision dans la peau, à partir de 1 cm caudal à l'angle inférieur gauche de l'omoplate vers l'aisselle gauche (Figure 1). Utilisez diathermie pour cautériser les vaisseaux sanguins de la peau pour prévenir les saignements excessifs.
- Couper à travers le muscle grand dentelé et muscle grand pectoral, en utilisant la modalité de coupe de la diathermie. Également utiliser la diathermie pour cautériser les vaisseaux sanguins dans la couche musculaire pour prévenir les saignements excessifs.
- Utilisez dissection de diviser soigneusement le muscle intercostal du quatrième espace intercostal gauche avec un collier de moustique. Maintenant la surface costale du poumon gauche couverte de la plèvre viscérale et pariétale doit être exposé.
- Pour entrer dans la cavité pleurale, percer soigneusement les deux feuillets de la plèvre et les déchirer ouvert.
- Utiliser un écarteur thoracique pour séparer les bords de la plaie et les côtes et à conduire avec force tissusà part pour obtenir une bonne exposition de la cavité pleurale.
- Repousser le poumon gauche en direction caudale et le maintenir en place avec une gaze humide. Maintenant, le cœur et les gros vaisseaux doivent être clairement exposés.
- Placement de cathéters et sondes de flux (Figure 1)
- Utilisez dissection d'enlever ~ 2 cm 2 de tissu conjonctif autour de l'aorte thoracique descendante.
- Effectuer une suture en bourse, constitué de trois points de suture, dans la paroi aortique avec un USP3-0 suture de soie tressée non absorbable (Ø0.2 mm).
- Pénétrer dans la paroi de la cuve de l'aorte avec un acier 16 G aiguille inoxydable dans le milieu de la suture en bourse.
- Insérer la pointe du cathéter rempli de liquide (jusqu'à ce que l'anneau) dans l'aorte, tirer la suture en bourse fermement ensemble et nouer les deux chaînes de la suture.
- Pour maintenir le cathéter en place, enrouler le fil de suture 3 fois autour du cathéter dessus de l'anneau et de nouveau tà savoir les deux chaînes de la suture. sécuriser davantage le cathéter avec une nouvelle maille d'environ 1 cm crânienne du lieu d'insertion.
- Connecter le cathéter rempli de fluide vers le transducteur de pression calibré, qui est relié à l'ordinateur, pour surveiller la pression artérielle moyenne pendant la chirurgie. Obtenir un gaz du sang artériel pour vérifier ou ajuster les paramètres corrects de ventilation.
- Ouvrir le péricarde avec une coupe croisée. Soyez conscient de garder le nerf phrénique qui fonctionne sur le péricarde intact.
- Identifier l'artère pulmonaire et tirez-le légèrement dans la direction caudale avec un écarteur Farabeuf. Maintenant, l'aorte ascendante et crosse de l'aorte devraient être exposés. Surveiller la pression artérielle moyenne tout en rétractant l'artère pulmonaire.
- Faire une petite incision (~ 1 cm) dans le tissu conjonctif entre l'aorte ascendante et l'artère pulmonaire avec des ciseaux Metzenbaum, pour être en mesure de disséquer soit l'aorte ascendante ou l'artère pulmonaire avec une grande courbemoustique pince pour placer la sonde de débit.
- Placer la bande de caoutchouc de la sonde d'écoulement autour de la cuve. Pour faciliter cette opération, placer une suture à travers une extrémité de la bande de caoutchouc, placer cette suture autour de la cuve et le tirer jusqu'à ce que la bande de caoutchouc entoure la cuve.
- La fixation du dispositif de mesure de la sonde de flux sur la bande en caoutchouc. Connecter la sonde de débit à l'ordinateur et vérifier le signal de sortie cardiaque sur l'ordinateur pour confirmer un placement correct de la sonde de débit.
- Placez cathéters remplis de fluide dans l'artère pulmonaire, le ventricule droit, ventricule gauche et l'oreillette gauche en même manière que celle décrite pour le cathéter rempli de liquide aortique (3.2.2 - 3.2.5). Notez qu'il est pas nécessaire d'enlever le tissu conjonctif avant d'effectuer une suture en bourse dans ces structures.
- Exposer et disséquer la partie proximale de l'artère interventriculaire antérieure coronaire d'abord soulever le tissu avec une pince et de faire un petit (2-3 mm) couper avec des ciseaux Metzenbaum, Suivie attentivement taquiner le tissu loin de l'artère avec un coton-tige. Veiller à dissection complète de l'artère coronaire en faisant passer un petit angle droit moustiques pince-dessous.
- Faire une couture parallèle à la veine coronaire interventriculaire antérieure avec un fil de suture, qui est relié au cathéter veineux coronaire.
- Piquer la veine coronaire avec le G aiguille 20 du cathéter veineux coronaire et insérer la canule du cathéter par voie intraveineuse.
- Retirez l'aiguille et fixer le cathéter avec le point déjà effectué (3.2.14). sécuriser davantage le cathéter avec une nouvelle maille d'environ 1 cm de l'endroit de la ponction initiale.
- Placer la sonde de débit coronaire autour de l'antérieur gauche préalablement disséqué artère coronaire. Lorsque l'artère est rétrécie et est à peine visible, utiliser la lidocaïne 10% pulvérisation pour se détendre le navire pour obtenir une meilleure exposition de la cuve. Vérifiez le signal du flux coronaire sur l'ordinateur pour confirm un placement correct de la sonde de débit (Figure 2).
- tunneling
- Tunnel sondes d'écoulement individuel à travers le troisième espace intercostal gauche et le muscle sous-dessus de la nervure à l'aide d'une pince courbe grande moustique.
- Tunnel cathéters remplis de fluide à travers le troisième ou le cinquième espace intercostal gauche en perçant le muscle intercostal. Clamper les cathéters remplis de fluide et retirer le robinet à trois voies pour réduire au minimum la zone de perforation et d'empêcher la fuite des cathéters remplis de liquide au cours de la construction de tunnels.
- Fixer les sondes de débit et les cathéters remplis de liquide non absorbable avec USP2-0 soie tressée (ø0.3 mm) au moyen d'une suture en bourse sur le muscle intercostal. Cette suture sert également à empêcher les fuites d'air après rétablissant la pression intrathoracique négative.
- Faire trois incisions dans la peau d'environ 2 cm sinistres et parallèle à la colonne vertébrale, à environ 3 cm delongueur 3 cm de distance les uns des autres.
- Percer un trocart sous le grand dorsal gauche dorsi de rostrale site d'incision des incisions sur le dos. Tunnel les sondes de flux et de cathéters de fluide vers l'arrière dans ce trocart.
- Placer les robinets sur les cathéters remplis de fluide et retirer la pince. Prélever du sang pour éliminer les caillots et les bulles d'air et de remplir les cathéters remplis de fluide avec 1000 UI / ml d'héparine. cathéters veineux coronaires doivent être remplis avec 5000 UI / ml d'héparine.
- Fermeture du Thorax
- Faire une incision d'une longueur d'environ 1,5 cm, 8 cm caudal et parallèle à la première incision.
- Diriger l'écoulement à partir de la cavité pleurale dans les muscles intercostaux sixième sous-cutanée de cette incision avec une grande pince moustique courbe. Connecter le drain au dispositif d'aspiration pour enlever tout liquide restant et de rétablir une pression négative dans la cavité pleurale lors de la fermeture du thorax.
- Soulager et gonflerle poumon avec une attente de fin d'inspiration. Assurer un remplissage adéquat du poumon par une surveillance visuelle.
- Fermez le thorax en tirant sur les nervures de la quatrième espace intercostal ainsi que sur deux sites distincts avec non absorbable polyester USP6 tressé (Ø0.8 mm).
- Fermez le muscle dentelé et grand pectoral avec un point en cours d'exécution et de la peau avec une suture sous-cutanée en cours d'exécution à l'aide non-absorbable soie tressée USP2-0 (ø0.3 mm)
- Suturer les incisions sur la face dorsale de polyester non absorbable USP2-0 tressé (ø0.3 mm) entre les cathéters. Première faire un noeud directement sur la peau pour fermer l'incision, puis fixer les cathéters à la suture avec un noeud à 1 cm de la peau. Pour les sondes de débit, utiliser une tresse polyglactine absorbable USP2-0 (ø0.3 mm) suture pour éviter de couper le fil de suture dans le fil de la sonde de débit (Figure 1).
- Retirez délicatement le drain en appliquant une pression sur le côté du crâne del'incision pour maintenir une pression négative dans la cavité pleurale. Fermer l'incision avec une suture en bourse en utilisant non résorbable tressée polyester USP2-0 (ø0.3 mm) et sceller la plaie avec de la vaseline.
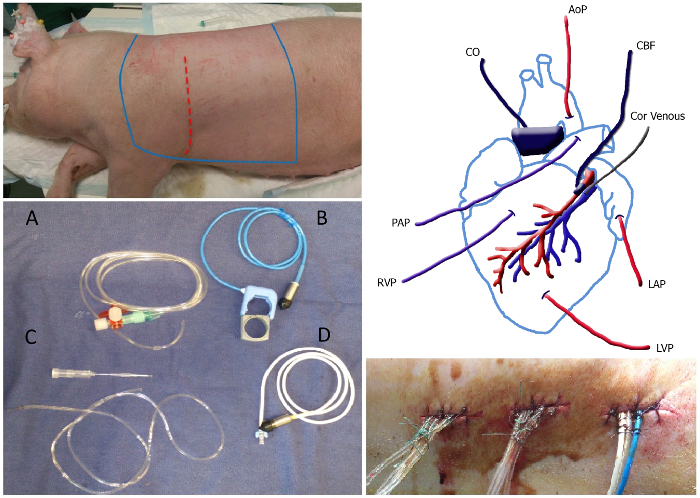
Figure 1. Vue d'ensemble de la chirurgie du panneau en haut à gauche:. La zone stérile de l'animal, qui doit être rasé et se trouve entre les lignes bleu stérilisé. Le site de l'incision est dépeint comme la ligne pointillée rouge. Panneau inférieur gauche: Image de cathéters et des sondes de flux: remplie de liquide cathéter (A), la sonde de débit pulmonaire de l'aorte / y compris bande de caoutchouc (B), un cathéter veineux coronaire dont 20 aiguille G (C) et la sonde de débit coronaire (D). Haut panneau de droite: vue d'ensemble schématique de mise en place des cathéters et des sondes de flux. MAP, la pression artérielle moyenne; Cor veineux, un cathéter veineux coronaire; LAP, la pression auriculaire gauche; LVPla pression ventriculaire gauche; VPR, la pression ventriculaire droite; PAP, la pression de l'artère pulmonaire; CO, le débit cardiaque; CBF, le débit sanguin coronaire. Panneau en bas à droite:. Tunneled cathéters sortant le dos fixé avec un point et un noeud à environ 1 cm de distance le long de la suture S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Résiliation de l'anesthésie et de récupération de la chirurgie
- Arrêtez l'anesthésie lorsque tous les sites d'incision sont fermés.
- Une analgésie par administration de la buprénorphine (0,015 mg / kg) im dans le muscle droit interne.
- Arrêtez la ventilation lorsque l'animal respire indépendamment et débrancher le tube trachéal du ventilateur. Vérifier régulièrement si l'animal respire suffisamment.
- Placez des tampons de gaze entre les sites d'extériorisation de cathéters à absorber le fluide de la plaie.
- Pour protéger l'externe SEgments des cathéters, donnent l'animal un gilet élastique et emballer les cathéters entre deux morceaux de peau de mouton artificielle.
- Dégonfler le ballon du tube trachéal et extuber lorsque l'animal retrouve sa réflexe de déglutition.
- Une analgésie à long terme au moyen d'un timbre de fentanyl à libération lente (12 ug / h pour une 20 kg de porc; ajuster la force en fonction de poids corporel). Placez le patch sur une partie fine de la peau (comme le bas de l'abdomen) pour assurer la prestation adéquate de l'analgésie.
- Maison l'animal séparément pour l'ensemble de la période post-opératoire. Fournir une lampe chauffante pour la première semaine après la chirurgie pour conserver la chaleur animale.
- Fournir suffisamment iv fluide si l'animal ne boit pas indépendamment.
- Rincer les cathéters remplis de fluide par jour, selon la première prélèvement de sang pour enlever les caillots, puis le remplissage avec une solution saline et enfin avec une solution saline héparinée (1000 - 5000 UI / ml) afin d'empêcher la formation de caillots dans le sang. Prenez soin de ne pas laisser infuser toute bubb d'airles sous balayage les cathéters.
- Administrer l'amoxicilline (25 mg / kg) iv par jour pendant 6 jours après l'intervention chirurgicale pour prévenir les infections post-chirurgicales.
- Permettre à l'animal de récupérer pendant une semaine avant de commencer les expériences de tapis roulant.
4. Tapis de course Experiment (Figure 2)
- Rincer les cathéters remplis de fluide tel que décrit (3.5.10) et fixer les cathéters vidées sur les capteurs de pression. Mesurer la température rectale pour être en mesure d'obtenir des valeurs de gaz du sang de température corrigée.
- Rincer les transducteurs de pression avec une solution saline pour empêcher l'amortissement des signaux dus à des bulles d'air. Fixer les transducteurs de pression de la veste élastique sur la face dorsale.
- Connecter les transducteurs de pression et des sondes de flux à l'amplificateur. Commencer à mesurer dans le programme informatique et calibrer les capteurs de pression et des sondes de flux à 0 mmHg étant ouverte à l'air (et fermé à l'animal) et 100 mmHg à l'aide d'un manomètre.
- Mettez le robinet à trois voies de manière à ce que les cathéters fluides ont une connexion ouverte avec les capteurs de pression. On notera que les pressions sanguines peuvent maintenant être obtenus. Contrôler les signaux de forme et l'amplitude (figure 2).
- Si nécessaire, connectez une ligne d'extension à l'une des cathéters fluides pour l'échantillonnage de sang veineux et artériel mixte.
- Mesurer l'hémodynamique lorsque l'animal est couché ainsi que debout tranquillement sur le tapis roulant. les pressions artérielles moyennes sont mesurées sur une période de 10 sec.
- Obtenir artérielle et échantillons de sang veineux mixte d'abord retirer 5 ml de sang en utilisant une seringue de 10 ml de telle sorte que 1 ml de sang pur peuvent être obtenues en utilisant une seringue de 1 ml héparine. Pour les échantillons de sang veineux coronaire, une seringue de 2 ml est utilisé à la place de la seringue de 10 ml et le retrait de 1 ml est suffisante pour obtenir du sang pur.
- Gardez les scellés seringues de 1 ml sur de la glace avant de traiter les échantillons de sang avec un analyseur de gaz du sang pour déterminerl'état métabolique et respiratoire de l'animal.
- Soumettre les porcs à un protocole d'exercice en cinq étapes sur le tapis roulant, 3 min par la vitesse, 1-5 km / h (~ 85% de la fréquence cardiaque maximale). Obtenir l'hémodynamique et les gaz du sang après 1,5 à 2 min par la vitesse de chaque vitesse dans la position de repos.
- Après le protocole d'exercice fermer les robinets et vérifier si la dérive est produite dans l'étalonnage 0 mmHg, faire une note de ce calibrage. Supprimer les capteurs de pression des cathéters remplis de fluide et déconnecter les sondes de débit.
- Rincer les cathéters remplis de fluide avec une solution saline et de l'héparine (1000 - 5000 UI / ml). Protéger les cathéters et des sondes d'écoulement en les mettant sous la veste élastique entre deux pièces de peau de mouton artificielle. L'animal peut maintenant être retourné dans sa cage.

Figure 2. Tapis de course Experiment. Volet gauchels: instrumenté porcine sur le tapis roulant. cathéters remplis de liquide sont reliés aux capteurs de pression, mis sur le dos de la peste. panneau en haut à droite: Vue d'ensemble de la mise en place expérimentale totale, y compris les tapis de course, un amplificateur et un ordinateur d'enregistrement. Bottom panneau de droite: Exemple typique des données hémodynamiques enregistrés. Du haut jusqu'en bas; la pression aortique (AoP, bleu) et la pression ventriculaire gauche (LVP, rouge); la pression auriculaire gauche (LAP, bleu) et la pression ventriculaire gauche (rouge); la pression artérielle pulmonaire (PAP, bleu) et la pression ventriculaire droite (RVP, rouge); débit aortique / débit cardiaque (AoF, bleu); débit coronarien (CBF, rouge). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Résultats
Exercice jusqu'à 5 km / h conduit à un doublement du débit cardiaque à partir de 4,3 ± 0,3 à 8,5 ± 0,7 L / min, qui a été principalement réalisé par une augmentation de la fréquence cardiaque de 137 ± 7 256 ± 8 battements par minute, en combinaison avec un légère augmentation du volume d'éjection de 32 ± 2 à 36 ± 3 ml (figure 3). L'augmentation du volume de la course a été facilitée par une augmentation de la contractilité du ventricul...
Discussion
La présente étude décrit la chirurgie pour chronique instrumentation de la peste ainsi que le protocole d'exercice du porcine instrumenté sur un tapis roulant motorisé tout en mesurant l'hémodynamique et de prendre des échantillons de sang pour la mesure de la teneur en oxygène dans le sang artériel, veineux mêlé et le sang veineux coronaire.
Étapes critiques dans le Protocole
Il existe plusieurs étapes critiques dans le protocole qui commencent déjà au cours de...
Déclarations de divulgation
Les auteurs ont rien à révéler.
Remerciements
Cette étude a été soutenue par les Pays-Bas Coeur Fondation subvention 2000T038 (DJ Duncker) subvention 2000T042 (à D. Merkus), Commission européenne FP7-HEALTH-2010 subvention MEDIA-261409 (à DJ Duncker et D. Merkus), Initiative de recherche cardiovasculaire Pays-Bas: la Fondation Coeur néerlandais, la Fédération néerlandaise des centres médicaux universitaires, l'Organisation néerlandaise pour la recherche en santé et le développement et l'Académie royale néerlandaise des sciences CVON- ARENA CVON 2011-11 (DJ Duncker), CVON-PHAEDRA CVON2012-08 (à D. Merkus) et CVON reconnexion CVON 2014-11 (DJ Duncker et D. Merkus), Fondation Sophia (à D. de Wijs-Meijler, D. Merkus et IKM Reiss).
matériels
| Name | Company | Catalog Number | Comments |
| 3-way stopcocks | B. Braun | 16496 | |
| Perfusor lines PVC (DEHP-free) 150 cm/2.6 ml | B. Braun | 8722960 | Used for fluid filled catheters |
| “python “ silicontubing | Rubber BV | 1757 ID 1 mm, OD 2 mm | Used for fluid filled catheters |
| Sodium Chloride 0.9% | Baxter | TKF7124 | |
| Glucose 10% | Baxter | WE0163 | |
| Suction device | |||
| Slim-Line electrosurgical pencil with 2 buttons | ERBE ELEKTROMEDIZIN GMBH | 20190-066 | |
| Servo Ventilator SV900C | Siemens-Elema AB | ||
| Laryngoscoop | Vererinary Technics Int. | 11.02.47 | |
| Sterile surgical gloves | |||
| tie-on surgical mask | 3M | 1818FS | |
| surgical hat | Klinidrape | 621301 | |
| Procedure pack | Molnlycke Health Care | 97027809 | Surgical drape, gauze pads, syringes, beaker etc |
| Droptears | Alcon | 288-28282-01 | |
| Betadine scrub 75 mg/ml Povidone-iodine | Meda Pharma BV | RVG08939 | |
| Betadine solution 100 mg/ml Povidone-iodine | Meda Pharma BV | RVG01331 | |
| Cuffed Endotracheal tube | Emdamed | size depends on animal size | |
| Breathing filter Hyrdo therm 3HME | Intersurgical | 1560000 | |
| Laryngoscope Handle+ Miller blade size 4 | Kawe Germany | ||
| Manual resuscitator- Combibag | Weinmann | 6515-12-313-5596 | |
| Perivascular flow probe 3PS | Transonic | For coronary artery; Size 2.5 - 4 mm depending on animal size | |
| Confidence flow probe | Transonic | For aorta/pulmonary artery, 16 - 20 mm; size depends on animal size | |
| Venflon-Venisystem 20 G x 32 mm | BD | 393224 | For coronary venous catheter |
| Blunt Needle 18 G | For coronary venous catheter | ||
| Tygon Tubing | Rubber BV | 2802 ID 0.8 mm (1/32’’), OD 2.4 mm (3/32’’) | For coronary venous catheter |
| Suction Handle 17 cm 6 6/8 " Coupland 18/8 martinit with tube connector | KLS Martin Group | 18-575-24 | |
| Scalple blade | |||
| Scalpel Handle 13.5 cm 5 3/8 " Stainless Steel solid | KLS Martin Group | 10-100-04 | |
| Vascular Forceps 20.2 cm 8 " De Bakey Stainless Stee | KLS Martin Group | 24-388-20 | ± 14 cm |
| Dressing Forceps 17 cm 6 6/8 " Cushing Stainless Steel | KLS Martin Group | 12-189-17 | ± 18 cm |
| halsted-musquito straight 12.5 cm - 5" | Rudolf Medical | RU-3100-13 | ± 12 cm |
| halsted-musquito curved 12.5 cm - 5" | Rudolf Medical | RU-3101-12 | ± 12 cm |
| Dissecting and Ligature Forceps 13 cm 5 1/8 " Gemini Stainless Steel | KLS Martin Group | 13-451-13 | ± 12 cm |
| Dissecting and Ligature Forceps 18.5 cm 7 2/8 " Schnidt Stainless Steel | KLS Martin Group | 13-363-18 | |
| Rib Retractor Finochietto, Baby Aluminium - | KLS Martin Group | 24-162-01 | |
| suture forceps Mayo-Hegar 3 mm 18 cm - 7" | Rudolf Medical | RU-6050-18 | |
| Metchenbaum blunt curved 14.5 cm - 5(3/4)" | Rudolf Medical | RU-1311-14M | |
| Retrector farabeuf 12 cm - 4 (3/4)" | Rudolf Medical | RU-4497-12 | |
| Towel forceps schrädel curved 9cm - 3,5" | Rudolf Medical | RU-3550-09 | |
| surgical scissors blunt 13 cm - 5" | Rudolf Medical | RU-1001-13 | |
| Gauzes Cutisoft 10 x 10 cm 4-ply | BSN Medical | 45846-00 | |
| Gauzes Cutisoft 5 x 5 cm 4-ply | BSN Medical | 45844-00 | |
| Flowmeter -CM2 / SF2 - 2gas (O2 and Air) | UNO BV | 180000008 | |
| Tec 7 Vaporizer | Datex-Ohmeda | ||
| Acederm wound spay | Ecuphar NV | ||
| Vaseline Album | Bufa | 165313 | |
| silkam 3-0 Natural silk, non-absorbable | B. Braun | F 1134043 | sutures for placement of catheters |
| silkam 2-0 Natural silk, non-absorbable | B. Braun | F 1134051 | sutures for muscular approximation |
| dagrofil 3-0 Polyester, non-absorbable | B. Braun | C 0842478 | sutures for fluid fille catheters after tunneling |
| Vicryl rapide 3-0, 1 x 45 cm FS2, V2930G | Daxtrio medische producten | 15560 | sutures for electrical catheters after tunneling |
| Vitafil 6 USP | SMI | 6080 | Ties |
| Syringes | 10 ml and 2.5 ml | ||
| Heparin LEO (heparin sodium) | LEO Pharma A/S | ||
| Zoletil | Virbac | tiletamine / zolazepam | |
| Sedazine | AST farma | 108855 | xylazine |
| Temgesic | RB Pharmaceuticals | 5429 | buprenorphine |
| Tensogrip | BSN Medical | 71522-00 | elastic vest |
Références
- Laughlin, M. H., et al. Peripheral circulation. Compr Physiol. 2, 321-447 (2012).
- Datta, D., Normandin, E., ZuWallack, R. Cardiopulmonary exercise testing in the assessment of exertional dyspnea. Ann Thorac Med. 10, 77-86 (2015).
- Vatner, S. F., Braunwald, E. Cardiovascular control mechanisms in the conscious state. N Engl J Med. 293, 970-976 (1975).
- Duncker, D. J., Bache, R. J. Regulation of coronary blood flow during exercise. Physiol Rev. 88, 1009-1086 (2008).
- Tune, J. D., Gorman, M. W., Feigl, E. O. Matching coronary blood flow to myocardial oxygen consumption. J Appl Physiol. 97 (1985), 404-415 (2004).
- van den Heuvel, M., et al. Coronary microvascular dysfunction in a porcine model of early atherosclerosis and diabetes. Am J Physiol Heart Circ Physiol. 302, H85-H94 (2012).
- Zhou, Z., et al. Pulmonary vasoconstrictor influence of endothelin in exercising swine depends critically on phosphodiesterase 5 activity. Am J Physiol Lung Cell Mol Physiol. 306, L442-L452 (2014).
- Pereda, D., et al. Swine model of chronic postcapillary pulmonary hypertension with right ventricular remodeling: long-term characterization by cardiac catheterization, magnetic resonance, and pathology. J Cardiovasc Transl Res. 7, 494-506 (2014).
- Mercier, O., et al. Endothelin A receptor blockade improves regression of flow-induced pulmonary vasculopathy in piglets. J Thorac Cardiovasc Surg. 140, 677-683 (2010).
- Spinale, F. G., et al. Chronic supraventricular tachycardia causes ventricular dysfunction and subendocardial injury in swine. Am J Physiol. 259, H218-H229 (1990).
- Yarbrough, W. M., Spinale, F. G. Large animal models of congestive heart failure: a critical step in translating basic observations into clinical applications. J Nucl Cardiol. 10, 77-86 (2003).
- Duncker, D. J., Stubenitsky, R., Verdouw, P. D. Autonomic control of vasomotion in the porcine coronary circulation during treadmill exercise: evidence for feed-forward beta-adrenergic control. Circ Res. 82, 1312-1322 (1998).
- Stubenitsky, R., Verdouw, P. D., Duncker, D. J. Autonomic control of cardiovascular performance and whole body O2 delivery and utilization in swine during treadmill exercise. Cardiovasc Res. 39, 459-474 (1998).
- Zhou, Z., et al. Phosphodiesterase-5 activity exerts a coronary vasoconstrictor influence in awake swine that is mediated in part via an increase in endothelin production. Am J Physiol Heart Circ Physiol. 306, H918-H927 (2014).
- Gross, D. R. . Animal Models in Cardiovascular Research. , (2009).
- Merkus, D., Duncker, D. J. Perspectives: Coronary microvascular dysfunction in post-infarct remodelled myocardium. Eur Heart J Suppl. 16, A74-A79 (2014).
- de Beer, V. J., de Graaff, H. J., Hoekstra, M., Duncker, D. J., Merkus, D. Integrated control of pulmonary vascular tone by endothelin and angiotensin II in exercising swine depends on gender. Am J Physiol Heart Circ Physiol. 298, H1976-H1985 (2010).
- Lautt, W. W. Resistance or conductance for expression of arterial vascular tone. Microvasc Res. 37, 230-236 (1989).
- Merkus, D., et al. Phosphodiesterase 5 inhibition-induced coronary vasodilation is reduced after myocardial infarction. Am J Physiol Heart Circ Physiol. 304, H1370-H1381 (2013).
- Heusch, G. The paradox of alpha-adrenergic coronary vasoconstriction revisited. J Mol Cell Card. 51, 16-23 (2011).
- Merkus, D., Houweling, B., van den Meiracker, A. H., Boomsma, F., Duncker, D. J. Contribution of endothelin to coronary vasomotor tone is abolished after myocardial infarction. Am J Physiol Heart Circ Physiol. 288, H871-H880 (2005).
- Haitsma, D. B., et al. Minimal impairment of myocardial blood flow responses to exercise in the remodeled left ventricle early after myocardial infarction, despite significant hemodynamic and neurohumoral alterations. Cardiovasc Res. 52, 417-428 (2001).
- Bender, S. B., van Houwelingen, M. J., Merkus, D., Duncker, D. J., Laughlin, M. H. Quantitative analysis of exercise-induced enhancement of early- and late-systolic retrograde coronary blood flow. J Appl Physiol. 108 (3), 507-514 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon