A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
משיכת ממברנה צינוריות מן שלפוחית Unilamellar ענק
* These authors contributed equally
In This Article
Summary
חלבונים רבים בתא לחוש, זירוז עקמומיות ממברנה. אנו מתארים שיטה למשוך ממברנה צינוריות מן השומנים שלפוחית את האינטראקציה של חלבונים או כל מולקולה עקמומיות-פעיל עם ממברנות מעוקל חוץ גופית בתוך.
Abstract
העיצוב מחדש של קרום התא הוא חלק בלתי נפרד של תופעות סלולר רבות, כגון אנדוציטוזה, סחר בבני אדם, היווצרות של filopodia, וכו '. הרבה חלבונים שונים לשייך ממברנות מעוקל בגלל היכולת שלהם לחוש או זירוז עקמומיות ממברנה. בדרך כלל, תהליכים אלה כוללות מספר רב של חלבונים הפיכתם מורכב מדי ללמוד באופן כמותי בתא. אנו מתארים את פרוטוקול שתפעילי. מחדש ממברנה מעוקל במבחנה, מחקה את מבנה הסלולר מעוקל, כגון בצוואר endocytic. שלפוחית unilamellar ענק (בוס) משמש כמודל של קרום התא, אשר מתח ולחץ פנימי נשלט עם השאיפה micropipette. החלת של נקודת כוח מושך על הבוס באמצעות מלקחיים אופטיים יוצר שפופרת הנאנו עקמומיות גבוהה מחובר קרום שטוח. שיטה זו באופן מסורתי שימש כדי למדוד את התכונות המכאניות הבסיסית של ממברנות השומנים, כגון כפיפת קשיחות. בשנים האחרונות, זה הורחבה כדי ללמוד איך חלבונים אינטראקציה עם ממברנה עקמומיות ועל הדרך שבה הם משפיעים על הצורה והן את המכניקה של ממברנות. מערכת המשלבת חוץ-גופית, microinjection, מלקחיים אופטיים, מיקרוסקופיה קונפוקלית מאפשר מדידה של עקמומיות הממברנה מתח הממברנה, צפיפות המשטח של חלבונים, במקביל. מ מדידות אלה, שניתן להסיק נכסים חשובים רבים מכני ולא מורפולוגי של מערכת חלבונים-הממברנה. בנוסף, אנו להניח את פרוטוקול של יצירת כשמרוגזים בנוכחות ריכוז מלח פיזיולוגית, שיטה לכימות צפיפות המשטח של חלבונים על הקרום של עוצמות קרינה פלואורסצנטית שכותרתו חלבונים ושומנים.
Introduction
תהליכים תאיים רבים, כגון אנדוציטוזה, סחר, היווצרות של filopodia, זיהום, וכדומה, מלווים בשינוי דרמטי הצורה של קרום התא1,2. בתא, מספר חלבונים להשתתף תהליכים אלה על ידי איגוד הקרום ושינוי הצורה שלהם. הדוגמאות הבולטים ביותר הם בני משפחת חלבונים Bin/Amphiphysin/מ א (בר), המכיל מאפיין מהותי מעוקל בר תחום3,4,5,6,7. בדרך כלל, הם אינטראקציה עם הקרום על-ידי שמירה התחום בר אל פני השטח, במקרים רבים, גם רדודות הוספת amphipathic helices bilayer. הצורה, בגודל תשלום של התחום בר יחד עם מספר amphipathic helices קובע: (1) לכיוון קרום עקמומיות (כלומר, אם הם יניעו invaginations או בליטות), (2) בסדר גודל של קרום עקמומיות5,8. ראוי לציין, כאן עקמומיות חיובית מוגדרת בתור הצד הקמור של קרום מעוקל, קרי, הבליטה כלפי בחלקיק אינטראקציה, ושליליות אחרת. יתר על כן, מחקרים כמותיים של בר חלבונים חשף כי השפעתם על הקרום תלויה סט של פרמטרים פיזיקליים: משטח צפיפות של חלבונים, מתח הממברנה ממברנה צורה (שטוח לעומת צינורי לעומת כדורית הצורה)7. בהתאם פרמטרים אלה בר חלבונים יכולים: (1) מתנהג כמו חיישנים עקמומיות ממברנה, (2) לכופף ממברנות או (3) זירוז ממברנה scission7.
בשל המספר העצום של רכיבים מעורב שינוי צורה קרום התא, לומד בהיבטים כמותיים של התופעה, כגון אנדוציטוזה, ויוו הוא מאוד מאתגר. במבחנה הכינון של רכיבים מינימלי מחקה מעוקל ממברנות התא מספק אמצעי כדי להשיג הבנה מכניסטית של איך מתעקל קרום חלבונים לפעול. מאמר זה מתאר פרוטוקול שתפעילי. מחדש ממברנה nanotube במבחנה באמצעות חוץ-גופית, מיקרוסקופיה קונפוקלית מלקחיים אופטיים. הגישה ניתן ללמוד, באופן כמותי, כמה חלבונים, שומנים, או מולקולות קטנות אינטראקציה עם ממברנות מעוקל. האנשים שנגדם השומנים משמשים כמודלים של קרום התא, עקמומיות של מי הוא זניח בהשוואה לגודל של מולקולות מתעקל ממברנה אינטראקציה. . הם מוכנים באמצעות שיטת electroformation9 שבו השלפוחיות המוגלתיות נוצרות על ידי לחות סרט השומנים ונפיחות זה לתוך האנשים שנגדם תחת זרם חילופין (AC)10. מצעים הנפוץ ביותר שבו גדלים כשמרוגזים לוחיות גם מוליך למחצה מצופה תחמוצת בדיל אינדיום (ITO) או פלטינה חוטים (Pt-חוטים)11. בעבודה זאת, האנשים שנגדם גדלים Pt-חוטים כמו בשיטה זו הוכח לעבוד הרבה יותר טוב מאשר החלופה בקבלת כשמרוגזים בנוכחות מלחים מאגר12. למרות פרוטוקול electroformation מתואר כאן בפירוט מספיק כדי לשחזר את הכל, אנו להפנות את הקורא למאמרי הקודם בו תוארו דומה ושיטות אחרות של עשיית כשמרוגזים פרט13,14. בידיים שלנו, electroformation-Pt-חוטים בהצלחה הניב כשמרוגזים שילוב של ליפידים סינטטי או טבעי השומנים תמציות במאגר המכיל ~ 100 מ"מ NaCl. יתר על כן, היה גם אפשר לתמצת חלבונים בתוך האנשים שנגדם במהלך צמיחה. תא electroformation לדוגמה מוצג איור 1A; היא כוללת שני ~ 10-ס מארוך Pt-חוטי מוכנס לתוך בעל עשוי טפלון (PTFE) זה יכול להיות אטום משני הצדדים עם coverslips זכוכית דקה ~ 1-2 סנטימטרים (איור 1 א').

איור 1: הגדרת הניסוי. (א) electroformation בוס קאמרית עם מחברים חשמליים המוצמד Pt-חוטים. שמאל (B): מערכת ניסויית מציג את המיקרוסקופ, תא ניסיוני מעל המטרה, שני micropipettes (ימינה ושמאלה) לחבר micromanipulators ונוסף תא ניסיוני עבור צינור למשוך וחלבון זריקה. משמאל: מבט מקרוב על תא ניסיוני רכוב מעל המטרה מציג את הטיפים של השאיפה, את micropipettes הזרקה שנוספה. (ג) A המזרק המצויד מתקן דק מוכנס לתוך micropipette בקצה האחורי שלו. החלק התחתון הוא להציג מקרוב מנפק פנימה micropipette עם הקו המקווקו כחול חלוקה לרמות של micropipette. מערכת זו משמשת כדי למלא את micropipette עם קזאין passivate משטח זכוכית וגם בחזרה מילוי עם שמן מינרלי בעת הצורך. (ד) A מערכת המשמשת האחות µL כמויות של הפתרון חלבון. המחט מחוברת מזרק, אבובים אשר מחובר micropipette הזריקה. הטיפ micropipette בקפידה שקוע בתוך תמיסת חלבון, aspirated אז כדי למלא את הטיפ micropipette. Micropipette ואז בחזרה מלא שמן מינרלי באמצעות מערכת שמוצג בחלונית ג אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
שפופרת הנאנו ממברנה, הנעות בטווח מ מ-7 nm מספר מאות ננומטר, יכול להיות משך של בוס על ידי כוח חיצוני. שיטה זו תוכנן בתחילה כדי למדוד את המאפיינים אלסטי של קרום התא ושלפוחיות, כגון ה15,כיפוף קשיחות16. בעבודותיו האחרונות, השיטה הוארך כדי ללמוד את האינטראקציה של חלבונים עם ממברנות מעוקל מאת microinjecting את החלבונים ליד ה-7,nanotube משך17. פותחו שיטות אחרות ללמוד מתעקל קרום חלבונים. בשיטה אחת, חלבונים מודגרת עם ליפוזומים בגודל שונה קשור משטח passivated. מיקרוסקופיה קונפוקלית משמש כדי למדוד את חלבון מחייב כפונקציה של ליפוזום קוטר, אשר יכולה להצביע על עקמומיות-induced המיון18,19. שיטה נוספת החלבונים מוזרקים סמוך בוס aspirated מיקרו כדי למדוד את היכולת שלהם באופן ספונטני זירוז בקוריאנית20,21. השיטה המתוארת ב פרוטוקול זה הוא לצורכיכם ללמוד מתעקל ממברנה החלבונים המעורבים אנדוציטוזה, שבו רוב החלבונים בדרך כלל המפגש ממברנה preformed צינורות חיבור של invagination ממברנה המכילים מטען עם קרום פלזמה שטוח המשמש כבסיס. יתר על כן, בשיטה זו, בניגוד ב וזמינותו עם עגינה ליפוזומים קטנים, nanotube ממברנה ללא הרף מחובר הקרום; לכן, זה שיווי משקל מכני עם הבוס, המצב צפוי ויוו. לפיכך, הממברנה הבסיסית פיזיקה חל, אנחנו יכולים להסיק שפע של תכונות מכניות שלנו מדידות22,23,24.
עבור יישום מלא של שיטה זו, הציוד הנדרש כולל מיקרוסקופ קונפוקלי מלקחיים אופטיים, micropipettes אחד או שניים מחובר מיכל מים (איור 1B). על ידי שילוב של כל השלושה, זה האפשרות במקביל למדידת מתח הממברנה, עקמומיות ממברנה, צפיפות המשטח של חלבונים, צינור כוח25. השאיפה micropipette הוא חיוני, היא בנויה בקלות על-ידי הוספת micropipette של זכוכית בעל מחובר מיכל מים, השולטת, באמצעות לחץ הידרוסטטי, שאיפה הלחץ26. את micropipette ואת המחזיק נשלטים על-ידי micromanipulator ו, באופן אידיאלי, בכיוון אחד על ידי אלמנט פייזו-למפעיל לתנועה דיוק. כדי למשוך שפופרת הנאנו, microaspirated בוס תקוע בקצרה בגודל מיקרון חרוז ואז משם יצירת שפופרת הנאנו. ביישום זה, החרוז מתקיים על ידי מלקחיים אופטיים, אשר ניתן לבנות על-ידי ביצוע של פרוטוקול שפורסמו27. זה אפשרי לוותר של מלקחיים אופטיים, למשוך צינוריות בדרכים שונות, אם כי במחיר של מדידות מדויקות כוח. אם זה יותר מדי אתגרי לבנות מלכודת אופטי או אם כוח המידות הם לא חיוניים, כמו למשל אם אדם פשוט רוצה לבדוק את ההעדפה של חלבונים לממברנות מעוקל, יכול להיות משך צינור חרוז aspirated בקצה השני micropipette28. . זה גם ניתן למשוך צינורות באמצעות כוח כבידה29 או30,31לזרום... יתר על כן, מיקרוסקופיה קונפוקלית אינה חיונית גם; עם זאת, זה הוא העדיף אז למדידת צפיפות המשטח של חלבונים. זה גם מאפשר מדידת הרדיוס nanotube מפני קרינה פלואורסצנטית האינטנסיביות של ליפידים בצינור, ובכך ללא תלות ממברנה כוח ומתח. מסיקה רדיוס שפופרת של קרינה פלואורסצנטית חשוב במיוחד אם היחסים בין כמויות אלה סוטה משוואות ומבוססת בשל נוכחותם של חלבוני ממברנה-דבקה25. חשוב, אחד לא יכול לחלק של מלכודת אופטי והן מיקרוסקופיה קונפוקלית, כפי שזה לא יהיה אפשר למדוד את שיפוע הצינור.
השיטה כפי שמתואר פרוטוקול זה שימש ללמוד עקמומיות-induced המיון של חלבונים שונים ממברנה פריפריאלי על צינוריות, בעיקר אלה של בר משפחה25,32,33,34 . היא שודרה גם בערוץ אשלגן transmembrane conically בצורת ש-kvap מועשר על מעוקל צינוריות. באותה דרך כמו בר חלבונים35. על-ידי מיטוב השיטה כדי לכמס חלבונים בתוך בסדר, פרנקי, האינטראקציה של חלבונים עם עקמומיות שלילית נחקר לאחרונה בשם טוב36. יתר על כן, שיטה זו שימש התירי את היווצרות החלבון פיגומים25,37 , ללמוד את המנגנון של הממברנה scission או קו המתח38, חלבון dynamin39, או על ידי בר חלבונים40,41. בנוסף חלבונים, מולקולות קטנות או יונים יכול גם לגרום עקמומיות. באמצעות שיטה זו, יונים של סידן הוצגו לזירוז עקמומיות חיובית תחת תנאים ללא מלח42. מעניין, גם הוכח כי שומנים יכולות לעבור עקמומיות מיון, למרות רק עבור קומפוזיציות הסמוכים demixing נקודה43,44. לסיכום, שיטת יכול לשמש על ידי חוקרים המעוניינים לחקור איך גם רכיבים ממברנלי אינטגרלי (למשל, שומנים או חלבונים transmembrane) או באופן עקיף מחייב מולקולות (גם בתוך או מחוץ כשמרוגזים) אינטראקציה עם ממברנות cylindrically מעוקל, נקודות מבט מכני ולא כמותית. זה גם מיועד למעוניינים מדידת תכונות מכניות של קרום עצמה22,23,45.
Protocol
1. הכנת האנשים שנגדם מאת Electroformation ב- Pt-חוטים
- לנקות את התא electroformation (ראה מבוא ו איור 1A) ו- Pt-החוטים של הממס האורגני כגון אתנול או אצטון לשטוף ליפידים, עם מים כדי לשטוף את המלחים.
הערה: אנו מציעים ביסודיות לנגב את השאריות עם טישו ספוג אתנול ואז sonicating אצטון, אתנול, אז מים, כל אחד למשך 5 דקות. - להכין תערובת השומנים של הרכב השומנים הרצוי-1 מ"ג/מ"ל ב כלורופורם. המיקס צריך להכיל ~ 0.05% שבר שן טוחנת של ליפופרוטאין מצומדת עם ביוטין (לדוגמה, 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000]) ו ~ 0.5% שבר שן טוחנת של ליפופרוטאין מצומדת עם (fluorophore למשל, BODIPY-TR-C5-ceramide).
הערה: מניסיוננו, היה קשה לייצר כשמרוגזים-תשואה גבוהה המכיל יותר מ 30% מחויב שומנים.
התראה: כלורופורם צריך להיות מטופל בתוך ברדס כימי לבש כפפות מתאימות. - הכנס זוג חוטים-Pt תא electroformation. להפקיד את התמהיל השומנים על החוטים Pt בטיפות המופרדות על-ידי ~ 2-3 מ מ (סה כ ~ 4 µL של המיקס).
- יבש את החוטים תחת ואקום למשך 30-60 דקות בטמפרטורת החדר.
- חותם בתחתית התא על-ידי שמירה של coverslip על החדר באמצעות סיליקון גריז. למלא את החדר עם פתרון במאגר המכיל NaCl סוכרוז, סוכן חציצה (למשל70 מ"מ NaCl, סוכרוז 100 מ מ, 10 מ מ. טריס, ב- pH 7.4). בינוני יהיה בפנים האנשים שנגדם לניסוי. זה חיוני כי osmolarity של המדיום הזה תואם את osmolarity של המדיום ניסיוני בתוך ~ 10%. השתמש סוכרוז כדי להתאים את osmolarity. להוסיף חלבונים הפתרון-ריכוז הרצוי, אם המטרה היא לתמצת אותם ב- בסדר, פרנקי.
התראה: מלחים שונים, סוכרים במאגר יכולים להשפיע את הנוקשות כיפוף, את העקמומיות ספונטנית של ממברנות24,42,46,47. - חותם העליון של החדר על-ידי שמירה של coverslip עם גריז סיליקון הבטחת מינימום אוויר בתוך החדר. החלת סינוס AC זרם דרך החוטים-Pt-500 הרץ ו- 280 mV.
הערה: הצמיחה זמן וטמפרטורה חייב להיות מוטבת בהתאם הרכב השומנים ואת הרגישות של החלבון. בעת שימוש תמציות השומנים הטבעיים, גם כאשר לבצע חלבונים בבסדר, פרנקי, התשואה הטובה ביותר הושגה על ידי הגדלה כשמרוגזים ב 4 מעלות צלזיוס למשך הלילה. בהיעדרו של חלבונים, ועל יצירות השומנים סינתטי, צמיחה בטמפרטורת החדר במשך ~ 2 h היה מספיק.
2. הכנת החדר ניסיוני, את Micropipettes
- כדי להכין micropipettes, משוך על נימי זכוכית באמצעות של פולר פיפטה. הוא הציע להשתמש על נימי זכוכית עם רדיוס פנימי וחיצוני, בהתאמה, 0.7 מ"מ ו 1 מ מ. לאחר מכן, ללטש את קצה micropipette כך הקוטר הפנימי שלה הוא 5–מיקרומטר 7, על-ידי שימוש של microforge. אם חלבונים או מולקולות אחרות להיות מוזרק לניסוי, משוך micropipette אחר, ללטש את קצהו כדי קוטר פנימי של 8–15 מיקרומטר.
- לבנות חדר ניסיוני על ידי הצבת שני coverslips מיקרוסקופ מלבני על בסיס מתכתי כמוצג באיור1. Coverslips ניתנת להפרדה על ידי ~ 1 מ מ. החדר צריך להיות פתחים לאורך שולי ארוך (ראה איור 1). הצדדים פתוח צריך להתאים את קצה micropipette שם הטיפ צריך להגיע לפחות במרכז תא
- הכנת המאגר ניסיוני של מי osmolarity לא צריך שונות על ידי יותר מ-10% מן המאגר המשמש לגדול בסדר, פרנקי. להתאים את osmolarity עם גלוקוז. דוגמה של מאגר ניסיוני ששימש ללמוד את האינטראקציה של endophilin עם צינורות הוא 100 מ מ NaCl, גלוקוז 40 מ מ, באגירה מלאה עם טריס ל pH 7.4. שילוב של סוכרוז בפנים / גלוקוז בחוץ מבטיח: חדות מספקת (א) שלב לבחון. את האנשים שנגדם עם מיקרוסקופיית שדה בהיר, צפיפות גבוהה (ב) בפנים האנשים שנגדם הגורמת אותם להתיישב על החלק התחתון של החדר. להתאים את ריכוז המלחים בהתבסס על הדרישה ניסיוני.
הערה: בנוסף המשפיעים על תכונות מכניות של הקרום, מניסיוננו, ריכוז גלוקוז גבוהות (> 300 מ מ) באופן שלילי משפיע על הקמת חוב streptavidin-ביוטין, נדרש לבצע שפופרת הנאנו. יתר על כן, חסר מלח מעכב חוב streptavidin-ביוטין, בעוד גבוה מדי של ריכוז מסכי אינטראקציות חלבון-הממברנה. במקרה של חלבון כימוס, באמצעות ריכוז המלח גבוה מאוד במאגר חיצוני (למשל> 200 מ"מ NaCl) יכול לשמש תכסיס כדי לנתק את החלבונים מן העלון החיצוני36. יש צורך במגוון של ריכוז מלח כדי למצוא את התנאים המחייבים אופטימלית של המולקולה של עניין. -
30-60 דקות לפני איסוף האנשים שנגדם לניסוי, passivate את משטחי זכוכית על-ידי מילוי החדר ניסיוני והן את השאיפה micropipette עם פתרון 5 מ"ג/מ"ל של מאוד טהור β-קזאין (למשל, מומס המאגר ניסויית). Β-קזאין יוצר שכבת הגנה על משטחים מזכוכית, מניעת כשמרוגזים לדבוק גם חריפה, אשר תגרום להם להתפוצץ. דגירה עם β-קזאין למשך 30-60 דקות.
הערה: צריך להיות אין בועות בתוך micropipette זה היה מפריע לשליטה במתח הממברנה.- כדי לבנות מתקן למילוי micropipettes, לשבור מחט מזרק קרוב המחבר פלסטיק, הדבק לתוכו נימי סיליקה דק (כגון אלה שימשו כרומטוגרפיה נוזלית) (איור 1C).
- במהלך הדגירה עם β-קזאין, הר התא על המיקרוסקופ, מרכז זה מעל המטרה. הוסף את קצה micropipette השאיפה דרך הפתח לאורך הצד הארוך ולהביא את הטיפ מעל המטרה מיקרוסקופ. להתאים את רמת טנק של מים כך הלחץ השאיפה קרובה לאפס (שם צריך להיות אין זרימה כבדה או להיכנס הפיפטה אשר ניתן לראות תחת המיקרוסקופ).
-
במקרה של החלבונים או מולקולות אחרות להיות מוזרק במהלך הניסוי, למלא micropipette הזרקת עם מולקולת הרצוי מומס המאגר ניסיוני-ריכוז של בחירה, לטעון את micropipette פנימה micromanipulator, ו הכנס דרך הצד ההפוך של תא ניסיוני.
- כדי להשתמש סכום מינימלי של חלבונים, למלא רק את הטיפ micropipette החלבון על ידי השאיפה. כדי לעשות זאת, לעטוף את הסוף של מחט המצורפת מזרק עם צינורות פלסטיק. הכנס את הצנרור לחלק האחורי של micropipette הזריקה.
- בזהירות רבה לטבול את קצה micropipette בתוך תמיסת חלבון, תשאף את זה כדי למלא את קצה micropipette.
הערה: תוכנית התקנה פשוטה זו מוצג באיור 1D ו, מניסיוננו, זה מאפשר כ רפה בעברית מ קטנה כמו כמה µL של הפתרון חלבון. - מילוי רקע שאר הזרקת micropipette עם שמן מינרלי כדי למנוע ערבוב של הפתרון חלבון ומים ממיכל המים (באמצעות הגדרת ב- 1C איור).
- הקפידו לא להציג בועות אוויר לתוך הפיפטה הזרקה כפי יניעו אותו לא יציב הזרקה בלחץ. לחלופין, אם כמות חלבון מספקת, למלא את micropipette עם החלבונים באותו אופן כמו מילוי עם β-קזאין כפי שמתואר בשלב 2.4. להתאים את רמת טנק של מים כדי למזער את הלחץ השאיפה על פיפטה הזרקת.
הערה: הריכוז של מולקולה מוזרק או יון ליד nanotube יהיה נמוך יותר עקב דילול, זה יכול להיות מוערך על ידי מדידת הירידה עוצמת קרינה פלואורסצנטית כפונקציה של המרחק בין יציאה פיפטה42. עם זאת יותר חשוב לדעת הצפיפות bilayer מכורך של מולקולת מוזרק, אשר יכול להיות בדיוק נמדד (ראה סעיף 4).
- לאחר דגירה עם β-קזאין, להסיר את הפתרון מן החדר, לשטוף עם המאגר ניסיוני מספר פעמים. למלא מאגר ניסיוני.
- לעצור את electroformation של האנשים שנגדם ולאסוף אותם ישירות מ- Pt-חוטי החשמל. להוסיף כמה µL של הפתרון בוס אל התא ניסיוני. השתמש רק להתמחויות בסדר, פרנקי.
- להוסיף כמה µL של חרוזים מצופים streptavidin תא ניסיוני כדי ריכוז סופי של חרוזים בבית הבליעה-סביב 0.1 x−3 10% (w/v) או פחות. חרוזי פוליסטירן ~ 3 מיקרומטר בקוטר מומלצים (חרוזי פוליסטירן במים יש ניגוד ליד אופטימאליים מקדם שבירה לגבי הגדלת הכוח ההדרגתיות ביחס הכוח פיזור במלכודת אופטי). ריכוז חרוז ניתן להתאים בהתבסס על הניסוי: ריכוז נמוך מאוד מקשה למצוא אותם בבית הבליעה, ריכוז גבוה מדי של מפעיל את הסיכון של חרוזים מרובים נפילתן מלקחיים אופטיים.
3. מושך את שפופרת הנאנו ממברנה מ בוס
- . תן את האנשים שנגדם ולהתיישב החרוזים לחלק התחתון של החדר. השטחת קצה את האנשים שנגדם בלתת קצת המאגר ניסיוני להתאדות, עבור ~ 15 דקות מרוקן את האנשים שנגדם הוא חיוני כדי לייצר כמה שטח עודף זה יכול להיות aspirated עם micropipette. האנשים שנגדם צריך undulate בעליל (קרי, מופיעים תקליטונים) תחת מיקרוסקופ אור. אם הם מופיעים מתוח, לאפשר יותר זמן התאדות.
הערה: קצב שינוי osmolarity תלוי את פני השטח אידוי, טמפרטורה וכו ', צריך להיות במעקב צמוד. בעקרון, אפשרות לקבוע את ההבדל osmolarity מההתחלה על-ידי התאמת את הריכוז סוכרוז/גלוקוז, עם זאת, כדאי לשים לב לא לזירוז מכת אוסמוטי. - למצוא בוס תקליטונים, תשאף את זה לתוך פיפטה. האורך של הלשון השאיפה (החלק של הקרום בתוך פיפטה) צריך להיות שווה או גדול יותר מאשר הרדיוס פיפטה על הניתוח התיאורטי להיות ישים15,16,22,23 ( איור 2). נסה מספר האנשים שנגדם. אם אף אחד האנשים שנגדם יכול להיות aspirated לייצר לשון ארוכה מספיק, להמתין עוד כמה דקות. אם האנשים שנגדם מספיק תקליטונים, המשך לשלב הבא.
- חותם את התא עם שמן מינרלי, כדי למנוע אידוי של המאגר. לעשות זאת באמצעות pipetting בקפידה את השמן לאורך קצות החדר ניסיוני פתוח.
- כדי להגדיר את מיקום נקודת האפס של הלחץ השאיפה, ראשית, לחפש חרוז בבית הבליעה ומקם את היציאה פיפטה השאיפה ליד החרוז. להתאים את הגובה של מיכל המים כך החרוז הוא לא ינקה ולא התפוצץ עם פיפטה השאיפה. למרות שמן מינרלי מונע התאדות שינויים נוספים ולכן הלחץ בתוך החדר, אפס את הלחץ השאיפה לפני מדידת כל בוס.
- למצוא בוס, תשאף את זה. להעביר את micropipette ולא בפוקוס (כדי לשמור על הבוס מהמשטח איפה זה יכול להיות הוציא על פיפטה על ידי גזירה כאשר התא מועבר).
- חפשו חרוז על-ידי הזזת בזהירות סביב החדר. תנועות פתאומיות אפשרות להוציא הבוס. לינגוויני עם מלקחיים אופטיים ממרחק ~ 20 מיקרומטר הרחק בתחתית קאמרית. ודא כי האזור עניין נקי ללא חרוזים או ממברנות באופק. משהו בהתאהבות של מלקחיים אופטיים שאינו החרוז ישבש את המדידה.
- להחזיר את הבוס להתמקד, ורחוק החרוז עם micropipette מיושר עם המלכודת אופטי (איור 2).
- להקליט את התנועה של החרוז למשך 1-2 דקות למדוד את מיקום שיווי משקל (נדרש למדידות כוח).
- להפחית את הלחץ בתוך micropipette ככל האפשר מבלי לאבד את הבוס כדי להפחית את מתח הממברנה. בקפידה להביא הבוס בקשר עם החרוז עבור סביב שנייה, יצירת קשרים streptavidin-ביוטין, ולאחר מכן משוך בעדינות בחזרה יצירת שפופרת הנאנו. התנועה של הבוס או רחוק החרוז צריך להיעשות באופן אידיאלי עם אלמנט פייזו-למפעיל מינימלית לשבש החרוז ב מלקחיים אופטיים.
הערה: אם nanotube אינו הטופס, זה יכול להיות בגלל ציפוי streptavidin המסכן של החרוז, כמות מספקת של biotinylated שומנים בהבוס, לא מספיק ריכוז של ריכוז מלח או עודף של גלוקוז המאגר ניסיוני, או קרום המתח הבוס הוא גבוה מדי48. - להגביר את הלחץ השאיפה כדי לשחזר את הלשון השאיפה. יישר את הצינור לשקר בציר של השאיפה פיפטה ונוחות מקסימאלית על המרקע (איור 2).
- ודא בוס המשווה לבין הצינור בפוקוס. להקליט את התנועה של החרוז עם מיקרוסקופיית שדה בהיר למשך כמה דקות (כאן, מהירות הרכישה המצלמה הוא 30 הרץ). שיא הגובה, h, של מיכל המים ביחס האפס. לקחת כמה תמונות קונאפוקלית של המערכת (איור 2).
- חזור על השלב הקודם על לחצים שונים שאיפה במרומז ממברנה מתחים. טווח מתח טיפוסי הוא 0.015 – 0.2 mN/m, עם גודל צעד של mN חודשי בסביבות 0.02 נקודות.
- אם הזרקת חלבונים או מולקולות ליד המערכת, מביאים את micropipette הזרקת ליד הנאנו, מוודא כי החרוז במלכודת אופטי לא מוטרד. להחדיר בעדינות, בלחץ של סביב אבא 1 – 2
-
לאחר הכריכה חלבון יש equilibrated (עוצמת קרינה פלואורסצנטית של החלבון מוזרק, בקביעות שרידי קרום על הבוס), לחזור על המדידות צעד חכם כמו עם קרום חשופות (שלבים 3.11 ו- 3.12).
הערה: מאז המדידות נעשות תוך כדי הזרקת חלבונים ליד הבוס בלחץ קבוע, בצובר ריכוז החלבון נשמרת בערך ליד הבוס; לפיכך, desorption חלבון צריך להיות זניח במהלך המדידה.- לחלופין, אפשרי דגירה בסדר? יחד עם החלבונים לפני ביצוע ניסויים למשוך צינור כדי להבטיח ריכוז חלבון מתמדת בכמות גדולה. נתון כי השבר ממברנה היחסי של חלבונים על הצינור ועל הבוס נמדד, הדרך חלבונים מועברות לא משפיעים על חישוב עקמומיות-מיון (ראה סעיף 4).
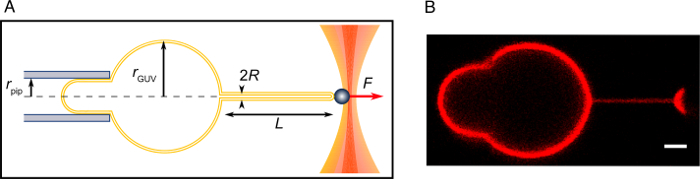
איור 2: ניסוי למשוך צינור. (א) השרטוטים של הניסוי. (B) א תמונה קונאפוקלית של צינור משך כפי שמתואר פרוטוקול זה. סרגל קנה מידה = 2 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
4. מדידות וניתוח נתונים
- מדידת מתח הממברנה
- לחשב את הלחץ ההידרוסטטי עבור כל שלב בלחץ שאיפה מתמדת:
ΔP = pgh
כאשר p הוא צפיפות המים, תאוצת הכובד g ו- h הגובה של מיכל המים מהשלב 3.11. - מתמונות קונאפוקלית, למדוד הרדיוס של הבוס, r.בוס, ואת הרדיוס של השאיפה הפיפטה rפיפ (איור 2).
- לחשב את מתח הממברנה, σ, באמצעות משוואת לפלס49:
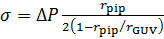
- לחשב את הלחץ ההידרוסטטי עבור כל שלב בלחץ שאיפה מתמדת:
- מדידת כוח ממברנה
- לקבוע את הנוקשות של מלקחיים אופטיים, k, על ידי שימוש באחד כיול מספר שיטות27. בהגדרת הזה, למדוד k באמצעות שיטת גרור צמיגה27.
- לחשב את המיקום שיווי משקל של החרוז, 0,כמו ממוצע בין מדידה לפני שנעלם הצינור (שלב 3.8).
- עבור כל אחת מהמידות מתח מתמיד, לחשב את שיווי משקל ממברנה כוח, F, מתוך חוק הוק:
F = k( - 0)
איפה המיקום הממוצע של החרוז במהלך את המדידה.
- מדידת הרדיוס שפופרת
- במקרה של קרום חשופות (לא הוסיף מתעקל ממברנה מולקולות), חישוב רדיוס שפופרת, R, מכוח כמו:
R = F/(4πσ)
(מפנה22,23). - כדי למדוד את רדיוס צינור בנוכחות מולקולות מתעקל ממברנה, ללא תלות בשלב 4.3.1, ראשית, שיא עוצמת קרינה פלואורסצנטית השומנים לאורך צינור, אניבאמבטיה, ולאורך קו המתאר בוס, אניבוס. למדוד את עוצמת קרינה פלואורסצנטית הממוצע של fluorophore ב או מאוגד למוח כמו עוצמה ממוצעת לאורך הקו המבריקים של צינור או מתאר בוס. בחר תיבה מלבנית המכיל מקטע אופקי של קו המתאר בוס או בצינור, לחשב את סכום עוצמות קרינה פלואורסצנטית כל קו אופקי בתיבה.
- לחלק את כל הסכום על-ידי מספר הפיקסלים של קו אופקי (קרי, את רוחב תיבת). הערה בתיבת שנבחר, צריכות להיות אין ממברנות אחרים הנוכחי. מתקבל לפרופיל עוצמת קרינה פלואורסצנטית לאורכו של התיבה שנבחרה.
- לאחר הפחתת עוצמת רקע, קח את עוצמת קרינה פלואורסצנטית הפיקסלים הממוצע מקו המבריקים. רדיוס צינור קשורה באופן ליניארי היחס של קרינה פלואורסצנטית לאורך קו המתאר של הצינור ואת הבוס כמו:
R = Kהאמבטיהאניבאמבטיה/אניבוס
? איפה Kבאמבטיה כיול פקטור25.
הערה: שיטה זו ניתן למדוד את רדיוס צינור בטווח nm 10-80 (כאשר הצינור צרים מספיק לשקר בתוך אחד voxel קונאפוקלית רוחב) ועם של חוסר ודאות גדול במקצת 80 ננומטר, טווח גבוה יותר. הרגישות של המדידה תלוי ההתקנה.
- לקבוע Kהאמבטיה על ידי ביצוע מדידות רדיוס עצמאית בשלבים 4.3.1, 4.3.2 על קומפוזיציה פשוטה ממברנה בעזרת שומנים לא טעונים. קומפוזיציה פשוטה קרום כזה מבטיח את הרדיוס ואת הכוח שיש הגומלין פשוטה בהתחשב בשלב 4.3.1. חזור על הניסוי מספר פעמים ותכין R, הסיק מן הכוח (שלב 4.3.1) לעומת אניבאמבטיה/אניבוס (שלב 4.3.2). לחשב Kבאמבטיה של התאם. ב תוכנית התקנה זו, Kהאמבטיה = 200 ± 50 ננומטר על-ידי שימוש ביצה L-α-phosphatidylcholine (ביצה-PC) ממברנה, ליפופרוטאין פלורסנט זריחה של מי מינימלית תלוי קיטוב25.
הערה: עבור מטרות שונות, בשל האחסון שלהם שונה voxel קונפוקלי Kהאמבטיה ניתן למדוד בהתאם. Fluorophore השומנים לא צריך אינטראקציה עם החלבונים/מולקולות מוזרק. השומנים פלורסנט מומלץ כאן, BODIPY TR ceramide, לא צפויה להיות באינטראקציה עם החלבונים. הנחה זו אושרה עם מחקרים קודמים של בר ובר תחומים25,36,37, אשר הראו כי-כיסוי משטחים חלבון גבוהה, רדיוס צינור קבוע על ידי החלבונים, ללא קשר המתח הבוס. אם חלבונים אינטראקציה עם fluorophore השומנים, דלדול או העשרה של fluorophore יתקיימו בצינור-שברים משטח מגוונת חלבון גבוהה.
- במקרה של קרום חשופות (לא הוסיף מתעקל ממברנה מולקולות), חישוב רדיוס שפופרת, R, מכוח כמו:
- מדידת צפיפות המשטח של חלבונים
- הכנת תערובות השומנים שימוש פשוט לא טעונים ליפופרוטאין (למשל, ביצה-PC) בתוספת חמישה שברים שומה שונה של ליפופרוטאין פלורסנט (באותם אורכי גל כמו לצבוע נהגה תווית החלבון, למשל, BODIPY-FLC5-hexadecanoyl-phosphatidylcholine (HPC *) עבור למשל, החלבון התווית על-ידי Alexa488) בטווח: XHPC * = 0.01 – 1%. הכן כשמרוגזים ב- 100 מ מ סוכרוז באמצעות electroformation על איטו צלחות (בצע את שלב 1 של הפרסום הקודם13).
- לאסוף את האנשים שנגדם ולהעביר תא ניסיוני passivated עם β-קזאין. השתמש למשלהגלוקוז 100 מ מ עבור הפתרון ניסיוני. המתן דקות אחדות האנשים שנגדם להתיישב.
- קרינה פלואורסצנטית קונאפוקלית תמונות של האנשים שנגדם, שיא עוצמת קרינה פלואורסצנטית הממוצע לאורך הבוס קווי המתאר כפונקציה של השבר השומה של השומנים פלורסנט (ראה שלב 4.3.2). עבור הרכב אחד, חישוב צפיפות אזור השומנים פלורסנט, φHPC*. לדוגמה, על-ידי בהנחה האזור לכל השומנים הוא 0.7 nm2, φHPC* = 1.43 x 106 XHPC * לכל עלון. מגרש HPC * עוצמת קרינה פלואורסצנטית בהבוס, אניHPC *, בוס, לעומת φHPC*. מתאים נותן את כיול הקבוע, A, שניתנו על ידי φHPC* = AIHPC *, בוס. א תלוי בהגדרות מיקרוסקופ, כמו את עוצמת הלייזר ואת הרגישות גלאי (קרי, רווח), לכן להקליט A עבור שונים נפוץ הגדרות מיקרוסקופ (עיין בדוגמה באיור 3).
- להכין מספר פתרונות של HPC * מומס דטרגנט, למשל, dodecyl-סולפט נתרן (מרחביות), בריכוזים שונים בטווח של ~ 1 ל- 10-50 מיקרומטר. עוצמת קרינה פלואורסצנטית כל פתרון בצובר ולהקליט לחשב את השיפוע של עוצמת לעומת ריכוז (איור 3). חזור על המדידה עם fluorophore זה להיות מצומדת כדי החלבון בטווח ריכוז דומה (ראה הדוגמה עם Alexa488 באיור3). מדידה זו נדרש להתייחס עוצמות קרינה פלואורסצנטית התווית חלבון והתווית השומנים, אניA488, בתפזורת / אניHPC *, בכמות גדולה, כפי שהם לא יכולים בהכרח פולטים באותו אופן-הריכוז בצובר זהה.
- למדוד את מספר fluorophores לכל מולקולת חלבון באמצעות של fluorospectrometer. לדוגמה, במקרה של Alexa488, מספר מולקולות Alexa488 לכל חלבון, nA488, ניתן לחשב באמצעות היחס הבא:
n A488 = (A494/εא488) / ((A280 - 0.11494) / חדוהפרוט)
כאשר A494 וא280 הם הערכים ספיגת עבור אורך יחידה-494 nm ו 280 ננומטר, בהתאמה,א488 וחדוה חדוהפרוט הם המקדמים הקליטה מולקולרית של Alexa488, החלבון, בהתאמה. - חישוב צפיפות המשטח של החלבון על הבוס, φפרוט, בוס, על פי הנוסחה הבאה:
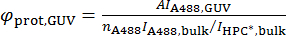
זכור המדינה פלמור של החלבון. לדוגמה, בר חלבונים dimerize, לכן צפיפות מחושב של מונומר בר לכל אזור אם משתמש המקדם הכחדה של הטופס monomeric.

איור 3: דוגמה של חלבון צפיפות המשטח כיול. נמדד הן HPC * השומנים פלורסצנטיות עוצמת בתפזורת (משמאל), האנשים שנגדם (במרכז). בנוסף, נמדד הן עוצמת קרינה פלואורסצנטית בצובר Alexa488 (קשור לתחום בר) (מימין). עוצמת קרינה פלואורסצנטית אומד באופן ליניארי עם ריכוז. מדידות הראו לרווח זיהוי ספציפי, לייזר הספק. חלקות שנוצר על פי נתוני הפניה37. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
תוצאות
הניסוי למשוך צינור יכול לתת מידע חיוני מכני על הקרום. בהיעדרו של חלבונים או מולקולות אחרות לכפות זוג עם ממברנה עקמומיות, הקרום, שפופרת radius יכול להיות קשור עם קרום המתח על-ידי החלת המילטוניאן Canham-Helfrich את משוואת לרכבת התחתית מהכלא בוס50,51
Discussion
השיטה של משיכת צינורות מן האנשים שנגדם מעניקה מידע עשיר על מערכת חלבון ממברנלי, זה לא רק אמצעי למדידת התכונות המכאניות הבסיסית של הקרום, אך זה עוזר לשפוך אור על המושבים בין חלבוני ממברנה עקמומיות. כפי שפורט במבוא, טכניקות אחרות קיימים כדי למדוד את ההשפעות של עיקול קרום חלבונים, על-ידי המקננ...
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים תודה בנואה Sorre דמיאן Cuvelier, פייר Nassoy, פרנסואה Quemeneur, גיל Toombes על תרומתם חיוני להקים את שיטת nanotube בקבוצה. שייכת הקבוצה ת כדי consortium CNRS את CellTiss, את Labex CelTisPhyBio (ANR-11-LABX0038), פריז מדעי et פרסים (ANR-10-IDEX-0001-02). פ-סי Tsai מומן על ידי EMBO מלגת לטווח ארוך (ALTF 1527-2014) ופעולות מארי קירי (H2020-MSCA-אם-2014, פרוייקט ממברנה-אזרין-אקטין). טרשת נפוצה הוא עמית ג'וניור מהבחורים סימונס החברה של.
Materials
| Name | Company | Catalog Number | Comments |
| 1,2-Dioleoyl-sn-glycero-3-phosphatidylcholine (DOPC) | Avanti | 850375 | Example lipid used in data for Figure 3 |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000] [DSPE-PEG(2000)-biotin] | Avanti | 880129 | biotinylated lipid |
| BODIPY-TR-C5-ceramide | Molecular Probes (ThermoFisher) | D7540 | fluorescent lipid |
| BODIPY- FLC5-hexadecanoyl phosphatidylcholine (HPC*) | Molecular Probes (ThermoFisher) | fluorescent lipid for protein density calibration | |
| egg L-α-phosphatidylcholine (eggPC) | Avanti | 840051 | used for calibrating the tube radius constant |
| β-casein from bovine milk (>99%) | Sigma Aldrich | C6905 | used for passivating the micropipette and the experimental chamber |
| Sucrose | Sigma Aldrich | S7903 | |
| D(+) glucose | Sigma Aldrich | G7021 | |
| NaCl | Sigma Aldrich | S7653 | |
| Tris | Sigma Aldrich | 10708976001 | |
| osmometer | Loser | n/a | |
| Pt-wires, 0.5 mm diameter, 99.99% pure | Goodfellow USA | PT005139 | used for GUV electroformation |
| function generator | n/a | used to create current for GUV electroformation | |
| putty sealant | Vitrex (from CML France) | CRIT 140013 | used to seal the electroformation chamber |
| bath sonicator | n/a | useful to clean the electroformation chamber, but not crucial | |
| Nikon TE2000 inverted microscope, eC1 confocal system (Nikon), with two laser lines (λ = 488 nm and 543 nm); optical tweezers induced by a 5 W ytterbium fiber continuous wave laser (λ > 1070 nm; IPG GmBH Germany) | an example of a confocal microscopy system equipped with optical tweezers | ||
| micromanipulators | n/a | ||
| borosilicate capillaries (with internal and external radii of 0.78 mm and 1 mm, respectively) | Harvard apparatus | 30-0036 | |
| micropipette puller | Sutter Instrument | P-2100 | |
| microforge | Narishige | MF-800 | |
| piezoelectric actuator | Physik Instrumente | n/a | |
| polystyrene streptavidin coated beads (diameter 3.2 µm) | Spherotech | SVP-30-5 |
References
- McMahon, H. T., Gallop, J. L. Membrane curvature and mechanisms of dynamic cell membrane remodelling. Nature. 438 (7068), 590-596 (2005).
- Johannes, L., Wunder, C., Bassereau, P. Bending "on the rocks"--a cocktail of biophysical modules to build endocytic pathways. Cold Spring Harb Perspect Biol. 6 (1), (2014).
- Dawson, J. C., Legg, J. A., Machesky, L. M. Bar domain proteins: a role in tubulation, scission and actin assembly in clathrin-mediated endocytosis. Trends Cell Biol. 16 (10), 493-498 (2006).
- Mim, C., Unger, V. M. Membrane curvature and its generation by BAR proteins. Trends Biochem Sci. 37 (12), 526-533 (2012).
- Qualmann, B., Koch, D., Kessels, M. M. Let's go bananas: revisiting the endocytic BAR code. EMBO J. 30 (17), 3501-3515 (2011).
- Rao, Y., Haucke, V. Membrane shaping by the Bin/amphiphysin/Rvs (BAR) domain protein superfamily. Cell Mol Life Sci. 68 (24), 3983-3993 (2011).
- Simunovic, M., Voth, G. A., Callan-Jones, A., Bassereau, P. When Physics Takes Over: BAR Proteins and Membrane Curvature. Trends Cell Biol. 25 (12), 780-792 (2015).
- Safari, F., Suetsugu, S. The BAR Domain Superfamily Proteins from Subcellular Structures to Human Diseases. Membranes (Basel). 2 (1), 91-117 (2012).
- Angelova, M. I., Soléau, S., Méléard, P., Faucon, F., Bothorel, P., Helm, C., Lösche, M., Möhwald, H. . Progress in Colloid and Polymer Science Vol. 89: Trends in Colloid and Interface Science VI. 89, 127-131 (1992).
- Meleard, P., Bagatolli, L. A., Pott, T. Giant unilamellar vesicle electroformation from lipid mixtures to native membranes under physiological conditions. Methods Enzymol. 465, 161-176 (2009).
- Montes, L. R., Alonso, A., Goni, F. M., Bagatolli, L. A. Giant unilamellar vesicles electroformed from native membranes and organic lipid mixtures under physiological conditions. Biophys J. 93 (10), 3548-3554 (2007).
- Mathivet, L., Cribier, S., Devaux, P. F. Shape change and physical properties of giant phospholipid vesicles prepared in the presence of an AC electric field. Biophys J. 70 (3), 1112-1121 (1996).
- Collins, M. D., Gordon, S. E. Giant liposome preparation for imaging and patch-clamp electrophysiology. J Vis Exp. (76), (2013).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. Reconstitution of a transmembrane protein, the voltage-gated ion channel, KvAP, into giant unilamellar vesicles for microscopy and patch clamp studies. J Vis Exp. (95), e52281 (2015).
- Hochmuth, R. M., Evans, E. A. Extensional flow of erythrocyte membrane from cell body to elastic tether. I. Analysis. Biophys J. 39 (1), 71-81 (1982).
- Hochmuth, R. M., Wiles, H. C., Evans, E. A., McCown, J. T. Extensional flow of erythrocyte membrane from cell body to elastic tether. II. Experiment. Biophys J. 39 (1), 83-89 (1982).
- Bassereau, P., Sorre, B., Levy, A. Bending lipid membranes: experiments after W. Helfrich's model. Adv Colloid Interface Sci. 208, 47-57 (2014).
- Hatzakis, N. S., et al. How curved membranes recruit amphipathic helices and protein anchoring motifs. Nature chemical biology. 5 (11), 835-841 (2009).
- Bhatia, V. K., et al. Amphipathic motifs in BAR domains are essential for membrane curvature sensing. EMBO J. 28 (21), 3303-3314 (2009).
- Shi, Z., Baumgart, T. Membrane tension and peripheral protein density mediate membrane shape transitions. Nat Commun. 6, 5974 (2015).
- Chen, Z., Shi, Z., Baumgart, T. Regulation of membrane-shape transitions induced by I-BAR domains. Biophys J. 109 (2), 298-307 (2015).
- Cuvelier, D., Derenyi, I., Bassereau, P., Nassoy, P. Coalescence of membrane tethers: experiments, theory, and applications. Biophys J. 88 (4), 2714-2726 (2005).
- Derenyi, I., Julicher, F., Prost, J. Formation and interaction of membrane tubes. Phys Rev Lett. 88 (23), 238101 (2002).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Adv Colloid Interface Sci. 208, 225-234 (2014).
- Sorre, B., et al. Nature of curvature coupling of amphiphysin with membranes depends on its bound density. Proc Natl Acad Sci U S A. 109 (1), 173-178 (2012).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Phys Rev Lett. 64 (17), 2094-2097 (1990).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5 (6), 491-505 (2008).
- Capraro, B. R., Yoon, Y., Cho, W., Baumgart, T. Curvature sensing by the epsin N-terminal homology domain measured on cylindrical lipid membrane tethers. J Am Chem Soc. 132 (4), 1200-1201 (2010).
- Bo, L., Waugh, R. E. Determination of bilayer membrane bending stiffness by tether formation from giant, thin-walled vesicles. Biophys J. 55 (3), 509-517 (1989).
- Rossier, O., et al. Giant Vesicles under Flows: Extrusion and Retraction of Tubes. Langmuir. 19 (3), 575-584 (2003).
- Borghi, N., Rossier, O., Brochard-Wyart, F. Hydrodynamic extrusion of tubes from giant vesicles. EPL (Europhysics Letters). 64 (6), 837 (2003).
- Zhu, C., Das, S. L., Baumgart, T. Nonlinear sorting, curvature generation, and crowding of endophilin N-BAR on tubular membranes. Biophys J. 102 (8), 1837-1845 (2012).
- Ramesh, P., et al. FBAR syndapin 1 recognizes and stabilizes highly curved tubular membranes in a concentration dependent manner. Sci Rep. 3, 1565 (2013).
- Knorr, R. L., et al. Membrane morphology is actively transformed by covalent binding of the protein Atg8 to PE-lipids. PLoS One. 9 (12), e115357 (2014).
- Aimon, S., et al. Membrane shape modulates transmembrane protein distribution. Dev Cell. 28 (2), 212-218 (2014).
- Prévost, C., et al. IRSp53 senses negative membrane curvature and phase separates along membrane tubules. Nat Commun. , (2015).
- Simunovic, M., et al. How curvature-generating proteins build scaffolds on membrane nanotubes. Proc Natl Acad Sci U S A. 113 (40), 11226-11231 (2016).
- Allain, J. M., Storm, C., Roux, A., Ben Amar, M., Joanny, J. F. Fission of a multiphase membrane tube. Phys Rev Lett. 93 (15), 158104 (2004).
- Morlot, S., et al. Membrane shape at the edge of the dynamin helix sets location and duration of the fission reaction. Cell. 151 (3), 619-629 (2012).
- Renard, H. F., et al. Endophilin-A2 functions in membrane scission in clathrin-independent endocytosis. Nature. 517 (7535), 493-496 (2015).
- Simunovic, M., et al. Friction Mediates Scission of Tubular Membranes Scaffolded by BAR Proteins. Cell. 170 (1), 172-184 (2017).
- Simunovic, M., Lee, K. Y., Bassereau, P. Celebrating Soft Matter's 10th anniversary: screening of the calcium-induced spontaneous curvature of lipid membranes. Soft Matter. 11 (25), 5030-5036 (2015).
- Sorre, B., et al. Curvature-driven lipid sorting needs proximity to a demixing point and is aided by proteins. Proc Natl Acad Sci U S A. 106 (14), 5622-5626 (2009).
- Heinrich, M., Tian, A., Esposito, C., Baumgart, T. Dynamic sorting of lipids and proteins in membrane tubes with a moving phase boundary. Proc Natl Acad Sci U S A. 107 (16), 7208-7213 (2010).
- Dasgupta, R., Dimova, R. Inward and outward membrane tubes pulled from giant vesicles. Journal of Physics D: Applied Physics. 47 (28), 282001 (2014).
- Vitkova, V., Genova, J., Mitov, M. D., Bivas, I. Sugars in the aqueous phase change the mechanical properties of lipid mono- and bilayers. Molecular Crystals and Liquid Crystals. 449, 95-106 (2006).
- Bouvrais, H. . Mechanical properties of giant vesicle membranes investigated by flickering technique. , (2011).
- Koster, G., Cacciuto, A., Derenyi, I., Frenkel, D., Dogterom, M. Force barriers for membrane tube formation. Phys Rev Lett. 94 (6), 068101 (2005).
- Kwok, R., Evans, E. Thermoelasticity of large lecithin bilayer vesicles. Biophys J. 35 (3), 637-652 (1981).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 28 (11), 693-703 (1973).
- Canham, P. B. The minimum energy of bending as a possible explanation of the biconcave shape of the human red blood cell. J Theor Biol. 26 (1), 61-81 (1970).
- Marcerou, J. P., Prost, J., Gruler, H. Elastic Model of Protein-Protein Interaction. Nuovo Cimento Della Societa Italiana Di Fisica D-Condensed Matter Atomic Molecular and Chemical Physics Fluids Plasmas Biophysics. 3 (1), 204-210 (1984).
- Leibler, S. Curvature Instability in Membranes. J Phys-Paris. 47 (3), 507-516 (1986).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved