É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Puxando a membrana nanotubos de vesículas Unilamellar gigante
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Muitas proteínas na célula sentem e induzem a curvatura da membrana. Nós descrevemos um método para puxar a membrana nanotubos de vesículas lipídicas para estudar a interação de proteínas ou qualquer molécula de curvatura-ativo com membranas curvo em vitro.
Resumo
A reformulação da membrana celular é parte integrante de muitos fenômenos celulares, tais como endocitose, tráfico, formação de filopodia, etc. Muitas proteínas diferentes associam com membranas curvadas por causa de sua capacidade de sentir ou induzir a curvatura da membrana. Normalmente, esses processos envolvem uma infinidade de proteínas, tornando-os muito complexa para estudar quantitativamente na célula. Descreveremos um protocolo para reconstituir uma membrana curva em vitro, imitando uma curvada estrutura celular, tais como o pescoço endocítica. Uma vesícula unilamellar gigante (GUV) é usada como um modelo de uma membrana celular, cuja pressão interna e a tensão superficial é controlado com aspiração micropipeta. Aplicando uma força puxando do ponto sobre o chefe usando a Pinça óptica cria um nanotubo de curvatura alta ligada a uma membrana plana. Este método tem sido tradicionalmente usado para medir as propriedades mecânicas fundamentais das membranas de lipídios, tais como rigidez de flexão. Nos últimos anos, tem sido expandido para estudar como as proteínas interagem com a curvatura da membrana e a forma como elas afetam a forma e a mecânica das membranas. Um sistema que combina micromanipulação, microinjeção, pinça óptica e microscopia confocal permite a medição da curvatura da membrana, tensão de membrana e a densidade da superfície das proteínas, simultaneamente. Partir destas medições, muitas propriedades mecânicas e morfológicas importantes do sistema de membrana-proteína podem ser inferidas. Além disso, podemos esquematizar um protocolo de criação de GUVs na presença de concentração de sal fisiológica e um método de quantificar a densidade da superfície das proteínas na membrana de intensidades de fluorescência de rotulada de proteínas e lipídios.
Introdução
Muitos processos celulares, tais como endocitose, tráfico, formação de filopodia, infecção, etc, são acompanhados por uma mudança dramática na forma de membranas celulares,1,2. Na célula, um número de proteínas participar nestes processos vinculando à membrana e alterando sua forma. Os exemplos mais notáveis são membros da família de proteínas de Rvs/Bin/Amphiphysin (BAR), que contém uma característica intrinsecamente curvada BAR domínio3,4,5,6,7. Normalmente, eles interagem com a membrana, aderindo o domínio de BAR para a superfície e, em muitos casos, também superficialmente, inserindo anfifílicos hélices a BICAMADA. Determina a forma, tamanho e carga do domínio do BAR, juntamente com o número de hélices de anfifílicos: (1) a direção da curvatura de membrana (ou seja, se eles irão induzir invaginações ou saliências) e (2) a magnitude da membrana curvatura de5,8. Digno de nota, aqui curvatura positiva é definida como o lado convexo da membrana curvada, ou seja, bulge em direção a interação das partículas e negativo caso contrário. Além disso, estudos quantitativos do BAR proteínas revelaram que seu efeito na membrana depende de um conjunto de parâmetros físicos: densidade de tensão de membrana, proteínas e forma de membrana (plana contra tubular contra esférico de superfície forma)7. Dependendo desses parâmetros barra de proteínas pode: (1) atuam como sensores de curvatura da membrana, (2) Dobre as membranas ou (3) induzir a membrana cisão7.
Devido o grande número de componentes envolvidos na remodelagem de membrana na célula, estudando os aspectos quantitativos dos fenómenos, tais como endocitose, na vivo é extremamente desafiador. In vitro a reconstituição dos componentes mínimos imitando curvas membranas na célula fornece meios para ganhar uma compreensão mecanicista das proteínas de membrana-curvar como operar. Este artigo descreve um protocolo para reconstituir uma membrana nanotubo em vitro usando micromanipulação, microscopia confocal e pinça óptica. A abordagem pode ser usada para estudar, de forma quantitativa, como proteínas, lipídios ou pequenas moléculas interagem com as membranas curvas. GUVs de lipídios são usados como modelos de uma membrana celular, cuja curvatura é insignificante em comparação com o tamanho das moléculas da membrana-curvando-se interagindo. Eles estão preparados usando o método electroformation9 em que as vesículas são formadas por um filme lipídico de hidratação e inchaço em GUVs sob uma corrente alternada (AC)10. Substratos mais comuns em que são cultivadas GUVs são também placas semi condutoras revestidas com óxido da lata do indium (ITO) ou fios de platina (Pt-fios)11. Neste trabalho, GUVs são cultivadas na Pt-fios como esse método foi demonstrado funcionar muito melhor do que a alternativa em fazer GUVs na presença de sais na reserva12. Embora o protocolo de electroformation é descrito aqui em detalhes suficientes para reproduzi-lo, nos referimos o leitor para artigos anteriores em que semelhantes e outros métodos de fazer GUVs têm sido descritos em detalhe13,14. Em nossas mãos, electroformation em Pt-fios com sucesso rendeu GUVs partir de uma mistura de lipídeos sintéticos ou lipídica natural extratos em um buffer que contém ~ 100 mM NaCl. Além disso, foi possível também encapsular as proteínas dentro de GUVs durante o crescimento. Uma câmara de electroformation exemplo é mostrada na figura 1A; é composto por dois ~ 10 cm de comprimento Pt-fios, inseridos em um suporte feito de politetrafluoretileno (PTFE) que pode ser selado em ambos os lados com as lamelas de vidro ~ 1-2 cm de distância (figura 1A).

Figura 1: configuração Experimental. (A), o chefe electroformation câmara com conectores elétricos, ligado ao Pt-fios. (B) à esquerda: o sistema experimental mostrando o microscópio, câmara experimental acima o objetivo e duas micropipetas (esquerdas e direita) anexado para os Micromanipuladores e inserido na câmara experimental para tubo puxando e proteína injeção. Direito: uma visão mais apurada da câmara experimental montado acima o objetivo de mostrar as dicas da aspiração e as Micropipetas de injeção inseridas. (C) A seringa equipada com um distribuidor fino inserido uma micropipeta no seu back-end. O fundo é uma close-up vista do distribuidor no interior da micropipeta com linha pontilhada azul delineando a micropipeta. Este sistema é usado para preencher a micropipeta com caseína passivate a superfície do vidro e também para voltar a enchê-lo com óleo mineral, quando necessário. (D), um sistema usado para aspirar quantidades µ l da solução da proteína. A agulha é conectada a uma seringa e a tubulação que é conectada à micropipeta de injeção. A ponta da micropipeta cuidadosamente é imerso na solução da proteína e então aspirada para preencher a ponta da micropipeta. A micropipeta é então volta preenchida com óleo mineral, utilizando o sistema mostrado no painel C. por favor clique aqui para ver uma versão maior desta figura.
Um nanotubo de membrana, variando no raio de 7 nm a várias centenas de nm, pode ser retirado um chefe por uma força externa. Esse método foi inicialmente projetado para medir as propriedades elásticas das membranas celulares e vesículas, tais como a flexão rigidez15,16. Em trabalhos mais recentes, o método foi estendido para estudar a interação das proteínas com membranas curvas por microinjecting as proteínas perto do nanotubo puxada7,17. Outros métodos foram desenvolvidos para o estudo de proteínas de membrana-curvando-se. Em um método, as proteínas são incubadas com lipossomas de diferente tamanhos amarrados a uma superfície passivada. Microscopia confocal é usada para medir o emperramento da proteína em função do diâmetro de lipossomas, que pode indicar induzida por curvatura classificação18,19. Em outro método, as proteínas são injetadas perto de um chefe de microaspirado para medir sua capacidade de induzir espontaneamente túbulos20,21. O método descrito neste protocolo é especialmente adequado para estudar o encurvamento da membrana proteínas envolvidas na endocitose, onde a maioria das proteínas normalmente encontram pré-formadas membrana nanotubos conectando a invaginação da membrana contendo carga com o membrana de plasma plana subjacente. Além disso, neste método, ao contrário no ensaio com lipossomas pequenos amarrados, o nanotubo de membrana está continuamente ligado à membrana; Portanto, é no equilíbrio mecânico com o chefe, uma situação esperada na vivo. Por isso, fundamental membrana física aplica-se e podemos inferir uma infinidade de propriedades mecânicas de nossas medições22,23,24.
Para uma plena implementação deste método, o equipamento necessário inclui um microscópio confocal, pinça óptica e uma ou duas micropipetas conectadas a um tanque de água (figura 1B). Combinando todos os três, é possível medir a tensão de membrana, curvatura de membrana, densidade de superfície das proteínas e simultaneamente tubo de força25. Micropipeta de aspiração é essencial e é facilmente construído através da inserção de uma micropipeta de vidro em um suporte ligado a um tanque de água, que, através de pressão hidrostática, controla a pressão de aspiração26. A micropipeta e o titular são controlados por um micromanipulador e, idealmente, em uma direção por um piezo-atuador para movimento de precisão. Para puxar um nanotubo, o microaspirated chefe é brevemente preso a um mícron de tamanho do grânulo então puxou embora criando um nanotubo. Nesta implementação, o grânulo é realizado pela Pinça óptica, que pode ser construída seguindo um protocolo publicado27. É possível dispensar da pinça óptica e puxar nanotubos de maneiras diferentes, embora à custa de medições precisas de força. Se é muito difícil construir uma armadilha óptica ou se as medições de força são não essenciais, como se você simplesmente quiser verificar a preferência de proteínas por membranas curvas, um tubo pode ser puxado usando um grânulo aspirado na ponta de um segundo micropipeta28. Também é possível puxar os tubos usando força gravitacional29 ou30,31de fluxo. Além disso, a microscopia confocal também não é essencial; no entanto, é tão preferido para medir a densidade da superfície de proteínas. Também permite medir o raio de nanotubo de intensidade de fluorescência de lipídios no tubo, assim, independentemente da membrana força e tensão. Raio de tubo inferindo da fluorescência é particularmente importante se a relação entre essas quantidades afasta-se das equações bem estabelecidas, devido à presença de proteínas de membrana se adere25. Importante, um não pode dispensar da armadilha óptica e microscopia confocal, pois não será possível medir a curvatura do tubo.
O método conforme descrito neste protocolo tem sido usado para estudar a classificação induzida em curvatura de várias proteínas de membrana periférica em nanotubos, principalmente aqueles do BAR família25,32,33,34 . Também foi demonstrado que o canal de potássio transmembrana cònicamente em forma em que kvap é enriquecida curvo nanotubos da mesma forma como BAR proteínas35. Otimizando o método para encapsular as proteínas dentro de GUVs, a interação das proteínas com curvatura negativa foi investigada recentemente como bem36. Além disso, este método tem sido usado para elucidar a formação de proteína andaimes25,37 e estudar o mecanismo de cisão de membrana por qualquer linha tensão38, proteína Dinamina39, ou BAR proteínas40,,41. Além de proteínas, pequenas moléculas ou íons podem também induzir a curvatura. Usando esse método, os íons de cálcio foram mostrados para induzir a curvatura positiva sob condições sem sal42. Curiosamente, ele também foi mostrado que lipídios podem sofrer curvatura classificação, embora somente para composições que estão perto de um demixing ponto43,44. Em suma, o método pode ser usado por pesquisadores interessados em investigar ou como componentes de integral de membrana (por exemplo, lipídios ou proteínas transmembrana) ou vinculação perifericamente moléculas (seja dentro ou fora GUVs) interagir com membranas cilindricamente curvas, do ponto de vista mecânico e quantitativo. Também se destina para aqueles interessados em medir as propriedades mecânicas da membrana em si22,23,45.
Protocolo
1. preparação de GUVs por Electroformation na Pt-fios
- Limpe a câmara de electroformation (ver introdução e figura 1A) e os Pt-fios com um solvente orgânico como etanol ou acetona para lavar os lipídios e com água para lavar os sais.
Nota: Sugerimos cuidadosamente enxugando o resíduo com tecido embebido em álcool etílico, em seguida, sonicating em acetona, etanol e água, cada um por 5 min. - Prepare uma mistura de lipídios de uma composição lipídica desejada no 1 mg/mL de clorofórmio. A mistura deve conter ~ 0.05% fração molar de um lipídio conjugado com biotina (por exemplo, 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000]) e ~ 0.5% fração molar de um lipídio, conjugados com um fluoróforo ( por exemplo, BODIPY-TR-C5-ceramida).
Nota: Na nossa experiência, era difícil produzir GUVs em um alto rendimento contendo mais de 30% cobrados de lipídios.
Cuidado: Clorofórmio deve ser tratado dentro de um capuz químico usando luvas apropriadas. - Insira um par de fios-Pt na câmara de electroformation. Deposite a mistura de lipídios para os Pt-fios em gotas separadas por ~ 2-3 mm (total ~ 4 µ l da mistura).
- Seque os fios sob vácuo para 30 a 60 min à temperatura ambiente.
- O fundo da câmara do selo, aderindo a lamela sobre a câmara usando graxa de silicone. Encha a câmara com uma solução tamponada contendo NaCl, sacarose e um agente tamponador (por exemplo, 70 mM NaCl, sacarose 100 mM e 10 mM Tris, pH 7,4). Este meio será dentro da GUVs no experimento. É essencial que a osmolaridade deste meio corresponde a osmolaridade do meio experimental dentro de ~ 10%. Use sacarose para ajustar a osmolaridade. Adicione proteínas à solução em uma concentração desejada, se o objetivo é encapsulá-los nos GUVs.
Cuidado: Vários sais e açúcares no buffer podem afetar a rigidez de dobra e a curvatura espontânea de membranas24,42,46,47. - Sele o topo da câmara, aderindo uma lamela com graxa de silicone, garantindo mínima do ar dentro da câmara. Aplicar uma corrente senoidal AC através da Pt-fios em 500 Hz e 280 mV.
Nota: O tempo de crescimento e a temperatura devem ser otimizadas dependendo da composição lipídica e a sensibilidade da proteína. Quando se utiliza extractos naturais de lipídios e também quando encapsulando proteínas em GUVs, o melhor rendimento foi conseguido pelo crescimento de GUVs a 4 ° C durante a noite. Na ausência de proteínas e por composições lipídicas sintéticas, crescimento em temperatura ambiente por ~ h 2 era suficiente.
2. preparação da câmara Experimental e as micropipetas
- Para preparar micropipetas, puxe um capilar de vidro usando um extrator de pipeta. É aconselhável para usar um capilar de vidro com raios internos e externos de, respectivamente, 0,7 mm e 1 mm. Em seguida, refinar a ponta da micropipeta para que seu diâmetro interno é de 5–7 µm, usando um microforge. Se as proteínas ou outras moléculas serão injetadas no experimento, puxar mais uma micropipeta e refinar sua ponta a um diâmetro interno de 8 µm de 15–.
- Construa uma câmara experimental, colocando duas lamelas de microscopia retangular sobre uma base metálica, como mostrado na Figura 1. As lamelas devem ser separadas por ~ 1 mm. A câmara deve ter aberturas ao longo das bordas de tempo (ver Figura 1). Os lados abertos devem se encaixar a ponta da micropipeta a onde a ponta deve chegar pelo menos ao centro da câmara.
- Prepare o buffer experimental cuja osmolaridade não deve diferir mais de 10% do buffer usado para crescer GUVs. Ajuste a osmolaridade com glicose. Um exemplo de um buffer experimental que foi usado no estudo da interação do endophilin com nanotubos é 100 mM de NaCl, glicose de 40mm, tamponado com Tris pH 7,4. Uma combinação de sacarose dentro / glicose fora garante: contraste de fase (a) suficiente para observar GUVs com microscopia de campo claro e (b) maior densidade dentro do GUVs, que faz com que resolver na parte inferior da câmara. Ajuste a concentração de sal baseada na exigência experimental.
Nota: Além de afetar as propriedades mecânicas da membrana, em nossa experiência, concentração elevada de glicose (> 300 milímetros) afeta negativamente o estabelecimento de laços de estreptavidina-biotina, necessários para puxar um nanotubo. Além disso, muito pouco sal inibe a estreptavidina-biotina títulos, enquanto muito alto de uma concentração telas interações proteína-membrana. Em caso de encapsulamento de proteína, usando muito alta concentração de sal no buffer externo (por exemplo, > 200 mM NaCl) pode ser usado como um truque para separar as proteínas do folheto exterior36. É necessário experimentar com um intervalo de concentração de sal para encontrar as condições ideais de vinculação da molécula de interesse. -
30 a 60 min antes de coletar a GUVs para o experimento, passivate as superfícies de vidro preenchendo tanto da câmara experimental e a micropipeta de aspiração com uma solução de 5 mg/mL de um β-caseína altamente puro (por exemplo, dissolvido no buffer experimental). Β-caseína cria uma camada protetora sobre as superfícies de vidro, impedindo que GUVs para aderir também fortemente, que poderia causar-lhes a estourar. Incube com β-caseína por 30 a 60 min.
Nota: Não deve haver sem bolhas dentro da micropipeta que iria interferir com o controlo de tensão de membrana.- Para construir um dispensador para Micropipetas de enchimento, quebrar uma agulha de seringa perto o conector de plástico e cola em um capilar de sílica fina (como aqueles usados para cromatografia líquida) (Figura 1).
- Durante a incubação com β-caseína, montar a câmara no microscópio e centralizá-lo acima do objectivo. Introduza a ponta da micropipeta de aspiração através da abertura ao longo da borda longa e ponha a ponta acima do objectivo de microscópio. Ajuste o nível do tanque de água para que a pressão de aspiração é quase zero (não deve haver nenhum fluxo pesado dentro ou fora da pipeta, que pode ser vista sob o microscópio).
-
No caso das proteínas ou outras moléculas serão injetadas durante o experimento, preenchimento a micropipeta de injeção com a molécula desejada dissolvida em reserva experimental em uma concentração de escolha, montar a micropipeta dentro um micromanipulador, e Insira através do lado oposto da câmara experimental.
- Para usar uma quantidade mínima de proteínas, preencha apenas a ponta da micropipeta com a proteína por aspiração. Para fazer isso, enrole a extremidade de uma agulha que está ligada a uma seringa com tubo plástico. Inserir o tubo na parte de trás da micropipeta de injeção.
- Muito cuidado imergir a ponta da micropipeta a solução da proteína e aspire-o para preencher a ponta da micropipeta.
Nota: Esta configuração simples é mostrado na Figura 1 e, em nossa experiência, permite a aspiração de tão pouco como algumas µ l da solução da proteína. - Aterre o resto da micropipeta de injeção com óleo mineral para evitar a mistura da solução da proteína e da água do tanque de água (usando a configuração na Figura 1).
- Tome cuidado para não introduzir bolhas de ar dentro da pipeta de injeção, como acto irá induzir a pressão de injeção instável. Como alternativa, se a quantidade de proteína é suficiente, encha a micropipeta com as proteínas da mesma forma que o enchimento com β-caseína conforme descrito na etapa 2.4. Ajuste o nível do tanque de água para minimizar a pressão de aspiração dentro da pipeta de injeção.
Nota: A concentração da molécula injetada ou íon perto do nanotubo vai ser inferior devido à diluição e pode ser calculada medindo-se a diminuição da intensidade da fluorescência em função da distância da pipeta saída42. É no entanto mais importante que saber a densidade de BICAMADA-limite da molécula injetada, que pode ser medida precisamente (ver secção 4).
- Após a incubação com β-caseína, remover a solução da câmara e enxaguar com o buffer experimental várias vezes. Preencha com o buffer de experimental.
- Pare de electroformation de GUVs e coletá-los diretamente do Pt-fios. Adicione alguns µ l da solução de chefe da câmara experimental. Use somente preparados na hora GUVs.
- Adicione alguns µ l de grânulos streptavidin-revestido para a câmara experimental para uma concentração final de grânulos na câmara ao redor 0.1 x 10− 3% (p/v) ou menos. Esferas de poliestireno ~ 3 µm de diâmetro são recomendados (esferas de poliestireno na água tem um índice de refração próximo-optimal contraste com relação ao maximizar a força de gradiente em relação a força de dispersão na armadilha óptica). A concentração de talão pode ser ajustada com base na experiência: uma concentração muito baixa torna difícil encontrá-los na câmara, e uma concentração muito alta corre o risco de múltiplos grânulos cair a Pinça óptica.
3. puxando um nanotubo de membrana de um chefe
- Deixe os GUVs e os grânulos de resolver para o fundo da câmara. Esvazie os GUVs, deixando um pouco da reserva experimental evaporar, para aproximadamente ~ 15 min., esvaziando os GUVs é essencial para produzir alguma área em excesso que pode ser aspirada com a micropipeta. GUVs visivelmente deve ondular (i.e., aparecem disquete) sob o microscópio de luz. Se eles aparecem tenso, permitem mais tempo de evaporação.
Nota: A taxa de mudança de osmolaridade varia de acordo com a área de superfície de evaporação, temperatura, etc.e deve ser monitorizada de perto. Em princípio, a diferença de osmolaridade pode ser ajustada desde início ajustando a concentração de sacarose/glicose, no entanto, tenha cuidado para não induzir um choque osmótica. - Encontrar um chefe disquete e Aspire-lo dentro da pipeta. O comprimento da língua (a parte da membrana dentro da pipeta) aspiração deve ser igual ou maior que o raio de uma pipeta para a análise teórica ser aplicável15,16,22,(23 A Figura 2). Tente várias GUVs. Se nenhum dos GUVs pode ser aspirado para produzir uma língua comprida o suficiente, espere mais alguns minutos. Se GUVs é flexível o suficiente, prossiga para a próxima etapa.
- Veda-se a câmara com óleo mineral, de evitar a evaporação do buffer. Fazê-lo pipetando cuidadosamente o óleo ao longo das bordas abertas da câmara experimental.
- Para definir a posição zero da pressão de aspiração, em primeiro lugar, procurar uma pérola na câmara e posicionar a saída de pipeta de aspiração perto do grânulo. Ajuste a altura da caixa d'água para que a pérola não é sugada nem encantada com a pipeta de aspiração. Embora o óleo mineral impede a evaporação e, portanto, novas alterações de pressão no interior da câmara, zero a pressão de aspiração antes de medir cada chefe.
- Encontrar um chefe e Aspire-lo. Mova a micropipeta acima e fora de foco (para manter o chefe longe da superfície onde ele pode ser puxado para fora da pipeta por tensão de cisalhamento quando a câmara é movida).
- Procure um grânulo movendo cuidadosamente ao redor da câmara. Nada de movimentos bruscos pode ejetar o chefe. Prendê-lo com pinça óptica a uma distância ~ 20 µm longe da parte inferior da câmara. Certifique-se de que a região de interesse é limpa sem grânulos ou outras membranas à vista. Nada caindo na Pinça óptica diferente o grânulo irá interromper a medição.
- Traga o chefe em foco e longe do grânulo com a micropipeta alinhada com a armadilha óptica (Figura 2).
- Grave o movimento da esfera por 1 – 2 min medir a posição de equilíbrio (necessária para medições de força).
- Reduza a pressão no interior da micropipeta tanto quanto possível, sem perder o chefe então para diminuir a tensão de membrana. Cuidadosamente trazer o chefe em contacto com o talão para cerca de um segundo, estabelecer laços de estreptavidina-biotina, em seguida, puxe delicadamente para trás criando um nanotubo. O movimento do chefe ou para longe do grânulo idealmente deve ser feito com um atuador piezo-perturbar minimamente o talão a Pinça óptica.
Nota: Se o nanotubo não forma, poderia ser devido a pobre streptavidin revestimento do cordão, quantidade insuficiente de lipídios biotinilado no GUV, insuficiente concentração de sal ou excessiva concentração de glicose no buffer de dados experimental, ou a membrana de tensão no chefe é muito alta,48. - Aumente a pressão de aspiração para recriar a língua de aspiração. Alinhe o tubo para mentir no eixo da pipeta de aspiração e màxima foco no tubo (Figura 2).
- Certifique-se de que o Equador do chefe e o tubo estão em foco. Gravar o movimento do cordão com microscopia de campo claro para min alguns de (aqui, a velocidade de aquisição de câmera é 30 Hz). Recorde a altura, h, do reservatório da água em relação à posição zero. Com algumas imagens confocal do sistema (Figura 2).
- Repita a etapa anterior a pressões de aspiração diferente, implicitamente as tensões de membrana. Gama de tensão típica é de 0.015 – 0,2 mN/m, com um tamanho de passo de cerca de 0,02 mN/m.
- Se injetando proteínas ou moléculas perto do sistema, trazer a micropipeta de injeção perto do nanotubo, certificando-se de que o talão na armadilha óptica não é perturbado. Injetar suavemente a uma pressão de em torno de 1 – 2 pa.
-
Depois que o emperramento da proteína tem incubado (a intensidade de fluorescência da proteína injetada sobre a membrana permanece constante sobre o chefe), repeti as medições de passo a passo como acontece com a membrana desencapada (etapas 3.11 e 3.12).
Nota: Desde que as medições são executadas enquanto injetando proteínas perto o chefe a pressão constante, a concentração em massa da proteína permanece inalterada aproximadamente perto o chefe; assim, a dessorção de proteína deve ser insignificante durante a medição.- Alternativamente, é possível incubar os GUVs juntamente com as proteínas antes de realizar experimentos de puxar o tubo para garantir uma concentração em massa de proteína constante. Dado que a fração de membrana relativa de proteínas sobre o tubo e o chefe é medida, a maneira que as proteínas são entregues não influencia o cálculo da curvatura-classificação (ver secção 4).
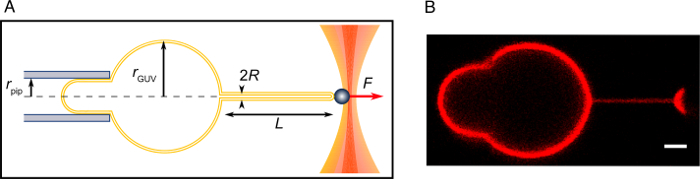
Figura 2: experimento de tubo-puxando. (A) esquema do experimento. (B) A imagem confocal de um tubo puxado, como descrito no presente protocolo. Barra de escala = 2 µm. clique aqui para ver uma versão maior desta figura.
4. medições e análise de dados
- Medir a tensão de membrana
- Calcule a pressão hidrostática para cada etapa a pressão constante de aspiração:
ΔP = pgh
onde p é a densidade da água, a aceleração gravitacional g e h a altura da caixa d'água da etapa 3.11. - A partir de imagens confocal, mede o raio do GUV, rchefee o raio da pipeta aspiração, rpip (Figura 2).
- Calcule a tensão de membrana, σ, usando a equação de Laplace49:
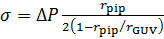
- Calcule a pressão hidrostática para cada etapa a pressão constante de aspiração:
- Medição de força de membrana
- Determine a rigidez da pinça óptica, k, usando um dos vários métodos de calibração27. Nesta instalação, medir k usando o método de arraste viscoso27.
- Calcule a posição de equilíbrio do cordão, um0, de, em média de uma medição antes de puxar o tubo (passo 3.8).
- Para cada medição de tensão constante, calcule a força de membrana equilíbrio, F, da lei de Hooke:
F = k(um - um0)
onde um é a posição do cordão de durante a medição.
- Raio de tubo de medição
- No caso de uma membrana desencapada (nenhum adicionadas curvando-membrana moléculas), calcule o raio do tubo, R, da força como:
R = F/(4πσ)
(referências22,,23). - Para medir o raio do tubo na presença de moléculas de membrana-encurvamento e independentemente de passo 4.3.1, primeiro, registre a intensidade de fluorescência de lipídios ao longo do comprimento do tubo, euabanheirae ao longo do contorno do chefe, euchefe. Medir a intensidade de fluorescência média de um fluoróforo em ou ligados à membrana como uma intensidade média ao longo da linha mais brilhante de um tubo ou um contorno de chefe. Selecione uma caixa retangular contendo uma secção horizontal do contorno do chefe ou do tubo e calcular a soma das intensidades de fluorescência de cada linha horizontal na caixa.
- Divida cada soma pelo número de pixels da linha horizontal (ou seja, a largura da caixa). Observe que na caixa selecionada, não deve haver nenhuma outras membranas presentes. O perfil de intensidade de fluorescência ao longo do comprimento da caixa selecionada é obtido.
- Depois de subtrair a intensidade de fundo, leve a intensidade de fluorescência de pixel média da linha mais brilhante. O raio do tubo é linearmente relacionado com a proporção de fluorescência ao longo do contorno do tubo e do chefe como:
R = Kbanheiraeubanheira/euchefe
onde Kbanheira é um fator de calibração25.
Nota: Este método pode ser usado para medir o raio do tubo na faixa de 10 a 80 nm (quando o tubo é estreito o suficiente para situar-se em um voxel confocal de largura) e com uma pouco maior incerteza nos 80 nm e maior alcance. A sensibilidade da medição depende da configuração.
- Determine Kbanheira através da realização de medições de raio independente em etapas 4.3.1 e 4.3.2 sobre uma composição de membrana simples usando lipídios descarregados. Tal composição de membrana simples garante que o raio e a força têm a relação simples dada na etapa 4.3.1. Repetir a experiência várias vezes e plotar R, deduzida a partir da força (passo 4.3.1) versus eubanheira/euchefe (passo 4.3.2). Calcule Kbanheira de ajuste. Nesta instalação, Kbanheira = 200 nm ± 50 usando ovo membrana L-α-fosfatidilcolina (ovo-PC) e um lipido fluorescente, cuja fluorescência depende minimamente polarização25.
Nota: Kbanheira deve ser medido para objetivos diferentes, devido a seus volumes diferentes voxel confocal. O fluoróforo de lipídios não deve interagir com as proteínas injetadas/moléculas. O lipídeo fluorescente recomendado aqui, BODIPY TR ceramida, não deverá ter quaisquer interacções com as proteínas. Esta hipótese foi confirmada com estudos anteriores de BAR e BAR-domínios25,36,37, que mostraram que a cobertura de superfície de alta proteína, o raio do tubo é fixada pelas proteínas, independentemente do tensão no chefe. Se as proteínas interagem com o fluoróforo lipídico, um empobrecimento ou enriquecimento do fluoróforo será observado no tubo em fracções de superfície variados de alta proteína.
- No caso de uma membrana desencapada (nenhum adicionadas curvando-membrana moléculas), calcule o raio do tubo, R, da força como:
- Medir a densidade da superfície das proteínas
- Prepare misturas de lipídios, usando um simples lipídios sem carga (por exemplo, ovo-PC) suplementado com cerca de cinco fracções diferentes mole de um lipídio fluorescente (do mesmo comprimento de onda como o corante usado para rotular a proteína, por exemplo, BODIPY-FLC5-hexadecanoyl-Phosphatidylcholine (HPC *) para , por exemplo, a proteína Alexa488-rotulado) no intervalo: XHPC * = 0,01-1%. Prepare-se GUVs em sacarose 100 mM por electroformation na ITO placas (siga a etapa 1 de uma anterior publicação13).
- GUVs de coletar e transferir para uma câmara experimental passivada com β-caseína. Use, por exemplo, glicose de 100 mM para a solução experimental. Aguarde alguns minutos para os GUVs resolver.
- Levar imagens de fluorescência confocal de GUVs e a intensidade de fluorescência média ao longo do chefe recorde os contornos como uma função da fração molar da fluorescente lipido (ver passo 4.3.2). Para cada composição, calcular a densidade de área do lipídeo fluorescente, φHPC*. Por exemplo, assumindo que a superfície por lipídios é 0.7 nm2, φHPC* = 1,43 x 106 XHPC * por folheto. Plotar HPC * intensidade de fluorescência no chefe, euHPC *, GUV, contra φHPC*. Ajuste dá a constante de calibração, A, dada por φHPC* = AIHPC *, chefe. A depende das configurações de microscopia, tais como a potência do laser e a sensibilidade do detector (ou seja, ganho), portanto A gravar para vário usados configurações de microscopia (ver exemplo na Figura 3).
- Preparar várias soluções de HPC * dissolvido em detergente, por exemplo, Dodecil-sulfato de sódio (SDS), em diferentes concentrações na faixa de ~ 1 a 10-50 µM. gravar a intensidade de fluorescência de cada solução em massa e calcular a inclinação da intensidade versus concentração (Figura 3). Repita a medição com o fluoróforo que irá ser conjugada com a proteína em uma faixa de concentração semelhante (Veja o exemplo com Alexa488 na Figura 3). Esta medição é necessário relacionar as intensidades de fluorescência do rótulo de proteína e o rótulo de lipídios, euA488, volume / euHPC *, em massa, como eles não podem emitir necessariamente da mesma forma na mesma concentração em massa.
- Medir o número de fluorophores por molécula de proteína usando um fluorospectrometer. Por exemplo, para o caso de Alexa488, o número de moléculas de Alexa488 por proteína, nA488, pode ser calculado usando a seguinte relação:
n A488 = (A494/εA488) / ((um280 - 0.11por494) / εprot)
onde A494 e um280 são os valores de absorvância por unidade de comprimento em 494 nm e 280 nm, respectivamente, e εA488 e εprot são os coeficientes de absorção molecular do Alexa488 e a proteína, respectivamente. - Calcular a densidade da superfície da proteína sobre o chefe, φprot, chefe, de acordo com a seguinte fórmula:
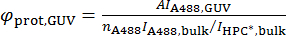
Tenha em mente o estado de polimerização da proteína. Por exemplo, barra de proteínas dimerizam, portanto a densidade calculada será que o monômero de BAR por área se usando o coeficiente de extinção da forma monomérica.

Figura 3: exemplo de calibração de densidade de superfície proteína. Medidos são a HPC * lipídico intensidade de fluorescência a granel (à esquerda) e no GUVs (centro). Também, medido são a intensidade de fluorescência em massa de Alexa488 (vinculado a um domínio de BAR) (à direita). Intensidade de fluorescência dimensiona linearmente com a concentração. As medidas mostradas são para ganho de deteção específico e potência de saída de laser. Parcelas geradas com base nos dados de referência37. Clique aqui para ver uma versão maior desta figura.
Resultados
O experimento de puxar o tubo pode dar informações vitais de mecânicas sobre a membrana. Na ausência de proteínas ou outras moléculas que força a par com a curvatura da membrana, a membrana e o raio do tubo pode estar relacionado com a tensão de membrana aplicando o hamiltoniano Canham-Helfrich equação para um tubo retirado um chefe50,51
Discussão
O método de puxar os tubos de GUVs dá a rica informação sobre o sistema de membrana-proteína, como não é apenas o meio para medir as propriedades mecânicas fundamentais da membrana, mas ajuda a lançar luz sobre o acoplamento entre proteínas e membrana curvatura. Como discutido na introdução, outras técnicas existem para medir os efeitos das proteínas de membrana-encurvamento, incubando-se as proteínas com lipossomas de submícron, amarrados a uma superfície passivadas18,...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores agradecer Benoit Sorre, Damien Cuvelier, Pierre Nassoy, François Quemeneur e Gil Toombes por suas contribuições essenciais para estabelecer o método de nanotubo no grupo. O grupo de P.B. pertence ao consórcio CNRS CellTiss, para o Labex CelTisPhyBio (ANR-11-LABX0038) e de Ciências de Paris et Lettres (ANR-10-IDEX-0001-02). F.-C. Tsai foi financiado pela EMBO comunhão a longo prazo (ALTF 1527-2014) e acções Marie Curie (H2020-ACEM-IF-2014, projeto membrana-Yasmim-actina). MS é um Junior Fellow da sociedade Simons de Fellows.
Materiais
| Name | Company | Catalog Number | Comments |
| 1,2-Dioleoyl-sn-glycero-3-phosphatidylcholine (DOPC) | Avanti | 850375 | Example lipid used in data for Figure 3 |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000] [DSPE-PEG(2000)-biotin] | Avanti | 880129 | biotinylated lipid |
| BODIPY-TR-C5-ceramide | Molecular Probes (ThermoFisher) | D7540 | fluorescent lipid |
| BODIPY- FLC5-hexadecanoyl phosphatidylcholine (HPC*) | Molecular Probes (ThermoFisher) | fluorescent lipid for protein density calibration | |
| egg L-α-phosphatidylcholine (eggPC) | Avanti | 840051 | used for calibrating the tube radius constant |
| β-casein from bovine milk (>99%) | Sigma Aldrich | C6905 | used for passivating the micropipette and the experimental chamber |
| Sucrose | Sigma Aldrich | S7903 | |
| D(+) glucose | Sigma Aldrich | G7021 | |
| NaCl | Sigma Aldrich | S7653 | |
| Tris | Sigma Aldrich | 10708976001 | |
| osmometer | Loser | n/a | |
| Pt-wires, 0.5 mm diameter, 99.99% pure | Goodfellow USA | PT005139 | used for GUV electroformation |
| function generator | n/a | used to create current for GUV electroformation | |
| putty sealant | Vitrex (from CML France) | CRIT 140013 | used to seal the electroformation chamber |
| bath sonicator | n/a | useful to clean the electroformation chamber, but not crucial | |
| Nikon TE2000 inverted microscope, eC1 confocal system (Nikon), with two laser lines (λ = 488 nm and 543 nm); optical tweezers induced by a 5 W ytterbium fiber continuous wave laser (λ > 1070 nm; IPG GmBH Germany) | an example of a confocal microscopy system equipped with optical tweezers | ||
| micromanipulators | n/a | ||
| borosilicate capillaries (with internal and external radii of 0.78 mm and 1 mm, respectively) | Harvard apparatus | 30-0036 | |
| micropipette puller | Sutter Instrument | P-2100 | |
| microforge | Narishige | MF-800 | |
| piezoelectric actuator | Physik Instrumente | n/a | |
| polystyrene streptavidin coated beads (diameter 3.2 µm) | Spherotech | SVP-30-5 |
Referências
- McMahon, H. T., Gallop, J. L. Membrane curvature and mechanisms of dynamic cell membrane remodelling. Nature. 438 (7068), 590-596 (2005).
- Johannes, L., Wunder, C., Bassereau, P. Bending "on the rocks"--a cocktail of biophysical modules to build endocytic pathways. Cold Spring Harb Perspect Biol. 6 (1), (2014).
- Dawson, J. C., Legg, J. A., Machesky, L. M. Bar domain proteins: a role in tubulation, scission and actin assembly in clathrin-mediated endocytosis. Trends Cell Biol. 16 (10), 493-498 (2006).
- Mim, C., Unger, V. M. Membrane curvature and its generation by BAR proteins. Trends Biochem Sci. 37 (12), 526-533 (2012).
- Qualmann, B., Koch, D., Kessels, M. M. Let's go bananas: revisiting the endocytic BAR code. EMBO J. 30 (17), 3501-3515 (2011).
- Rao, Y., Haucke, V. Membrane shaping by the Bin/amphiphysin/Rvs (BAR) domain protein superfamily. Cell Mol Life Sci. 68 (24), 3983-3993 (2011).
- Simunovic, M., Voth, G. A., Callan-Jones, A., Bassereau, P. When Physics Takes Over: BAR Proteins and Membrane Curvature. Trends Cell Biol. 25 (12), 780-792 (2015).
- Safari, F., Suetsugu, S. The BAR Domain Superfamily Proteins from Subcellular Structures to Human Diseases. Membranes (Basel). 2 (1), 91-117 (2012).
- Angelova, M. I., Soléau, S., Méléard, P., Faucon, F., Bothorel, P., Helm, C., Lösche, M., Möhwald, H. . Progress in Colloid and Polymer Science Vol. 89: Trends in Colloid and Interface Science VI. 89, 127-131 (1992).
- Meleard, P., Bagatolli, L. A., Pott, T. Giant unilamellar vesicle electroformation from lipid mixtures to native membranes under physiological conditions. Methods Enzymol. 465, 161-176 (2009).
- Montes, L. R., Alonso, A., Goni, F. M., Bagatolli, L. A. Giant unilamellar vesicles electroformed from native membranes and organic lipid mixtures under physiological conditions. Biophys J. 93 (10), 3548-3554 (2007).
- Mathivet, L., Cribier, S., Devaux, P. F. Shape change and physical properties of giant phospholipid vesicles prepared in the presence of an AC electric field. Biophys J. 70 (3), 1112-1121 (1996).
- Collins, M. D., Gordon, S. E. Giant liposome preparation for imaging and patch-clamp electrophysiology. J Vis Exp. (76), (2013).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. Reconstitution of a transmembrane protein, the voltage-gated ion channel, KvAP, into giant unilamellar vesicles for microscopy and patch clamp studies. J Vis Exp. (95), e52281 (2015).
- Hochmuth, R. M., Evans, E. A. Extensional flow of erythrocyte membrane from cell body to elastic tether. I. Analysis. Biophys J. 39 (1), 71-81 (1982).
- Hochmuth, R. M., Wiles, H. C., Evans, E. A., McCown, J. T. Extensional flow of erythrocyte membrane from cell body to elastic tether. II. Experiment. Biophys J. 39 (1), 83-89 (1982).
- Bassereau, P., Sorre, B., Levy, A. Bending lipid membranes: experiments after W. Helfrich's model. Adv Colloid Interface Sci. 208, 47-57 (2014).
- Hatzakis, N. S., et al. How curved membranes recruit amphipathic helices and protein anchoring motifs. Nature chemical biology. 5 (11), 835-841 (2009).
- Bhatia, V. K., et al. Amphipathic motifs in BAR domains are essential for membrane curvature sensing. EMBO J. 28 (21), 3303-3314 (2009).
- Shi, Z., Baumgart, T. Membrane tension and peripheral protein density mediate membrane shape transitions. Nat Commun. 6, 5974 (2015).
- Chen, Z., Shi, Z., Baumgart, T. Regulation of membrane-shape transitions induced by I-BAR domains. Biophys J. 109 (2), 298-307 (2015).
- Cuvelier, D., Derenyi, I., Bassereau, P., Nassoy, P. Coalescence of membrane tethers: experiments, theory, and applications. Biophys J. 88 (4), 2714-2726 (2005).
- Derenyi, I., Julicher, F., Prost, J. Formation and interaction of membrane tubes. Phys Rev Lett. 88 (23), 238101 (2002).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Adv Colloid Interface Sci. 208, 225-234 (2014).
- Sorre, B., et al. Nature of curvature coupling of amphiphysin with membranes depends on its bound density. Proc Natl Acad Sci U S A. 109 (1), 173-178 (2012).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Phys Rev Lett. 64 (17), 2094-2097 (1990).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5 (6), 491-505 (2008).
- Capraro, B. R., Yoon, Y., Cho, W., Baumgart, T. Curvature sensing by the epsin N-terminal homology domain measured on cylindrical lipid membrane tethers. J Am Chem Soc. 132 (4), 1200-1201 (2010).
- Bo, L., Waugh, R. E. Determination of bilayer membrane bending stiffness by tether formation from giant, thin-walled vesicles. Biophys J. 55 (3), 509-517 (1989).
- Rossier, O., et al. Giant Vesicles under Flows: Extrusion and Retraction of Tubes. Langmuir. 19 (3), 575-584 (2003).
- Borghi, N., Rossier, O., Brochard-Wyart, F. Hydrodynamic extrusion of tubes from giant vesicles. EPL (Europhysics Letters). 64 (6), 837 (2003).
- Zhu, C., Das, S. L., Baumgart, T. Nonlinear sorting, curvature generation, and crowding of endophilin N-BAR on tubular membranes. Biophys J. 102 (8), 1837-1845 (2012).
- Ramesh, P., et al. FBAR syndapin 1 recognizes and stabilizes highly curved tubular membranes in a concentration dependent manner. Sci Rep. 3, 1565 (2013).
- Knorr, R. L., et al. Membrane morphology is actively transformed by covalent binding of the protein Atg8 to PE-lipids. PLoS One. 9 (12), e115357 (2014).
- Aimon, S., et al. Membrane shape modulates transmembrane protein distribution. Dev Cell. 28 (2), 212-218 (2014).
- Prévost, C., et al. IRSp53 senses negative membrane curvature and phase separates along membrane tubules. Nat Commun. , (2015).
- Simunovic, M., et al. How curvature-generating proteins build scaffolds on membrane nanotubes. Proc Natl Acad Sci U S A. 113 (40), 11226-11231 (2016).
- Allain, J. M., Storm, C., Roux, A., Ben Amar, M., Joanny, J. F. Fission of a multiphase membrane tube. Phys Rev Lett. 93 (15), 158104 (2004).
- Morlot, S., et al. Membrane shape at the edge of the dynamin helix sets location and duration of the fission reaction. Cell. 151 (3), 619-629 (2012).
- Renard, H. F., et al. Endophilin-A2 functions in membrane scission in clathrin-independent endocytosis. Nature. 517 (7535), 493-496 (2015).
- Simunovic, M., et al. Friction Mediates Scission of Tubular Membranes Scaffolded by BAR Proteins. Cell. 170 (1), 172-184 (2017).
- Simunovic, M., Lee, K. Y., Bassereau, P. Celebrating Soft Matter's 10th anniversary: screening of the calcium-induced spontaneous curvature of lipid membranes. Soft Matter. 11 (25), 5030-5036 (2015).
- Sorre, B., et al. Curvature-driven lipid sorting needs proximity to a demixing point and is aided by proteins. Proc Natl Acad Sci U S A. 106 (14), 5622-5626 (2009).
- Heinrich, M., Tian, A., Esposito, C., Baumgart, T. Dynamic sorting of lipids and proteins in membrane tubes with a moving phase boundary. Proc Natl Acad Sci U S A. 107 (16), 7208-7213 (2010).
- Dasgupta, R., Dimova, R. Inward and outward membrane tubes pulled from giant vesicles. Journal of Physics D: Applied Physics. 47 (28), 282001 (2014).
- Vitkova, V., Genova, J., Mitov, M. D., Bivas, I. Sugars in the aqueous phase change the mechanical properties of lipid mono- and bilayers. Molecular Crystals and Liquid Crystals. 449, 95-106 (2006).
- Bouvrais, H. . Mechanical properties of giant vesicle membranes investigated by flickering technique. , (2011).
- Koster, G., Cacciuto, A., Derenyi, I., Frenkel, D., Dogterom, M. Force barriers for membrane tube formation. Phys Rev Lett. 94 (6), 068101 (2005).
- Kwok, R., Evans, E. Thermoelasticity of large lecithin bilayer vesicles. Biophys J. 35 (3), 637-652 (1981).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 28 (11), 693-703 (1973).
- Canham, P. B. The minimum energy of bending as a possible explanation of the biconcave shape of the human red blood cell. J Theor Biol. 26 (1), 61-81 (1970).
- Marcerou, J. P., Prost, J., Gruler, H. Elastic Model of Protein-Protein Interaction. Nuovo Cimento Della Societa Italiana Di Fisica D-Condensed Matter Atomic Molecular and Chemical Physics Fluids Plasmas Biophysics. 3 (1), 204-210 (1984).
- Leibler, S. Curvature Instability in Membranes. J Phys-Paris. 47 (3), 507-516 (1986).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados