JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
거 대 한 Unilamellar 소포에서 막 나노튜브를 당기
* 이 저자들은 동등하게 기여했습니다
요약
셀에 많은 단백질을 감지 하 고 막 곡률을 유도. 곡선된 막 체 외단백질 또는 어떤 곡률 활성 분자의 상호작용을 연구 하는 지질 소포에서 막 나노튜브를 당겨 하는 방법을 설명 합니다.
초록
세포 막의 재편 endocytosis, 인신 매매, 등 filopodia형성 등 많은 세포 현상의 중요 한 부분입니다. 많은 다른 단백질 그들의 능력을 감지 하거나 유도 막 곡률 때문에 곡선된 멤브레인과 연결 합니다. 일반적으로 이러한 프로세스는 다양 한 단백질 셀에서 양이 많게 공부 하기에 너무 복잡 하 포함 한다. 우리는 endocytic 목 같은 곡선된 세포 구조를 흉내 낸는 곡선된 막에 생체 외에서다시 구성할 프로토콜을 설명 합니다. 거 대 한 unilamellar 소포 (우두머리)는 그의 내부 압력 및 표면 장력 micropipette 포부와 함께 제어 되는 세포 막의 모델로 사용 됩니다. 광학 핀셋을 사용 하 여 우두머리에는 포인트 당기는 힘을 적용 평면 막에 연결 된 높은 곡률의 나노튜브를 만듭니다. 이 방법은 전통적으로 굽 힘 강성 등 지질 막의 기본적인 기계적 특성을 측정 하기 위해 사용 되었습니다. 최근 몇 년 동안, 그것은 단백질 막 곡률 및 그들은 모양과 막의 역학에 영향을 미칠 방법으로 상호 작용 하는 방법을 공부 하 확장 되었습니다. Micromanipulation, microinjection, 광학 핀셋, confocal 현미경 검사 법을 결합 한 시스템 동시에 막 곡률, 막 긴장, 그리고 단백질의 표면 밀도의 측정을 허용 한다. 이 측정에서 단백질 막 시스템의 많은 중요 한 기계 및 형태학 속성 유추 수 있습니다. 또한, 우리 하다 생리 소금 농도 형광 강렬 레이블이 단백질과 지질에서에서 막에 단백질의 표면 밀도 측정 하는 방법의 GUVs를 만드는 프로토콜.
서문
Endocytosis, 인신 매매, filopodia, 감염 등의 형성 등 많은 세포질 과정 세포 막1,2의 모양에 있는 극적인 변화를 함께 제공 됩니다. 셀에 다양 한 단백질 막에 바인딩 및 그들의 모양을 변경 하 여 이러한 프로세스에 참여 하 고. 가장 주목할 만한 보기는 본질적으로 도메인3,,45,,67바 곡선 특성을 포함 하는 빈/Amphiphysin/Rvs (바) 단백질 가족의 일원. 일반적으로, 그들은 표면에 그리고, 많은 경우에, 또한 얕게 삽입은 bilayer amphipathic 나선 바 도메인 준수는 막으로 작용. 모양, 크기, 및 amphipathic 나선 수와 함께 바 도메인의 결정: (1) 막 곡률의 방향 (즉, 여부 그들은 invaginations 또는 돌출을 유발 한다), 및 (2) 막의 크기 곡률의5,8. 노트, 여기 긍정적인 곡률 달리 곡선된 막, 즉, 상호 작용 입자, 그리고 부정적인 돌출의 볼록한 쪽으로 정의 됩니다. 또한, 단백질 바의 양적 연구는 막에 그들의 효과 물리적 매개 변수 집합에 따라 달라 집니다 공개: 표면 단백질, 막 긴장, 그리고 막 모양 (평면 대 관 대 구형의 밀도 모양)7. 단백질 바 이러한 매개 변수에 따라 수 있습니다: (1) 막 곡률의 센서 역할 (2) 구 부 막, 또는 (3) 유도 막 절단7.
막 셀에 재편 endocytosis, 같은 현상의 양적 측면을 공부에 관련 된 부품의 투명 한 수 비보에 매우 도전 이다. 최소한의 구성 요소를 셀에 곡선된 막을 흉내 낸의 생체 외에서 재구성 어떻게 막 커브 단백질의 작동 기계 이해를 얻기 위하여 수단을 제공 합니다. 이 문서는 막 나노튜브에서 생체 외에서 micromanipulation, confocal 현미경 검사 법, 광학 핀셋을 사용 하 여 다시 구성할 프로토콜을 설명 합니다. 접근은 공부 하 고, 양적 방법, 단백질, 지질, 또는 작은 분자 곡선된 막 상호 작용 하는 방법을 사용할 수 있습니다. GUVs 지질 누구의 곡률 막 커브 상호 작용 분자의 크기에 비해 무시할 수은 세포 막의 모델로 사용 됩니다. 그들은 electroformation 방법9 는 소포 지질 영화를 수 화와 교류 전류 (AC)10에서 GUVs로 붓기 형성 된다를 사용 하 여 준비 된다. 가장 일반적인 기판 GUVs 재배 되는 인듐 주석 산화물 (ITO) 코팅 중 반 전도성 격판덮개 또는 백 금 철사 (Pt-전선)11. 이 작품에서는, GUVs는이 방법은 버퍼12소금의 면 전에 서 GUVs를 만드는 대안 보다 훨씬 더 잘 작동 하도록 표시 되었습니다로 Pt-전선에 재배 됩니다. Electroformation 프로토콜은 여기에 설명 된 그것을 재현 하는 충분 한 세부 사항에, 하지만 우리는 비슷한 다른 메서드와 GUVs를 만드는 세부 사항13,14에서 설명 되었습니다 이전 기사에 독자를 참조 하십시오. 우리 손에 Pt 전선에 electroformation는 성공적으로 나왔고 GUVs 또는 자연 지질 합성 지질의 혼합에서 ~ 100 m m NaCl을 포함 하는 버퍼에 추출 물. 또한, 성장 하는 동안 GUVs 내부 단백질을 캡슐화 가능 했다 또한. 예를 들어 electroformation 챔버는 그림 1A;에 나와 그것은 2 ~ 10 cm 긴 Pt-와이어 홀더 유리 coverslips와 양쪽에 밀봉 될 수 있다 소계 (PTFE)에서 만든 삽입 구성 ~ 1-2 c m 간격 (그림 1A).

그림 1: 실험적인 체제. Pt-와이어에 연결 된 전기 커넥터 (A) 우두머리 electroformation 챔버. (B) 왼쪽: 현미경을 보여주는 실험 시스템, 목표 및 2 개의 micropipettes (왼쪽 및 오른쪽) 위 실험 챔버는 micromanipulators에 연결 된 고 튜브 고 단백질에 대 한 실험 챔버에 삽입 사출입니다. 오른쪽: 실험 챔버의 근접 보기는 포부와 삽입 분사 micropipettes의 끝을 보여주는 목표 위에 탑재. (C) 주사기의 백 엔드에 micropipette 삽입 얇은 디스펜서 장비. 하단의 파란색 점선 개요는 micropipette micropipette 내부 디스펜서의 근접 보기입니다. 이 시스템은 카 세 인 유리 표면 passivate 하 고 필요할 때 미네랄 오일 칠을 다시 하는 micropipette 채우기 위해 사용 됩니다. (D) A 시스템 µ L 양의 단백질 해결책을 발음 하는 데 사용 합니다. 바늘은 주사기와 주입 micropipette에 연결 된 튜브에 연결 되어 있습니다. Micropipette 팁 신중 하 게 단백질 해결책에 몰입 하 고 그렇게 발음 하는 micropipette 팁을 채우기 위해. micropipette 다음 다시 채워집니다 미네랄 오일 패널 C.에에서 표시 하는 시스템을 사용 하 여 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
막 나노튜브, 7에서 반경에 이르기까지 몇 백 nm nm는 우두머리에서 외부 힘으로 당길 수 있다. 이 방법은 처음 세포 막 및 소포, 휨 강성15,16등의 탄성 속성 측정 하도록 설계 되었습니다. 가장 최근 작품, 메서드 가져온된 나노튜브7,17근처 단백질 microinjecting 곡선된 멤브레인과 단백질의 상호 작용 연구를 확대 되었다. 다른 방법 막 커브 단백질 연구 개발 되었습니다. 한 방법에서는, 단백질 세 표면에 닿는 곳에 다르게 크기의 리와 알을 품는. Confocal 현미경 검사 법은 단백질 바인딩 곡률을 이용한 정렬18,19를 나타낼 수 있는 liposome 직경의 함수로 측정 하는 데 사용 됩니다. 다른 방법에서는, 단백질 tubules20,21을 자발적으로 유도 하는 능력을 측정 하기 위해 마이크로 발음 하는 우두머리 근처 주입 됩니다. 이 프로토콜에서 설명 하는 방법을 막 커브 단백질 endocytosis에 관련 된 공부에 특히 적합 한은 대부분 단백질이 일반적으로 미리 형성한 막 나노튜브와 함께 화물 포함 된 막 invagination 연결을 발생 합니다 평면 플라즈마 멤브레인 기본 또한,이 방법에서는, 달리 곁된 작은 리와 분석 결과에 막 나노튜브는 지속적으로에 연결 막; 따라서, 그것은 한 상황으로 예상 vivo에서우두머리와 기계적 평형 에입니다. 따라서, 근본적인 막 물리학 적용 하 고 우리가 우리의 측정22,,2324에서 기계적 특성의 과다를 추정할 수 있다.
이 방법의 전체 구현에 대 한 필요한 장비는 confocal 현미경, 광학 핀셋, 그리고 하나 또는 두 개의 micropipettes 물 탱크 (그림 1B)에 연결을 포함 합니다. 모든 3 개를 결합해 서, 동시에 막 긴장, 막 곡률, 단백질의 표면 밀도 측정 하 고 힘25를 튜브에 가능 하다. Micropipette 포부 필수적 이며, 그것은 쉽게 액체 정역학 압력을 통해26포부 압력 제어 하는 물 탱크에 연결 홀더 유리 제 micropipette 삽입 하 여 구성 됩니다. micropipette 홀더는 제어는 micromanipulator 고, 이상적으로, 한 방향으로 정밀 운동 위한 압 전 액추에이터. 나노튜브를, microaspirated 우두머리는 짧게 미크론 크기의 구슬을 다음 멀리는 나노튜브를 만드는에 붙어 됩니다. 이 구현에는 구슬27게시 된 프로토콜 따라 생성 될 수 있다 광학 족집게에 의해 개최 됩니다. 그것이 비록 정확한 힘 측정 비용 다른 방법으로, 광학 족집게 및 풀 나노튜브의 분배 가능 합니다. 광학 트랩을 만들려고 너무 어려운 경우 또는 힘 측정은 중요 하지,와 같은 경우 단순히 곡선된 멤브레인에 대 한 단백질의 선호를 확인 하 고 싶어 하는 경우 튜브 발음 하는 두 번째 micropipette28의 끝에 비드를 사용 하 여 가져온 수 있습니다. 그것은 또한30,31흐름 또는 중력29 를 사용 하 여 튜브를 당겨 수 있습니다. 또한, confocal 현미경 검사 법 중요 하지 않습니다. 그러나, 그것은 단백질의 표면 밀도 측정 하기 위해 그렇게 선호. 그것은 또한 지질 막 힘 및 긴장은 별도로 따라서 튜브의 형광 강도에서 나노튜브 반경 측정 있습니다. 형광에서 추론 튜브 반경 이러한 수량 사이의 관계 막 준수 단백질25의 존재로 인해 잘 설립 방정식에서 일탈 하는 경우에 특히 중요 하다. 중요 한 것은, 하나로 튜브 곡률을 측정할 수 있을 것입니다 광학 트랩 confocal 현미경 검사 법의 분배 수 없습니다.
이 프로토콜에서 설명 된 대로 메서드 나노튜브는 바 가족25,,3233,34에서에서 주로 그들에 다양 한 주변 막 단백질의 곡률을 이용한 정렬 공부 하는 데 사용 되었습니다. . 그것은 또한 KvAP에 농축 conically 모양의 막 횡단 칼륨 채널 단백질35바 같은 방식으로 나노튜브 곡선을 표시 했다. GUVs 내부 단백질을 캡슐화 하는 메서드를 최적화 하 여 부정적인 곡률과 단백질의 상호 작용은 최근 조사 잘36로. 또한,이 메서드는 사용 단백질 건설 기계25,37 의 형성을 명료 하 고 중 선 긴장38단백질 dynamin39, 또는 바 막 절단의 메커니즘을 연구 하 단백질40,41. 뿐만 아니라 단백질, 작은 분자 또는 이온 곡률을 유도할 수 있다 또한. 이 메서드를 사용 하 여 칼슘 이온 소금 없는 조건42에서 긍정적인 곡률을 유도 하기 위해 표시 했다. 흥미롭게도, 그것은 또한 보였다 지질 demixing 포인트43,44근처는 작곡에만 있지만 정렬, 곡률을 받을 수 있습니다. 합계에서는, 연구원은 어떻게 중 정수 막 구성 요소 (예:, 지질 또는 막 횡단 단백질) 조사에 관심이 메서드를 사용할 수 있습니다 또는 주변 분자 바인딩 (중 내부 또는 외부 GUVs)와 상호 작용 기계 및 양적 관점에서 원통 곡선된 막 그것은 또한22,,2345막 자체의 기계적 성질 측정에 관심 있는 사람을 위한 것입니다.
프로토콜
1. Pt-와이어에 Electroformation에 의해 GUVs의 준비
- Electroformation 챔버 청소 ( 소개 및 그림 1A참조)와 Pt-전선 에탄올 또는 지질을 멀리 세척 하는 아세톤 등 유기 용 매와 물으로 씻어 소금에.
참고: 우리는 철저 하 게 에탄올-젖은 티슈로 잔류물을 멀리 닦아 다음 아세톤, 에탄올, 각각 5 분 동안 물에서 sonicating 제안. - 클로 프롬에 1 mg/mL에서 원하는 지질 구성의 지질 믹스를 준비 합니다. 혼합을 포함 한다 ~ 0.05%는 지질의 어 금 니 분수 biotin과 활용 (예를 들어, 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000]) 및 ~ fluorophore (0.5%는 지질의 어 금 니 부분 활용 예를 들어, BODIPY-TR-C5-세 라마 이드).
참고: 우리의 경험에서 그것은 포함 하는 30% 이상 높은 수익률에 GUVs를 생산 하기 어렵다 지질 청구.
주의: 클로 프롬은 적절 한 장갑을 끼고 화학 후드 안에 처리 되어야 합니다. - Electroformation 챔버에 태평양 전선의 한 쌍을 삽입 합니다. Pt-전선에 지질 혼합 구분에서 입금 ~ 2-3 m m (총 ~ 믹스의 4 µ L).
- 실 온에서 30-60 분 동안 진공에서 와이어를 건조.
- 실리콘 윤활제를 사용 하 여 챔버에는 coverslip 준수 하 여 챔버의 하단 인감. NaCl, 자당, 버퍼링 에이전트 (예를 들어, 70 mM NaCl, 100mm 자당 및 pH 7.4에서 10 mM Tris,)를 포함 하는 버퍼 솔루션에 챔버를 채우십시오. 이 매체는 실험에 GUVs 안에 있을 것입니다. 그것은이 매체의 osmolarity 내 실험 매체의 osmolarity 일치 필수적입니다 ~ 10%. 자당을 사용 하 여 조정 하는 osmolarity. 목표는 GUVs에 그들을 캡슐화 하는 경우 원하는 농도에 솔루션에 단백질을 추가 합니다.
주의: 다양 한 소금과 설탕 버퍼에서 수에 영향을 휨 강성과 막24,42,,4647의 자발적인 곡률. - 챔버 내부에 공기를 최소 보장 실리콘 그리스와는 coverslip 준수 하 여 챔버의 상단을 봉인. Pt-500 Hz, 280에서 와이어를 통해 사인 AC 전류를 적용 mV.
참고: 성장 시간과 온도 지질 구성과 단백질의 감도 따라 낙관 되어야 한다. 자연적인 지질 추출 물을 사용 하는 경우 또한 하룻밤 4 ° C에서 GUVs 성장 하 여 최고의 수익률 달성 했다 GUVs에서 단백질을 캡슐화 하는 경우. 단백질, 그리고 합성 지질 구성, 대 한 상 온에서 성장에 대 한 부재에서 ~ 2 시간 충분 했다.
2. 실험 챔버와는 Micropipettes의 준비
- Micropipettes를 준비 하려면 유리 모 세관 피펫은 끌어당기는 사람을 사용 하 여 당겨. 그것은 각각 0.7 m m, 1mm의, 내부 및 외부 반지름으로 유리 모 세관을 사용 하 여 좋습니다. 그것의 안 직경은 5-는 micropipette의 팁을 다음, 수정 된 microforge를 사용 하 여 7 µ m. 단백질 또는 다른 분자 실험에 주입 될 것입니다, 다른 micropipette 당겨 하 고 8-15 µ m의 내부 직경에 팁을 수정.
- 그림 1에서 보듯이 금속 기지에 두 개의 직사각형 현미경 coverslips를 배치 하 여 실험 챔버를 생성 합니다. coverslips로 구분 되어야 한다 ~ 1 m m. 챔버 ( 그림 1참조) 긴 가장자리를 따라 채용 해야 합니다. 오픈 사이드 어디 끝 도달 해야 적어도 챔버의 센터는 micropipette의 팁을 적합 해야 한다.
- 누구의 osmolarity GUVs 성장 하는 데 사용 하는 버퍼에서 10% 이상 차이가 되지 해야 실험 버퍼를 준비 합니다. 포도와 osmolarity를 조정 합니다. 나노튜브와 endophilin의 상호 작용을 공부에 사용 된 실험 버퍼의 예는 100 m m NaCl, 40mm 포도 당, pH 7.4에 트리 스와 버퍼링입니다. 내부 자당의 조합 / 포도 당 밖에 보장: 밝은 분야 현미경 검사 법, 그리고 챔버의 하단에 그들을 일으키는 원인이 되는 GUVs 내부 (b) 높은 밀도와 GUVs를 관찰 하기 위해 (a) 충분 한 위상 대조. 실험 요구 사항에 따라 소금 농도 조정 합니다.
참고: 우리의 경험에서 막의 기계적 성질에 영향을 미치는 뿐만 아니라 높은 포도 당 농도 (> 300 m m) 부정적인 영향을 미친다는 나노튜브를 당겨 하는 데 필요한 streptavidin biotin 채권의 설립을. 또한, 너무 작은 소금 억제 streptavidin biotin 채권, 반면 너무 높은 농도 단백질 막 상호 작용 스크린. 단백질 캡슐, 외부 버퍼에 매우 높은 소금 농도 사용 하는 경우 (예를 들어, > 200 mM NaCl) 외부 전단지36에서 단백질을 분리 하는 트릭으로 사용할 수 있습니다. 그것은 다양 한 관심사의 분자의 최적의 바인딩 조건 찾을 수 소금 농도 실험 하는 데 필요한입니다. -
실험에 대 한 GUVs를 수집 하기 전에 30-60 분 실험 챔버와 포부 micropipette는 매우 순수한 β-카 세 인 (예를 들어, 실험 버퍼에 녹아 있는)의 5 mg/mL 해결책으로 작성 하 여 유리 표면 passivate. Β-카 세 인 그들을 폭발 하는 너무 강력 하 게 준수 GUVs 방지 유리 표면에 보호 층을 만듭니다. 30-60 분에 대 한 β-카 세 인을 품 어.
참고: 막 긴장 제어 방해 micropipette 안에 아무 거품을 하 고 있어야 합니다.- 디스펜서 micropipettes를 채우는 만들려고 주사기 바늘 플라스틱 커넥터 가까이 휴식과 얇은 실리 카 모 세관 (액체 크로마토그래피에 사용 등)에 접착제 (그림 1C).
- Β-카 세 인을 부 화, 동안 현미경에 챔버를 탑재 하 고 목표 위에 센터. 긴 가장자리를 따라 오프닝을 통해 포부 micropipette의 끝을 삽입 하 고 현미경 목표 위의 팁을가지고. 흡입 압력은 거의 제로 (더 무거운 흐름 또는 현미경 아래에서 볼 수 있는 피펫으로 있어야 함) 물 탱크 레벨을 조정 합니다.
-
채우기 선택의 농도에 실험 버퍼에 원하는 분자와 주입 micropipette 녹아 micromanipulator, 내부 micropipette 탑재 경우 단백질 또는 다른 분자 실험 기간 동안 주입 될 것입니다, 그리고 실험 챔버의 반대 측을 통해 삽입 합니다.
- 단백질의 최소 금액을 사용 하 여 채울 micropipette 팁만 단백질 포부에 의해. 그렇게 하려면, 플라스틱 배관으로 주사기에 부착 된 바늘의 끝을 감싸 줍니다. 사출 micropipette의 뒷면에 튜브를 삽입 합니다.
- 매우 신중 하 게 단백질 해결책에는 micropipette 끝을 담가 그리고는 micropipette의 팁을 채우기 위해 그것을 발음.
참고:이 간단한 설치 표시 됩니다 그림 1D 로 하 고, 우리의 경험에서는, 그것은 단백질 해결책의 조금 몇 µ L에서 발음 수 있습니다. - 백필 미네랄 오일 주입 micropipette 나머지 단백질 솔루션와 (사용 하 여 설치 그림 1C)는 물 탱크에서 물을 방지 하기 위해.
- 알아서 하지 기포 주입 피 펫에 소개로 그것은 불안정 한 사출 압력을 유발 한다. 또는 단백질 양이 충분 한 경우에, 채워는 micropipette 단백질 같은 방법으로 β-카 세 인 작성 단계 2.4에에서 설명 된 대로. 사출 피 펫에 포부 압력을 최소화 하기 위해 물 탱크 레벨을 조정 합니다.
참고: 삽입 된 분자 또는 이온은 나노튜브 근처의 농도 희석으로 인해 낮은 될 것입니다 그리고 피펫은 출구42에서 거리의 기능으로 형광 강도 감소를 측정 하 여 예상할 수 있습니다. 하지만 그것은 측정 될 수 있는 정확 하 게 (섹션 4 참조) 주입 된 분자의 bilayer 바인딩된 밀도 알아야 더 중요 한.
- Β-카 세 인으로 부 화 후, 상공에서 솔루션을 제거 하 고 실험 버퍼와 여러 번 씻어. 실험적인 버퍼를 채울.
- GUVs의 electroformation를 중지 하 고 태평양 전선에서 직접 수집. 실험 챔버에 우두머리 솔루션의 몇 가지 µ L를 추가 합니다. GUVs 갓 준비에 사용 합니다.
- 0.1 x 10− 3% (w/v) 또는 그 주위에 약 실에 있는 구슬의 최종 농도에 실험 챔버를 streptavidin 입히는 구슬의 몇 µ L를 추가 합니다. 폴리스 티 렌 구슬 ~ 3 µ m 직경에서 권장 (물에 폴리스 티 렌 구슬에는 광학 트랩에 산란 힘에 관하여 경도력 극대화에 관해서는 근처 최적 굴절률 대비). 비드 농도 실험에 따라 조정 될 수 있다: 매우 낮은 농도 어려워 챔버에 그들을 찾을 수 있게 그리고 광학 핀셋으로 떨어지는 여러 구슬의 위험을 실행 하는 너무 높은 농도.
3. 한 우두머리에서 막 나노튜브 당기
- GUVs와 구슬 챔버의 바닥에 정착. 조금 여는 GUVs 폐 실험 버퍼의 증발, 대 한 약 ~ 15 분에 GUVs Deflating는 micropipette로 발음 될 수 있는 일부 초과 지역 생산 필수적 이다. GUVs 기복 눈에 띄게 한다 (즉, 플로피 표시) 가벼운 현미경. 시제를 표시 하는 경우 더 많은 증발 시간에 대 한 수 있습니다.
참고: osmolarity 변경 비율 그리고 증발 표면 영역, 온도, 등등에 따라 밀접 하 게 모니터링 해야 합니다. 그러나 원칙적으로, osmolarity 차이부터 자당/포도 당 농도 조정 하 여 설정할 수,, 주의 해야 삼투성 충격 유도를 하지. - 플로피 우두머리 찾아서 피펫으로로 발음. 열망 혀 (피펫으로 내 막의 일부)의 길이 동일 하거나 해당15,,1622,23 (이론적 분석에 대 한 피 펫 반지름 보다 큰 이어야 한다 그림 2)입니다. 여러 GUVs를 보십시오. 경우에 GUVs의 충분히 긴 혀를 생산 하기 위해 발음 될 수, 몇 분을 기다립니다. GUVs 플로피 충분히 있다면, 다음 단계로 진행 합니다.
- 추가 버퍼의 증발을 방지 하기 위해 미네랄 오일 챔버 인감. 신중 하 게 실험 챔버의 오픈 가장자리를 따라 석유를 pipetting으로 그렇게.
- 흡입 압력의 제로 위치를 설정 하려면 먼저, 챔버에 구슬에 대 한 모양과 구슬 근처 포부 피펫은 출구 위치. 구슬에 빨려도 포부 피 펫에 의해 물 탱크의 높이 조정 합니다. 미네랄 오일은 증발 및 챔버 내부에 따라서 더 압력 변화 방지, 비록 각 우두머리를 측정 하기 전에 포부 압력을 0.
- 우두머리를 찾아서 그것을 발음. (어디 그것은 수도 수 꺼내 피펫으로 전단 응력에 의해 챔버를 움직일 때 표면에서 우두머리 유지) 하에서는 micropipette를 이동 합니다.
- 신중 하 게 실로 이동 하 여 비드를 찾습니다. 갑작스런 움직임 우두머리를 내보낼 수 있다. 거리에 광학 핀셋으로 트랩 ~ 챔버 바닥에서 20 µ m. 관심 영역 다른 구슬 또는 시야에 막 깨끗 한 있는지 확인 합니다. 구슬 이외의 광학 족집게에 아무것도 측정을 중단 것입니다.
- 돌려 우두머리에 초점, 그리고 구슬 멀리 micropipette 정렬 광학 트랩 (그림 2)와 함께.
- 1-2 분 (힘 측정에 필요한) 평형 위치 측정을 위한 구슬의 움직임을 기록 합니다.
- 그래서 막 긴장을 줄이기 위하여 우두머리를 손실 없이 가능한 micropipette 내부 압력을 줄일. 조심 스럽게 streptavidin biotin 채권을 설정, 두 번째 주위에 구슬 접촉 우두머리를가지고 다음 조심 스럽게 잡아 당겨는 나노튜브를 만드는 다시. 또는 구슬에서 우두머리의 모션 최소한 광학 족집게에 구슬 방해 압 전 액추에이터와 이상적으로 행해져야 한다.
참고: 경우는 나노튜브를 형성 하지 않습니다, 그것은 수 비드, biotinylated 지질 우두머리, 소금 또는 과도 한 실험 버퍼 또는 막에서 포도 당 농도의 부족 한 농도에서 부족 한 금액의 가난한 streptavidin 코팅 때문 우두머리에 있는 긴장은 너무 높은48. - 열망 혀를 다시 그렇게 열망 압력을 증가. 튜브를 열망 피 펫 및 극대로 튜브 (그림 2)에 초점의 축에 맞춥니다.
- 우두머리 적도 튜브 초점에서 인지 확인 합니다. 몇 분 동안 밝은 분야 현미경 검사 법으로 구슬의 움직임을 기록 (여기, 카메라 수집 속도 30 Hz). H, 제로 위치에 관하여 물 탱크의 높이 기록 합니다. (그림 2) 시스템의 몇 가지 confocal 이미지를 가져가 라.
- 다른 포부 압력, 암시적으로 막 긴장에서 이전 단계를 반복 합니다. 일반적인 긴장 범위는 0.015-0.2 mN/m, 약 0.02 mN/m의 스텝 크기.
- 단백질 또는 분자 시스템 근처 주입, 주입 micropipette 나노튜브, 광학 트랩에 구슬 불안정 하지 확인 하 고 근처를. 부드럽게 주입 압력의 주위에 1-2 실바
-
단백질 바인딩 (우두머리에 막 남아 상수에 주입 된 단백질의 형광 강도) equilibrated 있다, 후 맨 손으로 막 (3.11, 3.12 단계)와 마찬가지로 단계별 측정을 반복 합니다.
참고: 측정은 일정 한 압력에서 우두머리 근처 단백질을 주입 하는 동안 수행 됩니다, 이후 단백질의 대량 농도 그대로 약 근처 우두머리; 따라서, 단백질 탈 착 측정 동안 무시할 수 이어야 한다.- 또는, 그것은 지속적인 단백질 대량 농도 되도록 튜브 당기 실험을 수행 하기 전에 단백질 함께 GUVs를 품 어 수 있습니다. 그 튜브 및 우두머리에 단백질의 상대적 막 분수, 측정 단백질 전달 하는 방법을 영향을 주지 않습니다 곡률 정렬 계산 (섹션 4 참조).
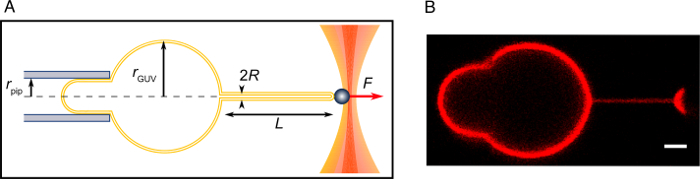
그림 2: 튜브 당기 실험. (A)는 실험의 회로도. 이 프로토콜에서 설명 된 대로 가져온된 튜브의 (B) 공초점 이미지. 눈금 막대 = 2 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
4. 측정 및 데이터 분석
- 막 장력 측정
- 일정 한 포부 압력에서 각 단계에 대 한 액체 정역학 압력 계산:
ΔP pgh =
여기서 p 는 물 밀도, g 는 중력 가속도, h 단계 3.11에서에서 물 탱크의 높이입니다. - 공초점 이미지에서 r우두머리, 우두머리의 반지름과 포부 피 펫, r핍 (그림 2)의 반지름을 측정 합니다.
- 막 긴장, σ, 라플라스의 방정식49를 사용 하 여 계산 합니다.
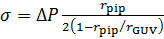
- 일정 한 포부 압력에서 각 단계에 대 한 액체 정역학 압력 계산:
- 막 힘을 측정
- 여러 보정 방법27중 하나를 사용 하 여 광학 핀셋, k의 강성을 결정 합니다. 이 설정에서 k 27점성 끌기 메서드 사용 하 여 측정 합니다.
- 튜브 (단계 3.8)를 당기는 전에 측정에서 평균 0,구슬의 평형 위치를 계산 합니다.
- 각 일정 한 긴장 측정 평형 막 힘, F, Hooke의 법률에서 계산.
F = k(한 - 0)
어디 는 구슬의 평균 위치를 측정 하는 동안.
- 측정 튜브 반경
- 맨 손으로 막 (없음 추가 막 커브 분자)의 경우로 힘에서 튜브 반경, R, 계산.
R = F/(4πσ)
(22,23참조) 합니다. - 막 커브 분자의 존재와 단계 4.3.1 별도로 튜브 반지름 측정, 하려면 첫째, 지질 형광 강도 나욕조, 튜브 길이 따라 그리고 난우두머리는 우두머리 윤곽선을 따라 기록 합니다. 튜브 또는 우두머리 윤곽선의 밝은 라인을 따라 평균 강도로 fluorophore 또는 막에 바운드의 평균 형광 강도 측정 합니다. 우두머리 컨투어 또는 튜브의 수평 섹션을 포함 하는 직사각형 상자를 선택 하 고 상자에서 각 수평 라인의 형광 강렬의 합계를 계산 합니다.
- (즉, 상자 너비) 가로줄의 픽셀 수로 각 합계를 나눕니다. 선택한 상자에 있어야 현재 없습니다 다른 막 note. 형광 강도 프로필 선택한의 길이 따라 얻을 수 있습니다.
- 배경 강도 뺀 후 밝은 라인에서 평균 픽셀 형광 강도 가져가 라. 튜브 반경 선형으로 우두머리와 튜브의 윤곽선을 따라 형광의 비율에 관련 된:
R = K욕조나욕조/내가우두머리
여기서 K욕조 는 보정 계수25입니다.
참고:이 방법을 사용할 수 있습니다 (튜브 하나 confocal 복 폭 내에 충분히 좁은 경우) 10-80 nm 범위에서 튜브 반지름을 측정 하 고 80 nm와 더 높은 범위에서 다소 큰 불확실성. 측정 감도 설정에 따라 달라 집니다.
- 4.3.1 및 4.3.2 단계 충전된 지질을 사용 하 여 간단한 막 구성에 독립적인 반지름 측정을 수행 하 여 K욕조 를 결정 합니다. 이러한 간단한 막 구성 방식 반지름과 힘 단계 4.3.1에서에서 주어진 간단한 관계 있습니다. 여러 번 실험을 반복 하 고 플롯 R,욕조 나대 힘 (4.3.1 단계)에서 추론 /내가우두머리 (4.3.2 단계). 맞에서는 K욕조 를 계산 합니다. 이 설치 프로그램, K욕조 에서 = 200 ± 50 nm를 사용 하 여 계란 L-α-phosphatidylcholine (계란-PC) 막과 형광 지질 누구의 형광 최소한 분극25에 따라 달라 집니다.
참고: K욕조 는 서로 다른 목표, 다른 confocal 복 볼륨 때문에 측정 해야 합니다. 지질 fluorophore 해야 삽입 된 단백질/분자와 상호 작용 하지. BODIPY TR 세 라마 이드, 여기에, 권장 형광 지질은 단백질의 상호 작용을 예상 되지 않음. 이 가정 막대의 이전 연구와 확인 되었다 고-바 도메인25,36,37, 높은 단백질 표면 검사, 튜브 반경에 표시가 있는 단백질에 의해 관계 없이 고정 된 우두머리에 긴장입니다. 경우 단백질 지질 fluorophore 상호 작용, 고갈 또는 농축에 fluorophore의 다양 한 높은 단백질 표면 부분에 튜브에서 관찰 됩니다.
- 맨 손으로 막 (없음 추가 막 커브 분자)의 경우로 힘에서 튜브 반경, R, 계산.
- 단백질의 표면 밀도 측정
- 지질 믹스는 간단한 충전된 지질 (예를 들어, 계란 PC) 약 5 다른 두더지 분수 (단백질, 예를 들어, 레이블을 사용 하는 염료로 동일한 파장의 형광 지질의 보충을 사용 하 여 준비 BODIPY-FLC5-hexadecanoyl-phosphatidylcholine (HPC *) 대 한 예를 들어, Alexa488 라는 단백질) 범위에서:HPC * X = 0.01-1%. 준비 GUVs 100 mM 자당에서 이토에 electroformation에 의해 플레이트 (이전 게시13의 1 단계를 수행).
- GUVs를 수집 하 고 β-카 세 인으로 패 실험 챔버를 전송. 예를 들어, 100 mM 포도 당 실험 솔루션에 대 한 사용 합니다. 정착에 GUVs에 대 일 분 정도 기다립니다.
- GUVs의 confocal 형광 이미지를가지고 고 기록 우두머리 따라 평균 형광 강도 등고선 형광 지질의 첩 자 분수의 기능으로 (4.3.2 단계 참조). 각 구성에 대 한 형광 지질, φ의 면적 밀도 계산HPC*. 예를 들어 지역 지질 당 0.7 nm2, φ는 가정에 의해HPC* = 1.43 x 106 XHPC * 전단지 당. 우두머리,HPC *, 우두머리, φ 대 에서 HPC * 형광 강도 플롯HPC*. 맞춤 제공 보정 상수, A, φ에 의해 주어진HPC* = AIHPC *, 우두머리. 일반적으로 사용 되는 다양 한 현미경 설정 ( 그림 3에서 예를 참조) 레이저 파워 및 (즉, 이득), 검출기 감도 기록 수 따라서 A 와 같은 A 현미경 설정에 따라 다릅니다.
- 범위에 다른 농도에서 HPC * 세제, 예를 들어, 라우릴 황산 나트륨 (SDS)에 녹아 있는 여러 솔루션을 준비 ~ 1 ~ 10-50 µ M. 대량에서 각 솔루션의 형광 강도 기록 하 고 강도의 기울기를 계산 대 농도 (그림 3). 반복 단백질 유사한 농도 범위에 활용 될 것 이다 fluorophore와 측정 ( 그림 3에 Alexa488와 함께 예 참조). 이 측정 단백질 레이블과 나A488, 대량 지질 라벨의 형광 강도 연결 하는 데 필요한 / IHPC *, 대량로 그들은 반드시 같은 대량 농도에서 같은 방법으로 방출 하지 않을 수 있습니다.
- 단백질 분자는 fluorospectrometer를 사용 하 여 당 fluorophores의 수를 측정 합니다. 예를 들어 Alexa488의 경우 단백질, nA488, 당 Alexa488 분자의 수 산출 될 수 있다 다음 관계를 사용 하 여:
n A488 = (A494/εA488) / ((A280 -0.11는494) / ε제자)
A494 와 A280 있는 494에 단위 길이 당 흡 광도 값 nm 및 280 nm, 각각, 그리고 εA488와 ε제자 Alexa488의 분자 흡수 계수 및 단백질, 각각. - 우두머리에 단백질의 표면 밀도 계산 φ제자, 우두머리, 다음 수식에 따라:
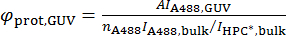
단백질의 중 합 상태를 명심에서 하십시오. 예를 들어 단백질 바 dimerize, 따라서 계산 된 밀도 될 영역 당 바 단위체 단위체 폼의 소멸 계수를 사용 하는 경우.

그림 3: 단백질 표면 밀도 교정의 예. 측정은 HPC * 지질 형광 강도 대량 (왼쪽)와 GUVs (센터)입니다. 또한, Alexa488 (바 도메인에 바인딩된)의 대량 형광 강도 측정 (오른쪽). 형광 강도 농도와 선형으로 확장 됩니다. 측정 표시 특정 탐지 이득에 대 한 고 출력 레이저. 생성 된 참조37에서 데이터를 플롯 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
결과
튜브를 당기 실험 멤브레인에 대 한 중요 한 기계적인 정보를 줄 수 있습니다. 단백질 또는 다른 분자를 막 곡률, 막와 커플 하 고 튜브 반경 막 긴장 Canham Helfrich 해밀턴을 적용 하 여 관련 될 수 없을 경우에는 튜브를 방정식 우두머리50,51에서 가져온
토론
하지만, 막의 기본적인 기계적 특성 측정을 의미 하지만 단백질 및 막 간의 결합에 빛을 발산 하는 데 도움이 막 단백질 시스템에 풍부한 정보를 제공 하는 GUVs에서 튜브를 당기기의 방법 곡률입니다. 소개에서 설명 했 듯이, 다른 기술을 서브 미크론 리19 세 표면18,곁에와 단백질을 배양 하거나 관찰 하 여 막 커브 단백질의 효과 측정 하기 위해 존재 합?...
공개
저자는 공개 없다.
감사의 말
저자 감사 Benoit Sorre, Damien Cuvelier, 피에르 Nassoy, 프랑수아 Quemeneur, 및 그들의 필수 기여에 대 한 길 Toombes 그룹에서 나노튜브 메서드를 설정 합니다. 샌드위치 그룹 속하는 CNRS 컨소시엄 CellTiss, Labex CelTisPhyBio (ANR-11-LABX0038), 그리고 파리 과학 외 Lettres (ANR-10-IDEX-0001-02). F. C. Tsai EMBO 장기 친교 (ALTF 1527-2014)과 마리 퀴리 행동 (H2020-MSCA-IF-2014, 프로젝트 막 ezrin 말라)에 의해 투자 되었다. 석사 시 몬스 사회 휄 로우의 주니어 연구원 이다.
자료
| Name | Company | Catalog Number | Comments |
| 1,2-Dioleoyl-sn-glycero-3-phosphatidylcholine (DOPC) | Avanti | 850375 | Example lipid used in data for Figure 3 |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000] [DSPE-PEG(2000)-biotin] | Avanti | 880129 | biotinylated lipid |
| BODIPY-TR-C5-ceramide | Molecular Probes (ThermoFisher) | D7540 | fluorescent lipid |
| BODIPY- FLC5-hexadecanoyl phosphatidylcholine (HPC*) | Molecular Probes (ThermoFisher) | fluorescent lipid for protein density calibration | |
| egg L-α-phosphatidylcholine (eggPC) | Avanti | 840051 | used for calibrating the tube radius constant |
| β-casein from bovine milk (>99%) | Sigma Aldrich | C6905 | used for passivating the micropipette and the experimental chamber |
| Sucrose | Sigma Aldrich | S7903 | |
| D(+) glucose | Sigma Aldrich | G7021 | |
| NaCl | Sigma Aldrich | S7653 | |
| Tris | Sigma Aldrich | 10708976001 | |
| osmometer | Loser | n/a | |
| Pt-wires, 0.5 mm diameter, 99.99% pure | Goodfellow USA | PT005139 | used for GUV electroformation |
| function generator | n/a | used to create current for GUV electroformation | |
| putty sealant | Vitrex (from CML France) | CRIT 140013 | used to seal the electroformation chamber |
| bath sonicator | n/a | useful to clean the electroformation chamber, but not crucial | |
| Nikon TE2000 inverted microscope, eC1 confocal system (Nikon), with two laser lines (λ = 488 nm and 543 nm); optical tweezers induced by a 5 W ytterbium fiber continuous wave laser (λ > 1070 nm; IPG GmBH Germany) | an example of a confocal microscopy system equipped with optical tweezers | ||
| micromanipulators | n/a | ||
| borosilicate capillaries (with internal and external radii of 0.78 mm and 1 mm, respectively) | Harvard apparatus | 30-0036 | |
| micropipette puller | Sutter Instrument | P-2100 | |
| microforge | Narishige | MF-800 | |
| piezoelectric actuator | Physik Instrumente | n/a | |
| polystyrene streptavidin coated beads (diameter 3.2 µm) | Spherotech | SVP-30-5 |
참고문헌
- McMahon, H. T., Gallop, J. L. Membrane curvature and mechanisms of dynamic cell membrane remodelling. Nature. 438 (7068), 590-596 (2005).
- Johannes, L., Wunder, C., Bassereau, P. Bending "on the rocks"--a cocktail of biophysical modules to build endocytic pathways. Cold Spring Harb Perspect Biol. 6 (1), (2014).
- Dawson, J. C., Legg, J. A., Machesky, L. M. Bar domain proteins: a role in tubulation, scission and actin assembly in clathrin-mediated endocytosis. Trends Cell Biol. 16 (10), 493-498 (2006).
- Mim, C., Unger, V. M. Membrane curvature and its generation by BAR proteins. Trends Biochem Sci. 37 (12), 526-533 (2012).
- Qualmann, B., Koch, D., Kessels, M. M. Let's go bananas: revisiting the endocytic BAR code. EMBO J. 30 (17), 3501-3515 (2011).
- Rao, Y., Haucke, V. Membrane shaping by the Bin/amphiphysin/Rvs (BAR) domain protein superfamily. Cell Mol Life Sci. 68 (24), 3983-3993 (2011).
- Simunovic, M., Voth, G. A., Callan-Jones, A., Bassereau, P. When Physics Takes Over: BAR Proteins and Membrane Curvature. Trends Cell Biol. 25 (12), 780-792 (2015).
- Safari, F., Suetsugu, S. The BAR Domain Superfamily Proteins from Subcellular Structures to Human Diseases. Membranes (Basel). 2 (1), 91-117 (2012).
- Angelova, M. I., Soléau, S., Méléard, P., Faucon, F., Bothorel, P., Helm, C., Lösche, M., Möhwald, H. . Progress in Colloid and Polymer Science Vol. 89: Trends in Colloid and Interface Science VI. 89, 127-131 (1992).
- Meleard, P., Bagatolli, L. A., Pott, T. Giant unilamellar vesicle electroformation from lipid mixtures to native membranes under physiological conditions. Methods Enzymol. 465, 161-176 (2009).
- Montes, L. R., Alonso, A., Goni, F. M., Bagatolli, L. A. Giant unilamellar vesicles electroformed from native membranes and organic lipid mixtures under physiological conditions. Biophys J. 93 (10), 3548-3554 (2007).
- Mathivet, L., Cribier, S., Devaux, P. F. Shape change and physical properties of giant phospholipid vesicles prepared in the presence of an AC electric field. Biophys J. 70 (3), 1112-1121 (1996).
- Collins, M. D., Gordon, S. E. Giant liposome preparation for imaging and patch-clamp electrophysiology. J Vis Exp. (76), (2013).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. Reconstitution of a transmembrane protein, the voltage-gated ion channel, KvAP, into giant unilamellar vesicles for microscopy and patch clamp studies. J Vis Exp. (95), e52281 (2015).
- Hochmuth, R. M., Evans, E. A. Extensional flow of erythrocyte membrane from cell body to elastic tether. I. Analysis. Biophys J. 39 (1), 71-81 (1982).
- Hochmuth, R. M., Wiles, H. C., Evans, E. A., McCown, J. T. Extensional flow of erythrocyte membrane from cell body to elastic tether. II. Experiment. Biophys J. 39 (1), 83-89 (1982).
- Bassereau, P., Sorre, B., Levy, A. Bending lipid membranes: experiments after W. Helfrich's model. Adv Colloid Interface Sci. 208, 47-57 (2014).
- Hatzakis, N. S., et al. How curved membranes recruit amphipathic helices and protein anchoring motifs. Nature chemical biology. 5 (11), 835-841 (2009).
- Bhatia, V. K., et al. Amphipathic motifs in BAR domains are essential for membrane curvature sensing. EMBO J. 28 (21), 3303-3314 (2009).
- Shi, Z., Baumgart, T. Membrane tension and peripheral protein density mediate membrane shape transitions. Nat Commun. 6, 5974 (2015).
- Chen, Z., Shi, Z., Baumgart, T. Regulation of membrane-shape transitions induced by I-BAR domains. Biophys J. 109 (2), 298-307 (2015).
- Cuvelier, D., Derenyi, I., Bassereau, P., Nassoy, P. Coalescence of membrane tethers: experiments, theory, and applications. Biophys J. 88 (4), 2714-2726 (2005).
- Derenyi, I., Julicher, F., Prost, J. Formation and interaction of membrane tubes. Phys Rev Lett. 88 (23), 238101 (2002).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Adv Colloid Interface Sci. 208, 225-234 (2014).
- Sorre, B., et al. Nature of curvature coupling of amphiphysin with membranes depends on its bound density. Proc Natl Acad Sci U S A. 109 (1), 173-178 (2012).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Phys Rev Lett. 64 (17), 2094-2097 (1990).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5 (6), 491-505 (2008).
- Capraro, B. R., Yoon, Y., Cho, W., Baumgart, T. Curvature sensing by the epsin N-terminal homology domain measured on cylindrical lipid membrane tethers. J Am Chem Soc. 132 (4), 1200-1201 (2010).
- Bo, L., Waugh, R. E. Determination of bilayer membrane bending stiffness by tether formation from giant, thin-walled vesicles. Biophys J. 55 (3), 509-517 (1989).
- Rossier, O., et al. Giant Vesicles under Flows: Extrusion and Retraction of Tubes. Langmuir. 19 (3), 575-584 (2003).
- Borghi, N., Rossier, O., Brochard-Wyart, F. Hydrodynamic extrusion of tubes from giant vesicles. EPL (Europhysics Letters). 64 (6), 837 (2003).
- Zhu, C., Das, S. L., Baumgart, T. Nonlinear sorting, curvature generation, and crowding of endophilin N-BAR on tubular membranes. Biophys J. 102 (8), 1837-1845 (2012).
- Ramesh, P., et al. FBAR syndapin 1 recognizes and stabilizes highly curved tubular membranes in a concentration dependent manner. Sci Rep. 3, 1565 (2013).
- Knorr, R. L., et al. Membrane morphology is actively transformed by covalent binding of the protein Atg8 to PE-lipids. PLoS One. 9 (12), e115357 (2014).
- Aimon, S., et al. Membrane shape modulates transmembrane protein distribution. Dev Cell. 28 (2), 212-218 (2014).
- Prévost, C., et al. IRSp53 senses negative membrane curvature and phase separates along membrane tubules. Nat Commun. , (2015).
- Simunovic, M., et al. How curvature-generating proteins build scaffolds on membrane nanotubes. Proc Natl Acad Sci U S A. 113 (40), 11226-11231 (2016).
- Allain, J. M., Storm, C., Roux, A., Ben Amar, M., Joanny, J. F. Fission of a multiphase membrane tube. Phys Rev Lett. 93 (15), 158104 (2004).
- Morlot, S., et al. Membrane shape at the edge of the dynamin helix sets location and duration of the fission reaction. Cell. 151 (3), 619-629 (2012).
- Renard, H. F., et al. Endophilin-A2 functions in membrane scission in clathrin-independent endocytosis. Nature. 517 (7535), 493-496 (2015).
- Simunovic, M., et al. Friction Mediates Scission of Tubular Membranes Scaffolded by BAR Proteins. Cell. 170 (1), 172-184 (2017).
- Simunovic, M., Lee, K. Y., Bassereau, P. Celebrating Soft Matter's 10th anniversary: screening of the calcium-induced spontaneous curvature of lipid membranes. Soft Matter. 11 (25), 5030-5036 (2015).
- Sorre, B., et al. Curvature-driven lipid sorting needs proximity to a demixing point and is aided by proteins. Proc Natl Acad Sci U S A. 106 (14), 5622-5626 (2009).
- Heinrich, M., Tian, A., Esposito, C., Baumgart, T. Dynamic sorting of lipids and proteins in membrane tubes with a moving phase boundary. Proc Natl Acad Sci U S A. 107 (16), 7208-7213 (2010).
- Dasgupta, R., Dimova, R. Inward and outward membrane tubes pulled from giant vesicles. Journal of Physics D: Applied Physics. 47 (28), 282001 (2014).
- Vitkova, V., Genova, J., Mitov, M. D., Bivas, I. Sugars in the aqueous phase change the mechanical properties of lipid mono- and bilayers. Molecular Crystals and Liquid Crystals. 449, 95-106 (2006).
- Bouvrais, H. . Mechanical properties of giant vesicle membranes investigated by flickering technique. , (2011).
- Koster, G., Cacciuto, A., Derenyi, I., Frenkel, D., Dogterom, M. Force barriers for membrane tube formation. Phys Rev Lett. 94 (6), 068101 (2005).
- Kwok, R., Evans, E. Thermoelasticity of large lecithin bilayer vesicles. Biophys J. 35 (3), 637-652 (1981).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 28 (11), 693-703 (1973).
- Canham, P. B. The minimum energy of bending as a possible explanation of the biconcave shape of the human red blood cell. J Theor Biol. 26 (1), 61-81 (1970).
- Marcerou, J. P., Prost, J., Gruler, H. Elastic Model of Protein-Protein Interaction. Nuovo Cimento Della Societa Italiana Di Fisica D-Condensed Matter Atomic Molecular and Chemical Physics Fluids Plasmas Biophysics. 3 (1), 204-210 (1984).
- Leibler, S. Curvature Instability in Membranes. J Phys-Paris. 47 (3), 507-516 (1986).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유