このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
巨大リポソームの膜カーボンナノ チューブを引っ張ってください。
* これらの著者は同等に貢献しました
要約
多くのタンパク質の細胞感覚し、膜の曲率を誘発します。湾曲した膜体外タンパク質または任意曲率活性分子の相互作用を研究する脂質小胞から膜ナノチューブをプルする方法について述べる。
要約
細胞膜の再編は、エンドサイトーシス、人身売買、糸状等の形成など多くの細胞現象の不可欠な部分です。多くの異なった蛋白質に関連付ける曲面膜感覚または膜の曲率を誘発する能力のため。通常、これらのプロセスは複雑すぎるために、細胞の定量的研究し蛋白質の多数を含みます。エンドサイトーシスの首などの曲線の細胞構造を模倣した、曲線状の膜の in vitro再構成するプロトコルについて述べる。巨大リポソーム (GUV) 小嚢は、ピペット吸引がその内部圧力と表面張力を制御、細胞膜のモデルとして使用されます。光ピンセットによる旦那のポイント引き力を適用するには、平膜に接続されている高曲率のカーボンナノ チューブが作成されます。このメソッドは、曲げ剛性などの脂質膜の基本的な機械的性質を測定する伝統的に使用されています。近年、タンパク質が膜の湾曲や形状および膜の力学に影響する方法と対話する方法の研究に展開されています。マイクロマニピュレーション、マイクロインジェクション、光ピンセットと共焦点顕微鏡を組み合わせたシステムは、膜の曲率、膜張力および蛋白質の表面密度の測定を同時にできます。これらの測定からタンパク質膜システムの多くの重要な機械的および形態学のプロパティを推測できます。さらに、我々 は生理的塩濃度および分類された蛋白質と脂質の蛍光強度から膜タンパク質の表面密度を定量化する手法の存在下で膜を作成するプロトコルをレイアウトします。
概要
エンドサイトーシス、人身売買、糸状、感染症などの形成など多くの細胞プロセスは細胞膜1,2という形で劇的な変化を伴っています。セルで、いくつかの蛋白質は膜にバインドし、その形状を変更するこれらのプロセスに参加します。最も顕著な例は、本質的にドメイン3,4,5,6,7バー曲線特性を含む箱/アンフィフィシン/Rv (バー) 蛋白質家族のメンバーです。通常、彼らは表面と、多くの場合、両親媒性ヘリックスを 2 層も浅く挿入バー ドメインを付着する膜と対話します。形状、サイズ、および両親媒性ヘリックスの数と共に BAR ドメインの料金を決定します: (1) 膜の湾曲の方向 (すなわち、かどうか彼らは陥入や突起を誘発するが)、(2) 膜の大きさ曲率5,8。注記のうち、ここで正の曲率は曲線状の膜、すなわち、相互作用する粒子と負の膨らみのそれ以外の凸側として定義されます。さらに、蛋白質バーの定量的研究は、膜への影響は物理的なパラメーターのセットによって異なりますを明らかにした: 表面蛋白質、膜張力膜形状 (フラット対鋼管対球の密度図形)7。タンパク質バーこれらのパラメーターに応じてすることができます: (1) 膜の曲率のセンサーとしての機能、(2) 膜を曲げたり、(3) 膜切断7を誘発します。
膜再編のセルで、エンドサイトーシスなどの現象の定量的側面を勉強に関連するコンポーネントの数により生体内では非常に挑戦的です。セルに湾曲した膜を模倣した最小限のコンポーネントのin vitro再構成は、どのように膜カービング タンパク質の動作機構の理解を得るための手段を提供します。この記事では、膜カーボンナノ チューブ体外顕微操作、共焦点顕微鏡、光ピンセットを使用して再構成するプロトコルについて説明します。アプローチは、タンパク質、脂質、または小さい分子が湾曲した膜と対話する方法を定量的な方法で勉強する使用できます。脂質膜は、曲率が無視できる膜カービング結合分子のサイズと比較して、細胞膜のモデルとして使用されます。彼らは、脂質膜の水和と交流電流 (AC)10の下でそれを膨潤膜に小胞を形成する electroformation メソッド9を使用して準備されます。最も一般的な基質 Guv が栽培されているインジウムの錫の酸化物 (ITO) のいずれか半導べ電性皮膜や白金線 (Pt 線)11。この作品は、このメソッドは、バッファー12に塩の存在下で膜を作るの代替よりもはるかに良い動作するように示されている、Guv、Pt ワイヤ上育ちます。Electroformation プロトコルここでそれを再現するのに十分な詳細に説明しています、我々 は詳細13,14に、膜を作るのと同様、他の方法を記載されている以前の記事へ読者を参照します。私たちの手で Pt ワイヤ上 electroformation 正常にもたらした膜合成脂質のミックスや天然脂質から 〜 100 mM の NaCl を含むバッファーで抽出。さらに、成長過程における膜内タンパク質をカプセル化することが可能だったも。図 1 a; での例が electroformation 商工会議所を表示します。両側からす coverslips に封印できるポリテトラフルオロ エチレン (PTFE) から作られたホルダーに挿入 2 ~ 10 cm ロング Pt ワイヤーが装備されている 1 〜 2 cm 離れて (図 1 a)。

図 1: 実験的セットアップします。白金線に接続された電気コネクタの旦那 electroformation (A) 室。(B) 左: 顕微鏡を示す実験的システム、上記の目的は、2 つのマイクロ ピペット (左と右) 実験室マニピュレーターに取り付け、チューブを引っ張るとタンパク質の実験室に挿入インジェクション。右: 実験室のクローズ アップ ビューを吸引し挿入注入マイクロ ピペットの先端を示す目的上マウント。(C) A の注射器そのバックエンドでマイクロ ピペットに挿入される細いディスペンサーを装備しました。下部は、青の点線のアウトライン、ピペットでマイクロ ピペット内ディスペンサーのクローズ アップ ビューです。このシステムは、カゼイン ガラス表面にまた必要なとき鉱物油で塗りつぶしをバックアップすると、マイクロ ピペットを埋めるためです。(D) A システム μ L タンパク質溶液の量を吸引するために使用します。針は、注射器と注入マイクロ ピペットに接続されているチューブに接続されているです。マイクロ ピペット チップは慎重にタンパク質溶液に浸漬、マイクロ ピペットのチップを記入するので吸気します。マイクロ ピペットがパネル c. に示すシステムを使用して鉱物油で再び埋められますこの図の拡大版を表示するのにはここをクリックしてください。
7 からの半径に至るまで膜ナノチューブ nm ~ 数百 nm は、外部の力が、旦那から引っ張ることができます。このメソッドの細胞膜と小胞、曲げ剛性15,16などの弾性的性質を測定するために設計されました。最も最近の作品の方法は microinjecting プル カーボンナノ チューブ7,17近く蛋白質による曲面膜とタンパク質の相互作用を研究に拡張されました。他の方法は蛋白質の膜カービングを勉強するために開発されています。1 つの方法で蛋白質は不動態化された表面につながれた異なるサイズのリポソームと孵化させます。共焦点の顕微鏡を使用して、曲率による並べ替え18,19を示すことができます, リポソーム径の関数として蛋白質の結合を測定します。別の方法で蛋白質は尿細管20,21を自発的に誘発する能力を測定するマイクロ吸気 GUV 近く注入されます。このプロトコルで説明する方法は、エンドサイトーシスに関与する膜カービング蛋白質を研究に適してほとんどの蛋白質が通常の貨物を含む細胞膜の陥入を接続する前もって形成された膜ナノチューブに遭遇、平膜を基になります。さらに、このメソッドとは異なり、つなぎ縄でつながれた小さなリポソームを用いる試金で膜カーボンナノ チューブは継続的に接続されて膜;したがって、それは GUV、状況が予想される生体内力学的平衡です。したがって、基本的な膜の物理が適用され、我々 は我々 の測定22,23,24から機械的性質の茄多を推測できます。
このメソッドの完全な実装、必要な機器は、共焦点顕微鏡、光ピンセット、水タンク (図 1 b) に接続されている 1 つまたは 2 つのマイクロ ピペットに含まれます。すべての 3 つを組み合わせて、同時に力25をチューブの膜、膜の曲率、蛋白質の表面密度を測定し不可能です。マイクロ ピペット吸引は不可欠ですし、静水圧による吸引圧26を制御する水タンクに接続されているホルダーにガラス ピペットを挿入することによって簡単に構築します。マイクロ ピペットとホルダーは高精度動きの圧電アクチュエータを用いたマイクロマニピュレーターと、理想的には、一方向に制御されます。カーボンナノ チューブ、旦那は微小ビーズを引いて離れて、カーボンナノ チューブの作成にこだわった簡単に microaspirated を引く。この実装では、ビーズが27公開されたプロトコルに従うことによって構築することができます光ピンセットを用いて行われます。正確な力の測定を犠牲にして、光ピンセットとプル カーボンナノ チューブのさまざまな方法で調剤することが可能です。光トラップを構築するも困難な場合、または力の測定は必須ではありませんなど単に湾曲した膜蛋白質の好みをチェックしたい場合、2 番目のマイクロ ピペット28の先端に吸引ビーズを使用してチューブを引っ張ることが。また、重力29を使用してチューブを引くか、30,31をフローすることが可能です。さらに、共焦点顕微鏡必須ではありません。しかし、それは蛋白質の表面密度を測定するので勧めします。また、脂質膜力と緊張とは関係なくこうして、管内の蛍光強度からカーボンナノ チューブの半径を測定できます。蛍光から推論のチューブの半径は膜付着蛋白質25の存在のため確立された方程式から逸脱するこれらの量の間の関係は特に重要です。重要なは、1 つは管の曲率を測定するそれはできない、光学トラップと共焦点顕微鏡のはやれない。
このプロトコルで説明するメソッドは、様々 な末梢膜タンパク質ナノチューブ バー家族25,32,33,34 からの大抵それらの曲率による並べ替えを研究に使用されています.また KvAP に濃縮されて円錐形の貫通型カリウム チャネルは、タンパク質35バーとしてカーボンナノ チューブを同じ方法で湾曲したが示されました。膜内タンパク質をカプセル化する方法を最適化することによって負の曲率とタンパク質の相互作用は、最近よく36として研究されています。タンパク質足場25,37の形成を明らかにし、どちらかライン テンション38, タンパク質ダイナミン39、またはバーの膜切断機構の研究にさらに、このメソッドが使用されていますタンパク質40,41。蛋白質に加えて小さな分子やイオンで曲率も誘導できます。このメソッドを使用すると、カルシウム イオンは塩無料条件42の下で正の曲率を誘導するために示されていた。興味深いことに、脂質が demixing ポイント43,44近くにある組成のだけが並べ替え、曲率を受けることができることはまた示します。合計では、メソッドは、方法のいずれかの積分膜成分 (例えば脂質や膜貫通タンパク質) の調査に興味を持って研究によって使用することができますまたは末梢分子をバインド (または内部または外膜) の対話開放円筒曲面膜、機械的かつ定量的視点から。それはまた22,23,45膜自体の機械的性質の測定に興味のある方のものは。
プロトコル
1 Pt 線の Electroformation によって膜の作製
- Electroformation の洗浄 (導入および図 1A参照) と Pt-ワイヤ エタノールや脂質を洗い流すためアセトンなどの有機溶剤と水で塩を洗い流す。
注: 私達は徹底的にエタノールに浸したティッシュでふき取り、アセトン、エタノール、水、5 分ごとで sonicating を提案します。 - 1 mg/mL のクロロホルムで必要な脂質の脂質ミックスを準備します。ミックスが含まれてする必要があります 〜 ビオチンと結合して脂質のモル分率を 0.05% (例えば1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000]) と 〜 0.5%、脂質のモル分率は、fluorophore (共役例えば、BODIPY TR-C5 セラミド)。
注: 我々 の経験では難しかった 30% 以上を含む高収率で膜を生成する脂質を充電します。
注意: クロロホルムは、適切な手袋を着用化学フード内部処理必要があります。 - Electroformation 室に Pt ワイヤのペアを挿入します。滴で区切られた白金線に脂質ミックスを預金 〜 2 〜 3 mm (合計 〜 ミックスの 4 μ L)。
- 室温で 30-60 分のための真空の下でワイヤーを乾燥させます。
- シリコン グリスを使用して室の上、coverslip の付着によって容器の底をシールします。塩化ナトリウム, ショ糖および緩衝剤 (例えば70 mM の NaCl 100 mM ショ糖、10 mM トリス、ph 7.4) を含むバッファー溶液で商工会議所を埋めます。実験では、膜内部この媒体になります。実験媒体内の浸透圧をこの培地の浸透圧に一致不可欠だ ~ 10%。ショ糖を使って浸透圧を調整します。目標は、膜中にカプセル化する場合必要な濃度でソリューションにタンパク質を追加します。
注意: さまざまな塩およびバッファー内糖膜24,42,46,47の自発曲率と曲げ剛性に影響します。 - チャンバー内の最低気温を確保するシリコン グリスと観察を付着によって商工会議所の上部をシールします。500 Hz と 280 Pt ワイヤを介して正弦 AC 電流 mV。
注: 成長時間と温度は、脂質とタンパク質の感度に応じて最適化されなければなりません。自然な脂質抽出物を使用する場合、また一晩 4 ° C で膜を成長することにより最高の収量を得た膜蛋白質をカプセル化するとき。合成脂質組成、室温で成長、蛋白質の不在で 〜 2 h で十分でした。
2. 実験室と、マイクロ ピペットの準備
- マイクロ ピペットを準備、ピペットの引き手を使用してガラス管を引っ張ってくる。それぞれ、0.7 mm と 1 mm の内部および外部の半径でガラスキャピ ラリーを使用する勧めします。その後、マイクロ ピペットの先端を絞り込む、その内径が 5-、マイクロフォージを使用しての 7 μ m。タンパク質や他の分子は実験で注入される、別のマイクロ ピペットを取り出して、8-15 μ m の内径に、その先端を絞り込みます。
- 図 1に示すように、金属のベースに 2 つの長方形の顕微鏡 coverslips を置くことによって実験室を構築します。区切ってください、coverslips 〜 1 mm。商工会議所 (図 1参照) 長い端に沿って開口部が必要です。オープン サイドは、先端べきである少なくとも到達する商工会議所の中心、ピペットの先端に合うべきであります。
- その浸透圧が膜の成長に使用されるバッファーから 10% 以上によって違いはありません実験的バッファーを準備します。グルコースと浸透圧を調整します。エンドフィリン カーボンナノ チューブとの相互作用の研究に使用された実験的バッファーの例は 100 mM NaCl、40 mM グルコース、pH 7.4 に tris バッファーです。中のスクロースの組み合わせにより、外のグルコース/: 明視野顕微鏡とチャンバーの底に解決する原因となる、膜の内側 (b) 高密度膜を観察する (a) 十分な位相コントラスト。実験的要件に基づいて塩の濃度を調整します。
注: 我々 の経験で、膜の機械的性質に及ぼすに加えて高グルコース濃度 (> 300 mM) 悪影響を与えますナノチューブをプルするために必要なストレプトアビジン-ビオチン結合の確立。さらも少し塩ストレプトアビジン-ビオチン結合を阻害する、タンパク質膜相互作用中の高すぎる濃度の画面します。外部バッファーに非常に高い塩濃度を使用して蛋白質のカプセル化の場合 (例えば、> 200 mM の NaCl) 外側リーフレット36から蛋白質をデタッチするトリックとして使用できます。興味の分子の最適な結合条件を見つけるための塩分濃度の範囲で実験する必要があります。 -
実験のための膜を収集する前に 30-60 分、非常に純粋な β-カゼインの (例えば、実験的バッファーに溶解) 5 mg/mL の溶液での実験室および吸引ピペットを記入させるガラス表面パッシベーションを行います。Β-カゼインは、それらバーストを原因となる余りに強く、付着する膜を防止するガラス表面に保護層を作成します。30-60 分の β-カゼインを孵化させなさい。
注: 必要がありますない膜の張力を制御することを妨げるマイクロ ピペット内部の泡。- 充填用マイクロ ピペットのディスペンサーを構築、プラスチックのコネクタの近くに注射針を解除し、それに接着剤の薄い石英キャピラリー (液体クロマトグラフィー用など) (図 1)。
- Β-カゼインと、インキュベーション中に顕微鏡に商工会議所をマウントし、目的上センターします。長辺に沿って開口部を通して吸引ピペットの先端を挿入し、対物レンズの上のヒントをもたらします。吸引圧が 0 (必要があります重い流れまたはピペット、顕微鏡下で見ることができるから) に近いので水タンクのレベルを調整します。
-
場合にタンパク質や他の分子は実験中に注入される、好みの濃度で実験的バッファーに溶解目的分子をインジェクション ピペット塗りつぶしマウント マイクロマニピュレーター、内部マイクロ ピペットと実験室の反対側から挿入します。
- 蛋白質の最小量を使用するには、吸引により蛋白質とマイクロ ピペット チップのみを記入します。ためには、プラスチック製のチューブと注射器の針の端をラップします。インジェクション ピペットの背中にチューブを挿入します。
- 非常に慎重にタンパク質溶液をマイクロ ピペットの先端を浸すし、ピペットの先端を埋めるためそれを吸引します。
注: この単純な設定が表示されます図 1と、我々 の経験でタンパク質溶液のわずか数 μ L から吸引できます。 - バックフィル (図 1のセットアップを使用) の水タンクから水とタンパク質溶液の混合を防ぐために鉱物油とインジェクション ピペットの残りの部分。
- それは不安定な射出圧力を誘発する、インジェクション ピペットに気泡を導入すること注意してください。また、蛋白質の量が十分な場合、記入、ピペット蛋白質と β-カゼインの充填と同じ方法ステップ 2.4 で説明されているよう。インジェクション ピペットで吸引圧を最小限に抑えるため水タンクのレベルを調整します。
注: 挿入された分子ナノチューブの近くのイオンの濃度は希釈により減少するつもりとピペット出口42からの距離の関数としての蛍光強度の減少を測定することにより推定することができます。(セクション 4 を参照) 正確に測定することができます挿入された分子の膜結合密度を知っているしかしより重要です。
- Β-カゼインの孵化後、チャンバーからソリューションを削除して数回実験的バッファーですすいでください。実験的バッファーに入力します。
- 膜の electroformation を停止し、Pt 線から直接それらを収集します。実験室に数 μ L の GUV ソリューションを追加します。作りたての膜だけを使用します。
- ストレプトアビジン コーティング ビーズの数 μ L を最終濃度 0.1 x 10−3% (w/v) またはより少しのまわりで商工会議所にビーズを実験室に追加します。ポリスチレン ビーズ 〜 3 μ m をお勧めします (水のポリスチレン ビーズは、光学トラップの散乱力に関して勾配力の最大化に関して最適に近い屈折コントラストを持っている)。ビーズ濃度は実験に基づいて調整することができます: チャンバーでそれらを見つけることが困難な非常に低濃度と高濃度は光ピンセットに陥る多重ビードのリスクを実行します。
3、旦那から膜カーボンナノ チューブを引っ張ってください。
- Guv とビーズがチャンバーの底に沈殿します。少しさせることによって、膜を収縮させる実験的バッファーの蒸発の約 〜 15 分、膜をしぼませるマイクロ ピペットで吸引することができますいくつかの余分な領域を生成することが欠かせません。膜が目に見えてうねる (すなわち、フロッピー表示) 光学顕微鏡の下で。緊張を表示されている場合より多くの蒸発時間。
注: 浸透圧変化率蒸発表面積、温度等に依存し、密接に監視する必要があります。原則として、浸透圧差は、ショ糖・ ブドウ糖の濃度を調整することによってスタートから設定でした、ただし、注意が必要ない高浸透圧刺激を誘発します。 - フロッピーの旦那は、ピペットに吸引します。吸引舌 (ピペット内膜の部分) の長さが該当する15,16,22,23 (理論解析のピペット半径以上にする必要があります。図 2)。いくつかの膜をみてください。Guv のどれもは、十分な長さの舌を生成するしないすることができる場合、いくつかのより多くの分を待ちます。膜が十分にフロッピーの場合は、次の手順に進みます。
- さらにバッファーの蒸発を防ぐために、鉱物油とチャンバーをシールします。実験室のオープン エッジに沿ってオイルを丁寧にピペッティングして行うこと。
- 吸引圧のゼロの位置を設定するのにはまず、商工会議所でのビードを探します、ビード近く吸引ピペットの出口の位置します。ビーズは吸い込まも吸引ピペットによって吹き飛ばさよう水タンクの高さを調整します。鉱物油は蒸発とチャンバー内したがってさらに圧力の変化を防止がそれぞれの旦那を計測する前に吸引圧をゼロします。
- 旦那を見つけるし、それを吸引します。マイクロ ピペットを移動 (どこそれが引き抜くピペットせん断応力による商工会議所が移動すると表面から旦那を保つ) に焦点が合っていません。
- チャンバー周りを慎重に移動してビーズを探します。突然移動は、旦那を取り出すことができます。距離で光ピンセット トラップ 〜 チャンバー底部から 20 μ m。関心領域がない他のビーズまたは視力の膜でクリーンであることを確認します。ビーズ以外の光学ピンセットで落ちて何も測定が中断されます。
- 旦那戻って焦点を当てとビーズから離れてをもたらすマイクロ ピペットの光トラップ (図 2) に揃えて配置されます。
- (力計測に必要な) 平衡位置を測定する 1-2 分のビーズの動きを記録します。
- 膜張力を減らすように旦那を失うことがなく、可能な限りマイクロ ピペット内の圧力を減らします。ストレプトアビジン-ビオチン結合を確立する、第 2 のまわりのビーズと接触して旦那を慎重に持参し、軽く引いて、カーボンナノ チューブの作成をバックアップします。GUV 近づいたり離れたり、ビーズの動きは、光ピンセットのビードの中断を最小限に圧電アクチュエータを用いた理想的に行ってする必要があります。
注: ナノチューブを形成していない、それができれば貧しいストレプトアビジン コーティング ビーズ、GUV、塩や過剰な実験的バッファーや膜のグルコース濃度の不十分な集中のビオチン標識脂質の量が不足のため旦那の緊張は高すぎる48です。 - 吸引舌を作り直すように吸引圧を増加します。吸引ピペットと最大限に管 (図 2) に焦点を当てるの軸で横にチューブを合わせます。
- GUV 赤道とチューブでは、フォーカスを確認します。数分の明視野顕微鏡とビーズの動きを記録 (ここでは、カメラ取り込み速度は 30 Hz)。H、ゼロの位置に関して水タンクの高さを記録します。システム (図 2) の数の共焦点画像を取る。
- 別の吸引圧、暗黙的に膜緊張で前の手順を繰り返します。典型的な緊張範囲は 0.015-0.2 mN/m、約 0.02 mN/m のステップ サイズ。
- 蛋白質または分子システムの近くに注射すると、は、インジェクション ピペットの光トラップ ビーズが乱されていませんかどうかを確かめて、カーボンナノ チューブの近くをもたらします。そっと周りの圧力で注入 1-2 pa.
-
蛋白質の結合は (旦那に膜一定に注入された蛋白質の蛍光強度) を平衡が後、裸膜 (3.11 と 3.12 のステップ) と段階ごとの測定を繰り返します。
注: ので、一定の圧力で旦那に近いタンパク質を注入しながら測定を実行すると、タンパク質のバルク濃度は横這い GUV; 近くしたがって、タンパク質の脱離は測定中に無視できるはずです。- また、一定した蛋白質バルク濃度を確保するためのチューブを抜く実験を実行する前に一緒に蛋白質の膜をインキュベートすることが可能です。チューブと旦那のタンパク質の相対膜画分を測定すると、そのタンパク質が配信される方法に曲率ソート計算は影響しません (セクション 4 を参照)。
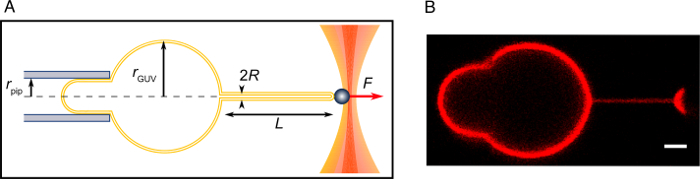
図 2: チューブを抜く実験。(A) 実験の概略図。(B) A はこのプロトコルで記述として引っ張られたチューブのコンフォーカル画像。スケール バー = 2 μ m.この図の拡大版を表示するのにはここをクリックしてください。
4. 測定とデータ解析
- 膜張力を測定
- 一定の吸引圧でステップごとに静水圧を計算します。
ΔP = pgh
ここでpは水の密度、 g重力加速度、 hステップ 3.11 から水タンクの高さ。 - 共焦点画像から旦那、旦那、 rの半径と吸引ピペット、 rpip (図 2) の半径を測定します。
- Σ, ラプラス方程式49を使用して膜張力を計算します。
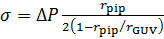
- 一定の吸引圧でステップごとに静水圧を計算します。
- 膜力を測定
- いくつかのキャリブレーション方法27の 1 つを使用して、光ピンセット、 k剛性を決定します。このセットアップで粘性抵抗法27 kを測定します。
- (ステップ 3.8) 管を抜く前に計測値から平均値として0ビーズの平衡位置を計算します。
- 各一定張力の測定では、フックの法則から平衡膜力Fを計算します。
F = k(、 - 0)
場所はビーズの平均的な位置、測定中に。
- 測定チューブの半径
- 裸膜 (no 追加膜カービング分子) の場合はフォースからチューブの半径、 Rを計算します。
R = F/(4πσ)
(22,23を参照)。 - ステップ 4.3.1 独立して膜カービング分子存在下でチューブの半径を測定するには、脂質蛍光管の長さ、浴槽を私と私旦那旦那輪郭に沿って最初に、記録します。チューブまたは GUV 輪郭の明るいラインに沿って平均強度としての蛍光体や膜にバインドの平均蛍光強度を測定します。GUV 輪郭または管の水平方向のセクションを含む長方形のボックスを選択し、ボックスに水平の線の蛍光強度の合計を計算します。
- 水平線 (すなわちボックスの幅) のピクセル数での合計を除算します。選択したボックスにする必要がありますないこと他の膜の存在に注意してください。選択したボックスの長さに沿って蛍光強度分布が得られます。
- バック グラウンド強度を差し引いた、明るいラインから平均ピクセル蛍光強度を取る。チューブの半径直線的チューブ ・として旦那の輪郭に沿って蛍光の比に関連しています。
R = K浴槽私浴槽/私旦那
ここK浴槽は校正係数25です。
注: このメソッドは (1 つの共焦点ボクセル幅内にあるには十分に狭いチューブの場合) 10-80 nm の波長範囲でチューブの半径を測定する使用ことができますと 80 nm、高い範囲でやや大きい不確実性。測定の感度は、セットアップによって異なります。
- 中性脂質を用いた単純な膜構成に関する手順 4.3.1 と 4.3.2 で独立した半径測定を実行することによってK浴槽を決定します。このような単純な膜組成により半径と力に、4.3.1 のステップで与えられた単純な関係。実験を数回繰り返すし、 R、私浴槽対力 (ステップ 4.3.1) から推定されるプロット/私旦那(ステップ 4.3.2)。フィットからK浴槽を計算します。このセットアップでは、 K浴槽で = 200 ± 50 nm を使用して卵 L-α-ホスファチジルコリン (PC-卵) 膜とその蛍光偏光25によって異なります最小蛍光脂質。
注: K浴槽は、彼らの異なる共焦点ボクセルのボリュームにより、異なる目的のため測定する必要があります。脂質蛍光体注入の蛋白質または分子と通信してはいけません。BODIPY TR セラミドをお勧めしますここで、蛍光の脂質は、蛋白質との相互作用はありません。この仮定はバーの前の調査で確認され、関係なく、タンパク質を定める - バー ドメイン25,36,37, 高蛋白質表面報道、チューブの半径を示しているが、旦那の緊張。蛋白質は、脂質蛍光体と対話する場合、様々 な高い表面蛋白で管内の枯渇や蛍光体の濃縮を観察するが。
- 裸膜 (no 追加膜カービング分子) の場合はフォースからチューブの半径、 Rを計算します。
- 蛋白質の表面密度の測定
- 単純な中性脂質 (例えば、卵 PC) (例えば蛋白質のラベルに使用される染料と同じ波長の蛍光脂質の約 5 つの別のモル分率を補完を使用して脂質ミックスを準備します。BODIPY-FLC5-hexadecanoyl-phosphatidylcholine (HPC *)などの Alexa488 というラベルの付いたタンパク質) の範囲:HPC * X = 0.01-1%。準備 Guv 100 mM ショ糖で伊藤の electroformation プレート (以前文書13のステップ 1 に従ってください)。
- 膜を収集し、β-カゼインのパッシベーションされる実験室に転送します。例えば、実験用ソリューションの 100 mM グルコースを使用します。膜を解決するために数分を待ちます。
- Guv の共焦点の蛍光画像を取るし、記録、GUV に沿って平均蛍光強度は、蛍光脂質のモル分率の関数としての輪郭 (ステップ 4.3.2 を参照してください)。各コンポジションの蛍光脂質、φ の面積密度を計算HPC*。脂質面積で 0.7 nm2φ であると仮定するなどのHPC* 1.43 x 10 =6 XHPC *リーフレットあたり。HPC * GUV、私はHPC *、GUV、対φ で蛍光強度をプロットHPC*。フィットは、校正定数、 A、φ によって与えられるHPC* = AIHPC *、旦那。様々 な一般的顕微鏡設定 (図 3の例を参照) に使用されるため記録レーザー パワーと検出器の感度 (すなわち利得)、したがってAのようにAが顕微鏡設定に依存します。
- 範囲で異なる濃度での HPC * 洗剤、例えば、ドデシル硫酸ナトリウム (SDS) に溶解したいくつかのソリューションの準備 〜 10-50 μ M に 1 一括で各ソリューションの蛍光強度を記録し、強度の勾配を計算対濃度 (図 3)。同様の濃度範囲の蛋白質共役、蛍光測定を繰り返します (図 3の Alexa488 の例を参照)。この測定はタンパク質ラベルと私A488、一括脂質ラベルの蛍光強度を関連付ける必要は/私HPC *、一括と彼らは必ずしも同じバルク濃度で同じように発することはできません。
- Fluorophores が付いて、fluorospectrometer を用いたタンパク質分子あたりの数を測定します。など Alexa488 の場合、 nA488、タンパク質あたり Alexa488 分子の数は次の関係を使用して計算することができます。
nA488 = (A494/εA488)/((A280 - 0.11、494)/εprot)
A494とA280が 494 で単位長さあたりの吸光度値を nm と 280 nm, Alexa488 の分子吸光係数 εは488と εprotとタンパク質、それぞれ。 - GUV、上で、蛋白質の表面の密度を計算 φprot GUV、次の式に従って。
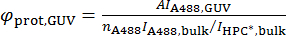
タンパク質の重合状態を覚えてをおいてください。たとえば、タンパク質バー dimerize、したがって計算される密度面積当たりバー モノマーのフォーム単量体の消散係数を使用している場合。

図 3: タンパク質表面密度調整の例です。測定は、HPC * 脂質蛍光強度膜 (センター) およびバルク (左) です。また、Alexa488 (BAR ドメイン行き) の一括蛍光強度は、測定 (右)。蛍光強度は濃度に比例して拡張します。示す測定項目は特定の検出の利益のため、レーザーの出力。参照37からのデータに基づいて生成されたプロットされます。この図の拡大版を表示するのにはここをクリックしてください。
結果
チューブを抜く実験膜に関する重要な力学的情報を与えることができます。旦那50,51 から引き出されたチューブ式のタンパク質や他の分子膜膜曲率を持つカップルを強制的に、Canham Helfrich ハミルトニアンを用いた膜張力チューブの半径を関連付けることができますがない場合
ディスカッション
膜からチューブを抜く方法、膜蛋白質システムに豊富な情報と、膜の基本的な機械的性質を測定するための手段だけではないが、タンパク質や膜間の結合に光を当てること曲率。サブミクロン リポソーム表面パッシベーションされた18,19につながれたと蛋白質をインキュベートするか観察することによって、タンパク質の膜カーブの効果を測定す?...
開示事項
著者が明らかに何もありません。
謝辞
著者は、ブノワ ・ ソール、ダミアン キュヴリエ、ピエール ・ Nassoy、フランソワ Quemeneur、グループでカーボンナノ チューブ法を確立するギル Toombes 彼らの本質的な貢献のためにありがとうございます。脱法属する CNRS コンソーシアム CellTiss、Labex CelTisPhyBio (ANR-11-LABX0038)、およびパリ科学 et レトル (ANR-10-アイデックス-0001-02)。F. C. ツァイ エンボ長期フェローシップ (ALTF 1527-2014 年)、マリー キュリー アクション (H2020 MSCA-場合 2014、プロジェクト膜・ エズリン アクチン) によって資金を供給されました。修士はシモンズの仲間社会短期やつです。
資料
| Name | Company | Catalog Number | Comments |
| 1,2-Dioleoyl-sn-glycero-3-phosphatidylcholine (DOPC) | Avanti | 850375 | Example lipid used in data for Figure 3 |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000] [DSPE-PEG(2000)-biotin] | Avanti | 880129 | biotinylated lipid |
| BODIPY-TR-C5-ceramide | Molecular Probes (ThermoFisher) | D7540 | fluorescent lipid |
| BODIPY- FLC5-hexadecanoyl phosphatidylcholine (HPC*) | Molecular Probes (ThermoFisher) | fluorescent lipid for protein density calibration | |
| egg L-α-phosphatidylcholine (eggPC) | Avanti | 840051 | used for calibrating the tube radius constant |
| β-casein from bovine milk (>99%) | Sigma Aldrich | C6905 | used for passivating the micropipette and the experimental chamber |
| Sucrose | Sigma Aldrich | S7903 | |
| D(+) glucose | Sigma Aldrich | G7021 | |
| NaCl | Sigma Aldrich | S7653 | |
| Tris | Sigma Aldrich | 10708976001 | |
| osmometer | Loser | n/a | |
| Pt-wires, 0.5 mm diameter, 99.99% pure | Goodfellow USA | PT005139 | used for GUV electroformation |
| function generator | n/a | used to create current for GUV electroformation | |
| putty sealant | Vitrex (from CML France) | CRIT 140013 | used to seal the electroformation chamber |
| bath sonicator | n/a | useful to clean the electroformation chamber, but not crucial | |
| Nikon TE2000 inverted microscope, eC1 confocal system (Nikon), with two laser lines (λ = 488 nm and 543 nm); optical tweezers induced by a 5 W ytterbium fiber continuous wave laser (λ > 1070 nm; IPG GmBH Germany) | an example of a confocal microscopy system equipped with optical tweezers | ||
| micromanipulators | n/a | ||
| borosilicate capillaries (with internal and external radii of 0.78 mm and 1 mm, respectively) | Harvard apparatus | 30-0036 | |
| micropipette puller | Sutter Instrument | P-2100 | |
| microforge | Narishige | MF-800 | |
| piezoelectric actuator | Physik Instrumente | n/a | |
| polystyrene streptavidin coated beads (diameter 3.2 µm) | Spherotech | SVP-30-5 |
参考文献
- McMahon, H. T., Gallop, J. L. Membrane curvature and mechanisms of dynamic cell membrane remodelling. Nature. 438 (7068), 590-596 (2005).
- Johannes, L., Wunder, C., Bassereau, P. Bending "on the rocks"--a cocktail of biophysical modules to build endocytic pathways. Cold Spring Harb Perspect Biol. 6 (1), (2014).
- Dawson, J. C., Legg, J. A., Machesky, L. M. Bar domain proteins: a role in tubulation, scission and actin assembly in clathrin-mediated endocytosis. Trends Cell Biol. 16 (10), 493-498 (2006).
- Mim, C., Unger, V. M. Membrane curvature and its generation by BAR proteins. Trends Biochem Sci. 37 (12), 526-533 (2012).
- Qualmann, B., Koch, D., Kessels, M. M. Let's go bananas: revisiting the endocytic BAR code. EMBO J. 30 (17), 3501-3515 (2011).
- Rao, Y., Haucke, V. Membrane shaping by the Bin/amphiphysin/Rvs (BAR) domain protein superfamily. Cell Mol Life Sci. 68 (24), 3983-3993 (2011).
- Simunovic, M., Voth, G. A., Callan-Jones, A., Bassereau, P. When Physics Takes Over: BAR Proteins and Membrane Curvature. Trends Cell Biol. 25 (12), 780-792 (2015).
- Safari, F., Suetsugu, S. The BAR Domain Superfamily Proteins from Subcellular Structures to Human Diseases. Membranes (Basel). 2 (1), 91-117 (2012).
- Angelova, M. I., Soléau, S., Méléard, P., Faucon, F., Bothorel, P., Helm, C., Lösche, M., Möhwald, H. . Progress in Colloid and Polymer Science Vol. 89: Trends in Colloid and Interface Science VI. 89, 127-131 (1992).
- Meleard, P., Bagatolli, L. A., Pott, T. Giant unilamellar vesicle electroformation from lipid mixtures to native membranes under physiological conditions. Methods Enzymol. 465, 161-176 (2009).
- Montes, L. R., Alonso, A., Goni, F. M., Bagatolli, L. A. Giant unilamellar vesicles electroformed from native membranes and organic lipid mixtures under physiological conditions. Biophys J. 93 (10), 3548-3554 (2007).
- Mathivet, L., Cribier, S., Devaux, P. F. Shape change and physical properties of giant phospholipid vesicles prepared in the presence of an AC electric field. Biophys J. 70 (3), 1112-1121 (1996).
- Collins, M. D., Gordon, S. E. Giant liposome preparation for imaging and patch-clamp electrophysiology. J Vis Exp. (76), (2013).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. Reconstitution of a transmembrane protein, the voltage-gated ion channel, KvAP, into giant unilamellar vesicles for microscopy and patch clamp studies. J Vis Exp. (95), e52281 (2015).
- Hochmuth, R. M., Evans, E. A. Extensional flow of erythrocyte membrane from cell body to elastic tether. I. Analysis. Biophys J. 39 (1), 71-81 (1982).
- Hochmuth, R. M., Wiles, H. C., Evans, E. A., McCown, J. T. Extensional flow of erythrocyte membrane from cell body to elastic tether. II. Experiment. Biophys J. 39 (1), 83-89 (1982).
- Bassereau, P., Sorre, B., Levy, A. Bending lipid membranes: experiments after W. Helfrich's model. Adv Colloid Interface Sci. 208, 47-57 (2014).
- Hatzakis, N. S., et al. How curved membranes recruit amphipathic helices and protein anchoring motifs. Nature chemical biology. 5 (11), 835-841 (2009).
- Bhatia, V. K., et al. Amphipathic motifs in BAR domains are essential for membrane curvature sensing. EMBO J. 28 (21), 3303-3314 (2009).
- Shi, Z., Baumgart, T. Membrane tension and peripheral protein density mediate membrane shape transitions. Nat Commun. 6, 5974 (2015).
- Chen, Z., Shi, Z., Baumgart, T. Regulation of membrane-shape transitions induced by I-BAR domains. Biophys J. 109 (2), 298-307 (2015).
- Cuvelier, D., Derenyi, I., Bassereau, P., Nassoy, P. Coalescence of membrane tethers: experiments, theory, and applications. Biophys J. 88 (4), 2714-2726 (2005).
- Derenyi, I., Julicher, F., Prost, J. Formation and interaction of membrane tubes. Phys Rev Lett. 88 (23), 238101 (2002).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Adv Colloid Interface Sci. 208, 225-234 (2014).
- Sorre, B., et al. Nature of curvature coupling of amphiphysin with membranes depends on its bound density. Proc Natl Acad Sci U S A. 109 (1), 173-178 (2012).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Phys Rev Lett. 64 (17), 2094-2097 (1990).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5 (6), 491-505 (2008).
- Capraro, B. R., Yoon, Y., Cho, W., Baumgart, T. Curvature sensing by the epsin N-terminal homology domain measured on cylindrical lipid membrane tethers. J Am Chem Soc. 132 (4), 1200-1201 (2010).
- Bo, L., Waugh, R. E. Determination of bilayer membrane bending stiffness by tether formation from giant, thin-walled vesicles. Biophys J. 55 (3), 509-517 (1989).
- Rossier, O., et al. Giant Vesicles under Flows: Extrusion and Retraction of Tubes. Langmuir. 19 (3), 575-584 (2003).
- Borghi, N., Rossier, O., Brochard-Wyart, F. Hydrodynamic extrusion of tubes from giant vesicles. EPL (Europhysics Letters). 64 (6), 837 (2003).
- Zhu, C., Das, S. L., Baumgart, T. Nonlinear sorting, curvature generation, and crowding of endophilin N-BAR on tubular membranes. Biophys J. 102 (8), 1837-1845 (2012).
- Ramesh, P., et al. FBAR syndapin 1 recognizes and stabilizes highly curved tubular membranes in a concentration dependent manner. Sci Rep. 3, 1565 (2013).
- Knorr, R. L., et al. Membrane morphology is actively transformed by covalent binding of the protein Atg8 to PE-lipids. PLoS One. 9 (12), e115357 (2014).
- Aimon, S., et al. Membrane shape modulates transmembrane protein distribution. Dev Cell. 28 (2), 212-218 (2014).
- Prévost, C., et al. IRSp53 senses negative membrane curvature and phase separates along membrane tubules. Nat Commun. , (2015).
- Simunovic, M., et al. How curvature-generating proteins build scaffolds on membrane nanotubes. Proc Natl Acad Sci U S A. 113 (40), 11226-11231 (2016).
- Allain, J. M., Storm, C., Roux, A., Ben Amar, M., Joanny, J. F. Fission of a multiphase membrane tube. Phys Rev Lett. 93 (15), 158104 (2004).
- Morlot, S., et al. Membrane shape at the edge of the dynamin helix sets location and duration of the fission reaction. Cell. 151 (3), 619-629 (2012).
- Renard, H. F., et al. Endophilin-A2 functions in membrane scission in clathrin-independent endocytosis. Nature. 517 (7535), 493-496 (2015).
- Simunovic, M., et al. Friction Mediates Scission of Tubular Membranes Scaffolded by BAR Proteins. Cell. 170 (1), 172-184 (2017).
- Simunovic, M., Lee, K. Y., Bassereau, P. Celebrating Soft Matter's 10th anniversary: screening of the calcium-induced spontaneous curvature of lipid membranes. Soft Matter. 11 (25), 5030-5036 (2015).
- Sorre, B., et al. Curvature-driven lipid sorting needs proximity to a demixing point and is aided by proteins. Proc Natl Acad Sci U S A. 106 (14), 5622-5626 (2009).
- Heinrich, M., Tian, A., Esposito, C., Baumgart, T. Dynamic sorting of lipids and proteins in membrane tubes with a moving phase boundary. Proc Natl Acad Sci U S A. 107 (16), 7208-7213 (2010).
- Dasgupta, R., Dimova, R. Inward and outward membrane tubes pulled from giant vesicles. Journal of Physics D: Applied Physics. 47 (28), 282001 (2014).
- Vitkova, V., Genova, J., Mitov, M. D., Bivas, I. Sugars in the aqueous phase change the mechanical properties of lipid mono- and bilayers. Molecular Crystals and Liquid Crystals. 449, 95-106 (2006).
- Bouvrais, H. . Mechanical properties of giant vesicle membranes investigated by flickering technique. , (2011).
- Koster, G., Cacciuto, A., Derenyi, I., Frenkel, D., Dogterom, M. Force barriers for membrane tube formation. Phys Rev Lett. 94 (6), 068101 (2005).
- Kwok, R., Evans, E. Thermoelasticity of large lecithin bilayer vesicles. Biophys J. 35 (3), 637-652 (1981).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 28 (11), 693-703 (1973).
- Canham, P. B. The minimum energy of bending as a possible explanation of the biconcave shape of the human red blood cell. J Theor Biol. 26 (1), 61-81 (1970).
- Marcerou, J. P., Prost, J., Gruler, H. Elastic Model of Protein-Protein Interaction. Nuovo Cimento Della Societa Italiana Di Fisica D-Condensed Matter Atomic Molecular and Chemical Physics Fluids Plasmas Biophysics. 3 (1), 204-210 (1984).
- Leibler, S. Curvature Instability in Membranes. J Phys-Paris. 47 (3), 507-516 (1986).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved