A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מכוונת ציסטאין תיולים במבחנה גליקוזילציה בייעודי לאתר של חומרים
In This Article
Summary
ניתוחים הביוכימי ומבניים של חלבונים glycosylated דורשים כמויות גדולות יחסית של דגימות הומוגנית. כאן, אנו מציגים שיטה כימית יעילה עבור גליקוזילציה בייעודי לאתר של חומרים מטוהרים של חיידקים על ידי מיקוד תיולים Cys תגובתי.
Abstract
האינטראקציה סטרומה מולקולה-1 (STIM1) הוא סוג-אני טראנסממברנלי הממוקם על רשתית תוך-פלזמית (ER), ממברנות פלזמה (PM). ER-תושב STIM1 מווסת את הפעילות של ערוצי PM Orai1 בתהליך המכונה תאחסן המופעלים סידן (Ca2 +) זהו המנהל Ca2 + איתות התהליך שמניע את התגובה החיסונית. STIM1 עובר post-translational N- גליקוזילציה בשני אתרים Asn luminal בתוך Ca2 + חישה תחום של המולקולה. עם זאת, הביוכימי, biophysical, מבנה השפעות ביולוגיות של N- glycosylated STIM1 היו ממעטים להבין עד לאחרונה עקב חוסר יכולת להשיג בקלות רמות גבוהות של חלבון - glycosylated Nהומוגנית. כאן, אנו מתארים מימוש במבחנה כימית גישה שמתחבר גלוקוז moieties לאתרים חלבון ספציפי, החלים על הבנת ההשפעות הבסיסית של N- גליקוזילציה על מבנה החלבון ואת מנגנון. באמצעות פתרון תהודה מגנטית גרעינית ספקטרוסקופיה לנו להעריך הן יעילות של השינוי, כמו גם את ההשלכות מבנית של הקובץ המצורף גלוקוז עם דוגמה אחת. גישה זו ניתן להתאים בקלות ללמוד את החלבונים glycosylated הרבות המצויים בטבע.
Introduction
לאחסן המופעלים סידן (Ca2 +) כניסה (SOCE) הוא מסלול מרכזי שבו תאים חיסוניים לקחת את2 + Ca מן המרחב חוץ-תאית לתוך ציטוזול. בלימפוציטים מסוג T, T cell קולטנים הממוקמים על קרום פלזמה (PM) לאגד אנטיגנים אשר להפעיל חלבון טירוזין kinases (נבדקה 1,2,3). מפל זרחון שמוביל ההפעלה של phospholipase-γ (PLCγ) אשר לאחר מכן שמתווכת של הידרוליזה של הממברנה phosphatidylinositol 4, 5-bisphosphate (פיפ2) לתוך diacylglycerol, אינוזיטול 1,4,5-טריפוספט (IP3 ). IP3 הוא שליח diffusible קטן אשר נקשר לקולטנים IP3 (IP3R) על תוך-פלזמית (ER) ובכך לפתוח ערוץ קולטן זה ואישורים Ca2 + לזרום במורד מעבר הצבע ריכוז מחדר המיון לומן ל ציטוזול (נבדקה ב 4). קולטן למנהיגנו לבין חלבון G בשילוב קולטני טירוזין קינאז במגוון של עופרת סוגים אחרים על טמפרמנט רב ועל אי-טמפרמנט תא ייצור זהה של IP3 והפעלה של IP3ר'.
עקב גבולית קה2 + קיבולת האחסון של חדר המיון, ה-IP3-שחרור בתיווך, שנפתח על ידי עלייה Ca cytosolic2 + היא רק ארעי; עם זאת, זו דלדול ER luminal Ca2 + עמוקות אפקטים אינטראקציה סטרומה מולקולה-1 (STIM1), סוג-אני transmembrane (TM) חלבון נמצאו בעיקר על6,7 5,ממברנה ER. STIM1 מכיל מונחה לומן Ca2 + חישה תחום מורכב, זוג EF-יד ו α-מוטיב סטרילי (EFSAM). שלושה תחומים של סליל מפותל cytosolic מונחה מופרדים EFSAM על-ידי קבוצת המחשבים TM יחיד (נבדקה ב 8). בעת מיון luminal Ca2 + התרוקנות, עובר EFSAM 7,oligomerization מצמידים הקשורה9 הגורמת rearrangements מבנית של TM ואת סליל מפותל תחומים 10. שינויים מבניים אלה מסתיימים השמנה של STIM1 ב ER-PM צמתי 11,12,13,14 דרך אינטראקציות עם PM phosphoinositides 15, 16 Orai1 subunits 17,18. Orai1 חלבונים הם subunits PM אשר להרכיב לטופס Ca2 + ערוצי 19,20,21,22. האינטראקציות STIM1-Orai1 ובצמתים ER-PM להקל על פתוח Ca2 + שחרור מופעל Ca2 + (CRAC) ערוץ קונפורמציה המאפשר את התנועה של Ca2 + לתוך ציטוזול מ ריכוזים גבוהים של מרחב חוץ-תאית. בתאי מערכת החיסון, מתמשכת cytosolic Ca2 + שינויי הגובה באמצעות ערוצים CRAC זירוז של Ca2 +- קלמודולין/calcineurin תלויים dephosphorylation של הגורם הגרעיני של תאי-T מופעל, אשר לאחר מכן נכנס לגרעין, מתחיל תעתיק ויסות גנים קידום T-cell הפעלה 1,3. התהליך של CRAC הפעלת הערוץ על ידי 23,STIM124 באמצעות אגוניסט-induced ER luminal Ca2 + הידלדלות שכבת שתיווצר מתמשכת cytosolic Ca2 + גובה קולקטיבי הנקרא SOCE 25. התפקיד החיוני של SOCE של תאי T-מתבטא על ידי מחקרים מדגימים כי מוטציות heritable הן STIM1 והן Orai1 יכול לגרום כשל חיסוני משולבים severe תסמונות 3,19,26, 27. EFSAM יוזם SOCE לאחר חישה Ca ER-luminal2 + דלדול דרך האובדן של Ca2 + תיאום הקנוני EF-היד, המוביל בסופו של דבר האגודה עצמית מצמידים הקשורה 7, 28,29.
גליקוזילציה הוא מצורף קוולנטיות עיבוד של פחמימה # מיון הפחמימות מבנים, הידוע גם בשם glycans, דרך השלבים השונים biosynthetic הוחלף נגזר ER, גולג'י (נבדקה ב 30,32,33). ישנם שני סוגי גליקוזילציה ב פרוקריוטים השולט: N-המקושר ו- O-מקושרים, בהתאם חומצת אמינו ספציפית אטום גישור ניגודים. ב- N- גליקוזילציה, glycans מחוברים את אמיד שרשרת הצד של Asn, ברוב המקרים, שלב החניכה מתרחשת בחדר המיון כמו מפוליפפטיד שרשרת נע לתוך לומן 34. הצעד הראשון גליקוזילציה - Nהוא ההעברה של מבנה ליבה 14-סוכר המורכב גלוקוז (Glc), מנוז (אדם) ו- N- acetylglucosamine (GlcNAc) (קרי Glc3איש9GlcNAc2) ממיון ממברנה השומנים על ידי 35,oligosaccharyltransferase36. צעדים נוספים, כגון מחשוף או העברה של גלוקוז משקעים, הן מזורז בחדר המיון glycosidases ספציפיות, glycosyltransferases. כמה חלבונים להשאיר בחדר המיון ולהעביר גולג'י יכול להיות עוד יותר מעובד 37. O- גליקוזילציה מתייחס התוספת של glycans, בדרך כלל אל קבוצת הידרוקסיל שרשרת הצד של שאריות Ser או חמישי, ומתרחשת שינוי זה לחלוטין ב 33,הגולגי34. ישנם מספר מבנים - glycan Oאשר יכול להיות מורכב של N- acetylglucosamine, fucose, גלקטוז, חומצה sialic עם כל חד-סוכר נוסף ברצף 33.
אמנם אין רצף מסוים זוהה תנאי הכרחי עבור סוגים רבים של O- גליקוזילציה, רצף קונצנזוס נפוצות נמצא קשור N-מקושרים השינוי: Asn-X-Ser/חמישי/Cys, שבו X יכול להיות כל חומצת אמינו רק Pro 33. STIM1 EFSAM מכיל את שני האתרים האלה - גליקוזילציה קונצנזוס N: Asn131-Trp132-Thr133 ו- Asn171-Thr172-Thr173. ואכן, מחקרים קודמים הראו כי EFSAM יכול להיות N- glycosylated בתרבית של תאים ב- Asn131 ו- Asn171 38,39,40,41. עם זאת, מחקרים קודמים ההשלכות של N- גליקוזילציה על SOCE היו incongruent, רומז מדוכא, potentiated או אין השפעה על ידי שינוי זה post-translational על SOCE ההפעלה 38,= "xref" >40,,3941. לפיכך, מחקר על ההשלכות biophysical, ביוכימי, מבניים הבסיסית של EFSAM N- גליקוזילציה חיוני כדי לגלות את ההשפעות הרגולציה של שינוי זה. עקב הדרישה לקבלת רמות גבוהות של חלבונים הומוגנית בניסויים אלה במבחנה , הוחל בגישה סלקטיבית באתר לצרף covalently גלוקוז moieties EFSAM. מעניין, Asn131 ו- Asn171 גליקוזילציה גרם לשינויים מבניים להתכנס בתוך תוכו EFSAM ולשפר את המאפיינים biophysical אשר לקדם בתיווך STIM1 SOCE 42.
הקובץ המצורף כימי של קבוצות glycosyl כדי Cys תיולים כבר ומבוססת על ידי עבודה הזרע אשר שהראו את התועלת של גישה זו ללא אנזים להבנת השפעת גליקוזילציה בייעודי לאתר על תפקוד החלבון 43 , 44. לאחרונה, ובעניין STIM1, משקעי Asn131 ו- Asn171 היו מוטציה כדי Cys ושימש glucose-5-(methanethiosulfonate) [glucose-5-(MTS)] כדי covalently לקישור גלוקוז חופשי תיולים 42. כאן, אנו מתארים גישה זו, אשר לא רק משתמשת מוטגנזה מכוונת לשלב באתר ספציפי Cys שאריות ולשנותן, אלא חל גם פתרון ספקטרוסקופיה תהודה מגנטית גרעינית (NMR) להעריך במהירות יעילות שינויים מבניים לפליטת כתוצאה גליקוזילציה. ראוי לציין, מתודולוגיה כללית זו ניתנת להתאמה בקלות לחקור את ההשפעות של או O- או N- גליקוזילציה של כל recombinantly מיוצר חלבון.
Protocol
1. תגובת שרשרת פולימראזית (PCR)-מתווכת מוטגנזה כהכנה לסיפוח Cys לתוך וקטור ביטוי חיידקי pET-28a.
- לקבוע את הריכוז של הווקטור pET-28a (כלומר כפול נטושים DNA) באמצעות מקדם הכחדה אולטרה סגול (UV) (μg/mL) 0.020 ס מ -1 ב 260 ננומטר.
- לסנתז זוג תחל מוטגניות משלימים עבור כל מוטציה Cys כזה כי אני) יש מינימום של 15 נוקלאוטידים משלים התבנית לפני ההתאמה הבסיס הראשון, משלים התבנית לאחר 15 נוקלאוטידים אי-התאמה של הבסיס הסופי, ii) אורך פריימר הכולל אינו עולה על 45 נוקלאוטידים, ו- iii), גואנין או ציטוזין ממוקם במיקום נוקלאוטיד הראשונה והאחרונה של כל פריימר (טבלה 1). להבטיח פריימר הסינתזה מתבצעת באמצעות סולם 0.025 μmol וטיהור מחסנית.
- באמצעות דיוק גבוה של ה-DNA פולימראז, להגדיר שני 20 µL PCR התגובה תערובות: אחד המכיל את פריימר לפנים והשניה המכיל את המפתח הפוכה. להכין את כל התערובת עד מכילים ריכוזים הסופי של מאגר x PCR 1 עם 1.5 mM MgCl 2, dNTPs 0.2 מ מ, 0.5 μM פריימר, דימתיל סולפוקסיד μL 0.4, ng/μL 1.25 תבנית ה-DNA, דיוק גבוה U/μL 0.02 נקודות DNA פולימראז.
- מחזור תרמית של תערובות נפרד באמצעות פרוטוקול שלושה שלבים: 98 ° C ל 30 s (denaturing), 53-56 ° C ל 30 s (ריפוי), 72 ° C עבור 30 s kilobase(kb) -1 (סיומת) של תבנית ה-DNA. חזור על התוכנית טמפרטורה למשך 5 מחזורים, הוסף שלב סיומת הסופי-72 מעלות צלזיוס במשך 7.5 מינימלית
- לאחר ה-PCR הראשונית, עם תחל ואחורה צינורות נפרדת לשלב את המוצרים לתוך צינור בודד (כלומר 40 μL סה כ) ולהמשיך את תגובת ה-PCR מחזורים 20 נוספים באמצעות אותם פרמטרים אופניים כפי שמתואר בשלב 1.4. ג'ל
- electrophorese 15 μL של תערובת התגובה PCR על agarose 1% (w/v) באמצעות x Tris 0.5, חומצה אצטית, אתילן diamine ב טטרה חומצה אצטית (EDTA) הפעלת מאגר (טה). כפקדי, electrophorese כמות שווה של תבנית ה-DNA אשר לא הוגדל על ידי ה-PCR ושל aliquot של סולם הדנ א הפניה המכילה סמן להקות יותר וגם פחות מאשר הגודל הצפוי של המוצר PCR.
- לאחר אלקטרופורזה-120 V למשך 40 דקות, להטביע את הג'ל במים המכילה 0.5 μg/mL אתידיום ברומיד ו- shake למשך 30 דקות בטמפרטורת החדר. לאשר תבנית באורך מלא יש כבר מוגבר על ידי תחל המוטגניות כמו עלייה יחסית אתידיום ברומיד פלורסנט בעוצמה של הלהקה מוגבר לעומת הלהקה תבנית הבקרה תחת אור UV (302 ננומטר).
- אם אין הגברה לכאורה, חוזר של PCR לאחר התאמת הטמפרטורה מחזק בתוספות 0.5 ° C 53-56 ° C הטמפרטורה בטווח שבין.
- על אישור של הגברה של התבנית על ידי תחל המוטגניות, להתייחס μL ~ 25 הנותרים את תערובת התגובה PCR עם האנזים הגבלת DpnI לעכל את התבנית מפוגל הדנ א. להשתמש DpnI µL 0.5 (10 יחידות) לכל תערובת התגובה של ה-PCR μL 25, ריכוז סופי של 1 × DpnI התגובה מאגר. תקופת דגירה של 2.5 h ב 37 º C
- בעקבות עיכול תבנית, להוסיף μL ~ 5-10 של תערובת מעוכל עד 100 µL של חום לחשמל DH5α Esherichia coli המוסמכת, בתאים צינור microcentrifuge מ ל 1.75. דגירה התערובת תא-DNA על קרח דק 60
- הלם חום התערובת תא-DNA בצינור microcentrifuge ב 42 מעלות צלזיוס במשך 45 s על גוש חום יבש. לאחר המקננת התערובת בקירור למשך 3 דקות, להוסיף μL 900 בטמפרטורת החדר לוריא-Bertani מרק (LB) התאים ולהעביר התליה תא הסכום לתוך צינור עגול-התחתון סטרילי mL 14.
- דגירה התליה תא ב 37 מעלות צלזיוס במשך 90 דקות ברעידות קבוע ב 190 סל ד.
- לאחר מכן, להעביר התליה תא בחזרה לתוך צינור microcentrifuge מ ל 1.75 צנטריפוגה ב 10,000 x g למשך 5 דקות בטמפרטורת החדר.
- לאחר צנטריפוגה, להסיר μL 900 של תגובת שיקוע, resuspend תאי חיידקים על ידי עדינה pipetting, μL 100 הנותרים של LB.
- להעביר את המתלים הנובעת תא מרוכז על גבי צלחת LB-אגר המכיל אנטיביוטיקה אשר הוא סלקטיבי עבור וקטור ביטוי (קרי 60 μg/mLKanamycin). גילוח ורחיצה כירורגית התפשטה ההשעיה באופן שווה על הצלחת אגר, תקופת דגירה של ~ 16 h ב- 37 מעלות צלזיוס.
- למחרת, לחסן מושבה בודדת מהצלחת לתוך 5 מ ל LB נוזלי המכיל את הלחץ הבחירה antiobiotic (קרי 60 μg/mL Kanamycin). לגדול התרבות נוזלי בן לילה ב 37 ° C עם טלטול מתמיד ב- 37 מעלות צלזיוס.
- לבודד ולטהר את פלסמיד שעבר בירושה את התאים e. coli באמצעות ערכת זמינים מסחרית בהתבסס על הליך פירוק אלקליין 45.
- לאשר המוטציה של עניין הוא ההווה במסגרת הקריאה הנכונה על ידי רצפי DNA סנגר פלסמיד 46.
2. מדים 15 ביטוי חלבון התווית על-ידי N BL21 ΔE3 Escherichia coli.
הערה: חומרים שונים דורשים תנאי ביטוי שונה. הבא הוא ההליך ממוטב עבור הביטוי של החלבון STIM1 EFSAM האנושי.
- להפוך הווקטור ביטוי מחסה מוטציות Cys (כלומר חיית מחמד-28a-EFSAM) BL21 ΔE3 codon (+) חום הלם המוסמכת תאים ו צלחת על צלחות LB-אגר המכיל את הלחץ הבחירה אנטיביוטי כמתואר בצעדים 1.9-1.14) עם בעקבות שינויים: ישירות צלחת של aliquot 150 μL לצאת מאיזון בתא סכום ~ 1,000 μL בצלחת LB-אגר ללא צורך ריכוז התאים צינור microcentrifuge על ידי צנטריפוגה.
- למחרת, גילוח ורחיצה כירורגית להעביר שמושבה בודדת לתוך 200 מ ל Erlenmeyer בקבוק המכיל 20 מ ל LB בתוספת אנטיביוטיקה מתאימה (קרי 60 μg/mL kanamycin עבור חיית המחמד-28a-EFSAM). לגדול starter נוזלי תרבות זו בין לילה (קרי ~ 16 h) ב 37 ° C עם טלטול מתמיד ב ~ סל ד 190.
- באותו יום כשלב 2.2, להכין M9 בינוני 15 ביטוי חלבון התווית על-ידי N autoclaving 1 ליטר של M9 מאגר מלחי (כלומר 42 מ מ נה 2 HPO 4, 22 מ מ ח' 2 PO 4, 8.6 מ' ' מ NaCl, pH 7.4) בבקבוקון Erlenmeyer 4 L. ברגע מגניב, לסנן תערובת של 20% (w/v) D-גלוקוז, CaCl 1 מ' 2, 1 מ' תיאמין, 1 מ' MgSO 4, 1 מ"ג/מ"ל ביוטין ו- 0.2 g/mL 15 N-NH 4 Cl דרך מסנן סטרילי מזרק μm 0.2 בתוך 1 ליטר M9 סטרילי תמיסת מלח כך ריכוז סופי של רכיבים אלה הם 0.2% (w/v) D-גלוקוז, 100 μM CaCl 2, 50 μM תיאמין, 1 מ MgSO 4, ביוטין μg/mL ו- 1 mg/mL 15 N-NH 4 Cl. 1
- למחרת, גילוח ורחיצה כירורגית העברת התרבות starter נוזלי 20 מ ל לילה לתוך צינור חרוטי סטרילי 50 מ ל צנטריפוגה ב × 2,400 g למשך 15 דקות הצניפה התאים.
- לאחר decanting המדיום ליברות, resuspend בגדר התא שנוצר ב- 10 מ"ל של בינונית מזערי M9 ולהעביר את התערובת resuspended צנפה לתוך 1 ליטר של M9 בינונית מזערי עם אנטיביוטיקה (קרי 60 kanamycin μg/mL).
- גדלים 1 ליטר של M9 בינונית מזערי המכיל את התרבות חיידקי starter-37 ° C ו ~ 190 סל"ד קבוע לרעוד עד הצפיפות האופטית-600 nm (OD600) מגיע ~0.6-0.8-
- כאשר הטווח specfified OD600 מתמלאת, להוסיף 200 μM של איזופרופיל β-D-1-thiogalactopyranoside (IPTG) כדי לעודד ביטוי חלבון.
- לאחר תוספת IPTG, להמשיך המקננת התאים עבור ביטוי חלבונים בטמפרטורת החדר ברעידות קבוע ב ~ 190 סל ד עבור h ~ 16 (קרי לילה).
- למחרת, לקצור את החיידקים על ידי צנטריפוגה ב ~ 10,000 × g, 4 מעלות צלזיוס במשך 30 דקות
- Decant LB ולהעביר בגדר תא לתוך צינור חרוטי 50 מ. לאחסן בגדר ב-80 מעלות צלזיוס עד טיהור.
3. טיהור של חלבון רקומביננטי של e. coli.
הערה: חומרים שונים דורשים תהליכי טיהור ברורים. לפניכם הפרוטוקול עבור 6 & #215; מתויג שלו טיהור EFSAM מגופים הכללה הביע מ- pET-28a הבונה.
- Homogenize באופן ידני בגדר קפוא תא החיידק ב 6 מ' guanidine-HCl, 20 מ מ טריס-HCl (pH 8) וβ 5 מ מבאמצעות פיפטה העברה של 10 מ"ל ממונע mercaptoethanol. להוסיף כ- 40 מ ל guanidine-HCl לכל 5 מ של גלולה רטובים בשלב זה. דגירה
- הבאות 90 דקות בטמפרטורת החדר עם סיבוב קבוע בתנור הכלאה, centrifuge את התערובת ב g × ~ 15,000, 8 מעלות במשך 40 דקות להפריד את שאריות תאים לא מסיסים (כלומר גלולה) חלבון מסיס תערובת (כלומר supernatant).
- 750 להוסיף µL של 50% (v/v) ני 2 +-agarose חומצה nitrilotriacetic חרוז slurry כדי מובהר lysate ואת תקופת דגירה של עוד 90 דקות בטמפרטורת החדר עם היפוך בתנור הכלאה.
- לאחר מכן, לכידת 6 × שלו מתויג החלבון קשור ני 2 + על ידי איסוף החרוזים agarose זרימת הכבידה חלבון טיהור בעמודה. לאפשר lysate לזרום דרך העמודה לחלוטין לפני שהחלו לנוע לשלב 3.5.
- לרחוץ את החרוזים שנאספו שלוש פעמים עם 10 מ"ל של 6 מ' אוריאה, 20 מ מ טריס-HCl pH 8 ו-5 מ מ β-mercaptoethanol.... להבטיח כי 10 מ ל כל עובר דרך העמודה לפני כל 10 מ"ל הבאים ווש
- Elute את החלבונים בסדרת 2 mL שברים בעזרת שישה מ' אוריאה, 20 מ מ טריס-HCl pH 8, imidazole 300 מ"מ, 5 מ"מ β-mercaptoethanol עם זמן דגירה s 90 בין שברים. להבטיח כי mL 2 כולו עובר דרך העמודה לפני כל שלב • תנאי עוקבות.
- בשלב זה, לאשר החלבון עניין קיים בחלקים eluted על ידי Coomassie נתרן מוכתם כחול dodecyl סולפט לזיהוי בג'ל (מרחביות-עמוד) בשיטת Laemmli 47. להעריך את גודל החלבון, הכמות ואת טוהר על ידי השוואה נגד משקל מולקולרי תקן סמן להקות שהן שתיהן פחות מאשר, יותר משקל מולקולרי הצפוי של החלבון עניין.
- מאגר שברים חלבון eluted לתוך קרום דיאליזה עם 3,500 Da מולקולרית משקל הקיצוץ, דגירה מאגר refolding 1 ליטר (20 מ מ טריס, 300 מ"מ NaCl, 1 מ"מ DTT, 5 מ מ CaCl 2, pH 8) ב 4 מעלות צלזיוס למשך הלילה בזמן המאגר הוא להיות מנוער מאת magneti קדירות c.
- לאחר ~ 16 h של זמן refolding, להוסיף ~ 1 U של תרומבין לכל מ ג חלבון ישירות אל השקית דיאליזה, דגירה ב 4 ° C עבור מתכוון ~ 24 נוספים
- לאמת היקף × 6 המחשוף התג שלו על-ידי Coomassie-כחול צביעה של ~ 15 μL חלבון aliquots שנלקחו השקית דיאליזה לפני ואחרי הדגירה עם תרומבין אשר הם electrophoresed על denaturing לזיהוי ג'לים (מרחביות-עמוד) באמצעות שיטת Laemmli 47. אם משמרת ~ 2 kDa ההעברה נצפית התואם המשקל המולקולרי של × 6 cleaved התג שלו, המשך לשלב 3.11; אם שבריר של חלבון מעוכל שרידים זה ניתן לגילוי על ידי צביעת Coomassie-כחול, להוסיף ~0.2 U של תרומבין לכל מ ג חלבון ישירות שקית דיאליזה, דגירה ב 4 ° C עבור ה ~ 24 נוספים
- שימוש בגודל כרומטוגרפיה החרגה או יונים בכדי לטהר את החלבון. עבור exchange אניון כרומטוגרפיה של EFSAM, להסיר את הפתרון חלבון שקית דיאליזה ולהתרכז ~ 10-fold באמצעות רכז צנטריפוגלי אולטראפילטרציה עם 10,000 Da מולקולרית משקל הקיצוץ. לאחר מכן, לדלל מחדש את הפתרון ~ 20-fold במאגר נטולת NaCl (20 מ"מ. טריס, 5 מ מ CaCl 2, 1 מ"מ DTT, pH 8)-
- Equilibrate עמודת exchange אניון prepacked עם 10 כרכים עמודה של המאגר ללא NaCl שמתואר בשלב 3.11. Equilibrate באמצעות מאגר נטען לתוך מזרק זכוכית-lock המכיל אין בועות אוויר על ידי דחיפת הפתרון באמצעות המדור באופן dropwise, הימנעות לחצים מזרק לגרום נחלים יציב של פתרון יציאה העמודה. שימוש כאמצעי חילופי אניון חזקה (למשל תפור agarose עם קבוצות פונקציונליות אמוניום רבעוני).
- לטעון את הפתרון חלבון מדולל NaCl ללא מאגר (שלב 3.11) אל העמודה כפי שמתואר בשלב 3.12.
- Elute את החלבונים של מעבר צבע [קרי 0 - 60% (v/v)] של הגדלת NaCl מאגר (20 מ"מ טריס, NaCl מ' 1, 5 מ מ CaCl 2, 1 מ"מ DTT, pH 8) באמצעות מערכת כרומטוגרפיה נוזלית (FPLC) חלבון מהיר 2-משאבה. להגדיר את המערכת FPLC לאסוף ~1-1.5 mL שברים ולנטר את הפרופיל • תנאי חלבון בעזרת UV 280 ננומטר ספיגת ולדרג זרם 0.5 מ ל לדקה
- לזהות את פסגות • תנאי ושברים המכיל חלבון עניין כמו גם חלבון טוהר על ידי מרחביות מוכתם כחול Coomassie-דף ג ' לים-בשיטת Laemmli 47.
- שברים הבריכה מראה > 95% (כלומר נלקח כשברים שמראים רק להקה חלבון יחיד על Coomassie-blue מוכתמת ג'לים) לתוך שקית דיאליזה exchange לתוך מאגר ניסיוני של עניין על-ידי דיאליזה כפי שמתואר בשלב 3.8.
4. מצורף כימי של גלוקוז-5-MTS לחלבון על-ידי דיאליזה.
- הכן 55 מ"מ פתרון מניות של N-(β-D-glucopyranosyl)-N '-[2-methanethiosulfonyl) אתיל] אוריאה (גלוקוז-5-MTS) על ידי המסת 10 מ ג של המתחם ב 500 μl של 100% (v/v) דימתיל סולפוקסיד. לאחסן שאינם בשימוש גלוקוז-5-MTS solubilized ב דימתיל סולפוקסיד ב-20 מעלות צלזיוס מאגר
- הכנת המדגם חלבון ולשנותן על ידי dialyzing 1.5 mL ~ 60 μM החלבון לתוך 1 ליטר של שינוי מורכב מ 20 מ מ מגבים, 150 מ מ NaCl, 5 מ מ CaCl 2 ו 0.1 מ"מ TCEP, pH 8.3. השתמש קרום דיאליזה ניתוק משקל מולקולרי שהינו קטן יותר מהגודל של חלבון והידועה (למשל להשתמש ניתוק Da 3,500 עבור EFSAM Da ~ 17,500).
- לאחר 24 h-4 ° C, להעביר את הדגימה מ השקית דיאליזה לתוך צינור microcentrifuge. להוסיף את solubilized דימתיל סולפוקסיד הגלוקוז-5-MTS ריכוז סופי של 2 מ מ.
- דגירה המדגם בחושך לשעה בטמפרטורת החדר. במהלך תקופת הדגירה 1 h, לערבב הפתרון על-ידי הקשה עדין של הצינור כל 10 דקות
- לאחר מכן מחדש חילופי החלבון למאגר ניסיוני הסופי המכילה ללא סוכן צמצום על-ידי דיאליזה ב 4 ° C, כפי שמתואר בשלב 4.2 או על-ידי אולטראפילטרציה צנטריפוגלי. עבור ההליך אולטראפילטרציה, לרכז את הדגימה חלבון mL ~1.5 כדי < 0.5 mL ו לדלל לאחר מכן ב במסוע אותו עם המאגר ניסיוני. חזור על שלב זה ריכוז-דילול פעמיים נוספות כך ההחלפה הכולל הוא מינימום של 30 × 30 × 30 = 27,000-fold. לשימוש EFSAM, 20 מ מ טריס, 150 מ מ NaCl, 5 מ מ CaCl 2, ה-pH 7.5 כמו המאגר ניסיוני.
- להכין את הדגימה ספקטרומטריית electrospray יינון ספקטרומטר מסה על ידי exchange דיאליזה או אולטראפילטרציה כפי שתואר בשלבים 4.2 ו- 4.5, בהתאמה, 25 מ מ אמוניום ביקרבונט או אצטט אמוניום 25 מ מ. אם משתמש דיאליזה, להבטיח לך להחליף לפחות שלוש פעמים כדי להסיר כל מלחי 2 שיורית של NaCl ו CaCl.
- לקבוע את המסה מדויק (קרי ± 1 Da) של החלבון עניין באמצעות ספקטרומטריית electrospray יינון מסה ספקטרומטר 48 , 49. מצפה כל תוספת גלוקוז קוולנטיות תיול Cys דרך החומר הכימי methanethiosulfonate כדי להוסיף 281.3 Da החלבון מסה (קרי הוספה Da 360.4 עבור הגלוקוז-5-MTS והפחתה של Da 79.1 CH 3 אז 2 עוזבת הקבוצה במהלך קוולנטיות מצורף).
5. פתרון NMR הערכה של שנוילפליטת יעילות מבניים ication.
חלבון- ודא ריכוז שונה הוא > 100 μM אחרי גלוקוז מצורף הסופי מאגר exchange. עבור EFSAM, לאמוד ריכוז חלבון באמצעות מקדם הכחדה UV ב 280 ננומטר (מ. ל. – מ ג 1) 1.54 ס מ – 1-
- תוספת הפתרון חלבון עם 60 μM של חומצה 4,4-dimethyl-4-silapentane-1-sulfonic (DSS) עבור כיול shimming ודופק ו- 10% (v/v) ד 2 O על המנעול. אות. עבור שימוש אות לרעש גבוה דגימות μL 600 צינורות מתאימים בתדר 5 מ"מ NMR, מוכנס לתוך ספקטרומטר 600 מגה-הרץ מינימום מצויד בדיקה קריוגני של מימן ציאנידי תהודה משולשת.
- לאסוף רגיל 1 H - 15 N HSQC ספקטרה ככל בעבר מפורט 50 , 51-טמפרטורה, 1 H ו 15 N לטאטא רוחבי, ארעי, תוספת קבועה הגדרות מתאים המדגם מסוים. EFSAM ספקטרה, שימוש 20 ° C, תופעות מעבר 1 H 256, 64 15 N מימד במרווחים של 1 H ו- 15 N לטאטא רוחב מוגדר כ- 8,000, 1,800 הרץ, בהתאמה.
- בעקבות רכישת הקשת חלבון glycosylated, להוסיף dithiothreitol (DTT) הדגימה NMR של המניה 1 מ' כדי ריכוז סופי של 15 מ מ. DTT מסיר את moiety גלוקוז החלבון על ידי הפחתת המצורף בתיווך דיסולפידי.
- לרכוש השני 1 H - 15 N HSQC בתנאים אלה יבוצעו בהם מופחת/לא שינויים ', מתן קשת הפניה להערכת השינוי לפליטת יעילות מבניים הנגרמת על ידי המצורף גלוקוז.
- לעבד נתונים NMR באמצעות NMRPipe כפי שתוארו קודם לכן 52. להבטיח כי עיבוד מינימלית כולל המרת נתונים, בהדרגה, דיכוי הממס, התמרת פורייה, ויזואליזציה הראשונית של הספקטרום.
- להעריך יעילות שינוי על ידי מדידת עוצמות שיא אמיד וערכים shift כימי ב ספקטרום שונה, מופחתת באמצעות התוסף NEASY על קארה 53. ודא כדי להעריך את עוצמת שיא אמיד Cys שניהם הגלוקוז מחובר האופטימיזציות ספקטרה. אם אמיד Cys לא יכול להיות אמין ממוקם שני ספקטרה, להשתמש עוצמות משקעים הסמוכים Cys readout.
- חישוב היעילות כמו עוצמת אמיד מהספקטרום Cys-לאחרונה מחולק עוצמת אמיד מהספקטרום Cys-מופחתת (קרי DTT-מטופלים), מוכפלים ב- 100:
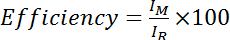 איפה אני מ' עוצמת אמיד בספקטרום Cys-לאחרונה, R הוא עוצמת אמיד בספקטרום Cys-מופחתת. לחלופין, להעריך את היעילות הממוצע מעל מספר פסגות אמיד:
איפה אני מ' עוצמת אמיד בספקטרום Cys-לאחרונה, R הוא עוצמת אמיד בספקטרום Cys-מופחתת. לחלופין, להעריך את היעילות הממוצע מעל מספר פסגות אמיד:
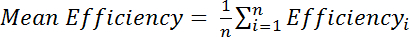 , כאשר יעילות i הוא בנפרד נחוש יעילות החישוב עבור כל אחד שאריות, ו- n הוא המספר הכולל של שאריות המשמשת לחישוב.
, כאשר יעילות i הוא בנפרד נחוש יעילות החישוב עבור כל אחד שאריות, ו- n הוא המספר הכולל של שאריות המשמשת לחישוב. - לחשב לפליטת shift כימי (CSP) מן ההבדלים shift כימי בין ספקטרום שני נצפתה ב 15 N ו 1 H מידות של כל שיא, נורמליזציה עבור שימוש בטווח של shift כימי 15 N גדול בעקבות משוואה:
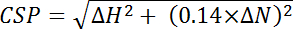 , שבה ΔH הוא השינוי ppm הממד פרוטון, ΔN היא השינוי ppm בממד חנקן.
, שבה ΔH הוא השינוי ppm הממד פרוטון, ΔN היא השינוי ppm בממד חנקן.
תוצאות
הצעד הראשון של גישה זו מחייבת מוטגנזה מכוונת של שאריות גליקוזילציה המועמד אל שאריות Cys אשר ניתן לשינוי באמצעות EFSAM של גלוקוז-5-MTS. יש ללא שאריות Cys אנדוגני, אז אין שיקולים מיוחדים צריכים להיעשות לפני מוטגנזה מכוונת. עם זאת, שאריות Cys יליד חייב להיות מוטציה כדי משקעים שאינם לש...
Discussion
גליקוזילציה חלבון הוא שינוי post-translational איפה סוכרים covalently מחוברים polypeptides בעיקר דרך קישורים לרשתות בצד חומצת אמינו. כ 50% של יונקים חלבונים הם glycosylated 54, שבו החלבונים glycosylated יכול לאחר מכן יש מגוון רחב של אפקטים מתוך שינוי זיקה מחייבת למערכות ביולוגיות, המשפיעים על חלבון קיפול, שינ?...
Acknowledgements
מחקר זה נתמך על ידי מדעי הטבע, הנדסה מחקר המועצה של קנדה (05239 כדי נשדר), קרן קנדי קרן מחקרים חדשנות/אונטריו (כדי נשדר), קרן סרטן הערמונית להילחם - טילוס נסיעה עבור אבא (כדי נשדר), אונטריו מלגות לתואר שני (כדי Y.J.C. ונ. ס).
Materials
| Name | Company | Catalog Number | Comments |
| Phusion DNA Polymerase | Thermo Fisher Scientific | F530S | Use in step 1.3. |
| Generuler 1kb DNA Ladder | Thermo Fisher Scientific | FERSM1163 | Use in step 1.6. |
| DpnI Restriction Enzyme | New England Biolabs, Inc. | R0176 | Use in step 1.8. |
| Presto Mini Plasmid Kit | GeneAid, Inc. | PDH300 | Use in step 1.16. |
| BL21 DE3 codon (+) E. coli | Agilent Technologies, Inc. | 230280 | Use in step 2.1. |
| DH5a E. coli | Invitrogen, Inc. | 18265017 | Use in step 1.9. |
| 0.22 mm Syringe Filter | Millipore, Inc. | SLGV033RS | Use in step 2.3. |
| HisPur Ni2+-NTA Agarose Resin | Thermo Fisher Scientific | 88221 | Use in step 3.3. |
| 3,500 Da MWCO Dialysis Tubing | BioDesign, Inc. | D306 | Use in step 3.8, 3.16, 4.2, 4.5 and 4.6. |
| Bovine Thrombin | BioPharm Laboratories, Inc. | SKU91-055 | Use in step 3.9. |
| 5 mL HiTrap Q FF Anion Exchange Column | GE Healthcare, Inc. | 17-5156-01 | Use in step 3.11. |
| Glucose-5-MTS | Toronto Research Chemicals, Inc. | G441000 | Use in step 4.1. |
| Vivaspin 20 Ultrafiltration Centrifugal Concentrators | Sartorius, Inc. | VS2001 | Use in step 3.11, 4.2, 4.5 and 4.6. |
| PageRuler Unstained Broad Protein Ladder | Thermo Fisher Scientific | 26630 | Use in step 3.7, 3.10 and 3.15 |
| HiTrap Q FF Anion Exchange Column | GE Healthcare, Inc. | 17-5053-01 | Use in step 3.12. |
| AKTA Pure Fast Protein Liquid Chromatrography System | GE Healthcare, Inc. | 29018224 | Use in step 3.14. |
| 600 MHz Varian Inova NMR Spectrometer | Agilent Technologies, Inc. | Use in step 5.2 and 5.5. |
References
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Feske, S., Skolnik, E. Y., Prakriya, M. Ion channels and transporters in lymphocyte function and immunity. Nat Rev Immunol. 12 (7), 532-547 (2012).
- Shaw, P. J., Feske, S. Physiological and pathophysiological functions of SOCE in the immune system. Front Biosci (Elite Ed). 4, 2253-2268 (2012).
- Seo, M. D., Enomoto, M., Ishiyama, N., Stathopulos, P. B., Ikura, M. Structural insights into endoplasmic reticulum stored calcium regulation by inositol 1,4,5-trisphosphate and ryanodine receptors. Biochim Biophys Acta. 1853 (9), 1980-1991 (2015).
- Stathopulos, P. B., Ikura, M. Structural aspects of calcium-release activated calcium channel function. Channels (Austin). 7 (5), 344-353 (2013).
- Stathopulos, P. B., Ikura, M. Structure and function of endoplasmic reticulum STIM calcium sensors. Curr Top Membr. 71, 59-93 (2013).
- Stathopulos, P. B., Li, G. Y., Plevin, M. J., Ames, J. B., Ikura, M. Stored Ca2+ depletion-induced oligomerization of stromal interaction molecule 1 (STIM1) via the EF-SAM region: An initiation mechanism for capacitive Ca2+ entry. J Biol Chem. 281 (47), 35855-35862 (2006).
- Stathopulos, P. B., Ikura, M. Store operated calcium entry: From concept to structural mechanisms. Cell Calcium. , (2016).
- Stathopulos, P. B., Ikura, M. Structurally delineating stromal interaction molecules as the endoplasmic reticulum calcium sensors and regulators of calcium release-activated calcium entry. Immunol Rev. 231 (1), 113-131 (2009).
- Muik, M., et al. STIM1 couples to ORAI1 via an intramolecular transition into an extended conformation. EMBO J. 30 (9), 1678-1689 (2011).
- Luik, R. M., Wang, B., Prakriya, M., Wu, M. M., Lewis, R. S. Oligomerization of STIM1 couples ER calcium depletion to CRAC channel activation. Nature. 454 (7203), 538-542 (2008).
- Luik, R. M., Wu, M. M., Buchanan, J., Lewis, R. S. The elementary unit of store-operated Ca2+ entry: local activation of CRAC channels by STIM1 at ER-plasma membrane junctions. J Cell Biol. 174 (6), 815-825 (2006).
- Wu, M. M., Buchanan, J., Luik, R. M., Lewis, R. S. Ca2+ store depletion causes STIM1 to accumulate in ER regions closely associated with the plasma membrane. J Cell Biol. 174 (6), 803-813 (2006).
- Liou, J., Fivaz, M., Inoue, T., Meyer, T. Live-cell imaging reveals sequential oligomerization and local plasma membrane targeting of stromal interaction molecule 1 after Ca2+ store depletion. Proc Natl Acad Sci U S A. 104 (22), 9301-9306 (2007).
- Calloway, N., et al. Stimulated association of STIM1 and Orai1 is regulated by the balance of PtdIns(4,5)P(2) between distinct membrane pools. J Cell Sci. 124 (Pt 15), 2602-2610 (2011).
- Korzeniowski, M. K., et al. Dependence of STIM1/Orai1-mediated calcium entry on plasma membrane phosphoinositides. J Biol Chem. 284 (31), 21027-21035 (2009).
- Park, C. Y., et al. STIM1 clusters and activates CRAC channels via direct binding of a cytosolic domain to Orai1. Cell. 136 (5), 876-890 (2009).
- Yuan, J. P., et al. SOAR and the polybasic STIM1 domains gate and regulate Orai channels. Nat Cell Biol. 11 (3), 337-343 (2009).
- Feske, S., et al. A mutation in Orai1 causes immune deficiency by abrogating CRAC channel function. Nature. 441 (7090), 179-185 (2006).
- Prakriya, M., et al. Orai1 is an essential pore subunit of the CRAC channel. Nature. 443 (7108), 230-233 (2006).
- Vig, M., et al. CRACM1 multimers form the ion-selective pore of the CRAC channel. Curr Biol. 16 (20), 2073-2079 (2006).
- Vig, M., et al. CRACM1 is a plasma membrane protein essential for store-operated Ca2+ entry. Science. 312 (5777), 1220-1223 (2006).
- Liou, J., et al. STIM is a Ca2+ sensor essential for Ca2+-store-depletion-triggered Ca2+ influx. Curr Biol. 15 (13), 1235-1241 (2005).
- Roos, J., et al. STIM1, an essential and conserved component of store-operated Ca2+ channel function. J Cell Biol. 169 (3), 435-445 (2005).
- Putney, J. W. A model for receptor-regulated calcium entry. Cell Calcium. 7 (1), 1-12 (1986).
- Feske, S. CRAC channelopathies. Pflugers Arch. 460 (2), 417-435 (2010).
- Maus, M., et al. Missense mutation in immunodeficient patients shows the multifunctional roles of coiled-coil domain 3 (CC3) in STIM1 activation. Proc Natl Acad Sci U S A. 112 (19), 6206-6211 (2015).
- Stathopulos, P. B., Zheng, L., Li, G. Y., Plevin, M. J., Ikura, M. Structural and mechanistic insights into STIM1-mediated initiation of store-operated calcium entry. Cell. 135 (1), 110-122 (2008).
- Stathopulos, P. B., Ikura, M. Partial unfolding and oligomerization of stromal interaction molecules as an initiation mechanism of store operated calcium entry. Biochem Cell Biol. 88 (2), 175-183 (2010).
- Dennis, J. W., Lau, K. S., Demetriou, M., Nabi, I. R. Adaptive regulation at the cell surface by N-glycosylation. Traffic. 10 (11), 1569-1578 (2009).
- Nilsson, T., Au, C. E., Bergeron, J. J. Sorting out glycosylation enzymes in the Golgi apparatus. FEBS Lett. 583 (23), 3764-3769 (2009).
- Stanley, P. Golgi glycosylation. Cold Spring Harb Perspect Biol. 3 (4), (2011).
- Moremen, K. W., Tiemeyer, M., Nairn, A. V. Vertebrate protein glycosylation: diversity, synthesis and function. Nat Rev Mol Cell Biol. 13 (7), 448-462 (2012).
- Gerlach, J., Sharma, S., Leister, K., Joshi, L., Agostinis, P., Afshin, S. . Endoplasmic Reticulum Stress in Health and Disease. , 23-39 (2012).
- Pearse, B. R., Hebert, D. N. Lectin chaperones help direct the maturation of glycoproteins in the endoplasmic reticulum. Biochim Biophys Acta. 1803 (6), 684-693 (2010).
- Stanley, P., Sundaram, S. Rapid assays for lectin toxicity and binding changes that reflect altered glycosylation in mammalian cells. Curr Protoc Chem Biol. 6 (2), 117-133 (2014).
- Avezov, E., Frenkel, Z., Ehrlich, M., Herscovics, A., Lederkremer, G. Z. Endoplasmic reticulum (ER) mannosidase I is compartmentalized and required for N-glycan trimming to Man5-6GlcNAc2 in glycoprotein ER-associated degradation. Mol Biol Cell. 19 (1), 216-225 (2008).
- Csutora, P., et al. Novel role for STIM1 as a trigger for calcium influx factor production. J Biol Chem. 283 (21), 14524-14531 (2008).
- Kilch, T., et al. Mutations of the Ca2+-sensing stromal interaction molecule STIM1 regulate Ca2+ influx by altered oligomerization of STIM1 and by destabilization of the Ca2+ channel Orai1. J Biol Chem. 288 (3), 1653-1664 (2013).
- Williams, R. T., et al. Stromal interaction molecule 1 (STIM1), a transmembrane protein with growth suppressor activity, contains an extracellular SAM domain modified by N-linked glycosylation. Biochim Biophys Acta. 1596 (1), 131-137 (2002).
- Mignen, O., Thompson, J. L., Shuttleworth, T. J. STIM1 regulates Ca2+ entry via arachidonate-regulated Ca2+-selective (ARC) channels without store depletion or translocation to the plasma membrane. J Physiol. 579 (Pt 3), 703-715 (2007).
- Choi, Y. J., Zhao, Y., Bhattacharya, M., Stathopulos, P. B. Structural perturbations induced by Asn131 and Asn171 glycosylation converge within the EFSAM core and enhance stromal interaction molecule-1 mediated store operated calcium entry. Biochim Biophys Acta. 1864 (6), 1054-1063 (2017).
- Davis, B. G., Lloyd, R. C., Jones, J. B. Controlled site-selective protein glycosylation for precise glycan structure-catalytic activity relationships. Bioorg Med Chem. 8 (7), 1527-1535 (2000).
- Gamblin, D. P., van Kasteren, S. I., Chalker, J. M., Davis, B. G. Chemical approaches to mapping the function of post-translational modifications. FEBS J. 275 (9), 1949-1959 (2008).
- Ehrt, S., Schnappinger, D. Isolation of plasmids from E. coli by alkaline lysis. Methods Mol Biol. 235, 75-78 (2003).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol Biol. 94 (3), 441-448 (1975).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Bell, D. J. Mass spectrometry. Methods Mol Biol. 244, 447-454 (2004).
- Domon, B., Aebersold, R. Mass spectrometry and protein analysis. Science. 312 (5771), 212-217 (2006).
- Farrow, N. A., et al. Backbone Dynamics of a Free and a Phosphopeptide-Complexed Src Homology-2 Domain Studied by N-15 Nmr Relaxation. Biochemistry. 33 (19), 5984-6003 (1994).
- Kay, L. E., Keifer, P., Saarinen, T. Pure Absorption Gradient Enhanced Heteronuclear Single Quantum Correlation Spectroscopy with Improved Sensitivity. Journal of the American Chemical Society. 114 (26), 10663-10665 (1992).
- Delaglio, F., et al. NMRPipe: a multidimensional spectral processing system based on UNIX pipes. J Biomol NMR. 6 (3), 277-293 (1995).
- Masse, J. E., Keller, R. AutoLink: automated sequential resonance assignment of biopolymers from NMR data by relative-hypothesis-prioritization-based simulated logic. J Magn Reson. 174 (1), 133-151 (2005).
- Monticelli, M., Ferro, T., Jaeken, J., Dos Reis Ferreira, V., Videira, P. A. Immunological aspects of congenital disorders of glycosylation (CDG): a review. J Inherit Metab Dis. 39 (6), 765-780 (2016).
- An, H. J., Kronewitter, S. R., de Leoz, M. L., Lebrilla, C. B. Glycomics and disease markers. Curr Opin Chem Biol. 13 (5-6), 601-607 (2009).
- Wani, W. Y., Chatham, J. C., Darley-Usmar, V., McMahon, L. L., Zhang, J. O-GlcNAcylation and neurodegeneration. Brain Res Bull. , (2016).
- Haines, A. M., Tobe, S. S., Kobus, H. J., Linacre, A. Properties of nucleic acid staining dyes used in gel electrophoresis. Electrophoresis. 36 (6), 941-944 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved