JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
재조합 형 단백질의 생체 외에서 사이트별 Glycosylation에 대 한 대상 시스테인 Thiols
요약
당화 단백질의 생화학 및 구조 분석 균질 샘플 상대적으로 많은 양의 필요합니다. 여기, 우리는 효율적인 화학 반응 Cys thiols를 대상으로 박테리아에서 정화 하는 재조합 형 단백질의 사이트별 glycosylation 방법 제시.
초록
Stromal 상호 작용 분자-1 (STIM1)은-내가 막 횡단 단백질 바인딩과 그물 (ER) 및 플라즈마 막 (오후)에 위치 해 있습니다. ER-상주 STIM1 오후 Orai1 채널 알려져 주 캘리포니아2 + 신호 과정 면역 응답을 구동 하는 운영된 칼슘 (캘리포니아2 +) 항목을 저장 하는 과정에서의 활동을 통제 한다. STIM1 Ca2 + 감지의 도메인 내에서 분자 두 luminal Asn 사이트에 닢 Nglycosylation를 겪 습. 그러나,는 생화학, 생물, 그리고 N-당화 STIM1의 구조 생물학적 효과 쉽게 균질 N-당화 단백질의 높은 수준을 얻을 수 없음 인해 최근까지 제대로 이해 했다. 여기, 우리가 시험관에 화학 접근의 단백질 구조와 메커니즘에 Nglycosylation의 기본 효과 이해 하는 데 적용 하는 특정 단백질 사이트로 포도 moieties 부착 구현을 설명 합니다. 우리 모두 효율성의 수정 뿐만 아니라 단일 샘플 포도 당 첨부 파일의 구조 결과 평가 솔루션 핵 자기 공명 분광학을 사용 하 여. 이 이렇게 자연에서 발견 하는 무수 한 당화 단백질 연구를 쉽게 적응 수 있습니다.
서문
운영된 칼슘 (캘리포니아2 +) 저장 항목 (SOCE)는 면역 세포는 cytosol로 세포 외 공간에서 캘리포니아2 + 을 차지 하는 주요 통로 이다. T 세포, T 세포 수용 체 (오후) 원형질 막에 있는 항 원 단백질 tyrosine kinases ( 1,2,3검토)을 활성화 하는 바인딩합니다. 인 산화 폭포 phospholipase-γ (PLCγ)는 이후 diacylglycerol 및 이노 시 톨 1,4,5-trisphosphate (IP3에 막 phosphatidylinositol 4, 5 bisphosphate (핍2)의 가수분해를 중재의 활성화로 연결 ). IP3 은 응급실에서 농도 기온 변화도 아래로 흐름 IP3 수용 체 (IP3R) 바인딩과 그물 (ER)에 그로 인하여이 수용 체 수로 열고 허용 캘리포니아2 + 바인딩하는 작은 diffusible 메신저 cytosol ( 4에서검토)에 루멘. 수용 체 G 단백질 결합 및 다양 한 기타 고르기 및 비 고르기 셀 유형 리드에에서 티로신 키 니 아 제 수용 체에서 IP3 의 동일한 생산 및 IP3Rs의 활성화 신호.
유한 캘리포니아2 + 의 저장 용량은 응급실, IP3인-중재 릴리스 및 cytosolic 캘리포니아2 + 에서 결과 증가 일시적;만 그러나, 응급실 luminal 캘리포니아2 + 이 고갈 뿌리깊은 stromal 상호 작용 분자-1 (STIM1), 유형 효과-난 막 횡단 (TM) 단백질은 주로 응급실 막 5,,67에 발견. STIM1 루멘 지향 Ca2 + 감지 도메인을 EF-손 쌍과 마른 α-주제 (EFSAM) 구성 포함 되어 있습니다. Cytosolic 지향 코일 코일 도메인 3 개 ( 8에서 검토) 단일 TM 도메인에서 EFSAM에서 분리 된다. ER luminal 캘리포니아2 + 고갈, 시 EFSAM TM 및 코일 코일 도메인 10의 구조상 재배열을 일으키는 원인이 되는 불안정 결합 oligomerization 7,9 을 겪 습. 이러한 구조 변화 응급실 오후 접속점 11,12,13,14 오후 phosphoinositides 15, 와 상호 작용을 통해 STIM1의 트랩에 달 하다 16 및 Orai1 소 단위 17,18. Orai1 단백질은 조립 형태로 캘리포니아2 + 채널 19,20,,2122는 오후 소 단위. ER-오후 접합에서 STIM1 Orai1 상호 작용 촉진는 오픈 캘리포니아2 + 릴리스 활성화 캘리포니아2 + (CRAC) 채널 구조의 높은 농도에서 cytosol에 캘리포니아2 + 의 움직임을 가능 하 게 합니다 세포 외 공간입니다. 면역 세포에는 지속적인된 cytosolic 캘리포니아2 + 고도 CRAC 채널을 통해 유도 캘리포니아2 +-calmodulin/calcineurin 종속 dephosphorylation 이후 핵을 입력 하면 활성화 된 T-세포의 핵 요인의 고 T 세포 활성화 1,3를 홍보 하는 유전자의 transcriptional 규칙을 시작 합니다. STIM1 23,24 주 작동 근 유도 응급실 luminal 캘리포니아2 + 고갈 통해 결과 지속적인된 cytosolic 캘리포니아2 + 고도로 CRAC 채널 활성화의 과정은 공동으로 SOCE 25불린다. T-세포에 SOCE의 중요 한 역할은 STIM1와 Orai1에서 상속 변이 심한 결합 된 면역 결핍 증후군 3,,1926, 를 발생할 수 있습니다 입증 하는 연구에 의해 분명 하다 27. 정식 EF-손에서 궁극적으로 자체 협회 불안 결합 7, 로 이어지는 Ca2 + 조정의 손실을 통해 응급실 luminal 캘리포니아2 + 고갈 감지 후 SOCE를 시작 하는 EFSAM 28,29.
Glycosylation 공유 첨부 파일 올리고 당 구조, 일컬어 glycans, ER 및 Golgi ( 30,,3233검토) 다양 한 생 합성 단계를 통해의 처리입니다. 진핵생물에서 glycosylation의 두 가지 주된 유형이 있다: N-연결 된 및 O-연결, 특정 아미노산 및 atom 가교 결합에 따라. N-glycosylation에서 glycans, Asn의 사이드 체인 아 미드에 연결 그리고 개시 단계 응급실에서 발생 하는 대부분의 경우에는 polypeptide 사슬 루멘 34로 이동. N-glycosylation의 첫 번째 단계는 포도 당 (Glc)만 노 오 스 (남자), 및 N-acetylglucosamine (GlcNAc) (예: Glc3남자9GlcNAc2)는 ER에서 만들어진 14 설탕 코어 구조 이전 oligosaccharyltransferase 35,36여 막 지질. 분열 또는 포도 당 잔류물의 양도 등의 더 단계는 특정 glycosidases와 glycosyltransferases 응급실에서 촉매. 응급실을 두고는 골으로 이동 하는 일부 단백질은 처리 37추가 될 수 있습니다. Oglycosylation Ser 또는 Thr 잔류물의 사이드 체인 수 산 기 그룹에 일반적으로 glycans의 추가를 참조 하 고이 수정 골 복잡 한 33,34에서 전적으로 발생 합니다. Nacetylglucosamine, fucose, 갈 락 토스, 구성 될 수 있는 여러 오-glycan 구조 이며 각 단 당 류와 sialic acid 33순차적으로 추가.
아니 특정 순서 Oglycosylation의 많은 종류에 대 한 사전 요구 사항 확인 되었습니다 동안 일반적인 합의 순서 N와 연결 되었습니다-수정 연결: Asn-X-Ser/Thr/Cys, X 어떤 아미노산을 될 수 있는 프로 33제외 하 고. STIM1 EFSAM 두 이러한 합의 N-glycosylation 사이트 포함: Asn131-Trp132-Thr133와 Asn171-Thr172-Thr173. 실제로, 이전 연구 EFSAM Asn131 및 Asn171 38,39,,4041에서 포유류 세포에서 N-당화 수 나타났습니다. 그러나, 이전 연구의 SOCE에서 Nglycosylation의 결과 되었다 합동, 제안 억제, potentiated 또는 SOCE 활성화 38, 에이 포스트 번역 상 수정에 의해 영향을 주지 않습니다"외부 참조" = > 39,,4041. 따라서, EFSAM Nglycosylation의 기본, 생화학, 생물 및 구조 결과 대 한 연구는이 수정의 규제 효과 이해 하는 중요 한. 이러한 생체 외에서 실험에 균질 단백질의 높은 수준에 대 한 요구 사항으로 인해 포도 당 moieties EFSAM covalently 연결할 사이트 선택적 접근 방식을 적용 했다. 흥미롭게도, Asn131 및 Asn171 glycosylation EFSAM 코어 내 수렴을 홍보 STIM1이 중재 SOCE 42생물 속성 강화 구조 변경 발생 합니다.
Cys thiols glycosyl 그룹의 화학 첨부 파일 정액 작품 처음 시연 단백질 기능 43 , glycosylation의 사이트 효과 이해 하 고이 효소 무료로 접근의 유틸리티에 의해 잘 설립 되었습니다. , 44. 최근에 STIM1에 관하여 Asn131과 Asn171 잔류물 했다 Cys을 돌연변이 glucose-5-(methanethiosulfonate) [glucose-5-(MTS)] covalently 무료 thiols 42에 포도 당을 연결 하는 데 사용 되었다. 여기, 우리 뿐만 아니라 mutagenesis 통합 수정에 대 한 사이트 특정 Cys의 잔류물을 사용 하지만 빠르게 수정 효율성 및 구조적 평가 솔루션 핵 자기 공명 (NMR) 분광학은 또한 적용 됩니다이 이렇게 설명 섭은 glycosylation 결과로입니다. 특히,이 일반적인 방법론 중 O-의 효과 연구에 쉽게 적응 또는 N-glycosylation의 recombinantly 단백질을 생산.
프로토콜
1. 중 합 효소 연쇄 반응 (PCR)-세균 애완 동물-28a 식 벡터에 Cys의 설립에 대 한 사이트 이동 mutagenesis 중재.
- 260에서 0.020 (μ g/mL) cm -1의 자외선 (UV) 소멸 계수를 사용 하 여 애완 동물-28a 벡터 (즉, 두 배 좌초 된 DNA)의 농도 결정 nm.
- 합성 각 Cys 돌연변이 대 한 보완 돌연변이 뇌관의 쌍 난) 이전에 1 루 불일치 및 15 뉴클레오티드 보완 후 서식 파일에 서식 파일을 보완 15 뉴클레오티드의 최소 있다는 마지막 기본 불일치, ii) 45 뉴클레오티드, 및 iii 총 뇌관 길이 초과 하지 않는) 구 아닌 또는 시 토 신은 각 뇌관 (표 1)의 첫 번째 및 마지막 뉴클레오티드 위치에 위치. 뇌관 종합 0.025 μmol 규모 및 카트리지 정화를 사용 하 여 수행 됩니다 확인 하십시오.
- 고 충실도 DNA 중 합 효소를 사용 하 여 두 개의 20 µ L PCR 반응 혼합물을 설정: 앞으로 뇌관과 두 번째가지고 있는 역방향 뇌관을 포함. 1.5 m m MgCl 2, 0.2 m m dNTPs, 0.5 μ M 뇌관, 0.4 μ DMSO, 1 x PCR 버퍼의 최종 농도 포함 하는 각 혼합물 준비 1.25 ng/μ 템플릿 DNA, 0.02 U/μ 고 충실도 DNA 중 합 효소.
- 열 3 단계 프로토콜을 사용 하 여 별도 혼합물을 주기: 98 ° C 30에 대 한 s (변성 시키기), 53-56 ° C 30에 대 한 s (어 닐 링), 30 s kilobase(kb) -1 (확장) 서식 파일 DNA의 72 ° C. 5 주기 위한 온도 프로그램을 반복 하 고 추가 7.5 분에 대 한 최종 72 ° C 확장 단계
- 별도 튜브에 앞으로 역 뇌관으로 초기 PCR 후 단일 튜브 (즉 40 μ 총)으로 제품을 결합 하 고 계속 1.4 단계에서 설명한 대로 동일한 자전거 매개 변수를 사용 하 여 추가 20 사이클에 대 한 PCR 반응.
- 1% (w/v) agarose에 PCR 반응 혼합물의 electrophorese 15 μ 젤 0.5 x Tris, 아세트산, 에틸렌 diamine tetra 아세트산 (EDTA) 실행 버퍼 (태)을 사용 하 여. 컨트롤 템플릿 하지 PCR에 의해 증폭 된 DNA의 상응 하는 금액 및 마커 밴드 모두 큰 고 예상된 PCR 제품의 크기 보다는 더 적은 포함 하는 참조 DNA 사다리의 약 수를 electrophorese.
- 40 분 120 V에서 전기 이동 법, 후 잠수함 물 0.5 μ g/mL ethidium 평범한 사람 및 실 온에서 30 분 동안 동요에에서 젤. 전체 길이 서식 파일은 증폭 되었다 돌연변이 뇌관에 의해 증가으로 UV 빛에서 컨트롤 템플릿 밴드에 비해 증폭된 밴드의 상대 ethidium 평범한 사람 형광 강도 확인 (302 nm).
- 아무 증폭 명백한 경우 0.5 ° C 증가 53-56 ° C 온도 범위에서 어 닐 링 온도 조정 후 PCR을 반복.
- 돌연변이 뇌관에 의해 템플릿의 증폭의 확인, 치료 DpnI 제한 효소 소화 methylated 템플릿 DNA PCR 반응 혼합물의 나머지 ~ 25 μ. DpnI를 사용 하 여 25 μ PCR 반응 혼합물 및 1 × DpnI 반응 버퍼의 마지막 농도 0.5 µ L (10 단위)에서. 2.5 h 37 ° c.에 대 한 품 어
- 열 100 µ L 소화 혼합물의 5 ~ 10 μ 충격 1.75 mL microcentrifuge 튜브에 유능한 DH5α Esherichia 대장균 세포 추가 템플릿 소화, 다음. 60 분에 대 한 얼음에 세포 DNA 혼합물을 품 어
- 열 충격 45 42 ° C에서 microcentrifuge 튜브에 세포 DNA 혼합물 건조 열 블록에 s. 3 분 동안 얼음에 혼합물, 잠복기 후 실내 온도 Luria Bertani 국물 (파운드)의 900 μ 셀 추가 하 고 총 세포 현 탁 액 살 균 14 mL 라운드-하단 튜브로 전송.
- 190 rpm에서 일정 한 동요와 90 분 동안 37 ° C에 세포 현 탁 액을 품 어.
- 이후, 세포 현 탁 액 1.75 mL microcentrifuge 튜브 및 실 온에서 5 분 동안 10000 x g에서 원심 분리기로 다시 전송.
- 원심, 후는 상쾌한의 900 μ를 제거 하 고 부드러운 pipetting 파운드의 나머지 100 μ에 의해 세균성 세포 resuspend
- 전송 식 벡터 (즉 60 μ g/mLKanamycin)에 대 한 선택은 항생제를 포함 하는 파운드-한 천 격판덮개에 결과 집중된 세포 현 탁 액. Aseptically 한 천 격판덮개에 균등 하 게 정지를 확산 하 고 37 ~ 16 h에 대 한 품 어 ° c.
- 다음 날, antiobiotic 선택 압력 (예: 60 μ g/mL 대)를 포함 하는 액체 LB의 5 mL에 접시에서 단일 식민지를 예방. 성장 37에 지속적인 동요를 37 ° C에서 하룻밤 액체 문화 ° c.
- 격리 및 45의 알칼리 성 세포의 용 해 절차 따라 상업적으로 사용할 수 있는 키트를 사용 하 여 대장균 세포에서 전파 된 플라스 미드 정화.
- 관심의 돌연변이 존재 하 고 적절 한 독서 프레임 46 플라스 미드 생어 DNA 연속 확인.
2. 15 BL21 ΔE3 대장균에 N 표시 된 단백질 식 통일.
참고: 다른 재조합 단백질 필요 다른 식을 조건. 다음은 인간 STIM1 EFSAM 단백질의 표현에 대 한 최적화 절차.
- BL21 ΔE3 codon (+) 열 충격 유능한 세포에 Cys 변이 (즉: 애완 동물-28a-EFSAM)을 품고 식 벡터를 변환 하 고 1.9-1.14 단계에 설명 된 대로 항생제 선택의 압력을 포함 하는 파운드-한 접시에 접시)와 다음 수정: 직접 원심 분리에 의해 microcentrifuge 튜브에 세포를 집중 하지 않아도 파운드-한 접시에 ~ 1000 μ 총 세포 현 탁 액에서 약 150 μ 수 접시.
- 다음 날, aseptically 200 mL 삼각 플라스 크를 포함 하는 적절 한 항생제 (예: 60 μ g/mL 대 애완 동물-28a-EFSAM에 대 한) 보충 파운드의 20 mL에 단일 식민지 전송. 이 액체 시 동기 문화 하룻밤 (즉 ~ 16 h) 37 ° C에서 일정 한 동요에 성장 ~ 190 rpm.
- M9 준비 단계 2.2로 같은 날 15 압력가 마로 소독 하 여 N 표시 된 단백질 표정 매체 1 L m 9의 4 L 삼각 플라스 크에 소금 (42 m m 나 2 HPO 4, 22 mM KH 2 포 4, 8.6 m m NaCl, pH 7.4)를 버퍼. 일단, 20% (w/v) D-포도 당, 1 M CaCl 2, 1 M 티 아민, 1 M MgSO 4, 1 mg/mL biotin, 0.2 g/mL 15 N-NH 4 Cl의 혼합물 1 L 살 균 M9 소금 솔루션으로 0.2 μ m의 무 균 주사기 필터를 통해 필터링 되도록는 이러한 구성의 최종 농도 0.2% (w/v) D-포도 당, 100 μ M CaCl 2, 50 μ M 티 아민, 1mm MgSO 4, 1 μ g/mL biotin과 1 mg/mL 15 N-NH 4 cl.
- 다음 날, aseptically 50 mL 살 균 원뿔 튜브와 작은 셀을 15 분 동안 2400 × g에서 원심 분리기로 20 mL 하룻밤 액체 시 동기 문화를 전송.
- 파운드 매체 decanting, 후 resuspend M9 최소 매체의 10 mL에 결과 셀 펠 릿 및 항생제 (예: 60 μ g/mL 대)와 M9 최소 매체의 1 L에 resuspended 펠 릿 혼합 전송.
- 성장 포함 하는 37 ° C에서 600 nm (OD600)에 도달에서 광학 밀도까지 떨고 ~ 190 rpm 상수 세균 스타터 문화 M9 최소 매체의 1 L ~0.6-0.8.
- Specfified OD600 범위에 도달 하면 추가 이소프로필 β-D-1-thiogalactopyranoside 단백질 표정 유도 (IPTG)의 200 μ M.
- IPTG 추가 후 ~ 190 rpm ~ 16 h (즉, 하룻밤)에 대 한 지속적인 동요와 주위 온도에 단백질 식 세포를 배양 하는 것을 계속.
- 다음 날, 수확 ~ 10000 × g, 30 분에 4 ° C에서 원심 분리 하 여 박테리아
- LB를 가만히 따르다와 50 mL 원뿔 튜브로 셀 펠 릿을 전송. 정화까지-80 ° C에서 펠 릿 저장.
3. 대장균에서 재조합 형 단백질의 정화.
참고: 다른 재조합 단백질 별개 정화 절차 필요. 다음은 6 & # 215에 대 한 프로토콜; 애완 동물-28a 구문에서 표현 된 포함 시체에서 그의 태그 EFSAM 정화.
- 수동으로 6 M guanidine-HCl, 20 mM Tris HCl (pH 8)에 냉동된 세균성 세포 pellet 균질 및 5mm β-mercaptoethanol 동력된 10 mL 전송 피 펫을 사용 하 여. Guanidine-HCl이이 단계에 대 한 젖은 셀 펠 릿의 5 mL 당 약 40 mL를 추가.
- 다음는 90 분 부 화 교 잡 오븐에 일정 회전 주위 온도에 원심 ~ 15000 × g, 수용 성 단백질에서 불용 성 세포 파편 (즉 펠 릿)을 40 분 동안 8 ° C에 혼합물 혼합 (즉, 표면에 뜨는).
- 50% (v/v) Ni 2 +의 추가 750 µ L-nitrilotriacetic 산 agarose 구슬 슬러리는 명확히 lysate와 교 잡 오븐에 반전으로 실 온에서 또 다른 90 분 동안 품 어.
- 이후, 6 × 태그 그의 단백질을 중력 흐름 단백질 정화 열에서 agarose 구슬 수집 하 여 Ni 2 +에 바인딩된 캡처합니다. Lysate 3.5 단계로 이동 하기 전에 완전히 열을 통해 흐름을 허용.
- 수집된 구슬 6 M 요소, 20 mM Tris HCl pH 8과 5 m m β-mercaptoethanol의 10 mL로 세 번 세척. 전체 10 mL 각 후속 10 mL 이전 열 통과 확인 워시
- 6 M 요소, 20 mM Tris HCl pH 8를 사용 하 여 2 mL 분수의 시리즈에 있는 단백질을 elute 300mm 이미, 그리고 5mm β-mercaptoethanol 분수 사이 90 s 보육 시간. 전체 2 mL 각 후속 차입 단계 전에 열 통과 확인 하십시오.
- 가이 단계에서 관심사의 단백질은 Coomassie 파란 얼룩이 나트륨 라우릴 황산 polyacrylamide 젤 전기 이동 법 (SDS-PAGE) 47 Laemmli 방법을 사용 하 여 의해 eluted 분수에 확인. 둘 다 표준 분자량 마커 밴드에 대 한 단백질 크기, 양 및 순수성을 비교 하 여 평가 및 보다 적게 보다는 예상된 분자량 보다 큰 관심사의 단백질의.
- 컷오프 3500 다 분자 무게와 투 석 막에 eluted 단백질 분수 수영장 및 4 ° C에서 1 L refolding 버퍼 (트리 스, 300 m m NaCl, 1 mM DTT, 5mm CaCl 2, pH 8 m 20 m)에서 품 어 하룻밤 동안 버퍼는 자석과 의해 자극 되는 c 활동가.
- ~ 16 h refolding 시간 후 ~ 1 투 석 가방에 직접 단백질의 밀리 그램 당 트 롬 빈의 U를 추가 하 고 추가 ~ 24 h. 4 ° C에서 품 어
- 는 Coomassie 파란 얼룩이 ~ 15 μ 단백질 aliquots 트 롬 빈과 보육 전후 투 석 가방에서 가져온 polyacrylamide 젤 (SDS 페이지)를 사용 하 여 변성 시키기에 electrophoresed는의 지에 의해 그의 태그 분열 6 ×의 범위를 확인 Laemmli 47의 방법입니다. 마이그레이션에 ~ 2 kDa 변화 그의 태그 쪼개진된 6 ×의 분자량에 해당 관찰, 3.11; 단계로 계속 경우 일부 소화 되지 않은 단백질 남아 있다 Coomassie 파란 얼룩에 의해 감지 되, 투 석 가방에 직접 단백질의 밀리 그램 당 트 롬 빈의 ~0.2 U를 추가 하 고 추가 ~ 24 h. 4 ° C에서 품 어
- 더 사용 크기 또는 이온 교환 크로마토그래피는 단백질 정화. EFSAM의 음이온 교환 크로마토그래피, 투 석 가방과 집중에서 단백질 솔루션 제거 ~는 10000 Da 분자량 컷오프로 한 원심 집중 장치를 사용 하 여 사진. 그 후, 다시 희석 솔루션 ~ 20-fold NaCl 무료 버퍼 (20 mM Tris, 5mm CaCl 2, 1mm DTT, pH 8)에.
- Prepacked 음이온 교환 열 단계 3.11에서에서 설명한 NaCl 무료 버퍼의 10 열 볼륨을 equilibrate. Equilibrate 로드 luer 잠금 주사기 dropwise 방식과 열 종료 솔루션의 꾸준한 흐름을 일으키는 원인이 되는 피하 주사기 압력 열을 통해 솔루션을 추진 하 여 아무 공기 방울을 포함 하는 버퍼를 사용 하 여. (예: 4 급 암모늄 기능 그룹으로 가교 된 agarose) 강한 음이온 교환기를 사용 하 여.
- NaCl 무료 (단계 3.11) 버퍼 열에 희석 단계 3.12에서에서 설명한 단백질 솔루션 로드.
- 그라데이션에 단백질을 elute [즉, 0-60% (v/v)] NaCl 증가의 버퍼 (20 mM Tris, 1 M NaCl, 5mm CaCl 2, 1mm DTT, pH 8) 2-펌프 고속 단백질 액체 착 색 인쇄기 (FPLC) 시스템을 사용 하 여. FPLC 시스템 ~1-1.5 mL 분수를 수집 하 고 모니터링 UV 280 nm 흡 광도 사용 하 여 단백질 차입 프로필을 설정 하 고 흐름 속도 0.5 mL/분
- 차입 봉우리와 분수 뿐만 아니라 단백질 순도 Coomassie 파란 얼룩이 SDS 페이지 젤 Laemmli 47의 방법을 사용 하 여 관심사의 단백질에 포함 된 식별.
- 풀 분수 보여주는 > 95% (즉 분수 Coomassie 파란 얼룩이 젤에만 단일 단백질 밴드를 표시로 찍은) 투 석 가방 및 투 석 단계 3.8에서에서 설명한 대로 의해 관심의 실험적인 버퍼 교환으로.
4. 투 석 하 여 단백질을 포도 당-5-MTS 화학 부착.
- 준비 55 m m a N-(β-D-glucopyranosyl)-N의 재고 솔루션 '-[2-methanethiosulfonyl) 에틸] 10 mg의 100% (v/v) DMSO의 500 μ에 화합물을 용 해 하 여 우 레 아 (포도 당-5-MTS). 사용 하지 않는 포도 당-5-MTS-20에서 DMSO에서 solubilized 저장 ° c.
- 준비 수정 1 리터에 ~ 60 μ M 단백질의 dialyzing 1.5 mL 수정에 대 한 단백질 견본 버퍼 20mm MOPS, 150 mM NaCl, 5mm CaCl 2와 0.1 m m TCEP, pH 8.3의 구성. 사용 하는 투 석 막 분자량 컷오프는 수정 되 고 단백질의 크기 보다 작은 (예: 17500 ~ 다 EFSAM에 대 한 3500 다 구분 사용).
- 후 24 h 4 ° C에서 microcentrifuge 튜브로 투 석 가방에서 샘플을 전송. 2mm의 최종 농도 DMSO solubilized 포도 당-5-MTS 추가.
- 주위 온도에서 1 h에 대 한 어둠 속에서 샘플을 품 어. 1 시간 잠복기 동안 혼합 솔루션 튜브의 부드러운 드려서 10 분 마다
- 이후에, 다시 4.2 또는 원심 한 단계에서 설명한 대로 4 ° C에서 투 석 하 여 아무 환 원제를 포함 하는 최종 실험 버퍼에 단백질 교환. 적용 절차에 대 한 집중 ~1.5 mL 단백질 샘플을 < 0.5 mL 이후에 실험 버퍼와 같은 집중에 희석. 반복이 농도 희석 단계 2 추가 번 총 exchange는 최소 30 × 30 × 30 = 27,000-fold. EFSAM, 20 mM Tris, 150 mM NaCl, 5mm CaCl 2, 실험적인 버퍼 pH 7.5 사용.
- 투 석 또는 한 exchange 25 m m 염화 중 탄산염 또는 25 mM 암모늄 아세테이트로 각각 4.2와 4.5, 단계에서 설명한 대로 의해 분무 이온화 질량 분석에 대 한 샘플을 준비 합니다. 투를 사용 하 여, 모든 잔여 NaCl와 CaCl 2 소금 제거를 적어도 세 번을 교환 확인.
- 정확한 질량을 결정 (예: ± 1 다) 분무 이온화를 사용 하 여 관심사의 단백질의 대량 분석 48 , 49. Methanethiosulfonate 화학 281.3 다 단백질에 추가를 통해 Cys thiol 각 공유 포도 당 뿐만 아니라 기대 질량 (360.4 다 포도 당 5 MTS에 대 한 추가 및 공유 하는 동안 그룹 2 떠나 그래서 채널 3 79.1 다 빼기 첨부 파일).
5. Modif 솔루션 NMR 평가ication 효율성과 구조 섭.
- 단백질은 > 포도 당 첨부 파일 및 최종 버퍼 교환 후 100 μ M. EFSAM에 대 한 추정 단백질 농도 UV 소멸 계수를 사용 하 여 280에서 1.54 (mg mL - 1) cm - 1 nm.
- 메우는 및 펄스 교정 및 10% (v/v) D 4,4-dimethyl-4-silapentane-1-sulfonic 산 (DSS)의 보충 60 μ M와 단백질 해결책 2 O 신호 잠금에 대 한. 높은 신호-잡음 사용 주파수 일치 5mm NMR 튜브에 600 μ 샘플, 트리플 공명 HCN 극저온 프로브를 갖춘 최소 600mhz 분석기에 삽입.
- 이전 상세한 50 , 51 온도, 1 H와 15 N 청소 폭, 변이 및 증가에서 표준 1 H-15 N HSQC 스펙트럼 수집 특정 샘플에 대 한 적합 한 설정입니다. EFSAM 스펙트럼, 사용 20 ° C, 256 1 H 과도, 64 15 N 차원 증가 1 H 15 N 그런 후 폭 8, 000와 1800 헤르쯔, 각각 설정.
- 당화 단백질 스펙트럼의 인수에 따라 추가 dithiothreitol (DTT) NMR 샘플 15 m m의 최종 농도를 1 M 주식에서. DTT 이황화 중재 첨부의 감소에 의해 단백질에서 포도 당 moiety를 제거 합니다.
- 두 번째 1 H-15 N HSQC 수정 효율성 및 구조적 섭 포도 당 첨부 파일에 의해 발생을 평가 하기 위해 참조 스펙트럼 제공이 감소/수정 되지 않은 조건 하에서 취득.
- 이전 52 자세한 NMRPipe를 사용 하 여 NMR 데이터 처리. 최소한 처리 데이터 변환, 단계적으로, 용 매 억제, 푸리에 변환 및 스펙트럼의 초기 시각화 포함 되어 있는지 확인 하십시오.
- 아 미드 피크 농도 및 카라 53에 NEASY 플러그인을 사용 하 여 수정 및 감소 된 스펙트럼에 화학 변화 값을 측정 하 여 평가 수정 효율성. 모두는 포도 당에 연결 하 고 스펙트럼을 감소 Cys 아 미드의 피크 강도 평가를 확인 합니다. Cys 아 미드 두 스펙트럼에 안정적으로 있을 수 없습니다, 경우는 Cys에 인접 한 잔류물의 농도 사용 하 여 한 판독으로.
- Cys 감소 (즉, DTT 취급) 스펙트럼에서 아 미드의 강도 나눈 Cys 수정 스펙트럼에서 아 미드의 농도로 효율 계산 100 곱한:
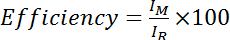 , 어디 내가 M Cys 수정 스펙트럼에 아 미드의 농도 이며 나 R Cys 감소 스펙트럼에 아 미드의 농도. 또는, 여러 아 미드 봉우리 위에 평균 효율 평가:
, 어디 내가 M Cys 수정 스펙트럼에 아 미드의 농도 이며 나 R Cys 감소 스펙트럼에 아 미드의 농도. 또는, 여러 아 미드 봉우리 위에 평균 효율 평가:
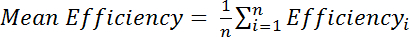 효율성 i가 별도로 결정된 효율성 각 계산, 잔류물, 나, 그리고 n 계산에 사용 하는 잔류물의 총 수입니다.
효율성 i가 별도로 결정된 효율성 각 계산, 잔류물, 나, 그리고 n 계산에 사용 하는 잔류물의 총 수입니다. - 계산 화학 변화 차이 두 스펙트럼 15 N과 각 피크의 1 H 치수에서 관찰 하 고 더 큰 15 N 화학 변화 범위 사용에 대 한 정상화에서 화학 이동 섭 (CSP)는 다음 방정식:
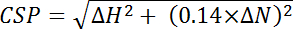 , 어디 ΔH 양성자 차원에 ppm 변화 이며 ΔN 질소 차원에서 ppm 변화.
, 어디 ΔH 양성자 차원에 ppm 변화 이며 ΔN 질소 차원에서 ppm 변화.
결과
이 방법의 첫 번째 단계 하려면 포도 당-5-MTS. EFSAM를 사용 하 여 수정할 수 있는 Cys의 잔류물을 후보 glycosylation 잔류물의 mutagenesis 아무 특별 한 고려 사항 이전에 만들어질 필요가 없는 생 Cys 잔류물에는 mutagenesis입니다. 그러나, 네이티브 Cys 잔류물 설명된 화학을 수행 하기 전에 수정 불가능 잔류물을 변경 해야 합니다. 최소한 기본 구조 효과, 우리 관심사의 단백질의 글?...
토론
단백질 glycosylation 설탕 covalently 주로 아미노산 사이드 체인 관계를 통해 polypeptides에 연결 된 포스트 번역 상 수정입니다. 많은 포유류 단백질의 50%는 당화 54, 당화 단백질 수 이후에 있는 다양 한 바이오 바인딩 선호도 변경에서 효과, 단백질 폴딩, 채널 활동을 변경, 대상에 영향을 미치는 저하 및 셀룰러 (33에서 검토 한 결과) 몇 가지 이름을, 인신 매매에 대 한...
감사의 말
이 연구는 자연과학 및 공학 연구 위원회 캐나다의 (P.B.S.에 05239), 캐나다 재단에 의해 지원 되었다 혁신/온타리오 연구 기금 (P.B.S.), 전립선 암 싸 워 재단-Telus 타고 아빠 (P.B.S.) 하 고 온타리오에 대 한 (Y.J.C. N.S.)를 대학원 장학입니다.
자료
| Name | Company | Catalog Number | Comments |
| Phusion DNA Polymerase | Thermo Fisher Scientific | F530S | Use in step 1.3. |
| Generuler 1kb DNA Ladder | Thermo Fisher Scientific | FERSM1163 | Use in step 1.6. |
| DpnI Restriction Enzyme | New England Biolabs, Inc. | R0176 | Use in step 1.8. |
| Presto Mini Plasmid Kit | GeneAid, Inc. | PDH300 | Use in step 1.16. |
| BL21 DE3 codon (+) E. coli | Agilent Technologies, Inc. | 230280 | Use in step 2.1. |
| DH5a E. coli | Invitrogen, Inc. | 18265017 | Use in step 1.9. |
| 0.22 mm Syringe Filter | Millipore, Inc. | SLGV033RS | Use in step 2.3. |
| HisPur Ni2+-NTA Agarose Resin | Thermo Fisher Scientific | 88221 | Use in step 3.3. |
| 3,500 Da MWCO Dialysis Tubing | BioDesign, Inc. | D306 | Use in step 3.8, 3.16, 4.2, 4.5 and 4.6. |
| Bovine Thrombin | BioPharm Laboratories, Inc. | SKU91-055 | Use in step 3.9. |
| 5 mL HiTrap Q FF Anion Exchange Column | GE Healthcare, Inc. | 17-5156-01 | Use in step 3.11. |
| Glucose-5-MTS | Toronto Research Chemicals, Inc. | G441000 | Use in step 4.1. |
| Vivaspin 20 Ultrafiltration Centrifugal Concentrators | Sartorius, Inc. | VS2001 | Use in step 3.11, 4.2, 4.5 and 4.6. |
| PageRuler Unstained Broad Protein Ladder | Thermo Fisher Scientific | 26630 | Use in step 3.7, 3.10 and 3.15 |
| HiTrap Q FF Anion Exchange Column | GE Healthcare, Inc. | 17-5053-01 | Use in step 3.12. |
| AKTA Pure Fast Protein Liquid Chromatrography System | GE Healthcare, Inc. | 29018224 | Use in step 3.14. |
| 600 MHz Varian Inova NMR Spectrometer | Agilent Technologies, Inc. | Use in step 5.2 and 5.5. |
참고문헌
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Feske, S., Skolnik, E. Y., Prakriya, M. Ion channels and transporters in lymphocyte function and immunity. Nat Rev Immunol. 12 (7), 532-547 (2012).
- Shaw, P. J., Feske, S. Physiological and pathophysiological functions of SOCE in the immune system. Front Biosci (Elite Ed). 4, 2253-2268 (2012).
- Seo, M. D., Enomoto, M., Ishiyama, N., Stathopulos, P. B., Ikura, M. Structural insights into endoplasmic reticulum stored calcium regulation by inositol 1,4,5-trisphosphate and ryanodine receptors. Biochim Biophys Acta. 1853 (9), 1980-1991 (2015).
- Stathopulos, P. B., Ikura, M. Structural aspects of calcium-release activated calcium channel function. Channels (Austin). 7 (5), 344-353 (2013).
- Stathopulos, P. B., Ikura, M. Structure and function of endoplasmic reticulum STIM calcium sensors. Curr Top Membr. 71, 59-93 (2013).
- Stathopulos, P. B., Li, G. Y., Plevin, M. J., Ames, J. B., Ikura, M. Stored Ca2+ depletion-induced oligomerization of stromal interaction molecule 1 (STIM1) via the EF-SAM region: An initiation mechanism for capacitive Ca2+ entry. J Biol Chem. 281 (47), 35855-35862 (2006).
- Stathopulos, P. B., Ikura, M. Store operated calcium entry: From concept to structural mechanisms. Cell Calcium. , (2016).
- Stathopulos, P. B., Ikura, M. Structurally delineating stromal interaction molecules as the endoplasmic reticulum calcium sensors and regulators of calcium release-activated calcium entry. Immunol Rev. 231 (1), 113-131 (2009).
- Muik, M., et al. STIM1 couples to ORAI1 via an intramolecular transition into an extended conformation. EMBO J. 30 (9), 1678-1689 (2011).
- Luik, R. M., Wang, B., Prakriya, M., Wu, M. M., Lewis, R. S. Oligomerization of STIM1 couples ER calcium depletion to CRAC channel activation. Nature. 454 (7203), 538-542 (2008).
- Luik, R. M., Wu, M. M., Buchanan, J., Lewis, R. S. The elementary unit of store-operated Ca2+ entry: local activation of CRAC channels by STIM1 at ER-plasma membrane junctions. J Cell Biol. 174 (6), 815-825 (2006).
- Wu, M. M., Buchanan, J., Luik, R. M., Lewis, R. S. Ca2+ store depletion causes STIM1 to accumulate in ER regions closely associated with the plasma membrane. J Cell Biol. 174 (6), 803-813 (2006).
- Liou, J., Fivaz, M., Inoue, T., Meyer, T. Live-cell imaging reveals sequential oligomerization and local plasma membrane targeting of stromal interaction molecule 1 after Ca2+ store depletion. Proc Natl Acad Sci U S A. 104 (22), 9301-9306 (2007).
- Calloway, N., et al. Stimulated association of STIM1 and Orai1 is regulated by the balance of PtdIns(4,5)P(2) between distinct membrane pools. J Cell Sci. 124 (Pt 15), 2602-2610 (2011).
- Korzeniowski, M. K., et al. Dependence of STIM1/Orai1-mediated calcium entry on plasma membrane phosphoinositides. J Biol Chem. 284 (31), 21027-21035 (2009).
- Park, C. Y., et al. STIM1 clusters and activates CRAC channels via direct binding of a cytosolic domain to Orai1. Cell. 136 (5), 876-890 (2009).
- Yuan, J. P., et al. SOAR and the polybasic STIM1 domains gate and regulate Orai channels. Nat Cell Biol. 11 (3), 337-343 (2009).
- Feske, S., et al. A mutation in Orai1 causes immune deficiency by abrogating CRAC channel function. Nature. 441 (7090), 179-185 (2006).
- Prakriya, M., et al. Orai1 is an essential pore subunit of the CRAC channel. Nature. 443 (7108), 230-233 (2006).
- Vig, M., et al. CRACM1 multimers form the ion-selective pore of the CRAC channel. Curr Biol. 16 (20), 2073-2079 (2006).
- Vig, M., et al. CRACM1 is a plasma membrane protein essential for store-operated Ca2+ entry. Science. 312 (5777), 1220-1223 (2006).
- Liou, J., et al. STIM is a Ca2+ sensor essential for Ca2+-store-depletion-triggered Ca2+ influx. Curr Biol. 15 (13), 1235-1241 (2005).
- Roos, J., et al. STIM1, an essential and conserved component of store-operated Ca2+ channel function. J Cell Biol. 169 (3), 435-445 (2005).
- Putney, J. W. A model for receptor-regulated calcium entry. Cell Calcium. 7 (1), 1-12 (1986).
- Feske, S. CRAC channelopathies. Pflugers Arch. 460 (2), 417-435 (2010).
- Maus, M., et al. Missense mutation in immunodeficient patients shows the multifunctional roles of coiled-coil domain 3 (CC3) in STIM1 activation. Proc Natl Acad Sci U S A. 112 (19), 6206-6211 (2015).
- Stathopulos, P. B., Zheng, L., Li, G. Y., Plevin, M. J., Ikura, M. Structural and mechanistic insights into STIM1-mediated initiation of store-operated calcium entry. Cell. 135 (1), 110-122 (2008).
- Stathopulos, P. B., Ikura, M. Partial unfolding and oligomerization of stromal interaction molecules as an initiation mechanism of store operated calcium entry. Biochem Cell Biol. 88 (2), 175-183 (2010).
- Dennis, J. W., Lau, K. S., Demetriou, M., Nabi, I. R. Adaptive regulation at the cell surface by N-glycosylation. Traffic. 10 (11), 1569-1578 (2009).
- Nilsson, T., Au, C. E., Bergeron, J. J. Sorting out glycosylation enzymes in the Golgi apparatus. FEBS Lett. 583 (23), 3764-3769 (2009).
- Stanley, P. Golgi glycosylation. Cold Spring Harb Perspect Biol. 3 (4), (2011).
- Moremen, K. W., Tiemeyer, M., Nairn, A. V. Vertebrate protein glycosylation: diversity, synthesis and function. Nat Rev Mol Cell Biol. 13 (7), 448-462 (2012).
- Gerlach, J., Sharma, S., Leister, K., Joshi, L., Agostinis, P., Afshin, S. . Endoplasmic Reticulum Stress in Health and Disease. , 23-39 (2012).
- Pearse, B. R., Hebert, D. N. Lectin chaperones help direct the maturation of glycoproteins in the endoplasmic reticulum. Biochim Biophys Acta. 1803 (6), 684-693 (2010).
- Stanley, P., Sundaram, S. Rapid assays for lectin toxicity and binding changes that reflect altered glycosylation in mammalian cells. Curr Protoc Chem Biol. 6 (2), 117-133 (2014).
- Avezov, E., Frenkel, Z., Ehrlich, M., Herscovics, A., Lederkremer, G. Z. Endoplasmic reticulum (ER) mannosidase I is compartmentalized and required for N-glycan trimming to Man5-6GlcNAc2 in glycoprotein ER-associated degradation. Mol Biol Cell. 19 (1), 216-225 (2008).
- Csutora, P., et al. Novel role for STIM1 as a trigger for calcium influx factor production. J Biol Chem. 283 (21), 14524-14531 (2008).
- Kilch, T., et al. Mutations of the Ca2+-sensing stromal interaction molecule STIM1 regulate Ca2+ influx by altered oligomerization of STIM1 and by destabilization of the Ca2+ channel Orai1. J Biol Chem. 288 (3), 1653-1664 (2013).
- Williams, R. T., et al. Stromal interaction molecule 1 (STIM1), a transmembrane protein with growth suppressor activity, contains an extracellular SAM domain modified by N-linked glycosylation. Biochim Biophys Acta. 1596 (1), 131-137 (2002).
- Mignen, O., Thompson, J. L., Shuttleworth, T. J. STIM1 regulates Ca2+ entry via arachidonate-regulated Ca2+-selective (ARC) channels without store depletion or translocation to the plasma membrane. J Physiol. 579 (Pt 3), 703-715 (2007).
- Choi, Y. J., Zhao, Y., Bhattacharya, M., Stathopulos, P. B. Structural perturbations induced by Asn131 and Asn171 glycosylation converge within the EFSAM core and enhance stromal interaction molecule-1 mediated store operated calcium entry. Biochim Biophys Acta. 1864 (6), 1054-1063 (2017).
- Davis, B. G., Lloyd, R. C., Jones, J. B. Controlled site-selective protein glycosylation for precise glycan structure-catalytic activity relationships. Bioorg Med Chem. 8 (7), 1527-1535 (2000).
- Gamblin, D. P., van Kasteren, S. I., Chalker, J. M., Davis, B. G. Chemical approaches to mapping the function of post-translational modifications. FEBS J. 275 (9), 1949-1959 (2008).
- Ehrt, S., Schnappinger, D. Isolation of plasmids from E. coli by alkaline lysis. Methods Mol Biol. 235, 75-78 (2003).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol Biol. 94 (3), 441-448 (1975).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Bell, D. J. Mass spectrometry. Methods Mol Biol. 244, 447-454 (2004).
- Domon, B., Aebersold, R. Mass spectrometry and protein analysis. Science. 312 (5771), 212-217 (2006).
- Farrow, N. A., et al. Backbone Dynamics of a Free and a Phosphopeptide-Complexed Src Homology-2 Domain Studied by N-15 Nmr Relaxation. Biochemistry. 33 (19), 5984-6003 (1994).
- Kay, L. E., Keifer, P., Saarinen, T. Pure Absorption Gradient Enhanced Heteronuclear Single Quantum Correlation Spectroscopy with Improved Sensitivity. Journal of the American Chemical Society. 114 (26), 10663-10665 (1992).
- Delaglio, F., et al. NMRPipe: a multidimensional spectral processing system based on UNIX pipes. J Biomol NMR. 6 (3), 277-293 (1995).
- Masse, J. E., Keller, R. AutoLink: automated sequential resonance assignment of biopolymers from NMR data by relative-hypothesis-prioritization-based simulated logic. J Magn Reson. 174 (1), 133-151 (2005).
- Monticelli, M., Ferro, T., Jaeken, J., Dos Reis Ferreira, V., Videira, P. A. Immunological aspects of congenital disorders of glycosylation (CDG): a review. J Inherit Metab Dis. 39 (6), 765-780 (2016).
- An, H. J., Kronewitter, S. R., de Leoz, M. L., Lebrilla, C. B. Glycomics and disease markers. Curr Opin Chem Biol. 13 (5-6), 601-607 (2009).
- Wani, W. Y., Chatham, J. C., Darley-Usmar, V., McMahon, L. L., Zhang, J. O-GlcNAcylation and neurodegeneration. Brain Res Bull. , (2016).
- Haines, A. M., Tobe, S. S., Kobus, H. J., Linacre, A. Properties of nucleic acid staining dyes used in gel electrophoresis. Electrophoresis. 36 (6), 941-944 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유