Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Целеуказание тиолы цистеина в Vitro участкам гликозилирования рекомбинантных белков
В этой статье
Резюме
Анализ биохимических и структурных белков гликозилированного требуют относительно большое количество однородных образцов. Здесь мы представляем эффективный метод химического для конкретных участков гликозилирования рекомбинантных белков, очищенного от бактерий путем ориентации реактивной Cys тиолы.
Аннотация
Стромальные взаимодействия молекулы-1 (STIM1) — это тип-я белка трансмембранного расположен на эндоплазменный ретикулум (ER) и мембраны плазмы (PM). ER-житель STIM1 регулирует деятельность вечера Orai1 каналов в процесс, известный как хранить оперированных кальция (Ca2 +) запись, которая является главным Ca2 + сигнализации процесс, который управляет иммунного ответа. STIM1 проходит столб-поступательные N- гликозилирования на двух участках Люминал Asn в Ca2 + зондирования домена молекулы. Однако биохимических, биофизических, и структуру биологических эффектов N- гликозилированного STIM1 были плохо поняты до недавно из-за неспособности легко получить высокий уровень однородных N- гликозилированного белка. Здесь мы описываем осуществление в vitro химический подход, который придает глюкозы постановление определенных белков сайтов применимым к пониманию основной воздействия N- гликозилирования на механизм и структуры белков. С помощью решения ЯМР спектроскопии мы оценивать как эффективность модификации, а также структурные последствия глюкозы вложения с одного образца. Этот подход может быть легко адаптирована к изучения множества гликозилированного белков, обнаруженных в природе.
Введение
Хранить оперированных кальция (Ca2 +) вход (SOCE) является основным путь, по которому иммунные клетки take up Ca2 + от внеклеточного пространства в цитозоль. В Т-лимфоцитов Т-клеток рецепторов, расположенных на мембране плазмы (PM) связывать антигены, которые активируют белка тирозин киназ (обзор в 1,2,3). Фосфорилирование Каскад приводит к активации фосфолипазы γ (PLCγ), который впоследствии опосредует гидролиза мембраны фосфатидилинозитол 4,5-Бисфосфат (пункт2) в диацилглицерол и инозитол 1,4,5-trisphosphate (IP3 ). IP3 является небольшой diffusible messenger, который привязывается к IP3 рецепторов (IP3R) в эндоплазматический ретикулум (ER) тем самым открыв этот рецептор канал и разрешительные Ca2 + течь вниз градиент концентрации от ER просвет в цитозоле (обзор в 4). Рецептор сигнализации от G-белка в сочетании и тирозин киназы рецепторов в различных других типов свинца возбудимых и не возбудимых клеток же производства IP3 и активации IP3Rs.
Из-за ограниченных Ca2 + емкость ER, IP3-опосредованной выпуска и результирующая увеличение цитозольной Ca2 + только является несохраняемым; Однако, это истощение ER Люминал Ca2 + глубоко эффекты стромальные взаимодействия молекулы-1 (STIM1), тип-я трансмембранного (TM) белков чаще встречаются на ER мембраны 5,6,7. STIM1 содержит люмен ориентированный Ca2 + зондирования домен состоит из пары EF-рука и стерильные α-мотив (EFSAM). Три ориентированных на цитозольной биспиральных домены отделены от EFSAM одного домена ТМ (обзор в 8). После ER Люминал Ca2 + истощение EFSAM подвергается дестабилизации в сочетании олигомеризации 7,9 , который вызывает структурных перестроек ТМ и домены биспиральных 10. Эти структурные изменения кульминацией треппинга STIM1 ER-PM развязок 11,12,13,14 через взаимодействие с вечера фосфоинозитидов 15, 16 и Orai1 субблоков 17,18. Orai1 белки являются субблоков вечера, которые собираются форме Ca2 + каналы 19,20,21,22. STIM1-Orai1 взаимодействий на перекрестках ER-PM содействовать открытой Ca2 + релиз активирован Ca2 + (CRAC) канал конформации который позволяет движение Ca2 + в цитозоль от высоких концентраций внеклеточного пространства. В иммунных клеток, устойчивый цитозольной Ca2 + фасады каналам Крак побудить Ca2 +- Кальмодулин/кальциневрина зависимых дефосфорилирование ядерного фактора активированные Т-клеток, который впоследствии проникает в ядро и начинает регуляцию генов, поощрение Т-клеток активации 1,3. Процесс активации Крак канал STIM1 23,24 через агонист индуцированной ER Люминал Ca2 + истощения и результате устойчивой цитозольной Ca2 + высота собирательно именуются SOCE 25. Жизненно важную роль SOCE в Т-клеток проявляется исследования демонстрируют, что наследственные мутации в STIM1 и Orai1 может вызвать тяжелый комбинированный иммунодефицит синдромы 3,19,26, 27. EFSAM инициирует SOCE после зондирования ER-просветный Ca2 + истощение через потери Ca2 + координации на канонической EF-рука, в конечном счете приводит к дестабилизации в сочетании самостоятельной ассоциации 7, 28,29.
Гликозилирование является ковалентной привязанность и обработка олигосахарида структур, также известный как гликаны, через различные биосинтетических шаги в ER и Гольджи (обзор в 30,,32-33). Существует два преобладающего типа гликозилирования у эукариот: N-связанные и O-связаны, в зависимости от конкретных amino acid и преодоление связь атома. В N- гликозилирования, гликанов прикрепляются к боковой цепи Амида в АСЦ, и в большинстве случаев, шаг возбуждение возникает в ER как полипептидной цепи перемещается в Люмене 34. На первом шаге N- гликозилирования является передача четырнадцать сахара ядра структура, состоящая из глюкозы (КЗС), манноза (Man) и N- acetylglucosamine (GlcNAc) (т.е. Glc3человек9GlcNAc2) от ER мембранных липидов, 35,oligosaccharyltransferase36. Дальнейшие шаги, такие, как расщепление или передаче остатков глюкозы, в ER катализируемые конкретную основу и гликозидазы. Некоторые белки, которые оставляют ER и переехать в Гольджи можно дополнительно обработанных 37. O- гликозилирования относится с добавлением гликаны, обычно в боковой цепи гидроксильной группы Ser или чет остатков, и это изменение происходит полностью в комплекс Гольджи 33,34. Существует несколько O- glycan структур, которые могут быть сделаны N- acetylglucosamine, Фукоза, галактоза, и сиаловая кислота с каждым моносахаридов последовательно добавлены 33.
Хотя без конкретных последовательность была определена в качестве предпосылки для многих типов O- гликозилирования, общую последовательность консенсуса был связан с N-связанных изменений: Asn-X-Ser/Чет/КМС, где X может быть любой амино кислоты за исключением Pro 33. STIM1 EFSAM содержит два из этих консенсуса N- гликозилирования сайтов: Asn131-Trp132-Thr133 и Asn171-Thr172-Thr173. Действительно предыдущие исследования показали, что EFSAM может быть N- гликозилированного в клетках млекопитающих в Asn131 и Asn171, 3839,40,41. Однако, предыдущие исследования последствий N- гликозилирования на SOCE были несовместимы, предлагая подавлены, потенцированные или не влияет на этот столб-поступательные изменения на SOCE активации 38,= «внешней» > 3940,,41. Таким образом исследования на основные биофизические, биохимические и структурные последствия EFSAM N- гликозилирования жизненно важное значение для понимания нормативных последствий этой модификации. Из-за требования для высоких уровней однородных белков в этих экспериментах в пробирке сайт селективный подход к ковалентно придают глюкоза постановление EFSAM был применен. Интересно, что Asn131 и Asn171 гликозилирования вызвало структурные изменения, которые сходятся в пределах EFSAM ядро и усиливают биофизические свойства, способствующие STIM1-опосредованной SOCE 42.
Химическая приверженность glycosyl групп Cys тиолы был хорошо установленными плодотворную работу, которая впервые продемонстрировал полезность этого фермента свободный подход к пониманию участкам воздействия гликозилирования на функции белка 43 , 44. совсем недавно и в отношении STIM1, остатки Asn131 и Asn171 были мутировал Cys и glucose-5-(methanethiosulfonate) [glucose-5-(MTS)] была использована для ковалентно связать бесплатно тиолы 42глюкозы. Здесь мы опишем этот подход, который не только использует для включения конкретных остатки Cys сайт для модификации мутагенеза, но также применяется решение ядерного магнитного резонанса (ЯМР) спектроскопия быстро оценить изменения эффективности и структурной возмущений в результате гликозилирования. Особенно эта общая методология легко адаптируется для изучения последствий либо O- или N- гликозилирования любого recombinantly производства белка.
протокол
1. полимеразной цепной реакции (ПЦР)-при посредничестве сайта Направленный мутагенез для включения Cys в вектора выражения бактериальной ПЭТ 28a.
- Определить концентрацию ПЭТ 28a вектора (то есть двойной мель ДНК) с помощью ультрафиолетового (УФ) Коэффициент вымирания 0,020 (мкг/мл) см -1 на 260 Нм.
- Синтезировать пару дополнительных мутагенных Праймеры для каждого мутация Cys такие что я) в шаблон до первой базы несоответствия и 15 нуклеотидов дополняет шаблон после дополняют минимум 15 нуклеотидов окончательный базовый несоответствие, ii) общий праймер длина не превышает 45 нуклеотидов и iii) гуанин или цитозин расположен в первый и последний нуклеотидной позиции каждого праймера (таблица 1). Обеспечить синтез праймера осуществляется с помощью очистки масштаба и картридж 0,025 мкмоль.
- С использованием высокоточных ДНК-полимеразы, настроить два 20 мкл ПЦР реакция смеси: один содержащие вперед грунтовка и второй содержащие обратный грунтовка. Подготовка каждого смеси содержат окончательной концентрации 1 x PCR буфера с 1,5 мм MgCl 2, дНТФ 0,2 мм, 0,5 мкм грунт, 0.4 мкл ДМСО, 1,25 нг/мкл шаблон ДНК, 0,02 U/мкл высокой верности ДНК полимеразы.
- Термически цикл отдельных смесей с использованием протокола три шага: 98 ° C за 30 s (денатурации), 53-56 ° C за 30 s (отжиг), 72 ° C для 30 s kilobase(kb) -1 (расширение) шаблона ДНК. Повторите температурная программа для 5 циклов и добавить шаг расширение окончательный 72 ° C для 7,5 мин
- После первоначального ПЦР с прямого и обратного грунтовки в отдельных труб, сочетать продукты в одну трубу (т.е. всего 40 мкл) и продолжить реакции PCR для дополнительных 20 циклов, с использованием же Велоспорт параметров, как описано в шаге 1.4. Гель
- electrophorese 15 мкл реакционной смеси ПЦР на агарозы 1% (w/v), с помощью 0.5 x Tris, уксусная кислота, этилена диамин тетра уксусной кислоты (ЭДТА) работает буфер (ТЭ). Как элементы управления, electrophorese эквивалентное количество шаблона ДНК, которые не были усилены ПЦР и Алиготе лестница ДНК ссылку, которая содержит маркер полосы больше и меньше, чем ожидаемый размер продукта PCR.
- После электрофореза на 120 V 40 мин, опускайте геля в воде, содержащей 0,5 мкг/мл ethidium бромид и трясти за 30 мин при комнатной температуре. Подтвердить полнометражного шаблон были усилены путем мутагенных грунтовки как увеличение в интенсивности флуоресценции бромид относительной ethidium усиливается группы, по сравнению с шаблон группы управления под УФ (302 Нм).
- Если не усилением очевидным, повторите ПЦР после корректировки отжига температуру с шагом 0,5 ° C между 53-56 ° C температура в.
- После подтверждения амплификации шаблон мутагенных праймеры, рассматривать оставшиеся ~ 25 мкл реакционной смеси ПЦР с ДПНИ энзима ограничения переваривать метилированной шаблон ДНК. Используйте ДПНИ на 0.5 мкл (10 единиц) на ПЦР 25 мкл реакционной смеси и конечная концентрация 1 × ДПНИ реакции буфера. Инкубируйте 2,5 ч при 37 ° C.
- После переваривания шаблон, добавьте ~ 5-10 мкл переваривается смеси до 100 мкл тепла шок сведущие клетки DH5α Esherichia coli в пробки microcentrifuge 1,75 мл. Инкубировать клетки ДНК смесь на льду на 60 мин
- Теплового шока клетки ДНК смесь в пробки microcentrifuge при 42 ° C для 45 s на блок сухого тепла. После инкубации в смесь на льду на 3 мин, добавить 900 мкл комнатной температуре Лурия Бертани бульона (LB) в клетки и передачи ячейке подвеска в стерильных 14 мл круглым дном.
- Инкубировать суспензию клеток при 37 ° C 90 мин с постоянной тряски на 190 об/мин.
- Впоследствии, передача суспензию клеток обратно в пробки microcentrifuge 1,75 мл и центрифуги на 10000 x g 5 мин при комнатной температуре.
- После центрифугирования удалите 900 мкл супернатант и Ресуспензируйте бактериальные клетки, нежный дозирование в оставшиеся 100 мкл фунта
- Передавать полученный концентрированный клеток подвеска на плиту LB-агар, содержащие антибиотик, который является селективным для выражения вектора (то есть 60 мкг/mLKanamycin). Асептически распространение подвеска равномерно на пластину агар и проинкубируйте ~ 16 ч при 37 ° с.
- Следующий день, прививать единую колонию от пластины в 5 мл жидкого LB, содержащие antiobiotic отбора давления (то есть 60 мкг/мл канамицин). Расти жидкого культуры на ночь при 37 ° C с постоянной тряски на 37 ° C.
- Изоляции и очистить распространяемый плазмида из клеток кишечной палочки, использование коммерчески доступных комплект на основе процедуры щелочного литического 45.
- Подтверждают мутации интерес присутствующих и в рамках надлежащего чтения путем sequencing Сэнгер ДНК плазмиды 46.
2. Равномерное 15 N-меченых белков в BL21 ΔE3 Escherichia coli.
Примечание: различные рекомбинантных белков требуются различные выражения условий. Ниже приводится оптимизированная процедура выражение человеческого белка STIM1 EFSAM.
- Преобразования вектора выражения, укрывательство Cys мутации (то есть питомец 28a-EFSAM) в BL21 ΔE3 кодон (+) теплового шока сведущие клетки и пластины на плиты LB-агара, содержащие антибиотик отбора давления, как описано в шагах 1.9-1.14) с После изменения: непосредственно пластина 150 мкл Алиготе из ~ 1000 мкл суспензии всего клеток на пластину LB-агар без необходимости концентрации клеток в пробки microcentrifuge центрифугированием.
- Следующий день, асептически перенесите единую колонию в 200 мл колбу Эрленмейера, содержащие 20 мл LB дополнена соответствующим антибиотиком (то есть 60 мкг/мл канамицин для ПЭТ 28a-EFSAM). Расти этот жидкий закваски на ночь (т.е. ~ 16 h) при 37 ° C с постоянной тряски на ~ 190 об/мин.
- В тот же день как шаг 2,2, подготовить M9 средних для 15 N-меченых белков путем автоклавирования 1 Л M9 буфера солей (т.е. 42 мм Na 2 HPO 4, 22 мм х 2 PO 4, 8,6 мм NaCl, рН 7,4) в колбу Эрленмейера 4 Л. После прохладной, фильтр смесь 20% (w/v) D-глюкоза, CaCl 1 M 2, 1М тиамина, 1М MgSO 4, биотин 1 мг/мл и 0,2 г/мл 15 N-NH 4 Cl через фильтр 0.2 мкм стерильным шприцем в раствор стерильный M9 1 Л соли так что Окончательный концентрации этих компонентов, 0,2% (w/v) D-глюкоза, 100 мкм CaCl 2, 50 мкм тиамина, 1 мм MgSO 4, 1 мкг/мл биотина и 1 мг/мл 15 N-NH 4 Cl.
- Следующий день, асептически перевести 20 мл на ночь жидкого закваски в 50 мл стерильного Конические трубки и центрифуги на 2400 × g за 15 мин до Пелле клетки.
- После декантирующие LB среднего, Ресуспензируйте результирующий Пелле клеток в 10 мл M9 минимальный средний и передача смеси ресуспензированы гранулы на 1 Л M9 минимальный средний с антибиотиками (то есть 60 мкг/мл канамицин).
- Растут 1 Л M9 минимальные средства, содержащие бактериальной закваски при 37 ° C и константы ~ 190 об/мин, пожимая до оптической плотности на 600 Нм (OD600) достигает ~0.6 0,8.
- При достижении specfified OD600 диапазон, добавить 200 мкм изопропиловый β-D-1-тиогалактопиранозид (IPTG) чтобы побудить выражение протеина.
- После добавления ИПТГ, продолжать инкубации клеток для выражения протеина при комнатной температуре с постоянной тряски на ~ 190 об/мин для ~ 16 h (то есть на ночь).
- Следующий день, урожай бактерий центрифугированием на ~ 10 000 × g, 4 ° C на 30 мин.
- Сцеживаться LB и передачи Пелле клеток в 50 мл Конические трубки. Хранить Пелле-80 ° c до очищения.
3. Очистки рекомбинантных белков от E. coli.
Примечание: различные рекомбинантных белков требуют различных очистительных процедур. Ниже приведен протокол для 6 & #215; Его меткой EFSAM очистки от включения органов выразили от конструкции ПЭТ 28a.
- Вручную гомогенизировать Пелле замороженные бактериальных клеток в гуанидина 6 M-HCl, 20 мм трис-HCl (рН 8) и β-меркаптоэтанол 5 мм с помощью пипетки передачи моторизованных 10 мл. Добавить примерно 40 мл гуанидина HCl 5 мл сырой камере гранул для этого шага.
- Следующие 90 мин инкубации при комнатной температуре с постоянным вращением в печь гибридизации, центрифуга смеси на ~ 15000 × g, 8 ° C в течение 40 мин для отделения нерастворимых ячейки мусор (то есть гранулы) от растворимого белка смесь (т.е. супернатант).
- Добавить 750 мкл на 50% (v/v) Ni 2 +-шарик навозной жижи осветленный lysate и инкубировать еще 90 мин при комнатной температуре с инверсии в печь гибридизации Нитрилотриуксусная кислота агарозы и.
- Впоследствии, захватить его меткой белок 6 × привязан к Ni 2 +, собирая агарозы бусины в столбце очистки белков потока гравитации. Разрешить lysate течь через колонку полностью до перехода к шагу 3.5.
- Мыть собранных бусины три раза с 10 мл 6 M мочевины, 20 мм трис-HCl pH 8 и 5 мм β-меркаптоэтанол. Убедитесь, что весь 10 мл проходит через колонку перед каждой последующей 10 мл Вашингтон
- Элюировать белков в серии 2 мл фракций с использованием 6 M мочевины, 20 мм трис-HCl рН 8, имидазола 300 мм и 5 мм β-меркаптоэтанол с 90 s время инкубации между фракциями. Убедитесь, что весь 2 мл проходит через колонку перед каждой последующей элюции шаг.
- На данном этапе, подтвердить в eluted фракций по Кумасси синим окрашенных натрия Додециловый сульфат электрофореза геля полиакриламида (SDS-PAGE) с помощью метода Лэмли 47 присутствует протеина интереса. Оценить размер протеина, количество и чистоты сравнения против стандартной молекулярный вес маркер полосы, которые оба меньше и больше чем ожидаемый молекулярный вес протеина интереса.
- Бассейн eluted белковых фракций в диализе мембрана с 3500 да молекулярной массой отсечки и инкубировать в 1 Л складывая буфера (20 мм трис, 300 мм NaCl, 1 DTT, 5 мм 2 CaCl, рН 8) при 4 ° C на ночь в то время как буфер перемешивают, magneti мешалка с.
- После ~ 16 h складывая времени добавьте ~ 1 U тромбина на мг белка прямо в мешок диализа и Инкубируйте на 4 ° C для дополнительных ~ 24 h.
- Проверить степень 6 × расщепление его тег, Окрашивание Кумасси синим ~ 15 мкл белка аликвоты взяты из мешка диализа, до и после инкубации с тромбин, electrophoresed на денатурации полиакриламидных гелей (SDS-PAGE) с помощью метод Лэмли 47. ~ 2 кДа сдвиг в миграции наблюдается соответствующее молекулярная масса рассеченного 6 × его тег, перейдите к шагу 3.11; Если часть останков непереваренные белки, обнаруживаемых Окрашивание Кумасси синим, добавить ~0.2 U тромбина на мг белка прямо в мешок диализа и Инкубируйте на 4 ° C для дополнительных ~ 24 h.
- Использование размер исключение или ионообменной хроматографии для дальнейшей очистки белков. Для анион обмен хроматографии EFSAM, удалить раствор белка из диализа мешок и концентрата ~ десятикратного с использованием ультрафильтрационных центробежные концентратор с 10000 да молекулярной массой отсечки. Впоследствии, повторно разбавить раствор ~ кратной NaCl свободного буфера (20 мм трис, 5 мм 2 CaCl, 1 DTT, рН 8).
- Сбалансировать кусочки анион обменной колонны с 10 столбцов томов бесплатно NaCl буфера, описанные в шаге 3.11. Сбалансировать с помощью буфера, загружается в шприц luer-lock, содержащие без воздушных пузырей, нажав решение через колонку прикапывают и избегая давления шприц, которые вызывают устойчивый потоки решения выхода из столбца. Используйте сильный анионит (например высокоструктурированные агарозы с функциональными группами четвертичного аммония).
- Загрузить белка раствор разбавляют в NaCl бесплатная буфер (шаг 3.11) на столбце, как описано в шаге 3.12.
- Элюировать белков в градиенте [т.е. 0 - 60% (v/v)] увеличения NaCl буфера (20 мм трис, 1 M NaCl, 5 мм 2 CaCl, 1 DTT, рН 8) с использованием системы двух насос быстро белок жидкостной хроматографии (ПСОК). Установите систему ПСОК для сбора ~1-1.5 мл фракций и контролировать профиль элюции белка, с помощью поглощения УФ 280 Нм и расход 0,5 мл/мин
- Идентифицировать элюции пики и фракций, содержащих протеин интереса а также чистоту белка путем Кумасси синим окрашенных SDS-PAGE гели, с помощью метода Лэмли 47.
- Бассейн дроби показаны > 95% (то есть берется как фракций, которые показывают только один белок группы на окрашенных гелей Кумасси синий) в мешок диализа и обмена в экспериментальной буфер интерес методом диализа, как описано в шаге 3.8.
4. Химическая привязанность к белков методом диализа Глюкоза-5-МТС.
Стоковый раствор- подготовить в 55 мм N-(β-D-glucopyranosyl)-n '-[2-methanethiosulfonyl) этил] мочевины (Глюкоза-5-МТС), растворяя 10 мг комплекса в 500 мкл, 100% (v/v) ДМСО. Храните неиспользованные глюкозы-5-МТС солюбилизирован в ДМСО в -20 ° с. Буфер
- подготовить образец протеина для модификации dialyzing 1,5 мл ~ 60 мкм белка в 1 Л модификации состоят из MOPS 20 мм, 150 мм NaCl, 5 мм CaCl 2 и 0,1 мм TCEP, рН 8.3. Используйте отсечки молекулярный вес мембраны диализа, который меньше, чем размер протеина вносятся изменения (например, использовать 3500 да отсечки для EFSAM да ~ 17500).
- После 24 ч при температуре 4 ° C, передача образец из мешка диализа в пробки microcentrifuge. Добавить солюбилизирован ДМСО глюкозы-5-МТС в конечной концентрации 2 мм.
- Инкубации образца в темноте за 1 ч при комнатной температуре. Период инкубации 1 h, mix решение нежные касания трубку каждые 10 мин
- Впоследствии, повторно обмен белков в окончательной экспериментальной буфер, содержащий не восстанавливающего агента методом диализа при температуре 4 ° C, как описано в шаге 4.2 или центробежные ультрафильтрацией. Для ультрафильтрации процедуры, концентрат для образца протеина мл ~1.5 < 0,5 мл и впоследствии разбавляют в же концентратор с экспериментальной буфера. Повторите этот шаг концентрации разбавления еще два раза, так что общий обмен минимум 30 × 30 × 30 = 27,000-fold. Для EFSAM, используйте 20 мм трис, 150 мм NaCl, 5 мм 2 CaCl, pH 7.5 как экспериментальный буфера.
- Подготовки образца для масс-спектрометрии электроспрей ионизации диализа или ультрафильтрации exchange, как описано в шагах, 4.2 и 4.5, соответственно, в бикарбонат аммония 25 мм или 25 мм аммония ацетат. Если с помощью диализа, убедитесь, что вы обмена по крайней мере три раза чтобы удалить любые остаточные соли NaCl и CaCl 2.
- Определения точной массы (т.е. ± 1 Да) протеина интереса, используя электроспрей ионизации массового спектрометрирования 48 , 49. Ожидать каждый ковалентных глюкозы дополнение к Cys тиоловых через methanethiosulfonate химические для добавления белка 281.3 да массы (т.е. Добавить 360.4 Да глюкозы-5-МТС и 79.1 Да для CH 3 поэтому оставляя 2 группы во время ковалентных вложение).
5. Решение ЯМР оценки modifмышсы эффективности и структурной возмущений.
- Обеспечить концентрацию измененный белок > 100 мкм после вложения глюкозы и окончательный буфера обмена. Для EFSAM, оценить концентрацию протеина используя коэффициент вымирания УФ на 280 Нм 1.54 1 cm – (мг мл – 1).
- Добавка белка решение с 60 мкм 4,4-dimethyl-4-silapentane-1-sulfonic кислоты (DSS) для калибровки опору и пульс и 10% (v/v) D 2 O сигнал блокировки. Для высокий сигнал шум 600 мкл выборок в трубы соответствуют частоте 5 мм ЯМР, вставляется в минимум 600 МГц спектрометр с тройной резонанс HCN криогенных зонда.
- Собирать спектры N HSQC стандарт 1 H - 15 как 51 ранее подробные 50 , при температуре, 1 H и 15 N развертки ширины, переходных и приращения настройки подходят для конкретной выборки. Для EFSAM спектры, использование 20 ° C, 256 1 H транзиентов, 64 измерения с шагом 15 N и 1 H и 15 N развертки ширины равным 8000 и 1800 Гц, соответственно.
- После приобретения гликозилированного спектра белков, добавить Дитиотреитол (DTT) в образце ЯМР из запаса 1 М до конечной концентрации 15 мм. DTT удаляет части молекулы глюкозы из белка, сокращения дисульфида опосредованной вложения.
- Приобрести второй 1 H - 15 N HSQC в этих условиях сокращение/неизмененной, обеспечивая спектр ссылку оценить изменения эффективности и структурной возмущения, вызванные глюкозы вложение.
- Процесс ЯМР данные с помощью NMRPipe как ранее подробно 52. Убедитесь, что обработка минимально включает преобразование данных, постепенное, растворителей подавления, Фурье и первоначальной визуализации спектров.
- Оценки изменения эффективности путем измерения Амида пика интенсивности и химический сдвиг ценностей в изменен и снижение спектры, используя плагин NEASY на Кара- 53. Обеспечить, чтобы оценить интенсивность пик Cys Амида глюкозы придает и снижение спектров. Если Cys Амида нельзя надежно расположен в обоих спектров, используйте интенсивности остатков рядом Cys как индикация.
- Расчет эффективности как интенсивность Амида Cys изменение спектра деленное на интенсивность Амида Cys снижение (т.е. Лечение DTT) спектра, умноженное на 100:
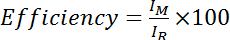 , где я M интенсивность Амида в КМС изменение спектра и я R является интенсивность Амида в спектре Cys снижение. Кроме того, оценки средней эффективности нескольких Амида вершины:
, где я M интенсивность Амида в КМС изменение спектра и я R является интенсивность Амида в спектре Cys снижение. Кроме того, оценки средней эффективности нескольких Амида вершины:
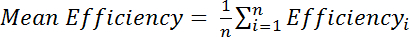 , где эффективность i-отдельно определяется эффективность рассчитывается для каждого остатков, i и n-общее количество отходов, используемых в расчетах.
, где эффективность i-отдельно определяется эффективность рассчитывается для каждого остатков, i и n-общее количество отходов, используемых в расчетах. - Вычисления возмущений (CSP) химический сдвиг от химический сдвиг различия между двумя спектры в 15 N и 1 H размеры каждого пика и нормализации для больших 15 N химический сдвиг диапазон с помощью следующим уравнением:
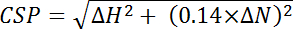 , где ΔH — это изменение ppm в измерении Протон и ΔN ppm изменения в измерении азота.
, где ΔH — это изменение ppm в измерении Протон и ΔN ppm изменения в измерении азота.
Результаты
Первый шаг этого подхода требует мутагенеза кандидат гликозилирования остатки Cys остатков, которые могут быть изменяемые с помощью EFSAM глюкозы-5-МТС в имеет не эндогенного остатки Cys, поэтому никакие специальные соображения должны быть сделаны до мутагенез. Однако род?...
Обсуждение
Гликозилирование белков является столб-поступательные изменения где сахара ковалентно присоединены к полипептидов, главным образом благодаря наличию связей с боковых цепей аминокислот. Как много как 50% млекопитающих белков являются гликозилированного 54, где гликозилир?...
Благодарности
Это исследование было поддержано естественных наук и инженерных исследований Совет Канады (05239 P.B.S.), Канадский фонд для инноваций/Онтарио научный фонд (для P.B.S.), рака простаты бороться фонд - Telus Ride для папы (для P.B.S.) и Онтарио Магистратура стипендии (для Y.J.C. и н.с.).
Материалы
| Name | Company | Catalog Number | Comments |
| Phusion DNA Polymerase | Thermo Fisher Scientific | F530S | Use in step 1.3. |
| Generuler 1kb DNA Ladder | Thermo Fisher Scientific | FERSM1163 | Use in step 1.6. |
| DpnI Restriction Enzyme | New England Biolabs, Inc. | R0176 | Use in step 1.8. |
| Presto Mini Plasmid Kit | GeneAid, Inc. | PDH300 | Use in step 1.16. |
| BL21 DE3 codon (+) E. coli | Agilent Technologies, Inc. | 230280 | Use in step 2.1. |
| DH5a E. coli | Invitrogen, Inc. | 18265017 | Use in step 1.9. |
| 0.22 mm Syringe Filter | Millipore, Inc. | SLGV033RS | Use in step 2.3. |
| HisPur Ni2+-NTA Agarose Resin | Thermo Fisher Scientific | 88221 | Use in step 3.3. |
| 3,500 Da MWCO Dialysis Tubing | BioDesign, Inc. | D306 | Use in step 3.8, 3.16, 4.2, 4.5 and 4.6. |
| Bovine Thrombin | BioPharm Laboratories, Inc. | SKU91-055 | Use in step 3.9. |
| 5 mL HiTrap Q FF Anion Exchange Column | GE Healthcare, Inc. | 17-5156-01 | Use in step 3.11. |
| Glucose-5-MTS | Toronto Research Chemicals, Inc. | G441000 | Use in step 4.1. |
| Vivaspin 20 Ultrafiltration Centrifugal Concentrators | Sartorius, Inc. | VS2001 | Use in step 3.11, 4.2, 4.5 and 4.6. |
| PageRuler Unstained Broad Protein Ladder | Thermo Fisher Scientific | 26630 | Use in step 3.7, 3.10 and 3.15 |
| HiTrap Q FF Anion Exchange Column | GE Healthcare, Inc. | 17-5053-01 | Use in step 3.12. |
| AKTA Pure Fast Protein Liquid Chromatrography System | GE Healthcare, Inc. | 29018224 | Use in step 3.14. |
| 600 MHz Varian Inova NMR Spectrometer | Agilent Technologies, Inc. | Use in step 5.2 and 5.5. |
Ссылки
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Feske, S., Skolnik, E. Y., Prakriya, M. Ion channels and transporters in lymphocyte function and immunity. Nat Rev Immunol. 12 (7), 532-547 (2012).
- Shaw, P. J., Feske, S. Physiological and pathophysiological functions of SOCE in the immune system. Front Biosci (Elite Ed). 4, 2253-2268 (2012).
- Seo, M. D., Enomoto, M., Ishiyama, N., Stathopulos, P. B., Ikura, M. Structural insights into endoplasmic reticulum stored calcium regulation by inositol 1,4,5-trisphosphate and ryanodine receptors. Biochim Biophys Acta. 1853 (9), 1980-1991 (2015).
- Stathopulos, P. B., Ikura, M. Structural aspects of calcium-release activated calcium channel function. Channels (Austin). 7 (5), 344-353 (2013).
- Stathopulos, P. B., Ikura, M. Structure and function of endoplasmic reticulum STIM calcium sensors. Curr Top Membr. 71, 59-93 (2013).
- Stathopulos, P. B., Li, G. Y., Plevin, M. J., Ames, J. B., Ikura, M. Stored Ca2+ depletion-induced oligomerization of stromal interaction molecule 1 (STIM1) via the EF-SAM region: An initiation mechanism for capacitive Ca2+ entry. J Biol Chem. 281 (47), 35855-35862 (2006).
- Stathopulos, P. B., Ikura, M. Store operated calcium entry: From concept to structural mechanisms. Cell Calcium. , (2016).
- Stathopulos, P. B., Ikura, M. Structurally delineating stromal interaction molecules as the endoplasmic reticulum calcium sensors and regulators of calcium release-activated calcium entry. Immunol Rev. 231 (1), 113-131 (2009).
- Muik, M., et al. STIM1 couples to ORAI1 via an intramolecular transition into an extended conformation. EMBO J. 30 (9), 1678-1689 (2011).
- Luik, R. M., Wang, B., Prakriya, M., Wu, M. M., Lewis, R. S. Oligomerization of STIM1 couples ER calcium depletion to CRAC channel activation. Nature. 454 (7203), 538-542 (2008).
- Luik, R. M., Wu, M. M., Buchanan, J., Lewis, R. S. The elementary unit of store-operated Ca2+ entry: local activation of CRAC channels by STIM1 at ER-plasma membrane junctions. J Cell Biol. 174 (6), 815-825 (2006).
- Wu, M. M., Buchanan, J., Luik, R. M., Lewis, R. S. Ca2+ store depletion causes STIM1 to accumulate in ER regions closely associated with the plasma membrane. J Cell Biol. 174 (6), 803-813 (2006).
- Liou, J., Fivaz, M., Inoue, T., Meyer, T. Live-cell imaging reveals sequential oligomerization and local plasma membrane targeting of stromal interaction molecule 1 after Ca2+ store depletion. Proc Natl Acad Sci U S A. 104 (22), 9301-9306 (2007).
- Calloway, N., et al. Stimulated association of STIM1 and Orai1 is regulated by the balance of PtdIns(4,5)P(2) between distinct membrane pools. J Cell Sci. 124 (Pt 15), 2602-2610 (2011).
- Korzeniowski, M. K., et al. Dependence of STIM1/Orai1-mediated calcium entry on plasma membrane phosphoinositides. J Biol Chem. 284 (31), 21027-21035 (2009).
- Park, C. Y., et al. STIM1 clusters and activates CRAC channels via direct binding of a cytosolic domain to Orai1. Cell. 136 (5), 876-890 (2009).
- Yuan, J. P., et al. SOAR and the polybasic STIM1 domains gate and regulate Orai channels. Nat Cell Biol. 11 (3), 337-343 (2009).
- Feske, S., et al. A mutation in Orai1 causes immune deficiency by abrogating CRAC channel function. Nature. 441 (7090), 179-185 (2006).
- Prakriya, M., et al. Orai1 is an essential pore subunit of the CRAC channel. Nature. 443 (7108), 230-233 (2006).
- Vig, M., et al. CRACM1 multimers form the ion-selective pore of the CRAC channel. Curr Biol. 16 (20), 2073-2079 (2006).
- Vig, M., et al. CRACM1 is a plasma membrane protein essential for store-operated Ca2+ entry. Science. 312 (5777), 1220-1223 (2006).
- Liou, J., et al. STIM is a Ca2+ sensor essential for Ca2+-store-depletion-triggered Ca2+ influx. Curr Biol. 15 (13), 1235-1241 (2005).
- Roos, J., et al. STIM1, an essential and conserved component of store-operated Ca2+ channel function. J Cell Biol. 169 (3), 435-445 (2005).
- Putney, J. W. A model for receptor-regulated calcium entry. Cell Calcium. 7 (1), 1-12 (1986).
- Feske, S. CRAC channelopathies. Pflugers Arch. 460 (2), 417-435 (2010).
- Maus, M., et al. Missense mutation in immunodeficient patients shows the multifunctional roles of coiled-coil domain 3 (CC3) in STIM1 activation. Proc Natl Acad Sci U S A. 112 (19), 6206-6211 (2015).
- Stathopulos, P. B., Zheng, L., Li, G. Y., Plevin, M. J., Ikura, M. Structural and mechanistic insights into STIM1-mediated initiation of store-operated calcium entry. Cell. 135 (1), 110-122 (2008).
- Stathopulos, P. B., Ikura, M. Partial unfolding and oligomerization of stromal interaction molecules as an initiation mechanism of store operated calcium entry. Biochem Cell Biol. 88 (2), 175-183 (2010).
- Dennis, J. W., Lau, K. S., Demetriou, M., Nabi, I. R. Adaptive regulation at the cell surface by N-glycosylation. Traffic. 10 (11), 1569-1578 (2009).
- Nilsson, T., Au, C. E., Bergeron, J. J. Sorting out glycosylation enzymes in the Golgi apparatus. FEBS Lett. 583 (23), 3764-3769 (2009).
- Stanley, P. Golgi glycosylation. Cold Spring Harb Perspect Biol. 3 (4), (2011).
- Moremen, K. W., Tiemeyer, M., Nairn, A. V. Vertebrate protein glycosylation: diversity, synthesis and function. Nat Rev Mol Cell Biol. 13 (7), 448-462 (2012).
- Gerlach, J., Sharma, S., Leister, K., Joshi, L., Agostinis, P., Afshin, S. . Endoplasmic Reticulum Stress in Health and Disease. , 23-39 (2012).
- Pearse, B. R., Hebert, D. N. Lectin chaperones help direct the maturation of glycoproteins in the endoplasmic reticulum. Biochim Biophys Acta. 1803 (6), 684-693 (2010).
- Stanley, P., Sundaram, S. Rapid assays for lectin toxicity and binding changes that reflect altered glycosylation in mammalian cells. Curr Protoc Chem Biol. 6 (2), 117-133 (2014).
- Avezov, E., Frenkel, Z., Ehrlich, M., Herscovics, A., Lederkremer, G. Z. Endoplasmic reticulum (ER) mannosidase I is compartmentalized and required for N-glycan trimming to Man5-6GlcNAc2 in glycoprotein ER-associated degradation. Mol Biol Cell. 19 (1), 216-225 (2008).
- Csutora, P., et al. Novel role for STIM1 as a trigger for calcium influx factor production. J Biol Chem. 283 (21), 14524-14531 (2008).
- Kilch, T., et al. Mutations of the Ca2+-sensing stromal interaction molecule STIM1 regulate Ca2+ influx by altered oligomerization of STIM1 and by destabilization of the Ca2+ channel Orai1. J Biol Chem. 288 (3), 1653-1664 (2013).
- Williams, R. T., et al. Stromal interaction molecule 1 (STIM1), a transmembrane protein with growth suppressor activity, contains an extracellular SAM domain modified by N-linked glycosylation. Biochim Biophys Acta. 1596 (1), 131-137 (2002).
- Mignen, O., Thompson, J. L., Shuttleworth, T. J. STIM1 regulates Ca2+ entry via arachidonate-regulated Ca2+-selective (ARC) channels without store depletion or translocation to the plasma membrane. J Physiol. 579 (Pt 3), 703-715 (2007).
- Choi, Y. J., Zhao, Y., Bhattacharya, M., Stathopulos, P. B. Structural perturbations induced by Asn131 and Asn171 glycosylation converge within the EFSAM core and enhance stromal interaction molecule-1 mediated store operated calcium entry. Biochim Biophys Acta. 1864 (6), 1054-1063 (2017).
- Davis, B. G., Lloyd, R. C., Jones, J. B. Controlled site-selective protein glycosylation for precise glycan structure-catalytic activity relationships. Bioorg Med Chem. 8 (7), 1527-1535 (2000).
- Gamblin, D. P., van Kasteren, S. I., Chalker, J. M., Davis, B. G. Chemical approaches to mapping the function of post-translational modifications. FEBS J. 275 (9), 1949-1959 (2008).
- Ehrt, S., Schnappinger, D. Isolation of plasmids from E. coli by alkaline lysis. Methods Mol Biol. 235, 75-78 (2003).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol Biol. 94 (3), 441-448 (1975).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Bell, D. J. Mass spectrometry. Methods Mol Biol. 244, 447-454 (2004).
- Domon, B., Aebersold, R. Mass spectrometry and protein analysis. Science. 312 (5771), 212-217 (2006).
- Farrow, N. A., et al. Backbone Dynamics of a Free and a Phosphopeptide-Complexed Src Homology-2 Domain Studied by N-15 Nmr Relaxation. Biochemistry. 33 (19), 5984-6003 (1994).
- Kay, L. E., Keifer, P., Saarinen, T. Pure Absorption Gradient Enhanced Heteronuclear Single Quantum Correlation Spectroscopy with Improved Sensitivity. Journal of the American Chemical Society. 114 (26), 10663-10665 (1992).
- Delaglio, F., et al. NMRPipe: a multidimensional spectral processing system based on UNIX pipes. J Biomol NMR. 6 (3), 277-293 (1995).
- Masse, J. E., Keller, R. AutoLink: automated sequential resonance assignment of biopolymers from NMR data by relative-hypothesis-prioritization-based simulated logic. J Magn Reson. 174 (1), 133-151 (2005).
- Monticelli, M., Ferro, T., Jaeken, J., Dos Reis Ferreira, V., Videira, P. A. Immunological aspects of congenital disorders of glycosylation (CDG): a review. J Inherit Metab Dis. 39 (6), 765-780 (2016).
- An, H. J., Kronewitter, S. R., de Leoz, M. L., Lebrilla, C. B. Glycomics and disease markers. Curr Opin Chem Biol. 13 (5-6), 601-607 (2009).
- Wani, W. Y., Chatham, J. C., Darley-Usmar, V., McMahon, L. L., Zhang, J. O-GlcNAcylation and neurodegeneration. Brain Res Bull. , (2016).
- Haines, A. M., Tobe, S. S., Kobus, H. J., Linacre, A. Properties of nucleic acid staining dyes used in gel electrophoresis. Electrophoresis. 36 (6), 941-944 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены