A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שילוב מיקרופלואידיקה Microrheology כדי לקבוע מאפייני Rheological מחומר רך במהלך שלב חוזרות מעברים
In This Article
Summary
נדגים את ייצור ושימוש של מכשיר microfluidic המאפשר מספר החלקיקים מעקב מדידות microrheology לחקור את ההשפעות rheological של מעברים שלב חוזרות ונשנות בעניין רך.
Abstract
מיקרו מחומר רך ישירות משפיעה על מאפייני rheological מאקרוסקופית והוא ניתן לשינוי על-ידי גורמים שונים, לרבות שחלוף colloidal במהלך השלב הקודם שינויים ומוחלים הטיה. כדי לקבוע את היקף השינויים הללו, פיתחנו מכשיר microfluidic מאפשר חזר על מעברי פאזה המושרה על ידי חילופי האפיון של נוזלים ושל microrheological שמסביב תוך הגבלת הטיה על הדגימה. טכניקה זו היא ממוצע2rheology, השילוב של מיקרופלואידיקה ו- microrheology. המכשיר microfluidic הוא עיצוב דו שכבתי עם כניסת סימטרי נחלים הזנת תא מדגם זה לוכד את הדגימה ג'ל במקום במהלך החלפת נוזלים. ניתן להחיל שאיבה רחוק מן החדר מדגם למשוך נוזלים אל החדר הדגימה. מאפייני rheological גשמי מאופיינים באמצעות חלקיקים מרובים מעקב microrheology (MPT). MPT, חלקיקים בדיקה פלורסנט מוטמעים בתוך החומר, תנועה בראונית של הגששים נרשם באמצעות מיקרוסקופ וידאו. מעקב אחר תנועת החלקיקים, העקירה אומר בריבוע (MSD) מחושבת. MSD קשורה מאקרוסקופית מאפייני rheological, באמצעות היחס סטוקס-איינשטיין מוכללת. השלב של החומר מזוהה על ידי השוואה כדי המעריך הקריטיים מרגוע, באמצעות עקרון הסופרפוזיציה זמן-קיור. מדידות של ג'ל colloidal סיביים ממחישים את התועלת של הטכניקה. התכשיר יש מבנה עדין שניתן לשינוי בלתי הפיך הטיה מוחל. ממוצע2rheology הנתונים מראה כי החומר שוב ושוב equilibrates על מאפייני rheological אותו לאחר כל מעבר פאזה, המציין כי מעברי פאזה לא לשחק תפקיד לשינויים microstructural. כדי לקבוע את התפקיד של הטיה, דגימות יכול הטייה לפני זריקה לתוך המכשיר microfluidic שלנו. ממוצע2rheology היא טכניקה החלים נרחב עבור אפיון החומר רך המאפשר קביעת מאפייני rheological מזערים עדין דגימה בודדת במהלך שלב מעברים בתגובה לשינויים חוזרות ונשנות תנאי הסביבה שמסביב.
Introduction
מעברי פאזה בעניין רך יכול לשנות את המבנה בפיגומים, אשר יש השלכות ביציבות עיבוד והאחרון של חומרים1,2,3. אפיון חומרים רכים במהלך מעברי פאזה דינאמי מספק מידע חיוני על הקשר בין התפתחות מבנית ואת מבנה שיווי משקל מאפייני rheological. לדוגמה, מוצרים ושרותים רבים דורשים שינוי פאזה במהלך שימוש על ידי הצרכן. כמו כן, בתהליך הייצור, צעדים עיבוד, כולל דילול, ערבוב, להקנות הטיה המשפיעים על מאפייני rheological של מיקרו הסופי של המוצר. הכרת מאפייני rheological לאורך כל שינוי פאזה מבטיחה כי המוצר מבצע כמתוכנן. בנוסף, אם כוחות לשנות rheology ההתחלתי של החומר בתהליך הייצור, מעברי פאזה יכולות להניב תוצאות בלתי צפויה ולא רצויה, לשנות את הפונקציה המיועד והיעילות. בנקודה קריטית gelation, הגדיר את הנקודה שבה החומר המעברים פתרון של קולואידים ואמולסיות המשויך או פולימרים לרשת ג'ל פורש-לדוגמה, תכונות החומר שינוי דרסטי עם שינויים קלים להתאחדות. כל שינוי המבנה בנקודה קריטית ג'ל יכול להשפיע את המוצר הסופי4. במהלך מעברים אלה דינמי, חומרים רכים יש תכונות מכניות חלש, מדידות משתמשים בטכניקות ניסיוני הקלאסית ניתן תוך מדידת רעש מגבלת5,6,7. לקחת בחשבון זה, טכניקות כגון microrheology, המגלה רגישות בטווח נמוך מודולים (10-3 - 4 הרשות הפלסטינית), נעשה שימוש כדי לאפיין את הג'ל התחלתית חלש במהלך האבולוציה דינמי. כמה חומרים רגישים לשינויים מיקרו בגלל כוחות חיצוניים, אשר מהווה אתגר במהלך האפיון, כמו לכל העברת חומר או נוזל יכול להשפיע על המבנה ובסופו של דבר, את תכונות החומר הסופי. כדי למנוע שינוי של מיקרו גשמי, פיתחנו מכשיר microfluidic שבו אפשר להחליף את הנוזל הסביבה סביב מדגם תוך מזעור הטיה. על ידי החלפת נוזלים לסביבה, שינויים מאפייני rheological מיקרו נמדדים במהלך שלב מעברים עם תרומות מינימלי של הטיה. המכשיר משולבת עם חלקיקים מרובים מעקב microrheology (MPT) בטכניקה הנקראת rheology2ממוצע. טכניקה זו משמשת כדי לכמת תכונות החומר במהלך שלב רצופים שינויים של ג'ל בתגובה כוח נהיגה חיצוני. הטכניקה יומחשו באמצעות ג'ל colloidal סיבי a, שמן קיק מוקשה (HCO)9,10,11.
ג'ל פיגומים יכול לעבור שינויים האגודה דיסוציאציה עקב שלהם לדוגמה הסביבה12,13,14,15. הכוח המניע של gelation והשפלה חומר מסוים, חייב יהיה מותאם עבור כל חומר מעניין. ראולוגיה2ממוצע ניתן לאפיון מערכות ג'ל מגיב לגירויים חיצוניים, כולל רשתות colloidal פולימריים. שינוי ה-pH, לחץ אוסמוטי או ריכוז המלחים הם דוגמאות של הכוחות זה יכול לגרום לשינויים מיקרו גשמי. לדוגמה, HCO עובר מעברי פאזה מבוקרת על-ידי יצירת מעבר צבע על לחץ אוסמוטי. כאשר מדגם ג'ל HCO מרוכז (4 wt % HCO) שקוע במים, כוחות אטרקטיביים בין colloidal חלקיקי להחליש, גורם השפלה. לחלופין, כאשר פתרון שתדללו של HCO (0.125 wt % HCO) הוא יצר קשר עם חומר הידרופיליות (המכונה הסוכן ג'לי, המורכבת בעיקר גליצרין, חומרים פעילי שטח), מושכת כוחות ההחזרה, גורם gelation. מערכת זו ג'ל ישמש כדי להראות את הפעולה של המכשיר ככלי למדידת מעברי פאזה רצופים מדגם יחיד9,10. כדי לאפיין פיגומים ג'ל אלה במהלך מעברים דינמיים, המבנה ג'ל עדין התחלתית-המעבר שלב קריטי, אנו משתמשים MPT לאפיון חומרים אלה עם רזולוציה גבוהה-עתיים.
Microrheology משמשת כדי לקבוע מאפייני ג'ל ומבנה, במיוחד בזמן המעבר הקריטי, של מערך מחומרים קלים, כולל ג'לים colloidal ו פולימריים5,6,9,16. MPT היא טכניקה microrheological פסיבי המשתמשת מיקרוסקופ וידאו לרשומה תנועה בראונית של חלקיקים בדיקה פלורסנט מוטבע בתוך מדגם. מיקומי החלקיקים לאורך קטעי וידאו נחושים בדיוק בתוך 1/10בתאנון השימוש פיקסל קלאסית מעקב אלגוריתמים17,18. ההרכב בממוצע בריבוע אומר הזחה (MSD, (Δr2(t))) מחושבת על פי מסלולי חלקיקים אלה. MSD קשורה תכונות החומר, כגון הציות השרץ, באמצעות יחס סטוקס-איינשטיין מוכללת17,19,20,21,22, 23. המדינה של החומר נקבע על ידי חישוב המדרון לוגריתמי של העקומה MSD כפונקציה של זמן השהיה, α,
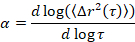
כאשר t הוא זמן השהיה ולאחר השוואתו המעריך הקריטיים מרגוע, n. n נקבעת באמצעות זמן-קיור הסופרפוזיציה, מתועדת היטב בטכניקה שונה כדי לנתח נתונים MPT לארסן, פירסט6. על ידי השוואה של n כדי α המדינה של החומר באופן כמותי נקבע. כאשר α > n החומר הוא סול, ומתי α < n החומר הוא ג'ל. העבודות הקודמות יש מאופיין שבמערכת HCO שימוש microrheology כדי לקבוע הרפיה ביקורתי המעריך9. באמצעות מידע זה, נוכל לקבוע בדיוק מתי החומר המעברים של ג'ל סול במהלך ניסוי. בנוסף, ניתן לחשב את הפרמטר הלא-Gaussian, αNG, כדי לקבוע את מידת הטרוגניות מבנית של מערכת,
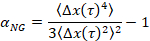
איפה תנועת החלקיקים מימדי בכיוון x , Δx(t). באמצעות MPT, ניתן לאפיין שינוי חד-פאזי, אך על ידי אפיון חומרים עם MPT התקן microfluidic, אנחנו מסוגלים לתפעל את סביבתו נוזלים ולאסוף נתונים של מעברים שלב מספר על מדגם יחיד ג'ל.
זה מכשיר microfluidic נועדה לחקור את המעברים הקריטיים של מדגם יחיד ג'ל זה עובר שינויים שלב בתגובה לשינויים בסביבה נוזלית שמסביב. המכשיר בורסות נוזלים המקיפים את הדגימה כאשר הוא גם במדינה ג'ל או סול על ידי נעילת המדגם במקום לזירוז מעבר שלב תוך מזעור הטיה. אגן הממס ממוקם ישירות מעל תא הדגימה, אשר מחוברים באמצעות שישה ערוצים כניסת מפוזרים באופן סימטרי. סימטריה זו מאפשרת חילופי נוזלים מאגן הממס לבין תא הדגימה תוך יצירת לחץ שווה סביב המדגם, נעילתה במקום. היו מספר מחקרים להשתמש בשיטה זו עבור חלקיק בודד ו- DNA השמנה, אך עבודה זו משנה את עוצמת הקול ממולקולות יחיד כדי דגימות המהווים כ 10 µL24,25,26. עיצוב ייחודי זה מאפשר גם אפיון microrheological בזמן אמת במהלך שלב מעברים.
ממוצע2rheology היא טכניקה חזקה הרלוונטיים מערכות רבות חומר רך. בטכניקה המתוארת במאמר זה תוכנן עבור colloidal ג'לים, אך זה ניתן בקלות להתאים חומרים אחרים כגון פולימר או פתרונות micellar. בטכניקה זו, נוכל לקבוע לא רק כיצד מעברי פאזה משפיעים על תכונות החומר של שיווי משקל, אך שלבי עיבוד גם כמה שונה שנמשך השפעות על ההתפתחות rheological של החומר ואת המבנה בפיגומים הסופי, מאפיינים.
Protocol
1. ייצור של המכשיר Microfluidic
- Microfluidic חותמת פבריקציה נוספת.
הערה: שלב זה מחייב השימוש בחומרים נדיפים, צריך להיעשות בשכונה fume כימי.- השתמש בעיצוב המודפס שלילי באותן מידות כמו השקופית זכוכית (75 × 50 מ מ), ערוצי הצבועים בלבן, הרקע בצבע שחור (ראה איור 1). הדפס עיצוב זה בגיליון אצטט ברורה (שקיפות) ברזולוציה של 1200 dpi.
- אם החלק האפל של השקיפות מאפשרת עדיין אור דרך, שכבה התשלילים מספר וציות באמצעות הקלטת צדדית כפולה.
- להפעיל בעוצמה גבוהה אולטרה סגול (UV) מקור אור ולאפשר לו להתחמם לפלט קבוע (כ- 30 דקות).
הערה: במשקפי מגן UV לענידה בעת שימוש בעוצמה גבוהה את מקור אור UV. - מילוי שלושה 150 מ צלחות פטרי עם אצטון, אתנול, מים מזוקקים.
- במקום ריק שקיפות על משטח שטוח קרוב למקור UV תפוקה גבוהה, אבל לא ישירות מתחת UV אור. זה יספק בסיס כדי לפברק את חותמת microfluidic.
- חלוקה לרמות את הפינות של 75 × 50 מ מ זכוכית שקופית במרכז השקיפות ריק שימוש של קבע סמן ומקום ארבע זכוכית מפרידי (כ 30 × 30 × 1 מ מ) פינות המלבן מחולקת לרמות.
- יוצקים כ- 5 מ ל UV שרף תיול לריפוי: ene במרכז קפיציות ולאחר מכן מקם בזהירות 75 x 50 x 1 שקופיות זכוכית מ מ על גבי זכוכית קפיציות, כך הדבק מכוסה לגמרי על ידי השקופית זכוכית עם אין בועות אוויר.
- מניחים את השקיפות שלילי המודפס על גבי השקופית זכוכית ולעבור את כל המרכיבים לעיל (מלמטה למעלה: ריק שקיפות, מפרידי כלי זכוכית UV, זכוכית, ודבק שקף מודפס שלילי) על-ידי גרירת השקיפות ריק בקפידה תחת מקור האור UV.
- לאפשר את האור האולטרה סגול וחובתו השלילי שרף ועל התרופה. הזמן מרפא יכול להיות מותאם כדי לשנות את הגובה של הערוץ. 45 s התרופה זמן תוצאות ב גובה ערוץ 1 מ מ, באמצעות מקור האור שלנו.
- להזיז את הרכיבים הרחק מהמקור UV ולהסיר על שקף מודפס שלילי והחלק זכוכית. השקופית זכוכית עם הערוצים מפוברק דבק UV עכשיו להיות המכונה החותמת microfluidic.
- להתעלם קפיציות שקיפות וזכוכית.
- טובלים את חותמת microfluidic באמבטיה אצטון, ואחריו האמבט אתנול. חזור על שלב זה פעמיים. אצטון לבזות את דבק UV, אז אל תעזוב אצטון בחותמת מ 10 s.
- בעוד אתה מחזיק את החותמת, להטביע את חותמת במים ולהשתמש ספוגית כותנה כדי להסיר את שארית שרף unreacted. אל ישירות תנגב את החלקים נרפא, זה שיהפוך את הערוצים קשה.
- למקם את החותמת על מגבת נייר, לחזור אל המקור UV במשך לפחות 30 דקות להבטיח ריפוי מלא.
- דפוס Polydimethylsiloxane (PDMS)
- שופכים 70 גרם של בסיס PDMS לתוך כוס נקי ולהוסיף את הסוכן cross-linking הבסיס יחס משקל של 1:10 crosslinker לבסיס. אלו הן ליצרן מומלץ יחסי. אל תשתמש מיכל הזכוכית.
- לערבב את מחדש, לבסס ביסודיות עם קדירות מתכת; התערובת צריכה להיות עכורים בגלל בועות אוויר כלואה ברגע כראוי מעורב.
- מכניסים את PDMS ואקום תנור ולמשוך ואקום-PDMS מעורב. לבטל ואקום אם הפתרון מתחילה גלישה מגביע, ולאחר מכן לחדש את אבק אחרי העומס שוככת. הלחץ הכולל בתנור ואקום לא משנה, כמו שואב האבק רק מזרזת את תהליך degassing. להשאיר בבית הבליעה עד כל הבועות פונו מן התערובת (כ- 60 דקות).
- המקום החותמת microfluidic פלסטיק בקוטר 150 מ מ ריק פטרי, ואז מוזגים את PDMS לתוך הפטרי, מכסה לחלוטין את חותמת microfluidic. יוצקים קרוב לפני השטח של הפטרי כדי למזער את בועות רפורמה ב PDMS.
- לכסות הפטרי ומניחים בתנור 55 ° C בלילה כדי לרפא. ברגע נרפא לגמרי, לחתוך את PDMS בדוגמת באמצעות סכין ולהסיר החותמת. שומרים על עודף PDMS לבנות את הממס (פרוטוקול שלב 1.6.3) ואגן PDMS פקקים (פרוטוקול שלב 2.2.1.1).
- באמצעות אגרוף ביופסיה 0.5 מ מ, חותכים חורים מהמיקומים הבאים: אחד בכל פינה, אחד בבית הבליעה היניקה סמוך לקצה של הערוץ, שש בבית הבליעה מדגם סימטרי להציב 60° לגזרים, ואחד במרכז תא הדגימה. כדי להבטיח חורים שמוקם באופן סימטרי להדפיס תבנית בגיליון נייר ומקום תחת תא הדגימה. מאז PDMS ברור, שניתן בקלות לראות היכן החורים צריך להיות ממוקם.
- הכנה של פתרון סול-ג'ל ליצירת קירות זכוכית במכשיר microfluidic
- צנצנת 100 מ ל, להוסיף 25 מ של 90% אתנול, 25 מ של pH 4 (ז 0.0001) פתרון חומצה הידרוכלורית, 25 מ של 98% tetraethoxysilane ו- 25 מ של 98% methyltriethoxysilane. מקם את הפתרון 100 מ ל, המכונה עכשיו הנוזל preconverted, במיקרוגל חשפו במשך 10 שניות, ואז במקום 80 מעלות צלזיוס למשך הלילה.
- התקן הרכבה
- מקום שני PDMS עם תבנית של, 75 × 50 × 0.10 מ מ זכוכית שקופיות לתוך הפלזמה מנקה ולהגדיר את השסתום אסידו למצב כבוי.
- להפעיל את משאבת ואקום, המתן דקה אחת לפנות את החדר.
- לשים את השסתום תלת-כיווני זרימה בקר המיקום ולתת תא equilibrate למשך 5 שניות. המיקום בקר זרימה מאפשר קצב זרימה קטן של האוויר נכנס פלזמה מנקה נמוך לשמור את התא הלחץ נמוך. להפעיל את המתג בתדר רדיו (RF) בינוני במשך 40 שניות ולאחר מכן לכבות את המתג RF ומשאבת ואקום.
- מקום 3-דרך המסתם למצב פתוח כדי לחזור לחדר תנאים אטמוספיריים. הסר את השקופית בדוגמת PDMS וזכוכית.
- דבקים בקפידה את PDMS בדוגמת לשקופית זכוכית על ידי לשים את שני המשטחים קשר איש עם רעהו.
- חלות UV לריפוי שרף התפרים סביב בדוגמת PDMS תרופה 5 דקות תחת בעצימות נמוכה אור UV.
- ייצור של קירות זכוכית בערוצים microfluidic.
הערה: שלב זה להשלימן תוך 30 דקות של טיפול פלזמה, כאשר היא מסתמכת על שינויים משטח PDMS להתרחש במהלך טיפול פלזמה. עובי השכבה יהיה כ- 5-10 מיקרומטר. שלב זה מחייב השימוש בחומרים נדיפים, צריך להיעשות בשכונה fume כימי.- הגדר פלטה עד 100 ° C ולהכין מזרקים ארבע (שלוש 30 מ"ל ו אחד 3 מ ל) עם מחטים מד 18, כ- 30 ס מ אורך צינורות תרמופלסטיים ברורה.
- למלא שלושה מזרקים 30 מ עם אתנול, כלורופורם ואוויר, בהתאמה. ממלאים מזרק 3 מ ל אחד עם נוזל preconverted (מתוך פרוטוקול שלב 1.3.1.)
- הכנס צינורות תרמופלסטיים ברור באמצעות מחברי נירוסטה לתוך כל החורים PDMS בדוגמת, למעט חור בפינה אחת. החור הזה ישמש בתור כניסת, בעוד כל האחרים יהיו שקעים.
- למלא את המכשיר microfluidic preconverted נוזלים המזרק ולאחר מכן מקם את המכשיר microfluidic בצלחת חם 100 ° C אז הזכוכית התחתונה היא נוגעת פני הכיריים.
- זורמים 3 מ"ל של נוזל preconverted דרך המכשיר microfluidic מעל 10 שניות. עובי קירות הזכוכית מותאמת על ידי שינוי קצב זרימת הנוזל preconverted.
- הסר את ההתקן microfluidic פלטת הבישול. להחליף את המזרק פתרון preconverted עם המזרק באוויר, לדחוף החוצה כל הנוזלים העודפים preconverted.
- להחליף את המזרק באוויר עם המזרק כלורופורם, אט-אט זורמת 15 מ"ל של כלורופורם דרך המכשיר microfluidic. להחליף את המזרק כלורופורם עם המזרק אתנול, אט-אט זורמת 30 מ של אתנול דרך המכשיר microfluidic. שלבים אלה צריך לקחת כ 1 דקות כל אחד.
- להחליף את המזרק אתנול עם האוויר מזרק, זרימת האוויר דרך המכשיר microfluidic עד יבש.
- יישום של זכוכית תומך ואגן הממס
- לחתוך 75 × 10 × 1 מ"מ פיסות זכוכית מ 75 × × 25 1 מ מ זכוכית שקופיות.
- חלות UV לריפוי שרף רצועות זכוכית. מניחים את המכשיר microfluidic על גבי הרצועות, עם הצד PDMS פונה כלפי מעלה. להעביר תחת מקור אור UV בעצימות נמוכה במשך 5 דקות.
- חתך של 30 × 30 מ מ מרובע של PDMS. באמצעות אגרוף ביופסיה, לחתוך חור גדול מספיק כדי לכסות את התא מדגם של 10 מ מ.
- למקם את PDMS מרובע והתקן microfluidic הפלזמה מנקה, ואז לשים את השסתום אסידו למצב כבוי והפעל את משאבת ואקום.
- המתן דקה אחת לפנות את החדר. לשים את השסתום 3-דרך המיקום בקר זרימה ותנו תא equilibrate למשך 5 שניות.
- להפעיל את המתג RF בינוני במשך 40 שניות ולאחר מכן לכבות את מתג RF, משאבת ואקום.
- מקום 3-דרך המסתם למצב פתוח כדי לחזור לחדר תנאים אטמוספיריים.
- להסיר את ההתקן microfluidic ואגן הממס מן החדר פלזמה, מקפידים על ידי פנייה ישירה על המשטחים. הקפד למקם את אגן ממס על החדר מדגם.
2. ממוצע2rheology הליך
-
הכנת חומר רך דגימות
- חלקיקים בדיקה כביסה
- פיפטה מים ו- 0.5 מיקרומטר הגששים לתוך צינור microcentrifuge ביחס של מים כדי הגששים של 10:1. לערבב ביסודיות באמצעות פיפטה ערבוב ולאחר מכן מקם את הצינור microcentrifuge לתוך microcentrifuge ו ספין ב 4600 x g במשך 10 דקות.
הערה: הפתרון בדיקה להשתמש בעבודה זו מתקבלת על תנאי מים עם ריכוז הראשונית של 2.6% מוצקים/אמצעי האחסון, הריכוז הסופי של הגששים שימוש במדגם הוא 0.1% מוצקים/אמצעי האחסון. - להסיר את צינור microcentrifuge פיפטה החוצה תגובת שיקוע. החלף את תגובת שיקוע DI מים. חזור על צנטריפוגה עבור סכום כולל של שלוש פעמים.
- למקם את צינור microcentrifuge sonicator, sonicate על אש נמוכה במשך 15 דקות להוציא אגרגטים כלשהו.
- פיפטה מים ו- 0.5 מיקרומטר הגששים לתוך צינור microcentrifuge ביחס של מים כדי הגששים של 10:1. לערבב ביסודיות באמצעות פיפטה ערבוב ולאחר מכן מקם את הצינור microcentrifuge לתוך microcentrifuge ו ספין ב 4600 x g במשך 10 דקות.
- שילוב של הגששים וחומר רך.
הערה: עבור הליך זה, ג'ל colloidal שימש את דגימת חומר רך.- בשקופית 75 × 50 מ מ זכוכית, למדוד 1 מ"ל של חומר מדגם. פיפטה µL 40 של בדיקה פתרון לתוך המרכז של המדגם.
- מקפלים בעדינות את הדגימה עם מרית מתכת עד משולב לחלוטין. סקופ המדגם לתוך צינור microcentrifuge צנטריפוגה-2340 x g 15 s כדי להוציא אוויר כלואה.
- מילוי מזרק 1 מ"ל מצויד עם מחט בקוטר 18, צינורות תרמופלסטיים ברור עם התערובת בדיקה/HCO.
- חלקיקים בדיקה כביסה
-
מעברי פאזה רצופים המושרה על ידי החלפת נוזלים
- מילוי המכשיר microfluidic
- כדי ליצור פקקים PDMS, שימוש עודף PDMS מהשלב פרוטוקול 1.2.5, לחתוך חתך מרובע 5 מ מ של PDMS. באמצעות אגרוף ביופסיה 0.5 מ מ קוטר, לחתוך חור באמצע הדרך לתוך פקק PDMS. הכנס את מחבר פלדת אל-חלד לתוך החור בקוטר 0.5 מ מ.
- להתחבר שלושת הערוצים כניסת פינה וערוץ עודפים שאיבה קאמרית צינורות תרמופלסטיים. לחלוטין למלא את המכשיר עם מים באמצעות מזרק המחובר למכשיר. להבטיח ישנם אין בועות תא הדגימה או בכל הערוצים microfluidic. לחסום את החור פינה הנותרים עם פקקים PDMS.
- האגן הממס אמורה להיות מלאה חלקית מהשלב 2.2.1.2; אם היא לא מלאה, למלא את אגן הממס במים.
- באמצעות המזרק מהשלב פרוטוקול 2.1.2.3, להזריק µL 10 תערובת מדגם/בדיקה דרך ערוץ מרכז לתוך תא הלחץ מדגם µL כ- 2/s ולאחר מכן השתמש פקק PDMS כדי לחסום את הערוץ מרכז בבית הבליעה מדגם.
- איסוף נתונים microrheological
- פנו את הגדרות המצלמה לאלה ממוטבת כדי למזער את החלקיקים סטטיים ודינמיים מעקב שגיאות, ולאחר מכן לעבור אל המטרה 63 של טבילה במים ×, pipette טיפת מים על גבי העדשה.
- למקם את המכשיר microfluidic על הבמה מיקרוסקופ ולגדל את המטרה עד ממוקד המדגם.
- להשתלט ודיאו תנועה בראונית של הגששים במרווחי זמן מתאימים האורך הכולל של שינוי פאזה. עבור gelation, להמשיך לקחת סרטונים עד בדיקה תנועה הופסק לחלוטין.
הערה: אנו אוספים נתונים כל 10 דקות. אם נתחיל עם ניסוי השפלה, הנתונים נאספים עד הגששים לשדר לחלוטין.
- החלפת נוזלים בבית הבליעה מדגם (זרימת הכבידה, חילופי נוזלים צפיפות נמוכה יותר בנוזלים צפיפות גבוהה יותר)
- הסר את ההתקן microfluidic מן הבמה מיקרוסקופ.
- לשאוב את המים האגן ממס באמצעות פיפטה של העברה ולאחר מכן פיפטה 4 מיליליטר גבוה יותר צפיפות נוזל לתוך האגן הממס.
- להחזיר את המכשיר microfluidic לבמה מיקרוסקופ וחזור לשלב 2.2.2.3
- החלפת נוזלים בבית הבליעה מדגם (זרימה היניקה, חילופי נוזלים צפיפות גבוהה יותר בנוזלים צפיפות נמוכה)
- להסיר את ההתקן microfluidic מן הבמה מיקרוסקופ ולהסיר את פקק PDMS מן החדר היניקה.
- להוסיף מזרק מצויד עם מחט בקוטר 18, צינורות תרמופלסטיים ברור לערוץ שאיבה קאמרית, לעשוק את המזרק עד מזרק משאבה. הגדר את משאבת מזרק למשוך 1 mL/min.
- להסיר את עודף הסוכן ג'לי באגן הממס ולשטוף שלוש פעמים עם מים על ידי מילוי הכיור הממס suctioning ואז את הנוזל שטיפה.
- בגין שאיבה עם המשאבה מזרק תוך הוספת מים לאגן ממס למשך דקה אחת. אל תתנו את אגן הממס ריק לחלוטין, כמו זה ימשוך אוויר לתוך החדר מדגם.
- להסיר את המזרק מהמכשיר microfluidic ולהחליף את פקק PDMS על תא היניקה.
- להחזיר את המכשיר microfluidic לבמה מיקרוסקופ ולהמשיך לקחת דגימות
- מילוי המכשיר microfluidic
- המשך נטילת דגימות במרווחי זמן קבועים במהלך השפלה/gelation מחזורי עד השלמת מספר מחזורים הרצוי או שאין מספיק זונדי מדידה.
תוצאות
מכשיר microfluidic דו שכבתי בנוי עם PDMS (איור 1א, ב), אשר הוא בדוגמת על בול microfluidic. העיצוב של החותמת מוצג באיור 1c. הגדרת הניסוי לקוי יכול לגרום הן שגיאות זורם microrheology ו- microfluidic פסיבית במהלך סביב החלפת נוזלים (איור 2). ...
Discussion
המכשיר microfluidic דו שכבתי (איור 1) יכול להתבצע בקלות על ידי טכניקות ייצור microfluidic מתועדת היטב הבאים29. זכוכית תומך מתווספים בתחתית המכשיר כדי להקטין השפעות הרטט על תנועת החללית. השקופית זכוכית הוא דק מאוד (מ מ 0.10) על מנת להתאים את המרחק עבודה של המטרה מיקרוסקופ. זה הו?...
Disclosures
ישנם אין גילויים לעבודה זו.
Acknowledgements
מימון עבור עבודה זו סופק על ידי את פרוקטר & גמבל ושות' וקרן אמריקאי כימי החברה נפט מחקר (54462-DNI7). וידוע עשוי תורמים אמריקאי כימי החברה נפט מחקר הקרן לתמיכה חלקית של מחקר זה. המחברים רוצה להכיר את ד ר מרקו Caggioni לדיונים מועיל.
Materials
| Name | Company | Catalog Number | Comments |
| 150 x 15 mm Petri Dish | Corning, Inc. | 351058 | |
| 75 x 50 x 0.15 mm glass slide | Fisher Scientific | Custom | |
| 75 x 50 x 1.0 mm glass slide | Fisher Scientific | 12-550-C | |
| 75 x 25 x 1.0 mm glass Slide | Fisher Scientific | 12-550-A3 | |
| 22 x 22 Glass cover slips | Fisher Scientific | 12-542-B | |
| Acetone, 99.5% | VWR Analytical | 67-64-1 | |
| Low intensity UV source | UVP | UVL-56 | |
| Chloroform, 99.9% | Fisher Chemical | C298-500 | |
| Cotton Swabs | Q-tips | 83289205 | |
| Ethanol, 90% | Fisher Chemical | A962-4 | |
| Fluoresbrite® YG Carboxylate Microspheres 0.50µm | Polysciences, Inc. | 15700-10 | |
| High-Intensity UV Lamp | Spectroline Corp. | SB-100P | |
| Hot plate | Corning, Inc. | PC-420 | |
| Hydrochloric Acid, 6N | Ricca Chemical Company | 3750-32 | |
| Methyltriethyoxysilane, 98% | Acros Organics | 174622500 | |
| Microcentrifuge | Eppendorf | 5424 | |
| Plasma cleaner | Harrick Plasma, Inc. | PDC-32G | |
| Polydimethylsiloxane (PDMS) | Robert McKwown Company | 2065622 | |
| Sonicator | Branson, Emerson Electric | 1800 | |
| Steel connectors, ID 0.023 inch | New England Small Tube Corp. | Custom | |
| Tetraethoxysilane, 98% | Alfa Aesar | A14965 | |
| Thiol-ene Resin (UV curable) | Norland Products, Inc. | NOA81 | |
| Transparency | Staples Inc. | 21828 | |
| Tygon tubing, ID 1/32 inch | McMaster-Carr | E-3603 | |
| Vacuum oven | Fisher Scientific | 282A | |
| Biopsy punch 8 mm | World Precision Instruments | 504535 | |
| Bioposy punch 0.5 mm | World Precision Instruments | 504528 | |
| Syringe, 30 mL | BD | 309659 | |
| Syringe, 3 mL | BD | 309651 | |
| Needle, 18 gauge | BD | 305195 | |
| Microcentrifuge tube, 1.5 mL | Eppendorf | 22-36-320-4 | |
| High-speed Camera | Vision Research | Miro M120 | |
| Microscope | Carl Zeiss AG | Zeiss Observer, Z1 | |
| Syringe pump | New Era Pump Systems | NE-300 | |
| Hydrogenated castor oil | Procter & Gamble | N/A | |
| Afício MP 6002 Printer | Ricoh Company, Ltd. | 415877 |
References
- Mitchell, P. Microfluidics-downsizing large-scale biology. Nat. Biotech. 19, 717-721 (2001).
- Haber, C. Microfluidics in commercial applications; an industry perspective. Lab Chip. 6, 1118-1121 (2006).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Huang, X., Raghavan, S. R., Terech, P., Weiss, R. G. Distinct kinetic pathways generate organogel networks with contrasting fractality and thixotropic properties. J. Am. Chem. Soc. 128, 15341-15352 (2006).
- Larsen, T. H., Schultz, K. M., Furst, E. M. Hydrogel microrheology near the liquid-solid transition. Korea-Aust. Rheol. J. 20, 165-173 (2008).
- Larsen, T. H., Furst, E. M. Microrheology of the liquid-solid transition during gelation. Phys. Rev. Lett. 100, 146001 (2008).
- Schultz, K. M., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid rheological screening to identify conditions of biomaterial hydrogelation. Soft Matter. 5, 740-742 (2009).
- Switzer, L. H., Klingenberg, D. J. Flocculation in simulations of sheared fiber suspensions. Int. J. Multiph. Flow. 30, 67-87 (2004).
- Wehrman, M. D., Lindberg, S., Schultz, K. M. Quantifying the dynamic transition of hydrogenated castor oil gels measured via multiple particle tracking microrheology. Soft Matter. 12, 6463-6472 (2016).
- Wehrman, M. D., Milstrey, M. J., Lindberg, S., Schultz, K. M. Using µ2rheology to quantify rheological properties during repeated reversible phase transitions of soft matter. Lab Chip. 17, 2085-2094 (2017).
- Wehrman, M. D., Lindberg, S. E., Schultz, K. M. Impact of shear on the structure and rheological properties of a hydrogenated castor oil colloidal gel during dynamic phase transitions. J. Rheol. , (2018).
- Loh, X. J. Dual-responsive "reversible micelles". J. Appl. Polym. Sci. 127, 992-1000 (2013).
- Kern, F., Zana, R., Candau, S. J. Rheological properties of semidilute and concentrated aqueous solutions of cetyltrimethylammonium chloride in the presence of sodium salicylate and sodium chloride. Langmuir. 7, 1344-1351 (1991).
- Trappe, V., Prasad, V., Cipelletti, L., Segre, P. N., Weitz, D. A. Jamming phase diagram for attractive particles. Nature. 411, 772-775 (2001).
- Philipse, A. P., Wierenga, A. M. On the density and structure formation in gels and clusters of colloidal rods and fibers. Langmuir. 14, 49-54 (1998).
- Schultz, K. M., Bayles, A. V., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid, high resolution screening of biomaterial hydrogelators by mu2rheology. Biomacromolecules. 12, 4178-4182 (2011).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179, 298-310 (1996).
- Mason, T. G. Estimating the viscoelastic moduli of complex fluids using the generalized Stokes--Einstein equation. Rheol. Actac. 39, 371-378 (2000).
- Mason, T. G., Ganesan, K., van Zanten, J. H., Wirtz, D., Kuo, S. C. Particle tracking microrheology of complex fluids. Phys. Rev. Lett. 79, 3282-3285 (1997).
- Mason, T. G., Weitz, D. A. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74, 1250-1253 (1995).
- Squires, T. M., Mason, T. G. Fluid mechanics of microrheology. Annu. Rev. Fluid Mech. 42, 413-438 (2010).
- Gittes, F., Schnurr, B., Olmsted, P. D., MacKintosh, F. C., Schmidt, C. F. Microscopic viscoelasticity: shear moduli of soft materials determined from thermal fluctuations. Phys. Rev. Lett. 79, 3286-3289 (1997).
- Mai, D. J., Brockman, C., Schroeder, C. M. Microfluidic systems for single DNA dynamics. Soft Matter. 8 (41), 10560-10572 (2012).
- Tanyeri, M., Ranka, M., Sittipolkul, N., Schroeder, C. M. A microfluidic-based hydrodynamic trap: design and implementation. Lab Chip. 11, 1786-1794 (2011).
- Lee, J. S., Dylla-Spears, R., Teclemariam, N. P., Muller, S. J. Microfluidic four-roll mill for all flow types. Appl. Phys. Lett. 90, 074103 (2007).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179 (1), 298-310 (1996).
- Mason, T. G., Weitz, D. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74 (7), 1250 (1995).
- Schultz, K. M., Furst, E. M. High-throughput rheology in a microfluidic device. Lab on a chip. 11, 3802-3809 (2011).
- Abate, A. R., Lee, D., Do, T., Holtze, C., Weitz, D. A. Glass coating for PDMS microfluidic channels by sol-gel methods. Lab Chip. 8, 516-518 (2008).
- Happel, J., Brenner, H. . Low Reynolds Number Hydrodynamics: with special applications to particulate media. , (1965).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved