È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Combinazione di microfluidica e Microrheology per determinare le proprietà reologiche dei materiali molli durante le transizioni di fase ripetute
In questo articolo
Riepilogo
Dimostriamo la fabbricazione e l'uso di un dispositivo microfluidico che consente più particelle rilevamento misure microrheology per studiare gli effetti reologici ripetute delle transizioni di fase su materia soffice.
Abstract
La microstruttura della materia soffice direttamente urta la proprietà reologiche macroscopiche e può essere modificata da fattori tra cui colloidale riorganizzazione cambiamenti di fase precedente e applicato al taglio. Per determinare la portata di tali modifiche, abbiamo sviluppato un dispositivo microfluidico che consente ripetano transizioni di fase indotte dal cambio della caratterizzazione microrheological e del liquido circostante limitando il taglio sul campione. Questa tecnica è µ2reologia, la combinazione di microfluidica e microrheology. Il dispositivo microfluidico è un disegno di due-strato con i flussi di ingresso simmetrica entrare in una camera del campione che intrappola il campione di gel in posto durante lo scambio di fluidi. Aspirazione possa essere applicati lontano dal pozzetto di misurazione estrarre fluidi nel pozzetto di misurazione. Proprietà reologiche del materiale sono caratterizzati utilizzando particelle più rilevamento microrheology (MPT). In MPT, particelle di sonda fluorescente sono incorporate nel materiale e il moto browniano delle sonde viene registrata utilizzando video microscopia. Il movimento delle particelle viene registrato e viene calcolata la cilindrata media-squared (MSD). il MSD è relativo a proprietà reologiche macroscopiche, utilizzando la relazione di Stokes-Einstein generalizzato. La fase del materiale viene identificato in confronto all'esponente critico relax, determinato mediante sovrapposizione tempo-cura. Misurazioni di un gel colloidale fibroso illustrano l'utilità della tecnica. Questo gel ha una struttura delicata che può essere modificata in modo irreversibile quando viene applicato il taglio. dati di reologia di2µ indicano che il materiale equilibra ripetutamente alle stesse proprietà reologiche dopo ogni transizione di fase, che indica che le transizioni di fase non giochino un ruolo nei cambiamenti microstrutturali. Per determinare il ruolo di shear, campioni possono essere tosati prima dell'iniezione nel nostro dispositivo microfluidico. reologia2µ è una tecnica ampiamente applicabile per la caratterizzazione della materia soffice che permette la determinazione delle proprietà reologiche di microstrutture delicate in un singolo campione durante le transizioni di fase in risposta a cambiamenti ripetuti nella condizioni ambientali circostanti.
Introduzione
Transizioni di fase in materia soffice possono modificare la struttura dell'impalcatura, che ha implicazioni nella stabilità finale ed elaborazione del materiale1,2,3. La caratterizzazione dei materiali molli durante le transizioni di fase dinamica fornisce informazioni essenziali circa il rapporto tra evoluzione strutturale e struttura di equilibrio e proprietà reologiche. Ad esempio, molti prodotti home care richiedono un cambiamento di fase durante l'uso dei consumatori. Inoltre, durante la produzione, fasi di lavorazione, tra cui la diluizione e miscelazione, può impartire shear che interessano le proprietà reologiche e microstruttura finale del prodotto. Comprendere le proprietà reologiche durante un cambiamento di fase assicura che il prodotto funzioni come progettato. Inoltre, se le forze alterano la partenza reologia del materiale durante la produzione, transizioni di fase possono produrre risultati inattesi e indesiderati, cambiando la destinazione d'uso prevista e l'efficacia. Al punto critico di gelificazione, definito come il punto dove il materiale transizioni da una soluzione di polimeri o di colloidi associati a una rete di gel campione-spanning, proprietà del materiale cambiano drasticamente con lievi modifiche all'associazione. Qualsiasi modifica alla struttura al punto critico gel può influire il prodotto finale4. Durante queste transizioni dinamiche, materiali morbidi hanno deboli proprietà meccaniche e misure che utilizzano tecniche sperimentali classiche possono essere all'interno la misura rumore limite5,6,7. Per tenere conto di questo, tecniche quali microrheology, che è sensibile nella gamma moduli basso (10-3 - 4 Pa), sono utilizzati per caratterizzare il gel incipiente debole durante l'evoluzione dinamica. Alcuni materiali sono sensibili ai cambiamenti nella microstruttura a causa di forze esterne, che presenta una sfida durante la caratterizzazione, come trasferimenti di materiale o di fluido possono influenzare la struttura e, in definitiva, la proprietà del materiale finale. Per evitare di alterare la microstruttura del materiale, abbiamo sviluppato un dispositivo microfluidico che possa scambiarsi il fluido ambientale intorno ad un campionamento riducendo al taglio. Scambiando l'ambiente fluido, cambiamenti nella microstruttura e proprietà reologiche sono misurati durante le transizioni di fase con il minimo contributo di taglio. Il dispositivo è combinato con più particelle microrheology (MPT) di rilevamento in una tecnica chiamata µ2reologia. Questa tecnica viene utilizzata per quantificare le proprietà del materiale cambiamenti di fase consecutivi di un gel in risposta a una forza esterna. Viene illustrata la tecnica utilizzando un fibroso gel colloidale, olio di ricino idrogenato (HCO)9,10,11.
Impalcature di gel possono subire modifiche in associazione e dissociazione a causa del loro campione ambiente12,13,14,15. La forza trainante di gelificazione e di degradazione sono materiali specifici e devono essere adattati per ogni materiale di interesse. reologia2µ può essere utilizzata per caratterizzare sistemi di gel che rispondono agli stimoli esterni, comprese le reti colloidale e polimeriche. Alterare il pH, pressione osmotica o concentrazione salina sono esempi di scacciare le forze che possono indurre cambiamenti nella microstruttura del materiale. Ad esempio, HCO subisce le transizioni di fase controllata mediante la creazione di un gradiente di pressione osmotica. Quando un campione di gel concentrato HCO (4 wt % HCO) è immerso in acqua, indeboliscono le forze attraenti fra particelle colloidali, degrado. In alternativa, quando una soluzione diluita di HCO (0,125 wt % HCO) è a contatto con un materiale idrofilo (indicato come agente gelificante e composto per lo più glicerina e tensioattivo), l'attraente forze ritorno, causando la gelificazione. Questo sistema gel serviranno per mostrare il funzionamento del dispositivo come uno strumento per la misurazione di transizioni di fase consecutivi su un singolo campione9,10. Per caratterizzare queste impalcature di gel durante transizioni dinamiche e la struttura di gel delicato incipiente alla transizione di fase critica, usiamo MPT per caratterizzare questi materiali con alta risoluzione spazio-temporale.
Microrheology viene utilizzato per determinare le proprietà del gel e la struttura, soprattutto alla transizione critica, di una matrice di materiali morbidi, tra cui gel colloidale e polimerici5,6,9,16. MPT è una tecnica di microrheological passiva che utilizza video microscopia per registrare il moto browniano delle particelle di sonda fluorescente incorporato all'interno di un campione. Le posizioni delle particelle in tutto i video sono precisamente determinate all'interno di 1/10th di un pixel usando algoritmi17,18di rilevamento classica. L'ensemble ha stato in media cilindrata media-squared (MSD, (Δr2(t))) viene calcolato da queste traiettorie delle particelle. il MSD è relativo alle proprietà del materiale, quali la conformità di creep, utilizzando la relazione di Stokes-Einstein generalizzato17,19,20,21,22, 23. Lo stato del materiale è determinato calcolando la pendenza della curva in MSD logaritmica in funzione del tempo di ritardo, α,
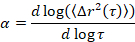
dove t è il tempo di ritardo e confrontandolo con l'esponente critico relax, n. n viene determinato utilizzando la sovrapposizione tempo-cura, una tecnica ben documentata che è stata modificata per analizzare i dati MPT di Larsen e Furst6. Tramite il confronto di n per α lo stato del materiale è determinato quantitativamente. Quando α > n il materiale è un sol e quando α < n il materiale è un gel. Il lavoro precedente ha caratterizzato il sistema HCO usando microrheology per determinare l' esponente critico relax9. Utilizzando queste informazioni, determinare con precisione quando il materiale passa da un gel a un sol durante un esperimento. Inoltre, il parametro di non-gaussiano, αNG, può essere calcolato a determinare il grado di eterogeneità strutturale di un sistema,
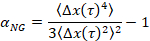
dove Δx(t) è il movimento delle particelle unidimensionale nella direzione x . Utilizzando MPT, noi possiamo caratterizzare una transizione di fase singola, ma di caratterizzazione di materiali con MPT in un dispositivo di microfluidica, siamo in grado di manipolare l'ambiente circostante fluido e raccogliere dati di diverse transizioni di fase su un campione di gel unico.
Questo dispositivo microfluidico è destinato per studiare le transizioni critiche di un campione unico gel che subisce cambiamenti di fase in risposta ai cambiamenti nell'ambiente fluido circostante. Il dispositivo scambia liquido che circonda il campione quando sia allo stato di gel o sol è bloccando il campione in grado di indurre una transizione di fase, riducendo al minimo taglio. Un bacino di solvente si trova direttamente di sopra del pozzetto, che sono collegate da sei canali di adduzione simmetricamente distanziati. Questa simmetria consente lo scambio di liquido dal bacino del solvente per la camera del campione durante la creazione di uguale pressione intorno al campione, bloccandola. Ci sono stati diversi studi che utilizzano questa tecnica per singola particella e intrappolamento del DNA, ma questo lavoro di scale il volume da singole molecole a campioni che sono circa 10 µ l24,25,26. Questo design unico consente inoltre la caratterizzazione di microrheological in tempo reale durante le transizioni di fase.
reologia2µ è una tecnica robusta che è applicabile a molti sistemi di materia soffice. La tecnica descritta in questo documento è stata progettata per gel colloidale, ma può essere facilmente adattato ad altri materiali come polimero o soluzioni micellari. Con questa tecnica, determiniamo non solo come transizioni di fase influenzano le proprietà del materiale di equilibrio, ma anche come diverse fasi possono avere effetti sull'evoluzione reologica del materiale e la struttura finale dell'impalcatura duraturi e Proprietà.
Protocollo
1. fabbricazione del dispositivo microfluidico
- Fabbricazione di timbro di microfluidica.
Nota: Questo passaggio richiede l'uso di materiali volatili e dovrebbe essere fatto in una cappa chimica.- Utilizzare un disegno stampato negativo con le stesse dimensioni come il vetrino (75 × 50 mm), il bianco colorato di canali, e lo sfondo di colore nero (Vedi Figura 1). Stampare questo disegno su un foglio di acetato trasparente (trasparenza) con una risoluzione di 1200 dpi.
- Se la sezione scura della trasparenza permette ancora di luce attraverso, layer diversi aspetti negativi e aderire utilizzando nastro biadesivo.
- Accendere la sorgente luminosa ad alta intensità (UV) di ultravioletto e consentono di riscaldare per un'uscita costante (circa 30 min).
Nota: Occhiali protettivi UV devono essere indossati quando si utilizza la sorgente di luce UV ad alta intensità. - Riempimento a tre 150ml Petri con acetone, etanolo e acqua distillata.
- Posizionare una trasparenza in bianco su una superficie piatta vicino alla fonte di UV ad alto rendimento, ma non direttamente sotto la UV luce. Ciò fornirà una base per fabbricare il timbro di microfluidica.
- Delineare gli angoli di una 75 × 50 mm lastra di vetro al centro della trasparenza in bianco usando un permanente marcatore e posto quattro vetro distanziali (approssimativamente. 30 × 30 × 1 mm) negli angoli del rettangolo delineato.
- Versare circa 5 mL di resina del tiolo: ene curabile UV nel centro dei distanziali, quindi posizionare con cura un 75 x 50 x 1 vetrino mm sul vetro distanziatori, in modo che la colla è completamente coperto dal vetrino senza bolle d'aria.
- Posizionare la trasparenza con negativo stampato sopra il vetrino e spostare tutti i componenti di cui sopra (dal basso verso l'alto: trasparenza, vetro distanziali e colla UV, vetrino e negativo trasparenza stampata in bianco) trascinando la trasparenza in bianco con attenzione sotto la sorgente di luce UV.
- Consentire la luce UV a brillare attraverso il negativo sulla resina e cura. Il tempo di cura può essere regolato per modificare l'altezza del canale. Un 45 s tempo risultati cure in un'altezza di canale di 1 mm, con la nostra fonte di luce.
- Spostare i componenti lontano dalla sorgente UV e rimuovere la trasparenza stampato negativo e vetrino. Il vetrino con i canali fabbricato in colla UV sarà ora essere denominato il timbro di microfluidica.
- Scartare i distanziatori trasparenza e vetro.
- Immergere il timbro di microfluidica in acetone bagno, seguito dal bagno di etanolo. Ripetere questo passaggio due volte. Acetone si degrada la colla UV, quindi non lasciare acetone sul francobollo per maggiore di 10 s.
- Tenendo il timbro, immergere il timbro in acqua e utilizzare un tampone di cotone per rimuovere il resto della resina non reagito. Non strofinare direttamente le porzioni di salumi, come farà i canali ruvido.
- Apporre il timbro su un tovagliolo di carta e tornare alla sorgente UV per almeno 30 minuti garantire una polimerizzazione completa.
- Stampaggio di polidimetilsilossano (PDMS)
- Versare una tazza trasparente 70 g di PDMS base e aggiungere l'agente reticolante alla base in un rapporto di peso di 01:10 reticolante alla base. Questi sono il produttore consigliato rapporti. Non utilizzare un contenitore di vetro.
- Mescolare il reticolante e base accuratamente con un agitatore in metallo; la miscela deve essere torbida a causa di bolle d'aria intrappolate una volta correttamente miscelato.
- Mettere il PDMS in un vuoto vuoto forno e tirare sul mista PDMS. Disattivare il vuoto se la soluzione inizia a traboccare dalla tazza, quindi riprendere il vuoto dopo l'overflow si abbassa. La pressione totale in forno sottovuoto non importa, come il vuoto solo accelera il processo di degasaggio. Lasciare nella camera fino a quando tutte le bolle sono state evacuate dalla miscela (circa 60 min).
- Posto il timbro di microfluidica in plastica di un vuoto 150 mm diametro piastra di Petri, quindi versare lentamente il PDMS in Petri, coprendo completamente il timbro di microfluidica. Versare vicino alla superficie del piatto Petri per minimizzare bubbles riformare nel PDMS.
- Coprire la piastra di Petri e mettere in forno a 55 ° C durante la notte per curare. Una volta completamente guarito, tagliare il PDMS modellato usando un coltello e togliere il timbro. Mantenere PDMS in eccesso per la costruzione del bacino di solvente (passo di protocollo 1.6.3) e tappi PDMS (passo di protocollo 2.2.1.1).
- Con un pugno di biopsia di 0,5 mm, tagliare fori nelle posizioni seguenti: uno in ogni angolo, uno nella camera di aspirazione vicino al bordo del canale, sei nel pozzetto di misurazione collocato simmetricamente 60° di distanza e uno al centro della camera del campione. Per garantire fori posizionati simmetricamente stampare un modello su un foglio di carta e posto sotto la camera del campione. Poiché il PDMS è chiaro, si può facilmente vedere dove i fori devono essere collocati.
- Preparazione della soluzione di sol-gel per creare pareti di vetro nel dispositivo microfluidico
- In un barattolo da 100 mL, aggiungere 25 mL di etanolo al 90%, 25 mL di pH 4 (0,0001 M) soluzione di acido cloridrico, 25 mL di tetraetossisilano 98% e 25 mL di 98% metiltrietossisilano. Posto 100 mL di soluzione, noto ora come fluido preconverted, nel forno a microonde scoperto per 10 secondi e quindi posto in un 80 ° C durante la notte.
- Montaggio del dispositivo
- Posizionare entrambi il PDMS fantasia e un 75 × 50 × 0,10 mm pulitore di vetro diapositiva nel plasma e impostare la valvola a 3 vie in posizione off.
- Accendere la pompa del vuoto e consentire un minuto evacuare la camera.
- Mettere la valvola a 3 vie per posizione regolatore di flusso e lasciare che la camera di equilibrare per 5 secondi. La posizione del regolatore di flusso permette una piccola portata di aria di entrare il plasma più pulito, abbastanza basso per tenere la camera a basse pressioni. Accendere l'interruttore di frequenza radio (RF) medio per 40 secondi, poi si spegne l'interruttore di RF e la pompa del vuoto.
- Posizionare la valvola a 3 vie per la posizione aperta per restituire la camera alle condizioni atmosferiche. Rimuovere il vetrino PDMS e vetro modellato.
- Accuratamente aderire il PDMS modellato sul vetrino mettendo le due superfici in contatto tra loro.
- Applicare UV resina per le cuciture intorno alla fantasia PDMS e cura per 5 min sotto luce UV di bassa intensità.
- Realizzazione di pareti di vetro nei canali microfluidici.
Nota: Questo passaggio deve essere completato entro 30 minuti di trattamento al plasma, in quanto si basa su cambiamenti di superficie PDMS che si verificano durante il trattamento al plasma. Lo spessore dello strato sarà circa 5-10 µm. Questo passaggio richiede l'uso di materiali volatili e dovrebbe essere fatto in una cappa chimica.- Impostare una piastra riscaldante a 100 ° C e preparare quattro siringhe (tre 30 mL e 3 mL) con aghi di calibro 18 e circa 30 cm di lunghezza di tubi termoplastici chiaro.
- Riempire tre siringhe da 30 mL con etanolo, cloroformio e aria, rispettivamente. Riempire una siringa da 3 mL di liquido preconverted (dal passaggio di protocollo 1.3.1.)
- Inserire i tubi chiari termoplastici utilizzando connettori in acciaio inox in ciascuno dei fori il PDMS fantasia, con l'eccezione di foro in un angolo. Questo foro fungerà da un'insenatura, mentre tutti gli altri saranno prese.
- Riempire il dispositivo microfluidico con preconverted liquido dalla siringa, quindi posizionare il dispositivo microfluidico sulla piastra calda 100 ° C, quindi il fondo di vetro sta toccando la superficie della piastra riscaldante.
- 3 mL di liquido preconverted il flusso attraverso il dispositivo microfluidico oltre 10 secondi. Lo spessore delle pareti di vetro viene regolato modificando la portata del fluido preconverted.
- Rimuovere il dispositivo microfluidico dalla piastra riscaldante. Sostituire la siringa di soluzione preconverted con la siringa ad aria e spingere fuori il liquido in eccesso preconverted.
- Sostituire la siringa ad aria con la siringa di cloroformio e lentamente fluire 15 mL di cloroformio attraverso il dispositivo microfluidico. Sostituire la siringa di cloroformio con la siringa di etanolo e lentamente fluire 30 mL di etanolo attraverso il dispositivo microfluidico. Questa procedura dovrebbe prendere circa 1 min.
- Sostituire la siringa di etanolo con l'aria di siringa e flusso di aria attraverso il dispositivo microfluidico fino a secco.
- Applicazione di sostegni di vetro e bacino di solvente
- 75 × 10 × 1 mm di taglio in strisce di vetro da 75 × 25 × 1 vetro diapositive.
- Applicare le strisce di vetro UV resina. Collocare il dispositivo microfluidico sulle strisce, con il lato PDMS rivolto verso l'alto. Spostare sotto fonte di luce UV di bassa intensità per 5 minuti.
- Tagliare un 30 × 30 mm quadrati di PDMS. Usando un punzone per biopsia, tagliare un buco abbastanza grande da coprire la camera di campionamento di 10 mm.
- Posizionare il PDMS quadrati e dispositivo microfluidico nel plasma pulitore, poi mettere la valvola a 3 vie in posizione off e accendere la pompa del vuoto.
- Consentire un minuto evacuare la camera. Mettere la valvola a 3 vie per la posizione del regolatore di flusso e lasciare la camera equilibrare per 5 secondi.
- Accendere interruttore di RF al mezzo per 40 secondi, poi si spegne switch RF e pompa a vuoto.
- Posizionare la valvola a 3 vie per la posizione aperta per restituire la camera alle condizioni atmosferiche.
- Rimuovere il dispositivo di bacino e microfluidica solvente dalla camera plasma e aderire contattando le superfici. Assicurarsi di posizionare il bacino del solvente sopra la camera del campione.
2. µ2reologia procedura
-
Preparazione dei campioni di materia soffice
- Particelle di sonda di lavaggio
- Pipettare 0,5 µm sonde e acqua in un tubo del microcentrifuge con un rapporto di acqua per sonde di 10:1. Mescolare accuratamente con pipetta di miscelazione, quindi posizionare il tubo del microcentrifuge nella microcentrifuga e spin a 4600 x g per 10 minuti.
Nota: La soluzione della sonda utilizzata in questo lavoro viene ricevuta sospesa in acqua con una concentrazione iniziale del 2,6% solidi/volume e la concentrazione finale delle sonde utilizzate nell'esempio è 0.1% solidi/volume. - Rimuovere il tubo del microcentrifuge e pipetta fuori il supernatante. Sostituire il surnatante con dell'acqua distillata. Ripetere la centrifugazione per un totale di tre volte.
- Inserire il tubo del microcentrifuge in sonicatore e Sonicare su bassa per 15 minuti per rimuovere qualsiasi aggregazione.
- Pipettare 0,5 µm sonde e acqua in un tubo del microcentrifuge con un rapporto di acqua per sonde di 10:1. Mescolare accuratamente con pipetta di miscelazione, quindi posizionare il tubo del microcentrifuge nella microcentrifuga e spin a 4600 x g per 10 minuti.
- Sonde di combinazione e materia soffice.
Nota: Per questa procedura, un gel colloidale è stato usato come il campione di materia soffice.- Su un vetrino 75 × 50 mm misura 1 mL di materiale campione. Dispensare 40 µ l di soluzione della sonda al centro del campione.
- Aggiungere delicatamente il campione con una spatola di metallo fino a quando completamente combinati. Raccogliere il campione in un tubo del microcentrifuge e centrifugare a 2340 x g per 15 s per rimuovere l'aria intrappolata.
- Dotato di riempire una siringa da 1 mL con ago calibro 18 tubi chiari termoplastici con la miscela di sonda/HCO.
- Particelle di sonda di lavaggio
-
Transizioni di fase consecutivi indotte dal fluido di scambio
- Riempimento del dispositivo microfluidico
- Per creare tappi PDMS, utilizzando PDMS in eccesso dal passaggio di protocollo 1.2.5, tagliare una sezione quadrata di 5 mm di PDMS. Usando un punzone per biopsia diametro 0,5 mm, tagliare a metà un foro nel tappo PDMS. Inserire un connettore in acciaio inox il foro di diametro di 0,5 mm.
- Collegare tubi termoplastici a tre dei canali ingresso angolo e il canale di scarico della camera di aspirazione. Riempire completamente il dispositivo con acqua utilizzando una siringa collegata al dispositivo. Garantire non ci sono bolle nel pozzetto di misurazione o nei canali microfluidici. Bloccare il foro di angolo rimanente con PDMS tappi.
- Bacino del solvente deve essere parzialmente riempito dal punto 2.2.1.2; Se non viene riempita, è possibile riempire il bacino solvente con acqua.
- Utilizzando la siringa dal passaggio di protocollo 2.1.2.3, iniettare 10 µ l di miscela della sonda di prelievo attraverso il canale centrale nella camera del campione a circa 2 µ l/s, quindi utilizzare un tappo PDMS per bloccare il canale centrale nel pozzetto di misurazione.
- La raccolta di dati microrheological
- Attivare le impostazioni della fotocamera per quelli ottimizzati per ridurre al minimo delle particelle statiche e dinamiche, rilevamento errori, poi cambiare il 63 × obiettivo di immersione in acqua e dispensare una goccia d'acqua sulla lente.
- Collocare il dispositivo microfluidico sul tavolino del microscopio e sollevare l'obiettivo fino a quando è focalizzato sul campione.
- Prendere video del moto browniano delle sonde in intervalli di tempo appropriati per la lunghezza totale di un cambiamento di fase. Per gelificazione, continuare a prendere video fino a quando la sonda movimento si è arrestato completamente.
Nota: Raccogliamo i dati ogni 10 min. Se cominciamo con un esperimento di degradazione, i dati sono raccolti fino a quando le sonde sono completamente diffondente.
- Lo scambio di fluidi nel pozzetto di misurazione (flusso di gravità, lo scambio di fluidi di densità inferiore con fluidi di densità maggiore)
- Rimuovere il dispositivo microfluidico dal tavolino del microscopio.
- L'acqua dal bacino del solvente utilizzando una pipetta di trasferimento di aspirazione, quindi dispensare 4 mL di liquido di densità superiore in bacino del solvente.
- Restituire il dispositivo microfluidico per il tavolino del microscopio e ripetere al passaggio 2.2.2.3
- Lo scambio di fluidi nel pozzetto di misurazione (flusso di aspirazione, scambio di maggiore densità fluidi con fluidi di densità inferiore)
- Rimuovere il dispositivo microfluidico dal tavolino del microscopio e rimuovere il tappo PDMS dalla camera di aspirazione.
- Inserire una siringa con un ago da 18 gauge e tubi chiari termoplastici al canale camera di aspirazione e collegare la siringa fino a una pompa a siringa. Impostare la pompa a siringa per tirare a 1 mL/min.
- Rimuovere l'agente gelificante in eccesso nel bacino del solvente e lavare tre volte con acqua da riempire il bacino solvente e quindi ad aspirare il liquido di risciacquo.
- Begin aspirazione con pompa a siringa durante l'aggiunta di acqua al bacino del solvente per un minuto. Non lasciare che il solvente bacino vuoto completamente, come questo si tirerà aria nella camera del campione.
- Rimuovere la siringa dal dispositivo microfluidico e sostituire il tappo PDMS sulla camera di aspirazione.
- Restituire il dispositivo microfluidico per il tavolino del microscopio e continuare a prendere campioni
- Riempimento del dispositivo microfluidico
- Continuare a prendere campioni a intervalli regolari durante la degradazione/gelificazione cicli fino a quando non viene completato il numero desiderato di cicli o ci sono insufficienti sonde per la misura.
Risultati
Un dispositivo microfluidico a due strati è costruito con PDMS (Figura 1a, b), che è modellato su un francobollo di microfluidica. Il design del bollo è mostrato in Figura 1c. Installazione sperimentale errata può provocare sia in errori nei flussi di microrheology e microfluidica passivi durante che circondano scambio fluido (Figura 2). Esempi di setup speriment...
Discussione
Il dispositivo di due-strato microfluidica (Figura 1) può essere facilmente fatta seguente ben documentato microfluidici fabbricazione tecniche29. Sostegni di vetro vengono aggiunte alla parte inferiore del dispositivo per diminuire gli effetti vibrazionali il movimento della sonda. Il vetrino è molto sottile (0,10 mm) al fine di accogliere la distanza di lavoro l'obiettivo del microscopio. Questo rende il dispositivo suscettibile di piccole vibrazioni nell'edificio...
Divulgazioni
Non ci sono nessun informazioni integrative per questo lavoro.
Riconoscimenti
Finanziamento di quest'opera fu fornito dalla Procter & Gamble co e l'americano chimico società Petroleum Research Fund (54462-DNI7). Riconoscimento viene dato ai donatori della American Chemical Society petrolio fondo di ricerca supporto parziale di questa ricerca. Gli autori desidera ringraziare il Dr. Marco Caggioni per utili discussioni.
Materiali
| Name | Company | Catalog Number | Comments |
| 150 x 15 mm Petri Dish | Corning, Inc. | 351058 | |
| 75 x 50 x 0.15 mm glass slide | Fisher Scientific | Custom | |
| 75 x 50 x 1.0 mm glass slide | Fisher Scientific | 12-550-C | |
| 75 x 25 x 1.0 mm glass Slide | Fisher Scientific | 12-550-A3 | |
| 22 x 22 Glass cover slips | Fisher Scientific | 12-542-B | |
| Acetone, 99.5% | VWR Analytical | 67-64-1 | |
| Low intensity UV source | UVP | UVL-56 | |
| Chloroform, 99.9% | Fisher Chemical | C298-500 | |
| Cotton Swabs | Q-tips | 83289205 | |
| Ethanol, 90% | Fisher Chemical | A962-4 | |
| Fluoresbrite® YG Carboxylate Microspheres 0.50µm | Polysciences, Inc. | 15700-10 | |
| High-Intensity UV Lamp | Spectroline Corp. | SB-100P | |
| Hot plate | Corning, Inc. | PC-420 | |
| Hydrochloric Acid, 6N | Ricca Chemical Company | 3750-32 | |
| Methyltriethyoxysilane, 98% | Acros Organics | 174622500 | |
| Microcentrifuge | Eppendorf | 5424 | |
| Plasma cleaner | Harrick Plasma, Inc. | PDC-32G | |
| Polydimethylsiloxane (PDMS) | Robert McKwown Company | 2065622 | |
| Sonicator | Branson, Emerson Electric | 1800 | |
| Steel connectors, ID 0.023 inch | New England Small Tube Corp. | Custom | |
| Tetraethoxysilane, 98% | Alfa Aesar | A14965 | |
| Thiol-ene Resin (UV curable) | Norland Products, Inc. | NOA81 | |
| Transparency | Staples Inc. | 21828 | |
| Tygon tubing, ID 1/32 inch | McMaster-Carr | E-3603 | |
| Vacuum oven | Fisher Scientific | 282A | |
| Biopsy punch 8 mm | World Precision Instruments | 504535 | |
| Bioposy punch 0.5 mm | World Precision Instruments | 504528 | |
| Syringe, 30 mL | BD | 309659 | |
| Syringe, 3 mL | BD | 309651 | |
| Needle, 18 gauge | BD | 305195 | |
| Microcentrifuge tube, 1.5 mL | Eppendorf | 22-36-320-4 | |
| High-speed Camera | Vision Research | Miro M120 | |
| Microscope | Carl Zeiss AG | Zeiss Observer, Z1 | |
| Syringe pump | New Era Pump Systems | NE-300 | |
| Hydrogenated castor oil | Procter & Gamble | N/A | |
| Afício MP 6002 Printer | Ricoh Company, Ltd. | 415877 |
Riferimenti
- Mitchell, P. Microfluidics-downsizing large-scale biology. Nat. Biotech. 19, 717-721 (2001).
- Haber, C. Microfluidics in commercial applications; an industry perspective. Lab Chip. 6, 1118-1121 (2006).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Huang, X., Raghavan, S. R., Terech, P., Weiss, R. G. Distinct kinetic pathways generate organogel networks with contrasting fractality and thixotropic properties. J. Am. Chem. Soc. 128, 15341-15352 (2006).
- Larsen, T. H., Schultz, K. M., Furst, E. M. Hydrogel microrheology near the liquid-solid transition. Korea-Aust. Rheol. J. 20, 165-173 (2008).
- Larsen, T. H., Furst, E. M. Microrheology of the liquid-solid transition during gelation. Phys. Rev. Lett. 100, 146001 (2008).
- Schultz, K. M., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid rheological screening to identify conditions of biomaterial hydrogelation. Soft Matter. 5, 740-742 (2009).
- Switzer, L. H., Klingenberg, D. J. Flocculation in simulations of sheared fiber suspensions. Int. J. Multiph. Flow. 30, 67-87 (2004).
- Wehrman, M. D., Lindberg, S., Schultz, K. M. Quantifying the dynamic transition of hydrogenated castor oil gels measured via multiple particle tracking microrheology. Soft Matter. 12, 6463-6472 (2016).
- Wehrman, M. D., Milstrey, M. J., Lindberg, S., Schultz, K. M. Using µ2rheology to quantify rheological properties during repeated reversible phase transitions of soft matter. Lab Chip. 17, 2085-2094 (2017).
- Wehrman, M. D., Lindberg, S. E., Schultz, K. M. Impact of shear on the structure and rheological properties of a hydrogenated castor oil colloidal gel during dynamic phase transitions. J. Rheol. , (2018).
- Loh, X. J. Dual-responsive "reversible micelles". J. Appl. Polym. Sci. 127, 992-1000 (2013).
- Kern, F., Zana, R., Candau, S. J. Rheological properties of semidilute and concentrated aqueous solutions of cetyltrimethylammonium chloride in the presence of sodium salicylate and sodium chloride. Langmuir. 7, 1344-1351 (1991).
- Trappe, V., Prasad, V., Cipelletti, L., Segre, P. N., Weitz, D. A. Jamming phase diagram for attractive particles. Nature. 411, 772-775 (2001).
- Philipse, A. P., Wierenga, A. M. On the density and structure formation in gels and clusters of colloidal rods and fibers. Langmuir. 14, 49-54 (1998).
- Schultz, K. M., Bayles, A. V., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid, high resolution screening of biomaterial hydrogelators by mu2rheology. Biomacromolecules. 12, 4178-4182 (2011).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179, 298-310 (1996).
- Mason, T. G. Estimating the viscoelastic moduli of complex fluids using the generalized Stokes--Einstein equation. Rheol. Actac. 39, 371-378 (2000).
- Mason, T. G., Ganesan, K., van Zanten, J. H., Wirtz, D., Kuo, S. C. Particle tracking microrheology of complex fluids. Phys. Rev. Lett. 79, 3282-3285 (1997).
- Mason, T. G., Weitz, D. A. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74, 1250-1253 (1995).
- Squires, T. M., Mason, T. G. Fluid mechanics of microrheology. Annu. Rev. Fluid Mech. 42, 413-438 (2010).
- Gittes, F., Schnurr, B., Olmsted, P. D., MacKintosh, F. C., Schmidt, C. F. Microscopic viscoelasticity: shear moduli of soft materials determined from thermal fluctuations. Phys. Rev. Lett. 79, 3286-3289 (1997).
- Mai, D. J., Brockman, C., Schroeder, C. M. Microfluidic systems for single DNA dynamics. Soft Matter. 8 (41), 10560-10572 (2012).
- Tanyeri, M., Ranka, M., Sittipolkul, N., Schroeder, C. M. A microfluidic-based hydrodynamic trap: design and implementation. Lab Chip. 11, 1786-1794 (2011).
- Lee, J. S., Dylla-Spears, R., Teclemariam, N. P., Muller, S. J. Microfluidic four-roll mill for all flow types. Appl. Phys. Lett. 90, 074103 (2007).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179 (1), 298-310 (1996).
- Mason, T. G., Weitz, D. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74 (7), 1250 (1995).
- Schultz, K. M., Furst, E. M. High-throughput rheology in a microfluidic device. Lab on a chip. 11, 3802-3809 (2011).
- Abate, A. R., Lee, D., Do, T., Holtze, C., Weitz, D. A. Glass coating for PDMS microfluidic channels by sol-gel methods. Lab Chip. 8, 516-518 (2008).
- Happel, J., Brenner, H. . Low Reynolds Number Hydrodynamics: with special applications to particulate media. , (1965).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon