Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Combinant la microfluidique et microrhéologie pour déterminer les propriétés rhéologiques de la matière molle au cours de Transitions de phases répétées
Dans cet article
Résumé
Nous démontrons la fabrication et l’utilisation d’un dispositif microfluidique qui permet le suivi des mesures microrhéologie pour étudier les effets rhéologiques des transitions de phases répétées sur la matière molle de particules multiples.
Résumé
La microstructure de la matière molle directement effets macroscopiques propriétés rhéologiques et peut être modifiée par des facteurs incluant colloïdal réarrangement lors des changements de la phase précédente et appliqué au cisaillement. Pour déterminer l’ampleur de ces changements, nous avons développé un dispositif microfluidique que permet répété des transitions de phase induites par l’échange de la caractérisation de fluides et microrheological environnante tout en limitant au cisaillement sur l’échantillon. Cette technique est µ2rhéologie, la combinaison de la microfluidique et microrhéologie. Le dispositif microfluidique est une conception de la bicouche avec des flux d’entrée symétrique entrant dans une chambre à échantillon qui intercepte l’échantillon de gel en place au cours de l’échange de fluides. Succion peut être appliquée très loin de la chambre de mesure extraire des fluides dans le compartiment de mesure. Propriétés rhéologiques des matériaux sont caractérisées à l’aide de plusieurs particules, suivi de microrhéologie (MPT). MPT, sonde fluorescente particules sont incorporées dans le matériau et le mouvement brownien des sondes est enregistré à l’aide de la microscopie vidéo. Le mouvement des particules est suivi et le déplacement quadratique moyenne (MSD) est calculé. Le TMS est liée à des propriétés rhéologiques macroscopiques, en utilisant la Relation de Stokes-Einstein généralisée. La phase de la matière est identifié par comparaison à l’exposant critique de relaxation, déterminée à l’aide de superposition de temps-cure. Les mesures d’un gel colloïdal fibreux illustrent l’utilité de la technique. Ce gel a une structure délicate qui peut être irréversiblement changée lorsque l’inclinaison est appliquée. données de rhéologie µ2montrent que le matériau s’équilibre à plusieurs reprises pour les mêmes propriétés rhéologiques après chaque phase de la transition, indiquant que les transitions de phase ne jouent pas un rôle dans modifications microstructurales. Pour déterminer le rôle de cisaillement, les échantillons peuvent être cisaillés avant injection dans notre dispositif microfluidique. rhéologie de2µ est une technique largement applicable pour la caractérisation de la matière molle permettant la détermination des caractéristiques rhéologiques des microstructures délicates dans un seul échantillon au cours de transitions de phase en réponse aux changements répétés dans le conditions environnementales existantes.
Introduction
Transitions de phase dans la matière molle peuvent changer la structure de l’échafaudage, qui a des implications dans la stabilité de transformation et finale de la matière1,2,3. La caractérisation de matériaux mous au cours de transitions de phase dynamique fournit des informations essentielles sur la relation entre l’évolution structurale et structure d’équilibre et des propriétés rhéologiques. Par exemple, de nombreux produits de soins à domicile nécessitent un changement de phase au cours de l’utilisation par les consommateurs. Aussi, lors de sa fabrication, étapes de traitement, y compris la dilution et le mixage, peut donner au cisaillement qui affectent les propriétés rhéologiques et microstructure finale du produit. Comprendre les propriétés rhéologiques tout au long d’un changement de phase permet d’utiliser le produit comme prévu. En outre, si les forces modifient la rhéologie départ du matériau lors de sa fabrication, transitions de phase peuvent donner des résultats inattendus et indésirables, changer la fonction et l’efficacité. Au point critique de gélation, défini comme le point où le matériau passe d’une solution de colloïdes associés ou de polymères à un réseau s’étendant sur échantillon de gel, les propriétés du matériau changent radicalement avec de légères modifications à l’association. Toute modification apportée à la structure au point critique de gel peut influer sur le produit final4. Pendant ces transitions dynamiques, matériaux souples ont de faibles propriétés mécaniques et des mesures qui utilisent des techniques expérimentales classiques peuvent être dans la mesure bruit limite5,6,7. Pour tenir compte de cette, techniques telles que microrhéologie, qui est sensible dans la gamme de modules d’élasticité faible (10-3 - 4 Pa), sont utilisés pour caractériser le gel naissant faible au cours de l’évolution dynamique. Certains matériaux sont sensibles à l’évolution de la microstructure en raison des forces extérieures, qui présente un défi lors de la caractérisation, que tout transfert de matériel ou de fluide peut influer sur la structure et, en fin de compte, les propriétés du matériau finales. Pour éviter d’altérer la microstructure des matériaux, nous avons développé un dispositif microfluidique qui peut échanger le fluide environnement autour d’un échantillon tout en minimisant le cisaillement. En échangeant l’environnement fluide, changements dans les propriétés rhéologiques et la microstructure sont mesurées au cours de transitions de phase avec des contributions minimales de cisaillement. Le dispositif est combiné avec plusieurs particules microrhéologie (MPT) de suivi dans une technique appelée µ2rhéologie. Cette technique est utilisée pour quantifier les propriétés matérielles lors des changements de phase consécutive d’un gel en réponse à un moteur externe. La technique sera illustrée à l’aide d’un gel colloïdal fibreux, l’huile de ricin hydrogénée (HCO)9,10,11.
Gel échafaudages peuvent subir des changements dans l’association et de dissociation en raison de leur échantillon environnement12,13,14,15. La force motrice de gélification et de dégradation sont matériel spécifique et doit être adaptée pour chaque matériau d’intérêt. rhéologie de2µ peut servir à caractériser les systèmes de gel qui répondent à des stimuli externes, y compris les réseaux colloïdaux et polymères. Modification de pH, pression osmotique ou concentration en sel est des exemples de moteurs qui peuvent induire des changements dans la microstructure du matériau. Par exemple, HCO subit des transitions de phase contrôlée en créant un gradient de pression osmotique. Lorsqu’un échantillon de gel concentré HCO (4 % en poids HCO) est immergé dans l’eau, les forces d’attraction entre les particules colloïdales s’affaiblir, entraînant la dégradation. Par ailleurs, lorsqu’une solution diluée d’HCO (0,125 % de poids HCO) est en contact avec un matériau hydrophile (dénommé le gélifiant et composé principalement de glycérine et agent tensio-actif), la séduisante forces retour, causant la gélification. Ce système de gel servira à montrer le fonctionnement de l’appareil comme un outil pour mesurer les transitions de phases consécutives sur un seul échantillon9,10. Pour caractériser ces échafaudages de gel au cours des transitions dynamiques et la structure délicate gel naissante à la transition de la phase critique, les MPT nous permet de caractériser ces matériaux avec une haute résolution temporelle.
Microrhéologie est utilisée pour déterminer les propriétés du gel et structure, en particulier pour la transition critique, d’un tableau des matériaux souples, y compris les gels colloïdaux et polymères5,6,9,16. MPT est une technique de microrheological passive qui utilise la microscopie vidéo pour enregistrer le mouvement brownien des particules sonde fluorescente intégré au sein d’un échantillon. Les positions des particules dans les vidéos sont précisément déterminées à 1/10ème d’un pixel à l’aide classique suivi algorithmes17,18. L’ensemble en moyenne quadratique moyenne cylindrée (MSD, (Δr2(t))) est calculé à partir de ces trajectoires de particules. Le TMS est lié aux propriétés des matériaux, tels que la conformité de fluage, en utilisant la Relation de Stokes-Einstein généralisée17,19,20,21,22, 23. L’état de la matière est déterminée en calculant la pente logarithmique de la courbe MSD en fonction du temps de latence, α,
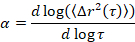
où t est le temps de latence et en le comparant à l’exposant critique de relaxation, n. n est déterminé à l’aide de superposition de temps-cure, une technique bien documentée qui a été modifiée pour analyser les données de la MPT de Larsen et Furst6. En comparaison de n α l’état de la matière est déterminé quantitativement. Lorsque α > n le matériau est un sol et quand α < n le matériau est un gel. Les travaux précédents a caractérisé le système HCO utilisant microrhéologie pour déterminer l' exposant critique de relaxation9. En utilisant cette information, nous déterminons précisément lorsque le matériel effectue une transition d’un gel d’un sol pendant une expérience. En outre, le paramètre non gaussiennes, αNG, peut être calculé pour déterminer le degré d’hétérogénéité structurelle d’un système,
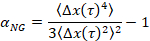
Δx(t) étant le mouvement de la particule unidimensionnel dans la direction x . À l’aide de MPT, nous pouvons caractériser une transition de phase unique, mais de caractériser les matériaux avec MPT dans un dispositif microfluidique, nous sommes en mesure de manipuler le milieu liquide environnant et de recueillir des données de plusieurs transitions de phase sur un échantillon de gel unique.
Ce dispositif microfluidique est conçu pour étudier les transitions critiques d’un échantillon de gel unique qui subit des changements de phase en réponse aux changements dans le milieu liquide environnant. Le dispositif échange liquide entourant l’échantillon lorsqu’il est dans l’état de gel ou de sol en verrouillant l’échantillon permettant d’induire une transition de phase tout en minimisant le cisaillement. Un bassin de solvant se situe directement au-dessus de la chambre de mesure, qui sont reliées par six canaux d’entrée symétriquement espacés. Cette symétrie permet l’échange de liquide dans le bassin de solvant pour le compartiment de mesure tout en créant une pression égale autour de l’échantillon, verrouiller en place. Il y a eu plusieurs études qui utilisent cette technique pour une seule particule et le piégeage de l’ADN, mais ce travail évolue au volume de molécules simples vers des exemples qui sont environ 10 µL24,25,26. Cette conception unique permet également la caractérisation microrheological en temps réel au cours de transitions de phase.
rhéologie de2µ est une technique robuste qui s’applique à de nombreux systèmes de matière molle. La technique décrite dans le présent document a été conçue pour les gels colloïdaux, mais il peut être facilement adaptée à d’autres matériaux tels que le polymère ou solutions micellaires. Avec cette technique, nous déterminons non seulement comment les transitions de phase affectent les propriétés matérielles de l’équilibre, mais aussi comment les différentes étapes peuvent avoir des effets sur l’évolution rhéologique du matériau et la structure de l’échafaudage final durables et Propriétés.
Protocole
1. fabrication du dispositif microfluidique
- Fabrication de microfluidique de timbre.
Remarque : Cette étape nécessite l’utilisation de matières volatiles et doit se faire sous une hotte chimique.- Utiliser un dessin imprimé négatif avec les mêmes dimensions que la lame de verre (75 × 50 mm), le blanc couleur de canaux, et le fond de couleur noir (voir Figure 1). Imprimer ce dessin sur une feuille d’acétate clair (transparence) avec une résolution de 1200 dpi.
- Si la partie sombre de la transparence permet toujours la lumière à travers, couche plusieurs négatifs et adhérer à l’aide de ruban adhésif double face.
- Allumez la source lumineuse de l’ultraviolette (UV) de forte intensité et laissez-le se réchauffer à une puissance constante (environ 30 min).
Remarque : Des lunettes de protection UV doivent être portés lors de l’utilisation de la source de lumière UV de forte intensité. - Remplissage trois plats de Pétri de 150 mL avec l’acétone, l’éthanol et l’eau distillée.
- Placez un transparent vierge sur une surface plane à proximité de la source d’UV à haut rendement, mais pas directement sous la lampe à UV légère. Cela fournira une base pour fabriquer le timbre de la microfluidique.
- Décrire les coins d’un 75 × 50 mm porte-objet en verre dans le centre de la transparence vide utilisant une permanente marqueur et placer quatre verre espacés (environ 30 × 30 × 1 mm) dans les coins du rectangle indiqué.
- Verser environ 5 mL de résine DURCISSABLE thiol : ene UV dans le Centre des entretoises, puis placez délicatement un 75 x 50 x 1 lame de verre mm sur les entretoises de verre, afin que la colle est couvert par la lame de verre avec aucune bulle d’air.
- Placez la transparence avec négatif imprimé sur le dessus de la lame de verre et de déplacer tous les éléments ci-dessus (de bas en haut : transparence, entretoises verre et colle UV, lame de verre et négatif transparence imprimé vierges) en faisant glisser le transparent vierge soigneusement en vertu de la source de lumière UV.
- Permettre à la lumière UV pour briller à travers le négatif sur la résine et la guérison. Le temps de polymérisation est réglable pour modifier la hauteur du canal. Soit 45 s cure temps entraîne une hauteur de canal de 1 mm, à l’aide de notre source de lumière.
- Déplacer les composants de la source UV puis retirez la transparence imprimé négatif et la lame de verre. La lame de verre avec les canaux fabriqué en colle UV sera désormais dénommée le timbre de la microfluidique.
- Jeter les entretoises de transparence et de verre.
- Tremper le tampon microfluidique dans le bain d’acétone, suivi par le bain d’éthanol. Répéter cette étape deux fois. L’acétone se dégraderont la colle UV, alors ne laissez ne pas d’acétone sur le timbre pendant plus de 10 s.
- En retenant le timbre, plongez les timbres dans l’eau et utilisez un coton-tige pour enlever le reste de la résine n’a pas réagi. N’essuyez pas directement les parties durcis, en rendant les canaux rugueux.
- Placez le timbre sur une serviette en papier et retourner à la source UV pendant au moins 30 minutes afin d’assurer une polymérisation complète.
- Moulage de polydiméthylsiloxane (PDMS)
- Verser 70 g de base PDMS dans une coupe claire et ajouter l’agent de réticulation à la base d’un rapport de poids de 01:10 RETICULATION à la base. Voici le fabricant recommandé les ratios. Ne pas utiliser un récipient en verre.
- Mélanger le pontage et la base soigneusement avec un agitateur métallique ; le mélange doit être trouble à cause des bulles d’air piégées une fois bien mélangé.
- Mettre le PDMS dans un vide vide de four et tirez sur le PDMS mixtes. Désactiver le vide si la solution commence à déborder de la tasse, puis reprendre le vide après que le dépassement de capacité s’apaise. La pression totale dans l’étuve à vide ne compte pas, car le vide seulement accélère le processus de dégazage. Laisser dans la chambre jusqu'à ce que toutes les bulles ont été évacués du mélange (environ 60 min).
- Place du timbre de microfluidique dans un plastique de diamètre vide 150 mm boîte de Pétri, puis versez lentement le PDMS dans la boîte de Pétri, couvrant complètement le timbre de la microfluidique. Verser près de la surface de la boîte de Pétri pour réduire au minimum les bulles réformer dans le PDMS.
- Couvrir le plat de Pétri et placer dans un four à 55 ° C pendant la nuit pour guérir. Une fois complètement guéri, couper le PDMS à motifs à l’aide d’un couteau et retirer le timbre. Conserver les excès PDMS pour construire le bassin de solvant (pas de protocole 1.6.3) et bouchons PDMS (étape de protocole 2.2.1.1).
- À l’aide d’un poinçon de biopsie de 0,5 mm, couper des trous dans les emplacements suivants : une à chaque coin, une dans la chambre d’aspiration près du bord du canal, six dans le compartiment de mesure placées symétriquement 60° dehors et un dans le centre de la chambre de l’échantillon. Afin d’assurer les trous placées symétriquement imprimant un motif sur une feuille de papier et de la place sous le compartiment de mesure. Étant donné que le PDMS est clair, vous pouvez facilement voir où les trous doivent être placées.
- Préparation de la solution de sol-gel pour créer des murs de verre en dispositif microfluidique
- Dans un pot de 100 mL, ajouter 25 mL d’éthanol à 90 %, 25 mL de pH 4 (0,0001 M) solution d’acide chlorhydrique, 25 mL de tétraéthoxysilane 98 % et 25 mL de methyltriethoxysilane de 98 %. Placer la solution de 100 mL, maintenant dénommée le fluide preconverted, au micro-ondes sans couvrir pendant 10 secondes, puis les place dans un 80 ° C durant la nuit.
- Assemblage de l’appareil
- Placez les deux motifs les PDMS et un 75 × 50 × 0,10 mm verre glissent dans le plasma nettoyant et régler la vanne 3 voies sur la position arrêt.
- Mettre en marche la pompe à vide et laisser une minute pour évacuer la chambre.
- Mettre la vanne 3 voies pour le poste de contrôleur de débit et de laisser la chambre équilibrer pendant 5 secondes. Le poste de contrôleur de flux permet un petit débit d’air de pénétrer dans le plasma cleaner, assez bas pour garder la chambre à basse pression. Allumez l’interrupteur de radiofréquence (RF) à moyen pendant 40 secondes, puis éteignez l’interrupteur RF et la pompe à vide.
- Placer la vanne 3 voies à la position ouverte pour retourner la chambre aux conditions atmosphériques. Retirez la lame PDMS et de verre à motifs.
- Respecter soigneusement le PDMS à motifs à la lame de verre en mettant les deux surfaces en contact avec l’autre.
- Appliquer résine durcissable UV aux veines autour des motifs PDMS et cure pendant 5 min sous faible intensité de lumière UV.
- Fabrication des murs de verre dans des canaux microfluidiques.
Remarque : Cette étape doit être remplie dans les 30 minutes de traitement au plasma, car il repose sur les modifications de la surface qui se produisent pendant le traitement plasma PDMS. L’épaisseur de la couche sera environ de 5 à 10 µm. Cette étape nécessite l’utilisation de matières volatiles et doit se faire sous une hotte chimique.- Définir une table de cuisson à 100 ° C et préparer les quatre seringues (trois 30 mL et un 3 mL) avec des aiguilles de calibre 18 et environ 30 cm de longueur de tube transparent thermoplastique.
- Remplir trois seringues 30 mL d’éthanol, le chloroforme et l’air, respectivement. Remplir une seringue de 3 mL de fluide preconverted (de l’étape de protocole 1.3.1.)
- Insérer le tube thermoplastique transparent à l’aide de connecteurs en acier inoxydable dans chacun des trous dans le PDMS à motifs, à l’exception du trou d’un des coins. Ce trou servira comme un bras, tandis que tous les autres seront prises.
- Remplir le dispositif microfluidique de preconverted liquide de la seringue, puis placer le dispositif microfluidique sur la plaque chauffante de 100 ° C pour le verre du bas est en contact avec la surface de la plaque chauffante.
- Traverser 3 mL de liquide preconverted du dispositif microfluidique en 10 secondes. L’épaisseur de la paroi de verre est ajusté en changeant la vitesse d’écoulement du fluide preconverted.
- Retirez le dispositif microfluidique de la plaque chauffante. Remplacer la seringue de solution preconverted avec la seringue à air et retirer tout excès de liquide preconverted.
- Remplacer la seringue à air avec la seringue de chloroforme et 15 mL de chloroforme lentement traversent le dispositif microfluidique. Remplacer la seringue de chloroforme avec la seringue de l’éthanol et coulent lentement 30 mL d’éthanol à travers le dispositif microfluidique. Ces mesures devraient prendre environ 1 min.
- Remplacer la seringue de l’éthanol avec la seringue et le débit de l’air à travers le dispositif microfluidique à sec.
- Demande de supports et bassin de solvant
- Coupe 75 × 10 × 1 mm bandes de verre de 75 × 25 × 1 mm verre de diapositives.
- Appliquer la résine durcissable UV pour les bandes de verre. Placez le dispositif microfluidique sur les bandes, PDMS face vers le haut. Circuler sous la source de lumière de faible intensité UV pendant 5 minutes.
- Couper un carré de PDMS de 30 × 30 mm. À l’aide d’un poinçon de biopsie, découper un trou assez grand pour couvrir le compartiment de mesure 10 mm.
- Placer le carré de PDMS et dispositif microfluidique dans le plasma l’aspirateur, puis mettre la vanne 3 voies sur la position arrêt et mettre en marche la pompe à vide.
- Laisser une minute pour évacuer la chambre. Mettre la vanne 3 voies pour le poste de contrôleur de débit et de laisser la chambre équilibrer pendant 5 secondes.
- Matrice de commutation RF au milieu s’allume pendant 40 secondes, puis s’éteint de commutation RF et pompe à vide.
- Placer la vanne 3 voies à la position ouverte pour retourner la chambre aux conditions atmosphériques.
- Retirer l’appareil du bassin et microfluidique solvant de la chambre de plasma et adhérer en contactant les surfaces. N’oubliez pas de placer le bassin de solvant sur le compartiment de mesure.
2. µ2rhéologie procédure
-
Préparation des échantillons de la matière molle
- Particules de sonde de lavage
- Pipetter 0,5 µm sondes et l’eau dans un tube de microcentrifuge à un ratio d’eau aux sondes de 10:1. Mélanger soigneusement avec la pipette de mélange, puis placer le tube de microcentrifuge dans la microcentrifugeuse et un essorage à 4600 x g pendant 10 minutes.
Remarque : La solution de la sonde utilisée dans ce travail est reçue suspendu dans l’eau avec une concentration initiale de 2,6 % solides/volume, et la concentration finale des sondes utilisées dans l’exemple 0,1 % solides/volume. - Sortir les tubes de microcentrifuge et la pipette sur le surnageant. Remplacer le liquide surnageant avec l’eau distillée. Répétez centrifugation pour un total de trois fois.
- Placez le tube de microcentrifuge le sonicateur et laisser agir pendant 15 minutes pour éliminer n’importe quel agrégat à faible température.
- Pipetter 0,5 µm sondes et l’eau dans un tube de microcentrifuge à un ratio d’eau aux sondes de 10:1. Mélanger soigneusement avec la pipette de mélange, puis placer le tube de microcentrifuge dans la microcentrifugeuse et un essorage à 4600 x g pendant 10 minutes.
- Combinant des sondes et la matière molle.
NOTE : Pour cette procédure, un gel colloïdal a été utilisé comme l’échantillon de la matière molle.- Une 75 × 50 mm lame de verre, mesurent 1 mL d’échantillon. Pipetter 40 µL de solution de la sonde dans le centre de l’échantillon.
- Incorporer délicatement l’échantillon avec une spatule métallique jusqu'à ce que complètement combinés. Verser l’échantillon dans un tube de microcentrifuge et centrifuger à 2340 x g pendant 15 s pour chasser l’air emprisonné.
- Remplissez une seringue de 1 mL muni d’une aiguille de calibre 18 et tube transparent thermoplastique avec le mélange de sonde/HCO.
- Particules de sonde de lavage
-
Transitions de phases consécutives induites par échange de fluides
- Remplissage du dispositif microfluidique
- Pour créer des bouchons PDMS, avec excès PDMS de l’étape de protocole 1.2.5, couper une section carrée de 5 mm du PDMS. À l’aide d’un poinçon de biopsie de diamètre 0,5 mm, découper un trou à mi-chemin dans le bouchon PDMS. Insérer un raccord en acier inoxydable dans le trou de diamètre 0,5 mm.
- Connecter des tubes thermoplastiques à trois des canaux d’entrée coin et le canal de sortie de la chambre d’aspiration. Remplir complètement l’appareil avec de l’eau à l’aide d’une seringue reliée à l’appareil. Il n’y a pas de bulles dans le compartiment de mesure ou dans les canaux microfluidiques. Bloquer le trou restant du coin avec bouchons PDMS.
- Le bassin de solvant doit être partiellement rempli de l’étape 2.2.1.2 ; Si elle n’est pas remplie, remplir le bassin de solvant avec de l’eau.
- À l’aide de la seringue de l’étape de protocole point 2.1.2.3, injecter 10 µL du mélange échantillon/sonde à travers le canal central dans le compartiment de mesure environ 2 µL/s, puis utiliser un bouchon PDMS pour bloquer le canal central dans le compartiment de mesure.
- Collecte de données microrheological
- Activer les paramètres de la caméra à ceux optimisés pour réduire au minimum les particules statiques et dynamiques, suivi des erreurs, puis prendre l’objectif à immersion d’eau × 63 et pipette une goutte d’eau sur la lentille.
- Placez le dispositif microfluidique sur la platine du microscope et déclenchent l’objectif jusqu'à ce qu’il se concentre sur l’échantillon.
- Prendre des vidéos du mouvement brownien des sondes sur des intervalles de temps appropriés pour la durée totale d’un changement de phase. Pour la gélification, continuer à prendre des vidéos jusqu'à ce que le mouvement de la sonde a été complètement arrêtée.
Remarque : Nous recueillons des données toutes les 10 min. Si nous commençons avec une expérience de dégradation, les données sont recueillies jusqu'à ce que les sondes sont complètement diffusant.
- Échange de fluides dans le compartiment de mesure (écoulement par gravité, échange de liquides de densité plus faibles avec des liquides de densité plus élevées)
- Retirez le dispositif microfluidique de la platine du microscope.
- D’aspiration de l’eau hors du bassin de solvant à l’aide d’une pipette de transfert, puis Pipetter 4 mL de fluide de densité plus élevée dans le bassin de solvant.
- Retourner le dispositif microfluidique à la platine du microscope et recommencez à l’étape 2.2.2.3
- Échange de fluides dans le compartiment de mesure (débit d’aspiration, échange de liquides de densité plus élevées avec des liquides de densité plus faibles)
- Retirer le dispositif microfluidique de la platine du microscope et retirez le bouchon PDMS de la chambre d’aspiration.
- Insérer une seringue avec une aiguille de calibre 18 et tubes thermoplastiques clair sur le canal de la chambre d’aspiration et accrochez la seringue jusqu'à un pousse-seringue. Mettre la pompe de seringue pour tirer à 1 mL/min.
- Enlever l’excès d’agent gélifiant dans le bassin de solvant et rincer trois fois à l’eau de remplissage du bassin de solvant et puis à aspirer le fluide de rinçage.
- Aspiration de commencer avec le pousse-seringue tout en ajoutant de l’eau dans le bassin de solvant pendant une minute. Ne laissez pas le solvant bassin vide complètement, comme cela va expulser l’air dans la chambre échantillon.
- Retirer la seringue du dispositif microfluidique et remettre le bouchon PDMS sur la chambre d’aspiration.
- Retourner le dispositif microfluidique à la platine du microscope et continuer à prélever des échantillons
- Remplissage du dispositif microfluidique
- Continuer à prendre des échantillons à intervalles réguliers au cours de la dégradation/gelation cycles jusqu'à ce que le nombre de cycles est terminé ou il n’y a pas suffisamment sondes pour la mesure.
Résultats
Un dispositif microfluidique à deux couches est construit avec le PDMS (Figure 1a, b), qui est modelé sur un timbre de la microfluidique. La conception du timbre est illustrée en Figure 1c. Montage expérimental incorrecte peut entraîner les deux erreurs dans les flux microrhéologie et microfluidique passives pendant entourant l’échange de fluides (Figure 2)....
Discussion
Le dispositif microfluidique diploblastique (Figure 1) peut être facilement fait par suivant bien documenté microfluidique fabrication techniques29. Supports de verre sont ajoutées à la partie inférieure de l’appareil pour diminuer les effets vibratoires sur le mouvement de la sonde. La lame de verre est très mince (0,10 mm) afin d’adapter le travail à distance de l’objectif de microscope. Cela rend l’appareil sensible aux petites vibrations dans le bâ...
Déclarations de divulgation
Il n’y a aucune divulgation pour ce travail.
Remerciements
Ce travail a été financé par Procter & Gamble Co. et l’américain chimique société Petroleum Research Fund (54462-DNI7). Accusé de réception est faite pour les donateurs de l’American Chemical Society pétrole fonds de recherche du prise en charge partielle de cette recherche. Les auteurs tiennent à remercier le Dr Marco Caggioni discussions utiles.
matériels
| Name | Company | Catalog Number | Comments |
| 150 x 15 mm Petri Dish | Corning, Inc. | 351058 | |
| 75 x 50 x 0.15 mm glass slide | Fisher Scientific | Custom | |
| 75 x 50 x 1.0 mm glass slide | Fisher Scientific | 12-550-C | |
| 75 x 25 x 1.0 mm glass Slide | Fisher Scientific | 12-550-A3 | |
| 22 x 22 Glass cover slips | Fisher Scientific | 12-542-B | |
| Acetone, 99.5% | VWR Analytical | 67-64-1 | |
| Low intensity UV source | UVP | UVL-56 | |
| Chloroform, 99.9% | Fisher Chemical | C298-500 | |
| Cotton Swabs | Q-tips | 83289205 | |
| Ethanol, 90% | Fisher Chemical | A962-4 | |
| Fluoresbrite® YG Carboxylate Microspheres 0.50µm | Polysciences, Inc. | 15700-10 | |
| High-Intensity UV Lamp | Spectroline Corp. | SB-100P | |
| Hot plate | Corning, Inc. | PC-420 | |
| Hydrochloric Acid, 6N | Ricca Chemical Company | 3750-32 | |
| Methyltriethyoxysilane, 98% | Acros Organics | 174622500 | |
| Microcentrifuge | Eppendorf | 5424 | |
| Plasma cleaner | Harrick Plasma, Inc. | PDC-32G | |
| Polydimethylsiloxane (PDMS) | Robert McKwown Company | 2065622 | |
| Sonicator | Branson, Emerson Electric | 1800 | |
| Steel connectors, ID 0.023 inch | New England Small Tube Corp. | Custom | |
| Tetraethoxysilane, 98% | Alfa Aesar | A14965 | |
| Thiol-ene Resin (UV curable) | Norland Products, Inc. | NOA81 | |
| Transparency | Staples Inc. | 21828 | |
| Tygon tubing, ID 1/32 inch | McMaster-Carr | E-3603 | |
| Vacuum oven | Fisher Scientific | 282A | |
| Biopsy punch 8 mm | World Precision Instruments | 504535 | |
| Bioposy punch 0.5 mm | World Precision Instruments | 504528 | |
| Syringe, 30 mL | BD | 309659 | |
| Syringe, 3 mL | BD | 309651 | |
| Needle, 18 gauge | BD | 305195 | |
| Microcentrifuge tube, 1.5 mL | Eppendorf | 22-36-320-4 | |
| High-speed Camera | Vision Research | Miro M120 | |
| Microscope | Carl Zeiss AG | Zeiss Observer, Z1 | |
| Syringe pump | New Era Pump Systems | NE-300 | |
| Hydrogenated castor oil | Procter & Gamble | N/A | |
| Afício MP 6002 Printer | Ricoh Company, Ltd. | 415877 |
Références
- Mitchell, P. Microfluidics-downsizing large-scale biology. Nat. Biotech. 19, 717-721 (2001).
- Haber, C. Microfluidics in commercial applications; an industry perspective. Lab Chip. 6, 1118-1121 (2006).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Huang, X., Raghavan, S. R., Terech, P., Weiss, R. G. Distinct kinetic pathways generate organogel networks with contrasting fractality and thixotropic properties. J. Am. Chem. Soc. 128, 15341-15352 (2006).
- Larsen, T. H., Schultz, K. M., Furst, E. M. Hydrogel microrheology near the liquid-solid transition. Korea-Aust. Rheol. J. 20, 165-173 (2008).
- Larsen, T. H., Furst, E. M. Microrheology of the liquid-solid transition during gelation. Phys. Rev. Lett. 100, 146001 (2008).
- Schultz, K. M., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid rheological screening to identify conditions of biomaterial hydrogelation. Soft Matter. 5, 740-742 (2009).
- Switzer, L. H., Klingenberg, D. J. Flocculation in simulations of sheared fiber suspensions. Int. J. Multiph. Flow. 30, 67-87 (2004).
- Wehrman, M. D., Lindberg, S., Schultz, K. M. Quantifying the dynamic transition of hydrogenated castor oil gels measured via multiple particle tracking microrheology. Soft Matter. 12, 6463-6472 (2016).
- Wehrman, M. D., Milstrey, M. J., Lindberg, S., Schultz, K. M. Using µ2rheology to quantify rheological properties during repeated reversible phase transitions of soft matter. Lab Chip. 17, 2085-2094 (2017).
- Wehrman, M. D., Lindberg, S. E., Schultz, K. M. Impact of shear on the structure and rheological properties of a hydrogenated castor oil colloidal gel during dynamic phase transitions. J. Rheol. , (2018).
- Loh, X. J. Dual-responsive "reversible micelles". J. Appl. Polym. Sci. 127, 992-1000 (2013).
- Kern, F., Zana, R., Candau, S. J. Rheological properties of semidilute and concentrated aqueous solutions of cetyltrimethylammonium chloride in the presence of sodium salicylate and sodium chloride. Langmuir. 7, 1344-1351 (1991).
- Trappe, V., Prasad, V., Cipelletti, L., Segre, P. N., Weitz, D. A. Jamming phase diagram for attractive particles. Nature. 411, 772-775 (2001).
- Philipse, A. P., Wierenga, A. M. On the density and structure formation in gels and clusters of colloidal rods and fibers. Langmuir. 14, 49-54 (1998).
- Schultz, K. M., Bayles, A. V., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid, high resolution screening of biomaterial hydrogelators by mu2rheology. Biomacromolecules. 12, 4178-4182 (2011).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179, 298-310 (1996).
- Mason, T. G. Estimating the viscoelastic moduli of complex fluids using the generalized Stokes--Einstein equation. Rheol. Actac. 39, 371-378 (2000).
- Mason, T. G., Ganesan, K., van Zanten, J. H., Wirtz, D., Kuo, S. C. Particle tracking microrheology of complex fluids. Phys. Rev. Lett. 79, 3282-3285 (1997).
- Mason, T. G., Weitz, D. A. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74, 1250-1253 (1995).
- Squires, T. M., Mason, T. G. Fluid mechanics of microrheology. Annu. Rev. Fluid Mech. 42, 413-438 (2010).
- Gittes, F., Schnurr, B., Olmsted, P. D., MacKintosh, F. C., Schmidt, C. F. Microscopic viscoelasticity: shear moduli of soft materials determined from thermal fluctuations. Phys. Rev. Lett. 79, 3286-3289 (1997).
- Mai, D. J., Brockman, C., Schroeder, C. M. Microfluidic systems for single DNA dynamics. Soft Matter. 8 (41), 10560-10572 (2012).
- Tanyeri, M., Ranka, M., Sittipolkul, N., Schroeder, C. M. A microfluidic-based hydrodynamic trap: design and implementation. Lab Chip. 11, 1786-1794 (2011).
- Lee, J. S., Dylla-Spears, R., Teclemariam, N. P., Muller, S. J. Microfluidic four-roll mill for all flow types. Appl. Phys. Lett. 90, 074103 (2007).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179 (1), 298-310 (1996).
- Mason, T. G., Weitz, D. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74 (7), 1250 (1995).
- Schultz, K. M., Furst, E. M. High-throughput rheology in a microfluidic device. Lab on a chip. 11, 3802-3809 (2011).
- Abate, A. R., Lee, D., Do, T., Holtze, C., Weitz, D. A. Glass coating for PDMS microfluidic channels by sol-gel methods. Lab Chip. 8, 516-518 (2008).
- Happel, J., Brenner, H. . Low Reynolds Number Hydrodynamics: with special applications to particulate media. , (1965).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon