Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Havacilik ve Microrheology tekrarlanan faz geçişleri sırasında yumuşak madde Rheological özellikleri belirlemek için birleştirme
Bu Makalede
Özet
Biz imalat ve birden çok parçacık tekrarlanan faz geçişleri yumuşak konuda rheological etkilerini incelemek için microrheology ölçümleri izleme sağlayan bir mikrosıvısal aygıt kullanımını göstermektedir.
Özet
Mikroyapı yumuşak maddenin doğrudan makroskopik rheological özellikleri etkiler ve kolloidal düzenlenmesi sırasında önceki faz değişiklikleri de dahil olmak üzere faktörler tarafından değiştirilebilir ve yamultma uygulanır. Bu değişiklikleri kapsamını belirlemek için biz etkinleştirir örnek üzerinde kesme sınırlama yaparken çevresindeki sıvı ve microrheological karakterizasyonu alışverişini tarafından indüklenen faz geçişleri tekrarlanan bir mikrosıvısal geliştirdik. Bu teknik µ2Reolojisi, havacilik ve microrheology ile birlikte olur. İki katlı tasarımı ile simetrik giriş akışı yerde jel örnek sıvı alışverişi sırasında yakalar bir örnek odasına girerek mikrosıvısal cihazdır. Emme uzak sıvılar örnek odanın içine çekmek için örnek odası uygulanabilir. Malzeme rheological özellikleri kullanarak birden çok parçacık microrheology (MPT) izleme karakterizedir. MPT, floresan sonda parçacıkları malzeme gömülür ve sondalar Albert hareket video mikroskobu kullanılarak kaydedilir. Parçacıkların hareketi izlenir ve ortalama kare deplasman (MSD) hesaplanır. MSD makroskopik rheological özelliklerle Genelleştirilmiş Stokes-Einstein ilişkisini kullanarak ilgili. Malzeme aşaması kıyasla kritik gevşeme üs tanımlanır, zaman-tedavi süperpozisyon kullanarak kararlı. Ölçümler fibröz kolloidal jel tekniği yardımcı programı göstermektedir. Bu Jel kesme uygulandığında geri dönüşümsüz değiştirilebilir hassas bir yapısı vardır. malzeme art arda faz geçişleri microstructural değişimler bir rol oynamayan gösteren her faz geçiş sonra aynı rheological özelliklerine Sakinleştiği µ2Reolojisi verileri gösterir. Yamultma rolünü belirlemek için örnekleri bizim mikrosıvısal aygıt içine enjeksiyon önce güdülmesini. µ2Reolojisi rheological hassas microstructures tek bir örnek özelliklerini belirlenmesi Faz geçişleri yanıt olarak tekrarlanan değişimler sırasında etkinleştirme yumuşak madde karakterizasyonu için geniş bir tekniktir çevre koşulları çevreleyen.
Giriş
Faz geçişleri yumuşak konuda malzeme1,2,3-işleme ve son istikrar etkileri vardır iskele yapısını değiştirebilirsiniz. Yumuşak malzeme karakterizasyonu dinamik faz geçişleri sırasında yapısal evrim ve denge yapısı ve rheological özellikleri arasındaki ilişki hakkında önemli bilgiler sağlar. Örneğin, birçok ev bakım ürünleri tüketici kullanımı sırasında bir faz değişikliği gerektirir. Ayrıca, üretim sırasında işleme adımları, seyreltme dahil olmak üzere ve karıştırma, vermek rheological özellikleri ve ürünün son Mikroyapı etkileyen kesme. Bir aşama değişiklik boyunca rheological özellikleri'ni anlama ürünün tasarlandığı gibi çalışacağından emin olmanızı sağlar. Kuvvetler üretim sırasında malzemenin başlangıç Reolojisi değiştirirseniz, Ayrıca, faz geçişleri hedeflenen işlevini ve etkinliğini değiştirme beklenmeyen ve istenmeyene ayırmayı bırak, sonuçlar olabilir. Nerede malzeme ilişkili Kolloidler veya polimerler bir çözümden bir örnek kapsayan jel ağa'a geçiş noktası olarak tanımlanan kritik jelleşme noktada malzeme özellikleri büyük ölçüde Derneği için küçük değişiklikler ile değiştirin. Herhangi bir değişiklik yapısı üzerinde kritik jel noktada son ürünü4etkileyebilir. Bu dinamik geçişler sırasında yumuşak malzeme zayıf mekanik özellikleri ve klasik deneysel teknikler kullanarak ölçüleri içinde ölçüm gürültü sınırı5,6,7olabilir. Düşük dönmeler aralığında hassas microrheology gibi bu, teknikleri hesaba katan (10-3 - 4 Pa), zayıf yeni başlayan jel dinamik evrimi sırasında tanımlamak için kullanılır. Bazı malzemeler nedeniyle dış güçler, malzeme veya sıvı devri yapısı ve sonuçta, son malzeme özellikleri etkileyebilir gibi hangi karakterizasyon sırasında bir meydan okuma sunuyor Mikroyapı değişikliklere duyarlıdırlar. Malzeme Mikroyapı değiştirmekten kaçının için bir örnek etrafında çevre sıvı kesme en aza indirerek alışverişi yapabilirsiniz bir mikrosıvısal cihaz geliştirdik. Sıvı çevre değiş tokuş ederek rheological özellikleri ve Mikroyapı değişiklikler kesme en az katkılarıyla faz geçişleri sırasında ölçülür. Cihazın µ2Reolojisi adında bir teknik microrheology (MPT) izleme birden çok parçacık ile birleştirilmiştir. Bu teknik bir jel yanıt harici bir itici güç olarak ardışık faz değişiklikleri sırasında malzeme özelliklerini ölçmek için kullanılır. Tekniği kullanarak bir fibröz kolloidal jel, hidrojene Hint yağı (HCO)9,10,11Ayr›ca gösterilecektir.
Jel iskele Derneği ve ayrılma onların örnek çevre12,13,14,15nedeniyle değişiklikleri uygulayabilir. Jelleşme ve yıkımı için itici güç ve malzeme özel ilgi her malzeme için uygun olmalıdır. µ2Reolojisi kolloidal ve polimerik ağları da dahil olmak üzere dış uyaranlara cevap jel sistemleri tanımlamak için kullanılabilir. PH, ozmotik basınç ve tuz konsantrasyonu değiştirme malzeme Mikroyapı değişiklikleri tetikleyebilir Kuvvetleri sürüş örnek verilebilir. Örneğin, HCO bir ozmotik basınç gradyan oluşturarak kontrollü faz geçişleri geçer. Ne zaman bir konsantre HCO jel örnek (4 wt % HCO) suda batık, düşmesine neden çekici güçleri kolloidal parçacıklar arasında zayıflatmak. Alternatif olarak, zaman HCO sulu çözeltisi (0,125 wt % HCO) (jelleşme ajan olarak anılacaktır ve çoğunlukla gliserin ve yüzey aktif oluşan) hidrofilik bir malzeme ile temas, çekici jelleşme neden dönüş zorlar. Bu jel sistem ardışık faz geçişleri tek örnek9,10ölçme aygıtı çalışması bir araç olarak göstermek için kullanılır. Bu jel iskele dinamik geçişler ve hassas yeni başlayan jel yapısı itibariyle kritik faz geçiş sırasında karakterize etmek için MPT bu malzemelerin yüksek spatio-zamansal çözünürlük ile karakterize etmek için kullanıyoruz.
Microrheology jel özellikleri ve yapısına, özellikle kritik geçiş, yumuşak malzeme, kolloidal ve polimer jelleri5,6,9,16dahil olmak üzere bir dizi belirlemek için kullanılır. MPT kayda floresan sonda parçacıkların Albert hareket bir örnek içinde gömülü video mikroskobu kullanan bir pasif microrheological tekniktir. Videoları boyunca parçacık pozisyonlar tam bir piksel kullanarak 1/10th içinde algoritmaları17,18izleme klasik belirlenir. Ortalama kare deplasman ensemble ortalama (MSD, (Δr2(t))) bu parçacık yörüngeleri hesaplanır. MSD Genelleştirilmiş Stokes-Einstein ilişkisi17,19,20,21,22kullanarak malzeme özelliklerini sürüngeni uyum gibi ilişkilidir, 23. Malzeme durumunu Logaritmik MSD eğrinin eğimini öteleme süresi, α bir fonksiyonu olarak hesaplayarak belirlenir,
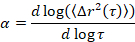
öteleme süresi ve kritik gevşeme üs nkarşılaştırarak t nerede. n zaman tedavi süperpozisyon, MPT verileri çözümlemek için Larsen ve Furst6tarafından güncellenmiştir iyi belgelenmiş bir teknik kullanılarak belirlenir. Buna karşılık n α için malzeme durumunu kantitatif belirlenir. Ne zaman α > n malzeme olduğunu bir sol ve ne zaman α < n malzeme olduğunu bir jel. Önceki çalışma HCO sistemi kritik gevşeme üs9belirlemek için microrheology kullanarak karakterize. Bu bilgileri kullanarak, biz tam olarak ne zaman malzeme deney sırasında bir sol için bir jel geçişleri belirlemek. Ayrıca, Gauss parametre, αNG, bir sisteminin yapısal heterojenite kapsamını belirlemek için hesaplanabilir,
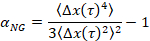
nerede Δx(t) x yönünde tek boyutlu parçacık hareketi var. MPT kullanarak, biz bir tek faz geçiş karakterize olabilir ama MPT malzemelerle bir mikrosıvısal cihazın karakterize tarafından biz sıvı çevresini değiştirmek ve tek jel örnek üzerinde birkaç faz geçişleri veri toplamak edebiliyoruz.
Bu mikrosıvısal cihaz faz değişiklikleri yanıt çevresindeki sıvı ortamındaki değişikliklere uğrar bir tek jel örnek kritik geçişler araştırmak için tasarlanmıştır. Cihazın bu jel veya sol durumda ya da yerine kesme en aza indirirken bir faz geçiş ikna etmek için örnek kilitleyerek olduğunda örnek çevreleyen sıvı alışverişi. Çözücü bir havza doğrudan altı simetrik aralıklı giriş kanalları tarafından bağlı örnek odası yukarıda yer alır. Bu simetri yerde kilitleme örnek etrafında eşit basınç oluşturulurken örnek odasına solvent Havzası'ndan sıvı alışverişi sağlar. Tek parçacık ve DNA bindirme için bu tekniği kullanmak birçok çalışma yapılmıştır ama tek molekülleri birimden yaklaşık 10 µL24,25,26örnekleri kadar bu eser ölçeklendirir. Bu benzersiz tasarım ayrıca gerçek zamanlı microrheological karakterizasyonu faz geçişleri sırasında sağlar.
µ2Reolojisi birçok yumuşak madde sistemlere uygulanabilir sağlam bir tekniktir. Bu raporda açıklanan tekniği kolloidal jeller için tasarlanmıştı, ancak polimer veya micellar çözümleri gibi diğer malzemelere kolayca uyarlanabilir. Bu teknik ile biz sadece faz geçişleri denge malzeme özellikleri etkilemesi belirler, ancak aynı zamanda nasıl farklı işleme adımlarını rheological evrim ve malzeme ve son İskele yapısı üzerindeki etkileri kalıcı olabilir ve özellikleri.
Protokol
1. mikrosıvısal cihaz imalatı
- Mikrosıvısal damga imalat.
Not: Bu adım uçucu malzeme kullanımı gerektirir ve bir kimyasal duman mahallede yapılmalıdır.- Arka plan siyah (bkz: şekil 1) renkli ve cam slayt (75 × 50 mm), kanalları renkli beyaz olarak aynı boyutlara sahip bir negatif baskılı tasarım kullanın. Bu tasarım 1200 dpi çözünürlüğe sahip açık asetat sayfasındaki (saydamlık) yazdırın.
- Şeffaflık karanlık kısmında hala ışık izin veriyorsa, birkaç negatifleri katman ve çift taraflı bant kullanarak uygun.
- Yüksek yoğunluklu ultraviyole (UV) ışık kaynağı üzerinde açmak ve sürekli bir çıkış (yaklaşık 30 dakika) ısınmak sağlar.
Not: Yüksek yoğunluklu UV ışık kaynağı kullanırken UV koruyucu gözlük takılmalıdır. - Dolgu üç 150 mL Petri yemekler aseton, etanol ve distile su ile.
- Boş bir şeffaflık ışık yüksek çıkış UV kaynağa yakın, ama doğrudan UV altında düz bir yüzeye yerleştirin. Bu mikrosıvısal damga imal etmek bir temel sağlayacaktır.
- 75 × 50 mm cam slayt Seviyelendirilmiş dikdörtgen köşelerinde bir kalıcı marker ve yer dört cam tutucular (yaklaşık 30 × 30 × 1 mm) kullanarak boş saydamlık ortasına köşelerini anahat.
- UV tedavi edilebilir thiol: Doğu reçine çubukları merkezinde yaklaşık 5 mL dökün, sonra dikkatlice yapıştırıcı tamamen cam slayt yok hava kabarcıkları ile kaplıdır 75 x 50 x 1 mm cam slayt cam tutucular üzerine yerleştirin.
- Cam slayt üzerine yazdırılan negatif şeffaflık yerleştirin ve yukarıdaki bileşenleri taşımak (alttan üste: boş şeffaflık, cam tutucular ve UV tutkal, cam slayt ve negatif yazdırılan şeffaflık) boş şeffaflık dikkatle sürükleyerek UV ışık kaynağı altında.
- UV ışık reçine ve tedavi üzerine negatif parlamasına izin. Tedavi zaman kanal yüksekliğini değiştirmek için ayarlanabilir. Bir 45 s tedavi zaman sonuçları bir kanal yüksekliği 1 mm, bizim ışık kaynağı kullanarak.
- UV kaynak uzak bileşenleri taşımak ve negatif yazdırılan şeffaflık ve cam slayt kaldırın. UV tutkal fabrikasyon kanalları ile cam slayt şimdi mikrosıvısal damgası sevk edilecek.
- Şeffaflık ve cam tutucular atmak.
- Etanol banyo tarafından takip aseton banyoda mikrosıvısal damga dip. Bu iki kez tekrarlayın. Aseton aseton 10 dan büyük kaşe üzerinde bırakmayın böylece UV tutkal aşağılamak s.
- Damga tutarken, su pul daldırın ve bir pamuklu çubukla unreacted reçine kalan kaldırmak için kullanın. O-ecek yapmak belgili tanımlık kanal kaba olarak doğrudan tedavi bölümleri silmek değil.
- Damga bir kağıt havlu üzerinde yer ve UV kaynak tam kür emin olmak en az 30 dakika geri dönün.
- Polydimethylsiloxane (PDMS) döküm
- 70 g PDMS tabanının temiz bir kaba dökün ve ağırlık oranı 1:10 Base'deki cross-linking agent eklemek temel almasını crosslinker. Bu oranları tavsiye üreticisi vardır. Bir cam kaba kullanmayın.
- Cross-linker karıştırın ve iyice baz metal bir karıştırıcı ile; karışımı düzgün karışınca hapsolmuş hava kabarcıkları nedeniyle bulanık olmalıdır.
- PDMS karışık PDMS vakum fırını ve çekme vakum içine koymak. Çözüm bardaktan taşması, o zaman taşma azalır sonra vakum devam başlarsa vakum dön. Vakum sadece gaz giderme işlemini hızlandırır gibi toplam basınç vakum fırında, önemli değil. Tüm kabarcıklar karışımı (yaklaşık 60 dak) tahliye edildi kadar odasında bırakın.
- Yer mikrosıvısal damga bir boş 150 mm çap plastik Petri dish, sonra yavaş yavaş dökün PDMS Petri kabına tamamen mikrosıvısal damga kapsayan. Baloncuklar içinde PDMS reform en aza indirmek için Petri kabına yüzeyine yakın dökün.
- Petri kabına kapak ve tedavisi için bir 55 ° C fırında gecede yerleştirin. Bir kez tamamen tedavi bir bıçak kullanarak desenli PDMS kesmek ve damga kaldırın. Aşırı PDMS solvent Havzası (iletişim kuralı adım 1.6.3) ve PDMS stoper (iletişim kuralı adım 2.2.1.1) oluşturmak için korur.
- 0,5 mm biyopsi yumruk kullanarak, delik aşağıdaki konumlara: bir kanal, altı simetrik olarak yerleştirilmiş 60 ° ayrı örnek odasında ve örnek odasının merkezinde bir kenarına yakın emme namluda her köşesinde. Simetrik olarak yerleştirilmiş delik bir desen kağıt ve yer altında örnek odası bir kağıda yazdırılmasını sağlama. PDMS açık olduğundan, delikleri yerleştirilmesi gereken yere kolayca görebilirsiniz.
- Sol-jel çözüm hazırlanması mikrosıvısal cihazda cam duvarları oluşturmak için
- % 90 etanol, pH 4 (0.0001 M) 25 mL 25 mL 100 mL kavanoz ekleyin hidroklorik asit çözüm, 25 mL % 98'i tetraethoxysilane ve 25 mL % 98'i methyltriethoxysilane. Şimdi 10 saniye sonra bir 80 ° C yer için bir gecede ortaya mikrodalga preconverted sıvı olarak anılacaktır 100 mL solüsyon yerleştirin.
- Cihaz Montaj
- Her iki desenli PDMS yerleştirin ve bir 75 × 50 × 0.10 mm slayt içine plazma temizleyici cam ve 3 yollu vana kapalı konuma getirin.
- Vakum pompası açmak ve odası tahliye için bir dakika izin verir.
- Denetleyicisi pozisyon akışı ve 5 saniye boyunca equilibrate odası izin için 3-yollu vana koymak. Akış denetleyicisi pozisyon küçük bir Debi hava plazma temizleyici, yeterince düşük düşük basınç odası tutmak için girmek için izin verir. Orta radyo frekansı (RF) geçmek için 40 saniye açın, sonra RF anahtarı ve vakum pompası devre dışı bırakmak.
- 3-yollu vana odası için atmosferik koşullar dönmek için açık konuma yerleştirin. Desenli PDMS ve cam slayt kaldırın.
- Dikkatli bir şekilde cam kaymak için desenli PDMS iki yüzeyler birbirine temas koyarak uygun.
- UV tedavi edilebilir reçine dikişleri desenli PDMS ve düşük yoğunluklu UV ışık altında 5 min için tedavi uygulanır.
- Cam duvarlar mikrosıvısal kanalları imalatı.
Not: plazma tedavi sırasında oluşan PDMS yüzey değişiklikleri yapılmasını gerektirecek ayarlamalardan gibi bu adımı plazma tedavisinin 30 dakika içinde tamamlanması gerekir. Katman kalınlığı yaklaşık 5-10 µm olacaktır. Bu adım uçucu malzeme kullanımı gerektirir ve bir kimyasal duman mahallede yapılmalıdır.- Bir ocağın 100 ° C- ve dört şırınga (üç 30 mL ve bir 3 mL) 18 gauge iğne ve yaklaşık 30 cm uzunluğunda açık termoplastik boru ile hazırlanın.
- Üç 30 mL şırınga etanol, kloroform ve hava, sırasıyla doldurun. Preconverted sıvı (adımdaki Protokolü 1.3.1.) olan bir 3 mL şırıngaya doldur
- Her bir köşede delik dışında desenli PDMS delikler paslanmaz çelik bağlayıcıları kullanarak açık termoplastik boru yerleştirin. Diğerlerinin çıkışları olur iken bu delik bir giriş kullanılacak.
- Mikrosıvısal aygıt--dan belgili tanımlık tenkıye preconverted sıvı ile doldurun, sonra alt cam sıcak plaka yüzeyine temas ediyor bu yüzden mikrosıvısal aygıt 100 ° C sıcak tabağa yerleştirin.
- Preconverted sıvı 3 mL mikrosıvısal aygıtı üzerinden 10 saniye içinde akışı. Cam duvar kalınlığı preconverted sıvı akış hızı değiştirerek ayarlanır.
- Mikrosıvısal aygıtı Pinar kaldırın. Preconverted çözüm şırınga hava şırınga ile değiştirmek ve herhangi bir fazla preconverted sıvıyı itin.
- Hava şırınga kloroform şırınga ile değiştirin ve yavaş yavaş kloroform 15 mL mikrosıvısal aygıtı üzerinden akışı. Kloroform şırınga etanol şırınga ile değiştirin ve yavaş yavaş 30 mL etanol mikrosıvısal aygıtı üzerinden akışı. Aşağıdaki adımları yaklaşık 1 dakika sürer.
- Etanol şırınga ile hava şırınga ve akış hava kuru kadar mikrosıvısal aygıtı değiştirin.
- Cam destekler ve solvent Havzası uygulanması
- 75 × 10 × 1 mm kesilmiş şeritler cam 75 × 25 × 1 mm slaytlar cam.
- UV tedavi edilebilir reçine cam şeritler için geçerlidir. Şeritler, üzerine mikrosıvısal aygıt PDMS yüzü yukarı bakacak şekilde yerleştirin. Düşük yoğunluklu UV ışık kaynağı altında 5 dakika boyunca hareket.
- Bir 30 × 30 mm PDMS kare kesilmiş. Bir biyopsi yumruk kullanarak, 10 mm örnek odası kapsayacak kadar büyük bir delik.
- PDMS kare ve mikrosıvısal aygıt plazma temizleyici, yeri o zaman 3-yollu vana kapalı konuma koymak ve vakum pompası açmak.
- Tahliye odası için bir dakika izin verin. 3-yollu vana akış denetleyicisi konumuna koyun ve 5 saniye boyunca equilibrate odası verelim.
- RF anahtarı orta açmak için 40 saniye sonra RF anahtarı ve vakum pompası devre dışı bırakmak.
- 3-yollu vana odası için atmosferik koşullar dönmek için açık konuma yerleştirin.
- Plazma odasından solvent Havzası ve mikrosıvısal aygıtı kaldırmak ve yüzeyleri irtibata geçerek uygun. Üzerinde örnek odası solvent Havzası yerleştirdiğinizden emin olun.
2. µ2Reolojisi yordamı
-
Yumuşak madde örnekleri hazırlanması
- Çamaşır sonda parçacıklar
- Su ve 0.5 µm sondalar, su için probları 10:1 oranında bir microcentrifuge tüp içine pipet. İyice pipet karıştırma kullanarak karıştırın, sonra yere microcentrifuge tüp microcentrifuge ve 4600 x g spin içine 10 dakika.
Not: Bu çalışmada kullanılan sonda çözüm su % 2.6 katı/birimin ilk bir konsantrasyon ile askıya alınır ve örnekte kullanılan sondalar son konsantrasyonu % 0,1 katı/birimdir. - Microcentrifuge tüp ve dışarı süpernatant pipet kaldırın. Süpernatant DI su ile değiştirin. Santrifüjü toplam üç kez tekrarlayın.
- Microcentrifuge tüp sonicator içinde yerleştirin ve düşük 15 dakika herhangi bir toplamları kaldırmak solüsyon içeren temizleyicide.
- Su ve 0.5 µm sondalar, su için probları 10:1 oranında bir microcentrifuge tüp içine pipet. İyice pipet karıştırma kullanarak karıştırın, sonra yere microcentrifuge tüp microcentrifuge ve 4600 x g spin içine 10 dakika.
- Birleştirme sonda ve yumuşak oldu.
Not: Bu yordam için kolloidal bir jel yumuşak madde örnek olarak kullanılmıştır.- Bir 75 × 50 mm cam slayt üzerinde 1 mL örnek malzeme ölçmek. Sonda çözüm 40 µL örnek merkezi haline pipet.
- Yavaşça örnek tamamen kombine kadar metal bir spatula ile katlayın. Örnek bir microcentrifuge tüp ve 15 2340 x g, santrifüj oymak s sıkışmışlık havayı çıkarmak için.
- Dolgu 1 mL şırınga bir 18 gauge iğne ve sonda/HCO karışımı ile açık termoplastik boru ile donatılmış.
- Çamaşır sonda parçacıklar
-
Sıvı alışverişi tarafından indüklenen ardışık faz geçişleri
- Mikrosıvısal aygıt doldurma
- PDMS stoper oluşturmak için iletişim kuralı adım 1.2.5, aşırı PDMS kullanılarak kesme PDMS 5 mm kare bölümünü. 0,5 mm çap biyopsi yumruk kullanarak, bir yarım PDMS tıpa delik açın. Paslanmaz çelik bağlayıcıyı 0,5 mm çap deliğe yerleştirin.
- Termoplastik boru üç köşe giriş kanalı ve emme odası çıkış kanalı bağlayın. Tamamen cihazın cihaza bağlı bir Ģırınga kullanarak su ile doldurun. Örnek odası veya mikrosıvısal kanalları hava kabarcığı yok olduğundan emin olun. PDMS stoper kalan köşe delikle engelleyin.
- Solvent Havzası 2.2.1.2 adımından kısmen dolu olması gerekir; o dolu değil, solvent Havzası su ile doldurun.
- İletişim kuralı adım 2.1.2.3 şırıngadan kullanarak yaklaşık 2 µL/s'de örnek odasına 10 µL Merkezi kanal üzerinden örnek/sonda karışımı enjekte sonra PDMS tıpa örnek Odası Merkezi kanalda engellemek için kullanın.
- Microrheological veri toplama
- Kamera ayarlarını bu hataları, izleme statik ve dinamik parçacık en aza indirmek için en iyi duruma getirilmiş sonra 63 × su daldırma amaç için geçin ve bir damla su objektif üzerine pipette.
- Mikrosıvısal aygıt mikroskobu sahnesinde yerini ve örnek üzerinde odaklanmıştır kadar hedefi yükseltmek.
- Zaman aralıkları bir faz değişikliği toplam uzunluğu için uygun videolar sondalar Albert hareket kazanır. Jelleşme için devam etmek sonda hareketi tamamen durana kadar video çekimi.
Not: Veri her 10 min topluyoruz. Bir bozulma deneyi ile başlarsak, sondalar tamamen Difüzyon kadar veri toplanır.
- (Yerçekimi akış, yüksek yoğunluk sıvıları ile daha düşük yoğunluklu sıvıların Satım) örnek odasında sıvısı alışverişi yapan
- Mikrosıvısal aygıtı mikroskobu Sahne Alanı'ndan kaldırın.
- Bir aktarım pipet kullanarak solvent Havzası su emme, o zaman daha yüksek yoğunluk sıvı 4 mL çözelti Havzası pipet.
- Mikrosıvısal aygıt mikroskobu Sahne Alanı'na dönün ve 2.2.2.3 adımı yineleyin
- (Emme akışını, düşük yoğunluk sıvıları ile daha yüksek yoğunluk sıvıların Satım) örnek odasında sıvısı alışverişi yapan
- Mikroskop Sahne Alanı'ndan mikrosıvısal aygıtı kaldırmak ve PDMS tıpa emme odasından kaldırın.
- Bir 18 gauge iğne ve emme odası kanal için açık termoplastik boru ile donatılmış bir şırınga yerleştirin ve şırınga bir şırınga pompa kadar kanca. 1 mL/dk az çekmek için şırınga pompa ayarlayın.
- Solvent havzasında aşırı jelleşme aracısını kaldırın ve solvent Havzası doldurma ve sonra durulama sıvı emme tarafından üç kez su ile durulayın.
- Begin vakum şırınga pompa su çözücü Havzası ekleme için bir dakika süre ile. Bu örnek odasına hava çeker gibi boş solvent Havzası tamamen, izin vermeyin.
- Şırınga mikrosıvısal aygıttan kaldırmak ve emme odası üzerinde PDMS tıpa değiştir.
- Mikrosıvısal aygıt mikroskobu Sahne Alanı'na dönün ve örnekleri alarak devam ediyor
- Mikrosıvısal aygıt doldurma
- Örnekleri düzenli aralıklarla bozulma/jelleşme sırasında döngüleri için istediğiniz sayıyı tamamlanıncaya veya ölçüm için yetersiz probları vardır kadar devir alarak devam ediyor.
Sonuçlar
İki katmanlı mikrosıvısal aygıt üzerinde bir mikrosıvısal pulu desenli PDMS (şekil 1a, b), ile inşa edilmiştir. Damga tasarım Resim 1cile gösterilir. Uygunsuz deneysel kurulum hataları sırasında sıvı alışverişi (Şekil 2) çevreleyen pasif microrheology ve mikrosıvısal akışı içinde her ikisi de yol açabilir. Uygunsuz deneysel Kur örnekler...
Tartışmalar
İki katlı mikrosıvısal aygıt (şekil 1) aşağıdaki iyi belgelenmiş mikrosıvısal imalat teknikleri29tarafından kolayca yapılabilir. Cam destekler cihazın alt tarafına sonda hareketi titreşim etkileri azaltmak için eklenir. Cam slayt çalışma mesafesi mikroskop amacın karşılamak için çok ince (0.10 mm) olduğunu. Bu cihazın küçük titreşimler için bina ve sonra yüksek hızlı kamera ile ölçülür örnek ortamında getirir. Cam destekler ba...
Açıklamalar
Bu iş için hiçbir açıklamalar vardır.
Teşekkürler
Bu iş için fon Procter & Gamble Co. ve Amerikan Kimya Derneği petrol Araştırma Fonu (54462-DNI7) tarafından sağlandı. Bildirim Amerikan Kimya Derneği petrol araştırma fonu Bu araştırmanın kısmi destek için bağış için yapılır. Yazarlar için yararlı tartışmalar Dr. Marco Caggioni kabul etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 150 x 15 mm Petri Dish | Corning, Inc. | 351058 | |
| 75 x 50 x 0.15 mm glass slide | Fisher Scientific | Custom | |
| 75 x 50 x 1.0 mm glass slide | Fisher Scientific | 12-550-C | |
| 75 x 25 x 1.0 mm glass Slide | Fisher Scientific | 12-550-A3 | |
| 22 x 22 Glass cover slips | Fisher Scientific | 12-542-B | |
| Acetone, 99.5% | VWR Analytical | 67-64-1 | |
| Low intensity UV source | UVP | UVL-56 | |
| Chloroform, 99.9% | Fisher Chemical | C298-500 | |
| Cotton Swabs | Q-tips | 83289205 | |
| Ethanol, 90% | Fisher Chemical | A962-4 | |
| Fluoresbrite® YG Carboxylate Microspheres 0.50µm | Polysciences, Inc. | 15700-10 | |
| High-Intensity UV Lamp | Spectroline Corp. | SB-100P | |
| Hot plate | Corning, Inc. | PC-420 | |
| Hydrochloric Acid, 6N | Ricca Chemical Company | 3750-32 | |
| Methyltriethyoxysilane, 98% | Acros Organics | 174622500 | |
| Microcentrifuge | Eppendorf | 5424 | |
| Plasma cleaner | Harrick Plasma, Inc. | PDC-32G | |
| Polydimethylsiloxane (PDMS) | Robert McKwown Company | 2065622 | |
| Sonicator | Branson, Emerson Electric | 1800 | |
| Steel connectors, ID 0.023 inch | New England Small Tube Corp. | Custom | |
| Tetraethoxysilane, 98% | Alfa Aesar | A14965 | |
| Thiol-ene Resin (UV curable) | Norland Products, Inc. | NOA81 | |
| Transparency | Staples Inc. | 21828 | |
| Tygon tubing, ID 1/32 inch | McMaster-Carr | E-3603 | |
| Vacuum oven | Fisher Scientific | 282A | |
| Biopsy punch 8 mm | World Precision Instruments | 504535 | |
| Bioposy punch 0.5 mm | World Precision Instruments | 504528 | |
| Syringe, 30 mL | BD | 309659 | |
| Syringe, 3 mL | BD | 309651 | |
| Needle, 18 gauge | BD | 305195 | |
| Microcentrifuge tube, 1.5 mL | Eppendorf | 22-36-320-4 | |
| High-speed Camera | Vision Research | Miro M120 | |
| Microscope | Carl Zeiss AG | Zeiss Observer, Z1 | |
| Syringe pump | New Era Pump Systems | NE-300 | |
| Hydrogenated castor oil | Procter & Gamble | N/A | |
| Afício MP 6002 Printer | Ricoh Company, Ltd. | 415877 |
Referanslar
- Mitchell, P. Microfluidics-downsizing large-scale biology. Nat. Biotech. 19, 717-721 (2001).
- Haber, C. Microfluidics in commercial applications; an industry perspective. Lab Chip. 6, 1118-1121 (2006).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Huang, X., Raghavan, S. R., Terech, P., Weiss, R. G. Distinct kinetic pathways generate organogel networks with contrasting fractality and thixotropic properties. J. Am. Chem. Soc. 128, 15341-15352 (2006).
- Larsen, T. H., Schultz, K. M., Furst, E. M. Hydrogel microrheology near the liquid-solid transition. Korea-Aust. Rheol. J. 20, 165-173 (2008).
- Larsen, T. H., Furst, E. M. Microrheology of the liquid-solid transition during gelation. Phys. Rev. Lett. 100, 146001 (2008).
- Schultz, K. M., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid rheological screening to identify conditions of biomaterial hydrogelation. Soft Matter. 5, 740-742 (2009).
- Switzer, L. H., Klingenberg, D. J. Flocculation in simulations of sheared fiber suspensions. Int. J. Multiph. Flow. 30, 67-87 (2004).
- Wehrman, M. D., Lindberg, S., Schultz, K. M. Quantifying the dynamic transition of hydrogenated castor oil gels measured via multiple particle tracking microrheology. Soft Matter. 12, 6463-6472 (2016).
- Wehrman, M. D., Milstrey, M. J., Lindberg, S., Schultz, K. M. Using µ2rheology to quantify rheological properties during repeated reversible phase transitions of soft matter. Lab Chip. 17, 2085-2094 (2017).
- Wehrman, M. D., Lindberg, S. E., Schultz, K. M. Impact of shear on the structure and rheological properties of a hydrogenated castor oil colloidal gel during dynamic phase transitions. J. Rheol. , (2018).
- Loh, X. J. Dual-responsive "reversible micelles". J. Appl. Polym. Sci. 127, 992-1000 (2013).
- Kern, F., Zana, R., Candau, S. J. Rheological properties of semidilute and concentrated aqueous solutions of cetyltrimethylammonium chloride in the presence of sodium salicylate and sodium chloride. Langmuir. 7, 1344-1351 (1991).
- Trappe, V., Prasad, V., Cipelletti, L., Segre, P. N., Weitz, D. A. Jamming phase diagram for attractive particles. Nature. 411, 772-775 (2001).
- Philipse, A. P., Wierenga, A. M. On the density and structure formation in gels and clusters of colloidal rods and fibers. Langmuir. 14, 49-54 (1998).
- Schultz, K. M., Bayles, A. V., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid, high resolution screening of biomaterial hydrogelators by mu2rheology. Biomacromolecules. 12, 4178-4182 (2011).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179, 298-310 (1996).
- Mason, T. G. Estimating the viscoelastic moduli of complex fluids using the generalized Stokes--Einstein equation. Rheol. Actac. 39, 371-378 (2000).
- Mason, T. G., Ganesan, K., van Zanten, J. H., Wirtz, D., Kuo, S. C. Particle tracking microrheology of complex fluids. Phys. Rev. Lett. 79, 3282-3285 (1997).
- Mason, T. G., Weitz, D. A. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74, 1250-1253 (1995).
- Squires, T. M., Mason, T. G. Fluid mechanics of microrheology. Annu. Rev. Fluid Mech. 42, 413-438 (2010).
- Gittes, F., Schnurr, B., Olmsted, P. D., MacKintosh, F. C., Schmidt, C. F. Microscopic viscoelasticity: shear moduli of soft materials determined from thermal fluctuations. Phys. Rev. Lett. 79, 3286-3289 (1997).
- Mai, D. J., Brockman, C., Schroeder, C. M. Microfluidic systems for single DNA dynamics. Soft Matter. 8 (41), 10560-10572 (2012).
- Tanyeri, M., Ranka, M., Sittipolkul, N., Schroeder, C. M. A microfluidic-based hydrodynamic trap: design and implementation. Lab Chip. 11, 1786-1794 (2011).
- Lee, J. S., Dylla-Spears, R., Teclemariam, N. P., Muller, S. J. Microfluidic four-roll mill for all flow types. Appl. Phys. Lett. 90, 074103 (2007).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179 (1), 298-310 (1996).
- Mason, T. G., Weitz, D. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74 (7), 1250 (1995).
- Schultz, K. M., Furst, E. M. High-throughput rheology in a microfluidic device. Lab on a chip. 11, 3802-3809 (2011).
- Abate, A. R., Lee, D., Do, T., Holtze, C., Weitz, D. A. Glass coating for PDMS microfluidic channels by sol-gel methods. Lab Chip. 8, 516-518 (2008).
- Happel, J., Brenner, H. . Low Reynolds Number Hydrodynamics: with special applications to particulate media. , (1965).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır