Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Kombination von Mikrofluidik und Microrheology während wiederholter Phasenübergänge rheologische Eigenschaften der weichen Materie ermitteln
In diesem Artikel
Zusammenfassung
Wir zeigen die Herstellung und Verwendung eines mikrofluidischen Gerät, das mehrere Teilchen tracking Microrheology Messungen zur Untersuchung der rheologischen Auswirkungen wiederholter Phasenübergänge auf weiche Materie ermöglicht.
Zusammenfassung
Die Mikrostruktur der weichen Materie direkt wirkt sich makroskopische rheologische Eigenschaften und kann durch Faktoren wie kolloidale Umlagerung während der vorherigen Phasenänderungen geändert werden und Scherung angewendet. Um das Ausmaß dieser Veränderungen zu ermitteln, haben wir eine mikrofluidischen Gerät entwickelt, dass ermöglicht wiederholt Phasenübergänge induziert durch Austausch von der umgebenden Flüssigkeit und Microrheological Charakterisierung Scherkräfte auf die Probe zu begrenzen. Diese Technik ist µ2Rheologie, die Kombination von Mikrofluidik und Microrheology. Das mikrofluidischen Gerät ist ein zwei-Schicht-Design mit symmetrischen Eingang Streams in eine Probenkammer, die Gel-Probe im Ort während der Flüssigkeitsaustausch fallen. Absaugung kann weit entfernt von der Probenkammer, Flüssigkeiten in die Probenkammer ziehen angewendet werden. Rheologische Eigenschaften sind mit mehreren Teilchen tracking Microrheology (MPT) charakterisiert. MPT fluoreszierende Sonde Partikel in das Material eingebettet sind und die Brownsche Bewegung der Sonden ist mit Videomikroskopie aufgezeichnet. Die Bewegung der Teilchen wird verfolgt und die Mean-squared Verschiebung (MSD) berechnet. MSD bezieht sich auf makroskopische rheologischen Eigenschaften, indem Sie die verallgemeinert Stokes-Einstein-Beziehung. Die Phase des Materials ist im Vergleich zu der kritischen Entspannung Exponent identifiziert, anhand von Zeit-Heilung-Überlagerung. Messungen von faserigen kolloidalen Gel illustrieren das Dienstprogramm der Technik. Dieses Gel hat eine feine Struktur, die irreversibel geändert werden kann, wenn Scherung angewendet wird. µ2Rheologie Daten zeigt, dass das Material immer wieder an den gleichen rheologischen Eigenschaften nach jedem Phasenübergang gestalten, darauf hinweist, dass Phasenübergänge mikrostrukturellen Veränderungen keine Rolle spielen. Um die Rolle der Scherung zu bestimmen, können Proben vor der Injektion in unserem mikrofluidischen Gerät geschert. µ2Rheologie ist ein breit anwendbare Verfahren zur Charakterisierung von weicher Materie ermöglicht die Bestimmung der rheologischen Eigenschaften von feinen Mikrostrukturen in einer einzigen Probe bei Phasenübergängen in Reaktion auf wiederholte Änderungen in der umliegenden Umweltbedingungen.
Einleitung
Phasenübergänge in weicher Materie können die Gerüst-Struktur ändern, die Auswirkungen in der Verarbeitung und endgültige Stabilität der Werkstoff-1,2,3hat. Die Charakterisierung von weichen Materialien während der dynamischen Phasenübergänge bietet wichtige Informationen über die Beziehung zwischen strukturellen Entwicklung und Gleichgewicht Struktur und rheologischen Eigenschaften. Beispielsweise erfordern viele häusliche Pflege-Produkte einen Phasenwechsel bei Verwendung durch Verbraucher. Auch während der Herstellung, können Bearbeitungsschritte, einschließlich Verdünnung und mischen, vermitteln Scherung die rheologischen Eigenschaften und endgültige Mikrostruktur des Produktes beeinflussen. Verständnis der rheologischen Eigenschaften in einem Phasenwechsel wird sichergestellt, dass das Produkt funktioniert wie vorgesehen. Darüber hinaus ändert Kräfte die Ausgangspunkt Rheologie des Materials bei der Herstellung, können Phasenübergänge unerwartete und unerwünschte, ändern die beabsichtigte Funktion und Wirksamkeit Ergebnissen. Zeitpunkt der kritischen Gelierung, definiert als der Punkt, wo das Material von einer Lösung der damit verbundenen Kolloide oder Polymere mit einem Probe-spanning Gel Netzwerk, Übergänge, Materialeigenschaften drastisch ändern mit geringfügigen Änderungen Verband. Änderungen an der Struktur der kritischen gelierpunkt kann das Endprodukt4auswirken. Während diese dynamische Übergänge können weiche Materialien haben schwache mechanische Eigenschaften und Messungen, die klassischen experimentellen Techniken verwenden, innerhalb der Messung Lärm Limit5,6,7. Zu dieser, Techniken wie Microrheology, entfallen die sensibel im Bereich von niedrigen Moduli (10-3 - 4 Pa), werden verwendet, um das schwach beginnende Gel während dynamische Entwicklung zu charakterisieren. Einige Materialien sind anfällig für Veränderungen in der Mikrostruktur durch externe Kräfte, die während der Charakterisierung, eine Herausforderung darstellt, da die Übertragung von Material oder Flüssigkeit die Struktur und letztlich die endgültige Materialeigenschaften beeinflussen kann. Um zu vermeiden, die Material Mikrostruktur verändern, haben wir eine mikrofluidischen Gerät entwickelt, das die Umwelt Flüssigkeit um eine Probe austauschen kann, bei gleichzeitiger Minimierung der Scherung. Durch den Austausch von den sich ständig verändernden Umfeld, sind Veränderungen in der rheologischen Eigenschaften und Mikrostruktur während Phasenübergänge mit minimalen Beiträgen von Scherkräften gemessen. Das Gerät ist mit mehreren Teilchen tracking Microrheology (MPT) in eine Technik namens µ2Rheologie kombiniert. Diese Technik wird verwendet, um die Materialeigenschaften bei aufeinander folgenden Phasenänderungen eines Gels als Reaktion auf eine externe Antriebskraft zu quantifizieren. Die Technik wird mit einem faserigen kolloidalen Gel, hydriertes Rizinusöl (HCO)9,10,11veranschaulicht werden.
Gel-Gerüste können Veränderungen in der Assoziation und Dissoziation aufgrund ihrer Probe Umwelt12,13,14,15unterziehen. Die treibende Kraft für die Gelierung und Abbau sind bestimmte Material und muss für jedes Material von Interesse zugeschnitten werden. µ2Rheologie kann verwendet werden, um Gel-Systeme zu charakterisieren, die auf äußere Reize, einschließlich kolloidale und Polymere Netzwerke reagieren. Salzkonzentration, pH-Wert oder osmotischen Druck zu verändern, sind Beispiele für Antriebskräfte, die Änderungen in der materiellen Mikrostruktur auslösen können. Zum Beispiel erfährt HCO kontrollierten Phasenübergänge durch die Schaffung eines osmotischen Druckgradienten. Wenn eine konzentrierte HCO Gel Probe (4 Gew.-% HCO) in Wasser untergetaucht ist, schwächen die Anziehungskräfte zwischen den kolloidalen Teilchen, Abbau verursacht. Alternativ, wenn eine verdünnte Lösung des HCO (0,125 Gew.-% HCO) ist mit einem hydrophilen Material (als das Geliermittel bezeichnet und besteht aus meist Glycerin und Tensid) kontaktiert, die attraktive Kräfte zurück, wodurch Gelierung. Dieses Gel-System wird verwendet, den Betrieb des Geräts als Instrument zur Messung der aufeinander folgenden Phasenübergängen auf eine einzelne Probe9,10zu zeigen. Um diese Gel-Gerüste während dynamische Übergänge und die zarten beginnende Gelstruktur am kritischen Phasenübergang zu charakterisieren, verwenden wir MPT, um diese Materialien mit hoher räumlich-zeitliche Auflösung zu charakterisieren.
Microrheology wird verwendet, um Gel Eigenschaften und Struktur, vor allem in den kritischen Übergang aus einem Array von weichen Materialien, einschließlich kolloidale und Polymere Gele5,6,9,16zu bestimmen. MPT ist eine passive Microrheological-Technik, die Videomikroskopie Datensatz verwendet die Brownsche Bewegung von fluoreszierenden Sonde Partikel innerhalb einer Probe eingebettet. Die Partikelpositionen in den Videos sind genau bis auf 1/10th eines Pixels mit klassischen tracking-Algorithmen17,18bestimmt. Das Ensemble im Durchschnitt Mean-squared Verschiebung (MSD, (ΔR2(t))) errechnet sich aus diesen Teilchen Flugbahnen. Der MSD bezieht sich auf Materialeigenschaften, wie z. B. die Einhaltung kriechen mit der verallgemeinerten Stokes-Einstein-Beziehung17,19,20,21,22, 23. Der Zustand des Materials wird bestimmt durch die Berechnung der logarithmischen Steigung der Kurve MSD als Funktion der Verzögerungszeit, α,
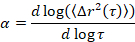
wobei t die Verzögerungszeit und vergleicht sie mit der kritischen Entspannung Exponent, nist. n wird mit der Zeit-Heilung Überlagerung, eine gut dokumentierte Technik, die geändert wurde, um MPT Datenanalyse von Larsen und Furst6ermittelt. Im Vergleich wird der Zustand des Materials von n zu α quantitativ bestimmt. Wenn α > n das Material ist ein Sol, und wenn α < n das Material ist ein Gel. Bisherigen Arbeit hat das HCO-System mit Microrheology um zu bestimmen, die kritische Entspannung Exponent9gekennzeichnet. Mithilfe dieser Informationen ermitteln wir genau, wann das Material von einem Gel in eine Sol während eines Experiments übergeht. Darüber hinaus kann der nicht-Gauß-Parameter αNG, berechnet werden, um das Ausmaß der strukturellen Heterogenität eines Systems festzustellen,
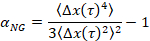
ΔX(t) ist der eindimensionale Teilchenbewegung in X -Richtung. Mit MPT, können wir einen einzigen Phasenübergang charakterisieren, aber durch die Charakterisierung von Materialien mit MPT in einem mikrofluidischen Gerät, sind wir in der Lage, flüssige Umgebung zu manipulieren und sammeln Daten von mehreren Phasenübergänge an einer einzigen Gel-Probe.
Dieses mikrofluidischen Gerät soll die kritische Übergänge von einer einzigen Gel Probe zu untersuchen, die Phasenänderungen als Reaktion auf Änderungen in der flüssigen Umgebung erfährt. Das Gerät tauscht Flüssigkeit umgeben die Probe, wenn es entweder in der Gel- oder Sol Staat ist durch Sperren der Probe im Ort, um einen Phasenübergang bei gleichzeitiger Minimierung der Scherung zu induzieren. Ein Lösungsmittel Becken befindet sich direkt oberhalb der Probenkammer, die durch sechs symmetrisch angeordneten zulaufkanäle verbunden sind. Diese Symmetrie ermöglicht den Austausch von Flüssigkeit aus dem Lösungsmittel Becken die Probenkammer beim Erstellen gleich Druck um die Probe im Ort sperren. Wurden mehrere Studien, die diese Technik für Einzelkorn und DNA-Überfüllung verwenden, aber diese Arbeit skaliert die Lautstärke von einzelnen Molekülen zu Beispielen, die ca. 10 µL24,25,26sind. Dieses einzigartige Design ermöglicht auch in Echtzeit Microrheological Charakterisierung während dieser Phasenübergänge.
µ2Rheologie ist eine robuste Technik, die auf viele weiche Materie Systeme anwendbar ist. In diesem Artikel beschriebene Verfahren wurde für kolloidale Gele entwickelt, aber es kann leicht an andere Materialien wie Kunststoff oder Mizellen Lösungen angepasst werden. Mit dieser Technik, wir bestimmen nicht nur, wie Phasenübergänge Materialeigenschaften Gleichgewicht beeinflussen, aber auch wie verschiedene Bearbeitungsschritte können nachhaltige Effekte auf die rheologischen Evolution des Materials und die endgültige Gerüst Struktur und Eigenschaften.
Protokoll
1. Herstellung von mikrofluidischen Gerät
- Mikrofluidische Stempel Herstellung.
Hinweis: Dieser Schritt erfordert die Verwendung von flüchtigen Stoffen und sollte in einem chemischen Abzug erfolgen.- Verwenden Sie negative Design-Aufdruck mit denselben Abmessungen wie die Objektträger (75 × 50 mm), die Kanäle weiß eingefärbt, und Hintergrund farbig schwarz (siehe Abbildung 1). Drucken Sie dieses Design auf einem klaren Acetat Blatt (Transparenz) mit einer Auflösung von 1200 dpi.
- Wenn der dunkle Bereich der Transparenz noch Licht durch erlaubt, mehrere negative Schicht und halten mit doppelseitigem Klebeband.
- Die hohe Intensität ultravioletten (UV) Lichtquelle schalten Sie ein und lassen Sie ihn Warmlaufen zu einer konstanten Leistung (ca. 30 min).
Hinweis: UV-Schutzbrille sollte getragen werden, wenn die hochintensive UV-Lichtquelle zu verwenden. - Füllen Sie drei 150 mL-Petrischalen mit Aceton, Ethanol und destilliertem Wasser.
- Legen Sie eine leere Transparenz auf einer ebenen Fläche in der Nähe von Hochleistungs-UV-Quelle, aber nicht direkt unter dem UV-Licht. Dieses versieht einen Ausgangspunkt, um die mikrofluidischen Stempel fabrizieren.
- Skizzieren Sie die Ecken einer 75 × 50 mm Glas Folie in der Mitte der leere Transparenz mit einem permanent Marker und Platz vier glasabstandshalter (ca. 30 × 30 × 1 mm) in den Ecken des skizzierten Rechtecks.
- Gießen Sie etwa 5 mL UV heilbar Thiol: ene Harz in der Mitte der Abstandhalter, dann legen Sie vorsichtig eine 75 x 50 x 1 mm-Objektträger auf die glasabstandshalter, so dass der Kleber durch die gläsernen Objektträger mit keine Luftblasen vollständig bedeckt ist.
- Legen Sie die Transparenz mit gedruckten negativ auf den Objektträger und verschieben Sie die oben genannten Komponenten (von unten nach oben: leer, Transparenz, glasabstandshalter und UV-Kleber, Objektträger und negative gedruckten Transparenz) durch Ziehen der leere Transparenz sorgfältig unter der UV-Lichtquelle.
- Das UV-Licht durchscheinen negativ auf den Harz und Heilung zu ermöglichen. Die Aushärtungszeit kann angepasst werden, um die Höhe des Kanals ändern. Eine 45 s Heilung Zeit führt eine Kanalhöhe von 1 mm, mit unserer Lichtquelle.
- Verschieben Sie die Komponenten von der UV-Quelle und entfernen Sie die negative gedruckten Transparenz und Objektträger. Der Objektträger mit den Kanälen in UV-Klebstoff hergestellt wird jetzt als mikrofluidischen Stempel bezeichnet werden.
- Entsorgen Sie die Transparenz und Glas Abstandhalter.
- Tauchen Sie den mikrofluidischen Stempel im Aceton Bad, gefolgt von der Ethanol-Bad. Wiederholen Sie diesen Schritt zweimal. Aceton wird abgebaut, die UV-Kleber, also nicht verlassen, Aceton auf den Stempel für mehr als 10 s.
- Halten Sie den Stempel, Tauchen Sie den Stempel in das Wasser und verwenden Sie einem Wattestäbchen, um den Rest der nicht umgesetztes Harz zu entfernen. Nicht direkt Abwischen der ausgehärteten Portionen, wie es die Kanäle rau zu machen.
- Legen Sie den Stempel auf einem Papiertuch und zurück auf die UV-Quelle für mindestens 30 Minuten zur vollständigen Aushärtung zu gewährleisten.
- Polydimethylsiloxan (PDMS) Gießen
- 70 g PDMS-Basis in eine klare Tasse Gießen und fügen Sie die Vernetzungsmittel an der Basis in einem Gewichtsverhältnis von 01:10 Vernetzer zu stützen. Dies sind die Hersteller empfohlen Verhältnisse. Verwenden Sie keinen Glasbehälter.
- Mischen der Vernetzer und gründlich mit einem Metall Rührer Basis; die Mischung sollte trübe durch Eingeschlossene Luftblasen, einmal richtig gemischt werden.
- Die gemischte PDMS der PDMS in einem Vakuum Vakuum Ofen und ziehen aufsetzen. Schalten Sie Vakuum, wenn die Lösung beginnt zu Überlauf aus dem Kelch, dann Vakuum fortgesetzt, nachdem der Überlauf nachlässt. Der Gesamtdruck in den Vakuumofen spielt keine Rolle, wie das Vakuum nur die Entgasung beschleunigt. Lassen Sie in der Kammer, bis alle Luftblasen aus der Mischung (ca. 60 min) evakuiert wurden.
- Ort der mikrofluidischen Stempel in einem leeren 150 mm Durchmesser Kunststoff Petrischale, dann Gießen Sie langsam die PDMS in der Petrischale mikrofluidischen Stempel vollständig bedeckt. Gießen Sie nah an der Oberfläche der Petrischale, Luftblasen in der PDMS Reform zu minimieren.
- Decken Sie der Petrischale ab und in einem 55 ° C Ofen über Nacht zu heilen. Einmal vollständig geheilt, die gemusterten PDMS mit einem Messer geschnitten und aus den Stempel entfernen. Behalten Sie überschüssige PDMS für den Bau der Lösungsmittel-Becken (Protokoll Schritt 1.6.3) und PDMS Stopper (Protokoll Schritt 2.2.1.1).
- Mit einem 0,5 mm-Biopsie-Punch, schneiden Sie Löcher in den folgenden Orten: an jeder Ecke, in die Ansaugkammer nahe dem Rand des Kanals, sechs in die Probenkammer symmetrisch angeordnet 60° auseinander, und eines in der Mitte die Probenkammer. Dafür Drucken symmetrisch platzierten Löcher eine Muster auf ein Blatt Papier und unter den Probenraum statt. Da die PDMS klar ist, können Sie leicht erkennen, wo die Löcher platziert werden müssen.
- Vorbereitung der Sol-Gel-Lösung Glaswände in mikrofluidischen Gerät erstellen
- Fügen Sie in einem 100 mL-Glas, 25 mL 90 % Ethanol, 25 mL pH 4 (0,0001 M) Salzsäure, 25 mL von 98 % Tetraethoxysilan und 25 mL 98 % Methyltriethoxysilane. Legen Sie die 100 mL Lösung, jetzt genannt die preconverted Flüssigkeit, in der Mikrowelle für 10 Sekunden, dann legen Sie in eine 80 ° C über Nacht unbedeckt.
- Gerätemontage
- Legen Sie beide die gemusterten PDMS und eine 75 × 50 × 0,10 mm Glas Folie in das Plasma Reiniger und legen Sie die 3-Wege-Ventil auf aus stellen.
- Schalten Sie die Vakuumpumpe und erlauben Sie eine Minute um die Kammer zu evakuieren.
- Setzen Sie das 3-Wege-Ventil, um flow Controller Position und lassen die equilibrate für 5 Sekunden Kammer. Die Flow Controller Lage erlaubt einen kleinen Volumenstrom der Luft, das Plasma Reiniger, niedrig genug zu betreten, um die Kammer bei niedrigem Druck zu halten. Aktivieren Sie die Radiofrequenz (RF), Medium für 40 Sekunden, dann schalten Sie den RF-Schalter und Vakuumpumpe.
- Legen Sie die 3-Wege-Ventil in die Öffnungsstellung atmosphärischen Bedingungen der Kammer wieder. Entfernen Sie die gemusterte PDMS und Glas gleiten.
- Befolgen Sie sorgfältig die gemusterten PDMS auf dem Objektträger indem man die beiden Flächen miteinander in Kontakt.
- Die Nähte um die gemusterten PDMS und Heilung für 5 min unter geringer Intensität UV-Licht UV heilbar Harz zuweisen.
- Herstellung von Glaswänden in mikrofluidischen Kanälen.
Hinweis: Dieser Schritt muss innerhalb von 30 Minuten nach der Plasmabehandlung, ausgeführt werden, da es stützt sich auf PDMS Oberflächenveränderungen, die während der Plasmabehandlung auftreten. Die Dicke der Schicht werden ca. 5 bis 10 µm. Dieser Schritt erfordert die Verwendung von flüchtigen Stoffen und sollte in einem chemischen Abzug erfolgen.- Legen Sie eine Herdplatte auf 100 ° C und bereiten Sie vier Spritzen (drei 30 mL und 3 mL) mit 18-Gauge Nadeln und etwa 30 cm Länge deutlich thermoplastische Rohre vor.
- Füllen Sie drei 30 mL Spritzen mit Ethanol, Chloroform und Luft, beziehungsweise. Füllen Sie eine 3 mL Spritze mit preconverted Flüssigkeit (aus Protokoll Schritt 1.3.1.)
- Legen Sie klare thermoplastischen Schlauch mit Edelstahl-Steckverbinder in jedes der Löcher in der gemusterten PDMS, mit Ausnahme von einer Ecke Loch. Dieses Loch wird als einen Einlass verwendet werden, während alle anderen Filialen werden.
- Füllen Sie das mikrofluidischen Gerät mit preconverted Flüssigkeit aus der Spritze, dann stellen Sie das Gerät von mikrofluidischen auf 100 ° C heißen Platte, so dass das untere Glas die Oberfläche der Heizplatte berührt.
- Fließen Sie 3 mL preconverted Flüssigkeit durch das mikrofluidischen Gerät über 10 Sekunden. Die Dicke der Wände aus Glas ist durch Veränderung des Durchfluss der preconverted Flüssigkeit eingestellt.
- Entnehmen Sie von der Herdplatte mikrofluidischen. Ersetzen Sie die preconverted Lösung-Spritze mit dem luftbläser und jede überschüssige preconverted Flüssigkeit herausdrücken.
- Die luftbläser mit Chloroform Spritze ersetzen und langsam 15 mL Chloroform durch mikrofluidischen Gerät fließen. Ersetzen Sie die Chloroform-Spritze mit der Ethanol-Spritze und fließen Sie langsam 30 mL Ethanol durch die mikrofluidischen Gerät. Diese Schritte sollten ca. 1 min. dauern.
- Ersetzen Sie die Ethanol-Spritze mit Luft-Spritze und Fluss-Luft durch das mikrofluidischen Gerät bis trocken.
- Anwendung der Glasauflagen und Lösungsmittel-Becken
- 75 × 10 × 1 mm kürzen Glas Glasstreifen aus 75 × 25 × 1 mm Folien.
- Die Glasleisten UV heilbar Harz zuweisen. Stellen Sie das Gerät von mikrofluidischen auf die Streifen mit der PDMS-Seite nach oben. Verschieben Sie unter geringer Intensität UV-Lichtquelle für 5 Minuten.
- Schneiden Sie eine 30 × 30 mm Quadrat des PDMS. Schneiden Sie mit einem Biopsie-Punch ein Loch groß genug, um die 10 mm Probenkammer zu decken.
- PDMS Quadrat und mikrofluidischen Gerät in das Plasma Reiniger, dann setzen Sie das 3-Wege-Ventil auf aus stellen und schalten Sie die Vakuumpumpe.
- Lassen Sie eine Minute, um die Kammer zu evakuieren. Stellen Sie das 3-Wege-Ventil auf Flow Controller Position und lassen Sie die Kammer für 5 Sekunden equilibrate.
- Schalten Sie RF ein Medium für 40 Sekunden, dann schalten Sie RF Switch und Vakuumpumpe.
- Legen Sie die 3-Wege-Ventil in die Öffnungsstellung atmosphärischen Bedingungen der Kammer wieder.
- Das Lösungsmittel Becken und mikrofluidischen Gerät aus der Plasmakammer entfernen und durch die Kontaktflächen zu halten. Achten Sie darauf, um das Lösungsmittel Becken über die Probenkammer zu platzieren.
(2) µ2Rheologie Verfahren
-
Vorbereitung der weichen Materie Proben
- Waschen-Sonde Partikel
- Pipette Wasser und 0,5 µm-Sonden zu einem Microcentrifuge Schlauch in einem Verhältnis von Wasser zu Sonden von 10:1. Mischen Sie gründlich mit Pipette mischen, dann legen Sie Microcentrifuge Schlauch in die Microcentrifuge und Spin bei 4600 X g für 10 Minuten.
Hinweis: In dieser Arbeit verwendeten Sonde-Lösung in Wasser mit einer Ausgangskonzentration von 2,6 % Feststoffe/Volumen schweben empfangen wird und die Endkonzentration von Sonden, die im Beispiel verwendeten ist 0,1 % Feststoffe/Volumen. - Die Microcentrifuge Schlauch und Pipette, überstand abnehmen. Den Überstand mit VE-Wasser zu ersetzen. Wiederholen Sie Zentrifugation für insgesamt drei Mal.
- Microcentrifuge Schlauch in den sonikator und beschallen auf Low für 15 Minuten, um Aggregate zu entfernen.
- Pipette Wasser und 0,5 µm-Sonden zu einem Microcentrifuge Schlauch in einem Verhältnis von Wasser zu Sonden von 10:1. Mischen Sie gründlich mit Pipette mischen, dann legen Sie Microcentrifuge Schlauch in die Microcentrifuge und Spin bei 4600 X g für 10 Minuten.
- Kombination von Sonden und weicher Materie.
Hinweis: Für dieses Verfahren war eine kolloidale Gel wie die weiche Materie-Probe verwendet.- Auf einer 75 × 50 mm Glas Folie 1 mL der Probe zu messen. Pipette 40 µL Sonde Lösung in der Mitte der Probe.
- Falten Sie sanft die Probe mit einem Metallspatel bis komplett kombiniert. Schöpfen Sie die Probe in einem Microcentrifuge Schlauch und Zentrifuge bei 2340 X g für 15 s um eingeschlossene Luft zu entfernen.
- Füllen Sie eine 1 mL Spritze mit 18 Gauge-Nadel und klare thermoplastische Schläuche mit der Sonde/HCO-Mischung ausgestattet.
- Waschen-Sonde Partikel
-
Aufeinander folgenden Phasenübergängen induziert durch Flüssigkeitsaustausch
- Füllung der Mikrofluidik-Gerät
- Um PDMS Stopper zu erstellen, schneiden Sie mit überschüssigen PDMS aus Protokoll Schritt 1.2.5, 5 mm quadratischem Querschnitt des PDMS. Mit einem 0,5 mm Durchmesser Biopsie-Punch, schneiden Sie ein Loch in der PDMS-Stopper auf halbem Weg. Die 0,5 mm Durchmesser-Loch stecken Sie einen Edelstahl-Anschluss.
- Verbinden Sie thermoplastische Rohre mit drei von der Ecke zulaufkanäle und dem Auslasskanal Schöpfraum. Komplett füllen Sie das Gerät mit Wasser mit einer Spritze, die mit dem Gerät verbunden. Sicherzustellen, gibt es keine Luftblasen in die Probenkammer oder in den Kanälen mikrofluidischen. Die andere Ecke Öffnung mit PDMS Stopper zu blockieren.
- Das Lösungsmittel Becken ist teilweise aus Schritt 2.2.1.2 auszufüllen; Wenn sie nicht gefüllt ist, füllen Sie das Lösungsmittel Becken mit Wasser.
- Mit der Spritze aus Protokoll Schritt 2.1.2.3, injizieren Sie 10 µL der Probe/Sonde Mischung durch den Center-Kanal in die Probenkammer mit ca. 2 µL/s, dann verwenden Sie einen PDMS-Stopper, um des Center-Kanals in die Probenkammer zu blockieren.
- Microrheological Datenerfassung
- Schalten Sie die Kamera-Einstellungen mit denen optimiert, um statische und dynamische Partikel, die Verfolgung von Fehlern zu minimieren und wechseln Sie zu den 63 × Wasser eintauchen Objektiv und pipette einen Tropfen Wasser auf die Linse.
- Mikroskoptisch setzen Sie mikrofluidischen Gerät auf und heben Sie das Ziel, bis es auf die Probe fokussiert ist.
- Zeitintervalle für die Gesamtlänge von einem Phasenwechsel übernehmen Sie Videos der Brownschen Bewegung der Sonden. Für die Gelierung Einnahme Videos bis Sonde Bewegung Stillstand gekommen ist.
Hinweis: Wir erheben Daten alle 10 Minuten. Wenn wir mit einem Abbau Experiment beginnen, werden Daten erfasst, bis die Sonden komplett verbreitet sind.
- Den Austausch von Flüssigkeiten in die Probenkammer (Schwerkraft, Austausch von niedriger Dichte Flüssigkeiten mit höherer Dichte Flüssigkeiten)
- Mikroskoptisch entfernen Sie mikrofluidischen Gerät.
- Absaugen des Wassers aus dem Lösungsmittel Becken mit einer transferpipette, dann pipette 4 mL höhere Dichte Flüssigkeit in das Lösungsmittel Becken.
- Mikroskoptisch mikrofluidischen Gerät wieder und wiederholen Sie die Schritt 2.2.2.3
- Den Austausch von Flüssigkeiten in die Probenkammer (Saugstrom, höhere Dichte Flüssigkeitsaustausch mit niedriger Dichte Flüssigkeiten)
- Mikrofluidische Gerät aus den Mikroskoptisch und entfernen Sie den PDMS-Stopper aus den saugraum.
- Legen Sie eine Spritze mit einem 18-Gauge-Nadel und klare thermoplastische Schläuche auf den Schöpfraum Kanal ausgestattet, und Haken Sie die Spritze bis zu eine Spritzenpumpe. Die Spritzenpumpe bei 1 mL/min eingestellt.
- Entfernen Sie überschüssige Geliermittel in das Lösungsmittel Becken und spülen Sie drei Mal mit Wasser, füllen das Lösungsmittel Becken und dann absaugen, die Flüssigkeit spülen.
- BEGIN Absaugung mit der Spritzenpumpe unter Zugabe von Wasser in das Lösungsmittel Becken für eine Minute. Bitte lassen Sie nicht das Lösungsmittel Becken leer komplett, ziehen diese Luft in die Probenkammer.
- Ziehen Sie die Spritze aus dem mikrofluidischen Gerät und ersetzen Sie PDMS Stopper Schöpfraum zu.
- Mikroskoptisch mikrofluidischen Gerät wieder und nehmen Sie Proben
- Füllung der Mikrofluidik-Gerät
- Fortsetzen Sie Entnahme von Proben in regelmäßigen Abständen während der Abbau/Gelierung Zyklen, bis die gewünschte Anzahl von Zyklen abgeschlossen oder es nicht genügend Sonden zur Messung gibt.
Ergebnisse
Eine zweischichtige mikrofluidischen Gerät baut mit PDMS (Abbildung 1a, b), die auf einer Briefmarke von mikrofluidischen gemustert ist. Das Design des Stempels ist in Abbildung 1cdargestellt. Unsachgemäße Versuchsaufbau kann dazu führen, dass beide Fehler in passive Microrheology und mikrofluidischen fließt während rund um Flüssigkeitsaustausch (Abbildung 2)....
Diskussion
Das zweilagige mikrofluidischen Gerät (Abbildung 1) kann leicht durch folgende gut dokumentierten mikrofluidischen Herstellung Techniken29gemacht werden. Glasträger ergänzen die Unterseite des Geräts, Schwingungs Auswirkungen auf die Bewegung der Sonde zu verringern. Die Glas-Folie ist sehr dünn (0,10 mm) um den Arbeitsabstand von das Mikroskopobjektiv gerecht zu werden. Dies macht das Gerät anfällig für kleine Schwingungen im Gebäude und Probe-Umfeld, die da...
Offenlegungen
Es gibt keine Angaben für diese Arbeit.
Danksagungen
Diese Arbeit wurde von der Procter & Gamble Co. und American Chemical Society Petroleum Research Fund (54462-DNI7) finanziert. Bestätigung erfolgt an die Spender der amerikanischen chemischen Gesellschaft Petroleum Research Fund für partielle Unterstützung dieser Forschung. Die Autoren möchten Dr. Marco Caggioni für hilfreiche Diskussionen zu bestätigen.
Materialien
| Name | Company | Catalog Number | Comments |
| 150 x 15 mm Petri Dish | Corning, Inc. | 351058 | |
| 75 x 50 x 0.15 mm glass slide | Fisher Scientific | Custom | |
| 75 x 50 x 1.0 mm glass slide | Fisher Scientific | 12-550-C | |
| 75 x 25 x 1.0 mm glass Slide | Fisher Scientific | 12-550-A3 | |
| 22 x 22 Glass cover slips | Fisher Scientific | 12-542-B | |
| Acetone, 99.5% | VWR Analytical | 67-64-1 | |
| Low intensity UV source | UVP | UVL-56 | |
| Chloroform, 99.9% | Fisher Chemical | C298-500 | |
| Cotton Swabs | Q-tips | 83289205 | |
| Ethanol, 90% | Fisher Chemical | A962-4 | |
| Fluoresbrite® YG Carboxylate Microspheres 0.50µm | Polysciences, Inc. | 15700-10 | |
| High-Intensity UV Lamp | Spectroline Corp. | SB-100P | |
| Hot plate | Corning, Inc. | PC-420 | |
| Hydrochloric Acid, 6N | Ricca Chemical Company | 3750-32 | |
| Methyltriethyoxysilane, 98% | Acros Organics | 174622500 | |
| Microcentrifuge | Eppendorf | 5424 | |
| Plasma cleaner | Harrick Plasma, Inc. | PDC-32G | |
| Polydimethylsiloxane (PDMS) | Robert McKwown Company | 2065622 | |
| Sonicator | Branson, Emerson Electric | 1800 | |
| Steel connectors, ID 0.023 inch | New England Small Tube Corp. | Custom | |
| Tetraethoxysilane, 98% | Alfa Aesar | A14965 | |
| Thiol-ene Resin (UV curable) | Norland Products, Inc. | NOA81 | |
| Transparency | Staples Inc. | 21828 | |
| Tygon tubing, ID 1/32 inch | McMaster-Carr | E-3603 | |
| Vacuum oven | Fisher Scientific | 282A | |
| Biopsy punch 8 mm | World Precision Instruments | 504535 | |
| Bioposy punch 0.5 mm | World Precision Instruments | 504528 | |
| Syringe, 30 mL | BD | 309659 | |
| Syringe, 3 mL | BD | 309651 | |
| Needle, 18 gauge | BD | 305195 | |
| Microcentrifuge tube, 1.5 mL | Eppendorf | 22-36-320-4 | |
| High-speed Camera | Vision Research | Miro M120 | |
| Microscope | Carl Zeiss AG | Zeiss Observer, Z1 | |
| Syringe pump | New Era Pump Systems | NE-300 | |
| Hydrogenated castor oil | Procter & Gamble | N/A | |
| Afício MP 6002 Printer | Ricoh Company, Ltd. | 415877 |
Referenzen
- Mitchell, P. Microfluidics-downsizing large-scale biology. Nat. Biotech. 19, 717-721 (2001).
- Haber, C. Microfluidics in commercial applications; an industry perspective. Lab Chip. 6, 1118-1121 (2006).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Huang, X., Raghavan, S. R., Terech, P., Weiss, R. G. Distinct kinetic pathways generate organogel networks with contrasting fractality and thixotropic properties. J. Am. Chem. Soc. 128, 15341-15352 (2006).
- Larsen, T. H., Schultz, K. M., Furst, E. M. Hydrogel microrheology near the liquid-solid transition. Korea-Aust. Rheol. J. 20, 165-173 (2008).
- Larsen, T. H., Furst, E. M. Microrheology of the liquid-solid transition during gelation. Phys. Rev. Lett. 100, 146001 (2008).
- Schultz, K. M., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid rheological screening to identify conditions of biomaterial hydrogelation. Soft Matter. 5, 740-742 (2009).
- Switzer, L. H., Klingenberg, D. J. Flocculation in simulations of sheared fiber suspensions. Int. J. Multiph. Flow. 30, 67-87 (2004).
- Wehrman, M. D., Lindberg, S., Schultz, K. M. Quantifying the dynamic transition of hydrogenated castor oil gels measured via multiple particle tracking microrheology. Soft Matter. 12, 6463-6472 (2016).
- Wehrman, M. D., Milstrey, M. J., Lindberg, S., Schultz, K. M. Using µ2rheology to quantify rheological properties during repeated reversible phase transitions of soft matter. Lab Chip. 17, 2085-2094 (2017).
- Wehrman, M. D., Lindberg, S. E., Schultz, K. M. Impact of shear on the structure and rheological properties of a hydrogenated castor oil colloidal gel during dynamic phase transitions. J. Rheol. , (2018).
- Loh, X. J. Dual-responsive "reversible micelles". J. Appl. Polym. Sci. 127, 992-1000 (2013).
- Kern, F., Zana, R., Candau, S. J. Rheological properties of semidilute and concentrated aqueous solutions of cetyltrimethylammonium chloride in the presence of sodium salicylate and sodium chloride. Langmuir. 7, 1344-1351 (1991).
- Trappe, V., Prasad, V., Cipelletti, L., Segre, P. N., Weitz, D. A. Jamming phase diagram for attractive particles. Nature. 411, 772-775 (2001).
- Philipse, A. P., Wierenga, A. M. On the density and structure formation in gels and clusters of colloidal rods and fibers. Langmuir. 14, 49-54 (1998).
- Schultz, K. M., Bayles, A. V., Baldwin, A. D., Kiick, K. L., Furst, E. M. Rapid, high resolution screening of biomaterial hydrogelators by mu2rheology. Biomacromolecules. 12, 4178-4182 (2011).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179, 298-310 (1996).
- Mason, T. G. Estimating the viscoelastic moduli of complex fluids using the generalized Stokes--Einstein equation. Rheol. Actac. 39, 371-378 (2000).
- Mason, T. G., Ganesan, K., van Zanten, J. H., Wirtz, D., Kuo, S. C. Particle tracking microrheology of complex fluids. Phys. Rev. Lett. 79, 3282-3285 (1997).
- Mason, T. G., Weitz, D. A. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74, 1250-1253 (1995).
- Squires, T. M., Mason, T. G. Fluid mechanics of microrheology. Annu. Rev. Fluid Mech. 42, 413-438 (2010).
- Gittes, F., Schnurr, B., Olmsted, P. D., MacKintosh, F. C., Schmidt, C. F. Microscopic viscoelasticity: shear moduli of soft materials determined from thermal fluctuations. Phys. Rev. Lett. 79, 3286-3289 (1997).
- Mai, D. J., Brockman, C., Schroeder, C. M. Microfluidic systems for single DNA dynamics. Soft Matter. 8 (41), 10560-10572 (2012).
- Tanyeri, M., Ranka, M., Sittipolkul, N., Schroeder, C. M. A microfluidic-based hydrodynamic trap: design and implementation. Lab Chip. 11, 1786-1794 (2011).
- Lee, J. S., Dylla-Spears, R., Teclemariam, N. P., Muller, S. J. Microfluidic four-roll mill for all flow types. Appl. Phys. Lett. 90, 074103 (2007).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid Interface Sci. 179 (1), 298-310 (1996).
- Mason, T. G., Weitz, D. Optical measurements of frequency-dependent linear viscoelastic moduli of complex fluids. Phys. Rev. Lett. 74 (7), 1250 (1995).
- Schultz, K. M., Furst, E. M. High-throughput rheology in a microfluidic device. Lab on a chip. 11, 3802-3809 (2011).
- Abate, A. R., Lee, D., Do, T., Holtze, C., Weitz, D. A. Glass coating for PDMS microfluidic channels by sol-gel methods. Lab Chip. 8, 516-518 (2008).
- Happel, J., Brenner, H. . Low Reynolds Number Hydrodynamics: with special applications to particulate media. , (1965).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten