Method Article
מודל חולדה של דמיאלינציה קליפת המוח הנרחבת הנגרמת על ידי הזרקה תוך מוחית של ציטוקינים פרו דלקתיים
* These authors contributed equally
In This Article
Summary
הפרוטוקול המוצג כאן מאפשר רבייה של חיקוי נרחב של חומר אפור של שתי ההמיספרות הקליפתיות בחולדות אגוטי אפלות זכריות בוגרות. השיטה כוללת השתלה תוך-מוחית של קטטר, חיסון תת-אקליני נגד מיאלין אוליגודנדרוציטים גליקופרוטאין, והזרקה תוך-מוחית של תערובת ציטוקינים פרו-דלקתית דרך הצנתר המושתל.
Abstract
טרשת נפוצה (MS) היא המחלה הנפוצה ביותר בתיווך מערכת העצבים המרכזית (CNS) ומובילה בהדרגה לנכות פיזית ומוות, הנגרמת על ידי נגעים בחומר הלבן בחוט השדרה וב במוח הקטן, כמו גם על ידי demyelination בחומר אפור. בעוד מודלים קונבנציונליים של דלקת המוח אלרגית ניסיונית מתאימים לחקירה של דלקת בתיווך התא בחומר הלבן בעמוד השדרה ובחומר המוח, הם אינם מצליחים לטפל בפתולוגיות של חומר אפור. כאן, אנו מציגים את הפרוטוקול הניסיוני למודל עכברושים חדשני של דמיאלינציה קליפת המוח המאפשר לחקור את המנגנונים הפתולוגיים והמולקולריים המובילים נגעים קליפת המוח. demyelination הוא המושרה על ידי חיסון עם מיאלין במינון נמוך אוליגודנדרוציטים גליקופרוטאין (MOG) באדג'ובנט של פרוינד לא שלם ואחריו משלוח תוך מוחי בתיווך קטטר של ציטוקינים פרו דלקתיים. הצנתר, יתר על כן, מאפשר סבבים מרובים של demyelination מבלי לגרום טראומה הנגרמת על ידי הזרקה, כמו גם משלוח תוך מוחי של תרופות טיפוליות פוטנציאליות עובר חקירה פרה קלינית. השיטה גם חיובית מבחינה אתית שכן כאב ומצוקה או נכות בעלי חיים נשלטים ומינימליים יחסית. מסגרת הזמן הצפויה ליישום הפרוטוקול כולו היא סביב 8 - 10 שבועות.
Introduction
MS היא מחלה דלקתית בתיווך מערכת החיסון של מערכת החיות, אשר פוגעת בעיקר יריעות מיאלין, אבל בסופו של דבר מוביל לאובדן אקסוני ונזק עצבי קבוע. טרשות נפוצה היא המחלה הנפוצה ביותר בתיווך מערכת חיסון של מערכת ן עם שכיחות מוערכת של כ -2.3 מיליון אנשים ברחבי העולם, על פי האגודה הלאומית לטראנס 1 , ומייצגתנטלאישי וסוציו-אקונומי גדול. הגיל הממוצע של תחלואה המחלה הוא 30 שנה ומוביל לאובדן שנים פוריות על ידי גרימת נכות חמורה. MS הוא כרגע חשוכת מרפא, ואת שיטות הטיפול הנוכחי שואפים לנהל את הסימפטומים במהלך הישנות חריפה בנסיגה-remitting MS ולשנות את מהלך המחלה כדי להקטין את תדירות הישנות על ידי טיפול אימונומודולטורי2,3. אין אפשרות טיפול עדיין הוכיחה יעילות עבור סוגים מתקדמים4, למעט ניסוי קליני האחרון של טיפול מרוקן B-cell, אשר הוכח להיות יעילות בקבוצת משנה של MS פרוגרסיבי ראשוני (PPMS) חולים עם דלקת פעילה5. בעוד מספר גורמי סיכון גנטיים פוטנציאליים6 וסביבתי7 זוהו, האטיולוגיה של MS, עם זאת, עדיין לא ידוע.
MS מאופיין על ידי לוחות demyelinating דלקתיים גדולים, ופציעות מפוזרות, החומר הלבן8,9. נגעים מוקדיים קושרו עם התקפה מתווכת נרחבת של תאי T, הרס אוליגודנדרוציטים, אסטרוגליוזיס תגובתי, ניוון אקסוניאלי, מה שמוביל לירידה בנוירונים מוטוריים. חומר אפור demyelination וניוון זכו להכרה כמאפיינים היסטופתולוגיים נוספים של המחלה9,10,11. האחרון הוצע לתרום לתפקוד נוירולוגי ולירידה קוגניטיבית בחולים12,13. שלושה דפוסים של demyelination קליפת המוח נבדלו, כלומר i) לויקוקורטיקליות, רציפות עם נגעי החומר הלבן (34%), ii) קטן, perivascular (16%), ו - iii) תת-צינורי (50%). שלא כמו נגעים בחומר הלבן מוקד, נגעים אלה חומר אפור דווחו חסר התקפה מתווכת תא T והם מאופיינים במקום זאת על ידי הפעלה microglial משופרת, אפופטוזיס, ואובדן עצבי12.
עד כה, לא ניתן היה לשחזר את MS האנושי במודל של חיה אחת, בעיקר בשל המורכבות של המחלה. מגוון מודלים של בעלי חיים MS, כל המדמה היבטים שונים של פתוגנזה המחלה והתקדמות פותחו, במקום זאת,14,15. המודלים הנוכחיים של בעלי חיים מחקים שלושה תהליכי מחלה שונים: i) נגעים דלקתיים מוקדיים, ii) פגיעה בחומר הלבן מפוזרים, ו-iii) פתולוגיית חומר אפור מפוזרת.
מחקרים בבעלי חיים של לוחות חומר לבן MS נערכו בעיקר במודלים אנצפלאמליטיס מכרסם (EAE). חיות ניסוי מחוסנות באופן פעיל עם אמולסיה המכילה אנטיגן מיאלין [בדרך כלל מיאלין אוליגודנדרוציטים גליקופרוטאין (MOG)16,17, חלבון בסיסי מיאלין (MBP)18, או חלבון פרוטאוליפיד (PLP)19], יחד עם אדג'ובנט של פרוינד שלם (CFA)20. המחלה יכולה גם להיות מושרה באופן פסיבי על ידי העברה מאמצת של תאי T ספציפיים מיאלין21. קורס המחלה תלוי בשילוב זן אנטיגן / עכבר המשמש. MOG35-55 ב C57BL/6, למשל, תוצאות מחלה כרונית מונופאזית22, בעוד PLP139-151 בעכברים שוויצרי ג'ים למברט (SJL) מוביל קורס מחלה חוזרת23 באופן ספציפי למין24. עכברוש MOG35-55,יתר על כן, מעורר תגובת תאי T אנצפליטוגנית, בעוד MOGאנושי 35-55 גורמת לדלקת תלוית תאי B ב- C57BL / 6 עכברים25. מודלים שונים של EAE מספקים כלי מצוין לחקר דלקת בתיווך התא בעיקר בחוט השדרה וב במוח הקטן, אך מבנים מוח-קדם כמו קליפת המוח, קורפוס קאלוסום ומבנים תת-קורטיטיים נותרו חסכים במידה רבה26. לא פציעה מפוזרת של חומר לבן ולא demyelination חומר אפור הוא, יתר על כן, משוכפל כראוי במודלים EAE26,27. demyelination קליפת המוח הקשורים אינדוקציה פעילה EAE דווחה מרמוסטים28,29 ובזני משנה חולדה לואיס מסוימים, במקרה האחרון המיוחס לשילובים השוררים של MHC class I ואיזוטיפים מדרגה II ואללים30.
דגם cuprizoneמודל 31 הוא כלי שימושי לחקר demyelination חומר לבן מפוזר ופתולוגיה של חומר אפור עם demyelination נרחב של קליפת המוח, תת קליפת המוח32, והיפוקמפוס33 אזורים, כמו גם קורפוס callosum34 ואת putamen caudate35. שיכרון Cuprizone, אשר, באופן עקרוני, גורם אפופטוזיס הנגרמת על ידי מתח מטבולי של אוליגודנדרוציטים, מחקה כמה מאפיינים של נגעים demyelinating קליפת המוח של המוחות טרשת נפוצה כגון הפעלת מיקרוגליה, אסטרוגליוזיס, וחוסר יחסי של תאים חיסוניים היקפיים חודרים. חוסר אפופטוזיס עצבי ניוון תלמי, כמו גם את הרזולוציה המלאה של demyelination עם remyelination חזק נצפתה עם הפסקת תוספי קופריזוןתזונתיים 32, עם זאת, להגביל את השימוש של שיכרון cuprizone כמודל טרשת נפוצה פרה-אקלינית. demyelination רעיל יכול גם להיגרם על ידי הזרקת מוקד של ליזולציטין או אתידיום ברומיד לתוך דרכי החומר הלבן36,37, אבל שיטות אלה משמשים לעתים רחוקות. מודלים רעילים demyelination מתאימים במיוחד לניתוח של מנגנונים מורכבים של remyelination, כגון הדרישה לתאי אבות אוליגודנדרוציטים אסטרוציטים38,39. מידע מפורט על מודלים EAE ושיכרון מסופקים בשתי ביקורות אחרונות15,40.
demyelination המושרה ציטוקינים פותח בתחילה כדי לחקור נגעים חומר לבן עמוד השדרה ב EAE41. מאוחר יותר, זה שונה כדי ללמוד פתולוגיות חומר אפור קליפת המוח ב MS. Dark Agouti (DA) או לואיס חולדות מוכנות לראשונה על ידי חיסון תת קליני עם MOG1-12542,43 או MOG1-11644 באדג'ובנט של פרוינד לא שלם (IFA). שלא כמו מודלים קלאסיים של EAE, בעלי חיים אלה אינם מפגינים תסמינים קליניים של נגעים דלקתיים מוקדיים בחוט השדרה. במקום זאת, תגובה דלקתית demyelination במוח מושגים לאחר מכן על ידי ממשל תוך מוחי של תערובת ציטוקינים פרו דלקתית [גורם נמק הגידול אלפא (TNFα) ואינטרפרון גמא (IFNγ)] ברגע שבעלי החיים השיגו titer יציב של נוגדנים נגד MOG בדם.
מחקרים של מרלר ואח'. 42 וגרדנר ואח' 44 הוכיחו את היעילות של אינדוקציה demyelination קליפת המוח תת-צינור על ידי חיסון MOG תת קליני הזרקת ציטוקינים תוך-עכבישיים או תת-עכבישיים. משך הזמן המדווח של demyelination היה, עם זאת, קצר מדי- remyelination מלא התרחש בתוך 14 ימים או פחות, ובכך להגביל את החלון עבור כל בדיקת התערבות פרמקולוגית. שני המודלים, יתר על כן, משתמשים במודוס הזרקה טראומטי, אשר כשלעצמו יכול לגרום טראומת הזרקה ומחסום דם - מוח התמוטטות (BBB) ובכך להוביל לגיוס בלתי מבוקר של תאים דלקתיים לתוך parenchyma. שני המחקרים, יתר על כן, הדגימו demyelination כי הוא מוגבל לאזור מוגבל, בקליפת המוח ipsilateral, או בקרבת האתר של הזרקת ציטוקינים.
כדי להתגבר על מגבלות אלה, שתלנו קטטר בקליפת המוח הקודקודית הימנית של חולדות DA, עם קצה הצנתר הממוקם ממש מעל הקורפוס קאלוסום. כדי לאפשר החלמה מלאה של שלמות BBB, בעלי החיים הורשו תקופת מנוחה של שבועיים לאחר השתלת הצנתר. לאחר מכן, החולדות היו מחוסנות תת קלינית עם 5 מיקרוגרם של MOG רקומביננטי1-125 ב- IFA. בעקבות השגת טיטר נוגדן אנטי-MOG יציב לאחר כ -4 שבועות, 2 μL של תערובת ציטוקינים הוזרק דרך הצנתר בתוך 10 דקות באמצעות משאבת מזרק לתכנות. הליך זה עורר demyelination קליפת המוח הנרחבת של IPSI - ואת האונה המוחית contralateral ב 15 ימים, עם remyelination חלקי סביב 30 ימים לאחר הזרקת ציטוקינים43. שלבי demyelination מרובים יכול, יתר על כן, להיגרם על ידי ניהול חוזר ונשנה של ציטוקינים פרו דלקתיים דרך הקטטר, ניוון המוח העולמי, תכונה נפוצה של תת סוגים מתקדמים MS45, יכול להיות מושרה כבר לאחר שלב demyelination השני43. חשוב לציין, הקטטר המושתל יכול לשמש גם לבדיקת התערבויות פרמקולוגיות.
הפרוטוקול המתואר להלן מספק הסבר מפורט על הצעדים הניסיוניים לדור רבייה של דמיאלינציה קליפתית נרחבת בשתי ההמיספרות המוחיות של חולדות DA באמצעות קטטר תוך-מוחי.
Protocol
כל השיטות המתוארות כאן אושרו על ידי הרשויות המקומיות (Bundesministerium für Wissenschaft und Forschung (משרד המדע והמחקר האוסטרי); מספר רישיון: 66.010/0132-WF/V/3b/2014). חולדות DA זכר מבוגר (10 - 12 שבועות של גיל) שוכנו במחזור 12/12 שעות אור / כהה עם גישה חופשית למזון ומים.
1. הכנה חומרית
הערה: הניתוח מתבצע בתנאים אספטיים. לפני ההתחלה, ודא כי כל המכשירים הכירורגיים כולל המקדחות מנוקים עם חומר חיטוי מתאים.
- הכן תערובת הרדמה: 0.02 מ"ג / מ"ל של פנטניל, 0.4 מ"ג / מ"ל של midazolam, ו 0.2 מ"ג / מ"ל של מדטומידין (ריכוזים סופיים בתערובת).
הערה: עיין בסעיף הדיון המתאים לקבלת הרדמה חלופית. - הכן תערובת נוגדנים: 0.07 מ"ג / מ"ל של פלומזניל ו 0.42 מ"ג / מ"ל של atipamezole (ריכוזים סופיים בתערובת).
- להרכיב את הצנתר ואת כובע הקטטר עם המפרצון ואת הבורג. חותכים את הקטטר לאורך של 2 מ"מ עם אזמל(איור 1).
הערה: אין להשתמש במספריים עבור זה, שכן הם לסחוט ומעוות את הצורה החתך המעגלי של קצה הקטטר.
2. הכנה כירורגית
- מרדים את החולדה על ידי ניהול תוך-פריתוניאלי (i.p.) של תערובת ההרדמה (1.5 מ"ל / קילוגרם של משקל גוף).
- לגלח את הראש של החולדה בין האוזניים באמצעות מכונת הגילוח החשמלית. מניחים שמיכה הומיאותרמית על המסגרת הסטריאו-טסטרואקטיבית לפני מיקום החיה, כדי למנוע היפותרמיה לאורך כל הניתוח.
- לשתק את ראש החולדה במסגרת הסטריאו-טקית באמצעות מוטות האוזניים וצלחת הנשיכה, מה שמבטיח שהראש אופקי ויציב. בדוק את היציבות על ידי הפעלת לחץ על הגולגולת עם אצבע או מלקחיים.
הערה: קיבוע רופף ומיצוב לא אופקי במסגרת הסטריאוטקטית עלולים לגרום לחריגה מהקואורדינטות המיועדות. - יש למרוח טיפות עיניים משמנות כדי למנוע יובש בקרנית במהלך הניתוח. לכסות את העיניים עם חומר אטום כדי למנוע כל חשיפה לאור כירורגי.
- נקה את האזור המגולח על ידי לסירוגין היישום של 70% אתנול ו 10% קומפלקס פוידון-יוד.
הערה: בצע את כל אמצעי הזהירות במהלך הניתוח כדי למנוע זיהום. הניתוח מתבצע בתנאים אספטיים. אם אספסיס שבור, אז החומר המזוהם צריך להיות מוחלף.
3. השתלת קטטר
- לעשות קיסם אורך של כ 2 ס"מ של אורך באמצע העור הראש. השתמש מלחציים בולדוג להחזיק את העור בצדדים. לקבלת סקירה כללית של שלבים אלה, ראו איור 2.
- הסר את הדם באמצעות אפליקטור כותנה.
- הסר את פריוסטיום הגולגולת. נקו את הרקמה עם אפליקטור קצה הכותנה וחשפו את עצם הגולגולת. אפשר לגולגולת להתייבש במשך כ 1 דקות.
- זהה את ציוני הדרך האנטומיים, למבדה, ברגמה והתפירה המודילית. כאשר המקדחה מותקנת על המסגרת הסטריאו-טסטרואטקטית, מקם את קצה המקדחה בברזמה כנקודת ההתחלה. מעבירים 2 מ"מ אחורי מהברזמה ומעבירים כ-2.4 מ"מ לרוחב לתבל המהודל.
- לקדוח חור בקוטר 0.5 מ"מ עבור הקטטר במצב זה. בעדינות לנפח כל אבק עצם.
הערה: חשוב כי dura mater נשאר שלם במהלך הקידוח. כדי להבטיח זאת, 1) השתמש במקדחה שניתן להתקין במסגרת הסטריאוטקטית, 2) בדוק את החור לעתים קרובות במהלך הקידוח, ו -3) להסתעף במדרגות קטנות - אם מופעל לחץ רב מדי על הגולגולת, קצה המקדחה ימשיך לתוך, ויפגע במוח כאשר הגולגולת חודרת במלואה. - מקדחה 3 חורים נוספים (קוטר של כ-1.3 מ"מ) עבור ברגי העוגן במרחק של כמה מילימטרים מהחור הראשון. לפוצץ בעדינות אבק עצם משם.
הערה: בחר מיקומי בורג עוגן המספקים מספיק מקום לראש הקטטר (קוטר של ~ 2 מ"מ) וצמרות בורג העוגן (~ 1 מ"מ). - הסר את אבק העצם על ידי השקיה עם סביב 1 - 2 מ"ל של תמיסת מלח סטרילית חוצץ פוספט (PBS) או מלוחים פיזיולוגיים באמצעות מזרק. תנקה את הגולגולת. הדקו את ברגי העוגן ב-2-3 סיבובים מלאים.
הערה: ברגי העוגן נחוצים כדי לייצב את ההקמה על ידי החזקת המלט הדנטלי, ובכך, את הקטטר, במקום. תוך הידוק בורג עוגן, ודא כי הוא לא ניתן להסרה בקלות על ידי הרמה בעדינות כלפי מעלה עם מלקחיים. מכיוון שהשתלת הצנתר עצמו גורמת לטראומה ברקמות, פגיעה נוספת של דורה במהלך הקידוח, או הידוק ברגי העוגן יובילו לפציעות טראומטיות מרובות, ואולי יפגעו בהשוואה בתוך קבוצה. הדקו תחילה את ברגי העוגן והכניסו את הקטטר אחרון. - הכנס את הצנתר באורך 2 מ"מ דרך החור הראשון, מאונך אל פני הגולגולת. בעוד עדיין מחזיק את הקטטר, להחיל קצת מלט דנטלי ולתת לו פילמור עם חשיפה קצרה (~ 5 s) לאור ריפוי השיניים כדי לייצב את הקטטר, המאפשר את השימוש בשתי הידיים בשלב הבא.
אזהרה: בעת עבודה עם אור ריפוי שיניים, הימנע מלהסתכל ישירות על הקצה, או על האור משתקף מאזור היישום, כמו העוצמה הגבוהה של אור זה יכול לגרום נזק ברשתית. השתמש במשקפי מגן מתאימים. - יש למרוח יותר מלט דנטלי סביב הצנתר, לעגן את הברגים ולחזק את הבטון הדנטלי עם אור ריפוי השיניים (~15 - 30). אשר את התקשות המלט עם קצה של מלקחיים.
4. סגירת הפצע ואנטגוניזציה של הרדמה
- סוגרים את עור הראש עם תפרים הניתנים למיחזור, הקדמי והאחוריים לקטטר.
הערה: מכיוון שתהיה הגדרת מהמורות מעל הגולגולת בסוף ההשתלה, בצע את סגירת הפצע בהתאם. הרמת העור יותר מדי תגרום לאי נוחות עבור החיה. - הזריקו את תערובת הנוגדן באופן תת עורי (1.5 מ"ל/ק"ג משקל גוף) באמצעות מזרק 1 מ"ל עם מחט 26 G.
- יש לתת enrofloxacin (2.5%) על ידי הזרקה תת עורית (7.5 מ"ג/ק"ג משקל גוף) לטיפול אנטיביוטי מניעתי. יש לנהל את carprofen (1 מ"ג/מ"ל; 5 מ"ג/ק"ג משקל גוף) ובופרנורפין (1.2 מ"ג/ק"ג) לשיכוך כאבים על ידי הזרקה תת עורית.
5. טיפול ותרופות לאחר ניתוח
- להחזיר את החיה לכלוב שונה ולשמור אותו תחת השגחה במשך 1 - 3 שעות, עם יישום של אור אינפרא אדום כדי למנוע היפותרמיה. כל הזמן להתבונן ולמקם מחדש את החיה כל 5 עד 10 דקות עד התאוששות לאחר הניתוח. יש לה מקפיד להימנע מחשיפה מתמדת לאור לעיניים עד להחלמה.
- חזור על enrofloxacin (7.5 מ"ג/ק"ג משקל גוף) ו carprofen (1 מ"ג / מ"ל; 5 מ"ג / קילוגרם משקל גוף) ממשלים על ידי זריקות תת עוריות יום לאחר הניתוח. Buprenorphine אין צורך לרענן כמו הטיפול הקודם יעיל במשך 72 שעות.
6. הכנת תערובת חיסונים (לכל המוקדם 14 ימים לאחר השתלת הצנתר)
הערה: מניחים את המזרקים על קרח במהלך הליך ההכנה.
- חבר שני מזרקי זכוכית קצה מנעול Luer 10 מ"ל לזרועות קצרות של stopcock 3 כיווני ולסגור את השקע השלישי עם הזרוע הארוכה.
- ודא שהחיבורים מאובטחים וללא דליפות: הוסיפו כ-4 מ"ל של PBS סטרילי למזרק הפתוח תוך החזקת בוכנה 2. הכנס בוכנה 1 ולדחוף את שתי הבוכנות קדימה ואחורה תוך כדי בדיקת דליפה. אם לא מתרחשת דליפה, יש להשליך את ה-PBS ולהסיר שוב את הבוכנה 1.
- Pipette 1 מ"ל של IFA ו 50 מיקרוגרם של rMOG1-125 יחד ולהתאים את התערובת לנפח סופי של 2 מ"ל עם PBS סטרילי (pH 7.4) בצינור מתאים.
הערה: עקב אובדן אמולסיה על טיפים או קירות של מזרקים במהלך ההכנה, להכין נפח גדול יותר מאשר מיועד לממשל. זה גם מעשי יותר להתכונן ליותר מבעל חיים אחד בבת אחת. - מניחים את תערובת IFA וrMOG 1-125 מדוללת במזרק הפתוח. הכנס את הבוכנה בעדינות תוך שמירה על לחץ רופף על הבוכנה הנגדית (איור 3A).
- תחליב את האינוקולום על ידי הנעתו ממזרק אחד לשני על ידי דחיפת הבוכנות קדימה ואחורה, עד שהוא לבן וצמיג(איור 3B).
- תקן מזרק מנעול Luer בגודל 1 מ"ל לזרוע הקצרה הפתוחה של העצירה ה-3-כיוונית ומלא אותו באינוקום(איור 3C). יש להפיץ את כל המזרקים ל-1 מ"ל. שמור אותו על קרח עד הזריקה. לנהל את התערובת ביום ההכנה.
7. חיסון
- להרדים את החולדה עם איזופלואורן בתא (~ 2 דקות, מעורבב עם חמצן 2 L / min) ולאחר מכן לשמור על הרדמה באמצעות מסכה (מעורבב עם חמצן 1.5 L / min).
- הזרק 200 μL של inoculum תת עורית בבסיס הזנב באמצעות מחט 21 G.
הערה: לנהל את הזריקה לאט כמו הפתרון הוא צמיג.
8. קביעת טיטרים נוגדנים
- לסגת ~ 200 μL של דם 4 שבועות לאחר החיסון על מנת לקבוע את titers נוגדנים נגד MOG.
- מצפים את הבארות של צלחת 96-באר עם MOG (5 מיקרוגרם / מ"ל ב PBS) ודגור אותם במשך 1 שעה ב 37 °C (5 °F).
- לחסום את הצלחת עם 1% אלבומין סרום בקר (BSA) ב PBS במשך 1 שעה בטמפרטורת החדר.
- לדגור על הצלחת עם סרום חולדה (1:50) ולתקן אותו במשך 2 שעות ב 37 °C (50 °F). לשטוף את הצלחת 3x עם 200 μL של PBS / Polysorbate 20.
- לדגור את הצלחת עם חזרת peroxidase מצומד נגד חולדה נוגדן משני IgG (1:10,000). לשטוף את הצלחת 3x עם 200 μL של PBS / Polysorbate 20.
- הוסף 100 μL של פתרון מצע peroxidase לכל באר ודגרה זה במשך 20 - 30 דקות בחושך בטמפרטורת החדר.
- מדוד את הצפיפות האופטית אורך גל של 405 ננומטר וחשב את טיטר הנוגדנים מהצפיפות האופטית באמצעות עקומה סטנדרטית.
9. הזרקת ציטוקינים תוך-מוחיים
- כוונן את אורך הצינורית המחבר (2 מ"מ). (ראו איור 4 לקבלת שלבי ההכנה).)
- מלא מזרק 1 מ"ל עם תערובת ציטוקינים (500 ננוגרם / μL של TNF-אלפא, 300 U / μL של חולדה רקומביננטית IFN-גמא PBS סטרילי). חבר את המזרק ל צינורית מחבר. ממלאים את הצינורית בתערובת הציטוקינים. הימנע מבועות.
- הר את המזרק על משאבת המזרק הניתן לתכנות ותכנת אותו להזרקה של 0.2 μL/min (איור 5A). התחל את המשאבה ולשמור אותו עובד על מנת למנוע היווצרות בועת אוויר בקצה הצינורית.
הערה: מהירות ההזרקה חייבת לקחת בחשבון את הקוטר הפנימי של המזרק הספציפי המשמש; ובכך, קוטר המזרק צריך להיות רשום במהלך המשאבה להגדיר. - להרדים את החולדה עם איזופלוראן בתא (~ 2 דקות, מעורבב עם 2 L / min של חמצן) ולאחר מכן לשמור על ההרדמה באמצעות מסכה (מעורבב עם 1.5 ליטר / דקה של חמצן)(איורים 5B ו 5C). החל טיפות עיניים סיכה כמו החיה תהיה מרדים לפחות 30 דקות.
- הסר את מכסה הקטטר עם המפרצון. הכנס את צינורית המחבר לתוך הקטטר ובורג והידוק אותו (איורים 5D ו 5E).
הערה: לא להגזים אותו, כמו זה יהרוס את הקצה העליון של הקטטר. - אפשר את הזריקה להמשיך במשך 10 דקות (הנפח הכולל של הזרקה להיות 2 μL). תעצור את המשאבה. השאירו את הצינורית בתוך הקטטר במשך 20 דקות כדי לאפשר את הנפח המוזרק לפזר באופן מלא.
- פתח את הצינורית של המחבר והסר אותה לאט כדי למנוע אפקט ואקום.
- לחבר מחדש את מכסה הקטטר עם המפרצון ולברג אותו. אפשר לחיה להתאושש מההרדמה בכלוב.
תוצאות
ניתן להעריך דמיאלינציה קליפתית בנקודות זמן שונות לאחר הזרקת ציטוקינים על ידי אימונוהיסטוכימיה לחלבון פרוטאוליפיד (PLP) (איור 6). איור 6A מראה חיסון PLP שלם ביום ה-15 בחית בקרה מחוסנת MOG שקיבלה PBS סטרילי בלבד דרך הצנתר המושתל. ביום הראשון לאחר הזרקת הציטוקינים, ניתן היה להבחין בדמיאלינציה בבעלי חיים בעלי ראש MOG, אם כי רק בסביבה הקרובה של האזור הצנתור(איור 6B). החיסון PLP נשאר שלם בקליפת המוח הנגדית 1-יום לאחר הזרקת ציטוקינים. ביום 3, ניתן היה לראות עלייה הדרגתית באובדן החיסון PLP, המתפשט בקליפת המוח האיסיליטרלית (איור 6C). ניתן היה לזהות דה-מיאלינציה קליפתית Contralateral גם ביום 3 (איור 6D),אך היא מוגבלת למדי לאזור שמתחת לברגי העוגן, אולי בשל אזור זרימה נמוך של נוזל ביניים הנגרם על ידי ברגי העוגן43. היעדר תצפית דומה בחיות הבקרה שהוזרקו ל-PBS אינו כולל את האפשרות של דמיאלינציה הנגרמת מטראומה הנובעת מבורג העוגן.
בין ימים 9 - 15, demyelination משפיע על חלקים גדולים של קליפת המוח של שתי ההמיספרות (איורים 6E, 6F, ו 6G). זה עולה בקנה אחד עם התבוננות של התנהגות איטית, אם כי ללא ירידה משמעותית סטטיסטית בכישורים המוטוריים במבחן רוטארוד43. demyelination קליפת המוח הוא מתמשכת עד 30 ימים לאחר הזרקת ציטוקינים בשתי ההמיספרות (איורים 6H ו 6I) עם remyelination חלקי בלבד. איור 6J מראה כימות של אובדן PLP בחומר האפור הקליפתי לאחר הזרקת ציטוקינים תוך-מוחיים. יש לציין כי חיסון PLP עדיין לא הוערך לאחר תקופות ארוכות יותר מ 30 ימים; ובכך, ההחלטה המיידית של remyelination, אם יש, נותר להעריך על ידי ניסויים נוספים. ממשל שני של תערובת ציטוקינים דרך הצנתר המושתל 30 יום לאחר ההזרקה הראשונה גורם ניוון מוחי מסומן ביום 15 (איור 7).

איור 1:הכנת הצנתר. (A ו- B)צינורית המדריך והמנולה הבובה (כובע צנתר עם מפרצון) מורכבים ומוברגים. (C)לאחר מכן הקטטר נחתך לגודל של 2 מ"מ בעזרת אזמל. התצפית המיקרוסקופית הראתה כי השימוש במספריים למטרה זו מעוות את הצורה המעגלית של קצה הצינורית, ובכך יש להימנע. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
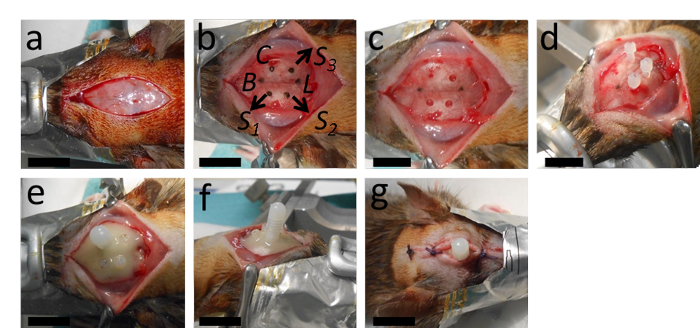
איור 2: השתלת הצנתר. (א)הניתוח מתחיל בחתירה אורכית והסרת פריוסטיום. (B, ג) פאנל זה מציג את סימון המקום עבור הקטטר ב 2 מ"מ אחורי ברגמה ו 2.4 מ"מ לרוחב מימין מן התפר קשת; כמו גם את המקומות עבור החורים המיועדים לשלושת ברגי העוגן עם מרחק מתאים מן הקטטר למבדה. (D)לאחר קידוח חור הקטטר (קוטר 0.5 מ"מ, עם קצה מקדחה עגול) ואת החורים עבור ברגי העוגן (1.3 מ"מ קוטר עם קצה מקדחה מפותל), ברגי העוגן מתהדקים. (ה, ו) לאחר מכן הקטטר מוכנס וכל ההתקנה מיוצבת עם פילמור מלט דנטלי. הפצעתפור עם שניים או שלושה קשרים הקדמיים והאחוריים של הצנתר. B = ברגמה; L = למדה; C = קטטר; S1, S2 ו- S3 = מקומות עבור החורים עבור שלושת ברגי העוגן. סרגלי קנה המידה = 1 ס"מ. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
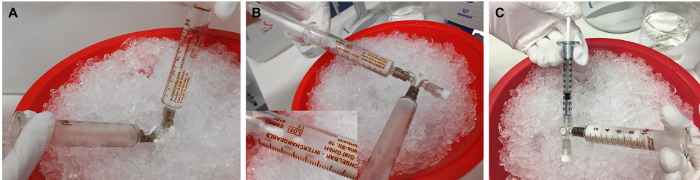
איור 3: הכנת אמולסיה rMOG /IFA. (A)התערובת של rMOG, PBS ו- IFA מתחלפת על ידי לחיצה על האינוקולום ממזרק אחד למשנהו על ידי דחיפת הבוכנות הלוך ושוב, (B) עד שהוא לבן וצמיג. (C)לאחר מכן, אינוקולום מופץ למזרקים 1 מ"ל עבור ההזרקה. 5 מיקרוגרם של rMOG משמש 200 μL של תערובת PBS / IFA כדי sub מבחינה קלינית לחסן חולדה אחת; עם זאת, בשל ההפסדים בקצות והקירות של המזרקים במהלך ההכנה, יש להכין נפח גדול יותר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: הכנת צינורית המחבר. (A - D)לוחות אלה מראים כיצד מחבר ומחבר פנימי מורכבים עם צינורית מדריך תבנית בגודל 2 מ"מ. (E)הפנימי נחתך לאותו גודל כמו צינורית המדריך בעזרת אזמל (F) ומדריך התבנית אינו נפתח לאחר מכן. (G)הקצה השני של הצינורית המחבר קבוע מזרק 1 מ"ל, אשר מכיל את תערובת ההזרקה, עם מחט 20 G. סרגלי קנה המידה = 3 ס"מ. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: הזרקה תוך-מוחית. (A) משאבת מזרק ניתנת לתכנות מותאמת למהירות הזרקה של 2 μL/min, והמזרק בגודל 1 מ"ל מלא בתערובת ציטוקינים (או PBS סטרילי עבור הפקדים) מותקן על המשאבה. (B)החיה מורדמת תחילה בתא באמצעות 5% איזופלוראן עם זרימת חמצן של 2 ליטר / דקה ולאחר מכן (C) ההרדמה מתקיימת דרך המסכה באמצעות 2.5% איזופלוראן עם זרימת חמצן של 1.5 ליטר לדקה. (D)מכסה הצנתר עם הכניסה (צינורית הדמה) מוברגת ונקניקת ההזרקה מוכנסת דרך הצנתר המושתל. מאז נפח הזריקה הוא קטן מאוד, החוקר צריך להיות זהיר כדי למנוע בועות אוויר בקצה הצינורית. מסיבה זו, חשוב להתחיל את ההחדרה בזמן המשאבה פועלת ורק כאשר יש בועה נוזלית גדלה בקצה. הנפח הנוסף לא ייכנס למוח בכל מקרה, כפי שהוא מתפרק על גבי הקטטר לפני הכניסה. (E)לאחר מכן הצינורית המחבר הוא התהדק, ואת המשאבה הוא מאפשר לפעול במשך 10 דקות. לאחר 10 דקות של הזרקה, המשאבה נעצרת, ואת הצינורית נשאר בפנים במשך 15 - 20 דקות כדי לאפשר את דיפוזיה של נפח מוזרק לנוזל interstitial. מוטות קנה המידה = 5 ס"מ, אלא אם צוין אחרת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
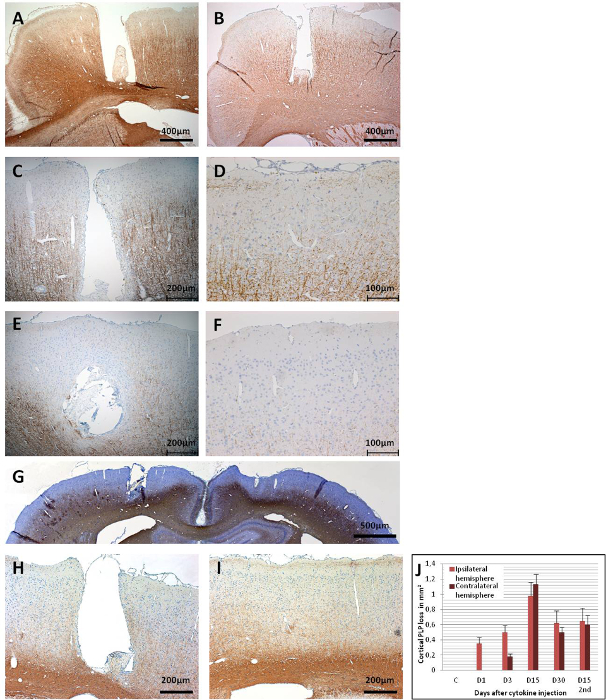
איור 6: חיסון PLP במקטעי מוח קורונלי. (A) פאנל זה מציג מוח בקרה (MOG-primed) עם הזרקת PBS (יום 15), אשר אינו גורם demyelination קליפת המוח. (B)כבר ביום הראשון לאחר הזרקת ציטוקינים, demyelination ניכר באזור הצנתר. (C)אובדן רחב יותר של חיסוניות PLP נצפה בקליפת המוח ipsilateral ביום 3, (D) כמו גם בצד הנגדי. אובדן נרחב של חיסוניות PLP נצפה בשתי ההמיספרות ביום 15, כמו (E) פאנל זה מראה את קליפת המוח ipsilateral ו -( F) פאנל זה מראה את קליפת המוח הנגדית. (ז)סקירה כללית של שתי ההמיספרות ניתנת בהצגת האובדן הנרחב של PLP ביום ה - 15. ביום 30, כמו (H) פאנל זה מראה את קליפת המוח ipsilateral ו (אני) פאנל זה מראה עבור קליפת המוח contralateral, עדיין יש demyelination מדהים, אבל גם כמה אזורים remyelinated ניתן היה לראות. (J)פאנל זה מציג את הכימות של demyelination (אובדן PLP ב מ"מ2/ חצי כדור). 1.5 - 2 μm מקטעי מוח כוראלי שימשו לגילוי PLP עם MS anti-PLP עם גורם דילול של 1:500. החלקים היו מוכתמים בהמטוקסילין עבור גרעיני תאים. למידע מפורט על האימונוהיסטוכימיה, ראה Ucal et al. 43. פאנל G ו- J שונו מ Ucal ואח '. 43. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
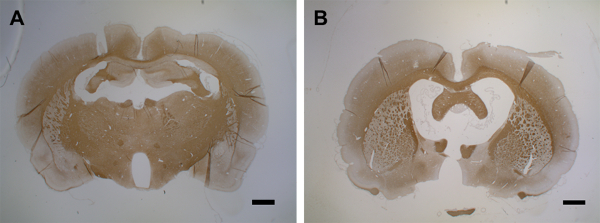
איור 7: ניוון המוח לאחר הזרקת ציטוקינים שנייה. (A)פאנל זה מציג מוח בקרה (MOG-primed) עם הזרקת PBS (יום 15). (B)ביום 15 לאחר הזרקת הציטוקינים הראשונה, זריקה שנייה מובילה להתנוונות המוח תוך 15 יום. 1.5 - 2 μm מקטעי מוח כוראלי שימשו לגילוי PLP עם MS anti-PLP עם גורם דילול של 1:500. החלקים היו מוכתמים בהמטוקסילין עבור גרעיני תאים. למידע מפורט על אימונוהיסטוכימיה, ראו בלקמור37. סרגלי קנה המידה = 500 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 8: כלובים מותאמים למניעת הסרת קטטר על ידי החיה. בכלובים הסטנדרטיים, שטח מחזיק המזון ברשת ממוקם קרוב יותר לתחתית הכלוב, ויוצר מרחב צר ומסוכן המגדיל את הסיכוי של הצנתר להסתבך עם הרשת, ובכך, הסרתו. כדי למנוע זאת, יש לשנות את הכלוב. חלל צר זה נחסם במישור שקוף, המאפשר את קיום החיה. האוכל צריך להינתן בתוך הכלוב בכלובים המותאמים האלה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
השיטה שלנו משתמשת בחולדות DA. ההסתגלות לעכברים תדרוש ככל הנראה שימוש בקטטר וברגים קטנים יותר. כמו כן יש לזכור כי קורס המחלה, התגובה הדלקתית, ואת היקף demyelination עשוי להיות שונה ממה שמוצג כאן אם נעשה שימוש מינים / זן אחר. הבדלים כאלה נצפו עם מודלים קלאסיים EAE באמצעות זנים שונים של עכברים. MOG92-106 ממוצא חולדה, למשל, הביא EAE פרוגרסיבי או משני ראשוני בעכברים A.SW, בעוד זה גרם הישנות-העברת EAE בעכברים SJL / J46. בעלי חיים מאותו זן צריך, אם כן, לשמש. הבדלים מגדריים בביטוי EAE דווחו גם במחקרים קודמים שונים24. המופע של השפעות מגדריות כאלה עשוי בהחלט להיות צפוי עבור הפרוטוקול המתואר כאן עדיין נשאר להיות מאומת בניסויים נוספים.
ניהול תוך-פריטיטונאלי (IP) של תערובת הרדמה הכוללת 0.02 מ"ג/מ"ל של פנטניל, 0.4 מ"ג/מ"ל של מידזולם, ו-0.2 מ"ג/מ"ל של מדטומינדין משמש להתערבות כירורגית. חולדות DA זכר מבוגר במשקל 270 - 300 גרם דורשות סביב 0.4 - 0.6 מ"ל של תערובת זו(כלומר,~ 1.5 מ"ל / קילוגרם) כדי לגרום להרדמה שנמשכת 60 - 90 דקות. לאחר הניתוח, ההרדמה היא אנטגוניזציה על ידי הזרקה תת עורית של תרופה הכוללת 0.07 מ"ג / מ"ל של flumazenil ו 0.42 מ"ג / מ"ל של atipamezole מלוחים פיזיולוגיים (0.9% NaCl). מנה של 1 - 1.5 מ"ל / קילוגרם מרגיז את ההרדמה בתוך 5 דקות. לחלופין, ניתן לאפשר לבעלי החיים להתעורר באופן ספונטני על שטיפה פיזיולוגית מתוך ההרדמה, אך במקרה זה, יש לשמור על בעלי החיים תחת השגחה עד שהם בהכרה מלאה.
אפשרויות הרדמה אחרות המשמשות לעתים קרובות לניתוחים בבעלי חיים, כגון הזרקת IP של קטמין וקסילאצין47 או נתרן פנטוברביטל48, או שאיפה של הרדמה נדיפה כמו איזופלואורן49 והלוטאן50, ניתן לשקול גם עבור הניתוח המוצג כאן. עם זאת, חשוב לבחור בסוכן הרדמה שאינו מפריע להתערבות הזרם המיועדת.
במהלך החיסון והזרקת ציטוקינים תוך-מוחיים, 5% איזופלוראן משמש להרדמה. המודל המתואר כאן הוקם באמצעות חולדות, והפרטים הניסיוניים המפורטים הם, אם כן, חלים במיוחד על החולדה. קואורדינטות השתלת הצנתר נבחרו כדי לאפשר ניתוח סימולטני של שינויים אפשריים בחומר הלבן (קצה הקטטר בקורפוס קלוסום). בעוד אתר החדרת הצנתר יכול להיות מגוון ביחס למיקום anteroposterior ו לרוחב, הבחירה של סולקוס מרכזי דורש הימנעות של נזק לסינוס קשת מעולה.
מאפיין נוסף של השיטה המתוארת הוא demyelination שווה ערך של isi - ו contralateral hemispheres, אולי כתוצאה מההובלה של תערובת ציטוקינים מוזרק לחלל subarachnoid על ידי הזרימה הפיזיולוגית של הנוזל interstitial מאזורים קליפת המוח51. מצב ההזרקה, ולא המיקום של הקטטר, ולכן, גורם demyelination בכל קליפת המוח, ואת הבחירה של קליפת המוח הימנית או השמאלית צריך, ולכן, להיות לא מהותי בהקשר זה.
הפרוטוקול משתמש צנתר 26 G, שהוא קטן מספיק כדי למנוע פגיעה טראומטית נרחבת וגדול מספיק כדי למנוע קצב מוגבר של סתימה של קצה הקטטר במהלך הארוך של הניסוי. אין ספק שההשתלה ונוכחות הקטטר עצמו גורמות להפעלה אסטרוציטית ומיקרו-גליאלית, גם בחיות הבקרה המקבלות רק את השתלת הצנתר; עם זאת, זה מינורי בהשוואה לבעלי החיים מוזרק ציטוקינים. 43 כדי למנוע כל הפרעה עם ניתוחים הבאים, השתמשנו צנתרים תואמי MRI עשויים פולי-אתר-אתר-קטון (PEEK).
עומק דומה של דמיאלינציה נוצר, למעשה, הן באזורים IPSI- והן באזורים מנוגדים עם השיטה המוצגת. משמעות הדבר היא כי עומק / אורך קטטר לא יכול לשחק תפקיד מרכזי בתבנית ובהיקף של demyelination בקליפת המוח. לכן, שינוי של אורך הצנתר עשוי להיחשב על מנת להפחית את גודל הנגע הנגרמת על ידי קטטר. עם זאת, אורך קטטר קצר משמעותית עלול לגרום לדמלינציה קליפתית מעט פחות בולטת, בעוד שתשובה חד משמעית תתקבל רק על ידי ניסויים שנערכו במיוחד לאורך הצנתר.
אחד היתרונות של המודל הוא כי הצנתר המושתל מאפשר בדיקה של טיפולים פוטנציאליים מנוהלים לקליפת המוח באמצעות הקטטר כדי לאפשר remyelination ב או אחרי השיא של demyelination קליפת המוח היסטולוגית (יום 15 ואילך), בעוד בסביבה טרום טיפול זה יהיה לאחר החיסון אבל לפני הזרקת ציטוקינים. ההחלטה על מסגרת הזמן שבה יינתן הטיפולים, אם כן, תהיה תלויה בשאלת המחקר הספציפית ובתרופה המעניינת.
לאחר השתלת הצנתר, חשוב לשכן בעלי חיים בודדים בכלובים המותאמים (רצוי גבוהים) על מנת למנוע הסרת צנתר עד סוף המחקר(איור 8). בעלי חיים עשויים גם לפתוח את מכסה הצנתר עם המפרצון, אם כי זה קורה לעתים רחוקות. יש לצפות בבעלי החיים מדי יום ולהסיר כובעים עם אלה טריים, כדי למנוע חסימת קצה קטטר בהיעדר מפרצון, כדי להבטיח משלוח מדויק לתוך parenchyma לאחר הזרקה תוך מוחית. בעלי החיים מחוסנים לכל המוקדם שבועיים לאחר השתלת הצנתר כדי לאפשר ריפוי וסגירה של מחסום הדם - מוח.
סרום נגד MOG נוגדנים titers צריך להימדד לאחר החיסון. ניסוי תגובת מינון הראה כי 5 מיקרוגרם של MOG1-125 (ב IFA) סיפק חיסון מספיק בתוך 4 שבועות בחולדות DA זכר מבוגר. titer של 5,000 מיקרוגרם / מ"ל ומעלה יהיה מספיק, אבל בהחלט יהיה תלוי במספר גורמים, כולל הכנת MOG ואת זן בעלי החיים, ולכן, יהיה צריך להיקבע בנפרד. חשוב להימנע מינוני אנטיגן גבוהים מדי פוטנציאל וכתוצאה מכך פנוטיפ EAE קלאסי עם גפיים אחוריות משותקות עוד לפני הזרקת ציטוקינים.
כל חיה מחוסנת ב-5 מיקרוגרם של אוליגודנדרוציט גליקופרוטאין (rMOG1-125)מחוסנת ב-200 מיקרוגרם של אדג'ובנט של פרוינד (IFA) לא שלם. מאז חלק אמולסיה הולך לאיבוד בתוך המזרק במהלך ההכנה, מומלץ להכין יותר מסכום זה עבור כל בעל חיים. השתמשנו ב- MOG רקומביננטי (1-125 מה- N-terminus של עכברוש MOG), אשר בא לידי ביטוי Escherichia coli ולאחר מכן טוהר הומוגניות על ידי כרומטוגרפיה כלאט, מומס ב 6 M אוריאה, ודיאליזה נגד PBS כדי לקבל הכנה פיזיולוגית52,53. MOG זמין מסחרית, עם זאת, עשוי לשמש גם.
תכשירי אנטיגן אחרים, כגון MOG1-116, MOG35-55 או PLP139-151 משמשים במודלים שונים של EAE, והבדלים בזן אנטיגן ובעלי חיים ידועים כמזינים פנוטיפים של מחלות שונות במודלים אלה20. תכשירי אנטיגן אלה לא נבדקו בחולדות DA, ואם נעשה שימוש בהעדפה rMOG1-125, עלול לגרום פנוטיפ מחלה או תוצאות היסתולוגיות שונה ממה שמוצג כאן.
צינורית מחבר באותו אורך כמו הקטטר מוכן לפני הזרקה תוך מוחית. ניתן לעשות זאת על ידי הרכבתו עם צנתר תבנית וחיתוך אותו לאותו גודל (באורך 2 מ"מ)(איור 4). חשוב כי הצינורית המחבר להיות ללא בועה אוויר במהלך הזרקת ציטוקינים - כי נפח ההזרקה הוא רק 2 μL, אפילו בועת אוויר זעירה בקצה הצינורית יפחית באופן משמעותי את נפח הנוזל המועבר בהצלחה לתוך המוח. זה מושגת על ידי שמירה על המשאבה פועלת והכנסת הצינורית רק כאשר טיפה גדלה של נוזל הזרקה נוכח בקצה. לאחר החדרת הצינורית, המחבר מוברג לקטטר תוך הימנעות overtightening כדי לא לפגוע בקצה העליון של הקטטר, אשר יקשה על סיכום לאחר הזריקה. מהירות הזרקה של 0.2 μL/ min משמשת כדי למנוע טראומה הנגרמת על ידי הזרקה. יתר על כן, זריקה איטית, בשילוב עם תקופת המתנה של 20 דקות לאחר ההזרקה, מבטיחה את דיפוזיית הנוזל המוזרק לתוך הנוזל interstitial וניקוז יעיל לתוך CSF. הצינורית מוסרת לאט כדי למנוע אפקט ואקום.
השיטה המדווחת כוללת התערבות כירורגית, ולכן דורשת צוות מסוגל לבצע ניתוח הישרדות סטריאוטקטי. אנשי צוות במגע ישיר עם בעלי החיים היו צריכים לקחת את קורסי הניסויים בבעלי חיים המתאימים. שאר הפרוטוקול יכול להתבצע על ידי חברי מעבדה מוסמכים.
השיטה נועדה לייצר demyelination מופעל דלקת של קליפת המוח ואינו לשחזר את כל התכונות של MS אנושי (למשל,התרחשות של נגעים חומר לבן דלקתי מוקד, המהווה סימן היכר של MS אנושי).
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מבקשים להודות לכל אנשי המכון למחקר ביו-רפואי באוניברסיטה הרפואית גראץ על עזרתם ושיתוף הפעולה, כמו גם כריסטופר ג'ון רייטון על הגהת כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| Adult male Dark Agouti rats (300 ±25 g) | |||
| Fentanyl | Hameln pharma plus, Germany | as Fentanyl-Citrate, 50 µg/ml | |
| Midazolam | ERWO Pharma, Austria | 50039017 | 5 mg/ml |
| Medetomidin | Orion Pharma, Finland | as Medetomidin hydrochloride, 1mg/ml | |
| Flumazenil | Roche, Switzerland | 0.1 mg/ml | |
| Atipamezol | Orion Pharma, Finland | as Atipamezol hydrochloride, 5 mg/ml | |
| 10% povidone-iodine complex | Mundipharma, Austria | ||
| Dental cement | Heraeus Kulzer, Germany | 6603 7633 | |
| Physiological saline solution | Fresenius Kabi, Austria | 0.9% NaCl | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Germany | P3813 | |
| Isofluorane | AbbVie, Austria | ||
| Lubricating eye drops | Thea Pharma, Austria | ||
| 70% EtOH | Merck, Germany | 1070172511 | Absolute ethanol was diluted in ddH2O for preparation of 70% v/v |
| 2.5% enrofloxacin | Bayer, Germany | Prophylactic antibiotics | |
| carprofen | Pfizer, USA | Painkillers, 50 mg/ml | |
| Tween-20 | Sigma-Aldrich, Germany | P9416 | |
| Pentobarbital | Richter Pharma, Austria | pentobarbital sodium, 400 mg/ml | |
| Interferon gamma | PeproTech, USA | 400-20 | |
| Tumor necrosis factor alfa | R&D Systems, USA | 510-RT-050/CF | |
| rMOG1-125 | own product at the Centre of Molecular Medicine, Karolinska Institute, Sweden | Recombinant rat myelin oligodendrocyte glycoprotein, amino acids 1-125 from the N-terminus, also commercially available: AnaSpec, AS-55152-500, USA | |
| Anti-MOG antibody | Ana Spec/Kaneka Corporation, Japan | AS-555157 | Standard from ELISA-Kit; Ana Spec/Kaneka |
| Incomplete Freund’s adjuvant | Sigma-Aldrich, Germany | F5506 | |
| Horse radish peroxidase conjugated anti-rat IgG secondary antibody | Ana Spec/Kaneka Corporation, Japan | AS-555157 | Secondary Antibody from ELISA-Kit; Ana Spec/Kaneka Corporation |
| Bovine serum albumin | Sigma-Aldrich, Germany | A9576 | |
| Peroxidase substrate solution | Vector Laboratories, USA | SK-45000 | |
| Stereotactic frame | David Kopf Instruments, USA | ||
| Catheters, MRI suitable | PlasticsOne, USA | 8IC315GPKXXC | |
| Dummy cannulas | PlasticsOne, USA | 8IC315DCNSPC | |
| Plastic screws, MRI suitable | PlasticsOne, USA | 8L080X093N01 | |
| Connector cannula | PlasticsOne, USA | 8IC313CXSPCC | |
| Screw driver with 2mm tip-size | |||
| Drill with flexible shaft extension | Proxxon, Germany | NO 28 472, NO 28 706, NO 28 620, | |
| Drill bit, round, 0.5 mm | Hager & Meisinger, Germany | REF310 104 001 001 009 | |
| Drill bit, twisted, 1.3 mm | Hager & Meisinger, Germany | REF350 104 417 364 013 | |
| Scalpel | Braun, Germany | BB510 | |
| Scalpel handle | Fine Science Tools, Germany | 91003-12 | |
| Cotton tip applicator | Henry Schein Medical, Austria | 900-3155 | |
| Surgical scissors | Fine Science Tools, Germany | 14101-14, 14088-10 | |
| Surgical forceps | Fine Science Tools, Germany | 11002-12, 11251-35 | |
| Bulldog clamps | Fine Science Tools, Germany | 18050-35 | |
| Homoeothermic blanket | TSE systems, Germany | ||
| Infrared Lamp | Beurer, Germany | 616.51 | |
| Dental curing light | Guilin Woodpecker Medical, China | ||
| Absorbable suture | Johnson & Johnson, Belgium | V792E | |
| Programmable syringe pump | World Precision Instruments, USA | AL-1000 | |
| Exam gloves | |||
| Surgical gown | |||
| Electric Shaver | Aesculap, Germany | GT420 | |
| Volatile anesthetic vaporizer | Rothacher Medical, Switzerland | CV 30-301-D | |
| Oxygen source for volatile anesthetic vaporizer | Air Liquide, Austria | 19,113 | |
| Volatile anesthesia chamber | Rothacher Medical, Switzerland | PS-0347 | |
| Anesthesia mask for rats | Rothacher Medical, Switzerland | PS-0307-A | |
| 1 ml syringe | Codan, Denmark | REF 62.1612 | |
| 26 Gauge needle for injection | Braun, Germany | 4657683 | |
| 20 Gauge needle for cytokine injection and immunization | Braun, Germany | 4657519 | |
| Luer lock tip glass syringes | Poulten & Graf, Germany | 7.140-37 | |
| 3 way stopcock | Becton Dickinson, Sweden | 394600 | |
| 96-well plate | Thermo Fisher Scientific, USA | 442404 | |
| Plate reader | Cole-Parmer, USA | EW-1396-00 | |
| 37°C incubator | Kendro, Germany | 50042301 | |
| Micropipettes | Gilson, USA | F167350 |
References
- Berkovich, R. Treatment of acute relapses in multiple sclerosis. Neurotherapeutics. 10 (1), 97-105 (2013).
- Kalincik, T. Multiple Sclerosis Relapses: Epidemiology, Outcomes and Management. A Systematic Review. Neuroepidemiology. 44 (4), 199-214 (2015).
- Feinstein, A., Freeman, J., Lo, A. C. Treatment of progressive multiple sclerosis: what works, what does not, and what is needed. The Lancet Neurology. 14 (2), 194-207 (2015).
- Montalban, X., et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. The New England Journal of Medicine. 376 (3), 209-220 (2017).
- Dyment, D. A., Ebers, G. C., Sadovnick, A. D. Genetics of multiple sclerosis. The Lancet Neurology. 3 (2), 104-110 (2004).
- Ascherio, A. Environmental factors in multiple sclerosis. Expert Review of Neurotherapeutics. 13, 3-9 (2013).
- Allen, I. V., McQuaid, S., Mirakhur, M., Nevin, G. Pathological abnormalities in the normal-appearing white matter in multiple sclerosis. Neurological Sciences. 22 (2), 141-144 (2001).
- Kutzelnigg, A., et al. Cortical demyelination and diffuse white matter injury in multiple sclerosis. Brain. 128 (11), 2705-2712 (2005).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the Neurological Sciences. 233 (1-2), 55-59 (2005).
- Lucchinetti, C. F., et al. Inflammatory cortical demyelination in early multiple sclerosis. The New England Journal of Medicine. 365 (23), 2188-2197 (2011).
- Peterson, J. W., Bo, L., Mork, S., Chang, A., Trapp, B. D. Transected neurites, apoptotic neurons, and reduced inflammation in cortical multiple sclerosis lesions. Annals of Neurology. 50 (3), 389-400 (2001).
- Kutzelnigg, A., Lassmann, H. Cortical demyelination in multiple sclerosis: a substrate for cognitive deficits. Journal of the Neurological Sciences. 245 (1-2), 123-126 (2006).
- Procaccini, C., De Rosa, V., Pucino, V., Formisano, L., Matarese, G. Animal models of Multiple Sclerosis. European Journal of Pharmacology. 759, 182-191 (2015).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: a clinical and histopathological perspective. Brain Pathology. 27 (2), 123-137 (2017).
- Lebar, R., Lubetzki, C., Vincent, C., Lombrail, P., Boutry, J. M. The M2 autoantigen of central nervous system myelin, a glycoprotein present in oligodendrocyte membrane. Clinical and Experimental Immunology. 66 (2), 423-434 (1986).
- Linington, C., Bradl, M., Lassmann, H., Brunner, C., Vass, K. Augmentation of demyelination in rat acute allergic encephalomyelitis by circulating mouse monoclonal antibodies directed against a myelin/oligodendrocyte glycoprotein. The American Journal of Pathology. 130 (3), 443-454 (1988).
- Panitch, H., Ciccone, C. Induction of recurrent experimental allergic encephalomyelitis with myelin basic protein. Annals of Neurology. 9 (5), 433-438 (1981).
- Tuohy, V. K., Sobel, R. A., Lees, M. B. Myelin proteolipid protein-induced experimental allergic encephalomyelitis. Variations of disease expression in different strains of mice. The Journal of Immunology. 140 (6), 1868-1873 (1988).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1952-1960 (2006).
- Mendel, I., Kerlero de Rosbo, N., Ben-Nun, A. A myelin oligodendrocyte glycoprotein peptide induces typical chronic experimental autoimmune encephalomyelitis in H-2b mice: fine specificity and T cell receptor V beta expression of encephalitogenic T cells. European Journal of Immunology. 25 (7), 1951-1959 (1995).
- McRae, B. L., et al. Induction of active and adoptive relapsing experimental autoimmune encephalomyelitis (EAE) using an encephalitogenic epitope of proteolipid protein. Journal of Neuroimmunology. 38 (3), 229-240 (1992).
- Bebo, B. F., Vandenbark, A. A., Offner, H. Male SJL mice do not relapse after induction of EAE with PLP 139-151. Journal of Neuroscience Research. 45 (6), 680-689 (1996).
- Oliver, A. R., Lyon, G. M., Ruddle, N. H. Rat and human myelin oligodendrocyte glycoproteins induce experimental autoimmune encephalomyelitis by different mechanisms in C57BL/6 mice. The Journal of Immunology. 171 (1), 462-468 (2003).
- Scheld, M., et al. Neurodegeneration Triggers Peripheral Immune Cell Recruitment into the Forebrain. The Journal of Neuroscience. 36 (4), 1410-1415 (2016).
- Chanaday, N. L., Roth, G. A. Microglia and astrocyte activation in the frontal cortex of rats with experimental autoimmune encephalomyelitis. Neuroscience. 314, 160-169 (2016).
- Pomeroy, I. M., Matthews, P. M., Frank, J. A., Jordan, E. K., Esiri, M. M. Demyelinated neocortical lesions in marmoset autoimmune encephalomyelitis mimic those in multiple sclerosis. Brain. 128 (11), 2713-2721 (2005).
- Merkler, D., et al. Differential macrophage/microglia activation in neocortical EAE lesions in the marmoset monkey. Brain Pathology. 16 (2), 117-123 (2006).
- Storch, M. K., et al. Cortical demyelination can be modeled in specific rat models of autoimmune encephalomyelitis and is major histocompatibility complex (MHC) haplotype-related. Journal of Neuropathology and Experimental Neurology. 65 (12), 1137-1142 (2006).
- Ludwin, S. K. Central nervous system demyelination and remyelination in the mouse: an ultrastructural study of cuprizone toxicity. Laboratory Investigation. 39 (6), 597-612 (1978).
- Skripuletz, T., et al. Cortical demyelination is prominent in the murine cuprizone model and is strain-dependent. The American Journal of Pathology. 172 (4), 1053-1061 (2008).
- Norkute, A., et al. Cuprizone treatment induces demyelination and astrocytosis in the mouse hippocampus. Journal of Neuroscience Research. 87 (6), 1343-1355 (2009).
- Acs, P., et al. 17beta-estradiol and progesterone prevent cuprizone provoked demyelination of corpus callosum in male mice. Glia. 57 (8), 807-814 (2009).
- Pott, F., et al. Cuprizone effect on myelination, astrogliosis and microglia attraction in the mouse basal ganglia. Brain Research. 1305, 137-149 (2009).
- Jeffery, N. D., Blakemore, W. F. Remyelination of mouse spinal cord axons demyelinated by local injection of lysolecithin. Journal of Neurocytology. 24 (10), 775-781 (1995).
- Blakemore, W. F. Ethidium bromide induced demyelination in the spinal cord of the cat. Neuropathology and Applied Neurobiology. 8 (5), 365-375 (1982).
- Mason, J. L., et al. Oligodendrocytes and progenitors become progressively depleted within chronically demyelinated lesions. The American Journal of Pathology. 164 (5), 1673-1682 (2004).
- Franco, P. G., Silvestroff, L., Soto, E. F., Pasquini, J. M. Thyroid hormones promote differentiation of oligodendrocyte progenitor cells and improve remyelination after cuprizone-induced demyelination. Experimental Neurology. 212 (2), 458-467 (2008).
- Lassmann, H., Bradl, M. Multiple sclerosis: experimental models and reality. Acta Neuropathologica. 133 (2), 223-244 (2017).
- Kerschensteiner, M., et al. Targeting experimental autoimmune encephalomyelitis lesions to a predetermined axonal tract system allows for refined behavioral testing in an animal model of multiple sclerosis. The American Journal of Pathology. 164 (4), 1455-1469 (2004).
- Merkler, D., Ernsting, T., Kerschensteiner, M., Bruck, W., Stadelmann, C. A new focal EAE model of cortical demyelination: multiple sclerosis-like lesions with rapid resolution of inflammation and extensive remyelination. Brain. 129, 1972-1983 (2006).
- Ucal, M., et al. Widespread cortical demyelination of both hemispheres can be induced by injection of pro-inflammatory cytokines via an implanted catheter in the cortex of MOG-immunized rats. Experimental Neurology. 294, 32-44 (2017).
- Gardner, C., et al. Cortical grey matter demyelination can be induced by elevated pro-inflammatory cytokines in the subarachnoid space of MOG-immunized rats. Brain. 136, 3596-3608 (2013).
- Minagar, A., et al. The thalamus and multiple sclerosis: modern views on pathologic, imaging, and clinical aspects. Neurology. 80 (2), 210-219 (2013).
- Tsunoda, I., Kuang, L. Q., Theil, D. J., Fujinami, R. S. Antibody association with a novel model for primary progressive multiple sclerosis: induction of relapsing-remitting and progressive forms of EAE in H2s mouse strains. Brain Pathology. 10 (3), 402-418 (2000).
- Lifshitz, J., Witgen, B. M., Grady, M. S. Acute cognitive impairment after lateral fluid percussion brain injury recovers by 1 month: evaluation by conditioned fear response. Behavioural Brain Research. 177 (2), 347-357 (2007).
- Kabadi, S. V., Hilton, G. D., Stoica, B. A., Zapple, D. N., Faden, A. I. Fluid-percussion-induced traumatic brain injury model in rats. Nature Protocols. 5 (9), 1552-1563 (2010).
- Leonard, J. R., Grady, M. S., Lee, M. E., Paz, J. C., Westrum, L. E. Fluid percussion injury causes disruption of the septohippocampal pathway in the rat. Experimental Neurology. 143 (2), 177-187 (1997).
- Hare, G. M., et al. Severe hemodilutional anemia increases cerebral tissue injury following acute neurotrauma. Journal of Applied Physiology. 103 (3), 1021-1029 (2007).
- Abbott, N. J. Evidence for bulk flow of brain interstitial fluid: significance for physiology and pathology. Neurochemistry International. 45 (4), 545-552 (2004).
- Amor, S., et al. Identification of epitopes of myelin oligodendrocyte glycoprotein for the induction of experimental allergic encephalomyelitis in SJL and Biozzi AB/H mice. The Journal of Immunology. 153 (10), 4349-4356 (1994).
- Adzemovic, M. Z., Zeitelhofer, M., Hochmeister, S., Gustafsson, S. A., Jagodic, M. Efficacy of vitamin D in treating multiple sclerosis-like neuroinflammation depends on developmental stage. Experimental Neurology. , 39-48 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved