Method Article
프로 염증 성 사이토카인의 인트레이스렐 주입에 의해 유도된 광범위한 대뇌 피질 탈량의 쥐 모델
* 이 저자들은 동등하게 기여했습니다
요약
여기에 제시 된 프로토콜은 성인 남성 다크 아구티 쥐에서 두 피질 반구의 광범위한 회색 물질 탈모의 재현을 허용합니다. 상기 방법은 카테터의 인트레이스레브레인 이식, 골엘린 올리고드로시테 당단백질에 대한 임상 접종, 이식된 카테터를 통한 프로염증성 사이토카인 혼합물의 인트레이스레브렐 주입을 포함한다.
초록
다발성 경화증 (MS)은 중추 신경계 (CNS)의 가장 흔한 면역 매개 질환이며, 점차적으로 물리적 인 장애와 죽음으로 이어질, 척수와 소뇌의 백색 물질 병변에 의해 발생, 뿐만 아니라 회색 물질의 탈취에 의해. 실험적인 알레르기 성 뇌척수염의 전통적인 모형은 척추와 소뇌 백색 물질에 있는 세포 매개한 염증의 조사에 적합하기 위하여 적당한 동안, 그(것)들은 회색 물질 병리를 해결하지 못합니다. 여기서, 우리는 피질 병변으로 이끌어 내는 병리학 및 분자 기계장치의 조사를 허용하는 피질 탈마일리네이션의 새로운 쥐 모형을 위한 실험 프로토콜을 제시합니다. 탈량은 미골 올리고드로시테 당단백질(MOG)을 함유한 면역에 의해 유도되며, 이어서 프로 염증성 사이토카인의 카테터 매개 인트레이스 레브레브롤 전달이 뒤따릅니다. 카테터는 또한 주사로 인한 외상을 일으키지 않고 여러 차례의 탈량 제고를 가능하게 할 뿐만 아니라 전임상 조사를 받는 잠재적 치료 약물의 인트레이스 레브레인 전달을 가능하게 합니다. 이 방법은 또한 동물의 고통과 고민 또는 장애가 통제되고 상대적으로 최소한의 경우 윤리적으로 유리합니다. 전체 프로토콜의 구현을 위한 예상 기간은 약 8-10주입니다.
서문
MS는 주로 myelin 시트를 손상시키지만 결국 축축손실과 영구적인 뉴런 손상으로 이어지는 CNS의 면역 매개, 염증성 질환입니다. MS는 전 세계적으로 약 230만 명의 추정 유병률을 가진 CNS의 가장 흔한 면역매개 질환이며, 주요 개인 및 사회 경제적 부담을 나타냅니다. 질병 개시의 평균 연령은 30 년이고 가혹한 장애를 일으키는 원인이 되어 생산적인 년의 손실로 이끌어 냅니다. MS는 현재 불치병이며, 현재 치료 양식은 재발 방출 MS에서 급성 재발 중 증상을 관리하고 면역 조절요법2,3에의한 재발 빈도를 감소시키는 질병의 과정을 수정하는 것을 목표로 한다. 활성 염증을 가진 1차 진행성 MS(PPMS) 환자의 하위 그룹에서 효과적인 것으로 나타났던 B 세포 고갈 요법의 최근 임상 시험을 제외하고는 아직 진행성 유형4에대한 치료 옵션이 입증되지않았다. 몇몇 잠재적인유전 6 및 환경 위험 요소7이 확인된 동안, MS의 병인은, 그러나, 알려지지 않은 남아 있습니다.
MS는 백색 물질8,9에큰 염증 제모 플라크및 확산 부상을 특징으로한다. 초점 병변은 광범위한 T 세포 매개 공격, 올리고드렌드로시테 파괴, 반응성 천체 글리오증 및 축삭 변성과 관련이 있어 운동 신경 이쇠가 감소합니다. 회색 물질 탈수 및 위축은 질병의 추가 조직 병리학 적 특징으로 인정을 얻고있다9,10,11. 후자는 환자에서 신경 기능 장애 및 인지 감소에 기여 하기 위해 제안 되었습니다12,13. 피질 탈myelination의 세 가지 패턴은 구별되었다, 즉 i) 백물질 병변 (34%), ii) 작은, 인식 (16%), 및 iii) 피피알 (50 %)와 인접. 초점 백색 물질 병변과는 달리, 이 회색 물질 병변은 T 세포 중재 공격이 결여되어 대신 향상된 microglial 활성화, 세포 멸낭 및 신경 손실12를특징으로 합니다.
현재까지, 질병의 복잡성으로 인해 단일 동물 모델에서 인간의 MS를 다시 회수할 수 없었습니다. 다양한 MS 동물 모델, 각각 질병 발생 및 진행의 상이한 양상을 시뮬레이션하였고, 대신14,15가개발되었다. 현재 동물 모델은 세 가지 다른 질병 과정을 모방: i) 초점 염증 병변, ii) 확산 백색 물질 부상, iii) 확산 회색 물질 병리학.
MS 백색 물질 플라크의 동물 연구는 주로 설치류 뇌척수염 (EAE) 모델에서 실시되었습니다. 시험동물들은 골수린 항원(보통 골린 올리고덴드로시테 당단백질(MOG)16,17,미엘린 기본 단백질(MBP)18,또는 프로테오라이트 단백질(PLP)19]를함유한 에멀젼으로 적극적으로 면역되며, 완전한 프룬트의 보조(CFA)와 함께20.20. 질병은 또한 골린 특이적 T 세포의 입양 전달에 의해 수동적으로 유도될 수있다(21). 질병 과정은 사용되는 항원 /마우스 변형 조합에 따라 달라집니다. 예를 들어, C57BL/6에서 MOG35-55는 단면 만성질환(22)을초래하고, 스위스 짐 램버트(SJL)의 PLP139-151은 성별 방식으로 재발-송금 질환코스(23)로 이어진다. 쥐 MOG35-55는,추가, 뇌성 T 세포 반응을 유도하고, 인간 MOG35-55는 C57BL/6마우스25에서B 세포 의존성 염증을 유도한다. 다양한 EAE 모델은 주로 척수와 소뇌에서 세포 매개 염증을 연구하는 훌륭한 도구를 제공하지만 피질, 코퍼스 캘로섬 및 피코피 구조와 같은 전뇌 구조는 크게26을절약합니다. 확산 백색 물질 부상이나 회색 물질 탈근은 EAE 모델26,27에서적절하게 복제됩니다. 활성 EAE 유도와 관련된 피질 탈근은 mhC 급 I 및 클래스 II 동종 및 항문30의일반적인 조합에 기인하는 후자의 경우, 마모셋28,29 및 특정 루이스 쥐 서브 균주에서 보고되었다.
큐브리존모델(31)은 피질, 서브 피질 32 및 해마33 개 지역뿐만 아니라 코퍼스 캘로섬(34)과 카우다테 푸타멘(35)의 광범위한 탈량과 함께 확산백색 물질 탈근 및 회색 물질 병리학을 연구하는 데 유용한 도구이다. Cuprizone 중독은 원칙적으로 올리고드로키테스의 대사 스트레스 유발 세포멸을 초래하며, 마이크로글리아 활성화, 점성술사증 및 말초 면역 세포에 침투하는 상대적 부족과 같은 MS 뇌의 피질 탈미엘리나이팅 병변의 일부 특성을 모방합니다. 뉴런 세포 세포증과 thalamic 위축의 부족뿐만 아니라 식이 컵 리존 보충제의 중단에 관찰 된 강력한 재명료와 탈마일레네이션의 완전한 해상도32,그러나, 전임상 MS 모델로 컵 리존 중독의 사용을 제한. 독성 탈량은 또한 백색 물질 로소로 리솔자시트틴 또는 에티듐 브로마이드의 초점 주입에 의해 유도될 수 있다36,37,그러나 이 방법은 거의 사용되지 않습니다. 독성 탈량 모델은 올리고드렌드로시테 전구 및성상세포(38,39)에대한 요구 사항과 같은 재생물의 복잡한 메커니즘의 분석에 특히 적합하다. EAE 및 중독 모델에 대한 자세한 정보는 최근 두 건의 리뷰15,40에서제공됩니다.
사이토카인 유도 탈myelination은 처음에 EAE41에서척추 백색 물질 병변을 연구하기 위하여 개발되었습니다. 나중에, MS. Dark Agouti (DA) 또는 루이스 쥐에서 피질 회색 물질 병리를 연구하기 위해 수정되었다 먼저 불완전 한 Freund의 보조제에서 MOG1-12542,43 또는 MOG1-11644와 하위 임상 예방 접종에 의해 프라이밍된다 (IFA). 고전 EAE 모델과는 달리, 이 프라이밍 동물은 척수에 있는 초점 선동적인 병변의 임상 현상을 전시하지 않습니다. 대신, 뇌의 염증 반응 및 탈량은 동물이 혈액내 항MOG 항체의 안정적인 티터를 획득하면 프로 염증성 사이토카인 혼합물[종양 괴사 인자 알파(TNFα) 및 인터페론 감마(IFNγ)]의 인트레이스레브레인 투여에 의해 달성된다.
메르클러 외에 의해 연구. 42 및 가드너 외. 도 44는 서브 임상 MOG 면역 및 피방 성 사이토카인 주입에 의한 피질 탈량 유도의 효능을 입증하였다. 그러나, 너무 짧은 완전한 재발견이 14일 이내에 발생하여 약리학적 개입 검사를 위한 창이 제한되었다. 두 모델, 또한, 외상성 주입 modus를 활용, 이는 se 내 주사 외상과 혈액 뇌 장벽 (BBB) 고장을 일으킬 수 있으며, 따라서 parenchyma에 염증 세포의 통제되지 않은 모집으로 이어질 수 있습니다. 두 연구, 또한, 제한된 영역으로 제한 되는 탈명 을 입증, ipsilateral 피 질에서, 또는 사이토 카인 주사의 사이트의 가까운 부근에.
이러한 한계를 극복하기 위해, 우리는 DA 쥐의 오른쪽 정수리 피질에 카테터를 이식, 카테터 팁은 코퍼스 callosum 바로 위에 위치. BBB 무결성의 완전한 회복을 허용하기 위해, 동물은 카테터 이식 후 2 주의 휴식 기간을 허용했다. 이어서, 쥐는 IFA에서 재조합 MOG1-125의 5 μg로 임상적으로 면역되었다. 약 4주 후 안정적인 항모그 항체 티터의 달성에 이어, 시토카인 혼합물의 2μL은 프로그래밍 가능한 주사기 펌프를 사용하여 10분 이내에 카테터를 통해 주입되었다. 이 절차는 15일 만에 입시및 금단성 대뇌반구의 광범위한 피질 탈myelination을 유도했으며, 30일 전후 시토카인 주사43을부분적으로 재마일로 증식했다. 다중 탈량 단계는 더욱이, 카테터를 통해 프로 염증 성 사이토카인의 반복 투여에 의해 유도될 수 있고, 진보성 MS아형(45)의일반적인 특징인 글로벌 뇌 위축은 제2탈량 단계43이후로 조기에 유도될 수 있다. 중요한 것은, 이식된 카테터는 약리학적 개입을 시험하기 위하여 또한 이용될 수 있었습니다.
아래에 설명된 프로토콜은 Intracerebral 카테터를 사용하여 DA 쥐의 두 대뇌 반구에서 광범위한 피질 탈마일레네이션의 재현 가능한 생성을 위한 실험 단계에 대한 상세한 설명을 제공합니다.
프로토콜
여기에 설명된 모든 방법은 지방 자치 단체 (분데스 장관 퓌르 위센샤프트 und Forschung (오스트리아 과학 연구부)에 의해 승인되었습니다. 라이센스 번호: 66.010/0132-WF/V/3b/2014). 성인 남성 DA 쥐 (10 - 12 주)는 음식과 물에 무료로 액세스 할 수있는 12/12 h 빛 / 어두운 주기에 보관되었습니다.
1. 재료 준비
참고 : 수술은 무균 조건에서 수행됩니다. 시작하기 전에 드릴 비트를 포함한 모든 수술 기구가 적절한 소독제로 청소되었는지 확인하십시오.
- 마취 혼합물을 준비: 펜타닐의 0.02 mg/mL, midazolam의 0.4 mg/mL, 그리고 0.2 mg/mL 의 메데토미딘 (혼합물의 최종 농도).
참고: 대체 마취제에 대한 각 토론 섹션을 참조하십시오. - 해독제 혼합물을 준비: 0.07 플루마제닐의 mg/mL 및 0.42 아티파메졸의 mg/mL (혼합물의 최종 농도).
- 입구와 나사로 카테터와 카테터 캡을 조립합니다. 카테터를 메스로 2mm 길이로 자른다(도1).
참고: 카테터 팁의 원형 단면 모양을 짜내고 왜곡하기 때문에 가위를 사용하지 마십시오.
2. 외과 준비
- 마취 혼합물(i.5 mL/kg의 체중)의 인트라테코네(i.p.) 투여로 쥐를 마취한다.
- 전기 면도기로 귀 사이에 쥐의 머리를 면도합니다. 수술 내내 저체온증을 피하기 위해 동물을 배치하기 전에 입체 프레임에 홈더믹 담요를 놓습니다.
- 이어 바와 바이트 플레이트를 사용하여 쥐의 머리를 스테레오테전술 프레임에 고정하여 머리가 수평이고 안정적입니다. 손가락이나 집게로 두개골에 압력을 가하여 안정성을 확인하십시오.
참고: 고정 프레임 내에서 고정 및 비수평 위치 지정이 의도한 좌표와 편차를 일으킬 수 있습니다. - 윤활 점 안약을 적용하여 수술 중 각막 건조를 방지하십시오. 불투명한 재료로 눈을 가리면 수술용 광 노출을 방지하십시오.
- 70% 에탄올과 10% 포비도요오드 복합체의 적용을 번갈아 가며 면도 영역을 청소하십시오.
참고: 수술 중 모든 예방 조치를 따라 감염을 피하십시오. 수술은 무균 조건하에서 수행됩니다. asepsis가 깨진 경우 오염 된 물질을 교체해야합니다.
3. 카테터 이식
- 머리 피부 의 중간에 약 2cm 길이의 세로 절개를합니다. 불독 클램프를 사용하여 피부를 옆으로 잡아버라. 이러한 단계에 대한 개요는 그림 2를참조하십시오.
- 면 팁 어플리케이터를 사용하여 혈액을 제거합니다.
- 두개골 음막제거. 면 끝 어플리케이터로 조직을 청소하고 두개골 뼈를 노출시합니다. 두개골이 약 1분 동안 건조되도록 합니다.
- 해부학적 랜드마크, 람다, 브레그마, 내측 봉합사를 식별합니다. 드릴이 스테레오테틱 프레임에 설치되면 Bregma의 드릴 팁을 시작점으로 배치합니다. 브레그마에서 2mm 후방을 이동하고 ~ 2.4mm를 내측 봉합사로 이동합니다.
- 이 위치에서 카테터를 위해 직경 0.5mm의 구멍을 뚫습니다. 뼈 먼지를 부드럽게 퍼프합니다.
참고: 드릴링 중에 듀라 메이트가 그대로 유지되는 것이 중요합니다. 이를 보장하기 위해, 1) 스테레오전술 프레임에 설치할 수 있는 드릴을 사용하고, 2) 드릴링 중에 구멍을 자주 검사하고, 3) 작은 단계로 드릴다운-너무 많은 압력이 두개골에 가해지면, 드릴 팁이 계속 되어 두개골이 완전히 침투할 때 뇌가 손상된다. - 첫 번째 구멍에서 몇 밀리미터 떨어진 곳에 있는 앵커 나사에 대해 3개의 추가 구멍(직경 1.3mm)을 드릴합니다. 뼈 먼지를 부드럽게 날려 버리십시오.
참고: 카테터 상단(직경 2mm)과 앵커 나사 상판(~1mm)에 충분한 공간을 제공하는 앵커 나사 위치를 선택합니다. - 주사기를 사용하여 멸균 인산염 완충식염(PBS) 또는 생리식염수의 약 1-2mL의 관개에 의해 뼈 먼지를 제거합니다. 두개골을 청소합니다. 앵커 나사를 2 -3 전체 회전으로 조입니다.
참고 : 앵커 나사는 치과 시멘트를 잡고, 따라서, 카테터를 제자리에 고정하여 설정을 안정화할 필요가있다. 앵커 나사를 조이는 동안, 집게로 부드럽게 위로 들어 올려 쉽게 탈착할 수 없도록 합니다. 카테터 자체의 이식은 조직 외상을 유발하기 때문에, 앵커 나사를 시추하거나 조이는 동안 추가 듀라 손상은 여러 외상성 부상으로 이어지며 그룹 내에서 의 비교를 방해할 수 있습니다. 앵커 나사를 먼저 조이고 카테터를 마지막으로 삽입합니다. - 두개골 표면에 수직으로 첫 번째 구멍을 통해 2mm 길이 카테터를 삽입합니다. 카테터를 들고 있는 동안 약간의 치과 시멘트를 적용하여 치과 경화 광에 대한 짧은 (~5s) 노출로 중합하여 카테터를 안정화시켜 다음 단계에서 양손을 사용할 수 있게 합니다.
주의: 치과 경화 광으로 작업하는 동안 이 빛의 고강도가 망막 손상을 일으킬 수 있으므로 팁이나 적용 영역에서 반사되는 빛을 직접 보는 것을 피하십시오. 적절한 보호 고글을 사용하십시오. - 카테터 주위에 더 많은 치과 시멘트를 적용하고 나사를 고정하고 치과 경화 등 (~15 - 30 초)으로 치과 시멘트를 고화시하십시오. 집게 끝으로 시멘트의 경화를 확인합니다.
4. 마취의 상처 폐쇄 와 적대감
- 카테터에 리퍼블한 봉합사, 전방 및 후방으로 머리 피부를 닫습니다.
참고 : 이식의 끝에 두개골 위에 울퉁불퉁 한 설정이있을 것이기 때문에, 그에 따라 상처 폐쇄를 할. 피부를 너무 많이 들어 올리면 동물에게 불편함이 생길 수 있습니다. - 26 G 바늘로 1mL 주사기를 사용하여 해독제 혼합물(체중 1.5mL/kg)을 피하한다.
- 예방 항생제 치료를 위해 피하 주사(7.5 mg/kg 체중)에 의한 엔로플로록사신(2.5%)을 투여한다. 카프로펜 관리 (1 mg/mL; 5 mg/kg 체중) 및 buprenorphine (1.2 mg/kg) 피하 주사에 의해 통증 완화에 대 한.
5. 수술 후 치료 및 약물 치료
- 변형 된 케이지에 동물을 반환하고 저체온증을 피하기 위해 적외선의 응용 프로그램과 함께, 1 - 3 시간 동안 관찰에서 유지합니다. 수술 후 회복될 때까지 5~10분마다 동물을 지속적으로 관찰하고 재배치합니다. 회복될 때까지 눈에 일정한 광 노출을 피하십시오.
- 반복 enrofloxacin (7.5 mg/kg 체중) 및 carprofen (1 mg/mL; 5 mg/kg 체중) 수술 후 피하 주사에 의해 관리. Buprenorphine는 이전 치료가 72 시간 동안 효과적이기 때문에 새로 고칠 필요가 없습니다.
6. 예방 접종 혼합물의 준비 (카테터 이식 후 14 일)
참고: 준비 절차 중에 주사기를 얼음 위에 놓습니다.
- 10mL 루어 잠금 팁 유리 주사기 두 개를 3방향 스톱콕의 짧은 팔에 연결하고 긴 팔로 세 번째 콘센트를 닫습니다.
- 연결이 안전하고 누출되지 않았는지 확인: 피스톤 2를 들고 있는 동안 약 4mL의 멸균 PBS를 오픈 주사기에 추가하십시오. 피스톤 1을 삽입하고 누설을 확인하는 동안 피스톤을 앞뒤로 밀어 넣습니다. 누출이 발생하지 않으면 PBS를 폐기하고 피스톤 1을 다시 제거합니다.
- 파이펫 1 mL IFA와 rMOG1-125의 50 μg를 함께 조절하고 적절한 튜브에서 멸균 PBS (pH 7.4)로 2 mL의 최종 부피로 혼합물을 조정합니다.
참고: 준비 중 주사기의 팁이나 벽에 에멀젼이 손실되어 투여용보다 더 많은 양을 준비합니다. 한 번에 1개 이상의 동물을 준비하는 것이 더욱 실용적입니다. - 희석된 IFA 및 rMOG1-125 혼합물을 열린 주사기에 놓습니다. 반대쪽 피스톤(그림3A)에느슨한 압력을유지하면서 피스톤을 부드럽게 삽입합니다.
- 피스톤을 앞뒤로 밀어 내고, 흰색과 점성(도3B)까지한 주사기에서 다른 주사기로 운전하여 접종을 유화한다.
- 3 방향 스톱콕의 열린 짧은 팔에 1 mL 루어 잠금 주사기를 고정하고 접종(그림 3C)로채웁니다. 모든 접종을 1mL 주사기에 배포합니다. 주입 될 때까지 얼음에 보관하십시오. 준비 당일에 혼합물을 투여한다.
7. 예방 접종
- 챔버에서 이소플루오란으로 쥐를 마취 (~2 분, 산소 2 L/min과 혼합) 다음 마스크를 통해 마취를 유지 (산소 1.5 L/min혼합).
- 21 G 바늘을 사용하여 꼬리 베이스에 200 μL의 접종을 피하하십시오.
참고: 용액이 점성이 있기 때문에 사출을 천천히 관리합니다.
8. 항체 티터의 결정
- 항모그 항체 티터를 결정하기 위해 예방 접종 후 4주 후 혈액의 ~200 μL을 철회한다.
- MOG(PBS의 5 μg/mL)로 96웰 플레이트의 웰을 코팅하고 37°C에서 1시간 동안 배양합니다.
- 실온에서 1 시간 동안 PBS에서 1 % 소 세럼 알부민 (BSA)으로 플레이트를 차단합니다.
- 랫트 혈청(1:50)으로 플레이트를 배양하고 37°C에서 2시간 동안 표준으로 플레이트를 배양한다. PBS/폴리소르바테 20의 200 μL로 플레이트 3배 세척합니다.
- 고추냉이 과록시다제-공주 방지 쥐 IgG 이차 항체 (1:10,000)로 플레이트를 배양한다. PBS/폴리소르바테 20의 200 μL로 플레이트 3배 세척합니다.
- 우물당 100 μL의 peroxidase 기판 용액을 추가하고 실온에서 어둠 속에서 20 - 30 분 동안 배양하십시오.
- 405nm 파장에서 광학 밀도를 측정하고 표준 곡선을 사용하여 광학 밀도로부터 항체 티터를 계산합니다.
9. 인트레이스테렐 사이토카인 주입
- 커넥터 캐뉼라(2mm)의 길이를 조정합니다. (준비 단계의 그림 4를 참조하십시오.)
- 사이토카인 혼합물(TNF-알파 500 ng/μL, 재조합 쥐 IFN-감마의 300 U/μL)를 멸균 PBS로 1mL 주사기를 채우는 다. 주사기를 커넥터 캐뉼라에 연결합니다. 사이토카인 혼합물로 캐뉼라를 채웁니다. 거품을 피하십시오.
- 주사기를 프로그래밍 가능한 주사기 펌프에 장착하고 0.2 μL/min(그림5A)을주입하도록 프로그래밍합니다. 펌프를 시작하고 캐뉼라 의 끝에 기포 형성을 피하기 위해 작동 을 유지합니다.
참고: 사출 속도는 사용되는 특정 주사기의 내경을 고려해야 합니다. 따라서 주사기 직경은 펌프 설정 중에 등록되어야 합니다. - 챔버에서 이소플루란으로 쥐를 마취 (~2 분, 산소의 2 L/min혼합) 다음 마스크를 통해 마취를 유지 (산소의 1.5 L/min혼합)(그림 5B 및 5C). 동물이 적어도 30 분 동안 마취 될 때 윤활 점액을 적용하십시오.
- 입구를 통해 카테터 캡을 제거합니다. 커넥터 캐뉼라를 카테터에 삽입하고 나사로 조이고(그림 5D 및 5E)를조입니다.
참고 : 이것은 카테터의 상단 끝을 파괴하기 때문에, 그것을 과도하게 조인하지 마십시오. - 주사를 10분 동안 진행할 수 있도록 한다(주사의 총 부피는 2 μL). 펌프를 중지합니다. 캐뉼러 내부에 20분 동안 두어 주입된 부피가 완전히 확산되도록 하십시오.
- 커넥터 캐뉼라를 풀고 진공 효과를 피하기 위해 천천히 제거합니다.
- 카테터 캡을 입구로 다시 부착하고 나사로 연결합니다. 동물이 케이지의 마취에서 회복하도록 허용하십시오.
결과
피질 탈량은 프로테오라이트 단백질(PLP)에 대한 면역히스토케화학에 의한 사이토카인 주입 후 다른 시점에서 평가될 수있다(도 6). 도 6A는 이식된 카테터를 통해 멸균 PBS만 수신한 MOG 면역 조절 동물에서 15일째에 온전한 PLP 면역 반응활성을 나타낸다. 사이토카인 주사 후 1일째에는 카테터화된부위(도 6B)의가까운 부근에서만 모기 프라이밍 동물에서 탈민이 이미 검출될 수 있었다. PLP 면역 반응성은 1일 후 시토카인 주입에서 변종 피질에서 그대로 유지됩니다. 3일째에는 IPsilateral 피질(도6C)에서퍼지는 PLP 면역 반응활성의손실이 점진적으로 증가하는 것을 관찰할 수 있었다. 콘트라탈 피질 탈량도 3일째(도6D)에서검출될 수 있지만 앵커나사(43)에의한 중간 유체의 낮은 유동 영역으로 인해 앵커 나사 아래 영역으로 다소 제한됩니다. PBS 주입 대조군 동물에서 유사한 관측의 부재는 앵커 나사에서 유래 외상 유도 탈생의 가능성을 배제.
9-15일 사이에, 탈량은 두 반구의 피질의 큰 부분에 영향을미친다(그림 6E, 6F및 6G). 이것은 느린 행동의 관측과 일치, 하지만 로타로드 테스트에서 모터 능력에 통계적으로 유의한 감소없이(43). 피질 탈마일레네이션은 두 반구(그림6H 및 6I)에서최대 30일 동안 지속되며 부분적인 재마일레네이션만 으로 유지됩니다. 도 6J는 인트레이프렐 사이클토카인 주입 후 피질 회색 물질에서 PLP 손실의 정량화를 나타낸다. PLP 면역 반응성은 30 일 이상 기간 후에 아직 평가되지 않았다는 점에 유의해야합니다; 따라서, 재분화의 즉각적인 해결이 있는 경우, 추가 실험에 의해 평가되어야 한다. 이식된 카테터를 통해 사이토카인 혼합물을 제1 주사 후 30일 동안 제1회 뇌 위축발생(도7).

그림 1: 카테터의 준비. (A 와 B)가이드 캐뉼라와 더미 캐뉼라 (입구가있는 카테터 캡)가 조립되고 나사로 놓입니다. (C)그런 다음 카테터는 메스의 도움으로 크기가 2mm로 절단됩니다. 현미경 관찰은 그 목적을 위해 가위의 사용이 캐뉼라 팁의 원형 모양을 왜곡하고, 따라서, 피해야 한다는 것을 보여주었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
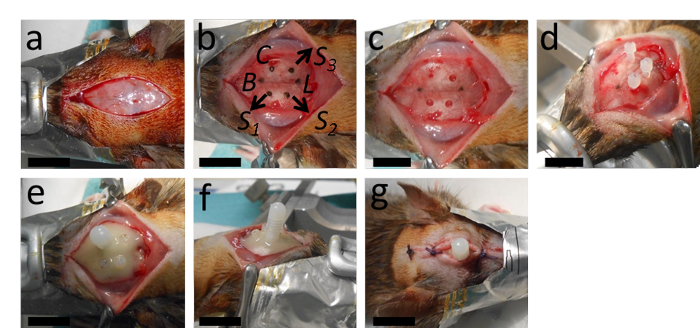
도 2: 카테터의 이식. (A)수술은 경도 절개 및 골막 제거로 시작됩니다. (B, C) 이 패널은 브레그마에서 2mm 후방에서 카테터를 위한 장소의 표시를 보여주고, 2.4mm 측면은 처상 봉합사로부터 오른쪽으로; 카테터와 람다에서 적절한 거리를 가진 세 개의 앵커 나사를 위한 구멍의 장소뿐만 아니라. (D)카테터 구멍(직경 0.5mm, 둥근 드릴 팁 포함)과 앵커 나사구멍(뒤틀린 드릴 팁이 있는 직경 1.3mm)을 드릴링한 후 앵커 나사가 조여져 있습니다. (E, F) 그런 다음 카테터가 삽입되고 전체 설정이 중합 치과 시멘트로 안정화됩니다. (G)상처는 카테터에 2~3노트 전방 및 후방으로 바느질된다. B = 브레그마; L = 람다; C = 카테터; S1, S2 및 S3 = 세 개의 앵커 나사에 대한 구멍에 대한 위치. 스케일 바 = 1cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
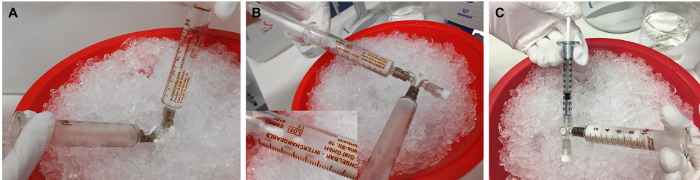
도 3: rMOG/IFA 에멀젼의 준비. (A)rMOG, PBS 및 IFA의 혼합물은 피스톤을 앞뒤로 밀어 서 한 주사기에서 다른 주사기로 접종을 눌러 유화되고,(B)흰색과 점성이 될 때까지. (C)이어서, 접종은 주입을 위해 1mL 주사기로 분배된다. rMOG의 5 μg는 PBS/IFA 혼합물의 200 μL에서 1개의 쥐를 서브 임상적으로 예방 접종하는 데 사용됩니다. 그러나 준비 중 주사기의 팁과 벽의 손실로 인해 더 큰 볼륨을 준비해야합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 커넥터 캐뉼라의 준비. (A - D)이러한 패널은 커넥터와 내부가 2mm 크기의 템플릿 가이드 캐뉼라로 조립되는 방법을 보여줍니다. (E)내부는메스(F)의도움으로 가이드 캐뉼라와 동일한 크기로 절단되고 템플릿 가이드는 나사로 풀려나게 된다. (G)커넥터 캐뉼라의 다른 쪽 끝은 20G 바늘로 사출 믹스를 포함하는 1mL 주사기에 고정된다. 스케일 바 = 3cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 인트레이스테렐 사출. (A)프로그래밍 가능한 주사기 펌프는 2 μL/분 사출 속도에 맞게 조정되고, 사이토카인 믹스(또는 컨트롤용 멸균 PBS)로 채워진 1mL 주사기가 펌프에 장착된다. (B)동물은 먼저 2L/min 산소 흐름으로 5% 이소플루란을 사용하여 챔버에서 마취한 다음(C)마취는 1.5 L/min 산소 흐름을 가진 2.5%의 이소플루란을 사용하여 마스크를 통해 유지된다. (D)입구(더미 캐뉼라)가 있는 카테터 캡이 나사로 놓이고 주입 캐뉼라가 이식된 카테터를 통해 삽입된다. 주사의 양이 매우 작기 때문에 조사관은 캐뉼라 끝에 기포를 피하기 위해 주의해야합니다. 이러한 이유로 펌프가 작동 중이고 끝에 액체 버블이 증가하는 경우에만 삽입을 시작하는 것이 중요합니다. 여분의 볼륨어쨌든 뇌로 이동 하지 않습니다., 그것은 삽입 하기 전에 카테터의 상단에 분해로. (E)커넥터 캐뉼라가 조여지고 펌프가 10분 동안 작동하게 됩니다. 10분 동안 주입후, 펌프가 정지되고, 캐뉼라는 15-20분 동안 내부에 남아 있어 주입된 부피의 확산을 중간 유체로 확산시킬 수 있다. 비늘 막대 = 5cm, 달리 달리 표시 하지 않는 한. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
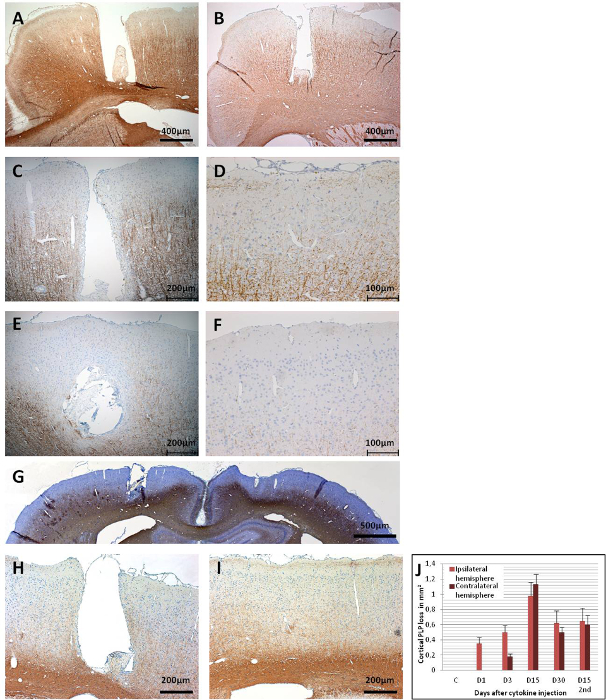
도 6: 관상 뇌 섹션에서 PLP 면역 반응성. (A)이 패널은 피질 탈근을 초래하지 않는 PBS 주사 (15 일)와 제어 뇌 (MOG-프라이밍)를 나타낸다. (B)1일째부터 사이토카인 주사 후, 카테터 영역에서 탈근이 명백하다. (C)PLP 면역 반응성의 폭 넓은 손실은 3일째에 입실피질 피질에서 관찰되며,(D)뿐만 아니라 단면측에서 관찰된다. PLP 면역 반응성의 광범위한 손실은 15일째에 양반구에서 관찰되며,(E)이 패널은 입실피질을 나타내고(F)이 패널은 단자 피질을 나타낸다. (G)두 반구의 개요는 15일째에 PLP의 광범위한 손실을 보여주는 데 주어진다. 30일째,(H)이 패널은 입실피질을 보여주고(I)이 패널은 모순된 피질을 위해 보여주고, 여전히 현저한 탈근이 있지만, 일부 재밀화 부위도 관찰될 수 있다. (J)본 패널은 탈량의 정량화를 나타낸다(MM 2/반구의 PLP 손실). 1.5 - 2 μm 관상 뇌 섹션은 1:500의 희석 계수를 가진 MS 안티 PLP를 사용하여 PLP 검출을 위해 사용되었다. 단면도는 세포 핵을 위한 헤마톡슬린으로 반성되었다. 면역 조직 화학에 대한 자세한 내용은 Ucal 외를 참조하십시오. 43. 패널 G와 J는 Ucal 등에서 수정되었습니다. 43. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
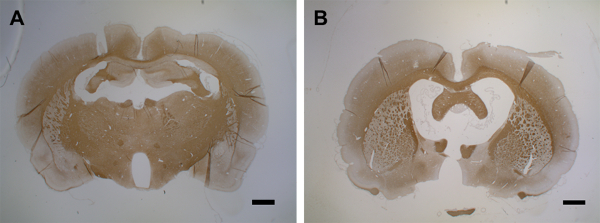
그림 7: 두 번째 사이토카인 주사 후 뇌 위축. (A)이 패널은 PBS 주사(15일)를 가진 제어 뇌(MOG-프라이밍)를 나타낸다. (B)첫 번째 사이토카인 주사 후 15일째에 두 번째 주사는 15일 이내에 뇌 위축으로 이어집니다. 1.5 - 2 μm 관상 뇌 섹션은 1:500의 희석 계수를 가진 MS 안티 PLP를 사용하여 PLP 검출을 위해 사용되었다. 단면도는 세포 핵을 위한 헤마톡슬린으로 반성되었다. 면역 히스토케화학에 대한 자세한 내용은 블레이크모어37을참조하십시오. 스케일 바 = 500 μm. 여기를 클릭하여 이 그림의 더 큰 버전을 확인하십시오.

그림 8: 동물에 의한 카테터 제거를 방지하기 위해 수정 된 케이지. 표준 케이지에서 그리드의 푸드 홀더 공간은 케이지 바닥에 더 가깝게 위치하여 카테터가 그리드와 얽힐 확률을 높이고 제거할 수 있는 위험한 좁은 공간을 만듭니다. 이를 방지하려면 케이지를 수정해야 합니다. 이 좁은 공간은 투명한 평면으로 막혀 동물을 관찰할 수 있었습니다. 이 수정된 케이지의 케이지 내부에 음식을 제공해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
우리의 방법은 DA 쥐를 사용합니다. 마우스에 적응가능성이 작은 카테터와 나사의 사용을 필요로한다. 또한 질병 과정, 염증 반응 및 탈모의 정도가 다른 종 / 균주를 사용하는 경우 여기에 제시되는 것과 다를 수 있음을 명심해야합니다. 이러한 차이는 마우스의 다른 긴장을 사용하여 고전적인 EAE 모델로 관찰되었습니다. 예를 들어, 쥐 기원의 MOG92-106은 A.SW 마우스에서 1차 프로그레시브 또는 이차 프로그레시브 EAE를 초래했으며, SJL/J마우스(46)에서재발 방출 EAE를 유도하였다. 따라서 동일한 균주의 동물을 사용해야 합니다. EAE 증상의 성별 차이도 다양한 이전 연구에서보고되었다24. 이러한 성 효과의 발생은 여기에 설명된 프로토콜에 대해 잘 예상될 수 있지만 추가 실험에서 검증될 수 있습니다.
펜타닐의 0.02 mg/mL, 미다졸람의 0.4 mg/mL, 및 메데토미딘의 0.2 mg/mL을 포함하는 마취 혼합물의 인트라페리톤(IP) 투여는 외과 적 개입을 위해 사용된다. 270-300g의 성인 수컷 DA 쥐는 60-90분 동안 지속되는 마취를 유도하기 위해 이혼합물(즉,~1.5mL/kg)의 약 0.4~0.6mL를 필요로 한다. 수술 후, 마취는 플루마제닐의 0.07 mg/mL및 생리식염수에 있는 atipamezole의 0.42 mg/mL를 포함하는 해독제의 피하 주입에 의해 적대된다 (0.9% NaCl). 1 -1.5 mL/kg의 투여량은 5분 이내에 마취를 항점합니다. 또는, 동물은 마취제에서 생리적 세척에 자발적으로 일어나 수 있습니다, 하지만 그 경우, 동물은 완전히 의식이 될 때까지 관찰하에 유지해야합니다.
케타민과자일라진(47) 또는 펜토바르비탈나트륨(48)의IP 주사, 또는 이소플루오란(49) 및 할로탄(50)과 같은 휘발성 마취제의흡입과 같은 동물 수술에 자주 사용되는 다른 마취 옵션도 여기에 제시된 수술로 간주될 수 있다. 그러나 의도된 다운스트림 개입을 방해하지 않는 마취제를 선택하는 것이 중요합니다.
예방 접종 및 인트레이스 레브레브 혈 중 세포 사출 동안, 5% 이소플루란마취에 사용된다. 여기에 설명된 모델은 쥐를 사용하여 확립되었으며, 나열된 실험 상세체는, 따라서, 특히 쥐에 적용가능하다. 카테터 이식 좌표는 가능한 백색 물질 변화의 동시 분석을 가능하게 하기 위해 선택되었다(코퍼스 캘로섬의 카테터 팁). 카테터 삽입 부위는 전방 및 측면 위치에 대해 다양할 수 있지만, 중앙 설커스의 선택은 우수한 처상 부비동에 대한 손상의 회피를 필요로한다.
상기 기술된 방법의 또 다른 특징은 피질 부위로부터의 간질유체의 생리적 흐름에 의해 지주막식 공간에 주입된 사이토카인 혼합물의 운송으로부터 유래된 ipsi-및 contralateral 반구 모두의 동등한 탈량제(51)이다. 주사 모드는 카테터의 위치가 아니라 대뇌 피질 전체에 걸쳐 탈모를 일으키고 오른쪽 또는 왼쪽 정수리 피질의 선택은 이 점에서 비물질적이어야 합니다.
프로토콜은 광범위한 외상성 부상을 피하기에 충분히 작고 실험의 긴 과정을 통해 카테터 팁의 막힘 속도를 피할 만큼 충분히 큰 26 G 카테터를 사용합니다. 확실히, 이식 및 카테터 자체의 존재는 성상체 및 미세 글리아 활성화를 일으킬, 또한 카테터 이식만수신 제어 동물; 그러나, 이것은 사이토카인 주입 동물에 비해 사소한. 43 후속 분석의 간섭을 피하기 위해, 우리는 폴리 에테르 -에테르 케톤 (PEEK)로 만든 MRI 호환 카테터를 사용했다.
유사한 깊이의 탈근은 실제로 제시된 방법으로 ipsi 및 모순 된 영역에서 만들어집니다. 이것은 카테터 깊이 / 길이가 피질의 탈모의 패턴과 정도에 중요한 역할을하지 않을 수 있음을 의미합니다. 따라서 카테터 유도 병변 크기를 줄이기 위해 카테터 길이의 변형이 고려될 수 있다. 그럼에도 불구 하 고, 상당히 짧은 카테터 길이 약간 덜 발음 피질 탈근을 일으킬 수 있습니다., 결정적인 대답은 카테터 길이에 대 한 특히 테스트 실험에 의해 얻을 것 이다 하는 동안.
모델의 한 가지 장점은 이식된 카테터가 카테터를 통해 피질에 투여된 잠재적 치료제의 시험을 허용하여 조직학적으로 검출가능한 피질 탈량(15일 이상)의 피크 이후 의 재발을 허용하는 반면, 전치료 설정에서는 예방 접종 이후에 있지만 키토킨 주사 전에 는 예방 접종 이후에 있을 것이라는 점입니다. 치료 가 투여 될 때 시간 프레임에 대 한 결정, 따라서, 특정 연구 질문 및 관심의 약물에 따라 달라 집니다.
카테터 이식에 따라, 연구가 끝날 때까지 카테터 제거를 피하기 위해 수정된(바람직하게는 하이탑) 케이지에 단일 동물을 수용하는 것이중요하다(도 8). 동물은 카테터 캡을 입구로 풀릴 수도 있지만 거의 발생하지 않습니다. 동물은 매일 관찰되어야하며 제거 된 캡은 신선한 캡으로 대체되어야하며, 입구가없는 카테터 팁 막힘을 피하고, 인트레이스 렐 주사 후 parenchyma로 정확한 전달을 보장해야합니다. 동물은 혈액-뇌 장벽의 치유와 폐쇄를 허용하기 위하여 카테터 이식 후에 초기 2 주에 면역됩니다.
혈청 항모그 항체 티터는 예방 접종 후 측정되어야 한다. 투여량 반응 실험은 모그1-125(IFA에서)의 5μg가 성인 남성 DA 쥐에서 4주 이내에 충분한 예방 접종을 제공하는 것으로 나타났다. 5,000 μg/mL 이상의 티터는 충분할 것이지만 MOG 준비 및 동물 변형을 포함한 여러 가지 요인에 확실히 의존하므로 개별적으로 결정해야합니다. 시토카인 주입 전에도 마비된 뒷다리를 가진 고전적인 EAE 표현형을 잠재적으로 초래하는 지나치게 높은 항원 복용량을 피하는 것이 중요합니다.
각 동물은 불완전한 프룬트(IFA)의 200μL에서 유화된 재조합 myelin oligodendrocyte 당단백질(rMOG1-125)의5μg으로 예방 접종됩니다. 일부 에멀젼은 준비 중에 주사기 내에서 손실되기 때문에 각 동물에 대해이 금액보다 더 많이 준비하는 것이 좋습니다. 에슈리치아 대장균에서 발현된 재조합 MOG(1-125)를 사용하고, 그 후 케르트 크로마토그래피에 의해 균일성으로 정제되고, 6M 우레아에 용해되고, PBS에 투석하여 생리적 제제52,53을얻었다. 그러나 상업적으로 이용 가능한 MOG도 사용될 수 있습니다.
MOG1-116,MOG35-55 또는 PLP139-151과 같은 다른 항원 제제는 다양한 EAE 모델에 사용되며, 항원 및 동물 균주 차이는 이들모델(20)에서뚜렷한 질병 표현형을 유도하는 것으로 알려져 있다. 이러한 항원 제제는 DA 쥐에서 테스트되지 않았으며, rMOG1-125에특혜로 사용되는 경우 여기에 제시되는 것과 다른 질병 표현형 또는 히스토리학 결과를 유도할 수 있다.
카테터와 동일한 길이의 커넥터 캐뉼라가 인트레이스렐 주사 전에 제조된다. 이는 템플릿 카테터로 조립하여 동일한 크기(길이 2mm)로 절단하여 수행할 수있습니다(도 4). 커넥터 캐뉼라는 사이토카인 주입 중에 기포가 없는 것이 중요합니다-주사 부피가 2μL에 불과하기 때문에 캐뉼라 팁의 작은 기포조차도 뇌로 성공적으로 전달되는 액체의 부피를 현저히 감소시킬 것이다. 이것은 펌프를 계속 실행하고 사출 액체의 증가 방울이 끝에 존재하는 경우에만 캐뉼라를 삽입하여 달성된다. 캐뉼라 삽입 후, 커넥터는 카테터의 상부 끝을 손상시키지 않도록 오버조닝을 피하면서 카테터에 나사로 연결되어 주사 후 다시 계산하기가 어려워집니다. 0.2 μL/min의 주입 속도는 주사 유발 외상을 피하기 위해 사용됩니다. 더욱이, 주입 후 20분 대기 기간과 결합된 느린 주입은 주입된 액체를 중간 유체로 확산시키고 CSF로 효과적인 배수를 보장합니다. 그런 다음 진공 효과를 피하기 위해 캐뉼라를 천천히 제거합니다.
보고된 방법은 외과 적 개입을 포함하고, 그러므로, 입체 생존 수술을 능력을 발휘할 수 있는 직원을 요구합니다. 동물과 직접 접촉하는 직원은 적절한 동물 실험 과정을 수강했어야 합니다. 프로토콜의 나머지 는 유능한 실험실 구성원에 의해 수행 될 수있다.
이 방법은 대뇌 피질의 염증 유발 탈근을 생성하기 위한 것이며 인간 MS의 모든 특징을 재현하지 않습니다(예를 들어,인간 MS의 특징인 초점 염증성 백색 물질 병변의 발생).
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 그들의 도움과 협력에 대한 의과 대학 그라츠에서 생물 의학 연구소의 모든 직원뿐만 아니라 원고를 교정 크리스토퍼 존 라이트턴을 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Adult male Dark Agouti rats (300 ±25 g) | |||
| Fentanyl | Hameln pharma plus, Germany | as Fentanyl-Citrate, 50 µg/ml | |
| Midazolam | ERWO Pharma, Austria | 50039017 | 5 mg/ml |
| Medetomidin | Orion Pharma, Finland | as Medetomidin hydrochloride, 1mg/ml | |
| Flumazenil | Roche, Switzerland | 0.1 mg/ml | |
| Atipamezol | Orion Pharma, Finland | as Atipamezol hydrochloride, 5 mg/ml | |
| 10% povidone-iodine complex | Mundipharma, Austria | ||
| Dental cement | Heraeus Kulzer, Germany | 6603 7633 | |
| Physiological saline solution | Fresenius Kabi, Austria | 0.9% NaCl | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Germany | P3813 | |
| Isofluorane | AbbVie, Austria | ||
| Lubricating eye drops | Thea Pharma, Austria | ||
| 70% EtOH | Merck, Germany | 1070172511 | Absolute ethanol was diluted in ddH2O for preparation of 70% v/v |
| 2.5% enrofloxacin | Bayer, Germany | Prophylactic antibiotics | |
| carprofen | Pfizer, USA | Painkillers, 50 mg/ml | |
| Tween-20 | Sigma-Aldrich, Germany | P9416 | |
| Pentobarbital | Richter Pharma, Austria | pentobarbital sodium, 400 mg/ml | |
| Interferon gamma | PeproTech, USA | 400-20 | |
| Tumor necrosis factor alfa | R&D Systems, USA | 510-RT-050/CF | |
| rMOG1-125 | own product at the Centre of Molecular Medicine, Karolinska Institute, Sweden | Recombinant rat myelin oligodendrocyte glycoprotein, amino acids 1-125 from the N-terminus, also commercially available: AnaSpec, AS-55152-500, USA | |
| Anti-MOG antibody | Ana Spec/Kaneka Corporation, Japan | AS-555157 | Standard from ELISA-Kit; Ana Spec/Kaneka |
| Incomplete Freund’s adjuvant | Sigma-Aldrich, Germany | F5506 | |
| Horse radish peroxidase conjugated anti-rat IgG secondary antibody | Ana Spec/Kaneka Corporation, Japan | AS-555157 | Secondary Antibody from ELISA-Kit; Ana Spec/Kaneka Corporation |
| Bovine serum albumin | Sigma-Aldrich, Germany | A9576 | |
| Peroxidase substrate solution | Vector Laboratories, USA | SK-45000 | |
| Stereotactic frame | David Kopf Instruments, USA | ||
| Catheters, MRI suitable | PlasticsOne, USA | 8IC315GPKXXC | |
| Dummy cannulas | PlasticsOne, USA | 8IC315DCNSPC | |
| Plastic screws, MRI suitable | PlasticsOne, USA | 8L080X093N01 | |
| Connector cannula | PlasticsOne, USA | 8IC313CXSPCC | |
| Screw driver with 2mm tip-size | |||
| Drill with flexible shaft extension | Proxxon, Germany | NO 28 472, NO 28 706, NO 28 620, | |
| Drill bit, round, 0.5 mm | Hager & Meisinger, Germany | REF310 104 001 001 009 | |
| Drill bit, twisted, 1.3 mm | Hager & Meisinger, Germany | REF350 104 417 364 013 | |
| Scalpel | Braun, Germany | BB510 | |
| Scalpel handle | Fine Science Tools, Germany | 91003-12 | |
| Cotton tip applicator | Henry Schein Medical, Austria | 900-3155 | |
| Surgical scissors | Fine Science Tools, Germany | 14101-14, 14088-10 | |
| Surgical forceps | Fine Science Tools, Germany | 11002-12, 11251-35 | |
| Bulldog clamps | Fine Science Tools, Germany | 18050-35 | |
| Homoeothermic blanket | TSE systems, Germany | ||
| Infrared Lamp | Beurer, Germany | 616.51 | |
| Dental curing light | Guilin Woodpecker Medical, China | ||
| Absorbable suture | Johnson & Johnson, Belgium | V792E | |
| Programmable syringe pump | World Precision Instruments, USA | AL-1000 | |
| Exam gloves | |||
| Surgical gown | |||
| Electric Shaver | Aesculap, Germany | GT420 | |
| Volatile anesthetic vaporizer | Rothacher Medical, Switzerland | CV 30-301-D | |
| Oxygen source for volatile anesthetic vaporizer | Air Liquide, Austria | 19,113 | |
| Volatile anesthesia chamber | Rothacher Medical, Switzerland | PS-0347 | |
| Anesthesia mask for rats | Rothacher Medical, Switzerland | PS-0307-A | |
| 1 ml syringe | Codan, Denmark | REF 62.1612 | |
| 26 Gauge needle for injection | Braun, Germany | 4657683 | |
| 20 Gauge needle for cytokine injection and immunization | Braun, Germany | 4657519 | |
| Luer lock tip glass syringes | Poulten & Graf, Germany | 7.140-37 | |
| 3 way stopcock | Becton Dickinson, Sweden | 394600 | |
| 96-well plate | Thermo Fisher Scientific, USA | 442404 | |
| Plate reader | Cole-Parmer, USA | EW-1396-00 | |
| 37°C incubator | Kendro, Germany | 50042301 | |
| Micropipettes | Gilson, USA | F167350 |
참고문헌
- Berkovich, R. Treatment of acute relapses in multiple sclerosis. Neurotherapeutics. 10 (1), 97-105 (2013).
- Kalincik, T. Multiple Sclerosis Relapses: Epidemiology, Outcomes and Management. A Systematic Review. Neuroepidemiology. 44 (4), 199-214 (2015).
- Feinstein, A., Freeman, J., Lo, A. C. Treatment of progressive multiple sclerosis: what works, what does not, and what is needed. The Lancet Neurology. 14 (2), 194-207 (2015).
- Montalban, X., et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. The New England Journal of Medicine. 376 (3), 209-220 (2017).
- Dyment, D. A., Ebers, G. C., Sadovnick, A. D. Genetics of multiple sclerosis. The Lancet Neurology. 3 (2), 104-110 (2004).
- Ascherio, A. Environmental factors in multiple sclerosis. Expert Review of Neurotherapeutics. 13, 3-9 (2013).
- Allen, I. V., McQuaid, S., Mirakhur, M., Nevin, G. Pathological abnormalities in the normal-appearing white matter in multiple sclerosis. Neurological Sciences. 22 (2), 141-144 (2001).
- Kutzelnigg, A., et al. Cortical demyelination and diffuse white matter injury in multiple sclerosis. Brain. 128 (11), 2705-2712 (2005).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the Neurological Sciences. 233 (1-2), 55-59 (2005).
- Lucchinetti, C. F., et al. Inflammatory cortical demyelination in early multiple sclerosis. The New England Journal of Medicine. 365 (23), 2188-2197 (2011).
- Peterson, J. W., Bo, L., Mork, S., Chang, A., Trapp, B. D. Transected neurites, apoptotic neurons, and reduced inflammation in cortical multiple sclerosis lesions. Annals of Neurology. 50 (3), 389-400 (2001).
- Kutzelnigg, A., Lassmann, H. Cortical demyelination in multiple sclerosis: a substrate for cognitive deficits. Journal of the Neurological Sciences. 245 (1-2), 123-126 (2006).
- Procaccini, C., De Rosa, V., Pucino, V., Formisano, L., Matarese, G. Animal models of Multiple Sclerosis. European Journal of Pharmacology. 759, 182-191 (2015).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: a clinical and histopathological perspective. Brain Pathology. 27 (2), 123-137 (2017).
- Lebar, R., Lubetzki, C., Vincent, C., Lombrail, P., Boutry, J. M. The M2 autoantigen of central nervous system myelin, a glycoprotein present in oligodendrocyte membrane. Clinical and Experimental Immunology. 66 (2), 423-434 (1986).
- Linington, C., Bradl, M., Lassmann, H., Brunner, C., Vass, K. Augmentation of demyelination in rat acute allergic encephalomyelitis by circulating mouse monoclonal antibodies directed against a myelin/oligodendrocyte glycoprotein. The American Journal of Pathology. 130 (3), 443-454 (1988).
- Panitch, H., Ciccone, C. Induction of recurrent experimental allergic encephalomyelitis with myelin basic protein. Annals of Neurology. 9 (5), 433-438 (1981).
- Tuohy, V. K., Sobel, R. A., Lees, M. B. Myelin proteolipid protein-induced experimental allergic encephalomyelitis. Variations of disease expression in different strains of mice. The Journal of Immunology. 140 (6), 1868-1873 (1988).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1952-1960 (2006).
- Mendel, I., Kerlero de Rosbo, N., Ben-Nun, A. A myelin oligodendrocyte glycoprotein peptide induces typical chronic experimental autoimmune encephalomyelitis in H-2b mice: fine specificity and T cell receptor V beta expression of encephalitogenic T cells. European Journal of Immunology. 25 (7), 1951-1959 (1995).
- McRae, B. L., et al. Induction of active and adoptive relapsing experimental autoimmune encephalomyelitis (EAE) using an encephalitogenic epitope of proteolipid protein. Journal of Neuroimmunology. 38 (3), 229-240 (1992).
- Bebo, B. F., Vandenbark, A. A., Offner, H. Male SJL mice do not relapse after induction of EAE with PLP 139-151. Journal of Neuroscience Research. 45 (6), 680-689 (1996).
- Oliver, A. R., Lyon, G. M., Ruddle, N. H. Rat and human myelin oligodendrocyte glycoproteins induce experimental autoimmune encephalomyelitis by different mechanisms in C57BL/6 mice. The Journal of Immunology. 171 (1), 462-468 (2003).
- Scheld, M., et al. Neurodegeneration Triggers Peripheral Immune Cell Recruitment into the Forebrain. The Journal of Neuroscience. 36 (4), 1410-1415 (2016).
- Chanaday, N. L., Roth, G. A. Microglia and astrocyte activation in the frontal cortex of rats with experimental autoimmune encephalomyelitis. Neuroscience. 314, 160-169 (2016).
- Pomeroy, I. M., Matthews, P. M., Frank, J. A., Jordan, E. K., Esiri, M. M. Demyelinated neocortical lesions in marmoset autoimmune encephalomyelitis mimic those in multiple sclerosis. Brain. 128 (11), 2713-2721 (2005).
- Merkler, D., et al. Differential macrophage/microglia activation in neocortical EAE lesions in the marmoset monkey. Brain Pathology. 16 (2), 117-123 (2006).
- Storch, M. K., et al. Cortical demyelination can be modeled in specific rat models of autoimmune encephalomyelitis and is major histocompatibility complex (MHC) haplotype-related. Journal of Neuropathology and Experimental Neurology. 65 (12), 1137-1142 (2006).
- Ludwin, S. K. Central nervous system demyelination and remyelination in the mouse: an ultrastructural study of cuprizone toxicity. Laboratory Investigation. 39 (6), 597-612 (1978).
- Skripuletz, T., et al. Cortical demyelination is prominent in the murine cuprizone model and is strain-dependent. The American Journal of Pathology. 172 (4), 1053-1061 (2008).
- Norkute, A., et al. Cuprizone treatment induces demyelination and astrocytosis in the mouse hippocampus. Journal of Neuroscience Research. 87 (6), 1343-1355 (2009).
- Acs, P., et al. 17beta-estradiol and progesterone prevent cuprizone provoked demyelination of corpus callosum in male mice. Glia. 57 (8), 807-814 (2009).
- Pott, F., et al. Cuprizone effect on myelination, astrogliosis and microglia attraction in the mouse basal ganglia. Brain Research. 1305, 137-149 (2009).
- Jeffery, N. D., Blakemore, W. F. Remyelination of mouse spinal cord axons demyelinated by local injection of lysolecithin. Journal of Neurocytology. 24 (10), 775-781 (1995).
- Blakemore, W. F. Ethidium bromide induced demyelination in the spinal cord of the cat. Neuropathology and Applied Neurobiology. 8 (5), 365-375 (1982).
- Mason, J. L., et al. Oligodendrocytes and progenitors become progressively depleted within chronically demyelinated lesions. The American Journal of Pathology. 164 (5), 1673-1682 (2004).
- Franco, P. G., Silvestroff, L., Soto, E. F., Pasquini, J. M. Thyroid hormones promote differentiation of oligodendrocyte progenitor cells and improve remyelination after cuprizone-induced demyelination. Experimental Neurology. 212 (2), 458-467 (2008).
- Lassmann, H., Bradl, M. Multiple sclerosis: experimental models and reality. Acta Neuropathologica. 133 (2), 223-244 (2017).
- Kerschensteiner, M., et al. Targeting experimental autoimmune encephalomyelitis lesions to a predetermined axonal tract system allows for refined behavioral testing in an animal model of multiple sclerosis. The American Journal of Pathology. 164 (4), 1455-1469 (2004).
- Merkler, D., Ernsting, T., Kerschensteiner, M., Bruck, W., Stadelmann, C. A new focal EAE model of cortical demyelination: multiple sclerosis-like lesions with rapid resolution of inflammation and extensive remyelination. Brain. 129, 1972-1983 (2006).
- Ucal, M., et al. Widespread cortical demyelination of both hemispheres can be induced by injection of pro-inflammatory cytokines via an implanted catheter in the cortex of MOG-immunized rats. Experimental Neurology. 294, 32-44 (2017).
- Gardner, C., et al. Cortical grey matter demyelination can be induced by elevated pro-inflammatory cytokines in the subarachnoid space of MOG-immunized rats. Brain. 136, 3596-3608 (2013).
- Minagar, A., et al. The thalamus and multiple sclerosis: modern views on pathologic, imaging, and clinical aspects. Neurology. 80 (2), 210-219 (2013).
- Tsunoda, I., Kuang, L. Q., Theil, D. J., Fujinami, R. S. Antibody association with a novel model for primary progressive multiple sclerosis: induction of relapsing-remitting and progressive forms of EAE in H2s mouse strains. Brain Pathology. 10 (3), 402-418 (2000).
- Lifshitz, J., Witgen, B. M., Grady, M. S. Acute cognitive impairment after lateral fluid percussion brain injury recovers by 1 month: evaluation by conditioned fear response. Behavioural Brain Research. 177 (2), 347-357 (2007).
- Kabadi, S. V., Hilton, G. D., Stoica, B. A., Zapple, D. N., Faden, A. I. Fluid-percussion-induced traumatic brain injury model in rats. Nature Protocols. 5 (9), 1552-1563 (2010).
- Leonard, J. R., Grady, M. S., Lee, M. E., Paz, J. C., Westrum, L. E. Fluid percussion injury causes disruption of the septohippocampal pathway in the rat. Experimental Neurology. 143 (2), 177-187 (1997).
- Hare, G. M., et al. Severe hemodilutional anemia increases cerebral tissue injury following acute neurotrauma. Journal of Applied Physiology. 103 (3), 1021-1029 (2007).
- Abbott, N. J. Evidence for bulk flow of brain interstitial fluid: significance for physiology and pathology. Neurochemistry International. 45 (4), 545-552 (2004).
- Amor, S., et al. Identification of epitopes of myelin oligodendrocyte glycoprotein for the induction of experimental allergic encephalomyelitis in SJL and Biozzi AB/H mice. The Journal of Immunology. 153 (10), 4349-4356 (1994).
- Adzemovic, M. Z., Zeitelhofer, M., Hochmeister, S., Gustafsson, S. A., Jagodic, M. Efficacy of vitamin D in treating multiple sclerosis-like neuroinflammation depends on developmental stage. Experimental Neurology. , 39-48 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유