Method Article
Modelo de Rato de Demyelinação Cortical Cerebral Generalizada Induzida por uma injeção intracerebral de citocinas pró-inflamatórias
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O protocolo aqui apresentado permite a reprodução de uma desmielinização de matéria cinzenta generalizada de ambos os hemisférios corticais em ratos agouti machos adultos. O método compreende a implantação intracerebral de um cateter, imunização subclínica contra glicoproteína de oligodendrocyte de mielina e injeção intracerebral de uma mistura de citocinas pró-inflamatórias através do cateter implantado.
Resumo
A esclerose múltipla (EM) é a doença imunomediada mais comum do sistema nervoso central (SNC) e progressivamente leva à incapacidade física e à morte, causada por lesões de matéria branca na medula espinhal e cerebelo, bem como pela desmielinização em matéria cinzenta. Embora modelos convencionais de encefalomielite alérgica experimental sejam adequados para a investigação da inflamação mediada por células na matéria branca vertebral e cerebelar, eles não conseguem abordar patologias de matéria cinzenta. Aqui, apresentamos o protocolo experimental para um novo modelo de desmielinização cortical permitindo a investigação dos mecanismos patológicos e moleculares que levam a lesões corticais. A demyelination é induzida por uma imunização com glioproteína de oligodendrocyte de baixa dose de mielina (MOG) em um adjuvante de Freund incompleto seguido por uma entrega intracerebral mediada por cateter de citocinas pró-inflamatórias. O cateter, aliás, permite múltiplas rodadas de desmielinização sem causar trauma induzido por injeção, bem como a entrega intracerebral de potenciais drogas terapêuticas submetidas a uma investigação pré-lítica. O método também é eticamente favorável, pois a dor e a angústia ou a incapacidade dos animais são controladas e relativamente mínimas. O prazo previsto para a implementação de todo o protocolo é de cerca de 8 a 10 semanas.
Introdução
A ESM é uma doença inflamatória imuno-mediada do SNC, que danifica principalmente as folhas de mielina, mas eventualmente leva à perda axonal e danos neuronais permanentes. A ESM é a doença imunomumulicada mais comum do SNC, com uma prevalência estimada de cerca de 2,3 milhões de pessoas em todo o mundo, de acordo com a National MS Society1, e representa uma grande carga pessoal e socioeconômica. A idade média do início da doença é de 30 anos e leva à perda de anos produtivos por causar incapacidade grave. Atualmente, a ESM é incurável, e as atuais modalidades de tratamento visam gerenciar os sintomas durante uma recaída aguda na esclerose múltipla recidiva e modificar o curso da doença para diminuir a frequência de recaída por terapia imunomodulatória2,3. Nenhuma opção de tratamento ainda se mostrou eficaz para os tipos progressivos4, com exceção de um recente ensaio clínico da terapia de esgotamento de células B, que mostrou-se eficaz em um subgrupo de pacientes primários progressivos (PPMS) com inflamação ativa5. Embora vários fatores potenciais genéticos6 e de risco ambiental7 tenham sido identificados, a etiologia da Etiologia da ETI, no entanto, permanece desconhecida.
A ESM é caracterizada por grandes placas inflamatórias desmielinizando e lesões difusas para a matéria branca8,9. Lesões focais têm sido associadas a um extenso ataque mediado por células T, destruição de oligodendrocyte, astrogliose reativa e degeneração axonal, levando a um declínio do neurônio motor. A dessalinização e a atrofia da matéria cinzenta ganharam reconhecimento como características histopatológicas adicionais da doença9,10,11. Este último foi sugerido para contribuir para a disfunção neurológica e o declínio cognitivo em pacientes12,13. Três padrões de desmielinização cortical foram distinguidos, ou seja, i) leucocortical, contíguo com as lesões de matéria branca (34%), ii) pequenas, perivasculares (16%) e iii) subpiais (50%). Ao contrário das lesões focais de matéria branca, essas lesões de matéria cinzenta têm sido relatadas como falta de um ataque mediado por células T e são caracterizadas por uma ativação microglial aprimorada, apoptose e perda neuronal12.
Até o momento, não foi possível recapitular a ESM humana em um único modelo animal, em grande parte devido à complexidade da doença. Uma variedade de modelos animais de ESM, cada um simulando diferentes aspectos da patogênese e progressão da doença foram, em vez disso, desenvolvidos14,15. Os modelos animais atuais imitam três processos diferentes da doença: i) lesões inflamatórias focais, ii) lesão difusa de matéria branca e iii) patologia difusa da matéria cinzenta.
Estudos em animais de placas de matéria branca de MS têm sido conduzidos principalmente em modelos de encefalomielite de roedores (EAE). Os animais de teste são ativamente imunizados com uma emulsão contendo um antígeno de mielina [geralmente mielina oligodendrocyte glicoproteína (MOG)16,17, proteína básica de mielina (MBP)18, ou proteína proteolipida (PLP)19], juntamente com um completo adjuvante de Freund (CFA)20. A doença também pode ser induzida passivamente por uma transferência adotiva de células T específicas damielina 21. O curso da doença depende da combinação de cepa de antígeno/camundongo que é usada. MOG35-55 em C57BL/6, por exemplo, resulta em uma doença crônica monofásica22, enquanto PLP139-151 em camundongos suíços Jim Lambert (SJL) leva a um curso de doença reencializando23 de forma específica de gênero24. O rato MOG35-55,além disso, induz uma resposta encefalilígena de células T, enquanto o MOG35-55 humano induz inflamação dependente de células B em camundongos C57BL/625. Vários modelos EAE fornecem uma excelente ferramenta para estudar a inflamação mediada por células principalmente na medula espinhal e no cerebelo, mas estruturas de cérebros como o córtex, corpus calosum e estruturas subcorticais permanecem em grande parte poupadas26. Nem a lesão difusa da matéria branca nem a desmielinização da matéria cinzenta são, além disso, adequadamente replicadas nos modelos EAE26,27. A dessalinização cortical associada à indução ativa da EAE foi relatada nos saguis28,29 e em certas subespeções de ratos de Lewis, neste último caso atribuída às combinações predominantes de isótipos e aletos classe II e alelosclasse II.
O modelo cuprizone31 é uma ferramenta útil para o estudo da desmielinização difusa da matéria branca e patologia da matéria cinzenta com uma extensa desmielinização das regiões cortical, sub-cortical32e hipocampal33, bem como o corpus calosum34 e o caudate putamen35. A intoxicação por cuprizone, que, em princípio, resulta em apoptose metabólica induzida pelo estresse dos oligodendrocitos, imita algumas características das lesões desmielinizantes corticais dos cérebros de ESM, como ativação de microglia, astrogliose e uma relativa falta de infiltração de células imunes periféricas. A falta de apoptose neuronal e atrofia talâmica, bem como a resolução completa da desmielinação com uma remielinação robusta observada após a cessação da suplementação da cuprizonedietética 32,no entanto, limitam o uso da intoxicação por cuprizone como modelo de MS pré-clínico. A dessalinização tóxica também pode ser induzida por uma injeção focal de tosolecithin ou brometo de ticídio nos tratos de matéria branca36,37, mas esses métodos raramente são usados. Modelos de dessalinização tóxica são especialmente adequados para a análise dos mecanismos complexos de remielinização, como a exigência de células progenitoras oligodendrocytes e astrócitos38,39. Informações detalhadas sobre eAE e modelos de intoxicação são fornecidas em duas revisões recentes15,40.
A demyelina induzida por citocina foi inicialmente desenvolvida para estudar lesões de matéria branca espinhal na EAE41. Mais tarde, foi modificado para estudar patologias de matéria cinzenta cortical em MS. Os ratos de Dark Agouti (DA) ou Lewis são primeiro preparados por uma imunização subclímptica com MOG1-12542,43 ou MOG1-11644 em um adjuvante incompleto de Freund (IFA). Ao contrário dos modelos clássicos da EAE, esses animais preparados não apresentam sintomas clínicos de lesões inflamatórias focais na medula espinhal. Em vez disso, uma resposta inflamatória e a desmielinização no cérebro são posteriormente alcançadas por uma administração intracerebral de uma mistura pró-inflamatório de citocinas [fator de necrose tumoral alfa (TNFα) e interferon gama (IFNγ)] uma vez que os animais atingiram um título estável de anticorpos anti-MOG no sangue.
Estudos de Merkler et al. 42 e Gardner et al. 44 comprovaram a eficácia de uma indução de desmielinização cortical subpial por uma imunização subclíquical de MOG e uma injeção de citocina intracerebral ou subaracnoidal. A duração relatada da desmielinização foi, no entanto, muito curta- uma remielinação completa ocorreu em 14 dias ou menos, limitando assim a janela para qualquer teste de intervenção farmacológica. Ambos os modelos, aliás, utilizam um modus de injeção traumática, que poderia, por si só, causar um trauma de injeção e uma quebra de barreira hematoencefálica (BBB) e, assim, levar a um recrutamento descontrolado de células inflamatórias para o parenchyma. Ambos os estudos, além disso, demonstraram desmielinização restrita a uma área limitada, no córtex ipsilateral, ou nas proximidades do local da injeção de citocina.
Para superar essas limitações, implantamos um cateter no córtex parietal direito dos ratos da DA, com a ponta do cateter localizada logo acima do corpus calosum. Para permitir uma recuperação completa da integridade do BBB, os animais foram autorizados a um período de descanso de 2 semanas após a implantação do cateter. Posteriormente, os ratos foram sub clinicamente imunizados com 5 μg de MOG recombinante1-125 em IFA. Após a obtenção de um titer de anticorpos anti-MOG estável após cerca de 4 semanas, 2 μL de mistura de citocinas foi injetado através do cateter dentro de 10 minutos usando uma bomba de seringa programável. Este procedimento provocou uma demyelinação cortical generalizada tanto dos hemisférios cerebrais ipsi quanto dos hemisférios cerebrais contralaterais em 15 dias, com uma remielinação parcial em torno de 30 dias após a injeção de citocina43. Várias fases de desmielinização poderiam, além disso, ser induzidas pela administração repetida de citocinas pró-inflamatórias através do cateter, e atrofia cerebral global, uma característica comum dos subtipos progressivos deESM 45,poderia ser induzida logo após a segunda fase de desmielinização43. É importante ressaltar que o cateter implantado também pode ser usado para testar intervenções farmacológicas.
O protocolo descrito abaixo fornece uma explicação detalhada das etapas experimentais para uma geração reprodutível de desmielinização cortical generalizada em ambos os hemisférios cerebrais de ratos da DA usando um cateter intracerebral.
Protocolo
Todos os métodos descritos aqui foram aprovados pelas autoridades locais (Bundesministerium für Wissenschaft und Forschung (Ministério da Ciência e Pesquisa austríaco); Número da Licença: 66.010/0132-WF/V/3b/2014). Os ratos machos adultos (10 - 12 semanas de idade) foram alojados em um ciclo claro/escuro de 12/12 horas com livre acesso a comida e água.
1. Preparação do material
NOTA: A cirurgia é realizada sob condições assépticas. Antes de começar, certifique-se de que todos os instrumentos cirúrgicos, incluindo as brocas, sejam limpos com um desinfetante apropriado.
- Prepare uma mistura anestésica: 0,02 mg/mL de fentanil, 0,4 mg/mL de midazolam e 0,2 mg/mL de medetomidina (concentrações finais na mistura).
NOTA: Consulte a respectiva seção Discussão para anestésicos alternativos. - Prepare uma mistura de antídoto: 0,07 mg/mL de flumazenil e 0,42 mg/mL de atipamezole (concentrações finais na mistura).
- Monte o cateter e a tampa do cateter com a entrada e o parafuso. Corte o cateter para um comprimento de 2 mm com um bisturi(Figura 1).
NOTA: Não utilize tesouras para isso, pois elas apertam e distorcem a forma transversal circular da ponta do cateter.
2. Preparação Cirúrgica
- Anestesiar o rato por uma administração intraperitoneal (i.p.) da mistura anestésico (1,5 mL/kg de peso corporal).
- Raspe a cabeça do rato entre as orelhas usando a máquina de barbear elétrica. Coloque um cobertor homeotérmico na estrutura estereotática antes de posicionar o animal, para evitar hipotermia durante toda a cirurgia.
- Imobilize a cabeça do rato na estrutura estereotática usando as barras de ouvido e a placa de mordida, garantindo que a cabeça esteja horizontal e estável. Verifique a estabilidade aplicando pressão no crânio com dedo ou fórceps.
NOTA: Uma fixação frouxa e um posicionamento não horizontal dentro do quadro estereotático podem causar um desvio das coordenadas pretendidas. - Aplique colírios lubrificantes para evitar o ressecamento da córnea durante a cirurgia. Cubra os olhos com um material opaco para evitar qualquer exposição cirúrgica à luz.
- Limpe a área raspada alternando a aplicação de 70% de etanol e 10% de complexo de iodo povidone.
NOTA: Siga todas as medidas de precaução durante a cirurgia para evitar a infecção. A cirurgia é realizada sob condições assépticas. Se a assepsia for quebrada, então o material contaminado tem que ser substituído.
3. Implantação de cateter
- Faça uma incisão longitudinal de cerca de 2 cm de comprimento no meio da pele da cabeça. Use grampos de buldogue para segurar a pele para os lados. Para obter uma visão geral dessas etapas, consulte a Figura 2.
- Remova o sangue usando um aplicador com ponta de algodão.
- Remova o periosteum do crânio. Limpe o tecido com o aplicador de ponta de algodão e exponha o osso do crânio. Deixe o crânio secar por cerca de 1 min.
- Identifique os marcos anatômicos, Lambda, Bregma e sutura medial. Com a broca instalada no quadro estereotático, posicione a ponta da broca na Bregma como ponto de partida. Mova 2 mm posteriores do Bregma e mova ~2,4 mm lateralmente para a sutura medial.
- Faça um orifício de 0,5 mm de diâmetro para o cateter nesta posição. Gentilmente soprar qualquer pó de osso.
NOTA: É importante que a dura-máter permaneça intacta durante a perfuração. Para garantir isso, 1) use uma broca que possa ser instalada no quadro estereotático, 2) inspecione o orifício com frequência durante a perfuração, e 3) forre em pequenos degraus - se muita pressão for aplicada no crânio, a ponta da broca continuará e danificará o cérebro quando o crânio estiver totalmente penetrado. - Furar 3 outros furos (~1,3 mm de diâmetro) para a âncora parafusos a poucos milímetros de distância do primeiro orifício. Gentilmente soprar pó de osso.
NOTA: Selecione os locais do parafuso de ancoragem que forneçam espaço suficiente para a parte superior do cateter (~2 mm de diâmetro) e as tampas do parafuso da âncora (~1 mm). - Remova o pó ósseo por irrigação com cerca de 1 - 2 mL de soro fisiológico tamponado (PBS) ou soro fisiológico usando uma seringa. Limpe o crânio. Aperte os parafusos da âncora por 2 a 3 voltas completas.
NOTA: Os parafusos de âncora são necessários para estabilizar a configuração segurando o cimento dentário e, assim, o cateter, no lugar. Ao apertar um parafuso de âncora, certifique-se de que ele não é facilmente removível levantando-o suavemente para cima com fórceps. Uma vez que a implantação do cateter em si causa trauma tecidual, lesões adicionais de dura durante a perfuração ou aperto dos parafusos de âncora levarão a múltiplas lesões traumáticas, e possivelmente dificultarão a comparabilidade dentro de um grupo. Aperte primeiro os parafusos da âncora e insira o cateter por último. - Insira o cateter de comprimento de 2 mm através do primeiro orifício, perpendicular à superfície do crânio. Enquanto ainda segura o cateter, aplique um pouco de cimento dental e deixe polimerizar com uma breve (~5 s) exposição à luz de cura dentária para estabilizar o cateter, permitindo o uso de ambas as mãos na próxima etapa.
ATENÇÃO: Ao trabalhar com uma luz de cura dentária, evite olhar diretamente para a ponta, ou para a luz refletida da área de aplicação, pois a alta intensidade desta luz pode causar danos na retina. Use óculos de proteção apropriados. - Aplique mais cimento dentário ao redor do cateter, ancore os parafusos e solidifique o cimento dental com a luz de cura dental (~15 - 30 s). Confirme o endurecimento do cimento com a ponta de um fórceps.
4. Fechamento da Ferida e Antagonização da Anestesia
- Feche a pele da cabeça com suturas resorbáveis, anteriores e posteriores ao cateter.
NOTA: Uma vez que haverá uma configuração esburacada sobre o crânio no final da implantação, faça o fechamento da ferida em conformidade. Levantar demais a pele resultará em desconforto para o animal. - Injete a mistura de antídoto subcutânea (1,5 mL/kg de peso corporal) usando uma seringa de 1 mL com uma agulha de 26 G.
- Administrar enrofloxacina (2,5%) por injeção subcutânea (peso corporal de 7,5 mg/kg) para tratamento profilático antibiótico. Administrar o carprofeno (1 mg/mL; 5 mg/kg de peso corporal) e buprenorfina (1,2 mg/kg) para alívio da dor por injeção subcutânea.
5. Cuidados e Medicamentos Pós-Operatórios
- Devolva o animal à gaiola modificada e mantenha-o sob observação por 1 - 3 h, com uma aplicação de luz infravermelha para evitar hipotermia. Observe e reposicione constantemente o animal a cada 5 a 10 minutos até a recuperação pós-operatória. Tome cuidado especial para evitar a exposição constante da luz aos olhos até a recuperação.
- Repita as administrações enrofloxacina (7,5 mg/kg de peso corporal) e carprofeno (1 mg/mL; 5mg/kg de peso corporal) por injeções subcutâneas no dia seguinte à cirurgia. Buprenorfina não é necessário para ser atualizado, pois o tratamento anterior é eficaz por 72 horas.
6. Preparação da Mistura de Imunização (nos primeiros 14 dias após a implantação do cateter)
Nota: Coloque as seringas no gelo durante o procedimento de preparação.
- Conecte duas seringas de vidro luer de 10 mL nos braços curtos de uma torneira de 3 vias e feche a terceira tomada com o braço longo.
- Certifique-se de que as conexões estão seguras e livres de vazamentos: adicione aproximadamente 4 mL de PBS estéril à seringa aberta enquanto segura o pistão 2. Insira o pistão 1 e empurre os dois pistões para frente e para trás enquanto verifica se há vazamentos. Se não ocorrer vazamento, descarte o PBS e remova novamente o pistão 1.
- Pipeta 1 mL de IFA e 50 μg de rMOG1-125 juntos e ajustar a mistura a um volume final de 2 mL com PBS estéril (pH 7.4) em um tubo adequado.
NOTA: Devido às perdas de emulsão nas pontas ou paredes de seringas durante a preparação, prepare um volume maior do que o pretendido para a administração. É igualmente mais prático se preparar para mais de 1 animal de uma só vez. - Coloque a mistura IFA diluída e rMOG1-125 na seringa aberta. Insira o pistão suavemente mantendo uma pressão solta no pistão oposto(Figura 3A).
- Emulsione o inóculo dirigindo-o de uma seringa para outra empurrando os pistões para frente e para trás, até que seja branco e viscoso(Figura 3B).
- Fixar uma seringa de bloqueio Luer de 1 mL no braço curto aberto da torneira de 3 vias e preenchê-la com inóculo(Figura 3C). Distribua todas as seringas inóculos a 1 mL. Mantenha-o no gelo até a injeção. Administre a mistura no dia da preparação.
7. Imunização
- Anestesiar o rato com isofluorane em uma câmara (~2 min, misturado com oxigênio 2 L/min) e, em seguida, sustentar anestesia através de uma máscara (misturada com oxigênio 1,5 L/min).
- Injete 200 μL de inóculo subcutâneamente na base traseira usando uma agulha de 21 G.
NOTA: Administre a injeção lentamente, pois a solução é viscosa.
8. Determinação de Titulantes de Anticorpos
- Retire ~200 μL de sangue 4 semanas após a imunização, a fim de determinar os títulos de anticorpos anti-MOG.
- Cubra os poços de uma placa de 96 poços com MOG (5 μg/mL em PBS) e incuba-os por 1h a 37 °C.
- Bloqueie a placa com 1% de albumina de soro bovino (BSA) na PBS por 1h em temperatura ambiente.
- Incubar a placa com soro de rato (1:50) e padrá-la por 2h a 37 °C. Lave a placa 3x com 200 μL de PBS/Polysorbate 20.
- Incubar a placa com rabanete peroxidase-conjugado anticorpo secundário IgG (1:10.000). Lave a placa 3x com 200 μL de PBS/Polysorbate 20.
- Adicione 100 μL de solução de substrato peroxidase por poço e incuba-a por 20 a 30 minutos no escuro à temperatura ambiente.
- Meça a densidade óptica em um comprimento de onda de 405 nm e calcule o títulor de anticorpos a partir da densidade óptica usando uma curva padrão.
9. Injeção de Citocina intracerebral
- Ajuste o comprimento da cânula do conector (2 mm). (Veja a Figura 4 para as etapas de preparação.)
- Encha uma seringa de 1 mL com a mistura de citocina (500 ng/μL de TNF-alfa, 300 U/μL de rato recombinante IFN-gama em PBS estéril). Conecte a seringa a uma cânula conectora. Encha a cânula com a mistura de citocinas. Evite bolhas.
- Monte a seringa na bomba de seringa programável e programe-a para injetar 0,2 μL/min(Figura 5A). Inicie a bomba e mantenha-a funcionando para evitar uma formação de bolha de ar na ponta da cânula.
NOTA: A velocidade de injeção deve levar em conta o diâmetro interno da seringa específica utilizada; assim, o diâmetro da seringa deve ser registrado durante a instalação da bomba. - Anestesiar o rato com isoflurane em uma câmara (~2 min, misturado com 2 L/min de oxigênio) e, em seguida, sustentar a anestesia através de uma máscara (misturada com 1,5 L/min de oxigênio) (Figuras 5B e 5C). Aplique colírios lubrificantes, pois o animal será anestesiado por pelo menos 30 minutos.
- Remova a tampa do cateter com a entrada. Insira a cânula do conector no cateter e no parafuso e aperte-a(Figuras 5D e 5E).
NOTA: Não aperte demais, pois isso destruirá a ponta superior do cateter. - Deixe a injeção proceder por 10 minutos (o volume total de injeção é de 2 μL). Pare a bomba. Deixe a cânula dentro do cateter por 20 minutos para permitir que o volume injetado seja totalmente difuso.
- Desaparafusar a cânula do conector e removê-la lentamente para evitar um efeito de vácuo.
- Recoloque a tampa do cateter com a entrada e enrosque-a. Permita que o animal se recupere da anestesia em uma gaiola.
Resultados
A demyelinação cortical poderia ser avaliada em diferentes momentos após uma injeção de citocina por imunohistoquímica para proteína proteolipida (PLP)(Figura 6). A Figura 6A mostra imunoreatividade PLP intacta no dia 15 em um animal de controle imunizado pelo MOG que recebeu apenas PBS estéril através do cateter implantado. No primeiro dia após a injeção de citocina, a dessalinização já podia ser detectada em animais preparados pelo MOG, embora apenas nas proximidades da área cateterizada(Figura 6B). A imunoreatividade PLP permanece intacta no córtex contralateral de 1 dia de injeção pós-citocina. No dia 3, foi observado um aumento gradual da perda da imunoreatividade PLP, que se espalha no córtex ipsilateral (Figura 6C). A desmielinização cortical contralateral também pode ser detectada no dia 3(Figura 6D),mas é bastante restrita à área abaixo dos parafusos de âncora, possivelmente devido a uma área de baixo fluxo de fluido intersticial causada pelos parafusos de âncora43. A ausência de observação semelhante nos animais de controle injetados pela PBS exclui a possibilidade de desmielinização induzida por trauma decorrente do parafuso de âncora.
Entre os dias 9 e 15, a dessalinização afeta grande parte do córtex de ambos os hemisférios (Figuras 6E, 6Fe 6G). Isso coincide com uma observação de comportamento lento, embora sem uma diminuição estatisticamente significativa nas habilidades motoras em um teste rotarod43. A demyelinação cortical é sustentada por até 30 dias de injeção pós-citocina em ambos os hemisférios(Figuras 6H e 6I) com apenas uma remielinização parcial. A Figura 6J mostra uma quantificação da perda de PLP na matéria cinzenta cortical após a injeção de citocina intracerebral. Deve-se notar que a imunoreatividade PLP ainda não foi avaliada após períodos superiores a 30 dias; assim, a resolução instantânea da remielinação, se houver alguma, permanece a ser avaliada por mais experimentações. Uma segunda administração da mistura de citocina através do cateter implantado 30 dias após a primeira injeção resulta em atrofia cerebral marcada no dia 15(Figura 7).

Figura 1: Preparação do cateter. (A e B) A cânula guia e a cânula manequim (tampa do cateter com entrada) são montadas e aparafusadas. (C) Em seguida, o cateter é cortado para 2 mm de tamanho com a ajuda de um bisturi. A observação microscópica mostrou que o uso de tesouras para esse fim distorce a forma circular da ponta da cânula e, assim, deve ser evitado. Clique aqui para ver uma versão maior desta figura.
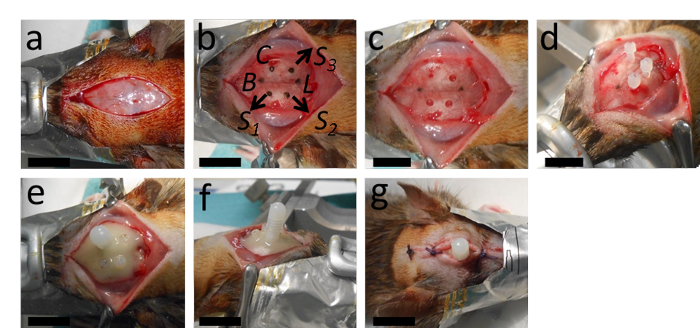
Figura 2: Implantação do cateter. (A) A cirurgia começa com incisão longitudinal e remoção do periósteo. (B, C) Este painel mostra a marcação do local para o cateter a 2 mm posterior de Bregma e 2,4 mm lateral à direita a partir da sutura sagital; bem como os locais para os orifícios destinados aos três parafusos de ancoragem com uma distância adequada do cateter e lambda. (D) Após a perfuração do orifício do cateter (diâmetro de 0,5 mm, com ponta redonda de broca) e os orifícios para os parafusos de ancoragem (1,3 mm de diâmetro com uma ponta de broca torcida), os parafusos de âncora são apertados. (E, F) Em seguida, o cateter é inserido e toda a configuração é estabilizada com cimento dentário polimerizador. (G) A ferida é costurada com dois ou três nós anteriores e posteriores ao cateter. B = Bregma; L = Lambda; C = Cateter; S1, S2 e S3 = lugares para os orifícios para os três parafusos de ancoragem. As barras de escala = 1 cm. Clique aqui para ver uma versão maior desta figura.
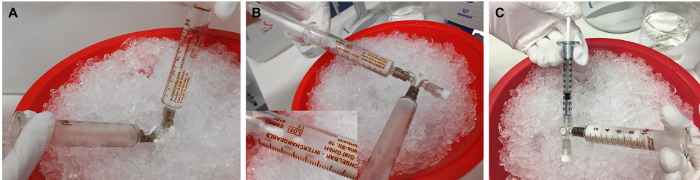
Figura 3: Preparação da emulsão rMOG/IFA. (A) A mistura de rMOG, PBS e IFA é emulsificada pressionando o inóculo de uma seringa para outra empurrando os pistões para frente e para trás,(B) até que seja branco e viscoso. (C) Posteriormente, o inóculo é distribuído para seringas de 1 mL para a injeção. 5 μg de rMOG é usado em 200 μL de mistura PBS/IFA para subisfizar clinicamente um rato; no entanto, devido às perdas nas pontas e paredes das seringas durante a preparação, um volume maior deve ser preparado. Clique aqui para ver uma versão maior desta figura.

Figura 4: Preparação da cânula do conector. (A - D) Estes painéis mostram como um conector e um interno são montados com uma cânula de guia de modelo de tamanho de 2 mm. (E) O interno é cortado para o mesmo tamanho da cânula guia com a ajuda de um bisturi (F) e o guia de modelo é então desparafusado. (G) A outra extremidade da cânula do conector é fixada em uma seringa de 1 mL, que contém a mistura de injeção, com uma agulha de 20 G. As barras de escala = 3 cm. Clique aqui para ver uma versão maior desta figura.

Figura 5: Injeção intracerebral. (A) Uma bomba de seringa programável é ajustada para uma velocidade de injeção de 2 μL/min, e a seringa de 1 mL cheia de mistura de citocina (ou PBS estéril para os controles) é montada na bomba. (B) O animal é primeiro anestesiado na câmara usando 5% de isoflurano com um fluxo de oxigênio de 2 L/min e, em seguida (C)a anestesia é sustentada através da máscara usando 2,5% de isoflurano com um fluxo de oxigênio de 1,5 L/min. (D) A tampa do cateter com a entrada (a cânula falsa) está aparafusada e a cânula de injeção é inserida através do cateter implantado. Como o volume da injeção é muito pequeno, o investigador deve ser cauteloso para evitar bolhas de ar na ponta da cânula. Por essa razão, é importante iniciar a inserção enquanto a bomba estiver em funcionamento e somente quando houver uma bolha líquida crescente na ponta. O volume extra não vai para o cérebro de qualquer maneira, como ele quebra em cima do cateter antes da inserção. (E) Em seguida, a cânula do conector é apertada, e a bomba é solta para funcionar por 10 minutos. Após 10 minutos de injeção, a bomba é parada, e a cânula é deixada dentro por 15 a 20 minutos para permitir a difusão do volume injetado ao fluido intersticial. As barras de escala = 5 cm, a menos que indicado o contrário. Clique aqui para ver uma versão maior desta figura.
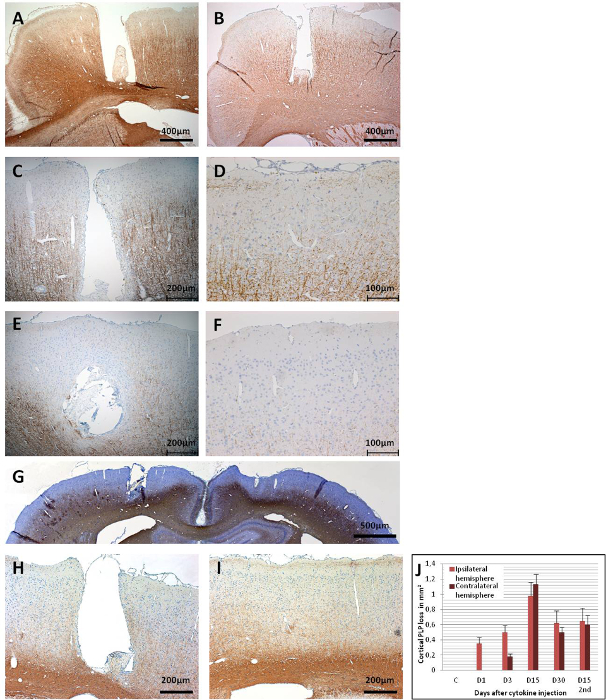
Figura 6: Imunoreatividade PLP em seções cerebrais coronais. (A) Este painel mostra um cérebro de controle (MOG-primed) com uma injeção de PBS (dia 15), o que não resulta em uma demyelinação cortical. (B) Já no primeiro dia de injeção pós-citocina, a desmielinização é aparente na área do cateter. (C) Observa-se uma perda mais ampla da imunoreatividade PLP no córtex ipsilateral no dia 3,(D)e no lado contralateral. A perda generalizada da imunoreatividade PLP é observada em ambos os hemisférios no dia 15, poisestepainel mostra o córtex ipsilateral e (F) este painel mostra o córtex contralateral. (G) Uma visão geral de ambos os hemisférios é dada ao mostrar a perda generalizada de PLP no dia 15. No dia 30, como (H) este painel mostra o córtex ipsilateral e (I) este painel mostra para o córtex contralateral, ainda há notável desmamlinização, mas também algumas áreas remielinadas poderiam ser observadas. (J) Este painel mostra a quantificação da desmielinização (perda de PLP em mm2/hemisfério). Foram utilizadas seções cerebrais coronal de 1,5 - 2 μm para a detecção de PLP com anti-PLP ms com fator de diluição de 1:500. As seções foram contra-manchadas com hematoxilina para núcleos celulares. Para obter informações detalhadas sobre a imunohistoquímica, consulte Ucal et al. 43. Os painels G e J foram modificados de Ucal et al. 43. Clique aqui para ver uma versão maior desta figura.
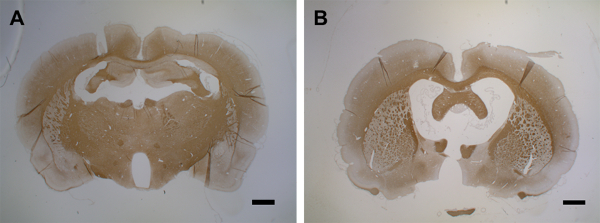
Figura 7: Atrofia cerebral após segunda injeção de citocina. (A) Este painel mostra um cérebro de controle (MOG-primed) com uma injeção de PBS (dia 15). (B) No dia 15 após a primeira injeção de citocina, uma segunda injeção leva à atrofia cerebral dentro de 15 dias. Foram utilizadas seções cerebrais coronal de 1,5 - 2 μm para a detecção de PLP com anti-PLP ms com fator de diluição de 1:500. As seções foram contra-manchadas com hematoxilina para núcleos celulares. Para obter informações detalhadas sobre a imunohistoquímica, consulte Blakemore37. As barras de escala = 500 μm. Clique aqui para ver uma versão maior desta figura.

Figura 8: Gaiolas modificadas para evitar a remoção do cateter pelo animal. Nas gaiolas padrão, o espaço do portador de alimentos na grade está localizado mais perto do fundo da gaiola, criando um espaço estreito arriscado que aumenta a chance do cateter se emaranhar com a grade e, assim, sua remoção. Para evitar isso, a gaiola precisa ser modificada. Este espaço estreito foi bloqueado com um plano transparente, permitindo a observância do animal. A comida tem que ser dada dentro da gaiola nestas gaiolas modificadas. Clique aqui para ver uma versão maior desta figura.
Discussão
Nosso método usa ratos da promotoria. A adaptação aos ratos provavelmente exigirá o uso de um cateter menor e parafusos. Deve-se também ter em mente que o curso da doença, a resposta inflamatória e a extensão da desmielinização podem diferir do que é apresentado aqui se uma espécie/cepa diferente for usada. Tais diferenças têm sido observadas com modelos clássicos da EAE utilizando diferentes cepas de camundongos. MOG92-106 de origem de rato, por exemplo, resultou em EAE progressiva primária progressiva ou secundária em camundongos A.SW, enquanto induziu a recaída-remissão EAE em ratos SJL/J46. Os animais da mesma cepa devem, portanto, ser utilizados. Diferenças de gênero na manifestação da EAE também foram relatadas em vários estudos anteriores24. A ocorrência de tais efeitos de gênero poderia muito bem ser esperada para o protocolo aqui descrito ainda a ser validado em outros experimentos.
A administração intraperitoneal (IP) de uma mistura de anestésicos composta por 0,02 mg/mL de fentanil, 0,4 mg/mL de midazolam e 0,2 mg/mL de medetomidina é utilizada para a intervenção cirúrgica. Ratos da da da macho adulto pesando 270 - 300 g requerem cerca de 0,4 - 0,6 mL desta mistura (ouseja, ~1,5 mL/kg) para induzir uma anestesia com duração de 60 a 90 min. Após a cirurgia, a anestesia é antagonizada por uma injeção subcutânea de um antídoto composto por 0,07 mg/mL de flumazenil e 0,42 mg/mL de atipamezole em soro fisiológico (0,9% NaC). Uma dose de 1 - 1,5 mL/kg antagoniza a anestesia dentro de 5 min. Alternativamente, os animais podem acordar espontaneamente sobre uma lavagem fisiológica dos anestésicos, mas nesse caso, os animais precisariam ser mantidos sob observação até estarem totalmente conscientes.
Outras opções de anestesia frequentemente utilizadas para cirurgias animais, como injeção ip de cetamina e xilazina47 ou pentobarbital de sódio48, ou uma inalação de anestésicos voláteis como isofluorano49 e halotano50,também podem ser consideradas para a cirurgia apresentada aqui. É fundamental, no entanto, escolher um agente anestésico que não interfira na intervenção a jusante pretendida.
Durante a imunização e injeção de citocina intracerebral, 5% de isoflurane é usado para a anestesia. O modelo descrito aqui foi estabelecido usando ratos, e os detalhes experimentais listados são, portanto, especificamente aplicáveis ao rato. As coordenadas de implantação do cateter foram selecionadas para permitir a análise simultânea de possíveis alterações de matéria branca (a ponta do cateter no caloso corpus). Embora o local de inserção do cateter possa ser variado em relação à posição anteroposterora e lateral, a seleção do sulco central requer a prevenção de danos ao seio sagital superior.
Outra característica do método descrito é a desmielinização equivalente dos hemisférios ipsi e contralateral, possivelmente resultante do transporte da mistura de citocina injetada ao espaço subaracnóide pelo fluxo fisiológico do fluido intersticial das regiões corticais51. O modo de injeção, e não a localização do cateter, portanto, causa desmielinização em todo o córtex cerebral, e a escolha do córtex parietal direito ou esquerdo deve, portanto, ser imaterial a esse respeito.
O protocolo usa um cateter de 26 G, que é pequeno o suficiente para evitar lesões traumáticas extensas e grande o suficiente para evitar um aumento da taxa de entupimento da ponta do cateter ao longo do experimento. Certamente, a implantação e a presença do próprio cateter causam ativação astróicica e microglial, também nos animais de controle que recebem apenas a implantação do cateter; no entanto, isso é menor quando comparado com os animais injetados por citocinas. 43 Para evitar qualquer interferência com análises subsequentes, utilizamos cateteres compatíveis com ressonância magnética feitos de poli-éter-cetona (PEEK).
Uma profundidade semelhante de desmielinização é, de fato, criada tanto nas regiões ipsi quanto contralateral com o método apresentado. Isso implica que a profundidade/comprimento do cateter pode não desempenhar um papel importante no padrão e extensão da desmielinização no córtex. Portanto, uma modificação do comprimento do cateter pode ser considerada para reduzir o tamanho da lesão induzida pelo cateter. No entanto, um comprimento de cateter significativamente mais curto pode causar uma demyelinação cortical ligeiramente menos pronunciada, enquanto uma resposta conclusiva só seria obtida por experimentos especificamente testando o comprimento do cateter.
Uma vantagem do modelo é que o cateter implantado permite o teste de potenciais terapêuticas administradas no córtex através do cateter para permitir a remielinação no ou após o pico da demyelinação cortical histologicamente detectável (dia 15 ou posterior), enquanto em um ajuste pré-tratamento isso seria após a imunização, mas antes da injeção de citocina. A decisão sobre o prazo em que a terapêutica seria administrada, portanto, dependerá da questão da pesquisa particular e da droga de interesse.
Após a implantação do cateter, é importante abrigar animais solteiros nas gaiolas modificadas (preferencialmente superiores) modificadas, a fim de evitar a remoção do cateter até o final do estudo(Figura 8). Os animais também podem desaparafusar a tampa do cateter com a entrada, embora isso raramente aconteça. Os animais devem ser observados diariamente e as tampas removidas devem ser substituídas por novas, para evitar o bloqueio da ponta do cateter na ausência de uma entrada e para garantir uma entrega precisa no parenchyma após a injeção intracerebral. Os animais são imunizados nas duas primeiras semanas após a implantação do cateter para permitir a cicatrização e fechamento da barreira hemencefálica.
Os títulos de anticorpos anti-MOG devem ser medidos após a imunização. Um experimento de dose-resposta mostrou que 5 μg de MOG1-125 (em IFA) forneceram imunização suficiente dentro de 4 semanas em ratos adultos da promotoria. Um título de 5.000 μg/mL e superior seria suficiente, mas certamente dependerá de vários fatores, incluindo a preparação do MOG e a cepa animal e, portanto, terá que ser determinado individualmente. É importante evitar doses excessivamente altas de antígeno, resultando em um fenótipo clássico da EAE com membros traseiros paralisados mesmo antes da injeção de citocina.
Cada animal é imunizado com 5 μg de oligodendrocyte de mielina recombinante (rMOG1-125) emulsionado em 200 μL de Adjuvante de Freund incompleto (IFA). Uma vez que parte da emulsão é perdida dentro da seringa durante a preparação, é aconselhável preparar mais do que essa quantidade para cada animal. Utilizamos MOG recombinante (1-125 do N-terminus of rat MOG), que foi expresso em Escherichia coli e foi então purificado à homogeneidade por cromatografia de quimlate, dissolvida em 6 M de ureia, e dialisada contra PBS para obter uma preparação fisiológica52,53. MoG comercialmente disponível, no entanto, também pode ser usado.
Outras preparações de antígeno, como MOG1-116, MOG35-55 ou PLP139-151 são usadas em vários modelos de EAE, e diferenças de antígeno e cepa animal são conhecidas por induzir fenótipos de doenças distintas nestes modelos20. Estas preparações de antígeno não foram testadas em ratos da DA e, se utilizadas em preferência para rMOG1-125,podem induzir um fenótipo da doença ou resultados de histologia diferentes do que é apresentado aqui.
Uma cânula conectora do mesmo comprimento do cateter é preparada antes da injeção intracerebral. Isso pode ser feito montando-o com um cateter de modelo e cortando-o para o mesmo tamanho (2 mm de comprimento)(Figura 4). É importante que a cânula do conector seja livre de bolhas de ar durante a injeção de citocinas - porque o volume de injeção é de apenas 2 μL, mesmo uma pequena bolha de ar na ponta da cânula reduzirá significativamente o volume do líquido entregue com sucesso no cérebro. Isso é conseguido mantendo a bomba funcionando e inserindo a cânula somente quando uma gota crescente de líquido de injeção está presente na ponta. Após a inserção da cânula, o conector é aparafusado ao cateter, evitando o apertaramento para não danificar a ponta superior do cateter, o que dificultará a recapitulação após a injeção. Uma velocidade de injeção de 0,2 μL/min é usada para evitar traumas induzidos por injeção. Além disso, uma injeção lenta, combinada com um período de espera de 20 minutos após a injeção, garante a difusão do líquido injetado no fluido intersticial e uma drenagem efetiva para o CSF. A cânula é então removida lentamente para evitar um efeito de vácuo.
O método relatado inclui intervenção cirúrgica e, portanto, requer pessoal capaz de realizar cirurgia de sobrevivência estereotática. O pessoal em contato direto com os animais deveria ter feito os cursos adequados de experimentação animal. O restante do protocolo pode ser realizado por membros competentes do laboratório.
O método destina-se a produzir a desmielinização desencadeada pela inflamação do córtex cerebral e não reproduz todas as características da ESM humana (por exemplo,a ocorrência de lesões focais inflamatórias de matéria branca, que é uma marca registrada da ESM humana).
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer a todos os funcionários do Instituto de Pesquisa Biomédica da Universidade Médica Graz por sua ajuda e cooperação, bem como Christopher John Wrighton pela revisão do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Adult male Dark Agouti rats (300 ±25 g) | |||
| Fentanyl | Hameln pharma plus, Germany | as Fentanyl-Citrate, 50 µg/ml | |
| Midazolam | ERWO Pharma, Austria | 50039017 | 5 mg/ml |
| Medetomidin | Orion Pharma, Finland | as Medetomidin hydrochloride, 1mg/ml | |
| Flumazenil | Roche, Switzerland | 0.1 mg/ml | |
| Atipamezol | Orion Pharma, Finland | as Atipamezol hydrochloride, 5 mg/ml | |
| 10% povidone-iodine complex | Mundipharma, Austria | ||
| Dental cement | Heraeus Kulzer, Germany | 6603 7633 | |
| Physiological saline solution | Fresenius Kabi, Austria | 0.9% NaCl | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Germany | P3813 | |
| Isofluorane | AbbVie, Austria | ||
| Lubricating eye drops | Thea Pharma, Austria | ||
| 70% EtOH | Merck, Germany | 1070172511 | Absolute ethanol was diluted in ddH2O for preparation of 70% v/v |
| 2.5% enrofloxacin | Bayer, Germany | Prophylactic antibiotics | |
| carprofen | Pfizer, USA | Painkillers, 50 mg/ml | |
| Tween-20 | Sigma-Aldrich, Germany | P9416 | |
| Pentobarbital | Richter Pharma, Austria | pentobarbital sodium, 400 mg/ml | |
| Interferon gamma | PeproTech, USA | 400-20 | |
| Tumor necrosis factor alfa | R&D Systems, USA | 510-RT-050/CF | |
| rMOG1-125 | own product at the Centre of Molecular Medicine, Karolinska Institute, Sweden | Recombinant rat myelin oligodendrocyte glycoprotein, amino acids 1-125 from the N-terminus, also commercially available: AnaSpec, AS-55152-500, USA | |
| Anti-MOG antibody | Ana Spec/Kaneka Corporation, Japan | AS-555157 | Standard from ELISA-Kit; Ana Spec/Kaneka |
| Incomplete Freund’s adjuvant | Sigma-Aldrich, Germany | F5506 | |
| Horse radish peroxidase conjugated anti-rat IgG secondary antibody | Ana Spec/Kaneka Corporation, Japan | AS-555157 | Secondary Antibody from ELISA-Kit; Ana Spec/Kaneka Corporation |
| Bovine serum albumin | Sigma-Aldrich, Germany | A9576 | |
| Peroxidase substrate solution | Vector Laboratories, USA | SK-45000 | |
| Stereotactic frame | David Kopf Instruments, USA | ||
| Catheters, MRI suitable | PlasticsOne, USA | 8IC315GPKXXC | |
| Dummy cannulas | PlasticsOne, USA | 8IC315DCNSPC | |
| Plastic screws, MRI suitable | PlasticsOne, USA | 8L080X093N01 | |
| Connector cannula | PlasticsOne, USA | 8IC313CXSPCC | |
| Screw driver with 2mm tip-size | |||
| Drill with flexible shaft extension | Proxxon, Germany | NO 28 472, NO 28 706, NO 28 620, | |
| Drill bit, round, 0.5 mm | Hager & Meisinger, Germany | REF310 104 001 001 009 | |
| Drill bit, twisted, 1.3 mm | Hager & Meisinger, Germany | REF350 104 417 364 013 | |
| Scalpel | Braun, Germany | BB510 | |
| Scalpel handle | Fine Science Tools, Germany | 91003-12 | |
| Cotton tip applicator | Henry Schein Medical, Austria | 900-3155 | |
| Surgical scissors | Fine Science Tools, Germany | 14101-14, 14088-10 | |
| Surgical forceps | Fine Science Tools, Germany | 11002-12, 11251-35 | |
| Bulldog clamps | Fine Science Tools, Germany | 18050-35 | |
| Homoeothermic blanket | TSE systems, Germany | ||
| Infrared Lamp | Beurer, Germany | 616.51 | |
| Dental curing light | Guilin Woodpecker Medical, China | ||
| Absorbable suture | Johnson & Johnson, Belgium | V792E | |
| Programmable syringe pump | World Precision Instruments, USA | AL-1000 | |
| Exam gloves | |||
| Surgical gown | |||
| Electric Shaver | Aesculap, Germany | GT420 | |
| Volatile anesthetic vaporizer | Rothacher Medical, Switzerland | CV 30-301-D | |
| Oxygen source for volatile anesthetic vaporizer | Air Liquide, Austria | 19,113 | |
| Volatile anesthesia chamber | Rothacher Medical, Switzerland | PS-0347 | |
| Anesthesia mask for rats | Rothacher Medical, Switzerland | PS-0307-A | |
| 1 ml syringe | Codan, Denmark | REF 62.1612 | |
| 26 Gauge needle for injection | Braun, Germany | 4657683 | |
| 20 Gauge needle for cytokine injection and immunization | Braun, Germany | 4657519 | |
| Luer lock tip glass syringes | Poulten & Graf, Germany | 7.140-37 | |
| 3 way stopcock | Becton Dickinson, Sweden | 394600 | |
| 96-well plate | Thermo Fisher Scientific, USA | 442404 | |
| Plate reader | Cole-Parmer, USA | EW-1396-00 | |
| 37°C incubator | Kendro, Germany | 50042301 | |
| Micropipettes | Gilson, USA | F167350 |
Referências
- Berkovich, R. Treatment of acute relapses in multiple sclerosis. Neurotherapeutics. 10 (1), 97-105 (2013).
- Kalincik, T. Multiple Sclerosis Relapses: Epidemiology, Outcomes and Management. A Systematic Review. Neuroepidemiology. 44 (4), 199-214 (2015).
- Feinstein, A., Freeman, J., Lo, A. C. Treatment of progressive multiple sclerosis: what works, what does not, and what is needed. The Lancet Neurology. 14 (2), 194-207 (2015).
- Montalban, X., et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. The New England Journal of Medicine. 376 (3), 209-220 (2017).
- Dyment, D. A., Ebers, G. C., Sadovnick, A. D. Genetics of multiple sclerosis. The Lancet Neurology. 3 (2), 104-110 (2004).
- Ascherio, A. Environmental factors in multiple sclerosis. Expert Review of Neurotherapeutics. 13, 3-9 (2013).
- Allen, I. V., McQuaid, S., Mirakhur, M., Nevin, G. Pathological abnormalities in the normal-appearing white matter in multiple sclerosis. Neurological Sciences. 22 (2), 141-144 (2001).
- Kutzelnigg, A., et al. Cortical demyelination and diffuse white matter injury in multiple sclerosis. Brain. 128 (11), 2705-2712 (2005).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the Neurological Sciences. 233 (1-2), 55-59 (2005).
- Lucchinetti, C. F., et al. Inflammatory cortical demyelination in early multiple sclerosis. The New England Journal of Medicine. 365 (23), 2188-2197 (2011).
- Peterson, J. W., Bo, L., Mork, S., Chang, A., Trapp, B. D. Transected neurites, apoptotic neurons, and reduced inflammation in cortical multiple sclerosis lesions. Annals of Neurology. 50 (3), 389-400 (2001).
- Kutzelnigg, A., Lassmann, H. Cortical demyelination in multiple sclerosis: a substrate for cognitive deficits. Journal of the Neurological Sciences. 245 (1-2), 123-126 (2006).
- Procaccini, C., De Rosa, V., Pucino, V., Formisano, L., Matarese, G. Animal models of Multiple Sclerosis. European Journal of Pharmacology. 759, 182-191 (2015).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: a clinical and histopathological perspective. Brain Pathology. 27 (2), 123-137 (2017).
- Lebar, R., Lubetzki, C., Vincent, C., Lombrail, P., Boutry, J. M. The M2 autoantigen of central nervous system myelin, a glycoprotein present in oligodendrocyte membrane. Clinical and Experimental Immunology. 66 (2), 423-434 (1986).
- Linington, C., Bradl, M., Lassmann, H., Brunner, C., Vass, K. Augmentation of demyelination in rat acute allergic encephalomyelitis by circulating mouse monoclonal antibodies directed against a myelin/oligodendrocyte glycoprotein. The American Journal of Pathology. 130 (3), 443-454 (1988).
- Panitch, H., Ciccone, C. Induction of recurrent experimental allergic encephalomyelitis with myelin basic protein. Annals of Neurology. 9 (5), 433-438 (1981).
- Tuohy, V. K., Sobel, R. A., Lees, M. B. Myelin proteolipid protein-induced experimental allergic encephalomyelitis. Variations of disease expression in different strains of mice. The Journal of Immunology. 140 (6), 1868-1873 (1988).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1952-1960 (2006).
- Mendel, I., Kerlero de Rosbo, N., Ben-Nun, A. A myelin oligodendrocyte glycoprotein peptide induces typical chronic experimental autoimmune encephalomyelitis in H-2b mice: fine specificity and T cell receptor V beta expression of encephalitogenic T cells. European Journal of Immunology. 25 (7), 1951-1959 (1995).
- McRae, B. L., et al. Induction of active and adoptive relapsing experimental autoimmune encephalomyelitis (EAE) using an encephalitogenic epitope of proteolipid protein. Journal of Neuroimmunology. 38 (3), 229-240 (1992).
- Bebo, B. F., Vandenbark, A. A., Offner, H. Male SJL mice do not relapse after induction of EAE with PLP 139-151. Journal of Neuroscience Research. 45 (6), 680-689 (1996).
- Oliver, A. R., Lyon, G. M., Ruddle, N. H. Rat and human myelin oligodendrocyte glycoproteins induce experimental autoimmune encephalomyelitis by different mechanisms in C57BL/6 mice. The Journal of Immunology. 171 (1), 462-468 (2003).
- Scheld, M., et al. Neurodegeneration Triggers Peripheral Immune Cell Recruitment into the Forebrain. The Journal of Neuroscience. 36 (4), 1410-1415 (2016).
- Chanaday, N. L., Roth, G. A. Microglia and astrocyte activation in the frontal cortex of rats with experimental autoimmune encephalomyelitis. Neuroscience. 314, 160-169 (2016).
- Pomeroy, I. M., Matthews, P. M., Frank, J. A., Jordan, E. K., Esiri, M. M. Demyelinated neocortical lesions in marmoset autoimmune encephalomyelitis mimic those in multiple sclerosis. Brain. 128 (11), 2713-2721 (2005).
- Merkler, D., et al. Differential macrophage/microglia activation in neocortical EAE lesions in the marmoset monkey. Brain Pathology. 16 (2), 117-123 (2006).
- Storch, M. K., et al. Cortical demyelination can be modeled in specific rat models of autoimmune encephalomyelitis and is major histocompatibility complex (MHC) haplotype-related. Journal of Neuropathology and Experimental Neurology. 65 (12), 1137-1142 (2006).
- Ludwin, S. K. Central nervous system demyelination and remyelination in the mouse: an ultrastructural study of cuprizone toxicity. Laboratory Investigation. 39 (6), 597-612 (1978).
- Skripuletz, T., et al. Cortical demyelination is prominent in the murine cuprizone model and is strain-dependent. The American Journal of Pathology. 172 (4), 1053-1061 (2008).
- Norkute, A., et al. Cuprizone treatment induces demyelination and astrocytosis in the mouse hippocampus. Journal of Neuroscience Research. 87 (6), 1343-1355 (2009).
- Acs, P., et al. 17beta-estradiol and progesterone prevent cuprizone provoked demyelination of corpus callosum in male mice. Glia. 57 (8), 807-814 (2009).
- Pott, F., et al. Cuprizone effect on myelination, astrogliosis and microglia attraction in the mouse basal ganglia. Brain Research. 1305, 137-149 (2009).
- Jeffery, N. D., Blakemore, W. F. Remyelination of mouse spinal cord axons demyelinated by local injection of lysolecithin. Journal of Neurocytology. 24 (10), 775-781 (1995).
- Blakemore, W. F. Ethidium bromide induced demyelination in the spinal cord of the cat. Neuropathology and Applied Neurobiology. 8 (5), 365-375 (1982).
- Mason, J. L., et al. Oligodendrocytes and progenitors become progressively depleted within chronically demyelinated lesions. The American Journal of Pathology. 164 (5), 1673-1682 (2004).
- Franco, P. G., Silvestroff, L., Soto, E. F., Pasquini, J. M. Thyroid hormones promote differentiation of oligodendrocyte progenitor cells and improve remyelination after cuprizone-induced demyelination. Experimental Neurology. 212 (2), 458-467 (2008).
- Lassmann, H., Bradl, M. Multiple sclerosis: experimental models and reality. Acta Neuropathologica. 133 (2), 223-244 (2017).
- Kerschensteiner, M., et al. Targeting experimental autoimmune encephalomyelitis lesions to a predetermined axonal tract system allows for refined behavioral testing in an animal model of multiple sclerosis. The American Journal of Pathology. 164 (4), 1455-1469 (2004).
- Merkler, D., Ernsting, T., Kerschensteiner, M., Bruck, W., Stadelmann, C. A new focal EAE model of cortical demyelination: multiple sclerosis-like lesions with rapid resolution of inflammation and extensive remyelination. Brain. 129, 1972-1983 (2006).
- Ucal, M., et al. Widespread cortical demyelination of both hemispheres can be induced by injection of pro-inflammatory cytokines via an implanted catheter in the cortex of MOG-immunized rats. Experimental Neurology. 294, 32-44 (2017).
- Gardner, C., et al. Cortical grey matter demyelination can be induced by elevated pro-inflammatory cytokines in the subarachnoid space of MOG-immunized rats. Brain. 136, 3596-3608 (2013).
- Minagar, A., et al. The thalamus and multiple sclerosis: modern views on pathologic, imaging, and clinical aspects. Neurology. 80 (2), 210-219 (2013).
- Tsunoda, I., Kuang, L. Q., Theil, D. J., Fujinami, R. S. Antibody association with a novel model for primary progressive multiple sclerosis: induction of relapsing-remitting and progressive forms of EAE in H2s mouse strains. Brain Pathology. 10 (3), 402-418 (2000).
- Lifshitz, J., Witgen, B. M., Grady, M. S. Acute cognitive impairment after lateral fluid percussion brain injury recovers by 1 month: evaluation by conditioned fear response. Behavioural Brain Research. 177 (2), 347-357 (2007).
- Kabadi, S. V., Hilton, G. D., Stoica, B. A., Zapple, D. N., Faden, A. I. Fluid-percussion-induced traumatic brain injury model in rats. Nature Protocols. 5 (9), 1552-1563 (2010).
- Leonard, J. R., Grady, M. S., Lee, M. E., Paz, J. C., Westrum, L. E. Fluid percussion injury causes disruption of the septohippocampal pathway in the rat. Experimental Neurology. 143 (2), 177-187 (1997).
- Hare, G. M., et al. Severe hemodilutional anemia increases cerebral tissue injury following acute neurotrauma. Journal of Applied Physiology. 103 (3), 1021-1029 (2007).
- Abbott, N. J. Evidence for bulk flow of brain interstitial fluid: significance for physiology and pathology. Neurochemistry International. 45 (4), 545-552 (2004).
- Amor, S., et al. Identification of epitopes of myelin oligodendrocyte glycoprotein for the induction of experimental allergic encephalomyelitis in SJL and Biozzi AB/H mice. The Journal of Immunology. 153 (10), 4349-4356 (1994).
- Adzemovic, M. Z., Zeitelhofer, M., Hochmeister, S., Gustafsson, S. A., Jagodic, M. Efficacy of vitamin D in treating multiple sclerosis-like neuroinflammation depends on developmental stage. Experimental Neurology. , 39-48 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados