Method Article
Pro-enflamatuar Sitokinlerin İntraserebral Enjeksiyonu ile İndüklenen Yaygın Serebral Kortikal Demiyelinasyonun Sıçan Modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada sunulan protokol, yetişkin erkek Dark Agouti sıçanlarında her iki kortikal yarımkürenin yaygın bir gri madde demyelinasyonunun çoğaltılmasına izin verir. Yöntem, bir kateterin intraserebral implantasyonu, miyelin oligodendrosit glikoproteine karşı subklinik bağışıklama ve implante kateterden pro-enflamatuar sitokin karışımının intraserebral enjeksiyonundan oluşur.
Özet
Multipl skleroz (MS), merkezi sinir sisteminin (CNS) en sık görülen immün aracılı hastalığıdır ve omurilik ve beyincikteki beyaz madde lezyonlarının yanı sıra gri maddedeki demyelinasyondan kaynaklanan fiziksel sakatlık ve ölüme yol açar. Deneysel alerjik ensefalomyelit geleneksel modeller spinal ve serebellar beyaz madde hücre aracılı iltihabın araştırılması için uygun olsa da, gri madde patolojilerini ele almada başarısız olurlar. Burada, kortikal lezyonlara yol açan patolojik ve moleküler mekanizmaların araştırılmasına izin sağlayan yeni bir sıçan modeli olan kortikal demyelinasyon için deneysel protokolü sunuyoruz. Demiyelinasyon, tamamlanmamış bir Freund'un adjuvanında düşük doz miyelin oligodendrosit glikoprotein (MOG) ile bağışıklama ve ardından pro-enflamatuar sitokinlerin kateter aracılı intraserebral doğumu ile indüklenir. Kateter, ayrıca, enjeksiyon kaynaklı travmaya neden olmadan birden fazla demyelinasyon turuna ve ayrıca preklinik bir incelemeden geçen potansiyel terapötik ilaçların intraserebral olarak verilmesine olanak tanır. Hayvan ağrısı ve sıkıntısı veya sakatlığı kontrol altında ve nispeten minimum olduğu için yöntem etik olarak da elverişlidir. Tüm protokolün uygulanması için beklenen zaman aralığı yaklaşık 8 - 10 haftadır.
Giriş
MS, öncelikle miyelin tabakalarına zarar veren, ancak sonunda aksonal kayba ve kalıcı nöronal hasara yol açan CNS'nin bağışıklık aracılı, enflamatuar bir hastalığıdır. MS, Ulusal MS Society1'egöre, dünya çapında yaklaşık 2,3 milyon kişi yaygınlığı olan CNS'nin en yaygın bağışıklık aracılı hastalığıdır ve büyük bir kişisel ve sosyoekonomik yükü temsil eder. Hastalığın başlangıç yaşı ortalaması 30'dur ve ağır sakatlığa neden olarak üretken yılların kaybına yol açar. MS şu anda tedavi edilemez ve mevcut tedavi yöntemleri, nüks-remitting MS'te akut nüks sırasında semptomları yönetmeyi ve immünomodülatör tedavi ile nüks sıklığını azaltmak için hastalığın seyrini değiştirmeyi amaçlamaktadır2,3. Hiçbir tedavi seçeneği henüz progresif tipler için etkili kanıtlanmamıştır4, B hücreli tükenme tedavisinin yakın tarihli bir klinik çalışması dışında, aktif inflamasyonlu primer progresif MS (PPMS) hastalarının bir alt grubunda etkili olduğu gösterilmiştir5. Bununla birlikte, çeşitli potansiyel genetik6 ve çevresel risk faktörleri7 tanımlanmış olmakla birlikte, MS'in etiyolojisi bilinmemektedir.
MS, beyaz madde8,9'dabüyük inflamatuar demiyelinasyon plakları ve dağınık yaralanmalar ile karakterizedir. Fokal lezyonlar geniş bir T hücre aracılı atak, oligodendrosit yıkımı, reaktif astrogliosis ve aksonal dejenerasyon ile ilişkilidir ve motor nöron düşüşüne yol açar. Gri madde demyelinasyonu ve atrofisi hastalığın ek histopatolojik özellikleri olarak tanınmaya kazanmıştır9,10,11. İkincisinin hastalarda nörolojik disfonksiyon ve bilişsel düşüşe katkıda bulunduğu öne sürlenmiştir12,13. Kortikal demiyelinasyonun üç deseni ayırt edilmiştir, yani i) lökokortik, beyaz madde lezyonları ile bitişik (%34), ii) küçük, pervasküler (%16) ve iii) subpial (%50). Fokal beyaz madde lezyonlarının aksine, bu gri madde lezyonlarının T hücre aracılı bir atak olmadığı bildirilmiştir ve bunun yerine gelişmiş bir mikroglial aktivasyon, apoptoz ve nöronal kayıp ile karakterizedir12.
Bugüne kadar, büyük ölçüde hastalığın karmaşıklığı nedeniyle, insan MS'ini tek bir hayvan modelinde yeniden yakalamak mümkün olmamıştır. Her biri hastalık patogenezinin ve ilerlemesinin farklı yönlerini simüle eden çeşitli MS hayvan modelleri geliştirilmiştir14,15. Mevcut hayvan modelleri üç farklı hastalık prosesi taklit eder: i) fokal inflamatuar lezyonlar, ii) dağınık beyaz madde yaralanması ve iii) dağınık gri madde patolojisi.
MS beyaz madde plaklarının hayvan çalışmaları çoğunlukla kemirgen ensefalomyelit (EAE) modellerinde yapılmıştır. Test hayvanları, miyelin antijeni içeren bir emülsiyon ile aktif olarak bağışıklanır [genellikle miyelin oligodendrosit glikoprotein (MOG)16,17, miyelin temel proteini (MBP)18veya proteolipid proteini (PLP)19], tam bir Freund'un adjuvant (CFA)20. Hastalık ayrıca miyelin spesifik T hücrelerinin benimsenen bir transferi ile pasif olarak indüklenebilir21. Hastalık seyri kullanılan antijen/fare gerinim kombinasyonuna bağlıdır. Örneğin, C57BL/6'daki MOG35-55 monofazik kronik hastalık22ile sonuçlanırken, İsviçreli Jim Lambert (SJL) farelerinde PLP139-151 cinsiyete özgü bir şekilde23 nüks eden bir hastalık seyrine yol açar24. Sıçan MOG35-55, daha da ileri, ensefalijenik bir T hücre yanıtına neden olurken, insan MOG35-55 C57BL / 6 farelerde B hücresine bağımlı inflamasyona neden olur25. Çeşitli EAE modelleri, öncelikle omurilik ve beyincikte hücre aracılı iltihabı incelemek için mükemmel bir araç sağlar, ancak korteks, korpus callosum ve subkortikal yapılar gibi ön beyin yapıları büyük ölçüde yedeklenmiş kalır26. Ne dağınık beyaz madde yaralanması ne de gri madde demiyelinasyonu, ayrıca, EAE modellerinde yeterince çoğaltılır26,27. Aktif EAE indüksiyonu ile ilişkili kortikal demiyelinasyon marmosets28,29 ve bazı Lewis sıçan alt suşlarında bildirilmiştir, ikinci durumda MHC sınıfı I ve sınıf II izotipleri ve alellerinin hakim kombinasyonlarına atfedilmiştir30.
Cuprizone model31, kortikal, sub-kortikal 32 ve hipokampal33bölgelerinin yanı sıra corpus callosum34 ve kaudat putamen35'in kapsamlı bir demiyelinasyonu iledağınık beyaz madde demiyelinasyonu ve gri madde patolojisini incelemek için yararlı bir araçtır. Prensip olarak, oligodendrositlerin metabolik strese bağlı apoptozu ile sonuçlanan Cuprizone zehirlenmesi, MS beyinlerinin mikroglia aktivasyonu, astroglitoz ve periferik bağışıklık hücrelerine sızma eksikliği gibi kortikal demiyelinerasyon lezyonlarının bazı özelliklerini taklit eder. Nöronal apoptoz ve talamik atrofi eksikliği ve diyet cuprizone takviyesi32'ninkesilmesi üzerine gözlenen sağlam bir remiyelinasyon ile demiyelinasyonun tam çözünürlüğü , bununla birlikte, cuprizone zehirlenmesinin preklinik bir MS modeli olarak kullanımını sınırlar. Toksik demiyelinasyon ayrıca beyaz madde yollarına lysolecithin veya ethidium bromürün odak enjeksiyonu ile de indüklenebilir36,37, ancak bu yöntemler nadiren kullanılır. Toksik demyelinasyon modelleri, özellikle oligodendrosit progenitör hücreleri ve astrositler38,39gereksinimi gibi karmaşık remyelinasyon mekanizmalarının analizi için uygundur. EAE ve zehirlenme modelleri hakkında ayrıntılı bilgi iki yeni incelemede verilmiştir15,40.
Sitokin kaynaklı demyelinasyon başlangıçta EAE41'dekispinal beyaz madde lezyonlarını incelemek için geliştirilmiştir. Daha sonra, MS. Dark Agouti (DA) veya Lewis sıçanlarında kortikal gri madde patolojilerini incelemek için değiştirildi ve ilk olarak tamamlanmamış bir Freund'un adjuvanında (IFA) MOG1-12542,43 veya MOG1-11644 ile bir alt klinik bağışıklama ile astarlandı. Klasik EAE modellerinin aksine, bu astarlı hayvanlar omurilikte fokal enflamatuar lezyonların klinik semptomlarını göstermez. Bunun yerine, beyinde enflamatuar bir yanıt ve demiyelinasyon, hayvanlar kanda kararlı bir anti-MOG antikor titresi elde ettikten sonra, pro-enflamatuar sitokin karışımının [tümör nekroz faktörü alfa (TNFα) ve interferon gama (IFNφ)] intraserebral bir uygulama ile elde edilir.
Merkler ve ark. 42 ve Gardner ve diğerleri. 44, subpial kortikal demiyelinasyon indüksiyonunun etkinliğini bir sub-klinik MOG bağışıklama ve intraserebral veya subaraknoidal sitokin enjeksiyonu ile kanıtlamıştır. Demyelinasyonun bildirilen süresi, 14 gün veya daha kısa bir sürede çok kısa bir remyelinasyon meydana geldi ve böylece herhangi bir farmakolojik müdahale testi için pencereyi sınırlandırdı. Her iki model de, ayrıca, bir enjeksiyon travmasına ve kan-beyin bariyeri (BBB) bozulmasına neden olabilecek ve böylece enflamatuar hücrelerin kontrolsüz bir şekilde parenkime alınmasına yol açabilecek travmatik bir enjeksiyon modus kullanır. Her iki çalışma da, ayrıca, sınırlı bir alanla sınırlı olan demyelinasyonu, ipsilateral kortekste veya sitokin enjeksiyon alanının yakın çevresinde göstermiştir.
Bu sınırlamaların üstesinden gelmek için, da sıçanlarının sağ parietal korteksine bir kateter yerleştirdik, kateter ucu korpus callosum'un hemen üzerinde bulundu. BBB bütünlüğünün tam olarak iyileşmesini sağlamak için, hayvanlara kateter implantasyonundan sonra 2 haftalık bir dinlenme süresi verildi. Daha sonra, sıçanlar IFA'da 5 μg rekombinant MOG1-125 ile klinik olarak aşılandı. Yaklaşık 4 hafta sonra stabil bir anti-MOG antikor titresinin elde edilmesiyle, programlanabilir bir şırıng pompası kullanılarak kateterden 10 dakika içinde 2 μL sitokin karışımı enjekte edildi. Bu prosedür, 15 gün içinde hem ipsi hem de kontrallateral serebral yarımkürelerin yaygın bir kortikal demiyelinasyonunu ortaya çıkararak, sitokin enjeksiyonu sonrası 30 gün civarında kısmi bir remiyelinasyon43. Çoklu demiyelinasyon evreleri, dahası, kateter yoluyla pro-enflamatuar sitokinlerin tekrar tekrar verilmesiyle indüklenebilir ve progresif MS alt tipleri45'inortak bir özelliği olan küresel beyin atrofisi , ikinci demiyelinasyonfazı 43'tensonra olduğu gibi indüklenebilir. Daha da önemlisi, implante kateter farmakolojik müdahaleleri test etmek için de kullanılabilir.
Aşağıda açıklanan protokol, intraserebral kateter kullanan DA sıçanlarının her iki serebral yarımküresinde de yaygın kortikal demiyelinasyonun tekrarlanabilir bir şekilde üretilmesi için deneysel adımların ayrıntılı bir açıklamasını sunmaktadır.
Protokol
Burada açıklanan tüm yöntemler yerel makamlar tarafından onaylanmıştır (Bundesministerium für Wissenschaft und Forschung (Avusturya Bilim ve Araştırma Bakanlığı); Ruhsat Numarası: 66.010/0132-WF/V/3b/2014). Yetişkin erkek DA sıçanları (10 - 12 haftalık) yiyecek ve suya ücretsiz erişim ile 12/12 saat açık / karanlık bir döngüde barındırıldı.
1. Malzeme Hazırlama
NOT: Ameliyat aseptik koşullarda yapılır. Başlamadan önce, matkap uçları da dahil olmak üzere tüm cerrahi aletlerin uygun bir dezenfektanla temizlendiğini unutmayın.
- Anestezik bir karışım hazırlayın: 0.02 mg/mL fentanil, 0.4 mg/mL midazolam ve 0.2 mg/mL medetomidin (karışımdaki son konsantrasyonlar).
NOT: Alternatif anestezikler için ilgili Tartışma bölümüne bakın. - Bir panzehir karışımı hazırlayın: 0.07 mg/mL flumazenil ve 0.42 mg/mL atipamezole (karışımdaki son konsantrasyonlar).
- Kateteri ve kateter kapağını giriş ve vida ile monte edin. Kateteri neşterle 2 mm uzunluğa kesin (Şekil 1).
NOT: Kateter ucunun dairesel kesit şeklini sıktıkları ve deforme ettikleri için bunun için makas kullanmayın.
2. Cerrahi Hazırlık
- Sıçanı anestezik karışımın intraperitoneal (yani) bir uygulama ile uyuşturun (1,5 mL / kg vücut ağırlığı).
- Elektrikli tıraş makinesini kullanarak sıçanın başını kulakların arasında tıraş edin. Ameliyat boyunca hipotermiden kaçınmak için hayvanı konumlandırmadan önce stereotaktik çerçeveye homeotermik bir battaniye yerleştirin.
- Farenin kafasını kulak çubuklarını ve ısırık plakasını kullanarak stereotaktik çerçevede hareketsiz hale koyun, başın yatay ve stabil olmasını sağlayın. Parmak veya tokalarla kafatasına basınç uygulayarak stabiliteyi kontrol edin.
NOT: Stereotaktik çerçevede gevşek bir sabitleme ve yatay olmayan konumlandırma, hedeflenen koordinatlardan sapmaya neden olabilir. - Ameliyat sırasında kornea kuruluğunu önlemek için yağlama göz damlaları uygulayın. Herhangi bir cerrahi ışığa maruz kalmayı önlemek için gözleri opak bir malzeme ile kapatın.
- %70 etanol ve %10 povidon-iyot kompleksi uygulamasını değiştirerek tıraş edilen bölgeyi temizleyin.
NOT: Enfeksiyondan kaçınmak için ameliyat sırasında tüm ihtiyati önlemleri alın. Ameliyat aseptik koşullarda yapılır. Asepsis kırılırsa, kirlenmiş malzemenin değiştirilmesi gerekir.
3. Kateter İmplantasyonu
- Baş derisinin ortasında yaklaşık 2 cm uzunluğunda uzunlamasına bir kesi yapın. Cildi yanlara tutmak için bulldog kelepçeleri kullanın. Bu adımlara genel bir bakış için bkz.
- Pamuk uçlu bir aplikatör kullanarak kanı çıkarın.
- Kafatası periosteumini çıkarın. Dokuyu pamuk ucu aplikatörü ile temizleyin ve kafatası kemiğini ortaya çıkarın. Kafatasının yaklaşık 1 dakika kurumasını bekleyin.
- Anatomik simge yapıları, Lambda, Bregma ve medial dikişi tanımlayın. Matkap stereotaktik çerçeveye monte edilmişken, matkap ucunu başlangıç noktası olarak Bregma'ya yerleştirin. Bregma'dan 2 mm posterior hareket ettirin ve ~2,4 mm yanal olarak medial dikişe taşıyın.
- Kateter için bu konumda 0,5 mm çapında bir delik açın. Kemik tozlarını hafifçe şişirin.
NOT: Sondaj sırasında dura mater'in bozulmadan kalması önemlidir. Bunu sağlamak için, 1) stereotaktik çerçeveye monte edilebilen bir matkap kullanın, 2) delme sırasında deliği sık sık inceleyin ve 3) kafatasına çok fazla basınç uygulanırsa, matkap ucu devam eder ve kafatası tam olarak nüfuz ettiğinde beyne zarar verir. - Ankraj vidaları için ilk delikten birkaç milimetre uzakta 3 delik daha (~1,3 mm çapında) delin. Kemik tozunu hafifçe üfleyin.
NOT: Kateter üst (~2 mm çapında) ve ankraj vidası üstleri (~1 mm) için yeterli alan sağlayan ankraj vidası konumlarını seçin. - Kemik tozunu, bir şırınna kullanarak yaklaşık 1 - 2 mL steril fosfat tamponlu salin (PBS) veya fizyolojik salin ile sulama yaparak çıkarın. Kafatasını temizle. Çapa vidalarını 2 - 3 tam dönüş sıkın.
NOT: Çapa vidaları, diş çimentosunda ve böylece kateteri yerinde tutarak kurulumu stabilize etmek için gereklidir. Bir çapa vidasını sıkarken, toslar ile hafifçe yukarı kaldırarak kolayca çıkarılamayacağına emin olun. Kateterin implantasyonu doku travmasına neden olduğundan, çapa vidalarını delerken veya sıkarken ek dura yaralanması birden fazla travmatik yaralanmaya yol açacak ve muhtemelen bir grup içindeki karşılaştırılabilirliği engelleyecektir. Önce çapa vidalarını sıkın ve kateteri en son yerleştirin. - 2 mm uzunluğundaki kateteri kafatası yüzeyine dik olarak ilk delikten geçirin. Kateteri hala tutarken, biraz diş çimentosu uygulayın ve kateteri stabilize etmek için diş kürleme ışığına kısa bir (~5 s) maruz kalarak polimerize olmasını ve bir sonraki adımda her iki elin de kullanılmasını sağlar.
DİkKAT: Diş kürleme ışığı ile çalışırken, bu ışığın yüksek yoğunluğu retina hasarına neden olabileceğinden, doğrudan ucuna veya uygulama alanından yansıyan ışığa bakmaktan kaçının. Uygun koruyucu gözlük kullanın. - Kateterin etrafına daha fazla diş çimentosu uygulayın, vidaları tuttuurun ve diş çimentosluğunu diş kürleme ışığıyla (~15 - 30 sn) katılaştırın. Çimentonun sertleşmesine bir kümes ucu ile onaylayın.
4. Yaranın Kapatılması ve Anestezinin Antagonizasyonu
- Baş derisini katetere resorbable dikişler, ön ve arka ile kapatın.
NOT: İmplantasyonun sonunda kafatası üzerinde engebeli bir kurulum olacağından, yara kapatmayı buna göre yapın. Cildi çok fazla kaldırmak hayvan için rahatsızlığa neden olacaktır. - Panzehir karışımını 26 G iğne ile 1 mL şırınga kullanarak deri altından (1,5 mL / kg vücut ağırlığı) enjekte edin.
- Profilaktik antibiyotik tedavisi için deri altı enjeksiyonu (%2.5) ile enrofloksasin (%2.5) uygulanır. Deri altı enjeksiyonu ile ağrı kesici için karprofen (1 mg/mL; 5 mg/kg vücut ağırlığı) ve buprenorfin (1,2 mg/kg) verin.
5. Ameliyat sonrası bakım ve ilaç tedavisi
- Hayvanı değiştirilmiş kafese geri döndürün ve hipotermiyi önlemek için kızılötesi ışık uygulamasıyla 1 - 3 saat gözlem altında tutun. Ameliyat sonrası iyileşmeye kadar hayvanı her 5 ila 10 dakikada bir sürekli gözlemleyin ve yeniden konumlandırın. İyileşmeden önce gözlere sürekli ışık maruz kalmasını önlemek için özel dikkat edin.
- Ameliyattan bir gün sonra deri altı enjeksiyonları ile enrofloksasin (7,5 mg/kg vücut ağırlığı) ve karprofen (1 mg/mL; 5mg/kg vücut ağırlığı) uygulamalarını tekrarlayın. Önceki tedavi 72 saat etkili olduğu için buprenorfin yenilenmesine gerek yoktur.
6. Bağışıklama Karışımının Hazırlanması (Kateter İmplantından En Erken 14 Gün Sonra)
Not: Hazırlık prosedürü sırasında şırınnaları buza yerleştirin.
- İki adet 10 mL Luer kilit ucu cam şırınnasını 3 yönlü bir stopcock'un kısa kollarına bağlayın ve üçüncü çıkışı uzun kolla kapatın.
- Bağlantıların güvenli ve sızdırmaz olduğundan emin olun: Piston 2'yi tutarken açık şırınna yaklaşık 4 mL steril PBS ekleyin. Piston 1'i takın ve sızıntı nedir diye kontrol ederken her iki pistona da ileri geri itin. Sızıntı olmazsa, PBS'yi atın ve piston 1'i tekrar çıkarın.
- Pipet 1 mL IFA ve 50 μg rMOG1-125 birlikte ve karışımı uygun bir tüpte steril PBS (pH 7.4) ile 2 mL'lik son hacme ayarlayın.
NOT: Hazırlık sırasında şırınna uçlarında veya duvarlarında emülsiyon kayıpları nedeniyle, yönetim için amaçlanandan daha büyük bir hacim hazırlayın. Aynı anda 1'den fazla hayvan için hazırlanmak benzer şekilde daha pratiktir. - Seyreltilmiş IFA ve rMOG1-125 karışımını açık şırınna yerleştirin. Pistonun karşı piston üzerinde gevşek bir basınç sağlarken pistona hafifçe takın (Şekil 3A).
- Inoculumu, pistonları beyaz ve viskoz olana kadar ileri geri iterek bir şırıngamdan diğerine sürerek emülsifiye edin (Şekil 3B).
- 1 mL Luer kilit şırınnasını 3 yönlü stopcock'un açık kısa koluna sabitleyin ve inoculum (Şekil 3C)ile doldurun. Tüm inoculum'u 1 mL şırıngamlara dağıtın. İğneye kadar buzda tut. Karışımı hazırlık gününde sunun.
7. Bağışıklama
- Sıçanı bir odada izofluoran ile uyuşturun (~2 dk, oksijenle karıştırılır 2 L/dk) ve ardından bir maske aracılığıyla anesteziyi sürdürebilir (oksijenle karıştırılır 1,5 L/dk).
- 21 G iğne kullanarak kuyruk tabanına 200 μL inoculum deri altından enjekte edin.
NOT: Çözelti viskoz olduğu için enjeksiyonu yavaşça yönetin.
8. Antikor Titrelerinin Belirlenmesi
- Anti-MOG antikor titrelerini belirlemek için bağışıklamadan 4 hafta sonra ~ 200 μL kan çekin.
- 96 kuyulu bir plakanın kuyularını MOG (PBS'de 5 μg / mL) ile kaplayın ve 37 °C'de 1 saat kuluçkaya yatırın.
- Pbs'de %1 sığır serum albümini (BSA) ile plakayı oda sıcaklığında 1 saat boyunca tıkayın.
- Plakayı sıçan serumu (1:50) ile kuluçkaya yatırın ve 37 °C'de 2 saat boyunca standart hale koyun. Plakayı 200 μL PBS/Polisorbat 20 ile 3x yıkayın.
- Plakayı yaban turpu peroksidaz konjuge anti-sıçan IgG ikincil antikoru ile kuluçkaya yatırın (1:10.000). Plakayı 200 μL PBS/Polisorbat 20 ile 3x yıkayın.
- Kuyu başına 100 μL peroksidaz substrat çözeltisi ekleyin ve oda sıcaklığında karanlıkta 20 - 30 dakika kuluçkaya yatırın.
- Optik yoğunluğu 405 nm dalga boyunda ölçün ve standart bir eğri kullanarak optik yoğunluktan antikor titresini hesaplayın.
9. İntraserebral Sitokin Enjeksiyonu
- Konnektörülün uzunluğunu (2 mm) ayarlayın. (Hazırlık adımları için Şekil 4'e bakın.)
- 1 mL'lik bir şırıngayı sitokin karışımıyla doldurun (500 ng/μL TNF-alfa, steril PBS'de 300 U/μL rekombinant sıçan IFN-gama). Şırındıcı bir konektörüle bağlayın. Canülleri sitokin karışımı ile doldurun. Kabarcıklardan kaçının.
- Şırıng'ı programlanabilir şırıngın pompasına monte edin ve 0,2 μL/dk enjekte etmek üzere programlayın (Şekil 5A). Pompayı başlatın ve canül ucunda bir hava kabarcığı oluşumunu önlemek için çalışmaya devam edin.
NOT: Enjeksiyon hızı, kullanılan belirli şırıncının iç çapını dikkate almalıdır; böylece, şırınna çapı pompa kurulumu sırasında kaydedilmek zorundadır. - Sıçanı bir odada izofluran ile uyuşturun (~2 dk, 2 L / dk oksijenle karıştırılır) ve ardından anesteziyi bir maske aracılığıyla sürdürün (1,5 L / dakika oksijenle karıştırılır) (Şekil 5B ve 5C). Hayvan en az 30 dakika uyuşturulacağı için yağlama göz damlaları uygulayın.
- Kateter kapağını girişle birlikte çıkarın. Konektörlü cannulayı katetere yerleştirin ve vidalayıp sıkın (Şekil 5D ve 5E).
NOT: Kateterin üst ucunu tahrip edeceğinden aşırı fazla iyice canlandırmayın. - Enjeksiyonun 10 dakika boyunca devam etmesine izin verin (toplam enjeksiyon hacmi 2 μL'dir). Pompayı durdurun. Enjekte edilen hacmin tamamen yayılması için kanı kateterin içinde 20 dakika bekletin.
- Konnektör kanülünü sökün ve vakum etkisinden kaçınmak için yavaşça çıkarın.
- Kateter kapağını girişle birlikte yeniden takın ve vidalayın. Hayvanın anesteziden bir kafeste iyileşmesine izin verin.
Sonuçlar
Kortikal demiyelinasyon, proteolipid protein (PLP) için immünhistokimya ile sitokin enjeksiyonundan sonra farklı zaman noktalarında değerlendirilebilir (Şekil 6). Şekil 6A, implante kateter aracılığıyla sadece steril PBS alan MOG aşılı bir kontrol hayvanında 15. Sitokin enjeksiyonundan sonraki 1. günde, mog astarlı hayvanlarda, sadece kateterlenmiş alanın yakın çevresinde olsa da demiyelinasyon zaten tespit edilebilirdi(Şekil 6B). PLP immünoreaktivitesi, kontraseteral korteks 1 günlük sitokin enjeksiyonunda bozulmadan kalır. 3. günde, ipsilateral kortekste yayılan PLP immünoreaktivite kaybında kademeli bir artış gözlenebilir (Şekil 6C). Kontrallateral kortikal demiyelinasyon da 3. PBS enjekte edilen kontrol hayvanlarında benzer bir gözlemin olmaması, çapa vidasından kaynaklanan travma kaynaklı demyelinasyon olasılığını dışlar.
9 - 15 gün arasında, demyelinasyon her iki yarımkürenin korteksinin büyük kısımlarını etkiler (Şekil 6E, 6Fve 6G). Bu, bir rotarod testinde motor becerilerde istatistiksel olarak anlamlı bir azalma olmadan yavaş davranışın bir gözlemi ile çakışıyor43. Kortikal demyelinasyon, her iki yarımkürede de sitokin enjeksiyonu sonrası 30 güne kadar sürdürülür (Şekil 6H ve 6I) sadece kısmi bir remyelinasyon ile. Şekil 6J, intraserebral sitokin enjeksiyonundan sonra kortikal gri maddede PLP kaybının nicelliğini göstermektedir. PLP immünoreaktivitenin 30 günden uzun süreler sonra henüz değerlendirilmediği belirtilmelidir; böylece, varsa, remyelinasyonun anlık çözünürlüğü, daha fazla deneyle değerlendirilmeye devam eder. İlk enjeksiyondan 30 gün sonra implante kateterden sitokin karışımının ikinci bir uygulama, 15. günde belirgin beyin atrofisi ile sonuçlanır (Şekil 7).

Şekil 1: Kateterin hazırlanması. (A ve B) Kılavuz kavun ve kukla canül (girişli kateter kapağı) monte edilir ve vidalanır. (C) Daha sonra kateter neşter yardımıyla 2 mm boyuta kesilir. Mikroskobik gözlem, bu amaçla makas kullanımının, oluk ucunun dairesel şeklini bozdığını ve böylece kaçınılması gerektiğini göstermiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
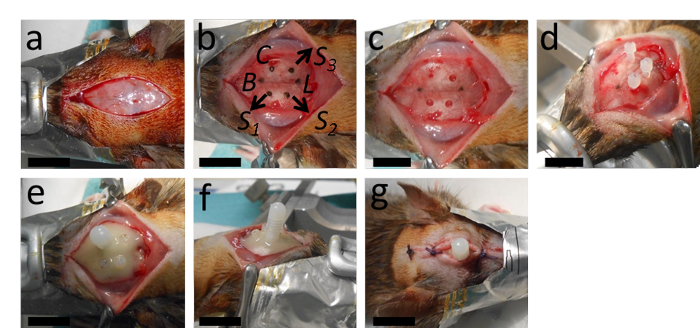
Şekil 2: Kateterin implantasyonu. (A) Ameliyat uzunlamasına bir kesi ve periosteumun çıkarılması ile başlar. (B, C) Bu panel, kateter için yerin Bregma'dan 2 mm posteriorda ve sagittal dikişten sağda 2,4 mm yanal olarak işaretini gösterir; kateter ve Lambda'dan uygun bir mesafeye sahip üç çapa vidası için tasarlanan delikler için yerlerin yanı sıra. (D) Kateter deliğini deldikten sonra (yuvarlak matkap ucu ile 0,5 mm çapında) ve çapa vidaları için delikler (bükülmüş matkap ucu ile 1,3 mm çapında), ankraj vidaları sıkılır. (E, F) Daha sonra kateter yerleştirilir ve tüm kurulum polimerize diş çimentosu ile stabilize edilir. (G) Yara, katetere iki veya üç knot ön ve arka ile dikilir. B = Bregma; L = Lambda; C = Kateter; S1, S2 ve S3 = üç ankraj vidası için delikler için yerler. Ölçek çubukları = 1 cm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
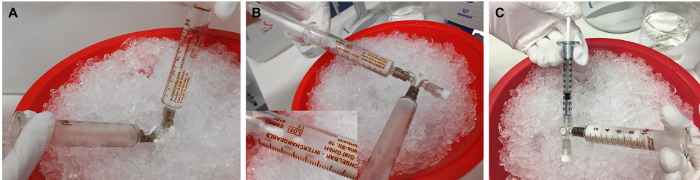
Şekil 3: rMOG/IFA emülsiyonunun hazırlanması. (A) rMOG, PBS ve IFA karışımı, inoculum bir şırıngamdan diğerine bastırılarak pistonlar ileri geri itilerek emülsifiye edilir, (B) beyaz ve viskoz olana kadar. (C) Daha sonra, inoculum enjeksiyon için 1 mL şırınna dağıtılır. 5 μg rMOG, bir sıçanı klinik olarak aşılamak için 200 μL PBS / IFA karışımında kullanılır; ancak hazırlık sırasında şırınnaların uç ve duvarlarındaki kayıplar nedeniyle daha büyük bir hacim hazırlanmalıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Konektörülülün hazırlanması. (A - D) Bu paneller, bir konektörün ve bir iç binanın 2 mm boyutunda şablon kılavuzlu birül ile nasıl birleştirildiğini gösterir. (E) İç neşter (F) yardımıyla kılavuz canül ile aynı boyutta kesilir ve şablon kılavuzu daha sonra sökülür. (G) Konektör kanülünün diğer ucu, enjeksiyon karışımını içeren 1 mL şırıngaya 20 G iğne ile sabitlenir. Ölçek çubukları = 3 cm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5: İntraserebral enjeksiyon. (A) Programlanabilir bir şırınna pompası 2 μL/dk enjeksiyon hızı için ayarlanır ve sitokin karışımı (veya kontroller için steril PBS) ile dolu 1 mL şırınna pompaya monte edilir. (B) Hayvan önce 2 L/dk oksijen akışı ile %5 izofluran kullanılarak odada uyuşturulur ve daha sonra (C) anestezi 1,5 L/dk oksijen akışı ile %2,5 izofluran kullanılarak maske ile sürdürülür. (D) Girişli kateter kapağı (kukla cannula) vidalanır ve enjeksiyon damarı implante edilen kateterden yerleştirilir. Enjeksiyonun hacmi çok küçük olduğundan, araştırmacı kanül ucundaki hava kabarcıklarından kaçınmak için dikkatli olmalıdır. Bu nedenle, pompa çalışırken ve sadece ucunda büyüyen bir sıvı kabarcık olduğunda yerleştirmeye başlamak önemlidir. Ekstra hacim zaten beyne gitmeyecek, çünkü yerleştirmeden önce kateterin üstüne parçalanacak. (E) Daha sonra konektörül sıkılır ve pompanın 10 dakika çalışmasına izin edilir. 10 dakikalık enjeksiyondan sonra pompa durdurulur ve enjekte edilen hacmin interstisyel sıvıya yayılmasına izin vermek için canül 15 - 20 dakika içeride bırakılır. Ölçek çubukları = 5 cm, aksi belirtilmedikçe. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
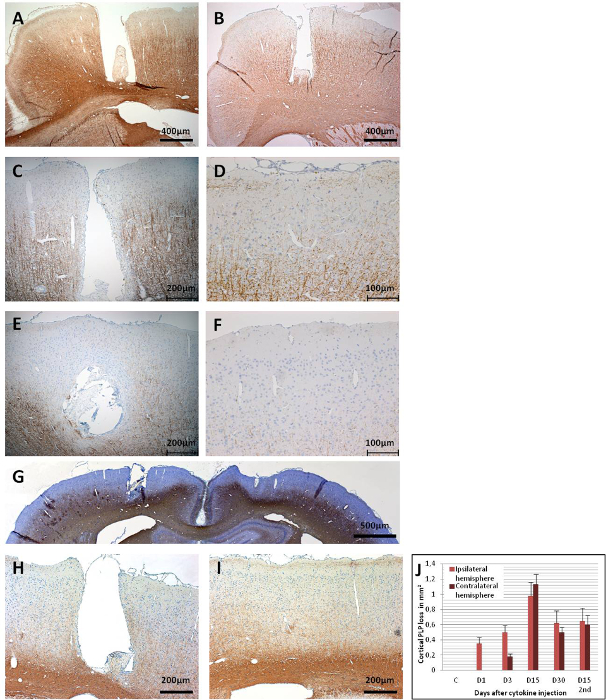
Şekil 6: Koronal beyin bölümlerinde PLP immünoreaktivite. (A) Bu panel, kortikal demiyelinasyonla sonuçlanmayan PBS enjeksiyonu (15. gün) ile bir kontrol beynini (MOG-primed) gösterir. (B) 1. gün sonrası sitokin enjeksiyonu gibi kateter bölgesinde demyelinasyon belirgindir. (C) 3. günde ipsilateral kortekste ve kontrallateraltarafta daha geniş bir PLP immünoreaktivite kaybı gözlenir. Her iki yarımkürede de 15. günde yaygın PLP immünoreaktivite kaybı gözlenir, çünkü (E) bu panel ipsilateral korteksi ve (F) bu panel kontrallateral korteksi gösterir. (G) 15. günde yaygın PLP kaybını gösteren her iki yarımküreye genel bir bakış verilmiştir. 30. günde,bupanel ipsilateral korteksi gösterir ve (I) bu panel kontralateral korteks için gösterir, hala dikkat çekici demiyelinasyon vardır, ancak bazı remiyelinli alanlar da gözlenebilir. (J) Bu panel demyelinasyonun nicelliğini gösterir (mm2/yarımkürede PLP kaybı). 1:500 seyreltme faktörü ile MS anti-PLP ile PLP tespiti için 1.5 - 2 μm koronal beyin kesiti kullanıldı. Bölümler hücre çekirdeği için hematoksilin ile karşı konuldu. İmmünohistokmya hakkında ayrıntılı bilgi için Ucal ve ark. 43. Panel G ve J Ucal ve ark. 43. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
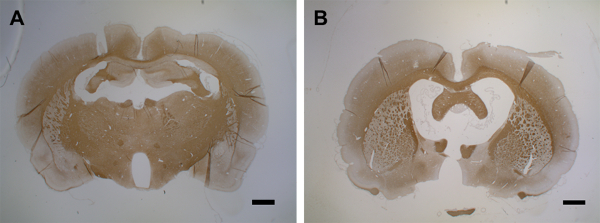
Şekil 7: İkinci sitokin enjeksiyonundan sonra beyin atrofisi. (A) Bu panel PBS enjeksiyonu ile bir kontrol beynini (MOG-primed) gösterir (gün 15). (B) İlk sitokin enjeksiyonundan sonraki 15. günde, ikinci bir enjeksiyon 15 gün içinde beyin atrofisine yol açar. 1:500 seyreltme faktörü ile MS anti-PLP ile PLP tespiti için 1.5 - 2 μm koronal beyin kesiti kullanıldı. Bölümler hücre çekirdeği için hematoksilin ile karşı konuldu. İmmünohistokmya hakkında ayrıntılı bilgiiçin, bkz. Ölçek çubukları = 500 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 8: Hayvan tarafından kateter çıkarılmasını önlemek için değiştirilmiş kafesler. Standart kafeslerde, ızgaradaki yiyecek tutucu alanı kafes tabanına daha yakın bulunur ve kateterin ızgaraya karışma şansını ve böylece çıkarılmasını artıran riskli bir dar alan oluşturur. Bundan kaçınmak için kafesin değiştirilmesi gerekir. Bu dar alan şeffaf bir düzlemle engellendi ve hayvanın gözlemlenmesine izin verildi. Yiyecekler kafesin içinde bu modifiye kafeslerde verilmelidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Yöntemimiz DA farelerini kullanıyor. Farelere adaptasyon muhtemelen daha küçük bir kateter ve vidaların kullanılmasını gerektirecektir. Ayrıca, farklı bir tür / suş kullanıldığında hastalığın seyri, enflamatuar yanıt ve demyelinasyon boyutunun burada sunulandan farklı olabileceği akılda tutulmalıdır. Bu farklılıklar, farklı fare suşları kullanılarak klasik EAE modellerinde gözlenmiştir. Örneğin, sıçan kökenli MOG92-106, A.SW farelerde birincil progresif veya ikincil progresif EAE ile sonuçlanırken, SJL / J farelerde EAE'yi yeniden relaps-remitting46. Bu nedenle, aynı türdeki hayvanlar kullanılmalıdır. EAE tezahüründeki cinsiyet farklılıkları da daha önceki çeşitli çalışmalarda bildirilmiştir24. Bu tür cinsiyet etkilerinin ortaya çıkması, burada açıklanan protokol için de beklenebilir, ancak daha sonraki deneylerde doğrulanmaya devam etmektedir.
Cerrahi müdahale için 0.02 mg/mL fentanil, 0.4 mg/mL midazolam ve 0.2 mg/mL medetomidin içeren anestezik karışımın intraperitoneal (IP) yönetimi kullanılır. 270 - 300 g ağırlığındaki yetişkin erkek DA sıçanları, 60 - 90 dk süren bir anesteziyi teşvik etmek için bu karışımın yaklaşık 0.4 - 0.6 mL'si(yani~ 1.5 mL / kg) gerektirir. Ameliyattan sonra anestezi, fizyolojik salinde 0.07 mg/mL flumazenil ve 0.42 mg/mL atipamezol (%0.9 NaCl) içeren bir panzehirin deri altı enjeksiyonu ile antagonize edilir. 1 - 1,5 mL / kg'lık bir doz anesteziyi 5 dakika içinde anagonize eder. Alternatif olarak, hayvanların anestezik bir fizyolojik yıkamada kendiliğinden uyanmalarına izin verilebilir, ancak bu durumda, hayvanların tamamen bilinçli olana kadar gözlem altında tutulmaları gerekir.
Hayvan ameliyatları için sıklıkla kullanılan diğer anestezi seçenekleri, örneğin KETAMIN ve ksilazinin IP enjeksiyonu47 veya sodyum pentobarbital48veya izofluoran49 ve halotan50gibi uçucu anesteziklerin solunması , burada sunulan ameliyat için de düşünülebilir. Bununla birlikte, amaçlanan aşağı akış müdahalelerine müdahale etmeyen bir anestezik ajan seçmek kritik öneme sahiptir.
Bağışıklama ve intraserebral sitokin enjeksiyonu sırasında anestezi için %5 izofluran kullanılır. Burada açıklanan model sıçanlar kullanılarak kuruldu ve listelenen deneysel detaylar, bu nedenle sıçan için özel olarak uygulanabilir. Kateter implantasyon koordinatları, olası beyaz madde değişikliklerinin (korpus callosumdaki kateter ucu) eşzamanlı analizini sağlamak için seçildi. Kateter ekleme bölgesi anteroposterior ve lateral pozisyona göre değiştirilebilirken, merkezi sülküs seçimi üstün sagittal sinüse zarar vermekten kaçınmayı gerektirir.
Açıklanan yöntemin bir başka özelliği, hem ipsi hem de kontrallateral yarımkürelerin eşdeğer demiyelinasyonudur, muhtemelen enjekte edilen sitokin karışımının kortikal bölgelerden interstisyel sıvının fizyolojik akışı ile subaraknoid uzaya taşınmasından kaynaklanır51. Bu nedenle kateterin yeri değil enjeksiyon modu serebral korteks boyunca demiyelinasyona neden olur ve sağ veya sol parietal korteks seçimi bu konuda önemsiz olmalıdır.
Protokol, kapsamlı travmatik yaralanmaları önleyebilecek kadar küçük ve kateter ucunun deneyin uzun süre boyunca tıkanma oranının artmasını önleyebilecek kadar büyük olan 26 G kateter kullanır. Kesinlikle, kateterin implantasyonu ve varlığı, sadece kateter implantasyonunu alan kontrol hayvanlarında da astrositik ve mikroglial aktivasyona neden olur; ancak, sitokin enjekte edilen hayvanlarla karşılaştırıldığında bu küçüktür. 43 Sonraki analizlerde herhangi bir paraziti önlemek için poli-eter-eter-ketondan (PEEK) yapılmış MRI uyumlu kateterler kullandık.
Benzer bir demyelinasyon derinliği, aslında, sunulan yöntemle hem ipsi hem de kontralteral bölgelerde yaratılır. Bu, kateter derinliğinin/uzunluğunun korteksteki demyelinasyon paterninde ve boyutunda önemli bir rol oynamayabileceği anlamına gelir. Bu nedenle katetere bağlı lezyon boyutunu azaltmak için kateter uzunluğunun değiştirilmesi düşünülebilir. Bununla birlikte, önemli ölçüde daha kısa bir kateter uzunluğu biraz daha az belirgin bir kortikal demyelinasyona neden olabilirken, kesin bir cevap sadece kateter uzunluğu için özel olarak test edilen deneylerle elde edilecektir.
Modelin bir avantajı, implante kateterin kateter aracılığıyla kortekse uygulanan potansiyel terapötiklerin test edilmesine izin vermesi ve histolojik olarak tespit edilebilir kortikal demyelinasyonun zirvesinde veya sonrasında (15. gün veya daha sonra) remyelinasyona izin vermesidir, ancak bir ön işlem ayarında bu bağışıklamadan sonra ancak sitokin enjeksiyonundan önce olacaktır. Terapötiklerin uygulanacağı zaman dilimine ilişkin karar, bu nedenle, belirli bir araştırma sorusuna ve ilgi çekici ilaca bağlı olacaktır.
Kateter implantasyonundan sonra, çalışmanın sonuna kadar kateter çıkarılmasını önlemek için hayvanların modifiye edilmiş (tercihen yüksek üst) kafeslerde tekli olarak barındırılması önemlidir (Şekil 8). Hayvanlar ayrıca kateter kapağını girişle birlikte sökebilir, ancak bu nadiren olur. Hayvanlar günlük olarak gözlemlenmeli ve çıkarılan kapaklar taze olanlarla değiştirilmeli, bir girişin yokluğunda kateter ucu tıkanmasını önlemek ve intraserebral enjeksiyonu takiben parankime doğru bir şekilde teslim edilmelidir. Hayvanlar, kan-beyin bariyerinin iyileşmesine ve kapanmasına izin vermek için kateter implantasyonundan en erken 2 hafta sonra aşılanır.
Serum anti-MOG antikor titreleri bağışıklamadan sonra ölçülmelidir. Bir doz-yanıt deneyi, yetişkin erkek DA sıçanlarında 4 hafta içinde 5 μg MOG1-125'in (IFA'da) yeterli bağışıklama sağladığını göstermiştir. 5.000 μg / mL ve daha yüksek bir titre yeterli olacaktır, ancak kesinlikle MOG hazırlığı ve hayvan suşu da dahil olmak üzere çeşitli faktörlere bağlı olacaktır ve bu nedenle bireysel olarak belirlenmesi gerekecektir. Sitokin enjeksiyonundan önce bile felçli arka uzuvları olan klasik bir EAE fenotipi ile potansiyel olarak sonuçlanan aşırı yüksek antijen dozlarından kaçınmak önemlidir.
Her hayvan, 200 μL eksik Freund's Adjuvan (IFA) emülsifiye edilmiş 5 μg rekombinant miyelin oligodendrocyte glikoprotein (rMOG1-125)ile bağışıklanır. Emülsiyonun bir kısmı hazırlık sırasında şırınna içinde kaybolduğundan, her hayvan için bu miktardan daha fazlasının hazırlanması tavsiye edilir. Escherichia coli'de ifade edilen ve daha sonra şelat kromatografisi ile homojenliğe saflaştırılmış, 6 M ürede çözünmüş ve fizyolojik bir preparat elde etmek için PBS'ye karşı dialyzed olan rekombinant MOG (sıçan MOG'un N-terminusundan1-125)kullandık. Bununla birlikte, piyasada bulunan MOG de kullanılabilir.
MoG1-116,MOG35-55 veya PLP139-151 gibi diğer antijen preparatları çeşitli EAE modellerinde kullanılır ve antijen ve hayvan suşu farklılıklarının bu modellerde farklı hastalık fenotiplerine neden olduğu bilinmektedir20. Bu antijen preparatları DA sıçanlarında test edilmedi ve rMOG1-125tercihiyle kullanılırsa, burada sunulandan farklı bir hastalık fenotipine veya histoloji sonuçlarına neden olabilir.
İntraserebral enjeksiyondan önce kateterle aynı uzunlukta bir konektörülül hazırlanır. Bu, bir şablon kateterle monte edilerek ve aynı boyuta (2 mm uzunluğunda) kesilerek yapılabilir (Şekil 4). Konektör kanülünün sitokin enjeksiyonu sırasında hava kabarcığı içermesi önemlidir-çünkü enjeksiyon hacmi sadece 2 μL'dir, kanül ucundaki küçük bir hava kabarcığı bile beyne başarıyla teslim edilen sıvının hacmini önemli ölçüde azaltacaktır. Bu, pompanın çalışmasını sağlamak ve sadece uçta büyüyen bir enjeksiyon sıvısı damlası olduğunda kolayı yerleştirerek elde edilir. Kolay yerleştirmeyi takiben, konektör kateterin üst ucuna zarar vermemek için aşırı iyileştiriciden kaçınırken katetere vidalanır, bu da enjeksiyondan sonra yeniden yakalanmayı zorlaştırır. Enjeksiyon kaynaklı travmayı önlemek için 0,2 μL/dk enjeksiyon hızı kullanılır. Ayrıca, enjeksiyondan sonra 20 dakikalık bir bekleme süresi ile birlikte yavaş bir enjeksiyon, enjekte edilen sıvının interstisyel sıvıya difüzyonunu ve CSF'ye etkili bir şekilde boşaltılmasını sağlar. Kanül daha sonra vakum etkisinden kaçınmak için yavaşça çıkarılır.
Bildirilen yöntem cerrahi müdahaleyi içerir ve bu nedenle stereotaktik sağkalım ameliyatı yapabilen personel gerektirir. Hayvanlarla doğrudan temas halinde olan personel uygun hayvan deneyi kurslarını almış olmalıdır. Protokolün geri kalanı yetkili laboratuvar üyeleri tarafından gerçekleştirilebilir.
Yöntem, serebral korteksin iltihapla tetiklenen demiyelinasyonunu üretmek için tasarlanmıştır ve insan MS'in tüm özelliklerini(örneğin,insan MS'in ayırt edici özelliği olan fokal inflamatuar beyaz madde lezyonlarının oluşumu) yeniden üretmez.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, Graz Tıp Üniversitesi Biyomedikal Araştırma Enstitüsü'nün tüm personeline yardımları ve işbirlikleri için ve christopher John Wrighton'a makaleyi düzelttikleri için teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adult male Dark Agouti rats (300 ±25 g) | |||
| Fentanyl | Hameln pharma plus, Germany | as Fentanyl-Citrate, 50 µg/ml | |
| Midazolam | ERWO Pharma, Austria | 50039017 | 5 mg/ml |
| Medetomidin | Orion Pharma, Finland | as Medetomidin hydrochloride, 1mg/ml | |
| Flumazenil | Roche, Switzerland | 0.1 mg/ml | |
| Atipamezol | Orion Pharma, Finland | as Atipamezol hydrochloride, 5 mg/ml | |
| 10% povidone-iodine complex | Mundipharma, Austria | ||
| Dental cement | Heraeus Kulzer, Germany | 6603 7633 | |
| Physiological saline solution | Fresenius Kabi, Austria | 0.9% NaCl | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Germany | P3813 | |
| Isofluorane | AbbVie, Austria | ||
| Lubricating eye drops | Thea Pharma, Austria | ||
| 70% EtOH | Merck, Germany | 1070172511 | Absolute ethanol was diluted in ddH2O for preparation of 70% v/v |
| 2.5% enrofloxacin | Bayer, Germany | Prophylactic antibiotics | |
| carprofen | Pfizer, USA | Painkillers, 50 mg/ml | |
| Tween-20 | Sigma-Aldrich, Germany | P9416 | |
| Pentobarbital | Richter Pharma, Austria | pentobarbital sodium, 400 mg/ml | |
| Interferon gamma | PeproTech, USA | 400-20 | |
| Tumor necrosis factor alfa | R&D Systems, USA | 510-RT-050/CF | |
| rMOG1-125 | own product at the Centre of Molecular Medicine, Karolinska Institute, Sweden | Recombinant rat myelin oligodendrocyte glycoprotein, amino acids 1-125 from the N-terminus, also commercially available: AnaSpec, AS-55152-500, USA | |
| Anti-MOG antibody | Ana Spec/Kaneka Corporation, Japan | AS-555157 | Standard from ELISA-Kit; Ana Spec/Kaneka |
| Incomplete Freund’s adjuvant | Sigma-Aldrich, Germany | F5506 | |
| Horse radish peroxidase conjugated anti-rat IgG secondary antibody | Ana Spec/Kaneka Corporation, Japan | AS-555157 | Secondary Antibody from ELISA-Kit; Ana Spec/Kaneka Corporation |
| Bovine serum albumin | Sigma-Aldrich, Germany | A9576 | |
| Peroxidase substrate solution | Vector Laboratories, USA | SK-45000 | |
| Stereotactic frame | David Kopf Instruments, USA | ||
| Catheters, MRI suitable | PlasticsOne, USA | 8IC315GPKXXC | |
| Dummy cannulas | PlasticsOne, USA | 8IC315DCNSPC | |
| Plastic screws, MRI suitable | PlasticsOne, USA | 8L080X093N01 | |
| Connector cannula | PlasticsOne, USA | 8IC313CXSPCC | |
| Screw driver with 2mm tip-size | |||
| Drill with flexible shaft extension | Proxxon, Germany | NO 28 472, NO 28 706, NO 28 620, | |
| Drill bit, round, 0.5 mm | Hager & Meisinger, Germany | REF310 104 001 001 009 | |
| Drill bit, twisted, 1.3 mm | Hager & Meisinger, Germany | REF350 104 417 364 013 | |
| Scalpel | Braun, Germany | BB510 | |
| Scalpel handle | Fine Science Tools, Germany | 91003-12 | |
| Cotton tip applicator | Henry Schein Medical, Austria | 900-3155 | |
| Surgical scissors | Fine Science Tools, Germany | 14101-14, 14088-10 | |
| Surgical forceps | Fine Science Tools, Germany | 11002-12, 11251-35 | |
| Bulldog clamps | Fine Science Tools, Germany | 18050-35 | |
| Homoeothermic blanket | TSE systems, Germany | ||
| Infrared Lamp | Beurer, Germany | 616.51 | |
| Dental curing light | Guilin Woodpecker Medical, China | ||
| Absorbable suture | Johnson & Johnson, Belgium | V792E | |
| Programmable syringe pump | World Precision Instruments, USA | AL-1000 | |
| Exam gloves | |||
| Surgical gown | |||
| Electric Shaver | Aesculap, Germany | GT420 | |
| Volatile anesthetic vaporizer | Rothacher Medical, Switzerland | CV 30-301-D | |
| Oxygen source for volatile anesthetic vaporizer | Air Liquide, Austria | 19,113 | |
| Volatile anesthesia chamber | Rothacher Medical, Switzerland | PS-0347 | |
| Anesthesia mask for rats | Rothacher Medical, Switzerland | PS-0307-A | |
| 1 ml syringe | Codan, Denmark | REF 62.1612 | |
| 26 Gauge needle for injection | Braun, Germany | 4657683 | |
| 20 Gauge needle for cytokine injection and immunization | Braun, Germany | 4657519 | |
| Luer lock tip glass syringes | Poulten & Graf, Germany | 7.140-37 | |
| 3 way stopcock | Becton Dickinson, Sweden | 394600 | |
| 96-well plate | Thermo Fisher Scientific, USA | 442404 | |
| Plate reader | Cole-Parmer, USA | EW-1396-00 | |
| 37°C incubator | Kendro, Germany | 50042301 | |
| Micropipettes | Gilson, USA | F167350 |
Referanslar
- Berkovich, R. Treatment of acute relapses in multiple sclerosis. Neurotherapeutics. 10 (1), 97-105 (2013).
- Kalincik, T. Multiple Sclerosis Relapses: Epidemiology, Outcomes and Management. A Systematic Review. Neuroepidemiology. 44 (4), 199-214 (2015).
- Feinstein, A., Freeman, J., Lo, A. C. Treatment of progressive multiple sclerosis: what works, what does not, and what is needed. The Lancet Neurology. 14 (2), 194-207 (2015).
- Montalban, X., et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. The New England Journal of Medicine. 376 (3), 209-220 (2017).
- Dyment, D. A., Ebers, G. C., Sadovnick, A. D. Genetics of multiple sclerosis. The Lancet Neurology. 3 (2), 104-110 (2004).
- Ascherio, A. Environmental factors in multiple sclerosis. Expert Review of Neurotherapeutics. 13, 3-9 (2013).
- Allen, I. V., McQuaid, S., Mirakhur, M., Nevin, G. Pathological abnormalities in the normal-appearing white matter in multiple sclerosis. Neurological Sciences. 22 (2), 141-144 (2001).
- Kutzelnigg, A., et al. Cortical demyelination and diffuse white matter injury in multiple sclerosis. Brain. 128 (11), 2705-2712 (2005).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the Neurological Sciences. 233 (1-2), 55-59 (2005).
- Lucchinetti, C. F., et al. Inflammatory cortical demyelination in early multiple sclerosis. The New England Journal of Medicine. 365 (23), 2188-2197 (2011).
- Peterson, J. W., Bo, L., Mork, S., Chang, A., Trapp, B. D. Transected neurites, apoptotic neurons, and reduced inflammation in cortical multiple sclerosis lesions. Annals of Neurology. 50 (3), 389-400 (2001).
- Kutzelnigg, A., Lassmann, H. Cortical demyelination in multiple sclerosis: a substrate for cognitive deficits. Journal of the Neurological Sciences. 245 (1-2), 123-126 (2006).
- Procaccini, C., De Rosa, V., Pucino, V., Formisano, L., Matarese, G. Animal models of Multiple Sclerosis. European Journal of Pharmacology. 759, 182-191 (2015).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: a clinical and histopathological perspective. Brain Pathology. 27 (2), 123-137 (2017).
- Lebar, R., Lubetzki, C., Vincent, C., Lombrail, P., Boutry, J. M. The M2 autoantigen of central nervous system myelin, a glycoprotein present in oligodendrocyte membrane. Clinical and Experimental Immunology. 66 (2), 423-434 (1986).
- Linington, C., Bradl, M., Lassmann, H., Brunner, C., Vass, K. Augmentation of demyelination in rat acute allergic encephalomyelitis by circulating mouse monoclonal antibodies directed against a myelin/oligodendrocyte glycoprotein. The American Journal of Pathology. 130 (3), 443-454 (1988).
- Panitch, H., Ciccone, C. Induction of recurrent experimental allergic encephalomyelitis with myelin basic protein. Annals of Neurology. 9 (5), 433-438 (1981).
- Tuohy, V. K., Sobel, R. A., Lees, M. B. Myelin proteolipid protein-induced experimental allergic encephalomyelitis. Variations of disease expression in different strains of mice. The Journal of Immunology. 140 (6), 1868-1873 (1988).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1952-1960 (2006).
- Mendel, I., Kerlero de Rosbo, N., Ben-Nun, A. A myelin oligodendrocyte glycoprotein peptide induces typical chronic experimental autoimmune encephalomyelitis in H-2b mice: fine specificity and T cell receptor V beta expression of encephalitogenic T cells. European Journal of Immunology. 25 (7), 1951-1959 (1995).
- McRae, B. L., et al. Induction of active and adoptive relapsing experimental autoimmune encephalomyelitis (EAE) using an encephalitogenic epitope of proteolipid protein. Journal of Neuroimmunology. 38 (3), 229-240 (1992).
- Bebo, B. F., Vandenbark, A. A., Offner, H. Male SJL mice do not relapse after induction of EAE with PLP 139-151. Journal of Neuroscience Research. 45 (6), 680-689 (1996).
- Oliver, A. R., Lyon, G. M., Ruddle, N. H. Rat and human myelin oligodendrocyte glycoproteins induce experimental autoimmune encephalomyelitis by different mechanisms in C57BL/6 mice. The Journal of Immunology. 171 (1), 462-468 (2003).
- Scheld, M., et al. Neurodegeneration Triggers Peripheral Immune Cell Recruitment into the Forebrain. The Journal of Neuroscience. 36 (4), 1410-1415 (2016).
- Chanaday, N. L., Roth, G. A. Microglia and astrocyte activation in the frontal cortex of rats with experimental autoimmune encephalomyelitis. Neuroscience. 314, 160-169 (2016).
- Pomeroy, I. M., Matthews, P. M., Frank, J. A., Jordan, E. K., Esiri, M. M. Demyelinated neocortical lesions in marmoset autoimmune encephalomyelitis mimic those in multiple sclerosis. Brain. 128 (11), 2713-2721 (2005).
- Merkler, D., et al. Differential macrophage/microglia activation in neocortical EAE lesions in the marmoset monkey. Brain Pathology. 16 (2), 117-123 (2006).
- Storch, M. K., et al. Cortical demyelination can be modeled in specific rat models of autoimmune encephalomyelitis and is major histocompatibility complex (MHC) haplotype-related. Journal of Neuropathology and Experimental Neurology. 65 (12), 1137-1142 (2006).
- Ludwin, S. K. Central nervous system demyelination and remyelination in the mouse: an ultrastructural study of cuprizone toxicity. Laboratory Investigation. 39 (6), 597-612 (1978).
- Skripuletz, T., et al. Cortical demyelination is prominent in the murine cuprizone model and is strain-dependent. The American Journal of Pathology. 172 (4), 1053-1061 (2008).
- Norkute, A., et al. Cuprizone treatment induces demyelination and astrocytosis in the mouse hippocampus. Journal of Neuroscience Research. 87 (6), 1343-1355 (2009).
- Acs, P., et al. 17beta-estradiol and progesterone prevent cuprizone provoked demyelination of corpus callosum in male mice. Glia. 57 (8), 807-814 (2009).
- Pott, F., et al. Cuprizone effect on myelination, astrogliosis and microglia attraction in the mouse basal ganglia. Brain Research. 1305, 137-149 (2009).
- Jeffery, N. D., Blakemore, W. F. Remyelination of mouse spinal cord axons demyelinated by local injection of lysolecithin. Journal of Neurocytology. 24 (10), 775-781 (1995).
- Blakemore, W. F. Ethidium bromide induced demyelination in the spinal cord of the cat. Neuropathology and Applied Neurobiology. 8 (5), 365-375 (1982).
- Mason, J. L., et al. Oligodendrocytes and progenitors become progressively depleted within chronically demyelinated lesions. The American Journal of Pathology. 164 (5), 1673-1682 (2004).
- Franco, P. G., Silvestroff, L., Soto, E. F., Pasquini, J. M. Thyroid hormones promote differentiation of oligodendrocyte progenitor cells and improve remyelination after cuprizone-induced demyelination. Experimental Neurology. 212 (2), 458-467 (2008).
- Lassmann, H., Bradl, M. Multiple sclerosis: experimental models and reality. Acta Neuropathologica. 133 (2), 223-244 (2017).
- Kerschensteiner, M., et al. Targeting experimental autoimmune encephalomyelitis lesions to a predetermined axonal tract system allows for refined behavioral testing in an animal model of multiple sclerosis. The American Journal of Pathology. 164 (4), 1455-1469 (2004).
- Merkler, D., Ernsting, T., Kerschensteiner, M., Bruck, W., Stadelmann, C. A new focal EAE model of cortical demyelination: multiple sclerosis-like lesions with rapid resolution of inflammation and extensive remyelination. Brain. 129, 1972-1983 (2006).
- Ucal, M., et al. Widespread cortical demyelination of both hemispheres can be induced by injection of pro-inflammatory cytokines via an implanted catheter in the cortex of MOG-immunized rats. Experimental Neurology. 294, 32-44 (2017).
- Gardner, C., et al. Cortical grey matter demyelination can be induced by elevated pro-inflammatory cytokines in the subarachnoid space of MOG-immunized rats. Brain. 136, 3596-3608 (2013).
- Minagar, A., et al. The thalamus and multiple sclerosis: modern views on pathologic, imaging, and clinical aspects. Neurology. 80 (2), 210-219 (2013).
- Tsunoda, I., Kuang, L. Q., Theil, D. J., Fujinami, R. S. Antibody association with a novel model for primary progressive multiple sclerosis: induction of relapsing-remitting and progressive forms of EAE in H2s mouse strains. Brain Pathology. 10 (3), 402-418 (2000).
- Lifshitz, J., Witgen, B. M., Grady, M. S. Acute cognitive impairment after lateral fluid percussion brain injury recovers by 1 month: evaluation by conditioned fear response. Behavioural Brain Research. 177 (2), 347-357 (2007).
- Kabadi, S. V., Hilton, G. D., Stoica, B. A., Zapple, D. N., Faden, A. I. Fluid-percussion-induced traumatic brain injury model in rats. Nature Protocols. 5 (9), 1552-1563 (2010).
- Leonard, J. R., Grady, M. S., Lee, M. E., Paz, J. C., Westrum, L. E. Fluid percussion injury causes disruption of the septohippocampal pathway in the rat. Experimental Neurology. 143 (2), 177-187 (1997).
- Hare, G. M., et al. Severe hemodilutional anemia increases cerebral tissue injury following acute neurotrauma. Journal of Applied Physiology. 103 (3), 1021-1029 (2007).
- Abbott, N. J. Evidence for bulk flow of brain interstitial fluid: significance for physiology and pathology. Neurochemistry International. 45 (4), 545-552 (2004).
- Amor, S., et al. Identification of epitopes of myelin oligodendrocyte glycoprotein for the induction of experimental allergic encephalomyelitis in SJL and Biozzi AB/H mice. The Journal of Immunology. 153 (10), 4349-4356 (1994).
- Adzemovic, M. Z., Zeitelhofer, M., Hochmeister, S., Gustafsson, S. A., Jagodic, M. Efficacy of vitamin D in treating multiple sclerosis-like neuroinflammation depends on developmental stage. Experimental Neurology. , 39-48 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır