Method Article
Крысиная модель широко распространенной церебральной кортикальной демиелинизации, индуцированной внутримозговой инъекцией провоспалительных цитокинов
* Эти авторы внесли равный вклад
В этой статье
Резюме
Протокол, представленный здесь, позволяет воспроизводить широко распространенную демиелинацию серого вещества обоих кортиковых полушарий у взрослых самцов темных крыс Агути. Метод включает внутримозговую имплантацию катетера, субклиническую иммунизацию против миелинового олигодендроцитарного гликопротеина и внутримозговую инъекцию провоспалительной цитокиновой смеси через имплантированный катетер.
Аннотация
Рассеянный склероз (РС) является наиболее распространенным иммуноопосредованным заболеванием центральной нервной системы (ЦНС) и постепенно приводит к физической инвалидности и смерти, вызванной поражениями белого вещества в спинном мозге и мозжечке, а также демиелинизации в сером веществе. В то время как обычные модели экспериментального аллергического энцефаломиелита подходят для исследования клеточно-опосредованного воспаления в спинномозговом и мозжечковом белом веществе, они не могут решить патологии серого вещества. Здесь мы представляем экспериментальный протокол для новой крысиной модели кортикальной демиелинизации, позволяющей исследуть патологические и молекулярные механизмы, приводящие к корковым поражениям. Демиелинизация индуцируется иммунизацией низкодозовым олигодендроцитарным гликопротеином (MOG) в неполном адъюванте Фройнда с последующей катетер-опосредованием внутримозговой доставкой провоспалительных цитокинов. Кроме того, катетер позволяет проводить несколько раундов демиелинизации, не вызывая травмы, вызванной инъекциями, а также внутримозговую доставку потенциальных терапевтических препаратов, проходящих доклиническое исследование. Метод также этически благоприятен, поскольку боль и дистресс или инвалидность животных контролируются и относительно минимальны. Ожидаемый срок реализации всего протокола составляет около 8 - 10 недель.
Введение
РС является иммуноопосредованным, воспалительным заболеванием ЦНС, которое в первую очередь повреждает миелиновые листы, но в конечном итоге приводит к потере аксонов и постоянному повреждению нейронов. РС является наиболее распространенным иммуноопосредованным заболеванием ЦНС с предполагаемой распространенностью около 2,3 миллиона человек во всем мире, по данным Национального обществаРС 1,и представляет собой серьезное личное и социально-экономическое бремя. Средний возраст начала заболевания составляет 30 лет и приводит к потере продуктивных лет, вызывая тяжелую инвалидность. РС в настоящее время неизлечим, и настоящие методы лечения направлены на управление симптомами во время острого рецидива при рецидивирующе-ремиттирующей РС и на изменение течения заболевания для снижения частоты рецидивов иммуномодулирующей терапией2,3. Ни один вариант лечения еще не доказал свою эффективность для прогрессирующих типов4,за исключением недавнего клинического испытания В-клеточной истощающей терапии, которая, как было показано, эффективна в подгруппе пациентов с первично-прогрессирующим РС (PPMS) с активным воспалением5. Хотя было идентифицировано несколько потенциальных генетических факторов6 и факторов риска окружающей среды7, этиология РС, однако, остается неизвестной.
РС характеризуется большими воспалительными демиелинизирующими бляшками и диффузными повреждениями белого вещества8,9. Очаговые поражения были связаны с обширной Опосредоточенная Т-клетками атака, разрушение олигодендроцитов, реактивный астроглиоз и аксональная дегенерация, приводящая к снижению двигательных нейронов. Демиелинизации серого вещества и атрофии получили признание в качестве дополнительных гистопатологических признаков заболевания9,10,11. Последнее было предложено способствовать неврологической дисфункции и снижению когнитивных функций у пациентов12,13 лет. Были выделены три паттерна кортикальной демиелинизации, а именно: i) лейкокортикальная, смежная с белым веществом поражения (34%), ii) мелкая, периваскулярная (16%) и iii) субпиальная (50%). В отличие от очаговых поражений белого вещества, эти поражения серого вещества, как сообщается, не имеют Опосредоточенную Т-клетками атаки и вместо этого характеризуются усиленной активацией микроглии, апоптозом и потерей нейронов12.
На сегодняшний день не удалось повторно оговорить РС человека на одной животной модели, во многом из-за сложности заболевания. Вместо этого были разработаны различные модели РС на животных, каждая из которых имитирует различные аспекты патогенеза и прогрессирования заболевания14,15. Современные модели животных имитируют три различных процесса заболевания: i) очаговые воспалительные поражения, ii) диффузное повреждение белого вещества и iii) диффузная патология серого вещества.
Исследования бляшек белого вещества РС на животных в основном проводились в моделях энцефаломиелита грызунов (EAE). Подопытных животных активно иммунизируют эмульсией, содержащей миелиновый антиген [обычно миелиновый олигодендроцитарный гликопротеин (MOG)16,17,основной белок миелина (MBP)18или протеолипидный белок (PLP)19],вместе с полным адъювантом Фройнда (CFA)20. Заболевание также может быть пассивно индуцировано путем принятия переноса миелин-специфических Т-клеток21. Течение заболевания зависит от используемой комбинации антиген/штамм мыши. НАпример, MOG35-55 в C57BL/6 приводит к монофазному хроническому заболеванию22,в то время как PLP139-151 у швейцарских мышей Jim Lambert (SJL) приводит к рецидивирующе-ремиттирующей болезни23 гендерно-специфической манерой24. Крысиный MOG35-55,кроме того, индуцирует энцефалитогенный Т-клеточный ответ, в то время как человеческий MOG35-55 индуцирует В-клеточное воспаление у мышей C57BL/625. Различные модели EAE обеспечивают отличный инструмент для изучения клеточно-опосредованного воспаления, в первую очередь в спинном мозге и мозжечке, но структуры переднего мозга, такие как кора, мозолистое тело и подкорковые структуры, остаются в значительной степени щадящими26. Кроме того, ни диффузное повреждение белого вещества, ни демиелинирование серого вещества не воспроизводятся адекватно в моделях EAE26,27. Кортикальная демиелинизации, связанная с активной индукциейEAE,была зарегистрирована у мартышек28,29 и у некоторых подстразов крыс Льюиса, в последнем случае приписывается преобладающим комбинациям изотипов и аллелей30класса I и класса II MHC.
Купризоновая модель31 является полезным инструментом для изучения диффузной демиелинизации белого вещества и патологии серого вещества с обширной демиелинизации кортикальной, подкорковой32и гиппокампа33 областей, а также мозолистого тела34 и хвостатого путамина35. Интоксикация купризоном, которая, в принципе, приводит к метаболическому стресс-индуцированию апоптоза олигодендроцитов, имитирует некоторые характеристики кортикального демиелинизирующего поражения мозга РС, такие как активация микроглии, астроглиоз и относительное отсутствие инфильтрирующих периферических иммунных клеток. Отсутствие нейронального апоптоза и таламической атрофии, а также полное разрешение демиелинизации с надежной ремиелинизации, наблюдаемое при прекращении приема пищевых добавок купризона32,однако, ограничивают использование интоксикации купризоном в качестве доклинической модели РС. Токсическое демиелинирование также может быть индуцировано очаговой инъекцией лизолецитина или бромида этидия в тракты белого вещества36,37,но эти методы используются редко. Модели токсической демиелинизации особенно подходят для анализа сложных механизмов ремиелинизации, таких как потребность в клетках-прародителях олигодендроцитов и астроцитах38,39. Подробная информация о моделях EAE и интоксикаций приведена в двух последних обзорах15,40.
Цитокин-индуцированная демиелинация была первоначально разработана для изучения поражений белого вещества позвоночника в EAE41. Позже он был модифицирован для изучения патологий серого вещества коры у MS. Темные агути (DA) или крысы Льюиса сначала праймированы субклинической иммунизацией MOG1-12542,43 или MOG1-11644 в неполном адъюванте Фройнда (IFA). В отличие от классических моделей EAE, эти праймлированные животные не проявляют клинических симптомов очаговых воспалительных поражений в спинном мозге. Вместо этого воспалительная реакция и демиелинация в головном мозге впоследствии достигаются внутримозговым введением провоспалительной цитокиновой смеси [фактор некроза опухоли альфа (TNFα) и интерферон гамма (IFNγ)], как только животные достигли стабильного титра анти-MOG антител в крови.
Исследования Мерклера и др. 42 и Гарднер и др. На фиг.44 доказана эффективность индукции субпиальной кортикальной демиелинизации субклинической иммунизацией MOG и внутримозговой или субарахноидальной инъекцией цитокинов. Однако заявленная продолжительность демиелинизации была слишком короткой - полная ремиелинация происходила через 14 дней или менее, тем самым ограничивая окно для любого фармакологического интервенционного тестирования. Кроме того, обе модели используют травматический инъекционный модус, который может сами по себе вызвать инъекционную травму и разрушение гематоэнцефалического барьера (ГЭБ) и, таким образом, привести к неконтролируемому набору воспалительных клеток в паренхиму. Кроме того, оба исследования продемонстрировали демиелинацию, которая ограничена ограниченной областью, в ипсилатеральной коре или в непосредственной близости от места инъекции цитокина.
Чтобы преодолеть эти ограничения, мы имплантировали катетер в правую теметальную кору крыс DA, причем наконечник катетера расположен чуть выше мозолистого тела. Чтобы обеспечить полное восстановление целостности ГЭБ, животным был предоставлен период покоя в 2 недели после имплантации катетера. Впоследствии крысы были субклинально иммунизированы 5 мкг рекомбинантного MOG1-125 в IFA. После достижения стабильного титра антител против MOG примерно через 4 недели 2 мкл цитокиновой смеси вводили через катетер в течение 10 мин с использованием программируемого шприцевого насоса. Эта процедура вызвала широко распространенную кортикальную демиелинизации как ипси-, так и контралатерального полушарий головного мозга через 15 дней, с частичной ремиелинией около 30 дней после инъекции цитокина43. Кроме того, множественные фазы демиелинизации могут быть вызваны повторным введением провоспалительных цитокинов через катетер, а глобальная атрофия мозга, общая черта прогрессирующих подтиповРС 45,может быть вызвана уже после второй фазы демиелинизации43. Важно отметить, что имплантированный катетер также может быть использован для тестирования фармакологических вмешательств.
Протокол, описанный ниже, предоставляет подробное объяснение экспериментальных этапов для воспроизводимой генерации широко распространенной кортикальной демиелинизации в обоих полушариях головного мозга крыс DA с использованием внутримозгового катетера.
протокол
Все методы, описанные здесь, были одобрены местными властями (Bundesministerium für Wissenschaft und Forschung (Министерство науки и исследований Австрии); Номер лицензии: 66.010/0132-WF/V/3b/2014). Взрослые самцы крыс DA (в возрасте 10-12 недель) были размещены в цикле 12/12 ч света / темноты со свободным доступом к пище и воде.
1. Подготовка материала
ПРИМЕЧАНИЕ: Операция проводится в асептических условиях. Перед началом работы убедитесь, что все хирургические инструменты, включая сверла, очищены соответствующим дезинфицирующим средством.
- Приготовьте анестетиковую смесь: 0,02 мг/мл фентанила, 0,4 мг/мл мидазолама и 0,2 мг/мл медетомидина (конечные концентрации в смеси).
ПРИМЕЧАНИЕ: Смотрите соответствующий раздел обсуждения для альтернативных анестетиков. - Приготовьте смесь антидотов: 0,07 мг/мл флумазенила и 0,42 мг/мл атипамезола (конечные концентрации в смеси).
- Соберите катетер и колпачок катетера с впускным отверстием и винтом. Вырежьте катетер на длину 2 мм скальпелем(рисунок 1).
ПРИМЕЧАНИЕ: Не используйте для этого ножницы, так как они сдавливают и искажают круглую форму поперечного сечения наконечника катетера.
2. Хирургическая подготовка
- Обезболить крысу внутрибрюшинным (т.п.) введением анестезирующего смеси (1,5 мл/кг массы тела).
- Побрить голову крысы между ушами с помощью электробритвы. Поместите гомеотермическое одеяло на стереотаксическую рамку перед позиционированием животного, чтобы избежать переохлаждения на протяжении всей операции.
- Обездвиживайте голову крысы в стереотаксической рамке, используя ушные перекладины и пластину укуса, гарантируя, что голова горизонтальна и стабильна. Проверьте стабильность, надавливая на череп пальцем или щипцами.
ПРИМЕЧАНИЕ: Слабая фиксация и негол горизонтальное позиционирование в стереотаксическом кадре могут привести к отклонению от намеченных координат. - Применяйте смазывающие глазные капли, чтобы предотвратить сухость роговицы во время операции. Закройте глаза непрозрачным материалом, чтобы предотвратить любое хирургическое воздействие света.
- Очистите бритый участок путем поперемежев применения 70% этанола и 10% повидон-йодного комплекса.
ПРИМЕЧАНИЕ: Соблюдайте все меры предосторожности во время операции, чтобы избежать инфекции. Операция проводится в асептических условиях. Если асептика нарушена, то загрязненный материал должен быть заменен.
3. Имплантация катетера
- Сделайте продольный разрез длиной около 2 см в середине кожи головы. Используйте бульдожьи зажимы, чтобы удерживать кожу в стороны. Обзор этих шагов см. на рисунке 2.
- Удалите кровь с помощью аппликатора с хлопковым наконечником.
- Удалить черепную покостную часть. Очистите ткань аппликатором с хлопковым наконечником и обнажите кость черепа. Дайте черепу высохнуть около 1 мин.
- Определите анатомические ориентиры, лямбда, брегму и медиаальный шов. Установив дрель на стереотаксическую раму, расположите наконечник сверла в Bregma в качестве отправной точки. Переместите 2 мм с задней части от Брегмы и переместите ~2,4 мм с боков к медиальному шву.
- Просверлите отверстие диаметром 0,5 мм для катетера в этом положении. Аккуратно смойте любую костную пыль.
ПРИМЕЧАНИЕ: Важно, чтобы твердое мозговое излияемая оболочка оставалась неповрежденной во время бурения. Чтобы обеспечить это, 1) используйте дрель, которая может быть установлена на стереотаксическую раму, 2) часто осматривайте отверстие во время сверления и 3) сверлите небольшими шагами - если на череп будет приложено слишком большое давление, наконечник сверла будет продолжаться и повреждать мозг, когда череп полностью проникнет. - Просверлите еще 3 отверстия (~1,3 мм в диаметре) для анкерных винтов на расстояние нескольких миллиметров от первого отверстия. Аккуратно сдуйте костную пыль.
ПРИМЕЧАНИЕ: Выберите места анкерного винта, которые обеспечивают достаточно места для верхней части катетера (~ 2 мм в диаметре) и верхушки анкерного винта (~ 1 мм). - Удалите костную пыль путем орошения примерно 1 - 2 мл стерильного фосфатно-буферного физиологического раствора (PBS) или физиологического физиологического раствора с помощью шприца. Очистите череп. Затяните анкерные винты на 2 - 3 полных оборота.
ПРИМЕЧАНИЕ: Анкерные винты необходимы для стабилизации установки, удерживая зубной цемент и, следовательно, катетер на месте. Затягивая анкерный винт, убедитесь, что его нелегко снять, осторожно подняв его вверх щипцами. Поскольку имплантация самого катетера вызывает травму ткани, дополнительное повреждение твердой мозговой оболочки во время сверления или затягивания анкерных винтов приведет к множественным травматическим повреждениям и, возможно, затруднит сопоставимость в группе. Сначала затяните анкерные винты, а затем вставьте катетер. - Вставьте катетер длиной 2 мм через первое отверстие, перпендикулярное поверхности черепа. Все еще удерживая катетер, нанесите немного зубного цемента и дайте ему полимеризоваться с коротким (~ 5 с) воздействием зубного отверждающего света, чтобы стабилизировать катетер, что позволит использовать обе руки на следующем этапе.
ВНИМАНИЕ: При работе с зубным отверждающим светом избегайте смотреть прямо на кончик или на свет, отраженный от области применения, так как высокая интенсивность этого света может привести к повреждению сетчатки. Используйте соответствующие защитные очки. - Нанесите больше зубного цемента вокруг катетера, закрепите винты и затвердите зубной цемент с помощью света отверждения зубов (~ 15 - 30 с). Подтвердите затвердевание цемента кончиком щипца.
4. Закрытие раны и антагонизм анестезии
- Закройте кожу головы рассасываясь швами, передней и задней частью катетера.
ПРИМЕЧАНИЕ: Поскольку в конце имплантации над черепом будет ухабистая установка, сделайте закрытие раны соответствующим образом. Слишком сильное поднятие кожи приведет к дискомфорту для животного. - Вводят смесь антидотов подкожно (1,5 мл/кг массы тела) с помощью шприца объемом 1 мл с иглой 26 г.
- Вводят энрофлоксацин (2,5%) путем подкожной инъекции (7,5 мг/кг массы тела) для профилактического лечения антибиотиками. Вводят карпрофен (1 мг/мл; 5 мг/кг массы тела) и бупренорфин (1,2 мг/кг) для облегчения боли путем подкожной инъекции.
5. Послеоперационный уход и медикаментозное лечение
- Верните животное в модифицированную клетку и держите его под наблюдением в течение 1 - 3 ч, с применением инфракрасного света во избежание переохлаждения. Постоянно наблюдайте и перепозиционировать животное каждые 5 - 10 минут до послеоперационного выздоровления. Проявите особую осторожность, чтобы избежать постоянного воздействия света на глаза до выздоровления.
- Повторите введение энрофлоксацина (7,5 мг/кг массы тела) и карпрофена (1 мг/мл; 5 мг/кг массы тела) путем подкожных инъекций на следующий день после операции. Бупренорфин не нужно обновлять, так как предыдущее лечение эффективно в течение 72 часов.
6. Приготовление иммунизационной смеси (не ранее чем через 14 дней после имплантации катетера)
Примечание: Поместите шприцы на лед во время процедуры подготовки.
- Соедините два стеклянных шприца с запорным наконечником Luer емкостью 10 мл к коротким рычагам 3-стороннего стоп-крана и закройте третье выходное отверстие длинным рычагом.
- Убедитесь, что соединения безопасны и не имеют утечек: добавьте приблизительно 4 мл стерильного PBS в открытый шприц, удерживая поршень 2. Вставьте поршень 1 и толкайте оба поршня вперед и назад, проверяя утечку. Если утечки не происходит, выбросьте PBS и снова удалите поршень 1.
- Пипетку 1 мл IFA и 50 мкг rMOG1-125 вместе и отрегулируйте смесь до конечного объема 2 мл со стерильным PBS (pH 7,4) в подходящей трубке.
ПРИМЕЧАНИЕ: В связи с потерями эмульсии на кончиках или стенках шприцев во время приготовления, готовят больший объем, чем предполагалось для введения. Точно так же практичнее готовиться к более чем 1 животному одновременно. - Поместите разбавленные смеси IFA и rMOG1-125 в открытый шприц. Вставьте поршень осторожно, сохраняя при этом слабое давление на противоположный поршень(рисунок 3А).
- Эмульгируйте инокулятивный, приводя его от одного шприца к другому, толкая поршни вперед и назад, пока он не будет белым и вязким(рисунок 3B).
- Прикрепите шприц с замком Luer 1 мл к открытому короткому плечу 3-стороннего запорного крана и заполните его инокулятором(рисунок 3C). Распределите весь инокулят по 1 мл шприцев. Держите его на льду до инъекции. Ввести смесь в день приготовления.
7. Иммунизация
- Обезболить крысу изофтораном в камере (~2 мин, смешать с кислородом 2 л/мин), а затем выдержать анестезию через маску (смешанную с кислородом 1,5 л/мин).
- Вводят 200 мкл инокулята подкожно в основание хвоста с помощью иглы 21 г.
ПРИМЕЧАНИЕ: Вводите инъекцию медленно, так как раствор вязкий.
8. Определение титров антител
- Выводит ~200 мкл крови через 4 недели после иммунизации с целью определения титров анти-MOG антител.
- Покрывайте колодцы 96-скважинной плиты MOG (5 мкг/мл в PBS) и инкубируете их в течение 1 ч при 37 °C.
- Блокируют пластину с 1% бычным сывороточным альбумином (BSA) в PBS в течение 1 ч при комнатной температуре.
- Инкубировать пластину с крысиной сывороткой (1:50) и стандартную ее в течение 2 ч при 37 °C. Вымойте пластину 3x с 200 мкл PBS/Полисорбата 20.
- Инкубировать пластину с пероксидазно-конъюгированным анти-крысиным вторичным антителом IgG (1:10 000). Вымойте пластину 3x с 200 мкл PBS/Полисорбата 20.
- Добавляют 100 мкл раствора пероксидазного субстрата на скважину и инкубируют его в течение 20 - 30 мин в темноте при комнатной температуре.
- Измерьте оптическую плотность на длине волны 405 нм и вычислите титр антител из оптической плотности с помощью стандартной кривой.
9. Внутримозговая инъекция цитокинов
- Отрегулируйте длину разъема канюли (2 мм). (Этапы подготовки см. на рисунке 4.)
- Заполните шприц 1 мл смесью цитокинов (500 нг/мкл TNF-альфа, 300 ЕД/мкл рекомбинантного крысиного IFN-гамма в стерильном PBS). Подключите шприц к разъему канюли. Наполните канюлю смесью цитокинов. Избегайте любых пузырьков.
- Установите шприц на программируемый шприцевой насос и запрограммируем его на впрыск 0,2 мкл/мин(рисунок 5А). Запустите насос и поддерживайте его в рабочем состоянии, чтобы избежать образования пузырьков воздуха на кончике канюли.
ПРИМЕЧАНИЕ: Скорость впрыска должна учитывать внутренний диаметр конкретного используемого шприца; таким образом, диаметр шприца должен быть зарегистрирован во время настройки насоса. - Обезболить крысу изофлураном в камере (~2 мин, смешанные с 2 л/мин кислорода), а затем выдержать анестезию через маску (смешанную с 1,5 л/мин кислорода)(рис. 5В и 5С). Нанесите смазывающие глазные капли, так как животное будет обезболиваться в течение не менее 30 минут.
- Снимите колпачок катетера с помощью входного отверстия. Вставьте соединительную канюлю в катетер и прикрутите и затяните ее(рисунки 5D и 5E).
ПРИМЕЧАНИЕ: Не перетягивайте его, так как это разрушит верхний наконечник катетера. - Дайте инъекции продолжаться в течение 10 мин (общий объем инъекции составляет 2 мкл). Остановите насос. Оставьте канюлю внутри катетера на 20 минут, чтобы объем инъекции полностью рассеялся.
- Открутите соединительную канюлю и медленно снимите ее, чтобы избежать эффекта вакуума.
- Прикрепите колпачок катетера к входу и прикрутите его. Дайте животному восстановиться после анестезии в клетке.
Результаты
Кортикальная демиелинация может быть оценена в разные моменты времени после инъекции цитокина с помощью иммуногистохимии для протеолипидного белка (PLP)(рисунок 6). На рисунке 6A показана неповрежденная иммунореактивность PLP на 15-й день у MOG-иммунизированного контрольного животного, которое получало только стерильный PBS через имплантированный катетер. На 1-й день после инъекции цитокинов демиелинизация уже могла быть обнаружена у животных, загрунтованных MOG, хотя и только в непосредственной близости от катетеризованной области(рисунок 6B). Иммунореактивность PLP остается неповрежденной в контралатеральной коре через 1 день после инъекции цитокина. На 3 день можно наблюдать постепенное увеличение потери иммунореактивности ПЛП, которая распространяется в ипсилатеральной коре(рисунок 6С). Контралатеральная кортикальная демиелинация также может быть обнаружена на 3-й день(фиг.6D),но она скорее ограничена областью под анкерными винтами, возможно, из-за низкопоточной области интерстициальной жидкости, вызванной анкерными винтами43. Отсутствие аналогичного наблюдения у контрольных животных, вводимых ВБС, исключает возможность вызванной травмой демиелинизации, вытекающей из анкерного винта.
Между 9 - 15 днями демиелинизация поражает большие части коры обоих полушарий(рисунки 6E, 6Fи 6G). Это совпадает с наблюдением медленного поведения, хотя и без статистически значимого снижения двигательных навыков в ротарод-тесте43. Кортикальная демиелинация поддерживается до 30 дней после инъекции цитокинов в обоих полушариях(рисунки 6H и 6I)только с частичной ремиелинцией. На рисунке 6J показана количественная оценка потери PLP в сером веществе коры после внутримозгового введения цитокинов. Следует отметить, что иммунореактивность ПЛП еще не оценивалась после периодов более 30 дней; таким образом, мгновенное разрешение ремиелинизации, если таковое имеется, еще предстоит оценить с помощью дальнейших экспериментов. Второе введение цитокиновой смеси через имплантированный катетер через 30 дней после первой инъекции приводит к выраженной атрофии мозга на 15-й день(рисунок 7).

Рисунок 1:Подготовка катетера. (А иВ) Направляющая канюля и манекен канюля (катетерная колпачка с впускным отверстием) собираются и привинчиваются. (C) Затем катетер разрезается до 2 мм в размере с помощью скальпеля. Микроскопическое наблюдение показало, что использование ножниц для этой цели искажает круглую форму кончика канюли, и, тем самым, ее следует избегать. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
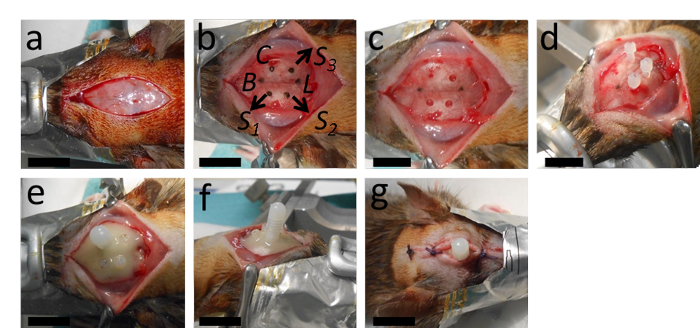
Рисунок 2:Имплантация катетера. (А)Операция начинается с продольного разреза и удаления надкости. (Б, В) На этой панели показана маркировка места для катетера на 2 мм с задней стороны от Брегмы и 2,4 мм сбоку справа от сагиттального шва; а также места для отверстий, предназначенных для трех анкерных винтов с соответствующим расстоянием от катетера и лямбда. (D)После сверления отверстия катетера (диаметром 0,5 мм, с круглым наконечником сверла) и отверстий для анкерных винтов (диаметром 1,3 мм со скрученным сверлильной головкой) анкерные винты затягиваются. (E, F) Затем вводится катетер и вся установка стабилизируется полимеризующим зубным цементом. (G) Рана зашивается двумя или тремя узлами с передней и задней частью катетера. B = Брегма; L = лямбда; C = катетер; S1, S2 и S3 = места для отверстий для трех анкерных винтов. Шкала = 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
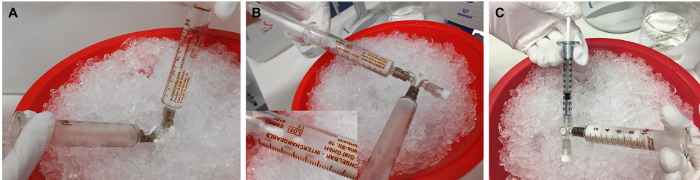
Рисунок 3:Получение эмульсии rMOG/IFA. (A) Смесь rMOG, PBS и IFA эмульгируют путем нажатия инокулята от одного шприца к другому путем проталкивания поршней вперед и назад, (B) до тех пор, пока он не будет белым и вязким. (C) Впоследствии инокулят распределяют по 1 мл шприцев для инъекции. 5 мкг rMOG используется в 200 мкл смеси PBS/IFA для субклинальной иммунизации одной крысы; однако из-за потерь на кончиках и стенках шприцев во время приготовления следует приготовить больший объем. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4:Подготовка соединительной канюли. (A - D) Эти панели показывают, как соединитель и внутренний соединитель собираются с помощью канюли размером 2 мм. (E) Внутренняя часть вырезается до того же размера, что и направляющая канюля с помощью скальпеля(F),а затем направляющая шаблона откручивается. (G)Другой конец соединительной канюли закреплен на шприце 1 мл, который содержит инъекционную смесь, с помощью иглы 20 г. Шкала = 3 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5:Внутримозговая инъекция. (A)Программируемый шприцевой насос регулируется для скорости впрыска 2 мкл / мин, и шприц 1 мл, заполненный цитокиновой смесью (или стерильным PBS для органов управления), устанавливается на насос. (B)Животное сначала анестезируют в камере с использованием 5% изофлурана с потоком кислорода 2 л / мин, а затем (C) анестезию поддерживают через маску с использованием 2,5% изофлурана с потоком кислорода 1,5 л / мин. (D) Колпачок катетера с входом (фиктивная канюля) привинчивается, и инъекционная канюля вводится через имплантированный катетер. Поскольку объем инъекции очень мал, исследователь должен быть осторожен, чтобы избежать пузырьков воздуха на кончике канюли. По этой причине важно начинать вставку во время работы насоса и только тогда, когда на кончике растет пузырь жидкости. Дополнительный объем все равно не попадет в мозг, так как он разрушается поверх катетера перед введением. (E) Затем соединительную канюлю затягивают, и насосу дают работать в течение 10 минут. После 10 мин инъекции насос останавливают, а канюлю оставляют внутри на 15 - 20 мин, чтобы обеспечить диффузию вводимого объема в интерстициальную жидкость. Шкала стержней = 5 см, если не указано иное. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
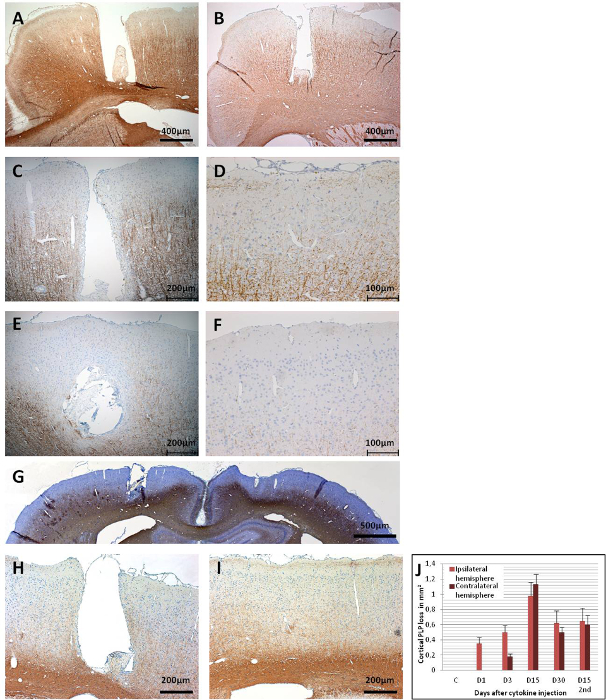
Рисунок 6:Иммунореактивность PLP в коронарных отделах мозга. (A) На этой панели показан контрольный мозг (MOG-праймированный) с инъекцией PBS (день 15), который не приводит к кортикальной демиелинизации. (B) Уже на 1-й день после инъекции цитокинов демиелинизация проявляется в области катетера. (C)Более широкая потеря иммунореактивности PLP наблюдается в ипсилатеральной коре на 3-й день(D),а также на контралатеральной стороне. Широко распространенная потеря иммунореактивности PLP наблюдается в обоих полушариях на 15-й день, так как(E)эта панель показывает ипсилатеральную кору и(F)эта панель показывает контралатеральную кору. (G)Обзор обоих полушарий приведен в демонстрации широко распространенной потери ПЛП на 15-й день. На 30-й день, поскольку(H)эта панель показывает ипсилатеральную кору и(I)эта панель показывает контралатеральную кору, все еще наблюдается замечательная демиелинация, но также могут наблюдаться некоторые ремиелинированные области. (J)На этой панели показана количественная оценка демиелинизации (потери PLP в мм2/полушарие). 1,5 - 2 мкм корональные участки мозга использовались для обнаружения PLP с MS anti-PLP с коэффициентом разбавления 1:500. Срезы были уравновешино гематоксилином для клеточных ядер. Для получения подробной информации об иммуногистохимии см. Ucal et al. 43. Панели G и J были изменены по сравнению с Ucal et al. 43. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
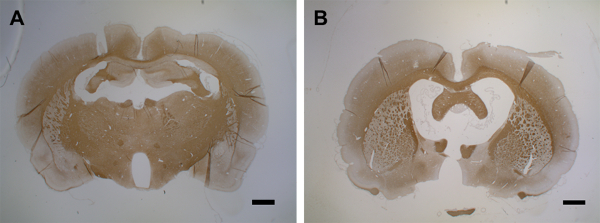
Рисунок 7:Атрофия мозга после второй инъекции цитокина. (A) На этой панели показан контрольный мозг (MOG-праймированный) с инъекцией PBS (день 15). (B)На 15-й день после первой инъекции цитокина вторая инъекция приводит к атрофии мозга в течение 15 дней. 1,5 - 2 мкм корональные участки мозга использовались для обнаружения PLP с MS anti-PLP с коэффициентом разбавления 1:500. Срезы были уравновешино гематоксилином для клеточных ядер. Для получения подробной информации об иммуногистохимии см. Blakemore37. Шкала = 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8:Модифицированные клетки для предотвращения удаления катетера животным. В стандартных клетках пространство держателя пищи на сетке расположено ближе к дну клетки, создавая рискованное узкое пространство, увеличиваемое вероятность запутывания катетера с сеткой и, тем самым, ее удаления. Чтобы этого избежать, клетку приходится модифицировать. Это узкое пространство было перекрыто прозрачной плоскостью, позволяющей соблюдать животное. Пища должна быть дана внутри клетки в этих модифицированных клетках. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Наш метод использует крыс DA. Адаптация к мышам, вероятно, потребует использования меньшего катетера и винтов. Следует также иметь в виду, что течение заболевания, воспалительная реакция и степень демиелинизации могут отличаться от того, что представлено здесь, если используется другой вид / штамм. Такие различия наблюдались с классическими моделями EAE с использованием различных штаммов мышей. НАпример, MOG92-106 крысьего происхождения приводил к первично-прогрессивной или вторичной прогрессирующей EAE у мышей A.SW, в то время как он индуцировал рецидивирующе-ремиттирующую EAE у мышей SJL / J46. Поэтому следует использовать животных одного и того же штамма. Гендерные различия в проявлении EAE также были зарегистрированы в различных предыдущих исследованиях24. Возникновение таких гендерных эффектов вполне можно было бы ожидать в связи с протоколом, описанным здесь, однако еще предстоит проверить в ходе дальнейших экспериментов.
Для хирургического вмешательства используется внутрибрюшинное (ИП) введение смеси анестетиков, содержащей 0,02 мг/мл фентанила, 0,4 мг/мл мидазолама и 0,2 мг/мл медетомидина. Взрослым самкам крыс DA весом 270 - 300 г требуется около 0,4 - 0,6 мл этой смеси(т.е.~ 1,5 мл / кг), чтобы вызвать анестезию продолжительностью 60 - 90 минут. После операции анестезия антагонизмируется подкожной инъекцией антидота, содержащего 0,07 мг/мл флумазенила и 0,42 мг/мл атипамезола в физиологическом физиологическом растворе (0,9% NaCl). Доза 1 - 1,5 мл/кг противодействовает анестезии в течение 5 мин. В качестве альтернативы животным может быть позволено просыпаться спонтанно после физиологического вымывания анестетиков, но в этом случае животных необходимо будет держать под наблюдением до тех пор, пока они не станут полностью сознательными.
Другие варианты анестезии, часто используемые для операций на животных, такие как инъекция IP кетамина и ксилазина47 или пентобарбитала натрия48или ингаляция летучих анестетиков, таких как изофторан49 и галотан50,также могут быть рассмотрены для операции, представленной здесь. Однако крайне важно выбрать анестетик, который не мешает предполагаемому последующему вмешательству (вмешательствам).
Во время иммунизации и внутримозгового введения цитокинов для анестезии используется 5% изофлуран. Модель, описанная здесь, была создана с использованием крыс, и перечисленные экспериментальные детали, таким образом, конкретно применимы к крысе. Координаты имплантации катетера были выбраны для одновременного анализа возможных изменений белого вещества (наконечник катетера в мозолистом теле). В то время как место введения катетера может варьироваться в отношении переднезадней и боковой позиции, выбор центральной борозды требует предотвращения повреждения верхнего сагиттального синуса.
Еще одной особенностью описанного способа является эквивалентное демиелинирование как ипси-, так и контралатерального полушарий, возможно, возникающее в результате носительства введенной цитокиновой смеси в субарахноидальное пространство физиологическим потоком интерстициальной жидкости из корковыхобластей 51. Режим инъекции, а не расположение катетера, следовательно, вызывает демиелинацию по всей коре головного мозга, и выбор правой или левой теменной коры должен, таким образом, быть несущественным в этом отношении.
В протоколе используется катетер 26 Г, который достаточно мал, чтобы избежать обширного травматического повреждения, и достаточно велик, чтобы избежать повышенной скорости засорения наконечника катетера в течение длительного курса эксперимента. Безусловно, имплантация и наличие самого катетера вызывают астроцитарную и микроглиальную активацию, также у контрольных животных, получающих только имплантацию катетера; однако это незначительно по сравнению с животными, вводимыми цитокинами. 43 Чтобы избежать каких-либо помех при последующих анализах, мы использовали МРТ-совместимые катетеры, изготовленные из поли-эфир-эфир-кетона (PEEK).
Подобная глубина демиелинизации, по сути, создается как в ипси-, так и в контралатеральных областях представленным методом. Это означает, что глубина /длина катетера может не играть важной роли в характере и степени демиелинизации в коре. Поэтому можно рассмотреть возможность модификации длины катетера, чтобы уменьшить размер поражения, вызванного катетером. Тем не менее, значительно более короткая длина катетера может вызвать немного менее выраженную кортикальная демиелинизация, в то время как окончательный ответ будет получен только в экспериментах, специально проверяя длину катетера.
Одним из преимуществ модели является то, что имплантированный катетер позволяет тестировать потенциальные терапевтические средства, вводимые в кору через катетер, чтобы обеспечить ремиелинацию на пике гистологически обнаруживаемой кортикальной демиелинизации (день 15 или позже), в то время как в условиях предварительной обработки это будет после иммунизации, но до инъекции цитокина. Таким образом, решение о сроках введения терапевтических средств будет зависеть от конкретного вопроса исследования и препарата, представляющий интерес.
После имплантации катетера важно размещать животных одиночными в модифицированных (предпочтительно с высоким верхом) клетках, чтобы избежать удаления катетера до конца исследования(рисунок 8). Животные могут также открутить крышку катетера с входом, хотя это происходит редко. Животные должны наблюдаться ежедневно, а снятые колпачки должны быть заменены на свежие, чтобы избежать закупорки наконечника катетера при отсутствии впускного входа и обеспечить точную доставку в паренхиму после внутримозговой инъекции. Животные иммунизируются не ранее чем через 2 недели после имплантации катетера, чтобы обеспечить заживление и закрытие гематоэнцефалических барьеров.
Титры анти-MOG в сыворотке крови должны быть измерены после иммунизации. Эксперимент «доза-реакция» показал, что 5 мкг MOG1-125 (в IFA) обеспечивают достаточную иммунизацию в течение 4 недель у взрослых самцов крыс DA. Титра в 5000 мкг/мл и выше было бы достаточно, но, безусловно, он будет зависеть от нескольких факторов, включая препарат MOG и штамм животных, и, таким образом, должен быть определен индивидуально. Важно избегать чрезмерно высоких доз антигенов, которые потенциально могут привести к классическому фенотипу EAE с парализованными задними конечностями еще до инъекции цитокина.
Каждое животное иммунизируется 5 мкг рекомбинантного миелинового олигодендроцитарного гликопротеина (rMOG1-125),эмульгированного в 200 мкл неполного адъюванта Фройнда (IFA). Поскольку часть эмульсии теряется внутри шприца во время приготовления, желательно приготовить больше этого количества для каждого животного. Мы использовали рекомбинантный MOG (1-125 из N-конца КРЫСиного MOG), который экспрессировали в кишечной палочке и затем очищали до однородности хелатной хроматографией, растворяли в 6 М мочевины и диализовали против PBS для получения физиологического препарата52,53. Коммерчески доступный MOG, однако, также может быть использован.
Другие антигенные препараты, такие как MOG1-116,MOG35-55 или PLP139-151, используются в различных моделях EAE, а различия между антигенами и штаммами животных, как известно, вызывают различные фенотипы заболеваний в этих моделях20. Эти препараты антигена не тестировались на крысах DA и, если они использовались в предпочтении rMOG1-125,могли бы вызвать фенотип заболевания или результаты гистологии, отличающиеся от того, что представлено здесь.
Соединительная канюля той же длины, что и катетер, готовится перед внутримозговой инъекцией. Это можно сделать, собрав его с помощью шаблонного катетера и разрезав до одинакового размера (2 мм в длину)(рисунок 4). Важно, чтобы соединительная канюля была без пузырьков воздуха во время инъекции цитокина - поскольку объем инъекции составляет всего 2 мкл, даже крошечный пузырь воздуха на кончике канюли значительно уменьшит объем жидкости, успешно доставляемой в мозг. Это достигается путем поддержания работы насоса и введения канюли только тогда, когда на кончике присутствует растущая капля инъекционной жидкости. После введения канюли соединитель привинчивается к катетеру, избегая при этом чрезмерного затягивания, чтобы не повредить верхний наконечник катетера, что затруднит повторение после инъекции. Скорость инъекции 0,2 мкл/мин используется для предотвращения травмы, вызванной инъекцией. Кроме того, медленная инъекция в сочетании с 20-минутным периодом ожидания после инъекции обеспечивает диффузию введенной жидкости в интерстициальную жидкость и эффективный слив в ликвор. Затем канюля медленно удаляется, чтобы избежать эффекта вакуума.
Представленный метод включает хирургическое вмешательство и, следовательно, требует персонала, способного выполнять стереотаксическую операцию по выживанию. Персонал, набирающий непосредственный контакт с животными, должен был проходить соответствующие курсы экспериментов на животных. Остальная часть протокола может быть выполнена компетентными членами лаборатории.
Метод предназначен для получения вызванной воспалением демиелинизации коры головного мозга и не воспроизводит все особенности РС человека(например,возникновение очаговых воспалительных поражений белого вещества, что является отличительной чертой РС человека).
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить всех сотрудников Института биомедицинских исследований при Медицинском университете Граца за помощь и сотрудничество, а также Кристофера Джона Райтона за корректуру рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Adult male Dark Agouti rats (300 ±25 g) | |||
| Fentanyl | Hameln pharma plus, Germany | as Fentanyl-Citrate, 50 µg/ml | |
| Midazolam | ERWO Pharma, Austria | 50039017 | 5 mg/ml |
| Medetomidin | Orion Pharma, Finland | as Medetomidin hydrochloride, 1mg/ml | |
| Flumazenil | Roche, Switzerland | 0.1 mg/ml | |
| Atipamezol | Orion Pharma, Finland | as Atipamezol hydrochloride, 5 mg/ml | |
| 10% povidone-iodine complex | Mundipharma, Austria | ||
| Dental cement | Heraeus Kulzer, Germany | 6603 7633 | |
| Physiological saline solution | Fresenius Kabi, Austria | 0.9% NaCl | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich, Germany | P3813 | |
| Isofluorane | AbbVie, Austria | ||
| Lubricating eye drops | Thea Pharma, Austria | ||
| 70% EtOH | Merck, Germany | 1070172511 | Absolute ethanol was diluted in ddH2O for preparation of 70% v/v |
| 2.5% enrofloxacin | Bayer, Germany | Prophylactic antibiotics | |
| carprofen | Pfizer, USA | Painkillers, 50 mg/ml | |
| Tween-20 | Sigma-Aldrich, Germany | P9416 | |
| Pentobarbital | Richter Pharma, Austria | pentobarbital sodium, 400 mg/ml | |
| Interferon gamma | PeproTech, USA | 400-20 | |
| Tumor necrosis factor alfa | R&D Systems, USA | 510-RT-050/CF | |
| rMOG1-125 | own product at the Centre of Molecular Medicine, Karolinska Institute, Sweden | Recombinant rat myelin oligodendrocyte glycoprotein, amino acids 1-125 from the N-terminus, also commercially available: AnaSpec, AS-55152-500, USA | |
| Anti-MOG antibody | Ana Spec/Kaneka Corporation, Japan | AS-555157 | Standard from ELISA-Kit; Ana Spec/Kaneka |
| Incomplete Freund’s adjuvant | Sigma-Aldrich, Germany | F5506 | |
| Horse radish peroxidase conjugated anti-rat IgG secondary antibody | Ana Spec/Kaneka Corporation, Japan | AS-555157 | Secondary Antibody from ELISA-Kit; Ana Spec/Kaneka Corporation |
| Bovine serum albumin | Sigma-Aldrich, Germany | A9576 | |
| Peroxidase substrate solution | Vector Laboratories, USA | SK-45000 | |
| Stereotactic frame | David Kopf Instruments, USA | ||
| Catheters, MRI suitable | PlasticsOne, USA | 8IC315GPKXXC | |
| Dummy cannulas | PlasticsOne, USA | 8IC315DCNSPC | |
| Plastic screws, MRI suitable | PlasticsOne, USA | 8L080X093N01 | |
| Connector cannula | PlasticsOne, USA | 8IC313CXSPCC | |
| Screw driver with 2mm tip-size | |||
| Drill with flexible shaft extension | Proxxon, Germany | NO 28 472, NO 28 706, NO 28 620, | |
| Drill bit, round, 0.5 mm | Hager & Meisinger, Germany | REF310 104 001 001 009 | |
| Drill bit, twisted, 1.3 mm | Hager & Meisinger, Germany | REF350 104 417 364 013 | |
| Scalpel | Braun, Germany | BB510 | |
| Scalpel handle | Fine Science Tools, Germany | 91003-12 | |
| Cotton tip applicator | Henry Schein Medical, Austria | 900-3155 | |
| Surgical scissors | Fine Science Tools, Germany | 14101-14, 14088-10 | |
| Surgical forceps | Fine Science Tools, Germany | 11002-12, 11251-35 | |
| Bulldog clamps | Fine Science Tools, Germany | 18050-35 | |
| Homoeothermic blanket | TSE systems, Germany | ||
| Infrared Lamp | Beurer, Germany | 616.51 | |
| Dental curing light | Guilin Woodpecker Medical, China | ||
| Absorbable suture | Johnson & Johnson, Belgium | V792E | |
| Programmable syringe pump | World Precision Instruments, USA | AL-1000 | |
| Exam gloves | |||
| Surgical gown | |||
| Electric Shaver | Aesculap, Germany | GT420 | |
| Volatile anesthetic vaporizer | Rothacher Medical, Switzerland | CV 30-301-D | |
| Oxygen source for volatile anesthetic vaporizer | Air Liquide, Austria | 19,113 | |
| Volatile anesthesia chamber | Rothacher Medical, Switzerland | PS-0347 | |
| Anesthesia mask for rats | Rothacher Medical, Switzerland | PS-0307-A | |
| 1 ml syringe | Codan, Denmark | REF 62.1612 | |
| 26 Gauge needle for injection | Braun, Germany | 4657683 | |
| 20 Gauge needle for cytokine injection and immunization | Braun, Germany | 4657519 | |
| Luer lock tip glass syringes | Poulten & Graf, Germany | 7.140-37 | |
| 3 way stopcock | Becton Dickinson, Sweden | 394600 | |
| 96-well plate | Thermo Fisher Scientific, USA | 442404 | |
| Plate reader | Cole-Parmer, USA | EW-1396-00 | |
| 37°C incubator | Kendro, Germany | 50042301 | |
| Micropipettes | Gilson, USA | F167350 |
Ссылки
- Berkovich, R. Treatment of acute relapses in multiple sclerosis. Neurotherapeutics. 10 (1), 97-105 (2013).
- Kalincik, T. Multiple Sclerosis Relapses: Epidemiology, Outcomes and Management. A Systematic Review. Neuroepidemiology. 44 (4), 199-214 (2015).
- Feinstein, A., Freeman, J., Lo, A. C. Treatment of progressive multiple sclerosis: what works, what does not, and what is needed. The Lancet Neurology. 14 (2), 194-207 (2015).
- Montalban, X., et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. The New England Journal of Medicine. 376 (3), 209-220 (2017).
- Dyment, D. A., Ebers, G. C., Sadovnick, A. D. Genetics of multiple sclerosis. The Lancet Neurology. 3 (2), 104-110 (2004).
- Ascherio, A. Environmental factors in multiple sclerosis. Expert Review of Neurotherapeutics. 13, 3-9 (2013).
- Allen, I. V., McQuaid, S., Mirakhur, M., Nevin, G. Pathological abnormalities in the normal-appearing white matter in multiple sclerosis. Neurological Sciences. 22 (2), 141-144 (2001).
- Kutzelnigg, A., et al. Cortical demyelination and diffuse white matter injury in multiple sclerosis. Brain. 128 (11), 2705-2712 (2005).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the Neurological Sciences. 233 (1-2), 55-59 (2005).
- Lucchinetti, C. F., et al. Inflammatory cortical demyelination in early multiple sclerosis. The New England Journal of Medicine. 365 (23), 2188-2197 (2011).
- Peterson, J. W., Bo, L., Mork, S., Chang, A., Trapp, B. D. Transected neurites, apoptotic neurons, and reduced inflammation in cortical multiple sclerosis lesions. Annals of Neurology. 50 (3), 389-400 (2001).
- Kutzelnigg, A., Lassmann, H. Cortical demyelination in multiple sclerosis: a substrate for cognitive deficits. Journal of the Neurological Sciences. 245 (1-2), 123-126 (2006).
- Procaccini, C., De Rosa, V., Pucino, V., Formisano, L., Matarese, G. Animal models of Multiple Sclerosis. European Journal of Pharmacology. 759, 182-191 (2015).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: a clinical and histopathological perspective. Brain Pathology. 27 (2), 123-137 (2017).
- Lebar, R., Lubetzki, C., Vincent, C., Lombrail, P., Boutry, J. M. The M2 autoantigen of central nervous system myelin, a glycoprotein present in oligodendrocyte membrane. Clinical and Experimental Immunology. 66 (2), 423-434 (1986).
- Linington, C., Bradl, M., Lassmann, H., Brunner, C., Vass, K. Augmentation of demyelination in rat acute allergic encephalomyelitis by circulating mouse monoclonal antibodies directed against a myelin/oligodendrocyte glycoprotein. The American Journal of Pathology. 130 (3), 443-454 (1988).
- Panitch, H., Ciccone, C. Induction of recurrent experimental allergic encephalomyelitis with myelin basic protein. Annals of Neurology. 9 (5), 433-438 (1981).
- Tuohy, V. K., Sobel, R. A., Lees, M. B. Myelin proteolipid protein-induced experimental allergic encephalomyelitis. Variations of disease expression in different strains of mice. The Journal of Immunology. 140 (6), 1868-1873 (1988).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1952-1960 (2006).
- Mendel, I., Kerlero de Rosbo, N., Ben-Nun, A. A myelin oligodendrocyte glycoprotein peptide induces typical chronic experimental autoimmune encephalomyelitis in H-2b mice: fine specificity and T cell receptor V beta expression of encephalitogenic T cells. European Journal of Immunology. 25 (7), 1951-1959 (1995).
- McRae, B. L., et al. Induction of active and adoptive relapsing experimental autoimmune encephalomyelitis (EAE) using an encephalitogenic epitope of proteolipid protein. Journal of Neuroimmunology. 38 (3), 229-240 (1992).
- Bebo, B. F., Vandenbark, A. A., Offner, H. Male SJL mice do not relapse after induction of EAE with PLP 139-151. Journal of Neuroscience Research. 45 (6), 680-689 (1996).
- Oliver, A. R., Lyon, G. M., Ruddle, N. H. Rat and human myelin oligodendrocyte glycoproteins induce experimental autoimmune encephalomyelitis by different mechanisms in C57BL/6 mice. The Journal of Immunology. 171 (1), 462-468 (2003).
- Scheld, M., et al. Neurodegeneration Triggers Peripheral Immune Cell Recruitment into the Forebrain. The Journal of Neuroscience. 36 (4), 1410-1415 (2016).
- Chanaday, N. L., Roth, G. A. Microglia and astrocyte activation in the frontal cortex of rats with experimental autoimmune encephalomyelitis. Neuroscience. 314, 160-169 (2016).
- Pomeroy, I. M., Matthews, P. M., Frank, J. A., Jordan, E. K., Esiri, M. M. Demyelinated neocortical lesions in marmoset autoimmune encephalomyelitis mimic those in multiple sclerosis. Brain. 128 (11), 2713-2721 (2005).
- Merkler, D., et al. Differential macrophage/microglia activation in neocortical EAE lesions in the marmoset monkey. Brain Pathology. 16 (2), 117-123 (2006).
- Storch, M. K., et al. Cortical demyelination can be modeled in specific rat models of autoimmune encephalomyelitis and is major histocompatibility complex (MHC) haplotype-related. Journal of Neuropathology and Experimental Neurology. 65 (12), 1137-1142 (2006).
- Ludwin, S. K. Central nervous system demyelination and remyelination in the mouse: an ultrastructural study of cuprizone toxicity. Laboratory Investigation. 39 (6), 597-612 (1978).
- Skripuletz, T., et al. Cortical demyelination is prominent in the murine cuprizone model and is strain-dependent. The American Journal of Pathology. 172 (4), 1053-1061 (2008).
- Norkute, A., et al. Cuprizone treatment induces demyelination and astrocytosis in the mouse hippocampus. Journal of Neuroscience Research. 87 (6), 1343-1355 (2009).
- Acs, P., et al. 17beta-estradiol and progesterone prevent cuprizone provoked demyelination of corpus callosum in male mice. Glia. 57 (8), 807-814 (2009).
- Pott, F., et al. Cuprizone effect on myelination, astrogliosis and microglia attraction in the mouse basal ganglia. Brain Research. 1305, 137-149 (2009).
- Jeffery, N. D., Blakemore, W. F. Remyelination of mouse spinal cord axons demyelinated by local injection of lysolecithin. Journal of Neurocytology. 24 (10), 775-781 (1995).
- Blakemore, W. F. Ethidium bromide induced demyelination in the spinal cord of the cat. Neuropathology and Applied Neurobiology. 8 (5), 365-375 (1982).
- Mason, J. L., et al. Oligodendrocytes and progenitors become progressively depleted within chronically demyelinated lesions. The American Journal of Pathology. 164 (5), 1673-1682 (2004).
- Franco, P. G., Silvestroff, L., Soto, E. F., Pasquini, J. M. Thyroid hormones promote differentiation of oligodendrocyte progenitor cells and improve remyelination after cuprizone-induced demyelination. Experimental Neurology. 212 (2), 458-467 (2008).
- Lassmann, H., Bradl, M. Multiple sclerosis: experimental models and reality. Acta Neuropathologica. 133 (2), 223-244 (2017).
- Kerschensteiner, M., et al. Targeting experimental autoimmune encephalomyelitis lesions to a predetermined axonal tract system allows for refined behavioral testing in an animal model of multiple sclerosis. The American Journal of Pathology. 164 (4), 1455-1469 (2004).
- Merkler, D., Ernsting, T., Kerschensteiner, M., Bruck, W., Stadelmann, C. A new focal EAE model of cortical demyelination: multiple sclerosis-like lesions with rapid resolution of inflammation and extensive remyelination. Brain. 129, 1972-1983 (2006).
- Ucal, M., et al. Widespread cortical demyelination of both hemispheres can be induced by injection of pro-inflammatory cytokines via an implanted catheter in the cortex of MOG-immunized rats. Experimental Neurology. 294, 32-44 (2017).
- Gardner, C., et al. Cortical grey matter demyelination can be induced by elevated pro-inflammatory cytokines in the subarachnoid space of MOG-immunized rats. Brain. 136, 3596-3608 (2013).
- Minagar, A., et al. The thalamus and multiple sclerosis: modern views on pathologic, imaging, and clinical aspects. Neurology. 80 (2), 210-219 (2013).
- Tsunoda, I., Kuang, L. Q., Theil, D. J., Fujinami, R. S. Antibody association with a novel model for primary progressive multiple sclerosis: induction of relapsing-remitting and progressive forms of EAE in H2s mouse strains. Brain Pathology. 10 (3), 402-418 (2000).
- Lifshitz, J., Witgen, B. M., Grady, M. S. Acute cognitive impairment after lateral fluid percussion brain injury recovers by 1 month: evaluation by conditioned fear response. Behavioural Brain Research. 177 (2), 347-357 (2007).
- Kabadi, S. V., Hilton, G. D., Stoica, B. A., Zapple, D. N., Faden, A. I. Fluid-percussion-induced traumatic brain injury model in rats. Nature Protocols. 5 (9), 1552-1563 (2010).
- Leonard, J. R., Grady, M. S., Lee, M. E., Paz, J. C., Westrum, L. E. Fluid percussion injury causes disruption of the septohippocampal pathway in the rat. Experimental Neurology. 143 (2), 177-187 (1997).
- Hare, G. M., et al. Severe hemodilutional anemia increases cerebral tissue injury following acute neurotrauma. Journal of Applied Physiology. 103 (3), 1021-1029 (2007).
- Abbott, N. J. Evidence for bulk flow of brain interstitial fluid: significance for physiology and pathology. Neurochemistry International. 45 (4), 545-552 (2004).
- Amor, S., et al. Identification of epitopes of myelin oligodendrocyte glycoprotein for the induction of experimental allergic encephalomyelitis in SJL and Biozzi AB/H mice. The Journal of Immunology. 153 (10), 4349-4356 (1994).
- Adzemovic, M. Z., Zeitelhofer, M., Hochmeister, S., Gustafsson, S. A., Jagodic, M. Efficacy of vitamin D in treating multiple sclerosis-like neuroinflammation depends on developmental stage. Experimental Neurology. , 39-48 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены