Method Article
בצפיפות גבוהה DNA ו-RNA מיקרומערכים-פוטוליתוגרפיה סינתזה, היברידיזציה והכנת ספריות גרעין גדול חומצות
In This Article
Summary
במאמר זה, אנו מציגים ולדון התפתחויות חדשות סינתזה ויישומים של חומצות גרעין מיקרומערכים מפוברק באתרו. באופן ספציפי, אנו מראים כיצד הפרוטוקולים לסינתזה DNA ניתן להרחיב RNA וכיצד מיקרו מערכים ניתן להשתמש כדי ליצור לאחזור ספריות גרעין של חומצה.
Abstract
פוטוליתוגרפיה היא טכניקה רבת-עוצמה לסינתזה של דנ א באמצעות שקופיות זכוכית, כפי שהיא משלבת את היעילות של תגובות מצמד זרחתית עם דיוק וצפיפות של אור UV המשתקף ממראות מיקרומטר בגודל. ליתוגרפיה מניב מיקרומערכים שיכולים להכיל מאות אלפי עד כמה מיליוני רצפי DNA שונים, 100-nt או יותר, בתוך שעות ספורות בלבד. עם מרחב זה גדול מאוד הרצף, microarrays הם פלטפורמות אידיאלי לחקור את המנגנונים של חומצת גרעין · ligand אינטראקציות, אשר רלוונטיים במיוחד במקרה של RNA. אנו דיווחו לאחרונה על הכנת קבוצה חדשה של זרחניות של RNA מתואם לפוטוגרפיה באתרו ואשר שימשו לאחר מכן כדי לגדל RNA olig, מhomopolymers כמו גם רצפי בסיס מעורב. כאן, אנו ממחישים בפרוטרוט את התהליך של ייצור מיקרוarray RNA, החל מהעיצוב הניסיוני, הגדרה אינסטרומנטלית, סינתזה מערך, הגנה ושיטת היברידיזציה סופית באמצעות רצף 25mer תבנית המכילה את כל ארבעת הבסיסים כדוגמה. במקביל, אנו הולכים מעבר לניסויים המבוססים על הכלאה ולנצל פוטוליתוגרפיה מיקרולוגרפיה כשער זול לספריות מורכבות של חומצות גרעין. כדי לעשות זאת, מיקרו-DNA בצפיפות גבוהה מיוצרים על מונומר רגיש בסיס המאפשר DNA להיות באופן נוח ביקע וחזר לאחר סינתזה והגנה. הפרוטוקול הייצור הוא ממוטב כדי להגביל את מספר השגיאות הסינטתיים לאפקט, שכבה של β-קרוטן הפתרון מוצג לקלוט פוטונים UV שעשויים אחרת לשקף בחזרה על מצעים סינתזה. אנו מתארים באופן צעד אחר צעד את התהליך המלא של הכנת הספרייה, מתוך עיצוב למחשוף וכימות.
Introduction
השימוש המעשי של מיקרומערכים DNA היתה באופן מסורתי במחקר של וריאציות ברמות הביטוי גנים בין שתי אוכלוסיות תאים, באמצעות קווצות משלימים וזריחה כמו שיטה לזיהוי1. מדי פעם, DNA מיקרו מערכים מיזם לתוך אירועים מחייב עם ליגנדס חומצה שאינם גרעין, כגון חלבונים, עם אסטרטגיה של תמורה רצף שיטתי המציעה סקירה מקיפה של נוף הכריכה2,3, 4,5. גישה זו משנה ביעילות מיקרומערכים ממשטחים היברידיים גרידא לפלטפורמות עם כיסוי רצף רחב, אשר יהיה נכס לחקר העולם עשיר יותר מורכב יותר של מבנה RNA ותפקוד. נתמך על ידי התגובה היעילה ביותר זרחהאמידיום6, מערכי ה-dna באתרו מסונתז יכול עכשיו גם להיחשב כמקור זול של ה-dna7, אשר הופכת רלוונטית במיוחד בהתחשב בביקוש הולך וגובר עבור חומצה גרעין חומר עבור הרכבה גנטית8,9, DNA מבוססי ננו מבנים10, אחסון מידע או רצף11,12. כמו כן, הטכנולוגיות ברצף עשויים להפיק תועלת מפיתוח שיטות שיניבו תערובות מורכבות מאוד של RNA פורוזימטר13. בהקשר זה, מערך הייצור פרוטוקולים המאפשרים oligונודיאודים להיות מסונתז באתרו ובצפיפות גבוהה ממוקמים באופן אידיאלי כדי לענות על הצרכים של השדה המתרחב במהירות של חומצות גרעין ביוטכנולוגיה. עם זאת, עם שדה מגוונות כמו ביוטכנולוגיה, המטרה של כל יישום עשוי לדרוש כי ה-DNA על microarray להיות מיוצר בתפוקה גבוהה או עם כמות נמוכה מאוד של שגיאות סינתטי14,15, או שניהם, דרישת מבט מקרוב על פרוטוקולי הסינתזה של מיקרומערכים DNA אשר, היסטורית, כבר אופטימיזציה בעיקר עבור היברידיזציה assays. בינתיים, סינתזה באתרו של מיקרומערכים RNA נמצא מאמץ מאתגר, עם רוב הקושי הקשור הקבוצה הגנה עבור 2 '-הו פונקציה, בדרך כלל moiety silyl בסינתזה בשלב אחיד רגיל כי הוא הוסר עם פלואור מבוססי ריאגנטים, כימיקלים שאינם תואמים עם זכוכית או סיליקון משטחים. אלה בעיות ואתגרים ב-DNA ו-RNA סינתזה microarray יש לאחרונה הנושא של גוף גדול של עבודה, במיוחד עם הגישה הפוטוגרפיה16.
פוטוליתוגרפיה משתמשת באור אולטרא סגול כדי לבטל את חסימת מחלת החמצן לפני הצימוד ודורשת מסכות לבניית תבנית של חשיפה אולטרא-סגול, ובכך לארגן ולשלוט בצמיחת הגידול של האוליונו, והשימוש בהם. מסיכות פיזיות הוחלפו על ידי מיקרומטר שבשליטת המחשב, שהטיה בררנית משקפת אור UV על מצע המיקרו-מערך17,18,19. כמקור UV, אנו משתמשים באור 365 ננומטר ממקור כוח גבוה LED20. הגדרות פוטוגרפיות נוכחיות מצוידות במערכים micromirror המכילים 1024 × 768 מראות, מתאים יותר מ 780,000 כתמים למיעון בנפרד ("תכונות") על שטח קטן של רק 1.4 ס"מ2, או 1080p עם מערכים של 1920 × 1080, או . > 2 מיליון מראות לכן כל המראות במכשיר יש שליטה ישירה על הרצף גדל על התכונה המתאימה. למעט אור UV, הפונקציות ליתוגרפיה כמו טכניקת סינתזה בשלב אחיד ומאמצת את הכימיה מבוססי מחזור זרחניאידיט. רק זה דורש אסטרטגיית הגנה שונה לחלוטין כדי סינתזה RNA להצליח. פיתחנו סדרה חדשה של זאמאידיטים RNA בעלי רגישות קלה הנושאת הידראזין-לבנה הגנה על קבוצות21. ונומרים אלה מאפשרים RNA להיות deprotected תחת תנאים קלים שאינם משפיעים על השלמות של פני השטח. הצעד הראשון הגנה משתמש triethyine כדי להסיר את ההגנה מפוספלי זרחן, בעוד הידראזין משמש בשלב השני, צעד נפרד כדי להסיר את אלה ב 2 '-או והפונקציות של אמין. בכל זאת עושה, רנ א פורוזימטר ~ 30-nt באורך ואת כל רצף יכול עכשיו להיות מסונתז באתרו על מיקרו מערכים22,23. במקביל, התחלנו גם לאחרונה לטפל בשאלות של תפוקה, איכות ומהירות ב-DNA ו-RNA photolithography. אנו מדדו יעילות צימוד > 99% עבור כל ה-DNA ו-RNA amidites (איור 1) וחקר כל צעד בודד במחזור התארכות olig, החל מזמן חמצון, לבחירה של activator ולחשיפה אופטימלית של UV24 , 25. הבאנו לקבוצות חדשות רגישות לאור 5, שניתן להסירם בתוך שניות בלבד, להפוך את הסינתזה של מאות אלפי מנות של 100 מיליון למשך שעות ספורות של תהליך26. הכפילו גם את תפוקת המערך של הייצור על ידי חשיפת שני מצעים בו27. בסופו של דבר, הצגנו זרחניות dT am, המכיל בסיס רגיש לקבוצה מאוד רגישה כדרך נוחה לקליב, לאסוף ולנתח DNA ו-RNA olig, שהוא מרכזי הכנה לספרייה28.
למרות ההיבט הארצי יחסית של DNA ו-RNA סינתזה שלב מוצק, במיוחד עבור חומצות גרעין כימאים, מיקרולוגרפיה microarray נשאר שדרוג לא טריוויאלי המחייב התקנה מורכבת, שליטה זהירה ופיקוח על התהליך, ו הוראות נפרדות לטיפול פוסט-סינתטי בהתאם לאופי השימוש בסוגי היישומים ולסוג היישום. במאמר זה, אנו רוצים לספק מצגת מפורטת של ההליך כולו צעד אחר צעד של סינתזה באתרו של DNA ו-RNA מיקרומערכים על ידי פוטוגרפיה, מתוך עיצוב ניסיוני לניתוח נתונים, עם דגש על הכנת מכשירים ו מתכלים. לאחר מכן נתאר את השיטות הפוסט-סינטתיים למניעת הגנה המתאימות למטרה המיועדת של ייצור microarray (כלומר, היברידיזציה או התאוששות מספריות חומצות גרעין).
Protocol
1. עיצוב מיקרוarray
- כתוב את הרצפים להיות מסונתז בעורך טקסט, 5 ' → 3 ', שורה אחת לכל רצף. עבור בקרת איכות 25mer, השתמש ברצף "gtcatcatcatgaacttttttttttttttttttttttt השתמש A, C, G ו-T מכתבים עבור נוקלאוטידים DNA ו 5, 6, 7 ו 8 מספרים עבור נוקלאוטידים RNA.
- במקרה של הכנה לספרייה, יש להוסיף מספר נוסף (כלומר, 9) בסוף כל סדרה 3. הדבר יתאים לזיווג של המונומר הרגיש לבסיס.
- יש לעקוב אחר כל רצף באמצעות פסיק. הקצה שם לכל רצף לאחר הפסיק, וודא שכל נתיב עוקב אחר התבנית [רצף, #sequence_name] (ללא סוגריים). שמור את רשימת הרצפים כקובץ txt.
- התחל MatLab לאחר מכן לטעון את התוכנית שבבים עיצוב. m. . תריץ את התוכנית
- בחלון לוח המאפיינים, טען את קובץ הפריסה EntireChip המיקרו-מערך. טען את קובץ הפריסה של מיליצ אם המטרה היא לסנתז את המערך כולו בארבעה מיקומים זהים.
- בחלון לוח המאפיינים , תחת מפרט שבב, בחר באפשרות בחירת מכולה לאחר מכן באזור סינתזה. תחת תבנית, בחר את התבנית המניבה את הכמות הנכונה של תכונות למיעון, כולל את מספר הרצפים × מספר השכפל. עבור בקרת איכות 25mer, בחר את תבנית 25:36.
- תחת בחירת גורם מכיל, בחר Fiducial. תכונות Fiducial מסונתז בדרך כלל בפינות של אזור סינתזה משמשות כדי לחלץ נתונים הכלאה. עם Fiducial נבחר, לכתוב רצף (5 ' ← ' 3 ') כי יהיה מסונתז על תכונות Fiducial ואשר יכול לשמש שליטה חיובית. לניסוי של 25mer, להשתמש באותו רצף דנ א.
- תחת רצף, טען את קובץ הטקסט המכיל את כל הרצפים הכתובים. ודא שבחרת באפשרות ' אקראי '. תן כותרת לניסוי ב- Project title וברצף מקשר, כתוב ttttt (התואם ל-T5 מקשר).
- לחץ ליצור, ולאחר מכן למצוא את מערך קבצי עיצוב ומסיכות (איור 2) תחת MaskGen_delta_rc1/עיצובים התיקייה. ודא שהוא מכיל קובץ script של תצוגה, רצף זרימה וקובץ עיצוב.
- לקבלת הכנה לספריה, פתח את קובץ ה-script של התצוגה. הוסף קו נוסף בתחתית קובץ ה-script של התצוגה המעתיק בדיוק את השורה הראשונה של קובץ ה-script (לדוגמה, הצג First_Mask. bmp 150). פעולה זו תסיר את הקבוצה של הטרמינל פוטורוטאט בקצה ה-5 של כל מחלת הגאות.
- הפעל את תוכנית העבודה האוטומטית של יוצר המשימות, טען תבנית על-ידי לחיצה על תבנית טעינה ולאחר מכן לחץ על הצג סקריפט כדי לטעון את קובץ ה-script של התצוגה שנוצר על-ידי MatLab. לחץ ליצור. שלב זה ייצור סידרה של הוראות, הנקראת קובץ עבודה, שתשלוט בתקשורת של המחשב באמצעות המיקרוגליות ובסינתיסייזר ה-DNA.
2. הכנה ופונקציונליזציה של שקופיות
- מקדחה שקופית אחת בשתי מיקומים המתאימים למיקום של מפרץ ואבובים שקע בתא הסינתזה. השתמש בסיבית יהלום 0.9 מ"מ על נתב CNC לתרגיל בדיוק ואמין. שטוף את שקופיות הקדח בעזרת מים באולטרסאונד וסדר אותם במדף שקופיות.
- נקו את המשטחים על-ידי sonicating השקופיות באמבט מים המכיל 5% מניקוי מטרה מיוחד המבוסס על אמוניה במשך 30 דקות ב-35 ° c. שטפו את השקופית בעזרת כפול מזוקק H2או והעבירו אותם לארון נקי ויבש.
- ארגן שקופיות של מיקרוסקופ מקדח ובלתי מקדח במדף שקופיות. בצילינדר גדול, הכינו את פתרון הפונקציונליזציה על ידי ערבוב 475 מ ל אתנול (אטוח) עם 25 מ ל של ddH2O, 10 גרם של מגיב סילאניזינג (N-(3-triethoxyl) -4-הידרוקסיבוטיד) ו 1 מ ל של חומצה אצטית. מערבבים היטב עד הומוגנית ולאחר מכן להעביר במיכל מתאים וסגור.
- מניחים את המתלה טעון במיכל, לסגור את המכסה ולתת את המיכל רוק בעדינות על שייקר מסלולית עבור 4 h בטמפרטורת החדר.
- לאחר 4 שעות, למחוק את הפתרון הפונקציונליזציה ולהחליף עם 500 mL של תמיסת כביסה, המורכב 475 mL של אטוח, 25 מ ל של ddH2O ו 1 מ ל של חומצה אצטית. מתפרעים לאט במשך 20 דקות בטמפרטורת החדר, ואז למחוק ולהחליף עם 500 mL של תמיסת שטיפת טרי.
- לאחר 20 דקות נוספות בטמפרטורת החדר, למחוק את הפתרון, לייבש את השקופיות עם זרם של ארגון ולרפא אותם בתנור ואקום מחומם מראש ב 120 ° c. לאחר 2 שעות, לכבות את התנור ואת משאבת ואקום אבל להשאיר את השקופיות תחת לחץ מופחת בלילה. לאחר מכן, החזר את התנור ללחץ אטמוספרי ואחסן את השקופיות בdesiccator עד לשימוש נוסף.
3. הכנת ריאגנטים לסינתזה ולמגיבים
- הביאו את האבקות הזרחתן (איור 1) מטמפרטורת האחסון (-25 או-45 ° c) לטמפרטורת החדר בdesiccator.
- כאשר הזאמאידים הגיעו לטמפרטורת החדר, ממיסים את האבקה בנפח של מאוד יבש במיוחד (< 30 דפים לדקה2O) על מנת להגיע לריכוז 30 מ"מ עבור DNA רגיל ו-RNA זרחניים, ו-50 mm עבור מונומר dT רגיש בסיס ( הכנה לספרייה). הוסיפו שק מולקולרי קטן כדי ללכוד כל סימן של לחות.
- הכינו פתרון של 1% (w/w) סרבאזול ב DMSO על ידי המסת 11 גרם של סרבאזול 1 L של יבש DMSO. נער היטב עד התפרקה לחלוטין. חברו את הפתרון ליציאת העזר של סינתיסייזר ה-DNA. זה יהיה ממיס החשיפה הנחוצה עבור הסרה מלאה של הקבוצה 5 ′-פוטורוטאל.
- לסינתזה של ספריות, להכין פתרון של 1% (w/v) β-קרוטן ב דיכלורומתאן על ידי המסת 100 mg של β-קרוטן ב 10 מ ל של דיכלורומתאן. לנער היטב בבקבוק זכוכית ענבר ולאחר מכן לעטוף רדיד אלומיניום.
4. הכנה וניטור של סינתזה מיקרוarray.
- להקליט טמפרטורה ולחות בחדר ייצור microarray ולוודא את הסינתיסייזר DNA הוא תחת לחץ הליום מספיק.
- הפעל את ה-UV-LED ואת מאוורר הקירור שלו. לצרף מד עוצמה UV במישור המוקד של אור UV הנכנס ולהדליק אותו (איור 3א).
- במחשב, הפעל את קובץ העבודה/micromirror/סינתזה של קבצי בקר קבצים (בשם Wicell). הפעל אז לאתחל את המכשיר micromirror ולטעון קובץ מסיכה כל לבן על ידי לחיצה ימנית על Dmd, ולאחר מכן בחירת טעינת תמונה.
- לחצו לחיצה ימנית על הסמל UVS ובחרו תריס לפתוח. קרא את ערך הכוח (ב-mW/cm2) על מד העוצמה וספירת 60 s. לאחר 60 s, קרא את ערך ההספק שוב ורשום לפניך את ערכי ההתחלה והסיום. סגור את התריס על ידי בחירת תריס בקרוב UV ולכבות את מד העוצמה. חשב את הערך הממוצע של עוצמת UV ב-mW/cm2.
- לחשב את זמן החשיפה הדרוש כדי להגיע לאנרגיה קורנת של 6 J/cm2 עבור 5 '-nהגנה מפני תמונות (DNA ו-RNA מיקרומערכים) ו-3 J/cm2 עבור 5 '-הגנה מפני photodeprotection (
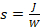 ספריות dna), פשוט בעקבות הקשר.
ספריות dna), פשוט בעקבות הקשר. - ב סינתיסייזר DNA תוכנה תחנת עבודה, ליצור קובץ רצף בעורך הרצף על ידי העתקה והדבקה של התוכן של רצף הזרימה שנוצר על ידי MatLab. הוסף שני שלבי שטיפה נוספים בסוף 3 (מחזור ברירת המחדל של המחזור: "s") כדי לשטוף את פני השטח של מצעים לפני המעבר אל הצימוד הראשון. שמור וייצא את קובץ הרצף.
- בעורך הפרוטוקולים של תוכנת תחנת העבודה, צור פרוטוקול המכיל מחזור ייעודי הקרוי על-שם כל אחד מהמכתבים והמספרים הנמצאים בקובץ הרצף (לדוגמה, אם קובץ רצף מכיל רק אותיות a, C, g ו-T, אזי קובץ הפרוטוקול חייב ל הכיל ארבעה מחזורים, בשם A, C, G ו-T).
- הגדר את זמן הצימוד עבור זרחנות DNA (מחזורים A, C, G ו-T) עד 15 s, כדי 120 s עבור מחזור (8) ו-300 s עבור rA, rC ו-rG זרחנות (מחזורים 5, 6 ו -7). לקראת הכנת הספריה, הגדר את הצימוד התלוי בבסיס, בקלימונומר dT מוגדר ל-2 × 120 s (טבלה 1 ושולחן 2).
- ודא שזמן ההמתנה בין שני אירועים מחוץ לאירועי תקשורת בכל מחזור תואם לזמן החשיפה המחושב של UV כדי להגיע לאנרגיה הקורן הנחוצה. באשר לקובץ הרצף, שמור וייצא את קובץ הפרוטוקול.
- בתוכנת WiCell, טען את קבצי העבודה, הרצף והפרוטוקול בתתי-חלונות המתאימים לאחר מכן לחץ על שלח כדי לשלוח את קבצי הרצף והפרוטוקול לסינתיסייזר ה-DNA.
- בקובץ הרצף, ספור את מספר הזיווגים עבור כל זאמאידיט.
- כדי למדוד את אמצעי האחסון הנדרש (ב-μL) של הפתרון הזאמאידיט הדרוש לביצוע כל סינתזה, הכפל את מספר הזיווגים ב-60. הוסף 250 μL לכל אמצעי אחסון לבטיחות והטרמה של הקו בסינתיסייזר ה-DNA. השתמש באמצעי אחסון בסיסי של 250 μL עבור זאמאידיאידים המחייבים צימוד יחיד בלבד.
- העבר במהירות את הפתרון לבקבוקונים על סינתיסייזר ה-DNA המתאים לאות/מספר היציאה במחזורי הפרוטוקול.
- הממשלה הנמלים עם פתרונות זרחטיים עם 10 פולסים ראשוניים כל אחד כדי למלא את הקווים עם מגיב. . לפני שתצרף את תא התגובות
- כדי להרכיב את התא סינתזה, במקום עבה (250 μm) gasket הופעת (FFKM) אטם ראשון על בלוק הקוורץ של התא. מניחים מיקרוסקופ, פונקציונליזציה שקופית על גבי האטם הראשון, ולוודא כי החורים על השקופיות להתחבר עם הצינורות מפרץ ולשקע של התא סינתזה.
- מניחים שנייה, דק (50 μm) באטם פוליטאנטאואתילן (מצופה) על שקופית הקדח, סביב שני החורים. בסופו של דבר, הציבו שקופית שנייה, פונקציונליזציה אך לא מקדח על גבי האטם השני (איור 3ב). מניחים מסגרת 4-בורג מתכת על גבי תא כפול המצע מורכב להדק את הבורג לאותו כוח להידוק (0.45 Nm) באמצעות מברג מומנט.
- לחבר את הצינורות השקע ואת הצינור לסינתיסייזר DNA. הממשלה התחתית לשטוף את הקו ולאמת את הזרימה הנכונה של acetonitrile (ACN) דרך מצעים. לפרק ולכנס מראש את התא אם יש דליפה של ACN כלשהו ניתן לצפות בשלב זה. מדוד את עוצמת הקול של ACN על קו הפסולת לאחר שעובר 7 מחזורים של הטרמה ACN. אמצעי אחסון זה אמור להיות 2 מ ל.
- חברו את תא הסינתזה במישור המוקד של אור UV הנכנס. במקרה של הכנת הספרייה, לצרף מפרץ נוסף קו השקע לחלק האחורי של התא ולמלא את החדר האחורי עם הפתרון β-קרוטן (2 מ ל של פתרון הוא מספיק). ודא שאין דליפה (איור 3ג).
- הפעל את הסינתזה על ידי לחיצה ראשונה על הפעלה בתוכנה wicell. בפקודת ההמתנה הראשונה בקובץ המשימה, לחץ על התחל על סינתיסייזר ה-DNA.
- במהלך הסינתזה, באופן קבוע לוודא כי התצוגה של קבצי מסכה בקנה אחד עם חשיפה UV ופתיחת התריס.
- לאחר הסינתזה של מיקרו-מערכים רגילים, נתק את התא מהסינתיסייזר, פרק את התא והשתמש בעט יהלום כדי לחרוט את מספר הסינתזה על מגלשות הזכוכית. לחרוט את המספר על הפנים הלא מסונתז של כל שקופית. העבר את השקופיות לצינורות צנטריפוגה 50 mL ואחסן באזור מיובש עד לשימוש נוסף.
- לאחר סינתזה של מיקרו מערכים ספריה, תחילה לנקז את הפתרון β-קרוטן מתוך החדר ואז לשטוף אותו על ידי הזרמת 2 × 5 מ ' CH2Cl2, ואז לנקז. המשך בפירוק לפי שלב 4.21. מערך מסונתז עשוי להיות גלוי לעין בלתי (איור 4).
5. הגנת מיקרומערך DNA
- ממלאים כד זכוכית מכתים עם 20 מ ל של אטוח ו -20 מ ל של אתילנסאמין (EDA). הניחו את מערכי ה-DNA בלבד בצנצנת, סגרו את המכסה, והניחו את השקופיות כדי להגן על 2 שעות בטמפרטורת החדר.
התראה: EDA הוא נוזל מאוד רעיל, מאכל ודליק. לעבוד עם כפפות בתוך מאוורר היטב. - לאחר 2 h, לאחזר את השקופיות באמצעות מלקחיים ולשטוף אותם ביסודיות עם מזוקקים כפול2O.
- יבש את השקופיות בצנטריפוגה מיקרוarray לכמה שניות ולאחר מכן אחסן בdesiccator.
6. ביטול הגנה ממיקרו RNA
- בצינורית צנטריפוגה 50 mL, הכינו פתרון יבש של 2:3 triethylamine/ACN (20 מ"ל ו 30 מ ל של כל אחד, בהתאמה). העברת אחד שקופית RNA microarray לתוך צינור הצנטריפוגה, לסגור את המכסה ואז לעטוף פלסטיק איטום הסרט. לנער בעדינות את צינור הצנטריפוגה על שייקר מסלולית עבור 1h ו 30 דקות בטמפרטורת החדר.
- לאחר 1h ו -30 דקות, להסיר את השקופית, לשטוף עם 2 × 20 מ ל יבש ACN לאחר מכן יבש בצנטריפוגה microarray במשך כמה שניות.
התראה: טריאתיאמין הוא נוזל בחריפות, רעיל ודליק. . הוא רעיל ודליק לעבוד עם כפפות בתוך מאוורר היטב.
הערה: שלב הביטול הראשון הושלם. - להכין 0.5 M הידראזין הידרוzine הפתרון ב 3:2 pyridine/חומצה אצטית. ראשית, לערבב 20 מ ל של חומצה אצטית 30 מ ל פירידין בגליל הדרגתי. המתן לפתרון להתקרר לפני הוספת 1.21 מ ל של הידראזין מימה. העברה סביב 40 mL של הפתרון שהתקבל לתוך שפופרת צנטריפוגה 50 mL.
התראה: הידראזין מימה הוא נוזל מאוד רעיל ומאכל. פירידין הוא דליק מאוד ורעיל בטירוף. חומצה אצטית דליקים ומאכל. לעבוד עם כפפות בתוך מאוורר היטב. - לאחר שלב deprotection הראשון, להעביר את שקופית RNA לתוך הפתרון מימה הידראזין, לסגור את המכסה ולעטוף בסרט איטום פלסטיק. לנער בעדינות את הצינור על שייקר מסלולית עבור 2 h בטמפרטורת החדר. לאחר 2 h, להסיר את השקופית, לשטוף עם 2 × 20 מ ' של ACN יבש לאחר מכן יבש בצנטריפוגה microarray במשך כמה שניות.
הערה: צעד הביטול השני הושלם. - אם ה-RNA microarray מכיל גם נוקלאוטידים DNA, להמשיך עם צעד deprotection שלישי. בשפופרת צנטריפוגה 50 mL, מערבבים 20 מ ל של EDA עם 20 מ ל של אטוח. הוסף את ה-DNA/RNA microarray לפתרון 1:1 EDA/אטוח ולצאת בטמפרטורת החדר למשך 5 דקות.
- לאחר 5 דקות, להסיר את השקופית, לשטוף עם 2 × 20 mL של מים סטרילי ולאחר מכן יבש בצנטריפוגה microarray ולאחסן בdesiccator.
7. היברידיזציה בעזרת מגדיל משלים בעזרת פלואורוסקופים
- הפשרה acetylated שור סרום אלבומין (10 מ"ג/mL) ו-Cy3 המשלים משלימים סטרנד (100 nM) ולהתחמם לטמפרטורת החדר.
- בצינור המיקרו-מיקרוצנטריפוגה. הסטרילי, 1.5 מ ל לערבב 150 μL של 2x MES מאגר (200 mM 2-(N-שורגואוסטינו) חומצה ethanesulfonic; 1.8 M הנאל; 40 MM edta; 0.02% רצף-20) עם 26.7 Μl של CY3-DNA, 13.4 μl של acetylated bsa ו 110 μl של שילוב של2O ומיקס ערבולת. כפול את אמצעי האחסון אם יש להשתמש בשתי השקופיות לשם הכלאה.
- לחמם מראש תנור הכלאה לטמפרטורה מתחת Tm של דופלקס אבל גבוה מספיק כדי להבטיח אפליה טובה בין התאמה מלאה ורצפים שאינם תואמים. לבקרת איכות 25mer, לקבוע את הטמפרטורה 42 ° צ' (Tm של 59 ° c).
- בזהירות המקום הדבקה עצמית 300 μL חדר היברידיזציה על אזור הסינתזה על כל שקופית ולחיות בפתרון הכלאה ה, שהוכן לעיל. כסו את חורי החדר בנקודות דביקות ועטפו את השקופית כולה ברדיד אלומיניום.
- מניחים את שקופית המיקרו-מערך בתנור הכלאה, מכסים ומניחים לו להסתובב בעדינות בטמפרטורת הכלאה שנבחרה במשך 2 שעות.
- לאחר 2 h, לנתק את השקופית, להסיר את רדיד אלומיניום ולקרוע בזהירות את התא הכלאה. העבר את השקופיות לתוך צינורית צנטריפוגה המכילה 30 מ ל של מאגר שטיפה לא מחמירים (NSWB; 0.9 M הנאל, 0.06 M פוספט, 6 מ"מ EDTA, 0.01% Tween20, pH 7.4) ולנער במרץ עבור 2 דקות בטמפרטורת החדר.
- העבר את השקופית לתוך צינור צנטריפוגה המכיל 30 מ ל של מאגר לשטוף מחמירים (SWB; 100 mM MES, 0.1 M הנאל, 0.01% Tween20) ו לנער במרץ עבור 1 דקות.
- לבסוף, להעביר את השקופית לתוך צינורית צנטריפוגה המכילה 30 מ ל של מאגר שטיפת סופי (FWB; 0.1 x נתרן מלוחים ציטראט) ולנענע למשך כמה שניות. ייבש את השקופית. בצנטריפוגה מיקרומערך
- הנח את המיקרו-מערך היבש, אזור הסינתזה הפונה כלפי מטה, במחזיק השקופיות של סורק המיקרו-מערך. עבור דופלקסים Cy3-מתויג, סרוק ברזולוציה של 5 יקרומטר עם 532 ננומטר באורך הגל, מסנן ננומטר 575 ו-"פוטולוטיפייר" של 350. שמור את סריקת הרזולוציה הגבוהה כקובץ תמונה. tif (איור 5א).
8. מיצוי נתונים וניתוחם
- לפני חילוץ הנתונים, לסובב את סריקת המערך השמור בעורך תמונה כדי למקם את השרשרת הארוכה ביותר של תכונות fiducial בפינה השמאלית העליונה של הסריקה. שמור את התמונה שסובבה.
- התחל את הסריקהולאחר מכן הקש על קובץ | פתח וטען את סריקת המערך. לאחר מכן, על-ידי לחיצה על עיון בסעיף הקטן של קובץ העיצוב, טען את. ndf עיצוב קובץ שנוצר באופן אוטומטי במהלך העיצוב של ניסוי microarray. לאחר מכן לחץ על פתח.
- בתצוגה, לחץ על ניגודיות אוטומטית /בהירות. לחץ על הסמל יישר באופן ידני מעל הסריקה. מניחים ארבעה סמנים בצורת ריבוע בארבע הפינות של הסריקה, ולאחר מכן לחץ שוב על סמל ירוק עכשיו. לחלץ את הנתונים הכלאה על ידי לחיצה על ניתוח, דוחות לאחר מכן לבדוק דוח.
- . פתח את זה קובץ דוח בדיקה בעורך גיליון אלקטרוני. שמור על עמודות B ו-I ולמחוק את השאר לפני שתמשיך בחישוב הערכים הממוצעים וסטיית התקן של הנתונים המחולצים (איור 5ב').
9. הגנת הספרייה, הפצילות והתאוששות
- כדי ליטול הגנה ולקליב ספריות DNA, להכין פתרון של 1:1 היבש EDA/toluene בשפופרת צנטריפוגה 50 mL. לטבול את השקופית לתוך פתרון המחשוף, לסגור את השקופית ולעטוף בסרט איטום פלסטיק, ואז לסובב בעדינות שייקר מסלולית עבור 2 h בטמפרטורת החדר.
- לאחר 2 שעות, להסיר את השקופית ולשטוף עם 2 × 20 מ ל של ACN יבש בקפידה. הסר את השקופית ושחרר אותו באוויר.
- עם פיפטה, החל 100 μL של שתיים מתוך2או על אזור הסינתזה הניכרת. Pipet הפתרון למעלה ולמטה כמה פעמים לפני העברתו לתוך שפופרת מיקרוצנטריפוגה 1.5 mL. חזרו על התהליך ושלבו את המיקרו-מערך באותו צינור (איור 6).
- להתנדף את 2 × 100 μL של שבב משחרל יובש לאחר מכן מתמוסס לתוך 10 μL של nuclease-H חינם2O. למדוד את ספיגת על ספקטרוסקופיה UV-Vis.
- Desalt את ספריית ה-DNA על 10 μL הצינורות מצויד שרף סי18. ראשית, להפוך את השבב להתחמק לתוך 0.1 M triethylammonium אצטט (TEAA) פתרון באגירה.
- להרטיב את השרף על ידי שאפתן 3 x 10 μL של H2O/acn 1:1, ו שאיפה את שרף על ידי שטיפת עם 3 x 10 μl של 0.1 M teaa מאגר. אגד את ה-DNA על ידי ליטוף את השבב משחרל 10 פעמים למעלה ולמטה דרך שרף. לשטוף את שרף עם 3 x 10 μL של 0.1 M TEAA מאגר, 3 x 10 μL של H2O.
- Elute ה-DNA התפלה מהקצה על ידי שטיפת שרף עם 10 μL של H2O/acn 1:1. יבש את הפתרון התפלה למטה ומתמוסס לתוך 10 μL של ה-H הסטרילי2O. למדוד את ספיגת על ספקטרוסקופיה UV-Vis (איור 7). המאדות את הספרייה ליובש ולאחסון ב-20 ° c עד לשימוש נוסף.
תוצאות
היברידיזציה של המיקרו-DNA ו-RNA
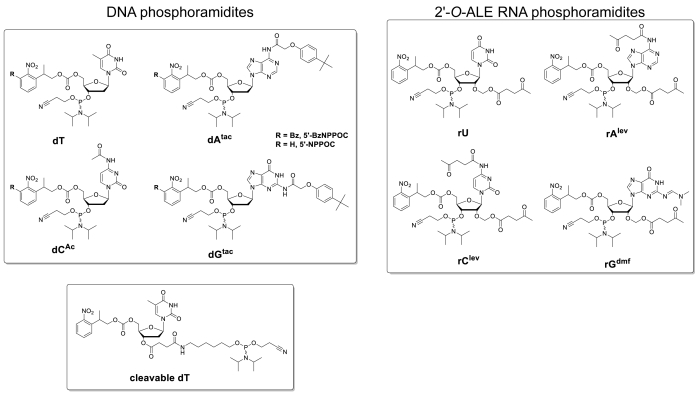
איור 5 מראה את התוצאות של שיטת היברידיזציה שבוצעה על מיקרוarray המכיל את ה-dna ו-RNA גרסאות של רצף 25mer (5 '-gtcatcatcatcctttttttttttttttttttttttttttttt הסריקה באיור 5מופיע בפורמט greenscale המתאים לספקטרום עירור/פליטה של Cy3 פלואורסצנטית, עם עוצמה פלואורסצנטית הקליט ביחידות שרירותיות בין 0 ו 65536. עיצוב המערך עקב אחר פריסת התכונות 25:36 המתוארת בסעיף הפרוטוקול. הסריקה מוצגת לאחר כיוון מתאים של המערך, כאשר הפינה השמאלית העליונה מאוכלסת בשרשרת הארוכה ביותר של תכונות fiducial. כאן, תכונות fiducial מכילות את גירסת ה-DNA של 25mer וצריך, בעיקרון, תמיד לתת אות זריחה חיובית כדי לבצע יישור סריקה וחילוץ נתונים. הוכלא microarray צריך להופיע בהיר אחיד, עם קצוות של אזור סינתזה להיות עם זאת בדרך כלל בהיר יותר מהמרכז (עד 50% בהיר). כמות גדולה של משכפל רצף, המופצים באופן אקראי ברחבי האזור, מפחית את ההשפעה של חפצים מרחביים. כאן, כל רצף (DNA ו-RNA) היה מסונתז ב 2,000 מיקומים אקראיים. יש בדרך כלל רעש של זריחה נמוכה (רקע), < 50 a.u., אשר מוביל ליחס אות/רעש בסדר של 200:1 אל 800:1 בתוך הכלאה assays. לאחר חילוץ נתונים, עוצמות של כוונת הזריחה הם הממוצע והתווה ± SD.
יש שינויים משמעותיים בערכי הקרינה המוחלטת בין ניסויים. כאן, אנו מראים את התוצאות עבור שלוש סינתזות עצמאיות באמצעות אותם פרמטרים הייצור ואת אותו טיפול לאחר סינתטי. ה-DNA 25mer, כאשר הוכלא המשלים שלה Cy3 המסומנת ה-DNA, תניב אותות פלואורסצנטית הנע בכל מקום מ 20,000 אל 30,000, לעתים רחוקות מאוד מעל או מתחת. ה-RNA 25mer, כאשר הוכלא אותו Cy3-DNA משלים את אותו, ייתן עוצמות כוונות הזריחה על התכונות המתאימות החל מ 15,000 אל 20,000. עם זאת, עוצמת הקרינה הפלואורסצנטית ו-dna דופלקסים לפעמים ירידה מתחת 8,000, כאשר המקביל ה-dna ו-dna דופלקסים עדיין זרוח תוך טווח 20000-30000. במקרים כאלה, התוצאות עבור RNA עשוי להיחשב תת אופטימלית. סינתזה או כישלון הכלאה, גם עבור DNA או RNA, יהיה מורגש מיד במהלך סריקה מהעדר הברור של זריחה. ישנן מספר הזדמנויות לסינתזה של RNA להיכשל או להצליח באופן חלקי והם יהיו מתוארים בחלק הדיון.
הגנה מפני הספרייה, המחשוף וההתאוששות
בהתאם למורכבות ולצפיפות הספרייה, ניתן לראות את הצורה והמתאר של המערך המסונתז ללא הגדלה, אך תחת תאורה נכונה (איור 4), עם הדנ א עדיין בצורה מוגנת. לאחר ביטול הגנה עם EDA/toluene, ולפני התוספת של מים כדי לאסוף את הספרייה ביקעת, את האזור סינתזה המכיל את מחלת הלוואי ה, הגנה מפני השטח עשוי להתבלט כאזור הידרופילי, כאשר שאר שקופית הזכוכית יופיע מכוסה בשכבת הידרופובי מטורבית. ההתבוננות הישירה באזור הסינתזה תלויה בשטח הכולל המשמש לסינתזה של האוקליונואודים: שימוש גדול יותר באזור הסינתזה יתאים לסיכוי רב יותר להבחנה ברורה בין אזורי הידרופיפילית והידרופובי על פני השטח. לעומת זאת, ספריות המעוצבות באמצעות פחות מראות ובתכונות קטנות יותר לא יהיו מיידי.
באופן דומה, את כמות ה-DNA התאושש לאחר התפלה הוא פרופורציונלי ישירות לאזור כולל המשמש סינתזה. אם כל התכונות משמשות לסינתזה של מחלת השמש, את המחשוף ואת ההתאוששות צריך להניב בין 25 ו 30 pmol של דנ א. 10% שימוש באזור סינתזה ולכן להרשות לעצמו רק סביב 3 pmol של ה-DNA.
איור 1 . מבנים כימיים של DNA ו-RNA זרחניות המשמשים לסינתזה של מיקרוונואוגרפיה על ידי מיקרו-מערך. (Nאפון) הגנה מפני הקבוצות ב-5 '-OH משמשות בסינתזה של דנ א רגיל ו-RNA מיקרוarray למטרות הכלאה. לגבי סינתזה של ספריות DNA מורכבות, photolabile בנזיל-Nאפון (בייפופוס) מעדיפים ב 5 '-או, כמו B, כפי שהוסר באופן משמעותי פי שניים כמו Nאפון c, אשר מפחית בצורה משמעותית את זמן סינתזה מיקרו מערך הכולל. מחלת ה-DNA לספריות מחייב גם את הזיווג של dT מונומר בקלישים בסוף 3. מונומר זה, אשר נושאת פונקציה אסתר סוקסיל, יהיה לעבור במהלך deprotection, המאפשר DNA לאסוף מן השבב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2 . דוגמה למסיכה כקובץ תמונה שנשלח להתקן המיקרומימד במהלך חשיפה לקרני UV. הפיקסלים הלבנים מקבילים למראות אשר יהיו מוטה בתנוחת "ON", המשקף אור UV על תא הסינתזה. פיקסלים שחורים מתאימים "OFF" מראות, שבו אור UV ישתקפו הרחק מתא. לפיכך, פיקסלים לבנים יאפשרו לזיווג של הזרחניות הנכנסות הבאות על מצעים הזכוכית שנמצאו בתכונות המתאימות. מחלת האוגורונואז מסונתז על התכונות שמראות המקביל שלהן, בקובץ מסיכה זה, פיקסלים שחורים יישארו לא פעילים במהלך אירוע הצימוד הבא. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3 . תמונות של ההתקנה האופטית והסינתזה של המיקרומערך. (א) מעגל אופטי לחשיפה לקרינת UV. אור UV מ UV-LED הוא הומוגניים הראשון באמצעות צינור אור מלבני-חוצה-חתך אז משקף על מיקרומטר. יקרו אשר כבר מוטה לתוך מיקום "OFF" ישקף אור UV מן התא סינתזה, אבל יקרו ב "על" מיקום ישקף אור על תא סינתזה, ממוקם במישור המוקד, על ידי הראשון עובר דרך ממסר 1:1 offner מערכת הדמיה. (ב) תא הסינתזה, שנאסף לאחר, מורכב משקופית קדח הממוקמת תחילה על בלוק הקוורץ של התא, מופרדים על ידי אטם עבה (לא מוצג). שקופית שנייה, שאינה מקדנית ממוקמת לאחר מכן על שקופית הקדח, ומופרדת באמצעות אטם דק. מסגרת מתכת (לא מוצגת) מחזיקה את ההרכבה יחד. (ג). עבור הכנה לספרייה, לאחר שתא הסינתזה מחובר במישור המוקד של אור UV הנכנס, החדר הממוקם בין בלוק הקוורץ לבין השקופית הקדח מתמלא בתמיסה של 1% של β-קרוטן ב-CH2Cl2. כדי לעשות זאת, אבובים לשקע נוספים מוצמד לבלוק קוורץ והפתרון הכתום זורם מהשמאלית ביותר למיקום השמאלי ביותר. זרם של ריאגנטים וממיסים עבור סינתזה מוצג חצים לבנים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4 . אזור הסינתזה הוא בדרך כלל גלוי לעין בלתי. כאן, ספריית דנ א ניתן לראות על פני הזכוכית מיד לאחר סינתזה, עם ה-DNA עדיין בצורה מוגנת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 5 . היברידיזציה הספר ל-DNA 25 מר ו-RNA רצפים מסונתז באתרו על מיקרו מערכים. (A) לסרוק את הקרינה הפלואורסצנטית של כל הוכלא DNA ו-RNA microarray. ה-DNA של 25mer ו-RNA oligהוכלא משלימים את החוטים המשלימים הCy3 שלהם. המערך נסרק עם לייזר ב-532-גל עירור ננומטר, ברזולוציה של 5 יקרומטר. (ב) כוונות הקרינה הפלואורסצנטית (יחידות שרירותיות) של ה-DNA: dna ו-RNA: דופלקסים ב-dna בשלושה ניסויים נפרדים. הנתונים הירוקים באור עבור מסונתז RNA oligונודיאודים באתרו יכול להיחשב תת אופטימלית, כאשר בהשוואה לעוצמת הזריחה של רצפי ה-DNA המתאימים. קווי שגיאה הם SD. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
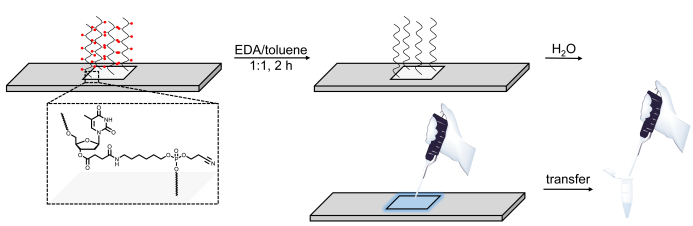
איור 6 . ייצוג סכמטי של הליכי ההגנה, המחשוף וההתאוששות של ספריות DNA המסונתז במיקרו מערכים. רצפי DNA הם גדלו על בסיס רגיש לביקוד dT נוקלאוטיד (מוצג באזור מוגדלת). לאחר הסינתזה, הגנה על ה-DNA olig, בסיס קבוצות הגנה מיוצגים כספירות אדומות) ב-EDA/toluene מותיר את החומר המוגן באופן סטטי מאוגד לפני השטח ולאחר מכן יכול להיות מיוצר מצינורות על ידי החלת כמות קטנה של מים על האזור הסונתז. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
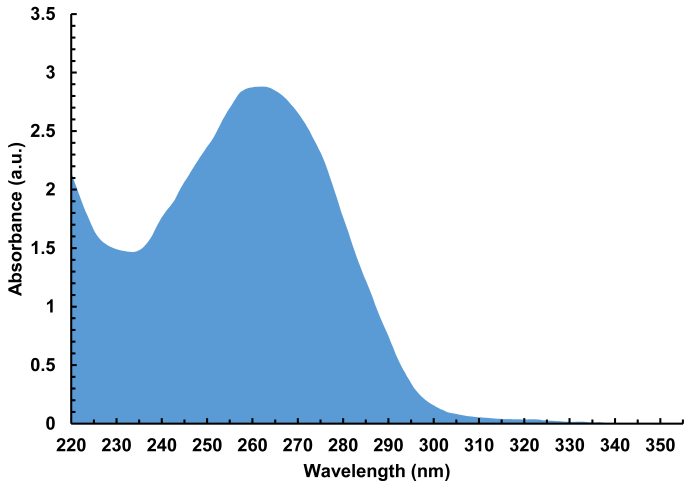
איור 7 . הספקטרום של ספיגת הנציגים (220-350 nm) של ספריית DNA, התפלה, הכוללת 4,000 רצפים שונים, 100-nt באורך. סך של 940 ng של ה-dna היה מבודד סינתזה מערך יחיד, המתאים 30 pmol של ה-dna סך, או 15 pmol לכל המצע הזכוכית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
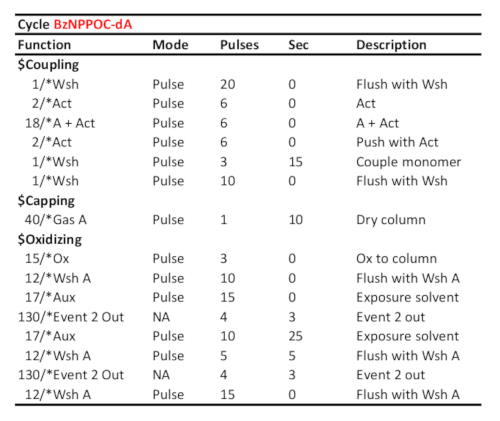
. שולחן 1 פרוטוקול מחזור מייצג עבור צימוד/חמצון/הגנה מפני 5 '-בהזאפון-דא, בהנחה שהזרחנות המקבילה היתה טעונה ביציאה "א". זמן צימוד (בשניות) מוצג בשורת "הזוג מונומר". הזמן הגנה מפני צילום UV, כאן המתאים לאנרגיה קורנת של 3 J/cm2 (באור התמונה), מחושב כאשר חלף הזמן בין שני "אירוע 2 Out" אותות תקשורת.
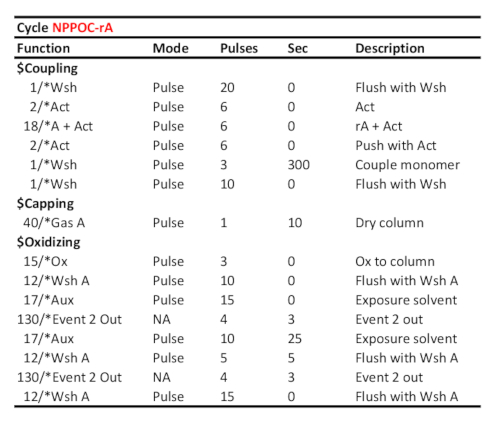
. שולחן 2 פרוטוקול מחזור מייצג עבור צימוד/חמצון/photodeprotection של 5 '-Nאפון-rA, בהנחה את המקבילה RNA זרחהאידידיום נטען על היציאה "A". זמן צימוד (בשניות) מוצג בשורת "הזוג מונומר". הזמן צילום UV הגנה, כאן מתאים לאנרגיה קורנת של 6 J/cm2 (כימיה n, כימיית התמונה), מחושב כמו הזמן שחלף בין שני "אירוע 2 Out" אותות תקשורת.
Discussion
בשלב מלא DNA סינתזה RNA הוא הלחם והחמאה של כל מעבדת הכימיה חומצות גרעין, ולמרות התוספת של הרכיב פוטוליטוגרפיה הוא מודה פעולה מורכבת, ייצור microarray מתווכת על ידי אור UV הוא גם תהליך אמין מאוד . זה, בנוסף, השיטה היחידה הזמינה לסינתזה של RNA באתרו במיקרו-מערכים. עדיין, כמו בכל הליך ניסיוני רב שלבית, יש מקום מספיק לטעות אנוש.
אולי הצעד הקריטי ביותר הוא זיווג של זרחניות, כפי שהיא צריכה להיות תגובה כימית מניב כל הזמן על מנת להרשות לעצמו מחלת האלרגיה עם כמה טעויות סינטתיים. בפרוטוקול סינתזה של המיקרו-מערך שלנו, מצמד זרחניות הוא אפילו יותר מרכזי לאיכות הסינתזה הכוללת מאז תהליך הייצור עוקף את הסגירה ומונע טיהור והאטה. הזיווגים מצמד היעילות למעלה 99% חושבו עבור כל ה-DNA הרגישים לאור היום ו-RNA זרחנות, אפילו עבור צימוד זמני מאוד קצר (15 s)24 אך תשואות הצימוד התחתון יכול להתרחש מדי פעם, במיוחד במקרה של dG am,. היציבות של זרחתי מסיסות בטמפרטורת החדר נחקר לפני והוצגה תלויה בטבעו של הנוקלאוטיסיס, עם guanosine זרחיות מועדים להשפלה נרחבת רק בעניין של ימים29, . בסדר, 30 אבל כאשר מאוחסן ב-25 ° c, מומס dG amאידיטים התפרקה ACN כמו 30 מ"מ פתרון נמצאו יציבים במשך מספר שבועות. חוסר היציבות היחסית של הפתרונות של dG הזאמאידיט בטמפרטורת החדר עושה זאת אומר כי הם לא צריכים להיות מחוברים הסינתיסייזר DNA במשך כמה ימים.
לקבלת זרחתן של RNA, התשואה הצימוד תלויה מאוד באיכות זרחהמטרית (אשר ניתן להעריך על ידי 31P nmr ספקטרוסקופיית) וזמן צימוד. שעות צימוד של 5 דקות עבור rA, rG, rC ו-2 דקות עבור rU מופיעים כנדרש. אכן, מצאנו כי קיצור זמן העיבוי ל 2 דקות עבור כל זרחני ה-RNA הובילו לסימני הכלאה נמוכים באופן משמעותי.
הסינתיסייזר DNA עצמו, כמו גם את הריאגנטים ואת ממיסים, בהחלט צריך להיות נקי ככל האפשר על מנת להשיג את התשואה הגבוהה ביותר של סינתזה olig, הגאות. עם זאת, חומר בלתי מסיסים, מלחים או חלקיקים, יכול להצטבר לאורך זמן בקווים ואבובים של מערכת המסירה, המוביל ירידה הדרגתית בצריכת של ריאגנטים ומגיב. כאשר ניקוי כללי של הסינתיסייזר אינו פותר נפח פלט נמוך, עלייה במספר הפולסים יכולה להיות פתרון חלופי. שימושי במיוחד במקרה של צריכת זרחני נמוכה, הקו בפרוטוקול הצימוד המתאים לשאיבה של שילוב של זרחני וactivator (השורה השלישית של סעיף קטן בטבלה 1 ושולחן 2) יכול להיות שונה, מ 6 עד 9 פולסים ללא כל השפעה שלילית ניכרת על איכות סינתזה. יתר על כן, מספר פולסים של activator הצורך להביא את התערובת am,/activator למצע סינתזה (כיום 6, הקו הרביעי בסעיף הקטן הצימוד, לראות את שולחן 1 ואת הטבלה 2) תלוי הסינתיסייזר DNA עצמו, כמו גם על אורך אבובים בתא הסינתזה. מספר זה יכול להיות מותאם לאחר החלפת זאמדיום עם פתרון צבעוני לספור את מספר פולסים הדרושים כדי לדחוף את תערובת צבעונית למצע זכוכית עבור צימוד.
השיטה המתוארת כאן מאפשרת לסינתזה של DNA ו-RNA להמשיך בו זמנית, על אותו מיקרו-מערך. כלאיים של דנ א ו-RNA עשוי להיות מוכן ללא כל שינוי לפרוטוקולי ייצור מערך, וכל עוד פרוטוקול deprotection שלושה שלבים מעקב אחריו. עם זאת, יש לציין כי מיקרומערכי RNA בלבד דורשים הגנה בשני צעדים בלבד: decyanoלציה ראשון עם Et3N ואחריו הידרוקסיל והבסיס deprotection עם הידראזין. נוקלאואוטיות DNA נמצאו לא מוגנים לחלוטין תחת תנאים אלה, וצריך את הצעד הנוסף ב-EDA כדי להשפיע על ההסרה המלאה של הקבוצות פניאוקסימרחקסיל (Pac). טיפול נוסף זה עם EDA הוא קצר יותר (5 דקות) מאשר עבור ההגנה הסטנדרטית של ה-DNA מיקרו-מערכים31, אבל זה מספיק כדי להסיע אותו להשלמה לאחר הטיפולים triethylamine והידראזין. בנוסף, זמן תגובה קצר עם EDA מגביל את החשיפה של רנ א מלאה הגנה מפני RNA לתנאים בסיסיים.
יתרון של סינתזה באתרו rna מערך על שיטות חלופיות כמו לזהות או שעתוק DNA32,33,34 היא היכולת לאחסן את שבב ה-rna מסונתז בצורה מוגנת עד השימוש, ובכך הימנעות ה סיכון של השפלה פוטנציאל RNA. לאחר הליכים סינתטיים עבור RNA עושה, מצד שני, לרמוז כי מתכלים וריאגנטים נשמרים סטרילי, כי הטיפול מבוצע בתנאים RNase-free. של הערה, מצאנו כי תוספת של RNase מעכב לערבב הכלאה לא להניב אותות הכלאה חזק יותר עבור תכונות RNA.
הסינתזה של ספריות DNA על מונומר רגיש בסיס הוא מורכב יותר מאשר סינתזה של רצפים שליטה כמה על פני השטח, וככזה הוא בהחלט נוטה יותר שגיאות עיצוב. עם זאת, בהנחה שעיצוב הרצף (כלומר, הטבע ומספר הרצפים) נכון, הפיכת רשימה זו לאוסף של מסיכות חשיפה וסידרה מסודרת של מחזורי צימוד נשארת תהליך פשוט. עם זאת, וריאציות חשובות של סינתזה מיקרוarray סטנדרטית קיימים והם קריטיים לייצור מוצלח של מערך ספרייה בצפיפות גבוהה.
ראשית, dT מוניומר בסיס רגיש ביחד כמו זרחבידיום הראשון לאחר סינתזה של המקשר. התשואה הצימוד של מונומר זה (איור 1) נמצאה נמוכה יחסית, בסביבות 85%28, ולכן מאמצי מאמצים לשפר את שיעור ההתאגדות שלה, אם על ידי הגברת הריכוז שלה ב-acn מ 30 מ"מ ל 50 מ"מ, או על ידי חזרה על שלב צימוד: שתי תגובות צימוד רצופות באמצעות מונמרים טריים, או שני מחזורי צימוד נפרד אך רציפים.
השינוי השני הוא תוספת של פתרון β-קרוטן בחדר האחורי של תא הסינתזה, אשר באופן נוח סופג אור 365 ננומטר. זהו שינוי חשוב של ההתקנה פוטוגרפיה כפי שהוא מונע אור UV משתקפים בחזרה על מצע המערך. ואכן, לאחר שעברו את המדיום הבין-ביניים בין הסובסטרטים, הרמזור הנכנס יוצא דרך שקופית הקדח ומגיע לבלוק הקוורץ של התא. משוואות פרנל לחזות כי ~ 4% של האירוע ניצב אור UV ישקף מכל אחד שלוש במורד ממשקי זכוכית אוויר (בצד היציאה שלהמצע 2 ושני הצדדים של בלוק קוורץ) ובחזרה על מצע סינתזה, המוביל לחשיפה לא מכוונת. של פוטוונואואני עקיפה ופיזור גם תורמים "off-target" הגנה מפני התמונה, ולכן, כדי נוקלאוטיד ההכנסה, אשר משפיע ישירות על שיעור השגיאות של סינתזה, אבל תרומות אלה הם הרבה יותר קטן מאשר השתקפויות ניתן בעיקר להתייחס על ידי צמצום צפיפות הסינתזה (השארת פערים בין התכונות). מצאנו כי רמת הפתרון β-קרוטן בחדר התחתון של התא נוטה מעט להקטין רק במהלך הדקות הראשונות של סינתזה המערך, ולכן צריך להיות מנוטרים ולקרוא מראש.
לבסוף, השינוי השלישי הוא פתרון deprotection, החלפת אטואה עבור toluene, אשר שומר את ספריית ה-DNA ביקח מאוגד אל פני השטח, ככל הנראה באמצעות אינטראקציות אלקטרוסטטית. החלת כמות קטנה של מים לאזור הסינתזה לאחר השטיפה ACN מאפשר לספרייה להיות בנוחות נאסף. התהליך הוא אולם מוצלח רק אם תוכן המים ב-EDA ו טולואן הוא מינימלי, עיבוד חומצת גרעין מסיסים לחלוטין בקוקטייל deprotection. לחילופין, ספריות DNA יכול להיות ביקדה את השבב באמצעות אמוניה9,10,14,35, ולאחר מכן deprotected נוסף על-ידי חימום ה-DNA המכיל פתרון אמוניה מימית כדי 55 ° c לילה. ההתאוששות של ספריות DNA באמצעות אמוניה היא עם זאת לא תואם RNA. ה-RNA פורוזימטר על מצע בסיס הניתן לביטול יכול להיות חומק מן המשטח באמצעות אותו הליך EDA/toluene המתואר לעיל, אבל רק בשלב לפני אחרון לאחר Et3N ו הידראזין אסטרטגיה בשני שלבים הגנה28.
אסטרטגיות חלופיות לשחזור מאגרי המידע בבריכות שונות ממיקרו-מערכים ללא צורך בטיפול בסיסי מסוים, הינם בעקרון תואמים לליתוגרפיה ומסתמכים על שימוש באנזימים. למשל, נוקלאוטיד בודד יכול להיות היעד של uracil-DNA גליסיקלז (UDG) והוא מגורש משאר רצף ה-DNA, או יחידה RNA אחת ניתן לזהות על ידי RNase H סוג 2 אנזימים ואת הקשר פוספדודיסטר 5 ' אל RNA ביקח , משחררים את. ה -5-DNA חלק23
עכשיו יש לנו עוצמה, אמין וצפיפות גבוהה שיטה לסינתזה של DNA, RNA, ו-DNA היברידית/RNA מיקרומערכים. אלה לא יכולים רק לשמש פלטפורמות היברידיזציה או קשירה בחני36, אבל הם גם מייצגים דרך מהירה וזולה לייצר ספריות גרעין מורכבות חומצות. עבור אחסון נתונים דיגיטליים מבוססי DNA, פוטוגרפיה של microarray עשוי להפוך לפיתרון פוטנציאלי לצוואר בקבוק הכתיבה (כלומר, לקידוד מידע באמצעות סינתזה). ההצלחה בקידוד דיגיטלי ב-DNA ו בהרכבה גנטית של דה נובו תלוי בנאמנות רצף אשר, ברמת הסינתזה, מיתרגם את קצב השגיאה. שגיאות סינטתיים ואופטיים בפרוטוקולי ייצור המערך הנוכחיים שלנו יידונו וידווחו במקום אחר. במקביל, המאמצים מתבצעת כעת כדי להגדיל את היקף ייצור ותפוקה.
Disclosures
המחברים מאשרים שאין להם זיקה לארגון למטרת רווח.
Acknowledgements
עבודה זו הייתה נתמכת על ידי הקרן האוסטרית למדעים (FWF מענקים P23797, P27275 ו P30596) ואת הקרן הלאומית למדע השוויצרי (גרנט #PBBEP2_146174).
Materials
| Name | Company | Catalog Number | Comments |
| Slide functionalization | |||
| Acetic acid >99.8% | Sigma | 33209 | For RNA deprotection |
| CNC router | Stepcraft | 300 CK | |
| Ethanol absolute | VWR | 1.07017.2511 | For deprotection and functionalization |
| N-(3-triethoxysilylpropyl)-4-hydroxybutyramide | Gelest | SIT8189.5 | Silanizing reagent |
| Nexterion Glass D microscope slides | Schott | 1095568 | |
| Polymax 1040 | Heidolph | Orbital shaker | |
| Proclean 507 Ultrasonic water bath | Ulsonix | To clean slides after drilling | |
| Tickopur RW 77 Special Purpose Cleaner | Sigma | Z860086 | To clean slides after drilling |
| Microarray synthesis | |||
| 0.25 M dicyanoimidazole in ACN | Biosolve | 0004712402BS | Activator |
| 0.7 XGA DMD | Texas Instruments | Digital Micromirror Device | |
| 20 mM I2 in pyridine/H2O/THF | Sigma | L860020-06 | Oxidizer |
| 250 μm thick Chemraz 584 perfluoroelastomer | FFKM | Lower teflon gasket | |
| 2'-O-ALE RNA phosphoramidites | ChemGenes | ||
| 365 nm high-power UV-LED | Nichia | NVSU333A | |
| 5'BzNPPOC DNA phosphoramidites | Orgentis | ||
| 5'NPPOC DNA phosphoramidites | FlexGen | ||
| Acetonitrile | Biosolve | 0001205402BS | For DNA synthesis |
| Amidite Diluent for DNA synthesis | Sigma | L010010 | For dissolving phosphoramidites |
| Cleavable dT | ChemGenes | Base-sensitive monomer for library preparation | |
| DMSO | Biosolve | 0004474701BS | As exposure solvent |
| DNA and RNA microarray deprotection | |||
| Ethylenediamine >99.5% | Sigma | 3550 | For deprotection |
| Expedite 8909 | PerSeptive Biosystems | DNA synthesizer | |
| Hydrazine hydrate 50-60% hydrazine | Sigma | 225819 | For RNA deprotection |
| Imidazole | Sigma | 56750 | |
| Industrial Strength lower-density PTFE tape | Gasoila | Thin, upper teflon gasket | |
| Pyridine >99% | Sigma | P57506 | For RNA deprotection |
| Triethylamine >99% | Sigma | T0886 | For RNA deprotection |
| β-carotene | Sigma | C9750 | For library preparation |
| Hybridization and scanning | |||
| 20x Sodium Saline Citrate | Roth | 1054.1 | |
| 5'Cy3-labelled complementary strand | Eurogentec | For duplex hybridization | |
| Biopur Safe-Lock microcentrifuge tube | Eppendorf | ||
| BSA (10 mg/mL) | Promega | R3961 | |
| EDTA molecular biology grade | Promega | H5031 | |
| GenePix 4100A | Molecular Devices | Microarray scanner | |
| Hybridization oven | Boekel Scientific | 230500 | |
| MES monohydrate | Sigma | 69889 | |
| MES sodium | Sigma | M3058 | |
| NaCl >99.5% | Sigma | 71376 | |
| SecureSeal SA200 hybridization chamber | Grace BioLabs | 623503 | |
| Spectrafuge mini | Labnet | C1301 | Microarray centrifuge |
| Tween-20 molecular biology grade | Sigma | P9416 | |
| Data extraction | |||
| Excel | Microsoft | For data extraction | |
| MatLab | MathWorks | Microarray design | |
| NimbleScan 2.1 | Roche NimbleGen | ||
| Desalting and quantification | |||
| NanoDrop One Spectrophotometer | Thermo Scientific | ||
| Toluene | Merck | ||
| ZipTip C18 | Millipore | ZTC18s008 | Desalting pipet tips |
References
- Bumgarner, R. . Current protocols in molecular biology. 101, 22 (2013).
- Berger, M. F., Bulyk, M. L. Universal protein-binding microarrays for the comprehensive characterization of the DNA-binding specificities of transcription factors. Nature Protocols. 4 (3), 393-411 (2009).
- Tietjen, J. R., Donato, L. J., Bhimisaria, D., Ansari, A. Z. Sequence-specificity and energy landscapes of DNA-binding molecules. Methods in enzymology. 497, 3-30 (2011).
- Katilius, E., Flores, C., Woodbury, N. W. Exploring the sequence space of a DNA aptamer using microarrays. Nucleic Acids Research. 35 (22), 7626-7635 (2007).
- Franssen-van Hal, N. L. W., et al. Optimized Light-Directed Synthesis of Aptamer Microarrays. Analytical Chemistry. 85 (12), 5950-5957 (2013).
- Matteucci, M. D., Caruthers, M. H. Nucleotide Chemistry .4. Synthesis of Deoxyoligonucleotides on a Polymer Support. Journal of the American Chemical Society. 103 (11), 3185-3191 (1981).
- Eroshenko, N., Kosuri, S., Marblestone, A. H., Conway, N., Church, G. M. Gene Assembly from Chip-Synthesized Oligonucleotides. Current Protocols in Chemical Biology. 2012, (2012).
- Kosuri, S., et al. Scalable gene synthesis by selective amplification of DNA pools from high-fidelity microchips. Nature Biotechnology. 28 (12), 1295 (2010).
- Richmond, K. E., et al. Amplification and assembly of chip-eluted DNA (AACED): a method for high-throughput gene synthesis. Nucleic Acids Research. 32 (17), 5011-5018 (2004).
- Schmidt, T. L., et al. Scalable amplification of strand subsets from chip-synthesized oligonucleotide libraries. Nature Communications. 6, (2015).
- Grass, R. N., Heckel, R., Puddu, M., Paunescu, D., Stark, W. J. Robust Chemical Preservation of Digital Information on DNA in Silica with Error-Correcting Codes. Angewandte Chemie International Edition. 54 (8), 2552-2555 (2015).
- Erlich, Y., Zielinski, D. DNA Fountain enables a robust and efficient storage architecture. Science. 355 (6328), 950-953 (2017).
- Garalde, D. R., et al. Highly parallel direct RNA sequencing on an array of nanopores. Nature Methods. 15 (3), 201-206 (2018).
- Cleary, M. A., et al. Production of complex nucleic acid libraries using highly parallel in situ oligonucleotide synthesis. Nature Methods. 1 (3), 241-248 (2004).
- LeProust, E. M., et al. Synthesis of high-quality libraries of long (150mer) oligonucleotides by a novel depurination controlled process. Nucleic Acids Research. 38 (8), 2522-2540 (2010).
- Lietard, J., Damha, M. J., Somoza, M. M., Fernández-Lucas, J. . Enzymatic and Chemical Synthesis of Nucleic Acid Derivatives. , (2018).
- Fodor, S. P. A., et al. Spatially Addressable Parallel Chemical Synthesis. Science. 251 (4995), 767-773 (1991).
- Singh-Gasson, S., et al. Maskless fabrication of light-directed oligonucleotide microarrays using a digital micromirror array. Nature Biotechnology. 17 (10), 974-978 (1999).
- Pease, A. C., et al. Light-Generated Oligonucleotide Arrays for Rapid DNA-Sequence Analysis. Proceedings of the National Academy of Sciences of the United States of America. 91 (11), 5022-5026 (1994).
- Holz, K., Lietard, J., Somoza, M. M. High-Power 365 nm UV LED Mercury Arc Lamp Replacement for Photochemistry and Chemical Photolithography. ACS Sustainable Chemistry & Engineering. 5 (1), 828-834 (2017).
- Lackey, J. G., Mitra, D., Somoza, M. M., Cerrina, F., Damha, M. J. Acetal Levulinyl Ester (ALE) Groups for 2′-Hydroxyl Protection of Ribonucleosides in the Synthesis of Oligoribonucleotides on Glass and Microarrays. Journal of the American Chemical Society. 131 (24), 8496-8502 (2009).
- Lackey, J. G., Somoza, M. M., Mitra, D., Cerrina, F., Damha, M. J. In-situ chemical synthesis of rU-DNA chimeras on chips and enzymatic recognition. Chimica Oggi-Chemistry Today. 27 (6), 30-33 (2009).
- Lietard, J., Ameur, D., Damha, M., Somoza, M. M. High-density RNA microarrays synthesized in situ by photolithography. Angewandte Chemie International Edition. 57 (46), 15257-15261 (2018).
- Agbavwe, C., et al. Efficiency, Error and Yield in Light-Directed Maskless Synthesis of DNA Microarrays. Journal of Nanobiotechnology. 9, (2011).
- Sack, M., et al. Express photolithographic DNA microarray synthesis with optimized chemistry and high-efficiency photolabile groups. Journal of Nanobiotechnology. 14, (2016).
- Kretschy, N., Holik, A. K., Somoza, V., Stengele, K. P., Somoza, M. M. Next-Generation o-Nitrobenzyl Photolabile Groups for Light-Directed Chemistry and Microarray Synthesis. Angewandte Chemie International Edition. 54 (29), 8555-8559 (2015).
- Sack, M., Kretschy, N., Rohm, B., Somoza, V., Somoza, M. M. Simultaneous Light-Directed Synthesis of Mirror-Image Microarrays in a Photochemical Reaction Cell with Flare Suppression. Analytical Chemistry. 85 (18), 8513-8517 (2013).
- Lietard, J., et al. Base-cleavable microarrays for the characterization of DNA and RNA oligonucleotides synthesized in situ by photolithography. Chemical Communications. 50 (85), 12903-12906 (2014).
- Krotz, A. H., et al. Solution stability and degradation pathway of deoxyribonucleoside phosphoramidites in acetonitrile. Nucleosides Nucleotides & Nucleic Acids. 23 (5), 767-775 (2004).
- Hargreaves, J. S., Kaiser, R., Wolber, P. K. The Degradation of Dg Phosphoramidites in Solution. Nucleosides Nucleotides & Nucleic Acids. 34 (10), 691-707 (2015).
- McGall, G. H., et al. The efficiency of light-directed synthesis of DNA arrays on glass substrates. Journal of the American Chemical Society. 119 (22), 5081-5090 (1997).
- Collett, J. R., et al. Functional RNA microarrays for high-throughput screening of antiprotein aptamers. Analytical Biochemistry. 338 (1), 113-123 (2005).
- Buenrostro, J. D., et al. Quantitative analysis of RNA-protein interactions on a massively parallel array reveals biophysical and evolutionary landscapes. Nature Biotechnology. 32 (6), 562-568 (2014).
- Wu, C. -. H., Holden, M. T., Smith, L. M. Enzymatic Fabrication of High-Density RNA Arrays. Angewandte Chemie International Edition. 53 (49), 13514-13517 (2014).
- Tian, J., et al. Accurate multiplex gene synthesis from programmable DNA microchips. Nature. 432 (7020), 1050-1054 (2004).
- Lietard, J., et al. Mapping the affinity landscape of Thrombin-binding aptamers on 2'F-ANA/DNA chimeric G-Quadruplex microarrays. Nucleic Acids Research. 45 (4), 1619-1632 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved