Method Article
Микроары ДНК и РНК с высокой плотностью - фотолитографический синтез, гибридизация и подготовка больших нуклеиновой кислоты
В этой статье
Резюме
В этой статье мы представляем и обсуждаем новые разработки в синтезе и применении микроаррей нуклеиновой кислоты, изготовленных на месте. В частности, мы показываем, как протоколы синтеза ДНК могут быть распространены на РНК и как микроаррей могут быть использованы для создания библиотек для извлечения нуклеиновой кислоты.
Аннотация
Фотолитография является мощным методом синтеза олигонуклеотидов ДНК на стеклянных слайдах, так как она сочетает в себе эффективность реакций фосфорамидита с точностью и плотностью уф-излучения, отраженного от зеркал размером с микрометр. Фотолитография дает микроаррей, которые могут вместить от сотен тысяч до нескольких миллионов различных последовательностей ДНК, 100-nt или дольше, всего за несколько часов. С этим очень большим пространством последовательности, microarrays являются идеальными платформами для изучения механизмов нуклеиновой кислоты, которые особенно актуальны в случае РНК. Недавно мы сообщили о подготовке нового набора РНК фосфорамидитов совместимы с на месте фотолитографии и которые впоследствии были использованы для выращивания РНК олигонуклеотидов, гомополимеров, а также смешанных баз последовательностей. Здесь мы подробно иллюстрируем процесс изготовления РНК-микроаррей, от экспериментального дизайна до инструментальной установки, синтеза массивов, дезащиты и окончательного проверки гибридизации с использованием последовательности шаблона 25mer, содержащей все четыре базы в качестве примера. Параллельно мы выходим за рамки экспериментов на основе гибридизации и используем фотолитографию микроаррей как недорогой шлюз для сложных библиотек нуклеиновой кислоты. Для этого микроаррей ДНК высокой плотности изготавливаются на базовом мономере, который позволяет удобно расщепляться и извлекать ДНК после синтеза и дезащиты. Протокол изготовления оптимизирован таким образом, чтобы ограничить количество синтетических ошибок, и с этой стороны, слой раствора к-каротина вводится для поглощения ультрафиолетовых фотонов, которые в противном случае могут отражать обратно на субстраты синтеза. Мы описываем пошагово полный процесс подготовки библиотеки, от проектирования до расщепления и количественной оценки.
Введение
Практическое использование микроаррей ДНК традиционно было в изучении вариаций в уровнях экспрессии генов между двумя популяциями клеток, используя дополнительные нити и флуоресценцию в качестве метода обнаружения1. Иногда, ДНК microarrays предприятие в связывание событий с ненуклеиновой кислоты лиганды, такие как белки, со стратегией систематической перестановки последовательности, которая предлагает всеобъемлющий обзор связывания пейзаж2,3, 4,5. Этот подход эффективно преобразует микроаррей из простой поверхности гибридизации в платформы с широким охватом последовательности, что было бы активом для изучения более богатого и более сложного мира структуры и функции РНК. При поддержке чрезвычайно эффективной реакции соединения фосфорамидита6, на месте синтезированных массивов ДНК теперь также можно рассматривать как дешевый источник ДНК7, который становится особенно актуальным, учитывая постоянно растущий спрос на нуклеиновой кислоты материал для сборки генов8,9, ДНК наноструктур10, хранение информации или секвенирования11,12. Аналогичным образом, технологии секвенирования, вероятно, выиграют от разработки методов, которые дают очень сложные смеси олигонуклеотидов РНК13. В этом контексте протоколы изготовления массивов, позволяющие синтезировать олигонуклеотиды на месте и при высокой плотности, идеально подходят для удовлетворения потребностей быстро расширяющейся области биотехнологии нуклеиновой кислоты. Однако, с полем, как разнообразны, как биотехнология, цель каждого приложения может потребовать, чтобы ДНК на microarray быть произведены либо на высокой пропускной их или с очень низким количеством синтетических ошибок14,15, или оба, требующие пристальный взгляд на протоколы синтеза микроаррей ДНК, которые исторически были в первую очередь оптимизированы для анализа гибридизации. Между тем, на месте синтез РНК microarrays было установлено, что сложные усилия, с большинством трудностей, связанных с защитой группы для 2'-OH функции, как правило, силило moiety в стандартной твердой фазы синтеза, который удаляется с реагенты на основе фтора, химические вещества, несовместимые со стеклянными или кремниевыми поверхностями. Эти вопросы и проблемы в СИНТЕЗе ДНК и РНК микроаррей в последнее время были предметом большого количества работы, в частности, с фотолитографии подход16.
Фотолитография использует ультрафиолетовый свет для разблокирования олигонуклеотидов перед соединением и требует маски, чтобы построить шаблон УФ-облучения, тем самым пространственно организации и контроля роста олигонуклеотидов. Физические маски были заменены управляемыми компьютером микрозеркалами, наклон евразийцев избирательно отражает ультрафиолетовый свет на микроаррей17,18,19. В качестве УФ-источника мы используем 365 нм света от источника светодиодов высокой мощности20. Текущие фотолитографические установки оснащены микрозеркальными массивами, содержащими зеркала 1024 и 768, что соответствует более чем 780 000 индивидуально адресных точек ("функций") на небольшой площади всего 1,4 см2, или 1080p с массивами 1920 и 1080, или 2 миллиона зеркал. Поэтому каждое из зеркал в устройстве имеет прямой контроль над последовательностью, выращенной на соответствующей функции. За исключением ультрафиолетового света, фотолитография функционирует как метод синтеза твердой фазы и принимает циклна на основе химии фосфорамидита. Только для этого требуется совершенно другая стратегия защиты синтеза РНК. Мы разработали новую серию светочувствительных РНК фосфорамиды подшипников гидразина-лабиля защиты групп21. Эти мономеры позволяют РНК быть дезащищены в умеренных условиях, которые не влияют на целостность поверхности. Первый шаг дезащиты использует триэтиламин для удаления цианоэтил фосфодиера защиты групп, в то время как гидразин используется во втором, отдельный шаг, чтобы удалить те, на 2'-OH и exocyclic амина функций. При этом, РНК олигонуклеотиды 30-nt в длину и любой последовательности теперь могут быть синтезированы на месте на microarrays22,23. Параллельно мы также недавно приступили к решению вопросов пропускной перечни, качества и скорости в ДНК и фотолитографии РНК. Мы измерили эффективность соединения ,gt;99% для всех ДНК и РНК-амидитов(Рисунок 1) и исследовали каждый отдельный шаг в цикле удлинения олигонуклеотида, от времени окисления, до выбора активатора и оптимального УФ-облучения24 , 25. Мы ввели в новых светочувствительных 5 'защиты групп, которые могут быть удалены в считанные секунды только, превращая синтез сотен тысяч 100mers в несколько часов-долго процесса26. Мы также удвоили пропускную стоимость изготовления массива, подвергая два субстрата одновременно27. Наконец, мы ввели dT фосфорамидита, содержащего базы чувствительных сукцинил группы в качестве удобного способа расщеплять, собирать и анализировать ДНК и РНК олигонуклеотидов, который имеет центральное значение для подготовки библиотеки28.
Несмотря на относительно обыденный аспект синтеза ТВЕРДОй фазы ДНК и РНК, особенно для химиков нуклеиновой кислоты, фотолитография микроаррей остается нетривиальной апгрейдом, требующим сложной установки, тщательного контроля и надзора за процессом, и отдельные инструкции по постсинтетической обработке в зависимости от характера олигонуклеотида и типа применения. В этой статье мы хотели бы представить подробную презентацию всей поэтапной процедуры синтеза ДНК и РНК-микроаррей с помощью фотолитографии, от экспериментального проектирования до анализа данных, с акцентом на подготовку приборов и Расходные материалы. Затем мы описываем постсинтетические методы дезащиты, которые соответствуют предназначению производства микроаррей (т.е. либо гибридизации, либо восстановлению библиотек нуклеиновой кислоты).
протокол
1. Дизайн Microarray
- Напишите последовательности, которые будут синтезированы в текстовом редакторе, 5'3', одна строка в последовательности. Для контроля качества 25mer, используйте последовательность "GTCATCATCATGAACCACCCTCTTC". Используйте буквы A, C, G и T для нуклеотидов ДНК и 5, 6, 7 и 8 цифр для нуклеотидов РНК.
- В случае подготовки библиотеки добавьте дополнительный номер (т.е. 9) в конце 3' каждой последовательности. Это будет соответствовать соединению базового мономера.
- За каждой последовательностью должна следовать запятая. Назначайте имя каждой последовательности после запятой и убедитесь, что каждая полоса следует формату«последовательность», #sequence_name(без скобок). Сохранить список последовательностей в виде файла .txt.
- Запустите MatLab затем загрузить программу ChipDesign.m. Выполнить программу.
- В окне панели свойств загрузите файл макета microarray EntireChip. Загрузите файл макета MilliChip, если цель состоит в том, чтобы синтезировать весь массив в четырех одинаковых местах.
- В окне панели свойств, под спецификацией чипа,выберите Выберите контейнер, то Область синтеза. В соответствии с шаблоном выберите шаблон, который дает правильное количество адресных функций, подсчитывая количество последовательностей и количество репликатов. Для контроля качества 25mer выберите шаблон 25:36.
- Под выберите контейнер, выберите Фидуциальный. Фидуциальные особенности обычно синтезируются по углам области синтеза и используются для извлечения данных о гибридизации. С Фидуциальной выбранной, напишите последовательность (5''3'), которая будет синтезирована на фидуциальных особенностей и которые могут выступать в качестве положительного контроля. Для 25-мерного эксперимента используйте ту же последовательность ДНК.
- Под sequenceзагрузите текстовый файл, содержащий все письменные последовательности. Убедитесь, что выбрана рандомизация. Дайте название для эксперимента в названии проекта и, в последовательности Linker, написать TTTTT (соответствующий T5 linker).
- Нажмите Generate, а затем найти файлы дизайна массива и маски (Рисунок 2) под MaskGen-delta'rc1/Designs папке. Убедитесь, что он содержит сценарий отображения, последовательность потока и файлдизайна.
- Для подготовки библиотеки откройте сценарий отображения. Добавьте дополнительную строку в нижней части скрипта отображения, которая копирует именно первую строку скрипта (например, отображение First-Mask.bmp 150). Это позволит удалить группу фотозащиты терминала в конце 5's всех олигонуклеотидов.
- Запустите программу создателя работautoJob, загрузите шаблон, нажав на шаблон нагрузки, затем нажмите на Display Script, чтобы загрузить файл скрипта отображения, который был сгенерирован MatLab. Пресс-генерировать. Этот шаг позволит создать серию инструкций, называемых jobfile, который будет контролировать связь компьютера с микрозеркалами и синтезатором ДНК.
2. Подготовка и функционализация слайдов
- Просверлите одну горку в двух позициях, соответствующих расположению впускной и выходной трубки на ячейке синтеза. Используйте 0,9 мм алмаз бит на маршрутизаторе CNC точно и надежно сверлить. Промыть просверленные горки ультрачистой водой и расположить их в слайд-стойку.
- Очистите поверхности, очистив горки в водяной бане, содержащей 5% аммиака на основе специального уборщика специального назначения в течение 30 минут при 35 градусах Цельсия. Промыть слайд с двойной дистиллированной H2O и передать их в чистой, сухой стойке.
- Упорядочить пробуренные и необслалмикроскоп слайды в слайд стойку. В большом цилиндре подготовьте функциональный раствор, смешав 475 мл этанола (EtOH) с 25 мл ddH2O, 10 г силанизирующего реагента (N -(3-триэтисилилпропил)-4-гидроксибутирамид) и 1 мл уксусной кислоты. Хорошо перемешать до однородной затем передать в подходящий, закрытый контейнер.
- Поместите загруженную стойку в контейнер, закройте крышку и дайте контейнеру аккуратно поставить на орбитальный шейкер на 4 ч при комнатной температуре.
- После 4 ч отбросьте раствор функционализации и замените 500 мл раствора для мытья, состоящего из 475 мл EtOH, 25 мл ddH2O и 1 мл уксусной кислоты. Агитировать медленно в течение 20 минут при комнатной температуре, затем отбросить и заменить 500 мл свежего раствора для мытья.
- После дополнительных 20 минут при комнатной температуре отбросьте раствор, высушите горки с помощью горки и вылечите их в предварительно разогретой вакуумной печи при температуре 120 градусов По Цельсию. После 2 ч, выключите духовку и вакуумный насос, но оставить слайды под пониженным давлением на ночь. Затем верните духовку к атмосферному давлению и храните горки в ошикаторе до дальнейшего использования.
3. Подготовка реагентов синтеза и реагентов
- Доведите фосфорамидиновые порошки(рисунок 1) от температуры их хранения (-25 или -45 градусов по Цельсию) до комнатной температуры в ошикаторе.
- Когда фосфорамитит достигли комнатной температуры, растворите порошок с объемом ультрасухого ацетонитрила (зlt;30 ppm H2O), чтобы достичь концентрации 30 мМ для стандартной концентрации ДНК и РНК фосфорамидитов, и 50 мм для базового чувствительного мономерного dT ( подготовки библиотеки). Добавьте небольшой мешок молекулярного сито, чтобы заманить в ловушку любые следы влажности.
- Подготовьте раствор 1% (w/w) имидазола в DMSO путем растворения 11 г имидазола в 1 л сухого ДМСО. Хорошо встряхните до полного растворения. Прикрепите раствор к вспомогательному порту синтезатора ДНК. Это будет растворитель экспозиции, необходимый для полного удаления группы фотозащиты 5 евро.
- Для синтеза библиотек приготовьте раствор в размере 1% (w/v) q-каротина в дихлорметане путем растворения 100 мг каротина в 10 мл дихлорметана. Хорошо встряхните в янтарной стеклянной бутылке, затем заверните в алюминиевую фольгу.
4. Подготовка и мониторинг синтеза микроаррей.
- Запись температуры и влажности в комнате микроаррей изготовления и убедитесь, что синтезатор ДНК находится под достаточным давлением гелия.
- Включите УЛЬТРАСветодиодны и вентилятор охлаждения. Прикрепите ультрафиолетовый счетчик интенсивности в фокусной плоскости поступающего ультрафиолетового света и включите его(рисунок 3A).
- На компьютере, начать jobfile / микрозеркало / синтез файлов контроллер программного обеспечения (названный WiCell). Включите затем инициализировать устройство микрозеркала и загрузить все-белый файл маски, нажав на DMD, а затем выбрав изображение нагрузки .
- Нажмите на значок UVS и выберите UV Shutter Open. Прочитайте значение мощности (вmW/cm 2) на метр интенсивности и подсчитайте 60 s. После 60 с, прочитайте значение питания снова и запишите вниз начальные и конечные значения. Закройте затвор, выбрав УФ-затвор закрыть и выключить метр интенсивности. Рассчитайте среднее значение интенсивности УФ в мВт/см2.
- Рассчитайте время экспозиции, необходимое для достижения сияющей энергии 6 J/cm2 для 5'-NPPOC фотодезащиты (ДНК и РНК microarrays) и 3
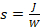 J/cm2 для 5'-BzNPPOC фотодезащиты (БИБЛИОТЕКи ДНК), просто после отношения.
J/cm2 для 5'-BzNPPOC фотодезащиты (БИБЛИОТЕКи ДНК), просто после отношения. - В программном обеспечении для синтезатора ДНК Workstation создайте файл последовательности в редакторе последовательности, копируя и вставляя содержимое последовательности потока, генерируемого MatLab. Добавьте дополнительные два шага стирки в конце 3' (письмо цикла по умолчанию: "s"), чтобы вымыть поверхность субстратов, прежде чем перейти к первому соединению. Сохранить и экспортировать файл последовательности.
- В протокольном редакторе программного обеспечения Workstation создайте протокол, содержащий выделенный цикл, названный в честь каждого из букв и цифр, присутствующих в файле последовательности (например, если файл последовательности содержит только буквы A, C, G и T, то протокольный файл должен содержат четыре цикла, названные A, C, G и T).
- Установите время соединения для ФОсфорамидитов ДНК (циклы A, C, G и T) до 15 с, до 120 с для ФОсфорамидита (цикл 8) и до 300 с для RA, rC и rG фосфорамид (циклы 5, 6 и 7). Для подготовки библиотеки установите соединение базового, примыкающего мономера dT до 2 х 120 с(таблица 1 и таблица 2).
- Убедитесь, что время ожидания между двумя событиями связи Event 2 Out в каждом цикле соответствует расчетному времени воздействия УФ-излучения для достижения необходимой сияющей энергии. Что касается файла последовательности, сохраните и экспортируете файл протокола.
- В программном обеспечении WiCell загрузите задания, последовательность и протокольные файлы в соответствующие подокна, а затем нажмите Send, чтобы отправить последовательность и протокольные файлы на синтезатор ДНК.
- В файле последовательности подсчитайте количество соединений для каждого фосфорамидита.
- Для измерения требуемого объема (в Зл) раствора фосфорамидита, необходимого для выполнения каждого синтеза, умножьте количество соединений на 60. Добавьте 250 к L к каждому тому для безопасности и грунтовки линии на синтезаторе дна. Используйте базовый объем в 250 л для фосфорамититов, требующих только одной связи.
- Быстро перенесите раствор во флаконы на синтезатор ДНК, соответствующий портовому букве/номеру в протокольных циклах.
- Премьер порты с фосфорамидитом решений с 10 премьер импульсов каждый для того, чтобы заполнить линии с реагентом. Прайм ацетонитрила мыть линии перед крепежем реакционной клетки.
- Чтобы собрать синтезную ячейку, поместите толстую (250 мкм) прокладку перфтоеластомера (FFKM) сначала на кварцевый блок клетки. Поместите просверленный, функционализированный микроскоп слайд на верхней части первой прокладки, и убедитесь, что отверстия на слайдах соединяются с входе и выходом труб синтеза ячейки.
- Поместите вторую, тонкую (50 мкм) прокладку политетрафтометилена (ПТФЕ) над просверленной горкой, окружающей два отверстия. Наконец, поместите второй, функционализированный, но необобщенный слайд на вершине второй прокладки(рисунок 3B). Поместите 4-винтовой металлический каркас поверх собранной двухсубстратовой ячейки и затяните винт до той же силы зажима (0,45 Нм) с помощью отвертки крутящего момента.
- Прикрепите входе и розетки трубки к синтезатору ДНК. Премьер ацетонитрила мыть линии и проверить надлежащий поток ацетонитрила (ACN) через субстраты. Разберите и соберите ячейку, если на данном этапе можно наблюдать утечку ACN. Измерьте объем ACN на линии отходов после прохождения 7 циклов грунтовки ACN. Этот объем должен быть 2 мл.
- Прикрепите клетку синтеза в фокусной плоскости поступающего ультрафиолетового света. В случае подготовки библиотеки, приложите дополнительную линию входе и розетки к задней части клетки и заполните заднюю камеру раствором к-каротина (2 мл раствора достаточно). Убедитесь, что нет утечки(Рисунок 3C).
- Начните синтез, сначала нажав на Run в программном обеспечении WiCell. При первой команде WAIT в файле задания нажмите «Старт» на синтезаторе ДНК.
- Во время синтеза регулярно проверяйте, совпадает ли отображение файлов маски с УФ-экспозицией и открытием затвора.
- После синтеза регулярных микроаррей отключите клетку от синтезатора, разберите клетку и используйте алмазную ручку, чтобы вытравить номер синтеза на стеклянных слайдах. Etch число на несинтезированной стороне каждого слайда. Перенесите слайды в центрифуги 50 мл и храните в высохшой области до дальнейшего использования.
- После синтеза библиотечных микроаррей сначала слейте раствор из каротина из камеры, затем промойте его, протекая 2 и 5 мл CH2Cl2,затем процедить. Продолжить разборку в рамках шага 4.21. Синтезированный массив может быть виден невооруженным глазом(рисунок 4).
5. Дезащита микроаррей ДНК
- Заполните окрашивание стеклянной банки с 20 мл EtOH и 20 мл этиленедиамин (EDA). Поместите микроаррей только ДНК вертикально в банку, закройте крышку и оставьте слайды дезащита в течение 2 ч при комнатной температуре.
ВНИМАНИЕ: ЭДА является остро токсичной, коррозионной и легковоспламеняющейся жидкостью. Работайте с перчатками в хорошо проветриваемом капоте дыма. - После 2 ч, получить слайды с помощью пинцета и промыть их тщательно с двойной дистиллированной H2O.
- Сухие слайды в центрифуге microarray в течение нескольких секунд, а затем хранить в desiccator.
6. РНК микроаррей дезащиты
- В 50 мл центрифуги трубки, подготовить сухой раствор 2:3 триэтиламин / ACN (20 мл и 30 мл каждого, соответственно). Перенесите одну РНК-микроаррей в центрифугу, закройте крышку, затем заверните пластиковой пленкой для уплотнения. Аккуратно встряхните центрифугу на орбитальной шейкере в течение 1 ч и 30 мин при комнатной температуре.
- После 1ч и 30 мин, удалить слайд, мыть с 2 20 мл сухой ACN затем высохнуть в центрифуге microarray в течение нескольких секунд.
ВНИМАНИЕ: Триэтиламин является остро токсичной, коррозионной и легковоспламеняющейся жидкостью. Ацетонитрил токсичен и легковоспламеняется. Работайте с перчатками в хорошо проветриваемом капоте дыма.
ПРИМЕЧАНИЕ: Первый этап дезащиты завершен. - Приготовьте раствор гидрата 0,5 М в 3:2 пиридина/ацетической кислоты. Во-первых, смешать 20 мл уксусной кислоты и 30 мл пиридина в градуированном цилиндре. Подождите, пока раствор остынет, прежде чем добавить 1,21 мл гидрата гидразина. Перенесите около 40 мл полученного раствора в центрифужную трубку 50 мл.
ВНИМАНИЕ: Гидрозиновый гидрат является остро токсичной и коррозионной жидкостью. Пиридин легковоспламеняющийся и остро токсичный. Ацетическая кислота легковоспламеняющаяся и коррозионная. Работайте с перчатками в хорошо проветриваемом капоте дыма. - После первого шага дезащиты перенесите РНК-слайд в раствор гидрата гидрата гидрата, закройте крышку и заверните пластиковой пленкой для уплотнения. Аккуратно встряхните трубку на орбитальном шейкере в течение 2 ч при комнатной температуре. После 2 ч, удалить слайд, мыть с 2 й 20 мл сухой ACN затем высохнуть в центрифуге microarray в течение нескольких секунд.
ПРИМЕЧАНИЕ: Второй этап дезащиты завершен. - Если РНК microarray также содержит нуклеотиды ДНК, приступить к третьему шагу дезащиты. В 50 мл центрифуги трубки, смесь 20 мл EDA с 20 мл EtOH. Добавьте микроаррей ДНК/РНК в раствор 1:1 EDA/EtOH и оставьте при комнатной температуре на 5 мин.
- После 5 минут, удалить слайд, мыть с 2 й 20 мл стерильной воды, то высохнуть в центрифуге microarray и хранить в desiccator.
7. Гибридизация с люминесцентно-маркированной дополнительной нитью
- Оттепель ацетилированного бычьего сыворотки альбумина (10 мг/мл) и комплементарной нити Cy3 (100 нм) и прогреваются до комнатной температуры.
- В стерильной микроцентрифуговой трубке мощностью 1,5 мл смесь 150 л 2x буфера MES (200 мМ 2-(N-морфолино)этансульфоновая кислота; 1,8 М. NaCl; 40 мМ EDTA; 0,02% Tween-20) с 26,7 лДнк с маркировкой Cy3, 13,4 л ацетилированной BSA и 110 L Вихрь. Удвойте громкость, если оба слайда будут использоваться для гибридизации.
- Предварительно разогреть печь гибридизации до температуры ниже Tм дуплекса, но достаточно высок, чтобы обеспечить хорошую дискриминацию между полноценными и несовпадениепоследовательности. Для контроля качества 25mer, установите температурудо 42 градусов по Цельсию (Tм 59 градусов по Цельсию).
- Тщательно поместите самоклеятную камеру гибридизации 300 л над областью синтеза на каждом слайде и пайпете в подготовленном выше растворе гибридизации. Обложка отверстия камеры с клеевыми точками и обернуть весь слайд в алюминиевой фольге.
- Поместите microarray слайд в духовку гибридизации, крышка и дайте ему аккуратно вращаться при выбранной температуре гибридизации для 2 ч.
- Через 2 ч отсоедините горку, снимите алюминиевую фольгу и осторожно снимите камеру гибридизации. Передача слайдов в центрифуги трубки, содержащие 30 мл нестрогих мытья буфера (NSWB; 0,9 М NaCl, 0,06 М фосфат, 6 мМ EDTA, 0,01% Tween20, рН 7,4) и встряхнуть энергично в течение 2 мин при комнатной температуре.
- Перенесите слайд в центрифужную трубку, содержащую 30 мл stringent Wash Buffer (SWB; 100 mM MES, 0.1 M NaCl, 0.01% Tween20) и энергично встряхните в течение 1 мин.
- Наконец, перенесите слайд в центрифужную трубку, содержащую 30 мл буфера Final Wash (FWB; 0.1x солевым цитратом натрия) и встряхните в течение нескольких секунд. Высушите горку в центрифуге microarray.
- Поместите сухой microarray, область синтеза вниз, в слайд-держатель сканера microarray. Для дуплексов с маркировкой Cy3 сканировать разрешение 5 мкм с длиной волны возбуждения 532 нм, фильтром 575 нм и фотомультипликатором 350. Сохранить скан с высоким разрешением в виде файла изображения .tif(рисунок 5A).
8. Извлечение и анализ данных
- Перед извлечением данных поверните сохраненное сканирование массива в редактор изображений, чтобы расставить самую длинную цепочку фидуциальных особенностей в верхнем левом углу сканирования. Сохраните вращающееся изображение.
- Начало NimbleScan, а затем нажмите Файл Откройте и загрузите сканирование массива. Затем, нажав Просмотр в подразделе файла проектирования, загрузите . ndf дизайн файл, который был автоматически создан во время разработки эксперимента microarray. Затем нажмите Открыть.
- В представлении, нажмите Авто Контраст/Яркость. Нажмите на значок Вручную выровнять выше сканирования. Поместите четыре квадратных маркера в четырех углах сканирования, а затем нажмите теперь зеленый значок снова. Извлеките данные гибридизации, нажав на анализ, Отчеты затем зонд доклад.
- Откройте . файл отчета зонда в редакторе электронной таблицы. Держите столбцы B и I и отбросить остальные, прежде чем приступить к расчету средних значений и стандартного отклонения от извлеченных данных (Рисунок 5B).
9. Библиотека дезащиты, расщепления и восстановления
- Чтобы дезащитить и расщеплять библиотеки ДНК, подготовьте раствор 1:1 сухого ЭДА/толуола в 50 мл центрифуги. Погрузите слайд в раствор расщепления, закройте горку и заверните пластиковой пленкой для уплотнения, затем аккуратно поверните в орбитальный шейкер на 2 ч при комнатной температуре.
- После 2 ч, удалить слайд и мыть с 2 х 20 мл скрупулезно сухой ACN. Удалите слайд и дайте ему высохнуть.
- С помощью пипетки нанесите 100 л стерильных H2O над теперь заметной областью синтеза. Пелет раствор вверх и вниз несколько раз, прежде чем передать его в 1,5 мл микроцентрифугтрубки. Повторите процесс и объединить microarray eluate в той же трубке(Рисунок 6).
- Испаряйте 2 й 100 л чипа ускользает от сухости, затем рерастворится в 10 злител без нуклеазы H2O. Измерьте абсорбцию на спектрофотометре УФ-Вис.
- Осальт библиотека ДНК на 10 л пипетки наконечник оснащен C18 мизины. Во-первых, преобразуйте чип eluate в 0,1 М триэтиламмония ацетата (TEAA) буферизированный раствор.
- Влажный сисьы, стремясь 3 х 10 Л H2O / ACN 1:1, и уравновесить посуды путем мытья с 3 х 10 Л 0,1 М TEAA буфера. Связать ДНК путем pipetting чип eluate 10 раз вверх и вниз через сиську. Вымойте с помощью 3 х 10 л из 0,1 М TEAA буфера, 3 х 10 Л H2O.
- Выясните опресненные ДНК из кончика, промыв аяму с 10 Зл H2O/ACN 1:1. Высушите опресненный раствор вниз и растворите в 10 Л стерильных H2O. Измерьте поглощение на спектрофотометре УФ-Вис (рисунок7). Испарите библиотеку до сухости и храните при -20 градусов до дальнейшего использования.
Результаты
Гибридизация ДНК и РНК микроаррей
На рисунке 5 показаны результаты анализа гибридизации, проведенного на микроаррейце, содержащем ДНК и РНК-версии 25-мерной последовательности (5'-GTCATCATGAACCACCCTTC-3' в форме ДНК). Сканирование на рисунке 5А отображается в зеленомасштабном формате, соответствующем спектру возбуждения/выбросов флуоресценции Cy3, при этом интенсивность флуоресценции регистрируется в произвольных единицах между 0 и 65536. Конструкция массива следовала макету функции 25:36, описанному в разделе протокола. Сканирование показано после правильной ориентации массива, при этом верхний левый угол заполняется самой длинной цепью фидуциальных особенностей. Здесь фидуциальные особенности содержат версию ДНК 25mer и должны, в принципе, всегда давать положительный сигнал флуоресценции для того, чтобы выполнить выравнивание сканирования и извлечение данных. Гибридизированный microarray должен появиться равномерно ярким, с краями зоны синтеза однако обычно ярче чем центр (up to 50% ярче). Большое количество репликаций последовательности, случайным образом распределенных по всей области, уменьшает воздействие пространственных артефактов. Здесь каждая последовательность (ДНК и РНК) была синтезирована в 2000 случайных местах. Существует, как правило, низкий шум флуоресценции (фон), злт;50 a.u., что приводит к сигнала / шума соотношение в порядке 200:1 до 800:1 в гибридизации анализов. После извлечения данных интенсивность флуоресценции усредняется и начертана .
Существует значительная изменчивость в абсолютных значениях флуоресценции между экспериментами. Здесь мы показываем результаты для трех независимых синтезов с использованием тех же параметров изготовления и той же пост-синтетической обработки. 25mer ДНК, когда гибридизированы с его дополнительной Cy3 помечены нити ДНК, даст флуоресценции сигналов в диапазоне от 20000 до 30000, очень редко выше или ниже. 25mer РНК, когда гибридизированы в том же Cy3-маркированных ДНК дополнение, даст флуоресценции интенсивности на соответствующие функции, начиная от 15000 до 20000. Тем не менее, интенсивность флуоресценции ДУплексов РНК/ДНК иногда опускается ниже 8000, когда соответствующие дуплексы ДНК/ДНК будут по-прежнему флуоресценции в пределах диапазона 20 000-30 000. В таких случаях результаты РНК могут считаться неоптимальными. Сбой синтеза или гибридизации, как для ДНК, так и для РНК, будет сразу же заметен во время сканирования от очевидного отсутствия флуоресценции. Есть несколько возможностей для синтеза РНК либо неудачу или частично успеха, и они будут изложены в дискуссионной части.
Библиотека дезащиты, расщепления и восстановления
В зависимости от сложности и плотности библиотеки, форма и контур синтезированного массива можно увидеть без увеличения, но при правильном освещении(рисунок 4), с ДНК все еще в защищенной форме. После дезащиты с EDA /toluene, и до добавления воды для того, чтобы собрать расщепленную библиотеку, область синтеза, содержащая теперь беззащитные олигонуклеотиды могут выделяться как гидрофильные зоны, когда остальная часть стеклянной горки появится покрытымут мутным гидрофобным слоем. Непосредственное наблюдение за областью синтеза зависит от общей площади, используемой для синтеза олигонуклеотидов: более широкое использование области синтеза будет соответствовать большей вероятности четкого различия между гидрофильных и гидрофобных регионов на поверхности. И наоборот, библиотеки синтезировались с использованием меньшего количества зеркал и с меньшими функциями не могут быть немедленно наблюдаемы.
Аналогичным образом, количество восстановленной ДНК после опреснения прямо пропорционально общей площади, используемой для синтеза. Если все функции используются для синтеза олигонуклеотида, расщепление и восстановление процедура должна дать между 25 и 30 pmol ДНК. 10% использования области синтеза, следовательно, позволит только около 3 моль ДНК.
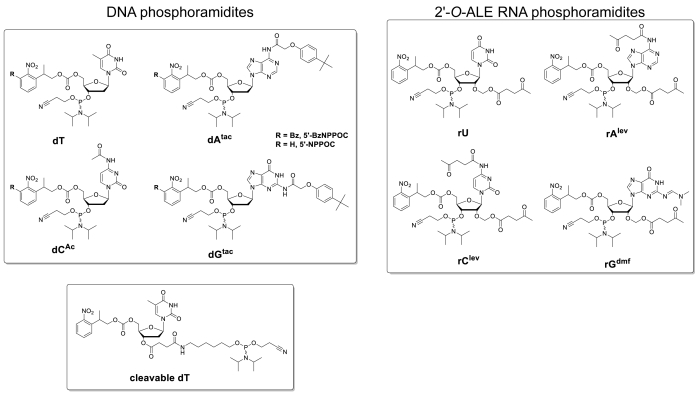
Рисунок 1 . Химические структуры ДНК и РНК фосфорамидитов, используемые в синтезе олигонуклеотидов с помощью фотолитографии микроарлей. Стандартный синтез нитрофенилпропилоксикарбонилов (NPPOC) фоточувствительных групп защиты на 5'-OH используются в регулярных СИНТЕЗ ДНК и РНК микроаррей для целей гибридизации. Для синтеза сложных библиотек ДНК, более фотолабиль бензил-NPPOC (BzNPPOC) являются предпочтительными на 5'-OH, как BzNPPOC удаляется в два раза быстрее, чем NPPOC, что значительно снижает общее время синтеза микроаррей. ДНК олигонуклеотиды для библиотек также требуют соединения cleavable dT мономер в конце 3'. Этот мономер, который носит функцию succinyl ester, будет расщепляться во время дезащиты, что позволит собрать ДНК из микрочипа. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2 . Пример маски в качестве файла изображения, отправленного на устройство микрозеркала во время воздействия УФ-излучения. Белые пиксели соответствуют зеркалам, которыебудут наклонены в положении «ON», отражая ультрафиолетовый свет на ячейку синтеза. Черные пикселисоответствуют зеркалам OFF, где ультрафиолетовый свет будет отражаться от ячейки. Таким образом, белые пиксели позволят соединить следующий входящий фосфорамигит на олигонуклеотидах, найденных на соответствующих характеристиках на стеклянных субстратах. Олигонуклеотиды синтезированы на функциях, соответствующие зеркала которых, в этом файле маски, черные пиксели, однако, останутся инертными во время следующего события соединения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3 . Фотографии микроаррей фотолитографии оптической и синтезустановки. (A) Оптическая схема для воздействия УФ-излучения. УФ-излучение от УФ-LED сначала гомогенизировано через прямоугольную поперечную световую трубу, а затем отражается на микрозеркалах. Микрозеркала, которые были наклонены в положение "OFF", будут отражать ультрафиолетовый свет вдали от синтеза клетки, но микрозеркала в положении "ON" будут отражать свет на ячейку синтеза, расположенную в фокусной плоскости, сначала проходя через 1:1 Offner Relay системы визуализации. (B) Ячейка синтеза, после сборки, состоит из просверленной слайд, помещенной сначала на кварцевый блок клетки, разделенный толстой прокладкой PTFE (не показано). Вторая, непросверленная горка затем расположена над просверленной горкой, разделенной тонкой прокладкой PTFE. Металлический каркас (не показан) удерживает сборку вместе. (C). Для подготовки библиотеки, как только ячейка синтеза прилагается в фокусной плоскости входящего ультрафиолетового света, камера, расположенная между кварцевым блоком и просверленной слайд заполнена 1% раствором к-каротина в CH2Cl2. Для этого к кварцевому блоку крепится дополнительная впускная и выходная трубка, а оранжевый раствор течет из самого правого в левое положение. Поток реагентов и растворителей для синтеза показан белыми стрелками. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4 . Область синтеза обычно видна невооруженным глазом. Здесь, библиотека ДНК можно увидеть на поверхности стекла сразу после синтеза, с ДНК все еще в защищенной форме. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Рисунок 5 . Гибридизация анализирует 25mer ДНК и РНК последовательности синтезируются на месте на microarrays. (A) Флуоресценция сканирования всей гибридизированной ДНК и РНК microarray. 25mer ДНК и РНК олигонуклеотиды гибридизированы с их Cy3-маркированных дополнительных нитей. Массив был отсканирован с помощью лазера на длине волны возбуждения 532 нм при разрешении 5 мкм. (B) Интенсивность флуоресценции (произвольные единицы) ДНК: ДНК и РНК: ДНК дуплексы в трех отдельных экспериментов. Светло-зеленые данные для синтезированных РНК-олигонуклеотидов РНК можно считать неоптимальными по сравнению с интенсивностью флуоресценции соответствующих последовательностей ДНК. Ошибки бары SD. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
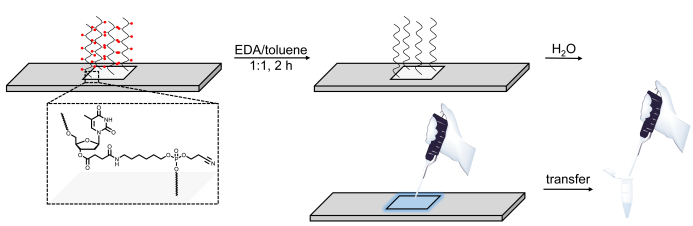
Рисунок 6 . Схематическое представление процедуры дезащиты, расщепления и восстановления библиотек ДНК, синтезированных на микроарах. Последовательности ДНК выращиваются на базовом чувствительном осклеиваемом нуклеозиде dT (показано в увеличенной области). После синтеза, дезащита ДНК олигонуклеотидов (группы защиты базы представлены как красные сферы) в EDA/toluene оставляет дезащищенный материал электростатически связаны с поверхностью и затем могут быть пипеты, применяя небольшое количество воды на синтезированной области. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
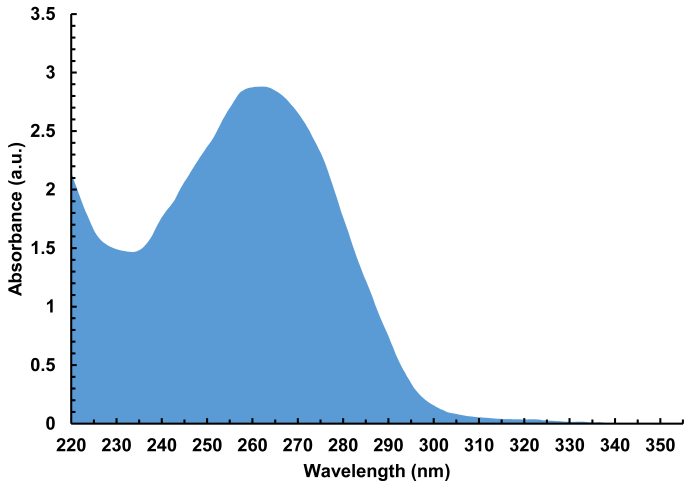
Рисунок 7 . Представительабиваивательный спектр (220 - 350 нм) расщепляющейся, опресненной библиотеки ДНК, содержащей 4000 различных последовательностей, 100-nt в длину. В общей сложности 940 нг ДНК была выделена из одного синтеза массива, что соответствует 30 рмоль общей ДНК, или 15 pmol на стеклянный субстрат. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
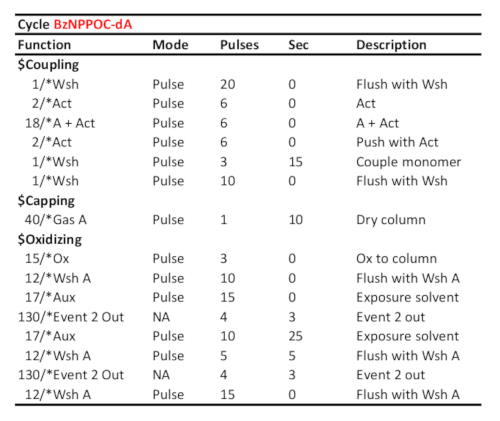
Таблица 1. Представительный протокол цикла для соединения/окисления/фотозащиты 5'-BzNPPOC-dA, предполагая, что соответствующий фосфорамидит был загружен в порт "А". Время соединения (в секундах) отображается на линии "пара мономер". Время УФ-фотозащиты, соответствующее сияющей энергии 3 J/cm2 (фотохимия BzNPPOC), рассчитывается как время, прошедшее между двумя сигналами связи "Event 2 Out".
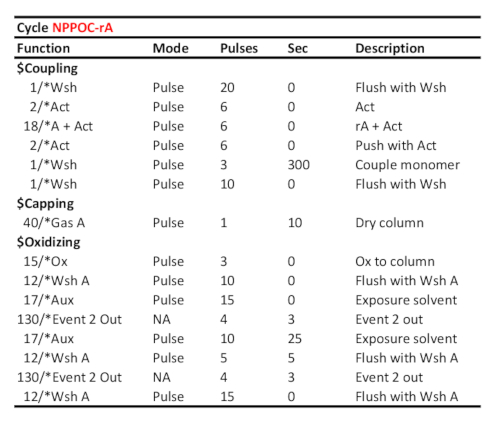
Таблица 2. Представительный протокол цикла для соединения/окисления/фотозащиты 5'-NPPOC-rA, предполагая, что соответствующий ФОсфорамитит РНК был загружен в порт "А". Время соединения (в секундах) отображается на линии "пара мономер". Время УФ-фотозащиты, соответствующее сияющей энергии 6 J/cm2 (фотохимия NPPOC), рассчитывается как время, прошедшее между двумя сигналами связи "Event 2 Out".
Обсуждение
Синтез твердой фазы ДНК и РНК является хлебом и маслом каждой лаборатории химии нуклеиновой кислоты, и, хотя добавление компонента фотолитографии, по общему признанию, является сложной операцией, изготовление микроаррей, опосредованного ультрафиолетовым светом, также является очень надежным процессом . Кроме того, это единственный доступный метод синтеза РНК на микроаррей. Тем не менее, как и в любой многоступенчатой экспериментальной процедуры, есть достаточно места для человеческой ошибки.
Возможно, самым важным шагом является соединение фосфорамидита, так как это должна быть постоянно высокоурожайная химическая реакция, чтобы позволить себе олигонуклеотиды с несколькими синтетическими ошибками. В нашем протоколе синтеза микроаррей, соединение фосфорамидита является еще более важным для общего качества синтеза, так как процесс изготовления обходит укупорки и предотвращает очистку олигонуклеотидов. Пошаговая эффективность соединения выше 99% были рассчитаны для всех фоточувствительных ДНК и РНК фосфорамититов, даже для очень коротких сроков соединения (15 с)24, но более низкие выходы соединения иногда может произойти, особенно в случае dG амидитов. Стабильность растворимых фосфорамидных фосфорамититов при комнатной температуре была исследована ранее и было показано, зависит от природы нуклеобазы, с гуанозина фосфорамидитов склонны к обширной деградации только в течение нескольких дней29, 30. Но при хранении при -25 градусов по Цельсию, гГ фосфорамиды растворяются в ACN как раствор 30 мМ были признаны стабильными в течение нескольких недель. Относительная нестабильность растворов фосфорамидита гГ при комнатной температуре означает, что они не должны быть прикреплены к синтезатору ДНК в течение нескольких дней.
Для РНК фосфорамидитов выход соединения очень зависит от качества фосфорамидита (которое может быть оценено 31P Спектроскопией ЯМР) и времени соединения. Время соединения 5 минут для rA, rG, rC и 2 мин для rU появляются необходимые. Действительно, мы обнаружили, что сокращение времени конденсации до 2 мин для всех ФОсфорамититОВ РНК привело к значительно более низким сигналам гибридизации.
Сам синтезатор ДНК, а также реагенты и растворители, безусловно, должны быть максимально чистыми, чтобы достичь наивысшего выхода синтеза олигонуклеотидов. Однако нерастворимый материал, соли или частицы могут со временем накапливаться в линиях и трубах системы доставки, что приводит к постепенному снижению потребления реагентов и реагентов. В тех случаях, когда общая очистка синтезатора не решает проблему низкого объема производства, альтернативное решение может быть увеличением количества импульсов. Особенно полезно в случае низкого потребления фосфорамидита, линия в протоколе соединения, соответствующая накачке смеси фосфорамидита и активатора (третья линия сцепления в таблице 1 и таблице2) может быть модифицированные, от 6 до 9 импульсов без заметного негативного влияния на качество синтеза. Кроме того, количество импульсов активатора, необходимого для приведения смеси амидитов/активатора в синтез субстрата (в настоящее время 6, четвертая строка в подразделе соединения, см. Таблица 1 и Таблица2) зависит от самого синтезатора ДНК, а также от длина труб в клетке синтеза. Это число может быть скорректировано после замены фосфорамидита с цветным раствором и подсчета количества импульсов, необходимых для нажатия цветной смеси на стеклянный субстрат для соединения.
Описанный в этом методе позволяет синтезу ДНК и РНК действовать одновременно, на одном и том же микроаррее. Гибриды ДНК и РНК также могут быть подготовлены без каких-либо изменений в протоколах изготовления массива, и до тех пор, пока соблюдается трехступенчатый протокол дезащиты. Тем не менее, следует отметить, что РНК-только microarrays требует только двухступенчатой дезащиты: decyanoethylation сначала с Et3N следуют гидроксила и базы дезащиты с гидразином. Нуклеобазы ДНК были признаны неполно дебошенными в этих условиях, и нуждаются в дополнительном шаге в EDA для того, чтобы осуществить полное удаление групп феноксиацетила (Pac). Это дополнительное лечение с EDA короче (5 мин), чем для стандартной дезащиты ДНК microarrays31, но достаточно, чтобы вести его к завершению после лечения триэтиламин и гидразин. Кроме того, короткое время реакции с EDA ограничивает воздействие полностью дезащищенных РНК олигонуклеотида к основным условиям.
Преимущество милитинического синтеза РНК-массива in situ по сравнению с альтернативными методами, такими как выявление пятен или транскрипция ДНК32,33,34, является возможность хранить синтезированный микрочип РНК в защищенной форме до использования, тем самым избегая риск потенциальной деградации РНК. Постсинтетические процедуры ДЛЯ РНК, с другой стороны, означает, что расходные материалы и реагенты хранятся стерильными и что обработка осуществляется в условиях, свободных от РНЗа. Примечательно, что добавление ингибитора RNase в смесь гибридизации не давало более сильных сигналов гибридизации для особенностей РНК.
Синтез библиотек ДНК на базовом мономере более сложен, чем синтез нескольких контрольных последовательностей на поверхности, и как таковой, безусловно, более подвержен ошибкам проектирования. Тем не менее, если предположить, что дизайн последовательности (т.е. характер и количество последовательностей) является правильным, преобразование этого списка в коллекцию маски экспозиции и упорядоченной серии циклов соединения остается простым процессом. Однако существуют важные вариации от стандартного синтеза микроэлементов, которые имеют решающее значение для успешного изготовления массива библиотек высокой плотности.
Во-первых, базовый чувствительный мономер dT в сочетании с первым фосфорамидитом после синтеза связующим. Соединение выход этого мономера(Рисунок 1) было установлено, что относительно низким, около 85%28, поэтому усилия предпринимаются для улучшения его регистрации, либо за счет увеличения его концентрации в ACN от 30 мМ до 50 мм, или путем повторения соединение шаг: два последовательных реакции соединения с использованием свежих мономеров, или два отдельных, но последовательных циклов соединения.
Второе изменение – это добавление раствора к-каротина в задней камере синтеза, который удобно поглощает 365 нм света. Это важная модификация настройки фотолитографии, поскольку она предотвращает отражание ультрафиолетового света обратно на подстрат массива. Действительно, после прохождения интерстициальной среды между субстратами, входящие УЛЬТРАВ-свет выходит через просверленную горку и достигает кварцевого блока ячейки. Уравнения Френеля предсказывают, что 4% уф-излучения, перпендикулярно инцидента, будет отражаться от каждого из трех интерфейсов воздухостекла вниз по течению (выходная сторона2-го субстрата и обе стороны кварцевого блока) и обратно на субстрат синтеза, приводит к непреднамеренному облучению фотозащищенных олигонуклеотидов. Дифракция и рассеяние также способствуют "вне цели" фотодезащиты и, следовательно, нуклеотидва вставки, которая непосредственно влияет на уровень ошибок синтеза, но эти вклады гораздо меньше, чем отражения и могут быть в основном рассмотрены снижение плотности синтеза (оставляя зазоры между объектами). Мы обнаружили, что уровень раствора к-каротина в нижней камере клетки имеет тенденцию к незначительному снижению только в первые минуты синтеза массива, и поэтому его необходимо контролировать и корректировать.
Наконец, третье изменение является решением дезащиты, заменяя EtOH на толуол, который держит расщепленную библиотеку ДНК привязанной к поверхности, предположительно через электростатические взаимодействия. Применение небольшого количества воды в области синтеза после мытья ACN позволяет удобно собирать библиотеку. Процесс, однако, только успешным, если содержание воды в EDA и толуол является минимальным, что делает нуклеиновой кислоты полностью нерастворимым в дезащитном коктейле. Кроме того, библиотеки ДНК могут быть расщеплены чип с помощью аммиака9,10,14,35, а затем дальнейшее дезащищены путем нагрева ДНК-содержащих вакарастворительный раствор аммиака до 55 градусов по Цельсию в одночасье. Восстановление библиотек ДНК с использованием аммиака, однако, не совместимо с РНК. Олигонуклеотиды РНК на базовом склеобляемом субстрате можно утилизировать с поверхности с помощью той же описанной выше процедуры EDA/толуена, но только на предпоследнем этапе после стратегии et3N и гидразина двухступенчатой дезащиты28.
Альтернативные стратегии по извлечению олигонуклеотидных бассейнов из микроаррей без необходимости проведения специального базового лечения существуют, в принципе совместимы с фотолитографией и опираются на использование ферментов. Например, один нуклеотид дезоксиурацила может быть мишенью урацил-ДНК гликозилазы (UDG) и вырезаны из остальной последовательности ДНК, или один блок РНК может быть признан RNase H типа 2 ферментов и фосфодидер облигаций 5' к РНК расщепления , выпуская 5' ДНК часть23.
Теперь у нас есть мощный, надежный и высокой плотности метод для синтеза ДНК, РНК, и гибридных ДНК / РНК microarrays. Они могут не только служить платформами для гибридизации или связывания анализы36, но они также представляют собой быстрый и недорогой способ производства сложных библиотек нуклеиновой кислоты. Для хранения цифровых данных на основе ДНК фотолитография микроаррей может стать потенциальным решением для «письменного» узкого места (т.е. для кодирования информации путем синтеза). Успех цифрового кодирования ДНК и сборки генов de novo зависит от точности последовательности, которая на уровне синтеза приводит к частоте ошибок. Синтетические и оптические ошибки в наших текущих протоколах изготовления массива будут обсуждаться и сообщаться в другом месте. Параллельно с этим предпринимаются усилия по дальнейшему увеличению масштабов и пропускной возможности производства.
Раскрытие информации
Авторы удостоверяют, что они не имеют никакого отношения к какой-либо некоммерческой организации.
Благодарности
Эта работа была поддержана Австрийским научным фондом (FWF гранты P23797, P27275 и P30596) и Швейцарский национальный научный фонд (Грант #PBBEP2_146174).
Материалы
| Name | Company | Catalog Number | Comments |
| Slide functionalization | |||
| Acetic acid >99.8% | Sigma | 33209 | For RNA deprotection |
| CNC router | Stepcraft | 300 CK | |
| Ethanol absolute | VWR | 1.07017.2511 | For deprotection and functionalization |
| N-(3-triethoxysilylpropyl)-4-hydroxybutyramide | Gelest | SIT8189.5 | Silanizing reagent |
| Nexterion Glass D microscope slides | Schott | 1095568 | |
| Polymax 1040 | Heidolph | Orbital shaker | |
| Proclean 507 Ultrasonic water bath | Ulsonix | To clean slides after drilling | |
| Tickopur RW 77 Special Purpose Cleaner | Sigma | Z860086 | To clean slides after drilling |
| Microarray synthesis | |||
| 0.25 M dicyanoimidazole in ACN | Biosolve | 0004712402BS | Activator |
| 0.7 XGA DMD | Texas Instruments | Digital Micromirror Device | |
| 20 mM I2 in pyridine/H2O/THF | Sigma | L860020-06 | Oxidizer |
| 250 μm thick Chemraz 584 perfluoroelastomer | FFKM | Lower teflon gasket | |
| 2'-O-ALE RNA phosphoramidites | ChemGenes | ||
| 365 nm high-power UV-LED | Nichia | NVSU333A | |
| 5'BzNPPOC DNA phosphoramidites | Orgentis | ||
| 5'NPPOC DNA phosphoramidites | FlexGen | ||
| Acetonitrile | Biosolve | 0001205402BS | For DNA synthesis |
| Amidite Diluent for DNA synthesis | Sigma | L010010 | For dissolving phosphoramidites |
| Cleavable dT | ChemGenes | Base-sensitive monomer for library preparation | |
| DMSO | Biosolve | 0004474701BS | As exposure solvent |
| DNA and RNA microarray deprotection | |||
| Ethylenediamine >99.5% | Sigma | 3550 | For deprotection |
| Expedite 8909 | PerSeptive Biosystems | DNA synthesizer | |
| Hydrazine hydrate 50-60% hydrazine | Sigma | 225819 | For RNA deprotection |
| Imidazole | Sigma | 56750 | |
| Industrial Strength lower-density PTFE tape | Gasoila | Thin, upper teflon gasket | |
| Pyridine >99% | Sigma | P57506 | For RNA deprotection |
| Triethylamine >99% | Sigma | T0886 | For RNA deprotection |
| β-carotene | Sigma | C9750 | For library preparation |
| Hybridization and scanning | |||
| 20x Sodium Saline Citrate | Roth | 1054.1 | |
| 5'Cy3-labelled complementary strand | Eurogentec | For duplex hybridization | |
| Biopur Safe-Lock microcentrifuge tube | Eppendorf | ||
| BSA (10 mg/mL) | Promega | R3961 | |
| EDTA molecular biology grade | Promega | H5031 | |
| GenePix 4100A | Molecular Devices | Microarray scanner | |
| Hybridization oven | Boekel Scientific | 230500 | |
| MES monohydrate | Sigma | 69889 | |
| MES sodium | Sigma | M3058 | |
| NaCl >99.5% | Sigma | 71376 | |
| SecureSeal SA200 hybridization chamber | Grace BioLabs | 623503 | |
| Spectrafuge mini | Labnet | C1301 | Microarray centrifuge |
| Tween-20 molecular biology grade | Sigma | P9416 | |
| Data extraction | |||
| Excel | Microsoft | For data extraction | |
| MatLab | MathWorks | Microarray design | |
| NimbleScan 2.1 | Roche NimbleGen | ||
| Desalting and quantification | |||
| NanoDrop One Spectrophotometer | Thermo Scientific | ||
| Toluene | Merck | ||
| ZipTip C18 | Millipore | ZTC18s008 | Desalting pipet tips |
Ссылки
- Bumgarner, R. Current protocols in molecular biology. 101, 22(2013).
- Berger, M. F., Bulyk, M. L. Universal protein-binding microarrays for the comprehensive characterization of the DNA-binding specificities of transcription factors. Nature Protocols. 4 (3), 393-411 (2009).
- Tietjen, J. R., Donato, L. J., Bhimisaria, D., Ansari, A. Z. Sequence-specificity and energy landscapes of DNA-binding molecules. Methods in enzymology. 497, 3-30 (2011).
- Katilius, E., Flores, C., Woodbury, N. W. Exploring the sequence space of a DNA aptamer using microarrays. Nucleic Acids Research. 35 (22), 7626-7635 (2007).
- Franssen-van Hal, N. L. W., et al. Optimized Light-Directed Synthesis of Aptamer Microarrays. Analytical Chemistry. 85 (12), 5950-5957 (2013).
- Matteucci, M. D., Caruthers, M. H. Nucleotide Chemistry .4. Synthesis of Deoxyoligonucleotides on a Polymer Support. Journal of the American Chemical Society. 103 (11), 3185-3191 (1981).
- Eroshenko, N., Kosuri, S., Marblestone, A. H., Conway, N., Church, G. M. Gene Assembly from Chip-Synthesized Oligonucleotides. Current Protocols in Chemical Biology. 2012, (2012).
- Kosuri, S., et al. Scalable gene synthesis by selective amplification of DNA pools from high-fidelity microchips. Nature Biotechnology. 28 (12), 1295(2010).
- Richmond, K. E., et al. Amplification and assembly of chip-eluted DNA (AACED): a method for high-throughput gene synthesis. Nucleic Acids Research. 32 (17), 5011-5018 (2004).
- Schmidt, T. L., et al. Scalable amplification of strand subsets from chip-synthesized oligonucleotide libraries. Nature Communications. 6, (2015).
- Grass, R. N., Heckel, R., Puddu, M., Paunescu, D., Stark, W. J. Robust Chemical Preservation of Digital Information on DNA in Silica with Error-Correcting Codes. Angewandte Chemie International Edition. 54 (8), 2552-2555 (2015).
- Erlich, Y., Zielinski, D. DNA Fountain enables a robust and efficient storage architecture. Science. 355 (6328), 950-953 (2017).
- Garalde, D. R., et al. Highly parallel direct RNA sequencing on an array of nanopores. Nature Methods. 15 (3), 201-206 (2018).
- Cleary, M. A., et al. Production of complex nucleic acid libraries using highly parallel in situ oligonucleotide synthesis. Nature Methods. 1 (3), 241-248 (2004).
- LeProust, E. M., et al. Synthesis of high-quality libraries of long (150mer) oligonucleotides by a novel depurination controlled process. Nucleic Acids Research. 38 (8), 2522-2540 (2010).
- Lietard, J., Damha, M. J., Somoza, M. M. Enzymatic and Chemical Synthesis of Nucleic Acid Derivatives. Fernández-Lucas, J. , Wiley Online Books. (2018).
- Fodor, S. P. A., et al. Spatially Addressable Parallel Chemical Synthesis. Science. 251 (4995), 767-773 (1991).
- Singh-Gasson, S., et al. Maskless fabrication of light-directed oligonucleotide microarrays using a digital micromirror array. Nature Biotechnology. 17 (10), 974-978 (1999).
- Pease, A. C., et al. Light-Generated Oligonucleotide Arrays for Rapid DNA-Sequence Analysis. Proceedings of the National Academy of Sciences of the United States of America. 91 (11), 5022-5026 (1994).
- Holz, K., Lietard, J., Somoza, M. M. High-Power 365 nm UV LED Mercury Arc Lamp Replacement for Photochemistry and Chemical Photolithography. ACS Sustainable Chemistry & Engineering. 5 (1), 828-834 (2017).
- Lackey, J. G., Mitra, D., Somoza, M. M., Cerrina, F., Damha, M. J. Acetal Levulinyl Ester (ALE) Groups for 2′-Hydroxyl Protection of Ribonucleosides in the Synthesis of Oligoribonucleotides on Glass and Microarrays. Journal of the American Chemical Society. 131 (24), 8496-8502 (2009).
- Lackey, J. G., Somoza, M. M., Mitra, D., Cerrina, F., Damha, M. J. In-situ chemical synthesis of rU-DNA chimeras on chips and enzymatic recognition. Chimica Oggi-Chemistry Today. 27 (6), 30-33 (2009).
- Lietard, J., Ameur, D., Damha, M., Somoza, M. M. High-density RNA microarrays synthesized in situ by photolithography. Angewandte Chemie International Edition. 57 (46), 15257-15261 (2018).
- Agbavwe, C., et al. Efficiency, Error and Yield in Light-Directed Maskless Synthesis of DNA Microarrays. Journal of Nanobiotechnology. 9, (2011).
- Sack, M., et al. Express photolithographic DNA microarray synthesis with optimized chemistry and high-efficiency photolabile groups. Journal of Nanobiotechnology. 14, (2016).
- Kretschy, N., Holik, A. K., Somoza, V., Stengele, K. P., Somoza, M. M. Next-Generation o-Nitrobenzyl Photolabile Groups for Light-Directed Chemistry and Microarray Synthesis. Angewandte Chemie International Edition. 54 (29), 8555-8559 (2015).
- Sack, M., Kretschy, N., Rohm, B., Somoza, V., Somoza, M. M. Simultaneous Light-Directed Synthesis of Mirror-Image Microarrays in a Photochemical Reaction Cell with Flare Suppression. Analytical Chemistry. 85 (18), 8513-8517 (2013).
- Lietard, J., et al. Base-cleavable microarrays for the characterization of DNA and RNA oligonucleotides synthesized in situ by photolithography. Chemical Communications. 50 (85), 12903-12906 (2014).
- Krotz, A. H., et al. Solution stability and degradation pathway of deoxyribonucleoside phosphoramidites in acetonitrile. Nucleosides Nucleotides & Nucleic Acids. 23 (5), 767-775 (2004).
- Hargreaves, J. S., Kaiser, R., Wolber, P. K. The Degradation of Dg Phosphoramidites in Solution. Nucleosides Nucleotides & Nucleic Acids. 34 (10), 691-707 (2015).
- McGall, G. H., et al. The efficiency of light-directed synthesis of DNA arrays on glass substrates. Journal of the American Chemical Society. 119 (22), 5081-5090 (1997).
- Collett, J. R., et al. Functional RNA microarrays for high-throughput screening of antiprotein aptamers. Analytical Biochemistry. 338 (1), 113-123 (2005).
- Buenrostro, J. D., et al. Quantitative analysis of RNA-protein interactions on a massively parallel array reveals biophysical and evolutionary landscapes. Nature Biotechnology. 32 (6), 562-568 (2014).
- Wu, C. -H., Holden, M. T., Smith, L. M. Enzymatic Fabrication of High-Density RNA Arrays. Angewandte Chemie International Edition. 53 (49), 13514-13517 (2014).
- Tian, J., et al. Accurate multiplex gene synthesis from programmable DNA microchips. Nature. 432 (7020), 1050-1054 (2004).
- Lietard, J., et al. Mapping the affinity landscape of Thrombin-binding aptamers on 2'F-ANA/DNA chimeric G-Quadruplex microarrays. Nucleic Acids Research. 45 (4), 1619-1632 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены