Method Article
פרוסות היפוקמפוס אופקיות של מוח העכבר
* These authors contributed equally
In This Article
Summary
מאמר זה נועד לתאר פרוטוקול שיטתי כדי להשיג פרוסות מוח היפוקמפוס אופקי בעכברים. מטרת מתודולוגיה זו היא לשמר את השלמות של מסלולי סיבים בהיפוקמפוס, כגון הנתיב המחורר ודרכי הסיבים הטחובים להערכת תהליכים נוירולוגיים הקשורים לgyrus.
Abstract
ההיפוקמפוס הוא מבנה מאורגן מאוד במוח שהוא חלק מהמערכת הלימבית ומעורב ביצירת זיכרון ואיחוד, כמו גם ביטוי של הפרעות מוחיות חמורות, כולל מחלת אלצהיימר ואפילפסיה. ההיפוקמפוס מקבל רמה גבוהה של קישוריות פנימית ואינטר, המאבטחת תקשורת נכונה עם מבני מוח פנימיים וחיצוניים. קישוריות זו מושגת באמצעות זרימות אינפורמציות שונות בצורה של מסלולי סיבים. פרוסות מוח הן מתודולוגיה נפוצה בעת חקירת תפקודים נוירופיזיולוגיים של ההיפוקמפוס. ניתן להשתמש בפרוסות מוח בהיפוקמפוס עבור מספר יישומים שונים, כולל הקלטות אלקטרופיזיולוגיות, מדידות מיקרוסקופיות קלות וכן מספר טכניקות ביולוגיות והיסטוכימיות מולקולריות. לכן, פרוסות מוח מייצגות מערכת מודל אידיאלית להערכת תפקודי חלבון, לחקור תהליכים פתופיזיולוגיים המעורבים בהפרעות נוירולוגיות כמו גם למטרות גילוי תרופות.
קיימות מספר דרכים שונות של הכנות פרוסה. ההכנות פרוסת המוח עם ויברטום לאפשר שימור טוב יותר של מבנה הרקמה ולהבטיח אספקת חמצן מספקת במהלך חיתוך, אשר מציגים יתרונות על פני השימוש המסורתי של מסוק רקמות. יתר על כן, מטוסי חיתוך שונים ניתן ליישם עבור תכשירים פרוסת המוח vibratome. כאן מסופק פרוטוקול מפורט להכנה מוצלחת של פרוסות היפוקמפוס אופקיות חתוכות ויברטום של מוחות עכברים. בניגוד להכנות אחרות לפרוסות, חתך אופקי מאפשר לשמור על הסיבים של נתיב הקלט ההיפוקמפוסי (נתיב מחורר) במצב שלם לחלוטין בתוך פרוסה, מה שמקל על חקירת אינטראקציות entorhinal-hippocampal. כאן, אנו מספקים פרוטוקול יסודי לניתוח, מיצוי, וקצץ אופקי חריף של המוח המורין, ולדון באתגרים ובמלכודות פוטנציאליות של טכניקה זו. לבסוף, נראה כמה דוגמאות לשימוש בפרוסות מוח ביישומים נוספים.
Introduction
המחקר הנרחב של ההיפוקמפוס החל כאשר סקוביל ומילנר דיווחו על חוסר היכולת של חולה (H.M.) ליצור זיכרון חדש, הצהרתי לאחר הסרה כירורגית של ההיפוקמפוס ומבני האונה הרקתית הסמוכים כטיפול באפילפסיה חמורה1. מרגע זה ואילך, ההיפוקמפוס נחקר בהרחבה החל תכונות עצביות כלליות פונקציות עד להתפתחות של הפרעות מוחיות חמורות, כגון אפילפסיה ומחלת אלצהיימר2,3,4,5. ההיפוקמפוס הוא חלק מהמערכת הלימבית, המורכבת מקבוצה של מבני מוח קשורים המעורבים בהיווצרות רגש וזיכרון6,7. רשת צפופה של מספר מסלולי סיבים משיגה קישוריות היפוקמפוס הדוקה למבני מוח פנימיים וחיצוניים. מסלולים אלה כוללים את הנתיב המדיאלי והנקבי לרוחב (קליפת המוח האנטורינלית כדי לכוון gyrus, CA3 – CA1 ו subiculum)8, נתיב סיבים טחב (לכוון gyrus כדי CA3)9 ואת נתיב שייפר בטחונות / שיוכי קומיסרלי (CA3 כדי CA1)10 (איור 1). ההיפוקמפוס מציג את אחד מאזורי המוח הנחקרים ביותר עד כה בגלל הארגון הלמינארי השמור ביותר של היווצרות השכבה העצבית, והאפשרות להשיג תרבויות עצביות חיוניות ופרוסות מוח בקלות יחסית5.
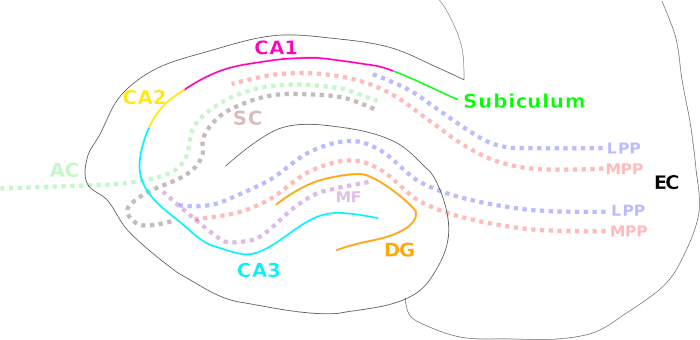
איור 1: קריקטורה הממחישה את אזורי ההיפוקמפוס השונים ואת מסלולי הסיבים העיקריים. אזורי ההיפוקמפוס השונים מסומנים על ידי קווים צבעוניים: קליפת המוח האנטורינאלית (EC; שחור), gyrus משועבד (DG; כתום), קורנו אמוניס (CA) 3 (ציאן), 2 (צהוב), ו 1 (מגנטה), ואת subiculum (ירוק). מסלולי סיבים מוצגים עם קו מנוקד צבעוני: נתיב ניקוב המדיאלי (MPP, אדום) ולרוחב (LPP, כחול) (מקליפת המוח האנטורינאלית ועד לgyrus משועבד, CA3, CA1, ו subiculum), מסלול סיבים טחב (MF, סגול) (מן gyrus משועבד CA3) ואת בטחונות שייפר (SC, חום) (ipsilateral מ CA3 כדי CA1)/ מסלולי קומיסראלי שיוך (AC, ירוק בהיר) (התווית מ CA3 ל CA1). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
פרוטוקולים פרוסת המוח לעתים קרובות לגרום לאובדן קשרים מאזורי מוח רחוקים יותר לאזור עניין5. יתר על כן, נימים כבר לא מתפקדים5 ואת זרימת הדם הוא משולל11. למרות מגבלות אלה, פרוסות המוח עדיין משמשות בעיקר לחקירת תפקודים נוירופיזיולוגיים של ההיפוקמפוס בשל מספר יתרונות. ראשית, החילוץ של ההיפוקמפוס הוא מהיר12 ואינו דורש חומרים רבים. המכשירים החיוניים היחידים כוללים ערכת ניתוח, אמבט מים במעבדה, גישה לפרבוגן ומיקרוטום רוטט (ויברטום)13. נכסים אחרים של טכניקת פרוסת המוח הם עקיפת מחסום הדם - מוח (BBB) ואת לשטוף מתוך מולקולות שפורסמו אנדוגני לפני תחילת הניסוי5, מה שמאפשר ללמוד את ההשפעה של תרופות עם בקרת מינון מדויקת יחסית14. יתר על כן, פרוסות המוח משמרות את ארכיטקטורת הציטו והמעגלים הסינפטיים בתוך ההיפוקמפוס15,16, שם הנוירואנטומיה והסביבה המקומית עם קישוריות עצבית ואינטראקציות נוירון-גליה מורכבות נשמרות4,11,17. בנוסף, חיבורי סיבים בהיפוקמפוס הם בעיקר נוירונים חד כיווניים והיפוקמפוסים יש פלסטיות סינפטית גבוהה, אשר מאוד מפשט את האוסף ואת הפרשנות של הקלטות אלקטרופיזיולוגיות באיכות גבוהה על מנת להבין תהליכים נוירולוגיים18,19. חשוב לציין, פרוסות המוח מציגות נכס בעל ערך החל במגוון רחב של טכניקות מדעיות שונות, המשתרעות מטכניקות ביולוגיות מולקולריות על פני הקלטות הדמיה ועד מדידות אלקטרופיזיולוגיות12,20,21,22,23,24,25,26.
כפי שתואר לעיל, פרוסות מוח בהיפוקמפוס מציגות כלי ניסיוני רב עוצמה לחקר תכונות מבניות ותפקודיות של הקישוריות הסינפטית. זה מציע את ההזדמנות להעריך את ההשפעות של כימיקלים או מוטציות על רגישות עצבית פלסטיות16.
ההכנות לפרוסות מוח חריפות מציגות טכניקה רגישה יחסית ואיכות הפרוסה האופטימלית תלויה מאוד בתנאים ניסיוניים אידיאליים, כולל גיל החיה, שיטת המתת החסד, מהירות הניתוח והחתיכה, פתרונות החתכים והפרמטרים (למשל, מהירות ההחתכה) כמו גם התנאים להתאוששות פרוסות4. לכן, פרוטוקול מתוכנן היטב הוא בעל חשיבות עליונה ומבטיח את הרבייה על פני יחידות מחקר שונות13.
כאן, אנו מספקים פרוטוקול מפורט עבור הכנות פרוסת היפוקמפוס אופקית חריפה, במטרה לשמור על שלמות המסלול לרוחב ההיפוקמפוס וניקוב המדיאלי ואת מסלול סיבים טחובים, המאפשר חקירה של תהליכים הקשורים gyrus שקע9. נתאר בפירוט את השלבים העיקריים לנתח, לחלץ ולפרוס אופקית את המוח המוריני, ואחריו תוצאות מייצגות של הקלטות סידן-מיקרופלואורימטריות והקלטות פוטנציאליות מעוררות שדה (fEPSPs) בתנאים בסיסיים ובמהלך פרוטוקולי אינדוקציה LTP בפרוסות מוח מסוג בר C57BL/6J עכברים.
Protocol
כל הניסויים בבעלי חיים למחקר זה אושרו על ידי ועדת הבדיקה האתית של KU Leuven (בלגיה) (P021/2012).
1. הכנת תמיסת פרוסת סוכרוז גבוהה ונוזל שדרתי מלאכותי (ACSF)
- לפני יום הניסוי
- הכן 1 L של פרוסת 10x טרום פתרון עם מים סוג 1 כיתה מעבדה המכיל (ב mM): 25 KCl, 20 CaCl2, 10 MgSO4, 12.5 KH2PO4 (טבלה 1). על מנת למנוע משקעים סידן פוספט, לאט לערבב את הכימיקלים ב כיור מלא מראש עם 800 מ"ל H2O תוך ערבוב מתמיד עם stirrer מגנטי. אחסן את הפתרון בטמפרטורה של 4 מעלות צלזיוס או בטמפרטורת החדר (RT).
- ביום הניסוי
- הכן 1 L של 1x ACSF עם סוג מעבדה 1 מים המכילים (ב mM): 125 NaCl, 2.5 KCl, 2 CaCl2, 1 MgSO4, 1.25 NaH2PO4, 26 NaHCO3, 25 גלוקוז (טבלה 2). השתמש osmometer לחץ אדים כדי לאמת את osmolarity בין 305-315 mOsm (pH ~ 7.55–7.6).
הערה: על מנת למנוע משקעים סידן פוספט, לאט לערבב את כל הכימיקלים מוצקים מלא מראש עם 800 מל של H2O תוך ערבוב מתמיד עם stirrer מגנטי. הוסף MgSO4 ו- CaCl2 ממש בסוף, מטפטף לאט את הסכום הדרוש מפתרונות 1 M מניות. - פתרון בועה 1x ACSF ללא הרף ב- RT עם קרבוגן כדי להגדיר pH בין 7.3-7.4.
הערה: אם ה- pH מעט גבוה מדי או נמוך מדי, התאמות קטנות בכוח הקרבוגן יספיקו. אם רמת ה- pH גבוהה מ- 7.45 עם פחמימות, התאם אותו על-ידי הוספת כמה טיפות של 1 M NaH2PO4 פתרון. - הכינו 250 מל (למוח) של 1x פרוסת סוכרוז גבוהה פתרון המכיל 25 מל של 10x פרוסת טרום פתרון ו (ב mM): 252 סוכרוז, 26 NaHCO3, ו 10 גלוקוז (טבלה 3). ודא כי osmolarity הוא בין 320-325 mOsm (pH ~ 7.55–7.6).
- מבעבעים את הפתרון פרוסת סוכרוז גבוהה במשך 10-15 דקות עם קרבוגן כדי לשלוט על ה- pH בין 7.3-7.4.
הערה: אם רמת ה- pH גבוהה מ- 7.45 עם פחמימוגנזה, התאם אותה על-ידי הוספת מספר טיפות של פתרון 1 M KH2PO4. - אחסנו את תמיסת פרוסת סוכרוז גבוהה במשך 20-30 דקות במקפיא אולטרה (-80 מעלות צלזיוס) עד שהוא קפוא חלקית.
- הכן 1 L של 1x ACSF עם סוג מעבדה 1 מים המכילים (ב mM): 125 NaCl, 2.5 KCl, 2 CaCl2, 1 MgSO4, 1.25 NaH2PO4, 26 NaHCO3, 25 גלוקוז (טבלה 2). השתמש osmometer לחץ אדים כדי לאמת את osmolarity בין 305-315 mOsm (pH ~ 7.55–7.6).
2. הכנת סביבת העבודה לניתוח המוח
- במהלך הקירור של פתרון פרוסת סוכרוז גבוהה, להכין את הדברים הבאים.
- מחממים את אמבט המים ל 32 מעלות צלזיוס.
- מלאו את תא ההתאוששות (איור 2A) בתמיסת ACSF קרבוגנית והניחו את התא באמבט המים. יש למרוח פחמימן ללא הרף על בקבוק ה-ACSF הראשי ועל ה-ACSF בתא ההתאוששות.
- תסדר את החיה לחדר הניסויים.
הערה: הגיל, המין והמתח של החיה צריכים להיקבע על ידי הנסיין הבודד ותלויים בשאלת המחקר הספציפית. עם זאת, הפרמטרים של החיה צריכים להישאר קבועים במחקר אחד על מנת להבטיח מיון בין ימי הניסוי השונים. פרוטוקול זה תוכנן לשימוש בעכברים זכרים C57BL/6J בגיל 2-6 שבועות. אם נעשה שימוש בבעלי חיים מבוגרים יותר, ייתכן שיהיה צריכה להתאים פתרונות פרוסות ושחזור בהתאם4,27 (למשל, NMDG+פתרונות מבוססי23,28) על מנת לשמור על בריאות המוח של הפרוסות החריפות. - הכינו את תא ההרדמה.
- פורסים נייר טישו, פלסטיק פסטר פיפטה עם פתח רחב (חתוך פתוח), צלחת תרבות 90 מ"מ מלא קרח, ריבוע של נייר סינון על גבי צלחת התרבות המצוננת, מספריים חזקים לעריפת ראש, מספריים, מלקחיים מעוגלים, מרית, צלחת תרבות 35 מ"מ, מברשת עדינה, להב, צלחת דגימה (מגיע עם ויברטום), דבק סופר, קצה פיפטה, ארבע רצועות של נייר מסנן (~ 2 ס"מ x 0.5 ס"מ)(איור 2A).
- הגדר את vibratome: ראשית, לתכנת את vibratome עבור ההגדרות הנכונות (מהירות נסיעה להב: 0.08 מ"מ / s, משרעת חיתוך: 1.4 מ"מ, תדר חיתוך: 85 הרץ) ולחבר את קו קרבוגן בתא הפרוסה. לאחר מכן, מניחים את תא הפרוסה במחזיק, ממלאים את המחזיק המקיף את תא הפרוסה בקרח ומחברים הכל לויברטום. לבסוף, הניחו את סכין הגילוח במחזיק להב הוויברטום (איור 2B).
- לאחר הקפאה של פתרון סוכרוז גבוהה לבצע את השלבים הבאים.
- לאחר 20-30 דקות, מוציאים את תמיסת פרוסת סוכרוז גבוהה מהמקפיא האולטרה-מקפיא של -80 מעלות צלזיוס ושומרים את הכומתה על הקרח.
- מניחים את הפתרון סוכרוז גבוהה ליד vibratome על הספסל שלך, למחוץ ומערבבים את הפתרון קפוא חלקית עם מרית כדי לקבל רפש נחמד ולהתחיל מבעבע עם קרבוגן.
- קחו קצת תמיסת פרוסת סוכרוז גבוהה עם פיפט פסטר פלסטיק כדי להשרות את נייר המסנן בריבוע על גבי צלחת תרבות 90 מ"מ מקורר.
- ממלאים את מנת התרבות 35 מ"מ (או כל מיכל קטן שווה ערך המתאים לאחסון המוח כולו) עד 75% בתמיסת פרוסת סוכרוז גבוהה (מספיק כדי לכסות את המוח כולו) ומצננים את צלחת התרבות על הקרח שנשמרה ליד הכומתה עם שאר הפתרון. קרבוגן את הפתרון בצלחת תרבות 35 מ"מ.
3. ניתוח ומיקום של המוח המורין
- יש למרדים את החיה עם 5% איזופלורן. לקבוע את העומק הנכון של הרדמה על ידי צביטת הכף. אין רפלקס נסיגת כפות רגליים צריך להתרחש.
- מעבירים את החיה על נייר טישו וערפו את ראשו במספריים חזקים או בגיליוטינה קטנה של בעלי חיים.
- השתמש מספריים ניתוק לחתוך לפתוח את הקרקפת.
- חותכים לפתוח את calvaria לאורך תפר sagittal ולהסיר אותו בעזרת מלקחיים מעוגלים עד המוח כולו, כולל נורות חוש הריח, גלוי.
הערה: היזהר לא לפגוע במוח עם הקצוות החדים של הגולגולתא או מלקחיים. - השתמש מרית כדי לגרוף בזהירות את המוח (נורות חוש הריח צריך להישאר מחובר).
- להעביר את המוח בצלחת תרבות 35 מ"מ מצונן ולהסיר את כל חלקיקי השיער או הדם מהרקמה על ידי שטיפת המוח בעדינות עם פיפטה פסטר מלא ACSF (לדם יש השפעות ציטוטוקסיות על רקמת המוח29).
- מעבירים את המוח בעזרת המרית על נייר הסינון הספוג על גבי מנת התרבות המצוננת של 90 מ"מ(איור 2A).
- השתמש בלהב כדי לחתוך את המוח לשניים, להפריד בין שתי ההמיספרות, ולמקם את שתי ההמיספרות בצד המדיאלי שנחתך זה עתה.
- השתמש בלהב כדי להסיר את החלק הגבי (5%-10%) של המוח מכל חצי כדור עם חתך מקביל לחלק העליון הגבי(איור 2C)30 ומניחים את שתי ההמיספרות בצד החתוך הטרי עם החלק הגחוני של המוח הפונה כלפי מעלה.
- מקם טיפה של דבק סופר על צלחת הדגימה ולהפיץ כראוי עם קצה פיפטה כדי להתאים את שתי ההמיספרות.
- השתמש רצועת נייר מסנן להרים חצי כדור אחד עם כוחות נימי על ידי נגיעה בצד הגחוני עם רצועת נייר מסנן, ובכך לא לפגוע ברקמה.
- השתמש ברצועת נייר מסנן אחרת כדי לייבש בזהירות את הצד הגבי של המוח לפני מיקום חצי הכדור עם הצד הגבי למטה על גבי הדבק על צלחת הדגימה. חזור על אותו הליך עם ההמיספרה השנייה.
הערה: ההמיספרות צריכות להיות ממוקמות ביישור אופקי בצורה משוקפת על צלחת הוויברטום, כאשר הצדדים הרוטאליים מצביעים לכיוון החיצוני והצדדים הקאודליים פונים זה לזה (אך לא נוגעים) זה בזה באמצע. הצדדים המדיאליים של שתי ההמיספרות צריכים להצביע לכיוון להב הוויברטום והצדדים הצדדיים לכיוון הניסוי (איור 2D). - מניחים את צלחת הדגימה בתא השיוך ובמהירות, אך בזהירות, מכסים אותה בפרוסת סוכרוז גבוהה וקרה כקרח. ברגע שהפתרון נוגע בדבק, הוא יחזק וידביק כראוי את ההמיספרות לצלחת הדגימה.
- להבטיח כי ההמיספרות מכוסות כראוי עם פתרון פרוסת סוכרוז גבוהה ולאשר כי הפתרון הוא מבעבע עם פחמימן.
הערה: יש לבצע את כל הליך הניתוח מהר ככל האפשר. אנא ודא כי המוח לא נשאר ללא אספקת חמצן במשך זמן רב מאוד. זה צריך לקחת רק סביב 1-1.5 דקות מעריפת ראש לשקיעה במוח ב slush פתרון פרוסת סוכרוז גבוהה. זוהי הדרישה הקריטית ביותר עבור תכשירים פרוסת מוח חריפה על מנת להצדיק איכות גבוהה של הפרוסה.
4. החלקה אופקית של המוח
- מקם את להב הוויברטום מול הצד המדיאלי של ההמיספרות והורד אותו לאותו גובה כמו הצדדים הגחוניים של ההמיספרות הפונים כעת כלפי מעלה. מנמיכים את הלהב בעזרת בקרת הוויברטום ל-600 מיקרומטר בכיוון הגב ומתחילים בחתך. הלהב צריך להכות את הרקמה (אם לא, להפוך את הלהב ולהוריד אותו קצת יותר). פורסים עד ששתי הפרוסות הראשונות מופרדות לחלוטין משתי ההמיספרות.
- הפוך את הלהב והורד עוד 300 מיקרומטר ופרוס שוב.
- כאשר ההיפוקמפוס הופך גלוי (השתמש בעכבר31 אטלס המוח לעזרה, במידת הצורך) (איור 2E) לאסוף את הפרוסות עם פיפטה פסטר פלסטיק מורחב. לאסוף את הפרוסות עד putamen caudate הופך גלוי ליד ההיפוקמפוס. בדרך כלל, בין 8-12 פרוסות של 300 מיקרומטר (4-6 לכל חצי כדור) ניתן לאסוף עבור מוח העכבר.
- השתמש בפיפטת פסטר מפלסטיק כדי לאסוף את הפרוסות ולהעביר אותן לתא ההתאוששות באמבט המים(איור 2F)(לאסוף פרוסות לאחר כל סיבוב של חתך כדי למנוע מהם לצוף בתא הפרוסה).
הערה: עבוד מהר ככל האפשר וודא שתמיסת פרוסת סוכרוז גבוהה היא קרה כקרח ופחמימות במהלך ההליך כולו. במידת הצורך, למלא את הקרח המקיף את תא הפרוסה.
5. שחזור של פרוסות מוח להקלטות אלקטרופיזיולוגיות
- השאירו את הפרוסות בתא ההתאוששות המלא ב-ACSF באמבט המים של 32 מעלות צלזיוס למשך שעה.
הערה: תאי שחזור זמינים גם הם מסחרית. - תוציא את תא ההתאוששות מאמבטיית המים.
- מניחים את הפרוסות ב RT לפחות עוד 30 דקות לשחזור לפני תחילת כל יישום נוסף.
6. הקלטות fEPSP בנתיב המחורר המדיאלי (MPP) של ההיפוקמפוס
- משוך פיפטות הקלטה של נימי זכוכית borosilicate עם מושך פיפטה אופקית כדי לקבל פיפטות בגודל של ~ 2 MΩ כאשר מלא פתרון ACSF שקוע בתא ההקלטה מלא ACSF.
- מלאו את פתרון האמבטיה ACSF ואת פתרון ACSF המכיל את הכימיקלים המתאימים (למשל, Bicuculline) במערכת זלוף רב חבית הנשלטת על ידי כוח הכבידה המחוברת לתא ההקלטה. ללא הרף carbogenate כל הפתרונות.
- הפעל משאבת פריסטלית או משאבת ואקום המחוברת לצינורות יניקה המסתיימים מול קו הזלוף בתא ההקלטה. פתחו את החבית המלאה ב-ACSF והתחילו ליצור זרימה רציפה (1-2 טיפות לשנייה). ודא שאלקטרודת הייחוס שקועה בפתרון ACSF.
- הפעל את מחשב ההתקנה, המגבר, המיקרומניפולטור, הממריץ, נוריות המיקרוסקופ, המצלמה והצג (אם רלוונטי).
- פתח את התוכנה המתאימה להקלטות אלקטרופיזיולוגיות (קיימים מספר ספקי חומרה ותוכנה שונים עבור ציוד אלקטרופיזיולוגי).
- מעבירים חצי כדור של פרוסת מוח אחת מתא ההתאוששות לתא ההקלטה של כיוונון הפרוסה וממקם אותה בכיוון הנכון עם שכבת תא גרגירי הגרגרים המשקעת והשכבה המולקולרית בשדה הראייה. ודא כי אלקטרודה גירוי יכול להגיע MPP בפרוסה מכיוון קליפת המוח האנטורינלית וכי אלקטרודה הקלטה יש גישה MPP מהצד הנגדי המדויק מכיוון CA3.
- ייצבו את הפרוסה בתא ההקלטה בעזרת מהדק נייר (איור 3A)או רשת פרוסות מוח זמינה מסחרית.
הערה: זה יכול להיות מועיל לכבות את זלוף במהלך העברת פרוסה ומיקום. עם זאת, זה לא צריך לקחת יותר מדי זמן על מנת להבטיח את איכות פרוסת המוח. - מנמיכים וממקם את אלקטרודות ההקלטה והגירוי ב- MPP בשליש התחתון של השכבה המולקולרית קרוב לשכבת תאי הגרגר (איור 3B), הפונים זה לזה במרחק של כ- 100-150 מיקרומטר. אלקטרודת הגירוי צריכה ליצור קשר מינימלי עם פני השטח, בעוד האלקטרודה המתעדת צריכה לחדור מעט לשכבת הפרוסה העליונה.
- החל גירוי בעוצמה נמוכה (30-50 μA עבור 0.1 ms) על פרוסת המוח על מנת לקבל את אות fEPSP. להתאים את המיקום של האלקטרודות במידת הצורך (למשל, אות fEPSP נמוך או לא טיפוסי).
- התחל להקליט עקומות קלט-פלט: החל עוצמות גירוי גוברות על פרוסת המוח במרווחים של 30 s.
- הגדר את עוצמת הגירוי ל-50% מתגיבת fEPSP המקסימלית והתחל בהקלטות fEPSP בסיסיות המחיילות את עוצמת הגירוי של 50% למשך 20-40 דקות במרווחים של 30 שניות לפרוסת המוח.
- אם נראה שהתוכנית הבסיסית יציבה, המשך בהקלטות נוספות (למשל, פרוטוקולי LTP/LTD ו/או יישומי סמים). (עבור אינדוקציה LTP ב MPP, כאן פרוטוקול המורכב ארבע פעמים 1 s 100 הרץ פולסים להחיל במרווח של 5 דקות שימש. Bicuculline הוחל 10 דקות לפני ובמהלך שלב ההתניה.)
הערה: יש לבצע את כל ההקלטות במצב ההידוק הנוכחי עם סינון נמוך(<5 kHz) וקצבי דגימה מתאימים (>10 kHz). - חלץ את הנתונים בתבנית קובץ מתאימה ונתח פרמטרי fEPSP, כגון מטח סיבים, משרעת fEPSP ושיפוע fEPSP.
7. הקלטות הדמיית סידן של פרוסות מוח
- מעבירים חצי כדור של פרוסת מוח אחת בתא של 12 בארות ומעמיסים אותה למשך 30 דקות עד שעה עם צבע סידן מתאים. ללא הרף carbogenate את פתרון הטעינה על ידי החדרת צינור carbogenation דרך חור מתוצרת עצמית (עם מחט 18G חם) במכסה של צלחת 12-well.
הערה: שלב זה אינו נחוץ במקרה של הכנות פרוסות מוח מבעלי חיים מהונדסים גנטית המבטאים באופן אנדוגני כתב פלואורסצנטי כגון GCaMP. - הכן את כיוונון ההקלטה כמתואר בשלבים 6.2-6.5.
הערה: אין צורך בגבר או מיקרומניפולטור לניסויי הדמיה מיקרופלואורית. השימוש בממריץ תלוי בניסוי. תוכנה ספציפית לניסויים בהדמיית פלואורסצנטיות היא חיונית. - התאם את התוכנה להגדרות הדימות הנכונות: הדבר כולל את מגבר המצלמה ואת הגדרת האיתור, הגדרת אורך הגל, זמן החשיפה ופרוטוקול התזמון. ההגדרות עשויות להשתנות בהתאם לניסויים המדויקים. (לדוגמה עקבות, 1 x 1 binning, 2.4x רווח טרום מגבר, 300 רווח מצלמה EM, חשיפה של 50 ms ב 488 ננומטר חזר על עצמו כל 500 ms למשך הניסוי שימש.)
- לאחר טעינה עם צבע הסידן, להעביר את ההמיספרה פרוסת המוח מן 12-well לתא ההקלטה ולמקם אותו על הבמה מיקרוסקופ.
- ייצבו את הפרוסה בתא ההקלטה בעזרת מהדק נייר (איור 3A)או רשת פרוסות מוח מסחרית הדומה לזו המתוארת בשלב 6.7.
- להבטיח כי תחום העניין הוא בתחום המיקרוסקופי הנכון ובפוקוס.
- השתמש בתוכנת דימות הפלואורסצנטי כדי לבחור מספר אזורי עניין (ROIs) בפרוסה שלך.
הערה: זה יכול להיות שימושי כדי לבחור את כל שדה הראייה כדי לעקוב אחר התנודות הכלליות בבהירות, עקב photobleaching. - התחל את ההקלטה וליישם את הניסויים בנקודות זמן נבחרות.
הערה: מומלץ ליישם פתרון K+ גבוה בסוף כל ניסוי כדי לאמת את האופי העצבי של התאים ואת איכות הפרוסה. - חלץ את הנתונים בתבנית קובץ מתאימה ונתח את השינויים באות הפלואורסצנטי המתרחשים ב- ROIs לאורך המדידה כולה. ניתן גם להתאים ROIs במהלך הניתוח הלא מקוון.
הערה: פרוטוקולים אחרים המתארים הקלטות fEPSP ומיקרופלואורימטריית סידן בפרוסות המוח זמינים בספרות24,32,33,34,35.
תוצאות
מבט כולל על כלים ושלבים קריטיים הדרושים לפרוטוקול
איור 2 מציג את כל הכלים הדרושים ואת השלבים הקריטיים להכנת פרוסות אופקיות חריפות של מוח ההיפוקמפוס כמתואר בפרוטוקול זה. בדרך כלל, נדרש מספר מצומצם של מכשירי מפתח, כולל כמה כלי ניתוח ותא התאוששות לפרוסות (איור 2A), אמבט מים במעבדה וויברטום (איור 2B). איור 2C–E דמיין שלבים וכיוונים חשובים של המוח וההמיספרות במהלך פרוטוקול הכנת הפרוסות. איור 2F הוא המחשה של תוצאה צפויה של פרוסות מוח אופקיות.
הקלטות fEPSP בנתיב המחורר המדיאלי
לאחר תקופת ההחלמה, ניתן להשתמש בפרוסות המוח להקלטות אלקטרופיזיולוגיות של fEPSPs. כאן השתמשנו במיקרוסקופ זקוף המצויד במערכת זלוף רב-ערוצית הנשלטת על-ידי כבידה (איור 3A ואיור 3B). מיקרופיפט זכוכית (~ 2 MΩ) היה מלא בתמיסת ACSF והוצמד על גבי אלקטרודה כסף מצופה כלוריד כי הוא רכוב על מגבר מבצעי במעגל עם אלקטרודה אמבטיה כלור. fEPSPs הוקלטו ותועדו עם מגבר ותוכנת הקלטה מתאימה על ידי החדרת מיקרופיפט הזכוכית לתוך MPP של ההיפוקמפוס בשכבה העליונה של פרוסת המוח. fEPSPs נגרמו על ידי גירוי עם microelectrode אשכול 2-מגע, החלת עוצמות זרם שונות על MPP במעלה הזרם של אלקטרודה הקלטה. שים לב כי פרוטוקול זה לא נועד להסביר כיצד להשיג הקלטות MPP, אלא פשוט משתמש בהקלטות ב- MPP כדוגמה כדי להדגים את ההצלחה של פרוטוקול הכנת הפרוסה המתואר כאן. אם מישהו מנסה לבצע הקלטות MPP, פקדים מסוימים (למשל, הקלטות דופק מזווגות) עשויים להיות נחוצים על מנת להבטיח את אתר ההקלטה הנכון ולהבדיל את MPP מ LPP8,36,37.
איור 3C מדגים דוגמה שלילית (חלונית שמאלית, פרוסה באיכות נמוכה) ודוגמה חיובית (חלונית ימין, פרוסה באיכות גבוהה) של הקלטת fEPSP. עקבות הדוגמה השלילית מציגות משרעת גדולה של מטח סיבים (FV) הגבוהה אף יותר משרעת fEPSP בפועל (≈0.5 mV). לעומת זאת, דוגמה לפרוסה באיכות גבוהה (לוח ימני) מציגה יחס FV קטן ל-fEPSP משרעת fEPSP גבוהה (>0.5 mV). מטח הסיבים הוא האות המתרחש בעת דפולריזציה של הסיבים העצביים מגורה ולכן מקדים את potentiation postsynaptic (fEPSP). היחס בין מאפייני FV ל- fEPSP מספק מידע חשוב אודות שימור המאפיינים האקסונליים והסינפטיים. פרוסות באיכות גבוהה עם סיבי עצב שלמים אמורות להראות משרעת fEPSP גבוהה ליחס FV. להיפך, פרוסות באיכות נמוכה עם תכונות הולכה לקוי יהיה יחס fEPSP ל FV מופחת. באופן דומה, ניתן לנתח את הכדאיות של פרוסת מוח על ידי התוויית מדרונות fEPSP לעומת משרעת מטח הסיבים(איור 3D).
יתר על כן, עקומות קלט-פלט (שיפוע fEPSP משרעת FV על עוצמת גירוי) משמשים באופן סטנדרטי על מנת לקבוע את איכות הפרוסה. עקומות כאלה מתקבלות על ידי החלת הגדלת הגירויים הנוכחיים על פרוסת המוח ועל ידי ניטור התגובות הבאות fEPSP. פרוסות מוח באיכות נמוכה מציגות עקומת קלט-פלט מופחתת עקב תכונות הולכה תת-אופטימליות של רקמת מוח שהשתמרה בצורה גרועה(איור 3E,F). יתר על כן, עקומות קלט-פלט נחוצות כדי להגדיר את טווח עוצמת הגירוי האידיאלי לחקירת תהליכים סינפטיים. באופן אידיאלי, עוצמת הגירוי צריכה להיות מוגדרת סביב 50% מהעוצמה לתגובות מקסימליות. בעוצמת גירוי נבחרת זו, תגובות fEPSP רגישות מאוד לכל שינוי פלסטיות סינפטית, אשר מציע את ההזדמנות לחקור הן potentiation לטווח ארוך (LTP) ודיכאון לטווח ארוך (בע"מ).
על מנת ללמוד פלסטיות סינפטית, השידור הסינפטי של פרוסת המוח (שיפוע fEPSP) בעוצמת הגירוי שנבחרה 50% מנוטר לתקופה ארוכה יותר (בדרך כלל בין 20-40 דקות) לפני שלב המיזוג. לפרוסות מוח בנות קיימא יהיו קווי בסיס יציבים, בעוד שפרוסות מוח עם בסיס לא יציב לא יכולות לשמש לפרוטוקולי מיזוג נוספים כדי לחקור פלסטיות סינפטית של מעגלי המוח (איור 3G, הלוח העליון). הקלטות בסיסיות של fEPSP יכולות גם להיות שימושיות כדי לנטר את השפעות הסמים על השידור הסינפטי עצמו (איור 3G, הפאנל התחתון). הממוצע של האותות הבסיסיים המוקלטים של fEPSP משמש בדרך כלל לנרמול מסלול זמן fEPSP ומוגדר באופן סטנדרטי ב- 100%.
פלסטיות סינפטית ניתן ללמוד על ידי החלת פרוטוקולי מיזוג ספציפיים על פרוסות המוח. פרוטוקולים אלה תלויים במעגל המוח שנחקר ובמנגנון העניין (למשל, LTP או LTD). על מנת לגרום LTP ב MPP של gyrus שקע, פרוטוקול מיזוג חזק יש צורך בשל עיכוב GABAergic חזק כי הוא נוכח ב MPP סינפסות38. הוא דיווח כי עיכוב GABAergic בולט עוד יותר פרוסות המוח מוכן עם פתרונות חתך סוכרוז גבוהה39. כאן, אנו משתמשים בפרוטוקול המורכב מארבעה גירויים של פולסים ארוכים של 100 הרץ של 100 הרץ המוחלים במרווח של 5 דקות תוך כדי טיפול באנטגוניסט קולטן GABAA Bicuculline(איור 3H). התוספת המשותפת של NMDA ו- Bicuculline במהלך תקופת ההתניה גורמת לעלייה ב- LTP (איור 3H). איכות נמוכה של הפרוסה ושידור סינפטי לא יציב (בסיס fEPSP) עלולים לגרום לכניסת LTP ו- LTD שהשתנתה או לא הצליחה. לכן, יש חשיבות גבוהה לעבוד עם הכנות פרוסה באיכות גבוהה ולהשתמש בקריטריוני אי-הכללה קפדניים (משרעת fEPSP נמוכה ליחס מטח סיבים (<3), שיפוע fEPSP קטן (<0.5 mV/ms) או משרעת (<0.5 mV) וקו בסיס fEPSP לא יציב (שינוי של יותר מ- 5%) לפרוסות בלתי ניתנות לסיכה בעת חקירת תהליכים סינפטיים.
מדידות מיקרופלואורימטריות סידן בשכבת תאי הגרגר של gyrus שקע
לאחר ההתאוששות, פרוסת מוח דגירה בטמפרטורת החדר עם 2 מיקרומטר של צבע רגיש לסידן במשך 1 שעות ASCF קרבוגני, מוגן מפני אור. הפרוסה הועברה לתא הקלטה(איור 3A)במיקרוסקופ פלואורסצנטי זקוף המצויד במערכת זלוף רב-ערוצית הנשלטת על ידי הכבידה. תמונות פליטת פלואורסצנטיות נרכשו כל 500 אלפיות שניה לאחר התאורה ב-488 ננומטר(איור 4A,B). עירור נעשה עם מנורת קסנון וסורק רכוב עקיפה גרידת מונוכרומטור ורכישת תמונה בוצעה עם מצלמת CCD הנשלטת על ידי מחשב. במהלך המדידות, הפרוסה טופלה עם אנטגוניסט קולטן NMDA APV, אשר הביא לירידה בריכוז הסידן תאיים. גירוי הפרוסה בתמיסה חוץ-תאית המכילה ריכוז אשלגן גבוה (50 מ"מ) הביא לזרם מסיבי של סידן חוץ-תאי עקב דפולריזציה של תאי העצב ופתיחת תעלות יון מגודרות מתח(איור 4C).
| מורכבים | ריכוז (mM) | משקל מולקולרי (g/מול) | סכום (ז) |
| KCl | 25 | 74.55 | 1.86 |
| CaCl2 * 2H2O | 20 | 147.01 | 2.94 |
| MgSO4 * 7H2O | 10 | 246.48 | 2.46 |
| KH2PO4 | 12.5 | 136.08 | 1.7 |
טבלה 1: 10 x פרוסת פתרון מקדים (1 L).
| מורכבים | ריכוז (mM) | משקל מולקולרי (g/מול) | סכום (ז) |
| נקלה (נקל) | 125 | 58.44 | 7.3 |
| KCl | 2.5 | 74.55 | 0.19 |
| CaCl2 * 2H2O | 2 | מ 1 M CaCl2 פתרון | 2 מ"ל |
| MgSO4 * 7H2O | 1 | מתמיסת M MGSO4 1 | 1 מ"ל |
| NaH2PO4 * 2H2O | 1.25 | 156.02 | 0.2 |
| נהקו3 | 26 | 84.01 | 2.18 |
| גלוקוז * H2O | 25 | 198.17 | 4.95 |
טבלה 2: 1x ACSF (1 L) (אוסמולריות בין 305-315 mOsm).
| מורכבים | ריכוז (mM) | משקל מולקולרי (g/מול) | סכום (ז) |
| 10x פרוסת תנוחה מוקדמת | מספר N/A | מספר N/A | 25 מ"ל |
| סוכרוז (נפת) | 252 | 342.3 | 21.57 |
| נהקו3 | 26 | 84.01 | 0.55 |
| גלוקוז * H2O | 10 | 198.17 | 0.49 |
טבלה 3: 1x פתרון פרוסת סוכרוז גבוהה (250 מ"ל) (osmolarity בין 320-325 mOsm).
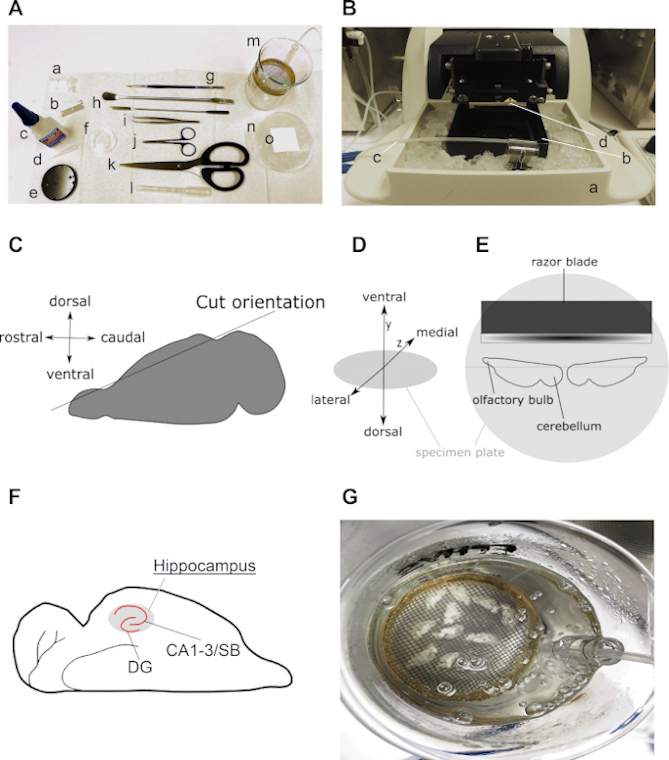
איור 2: מידע מפורט על הכנת פרוסות אופקיות של מוח ההיפוקמפוס. (A) תמונה של כלים הנדרשים לניתוח וצירוף של מוח המכרסמים: (א) אורך ±2 ס"מ ו-±0.5 ס"מ רצועות נייר סינון (למשל, כיתה 413); (ב) להב; (ג) דבק סופר; (ד) טיפ פיפטה; (ה) צלחת דגימה (מגיע עם ויברטום); (ו) צלחת תרבות 35 מ"מ; (ז) מברשת עדינה; (ח) מרית; (i) מלקחיים מעוגלים; (j) מספריים של ניתוח; (k) מספריים חזקים (אורך להב מעל 10 ס"מ); (l) פיפט פסטר פלסטיק עם פתח רחב (בין 0.6 ל 0.8 ס"מ קוטר); (m) תא התאוששות (מתוצרת עצמית עם 250 מל, טבעת פלסטיק, רשת ניילון, חתיכת פיפטה סרולוגית 10 מל); (n) צלחת תרבות 90 מ"מ במילוי קרח ו(o) ריבוע של נייר סינון על גבי צלחת התרבות המצוננת. (B) תמונה של ויברטום עם (א) מחזיק של תא פרוסה מלא קרח; (ב) תא פרוסה; (ג) קו פחמימוגן ו(ד) סכין גילוח חותך. (C) קריקטורה הממחישה את הכיוון של החתך של הצד הגבי של חצי כדור אחד על מנת להכין את המוח לחיתוך אופקי (ראה שלב 3.9). (D)הקרנה איזומטרית של כיוון המוח על צלחת הדגימה של הוויברטום. (E) קריקטורה הממחישה תצוגה עליונה של המיקום של שתי ההמיספרות על צלחת הדגימה. (F) קריקטורה המציגה את המיקום של ההיפוקמפוס בפרוסת מוח אופקית. אזורי הג'ירואים המשובחים (DG) וקורנו אמוניס (CA) –סוביקולום (SB) של ההיפוקמפוס מסומנים. (G) תמונה של תא התאוששות עם ACSF פחמימות המכיל עשר פרוסות מוח אופקיות פרוסות טריות. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
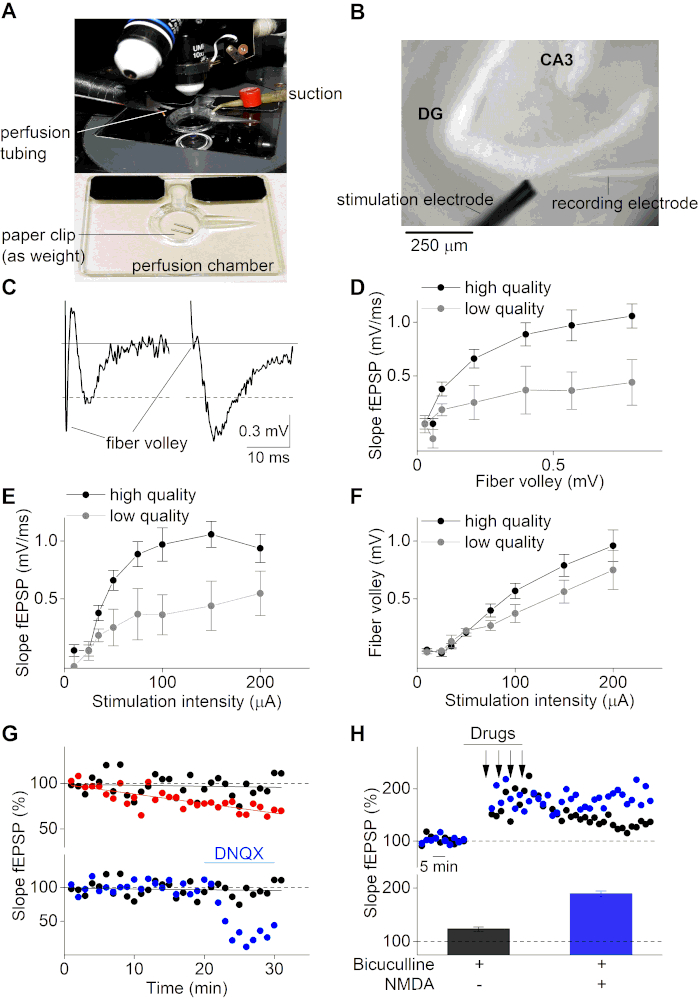
איור 3: הקלטות אלקטרופיזיולוגיות של פרוסות מוח בהיפוקמפוס. (A) תמונה של תא הקלטה עם זלוף ויניקה, המשמש תחת מיקרוסקופ זקוף. פרוסת מוח תונח בתא ותשתתק עם פיסת מהדק לפני תחילת ההקלטות. (B)תמונת שדה בהירה של פרוסת מוח בהיפוקמפוס תחת מיקרוסקופ זקוף (מטרה של פי 10). אזור ה-gyrus (DG) וה-CA3 המצוין, כמו גם הגירוי (השמאלי התחתון) והאלקטרודות המתעדות (הימנית התחתונה), המכוונות לנתיב המחורר המדיאלי במהלך הקלטות fEPSP. (C) שמאל: ייצוג של פרוסה באיכות נמוכה דוגמה של הקלטת fEPSP עם מטח סיבים חזק משרעת קטנה. מימין: דוגמה לפרוסה באיכות גבוהה של הקלטת fEPSP. הקו האפור מציין את רמת הבסיס. הקווים המנוקדים מצביעים על משרעת חתוכה של 0.5 mV. (D)התוויה של שיפוע fEPSP לעומת משרעת FV לאיכות גבוהה (שחור; n = 10) ופרוסות מוח באיכות נמוכה (אפור; n = 4). נתונים המיוצגים כמשמעותיים ± SEM. (E) של התוויית קלט-פלט (שיפוע fEPSP) עבור עוצמות גירוי שונות (μA) עבור פרוסות באיכות גבוהה (שחור; n = 10) ופרוסות באיכות נמוכה (אפור; n = 4)). (F) זהה ל-( E) אך עבור משרעת FV לעומת עוצמות הגירוי. (G)קורס זמן של שלוש הקלטות fEPSP בסיסיות שונות (שיפוע fEPSP ב- %; מנורמל לשיפוע fEPSP הממוצע של 5 דקות הראשונות). החלונית העליונה מייצגת דוגמה חיובית (שחורה) ושלילית (אדומה), שבה לאחרון יש בסיס לא יציב עקב השמטת קרבוגן במהלך ההקלטה. הפאנל התחתון מראה שתי הקלטות בסיסיות יציבות שטופלו (לאחר 20 דקות של בסיס יציב, קולטני אמפא נחסמו על ידי יישום של היריב קולטן אמפא DNQX (10 מיקרומטר)) (כחול) ומצב לא מטופל (שחור). (H)קורס זמן של הקלטות LTP עבור תנאי טיפול שונים (המצוין בלוח התחתון). צבע שחור ליישום של Bicuculline (20 מיקרומטר) במהלך מיזוג וכחול ליישום משותף של Bicuculline (20 מיקרומטר) ו NMDA (10 מיקרומטר) במהלך מיזוג. חצים בלוח העליון מציינים את נקודות הזמן שבהן הוחל גירוי בתדר גבוה (4 x 1s של 100Hz). גרף עמודות בחלונית התחתונה מייצג את מדרונות fEPSP הממוצעים (%) במשך 50-60 דקות לאחר אינדוקציה LTP של הניסויים המוצגים בלוח העליון (הקלטה נציג יחיד עבור כל תנאי). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
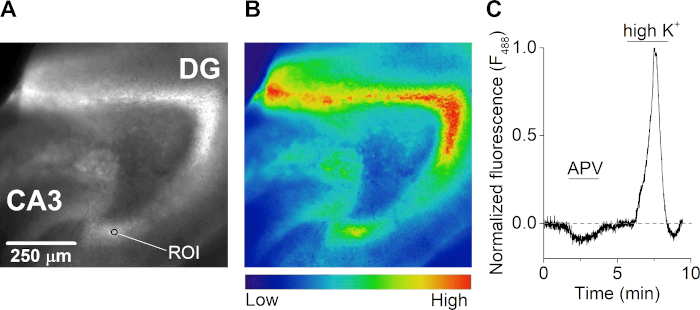
איור 4: סידן-מיקרופלואורימטריה של פרוסות מוח בהיפוקמפוס. (A ו- B) תמונת פלואורסצנטיות (נרגש ב 488 ננומטר) (A) ומפת חום תואמת (B) של פרוסת מוח היפוקמפוס אופקית של מוח העכבר. הג'ירו (DG), אזור CA3, ודוגמה של אזור עניין (ROI) מסומנים בלוח A. (C) משך זמן של תגובות סידן (F488 ננומטר)מ ROI ב gyrus שקע של פרוסת מוח היפוקמפוס חריפה במהלך הטיפול עם היריב קולטן NMDA APV (50 מיקרומטר) ופתרון המכיל אשלגן חוץ תאי גבוה (K+) (50 מ"מ). העקבות מנורמלים לתגובת הסידן הגבוהה ביותר במהלך K+ זלוף גבוה והוא מתוקן בסיסית עבור photobleaching. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
למרות נפוץ בקרב קהילת מדעי המוח, ההכנות פרוסת המוח מתמודדים גם עם מספר חסרונות. לדוגמה, חיבורי קלט ופלט לאזורי העניין במוח אינם מחוברים עוד בפרוסת מוח. יתר על כן, ברגע מבודד, הרקמה מתחילה להשפיל לאט לאורך זמן ותהליך זה יכול לשנות את התנאים הפיזיולוגיים של פרוסת המוח. נושא זה מדאיג מאוד מכיוון שרוב הקלטות פרוסות המוח לוקחות מספר דקות עד שעות, מה שמוביל לימי ניסוי ארוכים עם הקלטות שבוצעו על רקמות שבודדו עד 6-8 שעות לפני תחילת הניסוי. יתר על כן, הנוזל השדרתי ומחזור הדם מופרעים במהלך ההכנות לפרוסות, מה שעלול להוביל להיעדר תרכובות אנדוגניות חשובות בתוך פרוסת מוח. והכי ברור, הליך ההחתכה עצמו עלול לגרום נזק מכני לרקמות שעלול לסכן את התוצאות המתקבלות. עם זאת, היתרונות בפועל של ההכנות פרוסת המוח עדיין עולים על החסרונות שלהם, ולכן הם מציגים טכניקה מוערכת מאוד מועסק במחקר מדעי המוח.
פרוסות מוח היפוקמפוס חריפות מציגות טכניקה רבת עוצמה ולכן בשימוש נרחב כדי לחקור תהליכים עצביים מרמה מולקולרית ועד מחקרים מורכבים במעגל המוח. זה מבוסס על נוירואנטומיה האידיאלית של ההיפוקמפוס שניתן לשמר בקלות בפרוסת הכנה18. כתוצאה מכך, פרוסות מוח בהיפוקמפוס משמשות במגוון רחב של מחקרים מדעיים, כולל הקרנות סמים17, מחקרים על תכונות עצביות וסינפטיות המעורבות בתפקודים קוגניטיביים40,41, וחקירות של מחלות מוח פתולוגיות14,42,43. עם זאת, קשת רחבה של יישומים שונים גורמת גם למגוון רחב של פרוטוקולי הכנת פרוסות זמינים שיכולים להיות שונים בפרמטרים שונים, כגון תנאי ניתוח וחיתוך כיוון המישור, בין היתר. לכן, שאלת המחקר המדויקת של פרויקט מדעי צריכה להיקבע על מנת לבחור פרוטוקול הכנת פרוסה מתאים.
מסוק הרקמות מציג את אחת הטכניקות המשומשות העתיקות ביותר להכנת פרוסות מוח בהיפוקמפוס44,45. היתרונות העיקריים של שיטת הכנה זו כוללים את העלות הנמוכה של המסוק ואת השימוש המהיר והקל46. עם זאת, מסוקי רקמות לגרום ללחץ מכני שתוצאתו שינויים מורפולוגיים ומוותתאים 47. לשם השוואה, הוויברטום הוא מכונה יקרה למדי והזמן להכנת פרוסות גדל באופן משמעותי אשר עשוי להשפיע על איכות הפרוסה. עם זאת, vibratome בדרך כלל מציע אופן עדין יותר של הפרדת הפרוסות מן הרקמה ומאפשר לשמור על המוח מקורר יפה מחומצן על כל הליך הבידוד, ובכך לשפר את תכונות פרוסה46. לכן, מספר קבוצות משתמשות באופן סטנדרטי בטכניקה זו והביאו פרוטוקולים להכנת פרוסות מוח היפוקמפוס חריפות באמצעות vibratome16,30,48. בעוד פרוטוקולים מסוימים מספקים רק כמה פרטים עבור חיתוך עצמו, אלא להתמקד ביישום מסוים של הכנת פרוסה כזו48, אחרים מספקים פרוטוקולי פרוסה מפורטים השונים בחיתוך מישור או פרטי פרוטוקול אחרים (למשל, הטבעה agarose או פרוסה / פתרונות התאוששות) נתון במאמר זה27,30.
הפרוטוקול המתואר כאן מציג שיטה פשוטה על מנת להכין באיכות גבוהה פרוסות מוח עכבר היפוקמפוס אופקי באיכות גבוהה מבעלי חיים צעירים. הפרוטוקול שימושי במיוחד כדי לשמר את הנתיב המחורר (המדיאלי ולרוחב) המציג את מסלול הקלט ההיפוקמפוס, אשר מקרין מן קליפת המוח האנטורינלית אל ההיפוקמפוס8,49,50. קשת, קורנל, כמו גם היפוקמפוס מבודד תכשירים פרוסה רוחבית אינם משמרים כראוי את הנתיב המחורר, שמקורו בעיקר בשכבות II ו- V של קליפת המוח האנטורינלית ופרויקטים למספר אזורים בתוך ההיפוקמפוס18. בשל המיקום האנטומי של קליפת המוח האנטורינלית ביחס להיפוקמפוס, פרוסות מוח אופקיות הן הכרח על מנת לשמור על סיבי נתיב מחורר שלמים לחלוטין בתוך הפרוסה הכנה31. בנוסף, ההחתכה האופקית משמרת באופן אידיאלי את הסיבים הטחובים המקרינים מהgyrus המשקע לנוירונים CA3 בתוך ההיפוקמפוס9,30,50. לכן, שיטת הכנה זו היא בעלת ערך גבוה למחקרים החוקרים מסלולי קלט בהיפוקמפוס ותהליכים הקשורים ל- DG. בנוסף, פרוטוקול זה מאפשר את החקירה של מסלול בטחונות שייפר50. עם זאת, הכנות פרוסות המוח sagittal ו coronal נמצאים בשימוש נפוץ יותר בעת חקירת CA3 כדי CA1 תחזיות סיבים, ככל הנראה בגלל זמן ההכנה שלהם קצת יותר מהר שיכול להגדיל את הסיכוי להשיג פרוסות באיכות גבוהה. עם זאת, ההכנות לפרוסת ההיפוקמפוס האופקי מציגות כלי מחקר רב עוצמה שכן הוא מאפשר שימור וחקירה של כל מסלולי הסיבים בהיפוקמפוס בתוך חצי הכדור פרוסה אחת. זה יכול להיות שימושי במיוחד כאשר תגובות מעגל נחקרות, למשל, בהקלטות מבחני אלקטרודה מרובים.
דאגה מרכזית בעת הכנת פרוסות המוח היא שימור נאות של רקמת המוח. זה מושג על ידי מספר צעדים קריטיים בפרוטוקול שלנו, כולל ניתוח מהיר, חמצון מתמשך ומספיק וקירור של הרקמה, והגנה על רקמת המוח על ידי שימוש בשיטת חיתוך מגן עם נתרן נמוך, פתרון חיתוך סוכרוז גבוה39,51. למרות העובדה כי הפרוטוקול המתואר כאן מניב שיעור הצלחה סביב 90%, ייתכן שיידרשו צעדי הגנה נוספים בעת עבודה עם רקמות שמקורן בבעלי חיים מבוגרים או מגוונים גנטית או בעת ניסיון לשמר אוכלוסיית תאים מסוימת. מספר שיטות כבר דווחו כדי להגן על הכנות רגישות רקמת המוח. שיטות אלה כוללות שימוש בפתרונות חותכים מבוססי NMDG להפחתת חדירת הנתרן52, שימוש ברמות מגנזיום גבוהות בתמיסת החיתוך על מנת לחסום את פעילות הקולטן NMDA53, ושימוש ממושך בפתרונות מגן גם בתקופת ההחלמה23. כל האמצעים האלה יגרמו להתרגשות מופחתת. בנוסף, זלוף טרנס-קרדיאלי עם פתרונות ACSF מגן קר כקרח משמש לעתים קרובות והכרחי בעת עבודה עם בעלי חיים מבוגרים27.
פרוסות מוח היפוקמפוס חריפות מתאימות באופן אידיאלי ומשמשות בהרחבה למחקרים אלקטרופיזיולוגיים מסיבות כגון אותות משרעת גבוהים שניתן להשיג מפרוסת מוח חריפה עבה יחסית (300-500 מיקרומטר), המבטיחה אות גבוה ליחס רעש11. יישומים אלקטרופיזיולוגיים הנמצאים בשימוש סטנדרטי כוללים הקלטות שדה חוץ-תאיות והקלטות תאיות של תא שלם במצב מלחציים מתח או זרם. על מנת לרכוש נתונים אלקטרופיזיולוגיים באיכות גבוהה, בריאות הפרוסה היא הדאגה העיקרית וניתן להבטיח על ידי ביצוע קפדני של הפרוטוקול המוצג. עם זאת, כמו ההכנות פרוסה להציג טכניקה רגישה מאוד, בדיקת איכות צריך להיכלל באופן שגרתי לפני תחילת כל ניסוי. ניתן להשתמש במספר פרמטרים כבדיקת איכות של הפרוסה והם מוערכים באופן סטנדרטי באמצעות עקומות קלט-פלט והקלטות fEPSP או EPSC בסיסיות19. עם זאת, יש לציין כי תכונות אלקטרופיזיולוגיות תת-אופטימליות יכולות לנבוע מטעויות ניסיוניות כגון מיקום אלקטרודה, אוריינטציה או אפילו נזק ואינן מייצגות אך ורק את בריאות הפרוסה המוכנה. לכן, מומלץ לבצע פקדי איכות נוספים כגון הדמיה פשוטה והערכה של התאים תחת מטרה 40x או כתם גרעין DAPI. בדיקות איכות כאלה ניתן להשתמש כדי לאשר בריאות פרוסה קבועה על פני מספר מפגשי הכנה פרוסה.
מיקרופלואורימטריית סידן מציגה טכניקה פחות נפוצה לחקר פרוסות מוח בהיפוקמפוס. עם זאת, טכניקה זו היא בעלת ערך מוסף להקלטות האלקטרודה החוץ-תאית והבלתי תאית הסטנדרטיות, שכן היא מאפשרת לדמיין ולכמת שטפי סידן תאיים, בעלי חשיבות גבוהה באיתות עצבי וסינפטי. שינויים בריכוזי סידן תאיים מעורבים שחרור vesicle נוירוטרנסמיטר, הדור הפוטנציאלי postsynaptic, ויסות פלסטיות סינפטית הולכה עצבית אקסון54,55,56. כהמחשה לטכניקה זו (איור 4), עשינו שימוש בצבע סידן זמין מסחרית. באופן בלתי נמנע, טיפול בפרוסות רקמה עם צבעי סידן יכול להניב קשיים כגון מסגרת זמן ניסיונית מוגברת, כמו גם טעינה לא יעילה של תאים עצביים הממוקמים נמוך יותר. עם זאת, וריאציות על טכניקה זו יכול לשמש כדי לעקוף אתגרים טכניים אלה. לדוגמה, ניתן לשלב מדידות סידן והקלטות מהדק תיקון בפרוסות היפוקמפוס. בדרך זו, צבע פלואורסצנטי סידן יכול להיות טעון לתוך תא מסוים דרך פיפטה תיקון, המאפשר את המדידות של דינמיקת סידן בתא אחד ספציפי שלעניין 57. לחלופין, בעלי חיים מהונדסים גנטית המבטאים את מחוון הסידן, GCaMP58, או במוח כולו, או מונע על ידי פרומוטור ספציפי לתא, יכול לשמש. מעניין, רקמת המוח של בעלי חיים GCaMP עם מקשר ישיר חלבון של עניין יכול לספק הזדמנויות לקבוע את דפוס הביטוי העצבי או לחקור את המעורבות ניצוצות סידן וגלים.
בסך הכל, אנו מספקים את ההנחיות להכנה מוצלחת של פרוסות מוח היפוקמפוס אופקיות בריאות ובת קיימא מעכברים להקלטות אלקטרופיזיולוגיות והדמיה. מתודולוגיה זו שימושית מאוד כדי לגשת לשינויים נוירולוגיים המתרחשים פתולוגיות במוח המתוארים gyrus שקע.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים ליחידה לאלקטרופיזיולוגיה של מרכז VIB-KU Leuven לחקר המוח והמחלות בפיקוחם של ד"ר קימפה וירדה ופרופ' ז'וריס דה וויט על השימוש במתקני המחקר שלהם. יתר על כן, אנו מודים לכל חברי המעבדה לחקר ערוץ היונים ולמעבדה לאנדומטריום, אנדומטריוזיס ורפואת פוריות ב- KU Leuven על הדיונים וההערות המועילים שלהם.
פרויקט זה קיבל מימון מקרן המחקר-פלנדריה (G.084515N ו- G.0B1819N ל- J.V.) ומועצת המחקר של ה- KU Leuven (C1-מימון C14/18/106 ל- J.V.). K.P. היא עמיתת FWO [PEGASUS]2 Marie Skłodowska-Curie וקיבלה מימון מתוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי במסגרת הסכם המענק מארי סקלודובסקי-קירי (665501) עם קרן המחקר פלנדרס (FWO) (12T0317N). ק.ה. הוא פוסט דוקטורנט של קרן המחקר פלנדרס, בלגיה (12U7918N).
Materials
| Name | Company | Catalog Number | Comments |
| Anesthesia chamber | home made - Generic | N/A | plexiglas |
| Anesthesia vaporizer | Dräger & MSS International Ltd | Isoflurane Vapor 19.3 & MSS Isoflurane | to vaporize isoflurane for rodent anesthetization |
| Barrels for the perfusion system | TERUMO | Hypodermic syringes without needle | https://www.terumotmp.com/products/hypodermics/terumo-hypodermic-syringes-without-needle.html |
| Bicuculline methiodide | hellobio | HB0893 | https://www.hellobio.com/bicuculline-methiodide.html |
| Borosilcate glass capillaries | Science Products | GB150F-8P | https://science-products.com/en/shop/micropipette-fabrication-1/capillary-glass-for-micropipette-pullers/borosilicate-glass-capillaries/borosilicate-filament-polished |
| Calcium chlorid dihydrate | Merck | 102382 | https://www.merckmillipore.com/BE/en/product/Calcium-chloride-dihydrate,MDA_CHEM-102382?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Calcium Imaging software | Till Photonics | LiveAcquisition v2.3.0.18 | |
| Carbogen tank | Air Liquide | Alphagaz mix B50 | Gasmixture CO2/O2: 5/95, purity 5 |
| Cluster microelectrode | FHC | CE2C55 | https://www.fh-co.com/product/cluster-microelectrodes/ |
| Culture dish (35 mm) | Corning Life Sciences | 353001 | https://ecatalog.corning.com/life-sciences/b2c/US/en/Cell-Culture/Cell-Culture-Vessels/Dishes%2C-Culture/Falcon®-Cell-Culture-Dishes/p/353001 |
| Culture dish (90 mm) | Thermo Fisher Scientific | 101VR20 | https://www.thermofisher.com/order/catalog/product/101R20#/101R20 |
| Curved forceps | Fine Science tools | 11270-20 | https://www.finescience.de/de-DE/Products/Forceps-Hemostats/Dumont-Forceps/Dumont-7b-Forceps/11270-20 |
| D-AP5 | hellobio | HB0225 | https://www.hellobio.com/dap5.html |
| D-(+)-Glucose monohydrate | Sigma Aldrich | 16301 | https://www.sigmaaldrich.com/catalog/product/sial/16301?lang=en®ion=BE |
| Digital CMOS camera | HAMAMATSU | ORCA-spark C11440-36U | https://www.hamamatsu.com/eu/en/product/type/C11440-36U/index.html |
| Dissection scissors | Fine Science tools | 14058-09 | https://www.finescience.de/de-DE/Products/Scissors/Standard-Scissors/Fine-Scissors-ToughCut®/14058-09 |
| DNQX | hellobio | HB0262 | https://www.hellobio.com/dnqx-disodium-salt.html |
| EMCCD camera | Andor | iXon TM + DU-897E-CSO-#BV | https://andor.oxinst.com/products/ixon-emccd-cameras?gclid=CjwKCAjw97P5BRBQEiwAGflV6ULsKjXfhN2YZxtvsWAmF4QghyXZKuqYHVMa6KU9JyS80ATQkSKeBBoCIM0QAvD_BwE |
| EPC10 USB Double Patch Clamp Amplifier | HEKA Elektronik | 895278 | https://www.heka.com/sales/brochures_down/bro_epc10usb.pdf |
| Filter paper | VWR | 516-0818 | grade 413 |
| Fine brush | Raphael Kaerell | 8204 | Size #1 |
| 18G needle | Henke Sass Wolf Fine-Ject | 18G X 1 1/2" 4710012040 | https://www.henkesasswolf.de/cms/de/veterinaer_produkte/produkte_vet/einmalkanuelen/hsw_henke_ject_einmalkanuelen/ |
| Isoflurane | Dechra Veterinary Products | Iso-Vet 1000mg/g | 250 ml bottle |
| Loctite 406 | Henkel Adhesive technologies | Loctite 406 | Super glue |
| Magnesium sulfate heptahydrate | Merck | 105886 | https://www.merckmillipore.com/BE/en/product/Magnesium-sulfate-heptahydrate,MDA_CHEM-105886?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Micromanipulator | Luigs & Neumann | SM-10 with SM-7 remote control system | https://www.luigs-neumann.org |
| Microscope (for calcium imaging) | Olympus | BX51WI | https://www.olympus-lifescience.com/de/microscopes/upright/bx61wi/ |
| Microscope (for ephys recordings) | Zeiss | Axio Examiner.A1 | https://www.micro-shop.zeiss.com/de/de/system/axio+examiner-axio+examiner.a1-aufrechte+mikroskope/10185/ |
| Microscope light source | CAIRN Research | dual OptoLed power supply | https://www.cairn-research.co.uk/product/optoled/ |
| Monochromator | Till Photonics | Polychrome V | |
| N-Methyl-D-aspartic acid (NMDA) | Sigma Aldrich | M3262 | https://www.sigmaaldrich.com/catalog/product/sigma/m3262?lang=en®ion=BE |
| Oregon Green® 488 BAPTA-1 | Invitrogen Molecular Probes | #06807 | 10x50ug |
| Osmometer | Wescor | 5500 vapor pressure osmometer | to verify osmolarity of salt solutions |
| Peristaltic pump | Thermo Fisher Scientific | Masterflex C/L 77120-62 | https://www.fishersci.be/shop/products/masterflex-peristaltic-c-l-dual-channel-pump-2/p-8004229 |
| pH meter | WTW | inoLab series pH 720 | https://www.geminibv.nl/wp-content/uploads/manuals/wtw-720-ph-meter/wtw-inolab-ph-720-manual-eng.pdf |
| Pipette puller | Sutter Instrument | P-1000 | https://www.sutter.com/MICROPIPETTE/p-1000.html |
| Potassium chlorid | Chem-lab | CL00.1133 | https://www.chem-lab.be/#/en-gb/prod/1393528 |
| Potassium dihydrogen phosphate | Merck | 104873 | https://www.merckmillipore.com/BE/en/product/Potassium-dihydrogen-phosphate,MDA_CHEM-104873?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Razor blade to prepare hemispheres | SPI supplies | Safety Cartridge Dispenser - Pkg/10 | GEM Scientific Single Edge Razor Blades |
| Razor blade for vibratome | Ted Pella Inc | 121-6 | double edge breakable style razor blades (PTFE-coated stainless steel) |
| Recovery chamber | home made - Generic | N/A | to collect and store brain slices in (see details in manuscript) |
| Scissors | Any company | N/A | Blade should be well sharpened and at least 15 cm long for easy decapitation |
| Silver electrode wire | Any company | for recording and reference electrodes | |
| Sodium dihydrogen phosphate dihydrate | Merck | 106342 | https://www.merckmillipore.com/BE/en/product/Sodium-dihydrogen-phosphate-dihydrate,MDA_CHEM-106342?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Sodium hydrogen carbonate | Alfa Aesar | 14707 | https://www.alfa.com/en/catalog/014707/ |
| Sodium chlorid | Fisher Scientific | S/3160/60 | https://www.fishersci.co.uk/shop/products/sodium-chloride-certified-ar-analysis-meets-analytical-specification-ph-eur/10428420 |
| Software for field recordings | HEKA Elektronik | PatchMaster | https://www.heka.com/downloads/software/manual/m_patchmaster.pdf |
| Spatula | Sigma Aldrich | S9147-12EA | https://www.sigmaaldrich.com/catalog/product/sigma/s9147?lang=en®ion=BE |
| Stimulator | A.M.P.I | ISO-FLEX | http://www.ampi.co.il/isoflex.html |
| Sucrose | VWR International Ltd. | 102745C | https://es.vwr-cmd.com/ex/downloads/magazine/lupc_userguide_uk.pdf |
| Tubing for carbogen, perfusion and suction lines 1 | Warner Instruments | 64-0167 | Tygon tubing (TY-50) for standard valve systems |
| Tubing for carbogen, perfusion and suction lines 2 | Fisher Scientific | 800/100/200 & 800/100/280 | Smiths Medical Portex Fine Bore LDPE Tubing |
| Vacuum pump | home made - Generic | N/A | |
| 8 valve multi-barrel perfusion system | home made | N/A | consists of barrels, tubing and a self-made automated valve control (specifications of all purchased parts can be found in this Table) |
| Magnetic valves (to control the perfusion lines) | NResearch Inc. | p/n 161P011 | https://nresearch.com/ |
| Vibratome | Leica | 14912000001 | Semi-automatic vibrating blade microomei VT1200 |
| Water bath | Memmert | WNB 7 | https://www.memmert.be/wp-content/uploads/2019/09/Memmert-Waterbath-WNB-7.en_.pdf |
| Water purification system | Merck | Synergy millipore | to obtain highly purified water |
| 12-well plates | Greiner Bio-One | CELLSTAR, 665180 | http://www.greinerbioone.com/UserFiles/File/Catalogue%202010_11/UK/3680_005-Kapitel1_UK.pdf |
References
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neurology, Neurosurgery, and Psychiatry. 20 (1), 11-21 (1957).
- Cavarsan, C. F., Malheiros, J., Hamani, C., Najm, I., Covolan, L. Is mossy fiber sprouting a potential therapeutic target for epilepsy. Frontiers in Neurology. 9, 1023 (2018).
- Nadler, J. V. The recurrent mossy fiber pathway of the epileptic brain. Neurochemical Research. 28 (11), 1649-1658 (2003).
- Raimondo, J. V., et al. Methodological standards for in vitro models of epilepsy and epileptic seizures. A TASK1-WG4 report of the AES/ILAE translational task force of the ILAE. Epilepsia. 58, 40-52 (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. , 86-98 (2015).
- Tohno, Y., et al. Relationships among the hippocampus, dentate gyrus, mammillary body, fornix, and anterior commissure from a viewpoint of elements. Biological Trace Element Research. 140 (1), 35-52 (2011).
- Maclean, P. D. The limbic system and its hippocampal formation; studies in animals and their possible application to man. Journal of Neurosurgery. 11 (1), 29-44 (1954).
- Petersen, R. P., et al. Electrophysiological identification of medial and lateral perforant path inputs to the dentate gyrus. Neuroscience. 252, 154-168 (2013).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in Brain Research. 163, 3-22 (2007).
- Szirmai, I., Buzsaki, G., Kamondi, A. 120 years of hippocampal schaffer collaterals. Hippocampus. 22 (7), 1508-1516 (2012).
- Cho, S., Wood, A., Bowlby, M. R. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Current Neuropharmacology. 5 (1), 19-33 (2007).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. Journal of Visualized Experiments. (49), e2330 (2011).
- Papouin, T., Haydon, P. G. Obtaining Acute Brain Slices. Bio-protocol. 8 (2), 2699 (2018).
- Li, Q., Han, X., Wang, J. Organotypic hippocampal slices as models for stroke and traumatic brain injury. Molecular Neurobiology. 53 (6), 4226-4237 (2016).
- Lo, D. C., McAllister, A. K., Katz, L. C. Neuronal transfection in brain slices using particle-mediated gene transfer. Neuron. 13 (6), 1263-1268 (1994).
- Lein, P. J., Barnhart, C. D., Pessah, I. N. Acute hippocampal slice preparation and hippocampal slice cultures. Methods in Molecular Biology. 758, 115-134 (2011).
- Magalhaes, D. M., et al. Ex vivo model of epilepsy in organotypic slices-a new tool for drug screening. Journal of Neuroinflammation. 15 (1), 203 (2018).
- Bliss, T., Andersen, P., Morris, R., Amaral, D., O'Keefe, J. . The hippocampus book. , 37-114 (2007).
- Bortolotto, Z. A., Amici, M., Anderson, W. W., Isaac, J. T. R., Collingridge, G. L. Synaptic plasticity in the hippocampal slice preparation. Current Protocols in Neuroscience. 54 (1), 11-26 (2011).
- Al-Osta, I., et al. Imaging calcium in hippocampal presynaptic terminals with a ratiometric calcium sensor in a novel transgenic mouse. Frontiers in Cellular Neuroscience. 12, 209 (2018).
- McLeod, F., Marzo, A., Podpolny, M., Galli, S., Salinas, P. Evaluation of synapse density in hippocampal rodent brain slices. Journal of Visualized Experiments. (128), e56153 (2017).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. 1183, 221-242 (2014).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording synaptic plasticity in acute hippocampal slices maintained in a small-volume recycling-, perfusion-, and submersion-type chamber system. Journal of Visualized Experiments. (131), e55936 (2018).
- Zhou, Q., Abe, H., Nowak, T. S. Immunocytochemical and in situ hybridization approaches to the optimization of brain slice preparations. Journal of Neuroscience Methods. 59 (1), 85-92 (1995).
- Koike-Tani, M., Tominaga, T., Oldenbourg, R., Tani, T. Birefringence changes of dendrites in mouse hippocampal slices revealed with polarizing microscopy. Biophysical Journal. 110 (10), 2366-2384 (2020).
- Ting, J. T., et al. Preparation of acute brain slices using an optimized N-Methyl-D-glucamine protective recovery method. Journal of Visualized Experiments. (132), e53825 (2018).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8 (9), 745-752 (2011).
- Hua, Y., Keep, R. F., Hoff, J. T., Xi, G. Brain injury after intracerebral hemorrhage: the role of thrombin and iron. Stroke. 38, 759-762 (2007).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Paxinos, G., Franklin, K. . The Mouse Brain In Stereotaxic Coordinates. 3 edn. , 256 (2008).
- Lacar, B., Young, S. Z., Platel, J. C., Bordey, A. Preparation of acute subventricular zone slices for calcium imaging. Journal of Visualized Experiments. (67), e4071 (2012).
- Schauer, C., Leinders-Zufall, T. Imaging calcium responses in GFP-tagged neurons of hypothalamic mouse brain slices. Journal of Visualized Experiments. (66), e4213 (2012).
- Tetteh, H., Lee, J., Lee, J., Kim, J. G., Yang, S. Investigating Long-term Synaptic Plasticity in Interlamellar Hippocampus CA1 by Electrophysiological Field Recording. Journal of Visualized Experiments. (150), e59879 (2019).
- Smith, C. J., et al. Investigations on alterations of hippocampal circuit function following mild traumatic brain injury. Journal of Visualized Experiments. (69), e4411 (2012).
- McNaughton, B. L. Evidence for two physiologically distinct perforant pathways to the fascia dentata. Brain Research. 199 (1), 1-19 (1980).
- Colino, A., Malenka, R. C. Mechanisms underlying induction of long-term potentiation in rat medial and lateral perforant paths in vitro. Journal of Neurophysiology. 69 (4), 1150-1159 (1993).
- Coulter, D. A., Carlson, G. C. Functional regulation of the dentate gyrus by GABA-mediated inhibition. Progress in Brain Research. 163, 235-243 (2007).
- Kuenzi, F. M., Fitzjohn, S. M., Morton, R. A., Collingridge, G. L., Seabrook, G. R. Reduced long-term potentiation in hippocampal slices prepared using sucrose-based artificial cerebrospinal fluid. Journal of Neuroscience Methods. 100 (1-2), 117-122 (2000).
- Connor, S. A., et al. Loss of synapse repressor MDGA1 enhances perisomatic inhibition, confers resistance to network excitation, and impairs cognitive function. Cell Reports. 21 (13), 3637-3645 (2017).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Moodley, K. K., Chan, D. The hippocampus in neurodegenerative disease. Frontiers of Neurology and Neuroscience. 34, 95-108 (2014).
- Kong, H., et al. Inhibition of miR-181a-5p reduces astrocyte and microglia activation and oxidative stress by activating SIRT1 in immature rats with epilepsy. Laboratory Investigation; A Journal of Technical Methods and Pathology. , (2020).
- Skrede, K. K., Westgaard, R. H. The transverse hippocampal slice: a well-defined cortical structure maintained in vitro. Brain Research. 35 (2), 589-593 (1971).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Wang, T., Kass, I. S. Preparation of brain slices. Methods in Molecular Biology. 72, 1-14 (1997).
- Garthwaite, J., Woodhams, P. L., Collins, M. J., Balazs, R. On the preparation of brain slices: morphology and cyclic nucleotides. Brain Research. 173 (2), 373-377 (1979).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments: JoVE. (91), e51706 (2014).
- Aydin-Abidin, S., Abidin, &. #. 3. 0. 4. ;. 7,8-Dihydroxyflavone potentiates ongoing epileptiform activity in mice brain slices. Neuroscience Letters. 703, 25-31 (2019).
- Xiong, G., Metheny, H., Johnson, B. N., Cohen, A. S. A comparison of different slicing planes in preservation of major hippocampal pathway fibers in the mouse. Frontiers in Neuroanatomy. 11, 107 (2017).
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Reid, K. H., Edmonds, H. L., Schurr, A., Tseng, M. T., West, C. A. Pitfalls in the use of brain slices. Progress in Neurobiology. 31 (1), 1-18 (1988).
- Brini, M., Calì, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences: CMLS. 71 (15), 2787-2814 (2014).
- Gleichmann, M., Mattson, M. P. Neuronal calcium homeostasis and dysregulation. Antioxidants & Redox Signaling. 14 (7), 1261-1273 (2011).
- Padamsey, Z., Foster, W. J., Emptage, N. J. Intracellular Ca(2+) release and synaptic plasticity: a tale of many stores. The Neuroscientist: A Review Journal Bringing Neurobiology, Neurology and Psychiatry. 25 (3), 208-226 (2019).
- Chen-Engerer, H. J., et al. Two types of functionally distinct Ca2+ stores in hippocampal neurons. Nature Communications. 10 (1), 3223 (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 32 (40), 13819-13840 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved