Method Article
Horizontale Hippocampal Scheiben der Maus Gehirn
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieser Artikel zielt darauf ab, ein systematisches Protokoll zu beschreiben, um horizontale Hippocampus-Gehirnscheiben bei Mäusen zu erhalten. Das Ziel dieser Methode ist es, die Integrität von Hippocampus-Faserwegen zu erhalten, wie dem Perforantenweg und dem moosigen Fasertrakt, um dentate Gyrus-bezogene neurologische Prozesse zu bewerten.
Zusammenfassung
Der Hippocampus ist eine hochorganisierte Struktur im Gehirn, die ein Teil des limbischen Systems ist und an der Gedächtnisbildung und -konsolidierung sowie der Manifestation schwerer Hirnerkrankungen, einschließlich Alzheimer und Epilepsie, beteiligt ist. Der Hippocampus erhält ein hohes Maß an Intra- und Interkonnektivität, was eine korrekte Kommunikation mit internen und externen Gehirnstrukturen gewährleistet. Diese Konnektivität erfolgt über verschiedene Informationsflüsse in Form von Faserwegen. Gehirnscheiben sind eine häufig verwendete Methode bei der Erforschung neurophysiologischer Funktionen des Hippocampus. Hippocampal Gehirnscheiben können für verschiedene Anwendungen verwendet werden, einschließlich elektrophysiologischer Aufnahmen, lichtmikroskopische Messungen sowie verschiedene molekularbiologische und histochemische Techniken. Daher stellen Gehirnscheiben ein ideales Modellsystem dar, um Proteinfunktionen zu bewerten, pathophysiologische Prozesse zu untersuchen, die an neurologischen Störungen beteiligt sind, sowie für Die Entdeckungszwecke von Medikamenten.
Es gibt verschiedene Möglichkeiten der Scheibenvorbereitung. Hirnscheibenpräparate mit einem Vibram ermöglichen eine bessere Erhaltung der Gewebestruktur und garantieren eine ausreichende Sauerstoffversorgung beim Schneiden, die Vorteile gegenüber der herkömmlichen Verwendung eines Gewebehäckslers bietet. Darüber hinaus können verschiedene Schneidebenen für Vibratome GehirnScheibenpräparate angewendet werden. Hier wird ein detailliertes Protokoll für eine erfolgreiche Vorbereitung von vibratomegeschnittenen horizontalen Hippocampusscheiben von Maushirnen zur Verfügung gestellt. Im Gegensatz zu anderen Scheibenpräparaten ermöglicht das horizontale Schneiden, die Fasern des Hippocampus-Eingangspfades (Perforantenpfad) in einem vollständig intakten Zustand innerhalb einer Scheibe zu halten, was die Untersuchung von entorhinal-hippocampalen Wechselwirkungen erleichtert. Hier bieten wir ein gründliches Protokoll für die Zerlegung, Extraktion und akute horizontale Schneide des murinen Gehirns, und diskutieren Herausforderungen und mögliche Fallstricke dieser Technik. Schließlich werden wir einige Beispiele für die Verwendung von Gehirnscheiben in weiteren Anwendungen zeigen.
Einleitung
Die umfangreiche Erforschung des Hippocampus begann, als Scoville und Milner die Unfähigkeit eines Patienten (H.M.) berichteten, nach der chirurgischen Entfernung des Hippocampus und der nahegelegenen temporalen Lappenstrukturen als Behandlung für schwere Epilepsie ein neues, deklaratives Gedächtnis zu bilden1. Von diesem Moment an wurde der Hippocampus ausgiebig untersucht, beginnend mit allgemeinen neuronalen Eigenschaften und Funktionen bis hin zur Entwicklung schwerer Hirnerkrankungen, wie Epilepsie und Alzheimer-Krankheit2,3,4,5. Der Hippocampus ist Teil des limbischen Systems, bestehend aus einer Gruppe verwandter Gehirnstrukturen, die an Emotion und Gedächtnisbildung beteiligt sind6,7. Ein dichtes Netzwerk aus mehreren Faserwegen erreicht eine enge Hippocampus-Konnektivität zu internen und externen Gehirnstrukturen. Diese Wege umfassen den medialen und seitlichen perforanten Pfad (entorhinaler Kortex zum Dentat Gyrus, CA3 – CA1 und Subiculum)8, den moosigen Faserpfad (dentate gyrus to CA3)9 und den Schaffer Collateral/Associational Commissural Path (CA3 to CA1)10 (Abbildung 1). Der Hippocampus präsentiert eine der am weitesten verbreiteten Gehirnbereiche bisher wegen seiner hochkonservierten laminaren Organisation der neuronalen Schichtbildung, und die Möglichkeit, lebenswichtige neuronale Kulturen und Gehirnscheiben mit relativer Leichtigkeit zu erhalten5.
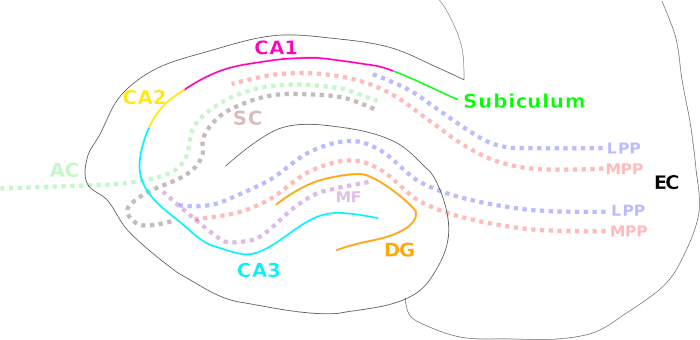
Abbildung 1: Cartoon, der die verschiedenen Hippocampusregionen und Hauptfaserpfade veranschaulicht. Die verschiedenen Hippocampus-Regionen sind durch einfarbige Linien gekennzeichnet: entorhinaler Kortex (EC; schwarz), Dentate Gyrus (DG; orange), Cornu Ammonis (CA) 3 (Cyan), 2 (gelb) und 1 (Magenta) und das Subiculum (grün). Faserwege werden mit einer farbigen gepunkteten Linie dargestellt: der mediale (MPP, rot) und der seitliche Perforantenweg (LPP, blau) (vom entorinalen Kortex bis zum Dentate Gyrus, CA3, CA1 und Subiculum), dem moosigen Faserweg (MF, violett) (vom Dentate Gyrus zu CA3) und den Schaffer-Kollateralen (SC, braun) (ipsilateral von CA3 bis CA1)/Assoziations-Kommissarionswegen (AC, hellgrün) (kontralateral von CA3 bis CA1). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Hirnschnittprotokolle führen oft zum Verlust von Verbindungen aus weiter entfernten Hirnbereichen zum Interessengebiet5. Darüber hinaus sind die Kapillaren nicht mehr funktionsfähig5 und die Durchblutung wird11beraubt. Trotz dieser Einschränkungen, Gehirnscheiben werden immer noch in erster Linie für die Untersuchung der neurophysiologischen Funktionen des Hippocampus aufgrund einer Reihe von Vorteilen verwendet. Erstens ist die Extraktion des Hippocampus schnell12 und erfordert nicht viele Materialien. Zu den einzigen wesentlichen Instrumenten gehören ein Sezierset, ein Laborwasserbad, der Zugang zum Carbogen und ein vibrierendes Mikrotome (Vibratome)13. Weitere Vorteile der Hirnscheibentechnik sind die Umgehung der Blut-Hirn-Schranke (BBB) und das Auswaschen endogen freigesetzter Moleküle vor Beginn des Experiments5, wodurch es möglich ist, die Wirkung von Medikamenten mit relativ präziser Dosierungskontrolle zu untersuchen14. Darüber hinaus bewahren Gehirnscheiben die Zyto-Architektur und synaptische Schaltkreise innerhalb des Hippocampus15,16, wo die Neuroanatomie und die lokale Umgebung mit neuronaler Konnektivität und komplexen neuron-glia Wechselwirkungen erhalten bleiben4,11,17. Darüber hinaus sind Hippocampus-Faserverbindungen überwiegend unidirektionale und hippocampale Neuronen haben eine hohe synaptische Plastizität, die die Erfassung und Interpretation hochwertiger elektrophysiologischer Aufnahmen enorm vereinfacht, um neurologische Prozesse zu verstehen18,19. Wichtig ist, dass Gehirnscheiben ein wertvolles Gut darstellen, das in einer Vielzahl unterschiedlicher wissenschaftlicher Techniken anwendbar ist, von molekularbiologischen Techniken über bildgebende Aufnahmen bis hin zu elektrophysiologischen Messungen12,20,21,22,23,24,25,26.
Wie oben beschrieben, präsentieren Hippocampus-Gehirnscheiben ein leistungsfähiges experimentelles Werkzeug, um strukturelle und funktionelle Merkmale der synaptischen Konnektivität zu untersuchen. Dies bietet die Möglichkeit, die Auswirkungen von Chemikalien oder Mutationen auf die neuronale Erregbarkeit und Plastizität16zu bewerten.
Akute Hirnscheibenpräparate präsentieren eine relativ empfindliche Technik und die optimale Schnittqualität hängt stark von idealen Versuchsbedingungen ab, einschließlich des Alters des Tieres, der Euthanasiemethode, der Geschwindigkeit des Sezierens und Schneidens, der Schneidlösungen und Parameter (z.B. Schnittgeschwindigkeit) sowie der Bedingungen für die Scheibenrückgewinnung4. Daher ist ein gut konzipiertes Protokoll von größter Bedeutung und sichert die Reproduzierbarkeit über verschiedene Forschungseinheitenhinweg 13.
Hier stellen wir ein detailliertes Protokoll für akute horizontale Hippocampus-Scheibenpräparate zur Verfügung, mit dem Ziel, die Integrität des hippocampalen seitlichen und medialen Perforantenwegs und des moosigen Faserwegs zu erhalten, was die Untersuchung von Dentate-Gyrus-Prozessen ermöglicht9. Wir werden die wichtigsten Schritte zum Sezieren, Extrahieren und horizontalen Schneiden des murinen Gehirns beschreiben, gefolgt von repräsentativen Ergebnissen von Calcium-mikrofluortrimetrischen Aufzeichnungen und feldexzitatorischen postsynaptischen Potentialaufnahmen (FEPSPs) unter Basisbedingungen und während der LTP-Induktionsprotokolle in Hirnscheiben von Wild-Typ-C57BL/6J-Mäusen.
Protokoll
Alle Tierversuche für diese Studie wurden vom Ethik-Review-Ausschuss der KU Leuven (Belgien) genehmigt (P021/2012).
1. Herstellung von hochsacchariner Scheibenlösung und künstlicher Zerebrospinalflüssigkeit (ACSF)
- Vor dem Experimentaltag
- Bereiten Sie 1 L 10x Scheibenvorlösung mit Labortyp 1 Wasser vor, das (in mM) enthält: 25 KCl, 20 CaCl2, 10 MgSO4, 12.5 KH2PO4 (Tabelle 1). Um Kalziumphosphatfällung zu verhindern, mischen Sie die Chemikalien langsam in einem becherten, mit 800 mlH2O vorgefüllten Becher, während Sie ständig mit einem Magnetischen Rührer rühren. Bewahren Sie die Lösung bei 4 °C oder Raumtemperatur (RT) auf.
- Am Experimentaltag
- Bereiten Sie 1 L von 1x ACSF mit Laborqualität Typ 1 Wasser mit (in mM): 125 NaCl, 2.5 KCl, 2 CaCl2, 1 MgSO4, 1.25 NaH2PO4, 26 NaHCO3, 25 Glucose (Tabelle 2). Verwenden Sie ein Dampfdruckosmometer, um die Osmolarität zwischen 305–315 mOsm (pH-Wert 7,55–7,6) zu validieren.
HINWEIS: Um Kalziumphosphatfällung zu verhindern, mischen Sie langsam alle festen Chemikalien in einem Becher, der mit 800 mlH2O vorgefüllt ist, während Sie ständig mit einem Magnetischen Rührer rühren. Fügen Sie MgSO4 und CaCl2 ganz am Ende hinzu und tropfen Sie langsam die notwendige Menge von 1 M Lagerlösungen. - Kontinuierlich Blase 1x ACSF-Lösung bei RT mit Carbogen, um pH-Wert zwischen 7.3–7.4 einzustellen.
HINWEIS: Wenn der pH-Wert etwas zu hoch oder zu niedrig ist, würden kleine Anpassungen der Karbogenationsfestigkeit ausreichen. Wenn der pH-Wert mit Carbogenation höher als 7,45 ist, stellen Sie ihn ein, indem Sie einige Tropfen von 1 M NaH2PO4 Lösung hinzufügen. - 250 ml (pro Gehirn) der 1x Hochsaccharosen-Scheibenlösung in einem Becher mit 25 ml 10x Scheibenvorlösung und (in mM): 252 Saccharose, 26 NaHCO3und 10 Glucose(Tabelle 3) vorbereiten Stellen Sie sicher, dass die Osmolarität zwischen 320 und 325 mOsm liegt (pH-Wert 7,55–7,6).
- Blasen Sie die Hochsaccharose-Scheibenlösung für 10-15 min mit Carbogen, um den pH-Wert zwischen 7,3 und 7,4 zu steuern.
HINWEIS: Wenn der pH-Wert mit Carbogenation höher als 7,45 ist, stellen Sie ihn ein, indem Sie ein paar Tropfen von 1 M KH2PO4 Lösung hinzufügen. - Bewahren Sie die Hochsaccharose-Scheibenlösung für 20–30 min im Ultra-Gefrierschrank (-80 °C) auf, bis sie teilweise eingefroren ist.
- Bereiten Sie 1 L von 1x ACSF mit Laborqualität Typ 1 Wasser mit (in mM): 125 NaCl, 2.5 KCl, 2 CaCl2, 1 MgSO4, 1.25 NaH2PO4, 26 NaHCO3, 25 Glucose (Tabelle 2). Verwenden Sie ein Dampfdruckosmometer, um die Osmolarität zwischen 305–315 mOsm (pH-Wert 7,55–7,6) zu validieren.
2. Vorbereitung des Arbeitsbereichs für die Hirnsektion
- Während der Abkühlung der Hochsaccharose-Scheibenlösung Folgendes vorbereiten.
- Das Wasserbad auf 32 °C aufwärmen.
- Füllen Sie die Rückgewinnungskammer (Abbildung 2A) mit der karbogenierten ACSF-Lösung und legen Sie die Kammer in das Wasserbad. Tragen Sie den Carbogen kontinuierlich auf die ACSF-Hauptflasche und den ACSF in der Rückgewinnungskammer auf.
- Usher das Tier in den Versuchsraum.
HINWEIS: Alter, Geschlecht und Stamm des Tieres müssen vom einzelnen Experimentator bestimmt werden und sind von der spezifischen Studienfrage abhängig. Die Parameter des Tieres sollten jedoch innerhalb einer Studie konstant bleiben, um die Vergleichbarkeit zwischen den verschiedenen Versuchstage zu gewährleisten. Dieses Protokoll wurde für die Verwendung von männlichen C57BL/6J-Mäusen im Alter von 2–6 Wochen entwickelt. Wenn ältere Tiere verwendet werden, müssen Slice- und Recovery-Lösungen möglicherweiseentsprechendangepasst werden 4,27 (z.B. NMDG+-basierte Lösungen23,28), um die Gesundheit des Gehirns der akuten Scheiben zu erhalten. - Bereiten Sie die Anästhesiekammer vor.
- Auslegen von Tissuepapier, Kunststoff Pasteur Pipette mit breiter Öffnung (aufgeschnitten), 90 mm Kulturschale mit Eis gefüllt, ein Quadrat aus Filterpapier auf der Oberseite der gekühlten Kulturschale, starke Schere zur Enthauptung, Sezierschere, gekrümmte Zange, Spachtel, 35 mm Kulturschale, feine Bürste, Klinge, Probenplatte (kommt mit Vibratom), Superkleber, Pipettespitze, vier Riemen Filterpapier (ca. 2 cm x 0,5 cm)
- Setzen Sie das Vibratom ein: Programmieren Sie zunächst das Vibratom für die richtigen Einstellungen (Blattfahrgeschwindigkeit: 0,08 mm/s, Schnittamplitude: 1,4 mm, Schnittfrequenz: 85 Hz) und befestigen Sie die Carbogen-Linie in der Scheibenkammer. Als nächstes legen Sie die Scheibenkammer in den Halter, füllen Sie den Halter um die Scheibenkammer mit Eis und befestigen Sie alles am Vibratom. Schließlich legen Sie die Rasierklinge in den Vibratom-Blatthalter (Abbildung 2B).
- Führen Sie nach dem Einfrieren der Hochsaccharoselösung die folgenden Schritte aus.
- Nach 20–30 min die Hochsaccharose-Scheibenlösung aus dem -80 °C-Ultra-Gefrierschrank nehmen und den Becher auf Eis halten.
- Legen Sie die Hochsaccharose-Lösung neben das Vibratome auf Ihre Bank, zerkleinern und mischen Sie die teilweise gefrorene Lösung mit einem Spachtel, um einen schönen Schlamm zu bekommen und mit Carbogen zu sprudeln.
- Nehmen Sie einige hochsaccharate Scheibenlösung mit der Kunststoff Pasteur Pipette, um das quadratische Filterpapier auf der gekühlten 90 mm Kulturschale einzuweichen.
- Füllen Sie die 35 mm Kulturschale (oder einen gleichwertigen kleinen Behälter, der geeignet ist, das ganze Gehirn zu speichern) bis zu 75% mit der Hochsaccharose-Scheibenlösung (ausreichend, um das ganze Gehirn zu bedecken) und kühlen Sie die Kulturschale auf Eis, die neben dem Becher mit dem Rest der Lösung aufbewahrt wird. Carbogenatdie Lösung in der 35 mm Kulturschale.
3. Zerlegung und Positionierung des murinen Gehirns
- Anästhesisieren Sie das Tier mit 5% Isofluran. Bestimmen Sie die richtige Tiefe der Anästhesie, indem Sie die Pfote kneifen. Es sollte kein Pfotenentzugsreflex auftreten.
- Das Tier auf Tissuepapier übertragen und mit einer starken Schere oder einer kleinen Tierguillotine enthaupten.
- Verwenden Sie Eine Sezierschere, um die Kopfhaut zu öffnen.
- Schneiden Sie die Calvaria entlang der sagittalen Naht auf und entfernen Sie sie mit Hilfe von gekrümmten Zangen, bis das gesamte Gehirn, einschließlich der riechhaften Glühbirnen, sichtbar ist.
HINWEIS: Achten Sie darauf, das Gehirn nicht mit den scharfen Kanten der Calvaria oder Zange zu beschädigen. - Verwenden Sie einen Spachtel, um das Gehirn sorgfältig auszuhöhlen (Olfaktor-Lampen sollten befestigt bleiben).
- Übertragen Sie das Gehirn in der gekühlten 35-mm-Kulturschale und entfernen Sie alle Haare oder Blutpartikel aus dem Gewebe, indem Sie das Gehirn sanft mit einer ACSF-gefüllten Pasteurpipette waschen (Blut hat zytotoxische Wirkungen auf das Hirngewebe29).
- Übertragen Sie das Gehirn mit Hilfe des Spachtels auf das eingeweichte Filterpapier auf der gekühlten 90 mm Kulturschale (Abbildung 2A).
- Verwenden Sie eine Klinge, um das Gehirn zu halbieren, die beiden Hemisphären zu trennen, und legen Sie beide Hemisphären auf der frisch geschnittenen medialen Seite.
- Verwenden Sie eine Klinge, um den dorsalen Teil zu entfernen (5%–10%) des Gehirns aus jeder Hemisphäre mit einem parallelen Schnitt zum dorsalen Oberteil (Abbildung 2C)30 und legen Sie beide Hemisphären auf die frisch geschnittene Seite mit dem ventralen Teil des Gehirns nach oben gerichtet.
- Positionieren Sie einen Tropfen Superkleber auf der Probenplatte und verteilen Sie sie ordnungsgemäß mit einer Pipettenspitze, um beide Hemisphären aufzunehmen.
- Verwenden Sie ein Filterpapierband, um eine Hemisphäre mit Kapillarkräften aufzunehmen, indem Sie die ventrale Seite mit dem Filterpapierband berühren und dadurch das Gewebe nicht beschädigen.
- Verwenden Sie ein anderes Filterpapierband, um die Rückenseite des Gehirns sorgfältig halbtrocknen zu lassen, bevor Sie die Hemisphäre mit der dorsalen Seite auf dem Kleber auf der Probenplatte positionieren. Wiederholen Sie das gleiche Verfahren mit der zweiten Hemisphäre.
ANMERKUNG: Die Hemisphären sollten in horizontaler Ausrichtung in gespiegelter Weise auf der Vibramplatte positioniert werden, wobei die rostralen Seiten nach außen zeigen und die kaudalen Seiten einander in der Mitte zeigen (aber nicht berühren). Die medialen Seiten beider Hemisphären sollten auf die Vibratomklinge und die Seiten seitenauf dem Experimentator zeigen (Abbildung 2D). - Die Probenplatte in die Schneidkammer legen und schnell, aber vorsichtig, mit eiskaltem Hochsukrose-Scheibenlösungsschlamm bedecken. Sobald die Lösung den Kleber berührt, wird sie verfestigen und die Hemisphären richtig auf die Probenplatte kleben.
- Stellen Sie sicher, dass die Hemisphären ordnungsgemäß mit hochsucrose Scheibenlösung bedeckt sind und bestätigen Sie, dass die Lösung mit Carbogen geblasen wird.
HINWEIS: Der gesamte Seziervorgang sollte so schnell wie möglich durchgeführt werden. Bitte stellen Sie sicher, dass das Gehirn nicht ohne sauerstoffreiche Versorgung für eine sehr lange Zeit bleibt. Es sollte nur etwa 1–1,5 min von der Enthauptung bis zum Untertauchen des Gehirns in die hochsukrose Scheibenlösung Schlamm dauern. Dies ist die wichtigste Voraussetzung für akute Hirnscheibenpräparate, um eine hohe Qualität der Scheibe zu rechtfertigen.
4. Horizontales Schneiden des Gehirns
- Positionieren Sie die Vibratomklinge vor der medialen Seite der Hemisphären und senken Sie sie auf die gleiche Höhe wie die ventralen Seiten der Hemisphären, die jetzt nach oben zeigen. Senken Sie die Klinge mit Hilfe der Vibratom-Steuerung auf 600 m weiter in die Dorsalrichtung und beginnen Sie zu schneiden. Die Klinge sollte das Gewebe treffen (wenn nicht, kehren Sie die Klinge um und senken Sie sie ein wenig mehr). Schneiden, bis die ersten beiden Scheiben vollständig von den beiden Hemisphären getrennt sind.
- Umkehren Sie die Klinge und senken Sie weitere 300 m und schneiden Sie sie erneut ab.
- Wenn der Hippocampus sichtbar wird (verwenden Sie die Maus31 Gehirnatlas für Hilfe, falls erforderlich) (Abbildung 2E) sammeln Sie die Scheiben mit der erweiterten Kunststoff Pasteur Pipette. Sammeln Sie die Scheiben, bis das Caudate Putamen neben dem Hippocampus sichtbar wird. In der Regel können für das Maushirn zwischen 8 und 12 Scheiben von 300 m (4–6 pro Hemisphäre) gesammelt werden.
- Verwenden Sie die Kunststoff Pasteur Pipette, um die Scheiben zu sammeln und übertragen Sie sie in die Rückgewinnungskammer im Wasserbad(Abbildung 2F) (sammeln Sie Scheiben nach jeder Runde des Schneidens, um zu verhindern, dass sie in der Scheibenkammer herumschwimmen).
HINWEIS: Arbeiten Sie so schnell wie möglich und stellen Sie sicher, dass die Hochsucrose-Scheibenlösung während des gesamten Verfahrens eiskalt und kariert ist. Falls erforderlich, füllen Sie das Eis um die Scheibenkammer herum.
5. Wiederherstellung von Hirnscheiben für elektrophysiologische Aufnahmen
- Lassen Sie die Scheiben in der ACSF-gefüllten Rückgewinnungskammer im 32 °C-Wasserbad 1 h.
HINWEIS: Rückgewinnungskammern sind auch im Handel erhältlich. - Nehmen Sie die Rückgewinnungskammer aus dem Wasserbad.
- Platzieren Sie die Scheiben bei RT für mindestens weitere 30 min für die Wiederherstellung, bevor Sie mit einer weiteren Anwendung beginnen.
6. fEPSP-Aufnahmen im medialen Perforantenpfad (MPP) des Hippocampus
- Ziehen Sie Aufnahmepipetten aus Borosilikatglaskapillaren mit einem horizontalen Pipettenzieher, um Pipetten in der Größe von 2 Mio. € zu empfangen, wenn sie mit ACSF-Lösung gefüllt und in die ACSF-gefüllte Aufnahmekammer eingetaucht sind.
- Füllen Sie ACSF-Badlösung und ACSF-Lösung mit den entsprechenden Chemikalien (z. B. Bicuculline) in einem schwerkraftgesteuerten Multi-Barrel-Perfusionssystem, das mit der Aufnahmekammer verbunden ist. Kontinuierlich alle Lösungen verkörpern.
- Schalten Sie eine Peristaltik- oder Vakuumpumpe ein, die mit einem Saugschlauch verbunden ist, der gegenüber der Perfusionsleitung in der Aufnahmekammer endet. Öffnen Sie den ACSF-gefüllten Lauf und beginnen Sie, einen kontinuierlichen Fluss (1–2 Tropfen pro Sekunde) zu etablieren. Stellen Sie sicher, dass die Referenzelektrode in die ACSF-Lösung eingetaucht ist.
- Schalten Sie den Einrichtungscomputer, den Verstärker, den Mikromanipulator, den Stimulator, das Mikroskoplicht(n), die Kamera und den Monitor (falls zutreffend) ein.
- Öffnen Sie die entsprechende Software für elektrophysiologische Aufnahmen (es gibt mehrere verschiedene Hardware- und Softwareanbieter für elektrophysiologische Geräte).
- Übertragen Sie eine Hirnscheibe-Hemisphäre aus der Rückgewinnungskammer in die Aufnahmekammer des Slice-Setups und positionieren Sie sie in der richtigen Ausrichtung mit der Dentat-Gyrus-Granulatzellschicht und der molekularen Schicht im Sichtfeld. Stellen Sie sicher, dass die Stimulationselektrode das MPP in der Scheibe aus der Richtung des entorhinalen Kortex erreichen kann und dass die Aufnahmeelektrode von der genau gegenüberliegenden Seite aus der Richtung ca3 Zugang zum MPP hat.
- Stabilisieren Sie die Scheibe in der Aufnahmekammer mit einer Büroklammer (Abbildung 3A) oder einem handelsüblichen Gehirnscheibenraster.
HINWEIS: Es kann hilfreich sein, die Perfusion während der Slice-Übertragung und Positionierung auszuschalten. Dies sollte jedoch nicht zu lange dauern, um die Qualität der Gehirnscheibe zu garantieren. - Senken und positionieren Sie die Aufnahme- und Stimulationselektroden im MPP im unteren Drittel der Molekülschicht in der Nähe der Granulatzellschicht (Abbildung 3B),die sich in einem Abstand von ca. 100–150 m gegenüberstehen. Die Stimulationselektrode sollte minimal mit der Oberfläche in Berührung kommen, während die Aufnahmeelektrode die obere Scheibenschicht leicht infiltrieren sollte.
- Wenden Sie einen Stimulus mit niedriger Intensität (30–50 A für 0,1 ms) auf die Hirnscheibe an, um das fEPSP-Signal zu erhalten. Passen Sie ggf. die Position der Elektroden an (z. B. niedriges oder atypisch geformtes fEPSP-Signal).
- Beginn der Aufnahme von Input-Output-Kurven: Wenden Sie in Intervallen von 30 s steigende Stimulusintensitäten auf die Hirnscheibe an.
- Legen Sie die Stimulusintensität auf 50 % der maximalen fEPSP-Antwort fest und starten Sie die Basis-fEPSP-Aufnahmen, die die 50%-Stimulusintensität für 20–40 min in 30 s Intervallen auf die Gehirnscheibe anwenden.
- Wenn die Baseline stabil zu sein scheint, fahren Sie mit zusätzlichen Aufzeichnungen fort (z. B. LTP/LTD-Protokolle und/oder Arzneimittelanwendungen). (Für die LTP-Induktion im MPP wurde hier ein Protokoll verwendet, das aus viermal 1 s 100 Hz-Impulsen besteht, die in einem Intervall von 5 min angewendet werden. Bicuculline wurde 10 min vor und während der Konditionierungsphase angewendet.)
HINWEIS: Alle Aufnahmen sollten im aktuellen Klemmmodus mit entsprechender Tiefpassfilterung (<5 kHz) und Abtastraten (>10 kHz) durchgeführt werden. - Extrahieren Sie die Daten in einem geeigneten Dateiformat, und analysieren Sie fEPSP-Parameter wie Faservolley, fEPSP-Amplitude und fEPSP-Neigung.
7. Calcium-Bildgebungsaufnahmen von Hirnscheiben
- Übertragen Sie eine Gehirnscheibe In einer 12-Well-Kammer und laden Sie sie für 30 min bis 1 h mit einem geeigneten Kalziumfarbstoff. Die Ladelösung kontinuierlich verkarnieren, indem sie ein Carbogenationsrohr durch ein selbstgebautes Loch (mit einer heißen 18G-Nadel) in den Deckel der 12-Well-Platte einlegt.
HINWEIS: Dieser Schritt ist nicht notwendig, wenn Hirnscheibenpräparate von genetisch veränderten Tieren, die endogen einen fluoreszierenden Reporter wie GCaMP ausdrücken. - Bereiten Sie das Aufzeichnungssetup wie in den Schritten 6.2–6.5 beschrieben vor.
HINWEIS: Für mikrofluorimetrische Bildgebungsexperimente sind keine Verstärker oder Mikromanipulator erforderlich. Der Einsatz eines Stimulaators ist experimenteabhängig. Spezifische Software für Fluoreszenz-Bildgebungsexperimente ist unerlässlich. - Passen Sie die Software an die richtigen Bildeinstellungen an: Dazu gehören Kameraverstärker und Binning-Einstellung, Einstellung der Wellenlänge, Belichtungszeit und Timing-Protokoll. Die Einstellungen können je nach den genauen Experimenten variieren. (Für die Beispielspuren wurden 1 x 1 Binning, 2,4x Vorverstärkerverstärkung, 300 EM Kameraverstärkung, Belichtung von 50 ms bei 488 nm alle 500 ms für die Dauer des Experiments wiederholt.)
- Übertragen Sie nach dem Beladen mit dem Kalziumfarbstoff die Hirnscheibe von der 12-Well-Indiek in die Aufnahmekammer und positionieren Sie sie auf der Mikroskopstufe.
- Stabilisieren Sie die Scheibe in der Aufnahmekammer mit einer Büroklammer (Abbildung 3A) oder einem handelsüblichen Gehirnscheibenraster ähnlich dem in Schritt 6.7 beschriebenen.
- Stellen Sie sicher, dass der Interessenbereich im richtigen mikroskopischen Feld und im Fokus liegt.
- Verwenden Sie die Fluoreszenz-Bildgebungssoftware, um mehrere Bereiche von Interesse (ROIs) auf Ihrem Slice auszuwählen.
HINWEIS: Es kann nützlich sein, das gesamte Sichtfeld auszuwählen, um den allgemeinen Helligkeitsschwankungen aufgrund von Photobleichungen zu folgen. - Starten Sie die Aufnahme und wenden Sie die experimentellen Testmedikamente zu ausgewählten Zeitpunkten an.
HINWEIS: Es ist ratsam, am Ende jedes Experiments eine hohe K+ Lösung anzuwenden, um den neuronalen Charakter der Zellen und die Schnittqualität zu überprüfen. - Extrahieren Sie die Daten in einem geeigneten Dateiformat, und analysieren Sie die Fluoreszenzsignaländerungen, die in den ROIs während der gesamten Messung auftreten. ROIs können auch während der Off-Line-Analyse angepasst werden.
HINWEIS: Andere Protokolle, die fEPSP-Aufnahmen und Kalzium-Mikrofluoridmetrie in Gehirnscheiben beschreiben, sind in Literatur24,32,33,34,35verfügbar.
Ergebnisse
Allgemeiner Überblick über die für das Protokoll erforderlichen Tools und kritischen Schritte
Abbildung 2 zeigt alle notwendigen Werkzeuge und kritischen Schritte zur Vorbereitung horizontaler akuter Hippocampus-Gehirnscheiben, wie in diesem Protokoll beschrieben. Im Allgemeinen ist eine begrenzte Anzahl von Schlüsselinstrumenten erforderlich, darunter ein paar Sezierwerkzeuge und eine Scheibenrückgewinnungskammer (Abbildung 2A), ein Laborwasserbad und ein Vibramme (Abbildung 2B). Abbildung 2C–E visualisiert wichtige Schritte und Orientierungen des Gehirns und der Hemisphären während des Slice-Vorbereitungsprotokolls. Abbildung 2F ist eine Abbildung eines erwarteten Ergebnisses horizontaler Gehirnscheiben.
fEPSP-Aufnahmen im medialen Perforantenpfad
Nach der Erholungsphase können die Gehirnscheiben für elektrophysiologische Aufnahmen von EPPS verwendet werden. Hier haben wir ein aufrechtes Mikroskop verwendet, das mit einem mehrkanaligen, schwerkraftgesteuerten Perfusionssystem ausgestattet ist (Abbildung 3A und Abbildung 3B). Eine Glas-Mikropipette (ca. 2 Mio.) wurde mit ACSF-Lösung gefüllt und auf einer chloridbeschichteten Silberelektrode befestigt, die in schaltung mit einer chlorierten Badelektrode an einem Operationsverstärker befestigt ist. fEPSPs wurden mit einem Verstärker und einer geeigneten Aufnahmesoftware aufgezeichnet und visualisiert, indem die Glasmikropipette in das MPP des Hippocampus in der oberen Schicht der Hirnscheibe eingesetzt wurde. fEPSPs wurden durch Stimulation mit einer 2-Kontakt-Cluster-Mikroelektrode induziert, wobei verschiedene Stromintensitäten auf das MPP vor der Aufnahmeelektrode angewendet wurden. Beachten Sie, dass dieses Protokoll nicht dazu dient, zu erklären, wie MPP-Aufnahmen zu erhalten sind, sondern einfach Aufzeichnungen in der MPP als Beispiel verwendet, um den Erfolg des hier beschriebenen Slice-Vorbereitungsprotokolls zu veranschaulichen. Wenn jemand versucht, MPP-Aufnahmen durchzuführen, können bestimmte Steuerelemente (z. B. gekoppelte Pulsaufzeichnungen) erforderlich sein, um die richtige Aufnahmestelle sicherzustellen und den MPP von den LPP8,36,37zu unterscheiden.
Abbildung 3C zeigt ein negatives (linkes Panel, Scheibe mit geringer Qualität) und positives (rechtes Bedienfeld, hochwertiges Slice) Beispiel für eine fEPSP-Aufnahme. Die negative Beispielspur zeigt eine große Faservolley (FV) Amplitude, die sogar höher ist als die tatsächliche fEPSP-Amplitude (≈0,5 mV). Im Gegensatz dazu zeigt das hochwertige Slice-Beispiel (rechtes Panel) ein kleines FV-zu-fEPSP-Verhältnis und eine hohe fEPSP-Amplitude (>0,5 mV). Der Faservolley ist das Signal, das bei der Depolarisation der stimulierten neuronalen Fasern auftritt und daher der postsynaptischen Potenzierung (fEPSP) vorausgeht. Die Beziehung von FV zu fEPSP-Eigenschaften liefert wichtige Informationen über die Erhaltung der axonalen und synaptischen Eigenschaften. Hochwertige Scheiben mit intakten Nervenfasern sollten eine hohe fEPSP-Amplitude im FV-Verhältnis aufweisen. Im Gegenteil, minderwertige Scheiben mit eingeschränkten Leitungseigenschaften haben ein verringertes FEPSP-Verhältnis zu FV. In ähnlicher Weise kann die Lebensfähigkeit einer Gehirnscheibe analysiert werden, indem fEPSP-Hänge im Vergleich zu den Faservolley-Amplituden dargestellt werden (Abbildung 3D).
Darüber hinaus werden Input-Output-Kurven (fEPSP-Neigung und FV-Amplitude über Stimulusintensität) standardmäßig verwendet, um die Slice-Qualität zu bestimmen. Solche Kurven werden durch die Anwendung zunehmender Stromreize auf die Hirnscheibe und durch die Überwachung der nachfolgenden fEPSP-Antworten erreicht. Minderwertige Hirnscheiben zeigen eine reduzierte Input-Output-Kurve aufgrund suboptimaler Leitungseigenschaften von schlecht erhaltenem Hirngewebe (Abbildung 3E,F). Darüber hinaus sind Input-Output-Kurven notwendig, um den idealen Stimulationsintensitätsbereich für die Untersuchung synaptischer Prozesse zu definieren. Idealerweise sollte die Stimulusintensität bei maximalen Reaktionen um 50 % der Intensität eingestellt werden. Bei dieser gewählten Stimulusintensität sind die fEPSP-Antworten hochempfindlich für Veränderungen der synaptischen Plastizität, die die Möglichkeit bietet, sowohl die Langzeitpotenzierung (LTP) als auch die Langzeitdepression (LTD) zu untersuchen.
Um die synaptische Plastizität zu untersuchen, wird die synaptische Übertragung der Hirnscheibe (fEPSP-Neigung) bei der gewählten Stimulusintensität von 50 % vor der Konditionierungsphase über einen längeren Zeitraum (in der Regel zwischen 20–40 min) überwacht. Lebensfähige Gehirnscheiben haben stabile Ausgangslinien, während Gehirnscheiben mit einer instabilen Grundlinie nicht für weitere Konditionierungsprotokolle verwendet werden können, um die synaptische Plastizität der Gehirnkreise zu untersuchen(Abbildung 3G, Oberplatte). fEPSP-Basisaufnahmen können auch nützlich sein, um die Arzneimittelwirkungen auf die synaptische Übertragung selbst zu überwachen(Abbildung 3G, untere Schalttafel). Der Mittelwert der aufgezeichneten fEPSP-Basissignale wird in der Regel zur Normalisierung eines fEPSP-Zeitverlaufs verwendet und standardmäßig auf 100 % festgelegt.
Synaptische Plastizität kann durch Die Anwendung spezifischer Konditionierungsprotokolle auf die Gehirnscheiben untersucht werden. Diese Protokolle hängen vom untersuchten Gehirnkreislauf und dem Mechanismus von Interesse ab (z. B. LTP oder LTD). Um LTP in der MPP des Dentate Gyrus zu induzieren, ist ein starkes Konditionierungsprotokoll aufgrund der starken GABAergen Hemmung notwendig, die an den MPP-Synapsen38vorhanden ist. Es wird berichtet, dass die GABAergische Hemmung ist noch stärker ausgeprägt in Gehirnscheiben mit hochsucrose Schneidlösungen39vorbereitet. Hier verwenden wir ein Protokoll, das aus vier Stimulationen von 1 s langen 100 Hz-Impulsen besteht, die in einem Intervall von 5 min angewendet werden, während sie mit dem GABA-A-Rezeptor-Antagonisten Bicuculline behandelt werden (Abbildung 3H). Die Gleichzeitigkeit von NMDA und Bicuculline während der Konditionierungsphase führt zu einem erhöhten LTP (Abbildung 3H). Eine geringe Qualität der Scheibe und eine instabile synaptische Übertragung (fEPSP-Baseline) können zu einer veränderten oder erfolglosen LTP- und LTD-Induktion führen. Daher ist es von großer Bedeutung, mit hochwertigen Scheibenpräparaten zu arbeiten und strenge Ausschlusskriterien (niedrige fEPSP-Amplitude-zu-Faser-Volley-Verhältnis (<3), kleine fEPSP-Neigung (<0,5 mV/ms) oder Amplitude (<0,5 mV) und instabile fEPSP-Baseline (Änderung von mehr als 5%) zu verwenden. für nicht lebensfähige Slices bei der Untersuchung synaptischer Prozesse.
Calciummikrofluortrimetriemessungen in der Granulatzellschicht des Dentatgyrus
Nach der Genesung wurde eine Hirnscheibe bei Raumtemperatur mit 2 m eines kalziumempfindlichen Farbstoffs für 1 h in kariertem ASCF inkubiert, abgeschirmt vor Licht. Die Scheibe wurde in eine Aufnahmekammer(Abbildung 3A) auf einem aufrechten Fluoreszenzmikroskop mit einem mehrkanaligen schwerkraftgesteuerten Perfusionssystem übertragen. Fluoreszenz-Emissionsbilder wurden alle 500 Millisekunden nach Beleuchtung bei 488 nm(Abbildung 4A,B) aufgenommen. Die Erregung erfolgte mit einer Xenon-Lampe und einem Scanner montiert beugungsGitter Monochromator und Bildaufnahme wurde mit einer computergesteuerten CCD-Kamera durchgeführt. Während der Messungen wurde die Scheibe mit dem NMDA-Rezeptor-Antagonisten APV behandelt, was zu einer Abnahme der intrazellulären Calciumkonzentration führte. Die Stimulation der Scheibe mit einer extrazellulären Lösung mit einer hohen Kaliumkonzentration (50 mM) führte zu einem massiven Zustrom von extrazellulärem Kalzium aufgrund der Depolarisation der Neuronen und der Öffnung von spannungsgebundenen Ionenkanälen (Abbildung 4C).
| Verbindung | Konzentration (mM) | Molekulargewicht (g/mol) | Betrag (g) |
| Kcl | 25 | 74.55 | 1.86 |
| CaCl2 * 2H2O | 20 | 147.01 | 2.94 |
| MgSO4 * 7H2O | 10 | 246.48 | 2.46 |
| KH2PO4 | 12.5 | 136.08 | 1.7 |
Tabelle 1: 10 x Scheibenvorlösung (1 L).
| Verbindung | Konzentration (mM) | Molekulargewicht (g/mol) | Betrag (g) |
| Nacl | 125 | 58.44 | 7.3 |
| Kcl | 2.5 | 74.55 | 0.19 |
| CaCl2 * 2H2O | 2 | ab 1 M CaCl2 Lösung | 2 mL |
| MgSO4 * 7H2O | 1 | ab 1 M MgSO4 Lösung | 1 ml |
| NaH2PO4 * 2H2O | 1.25 | 156.02 | 0.2 |
| NaHCO3 | 26 | 84.01 | 2.18 |
| Glukose * H2O | 25 | 198.17 | 4.95 |
Tabelle 2: 1x ACSF (1 L) (Osmolarität zwischen 305–315 mOsm).
| Verbindung | Konzentration (mM) | Molekulargewicht (g/mol) | Betrag (g) |
| 10x Slice-Auflösung | N/A | N/A | 25 ml |
| Saccharose | 252 | 342.3 | 21.57 |
| NaHCO3 | 26 | 84.01 | 0.55 |
| Glukose * H2O | 10 | 198.17 | 0.49 |
Tabelle 3: 1x Hochsaccharin-Scheibenlösung (250 ml) (Osmolarität zwischen 320–325 mOsm).
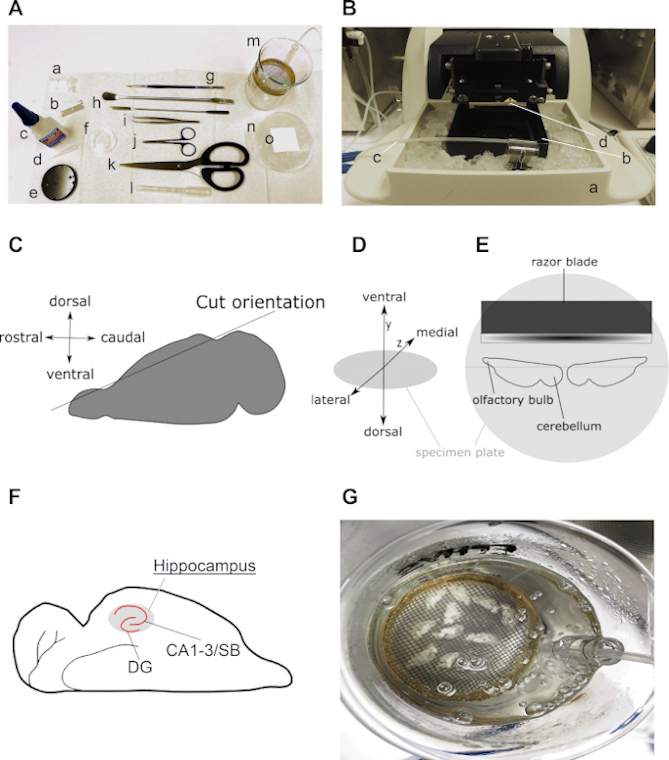
Abbildung 2: Detaillierte Informationen zur Herstellung horizontaler Hippocampus-Gehirnscheiben. (A) Abbild der Werkzeuge, die zum Zerlegen und Schneiden des Nagetierhirns erforderlich sind: a) ±2 cm lang und ±0,5 cm breite Gurte aus Filterpapier (z. B. Grad 413); b) Klinge; c) Superkleber; d) Pipettenspitze; e) Probenplatte (kommt mit Vibratom); f) 35 mm Kulturschale; g) feine Bürste; h) Spachtel; i) gekrümmte Zangen; j) Sezierschere; k) starke Schere (Klingenlänge über 10 cm); l) Pasteurpipetten aus Kunststoff mit breiter Öffnung (Durchmesser zwischen 0,6 und 0,8 cm); m) Rückgewinnungskammer (selbsthergestellt mit 250 ml Becher, Kunststoffring, Nylongewebe, Stück einer 10 ml serologischen Pipette); n) 90 mm Kulturschale, gefüllt mit Eis und (o) Quadrat von Filterpapier auf dem gekühlten Kulturgericht. (B) Bild eines Vibratome mit a) Halter der mit Eis gefüllten Scheibenkammer; b) Scheibenkammer; c) Carbogen-Linie und d) Messerklinge schneiden. (C) Karikatur, die die Ausrichtung des Schnitts der dorsalen Seite einer Hemisphäre veranschaulicht, um das Gehirn auf horizontales Schneiden vorzubereiten (siehe Schritt 3.9). (D) Isometrische Projektion der Hirnorientierung auf die Probenplatte des Vibratom. (E) Karikatur, die eine obere Ansicht der Position der beiden Hemisphären auf der Probenplatte veranschaulicht. (F) Cartoon zeigt die Position des Hippocampus in einer horizontalen Gehirnscheibe. Die Dentate gyrus (DG) und Cornu Ammonis (CA)-Subiculum (SB) Regionen des Hippocampus sind indiziert. (G) Bild einer Rückgewinnungskammer mit kariertem ACSF mit zehn frisch geschnittenen horizontalen Hirnscheiben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
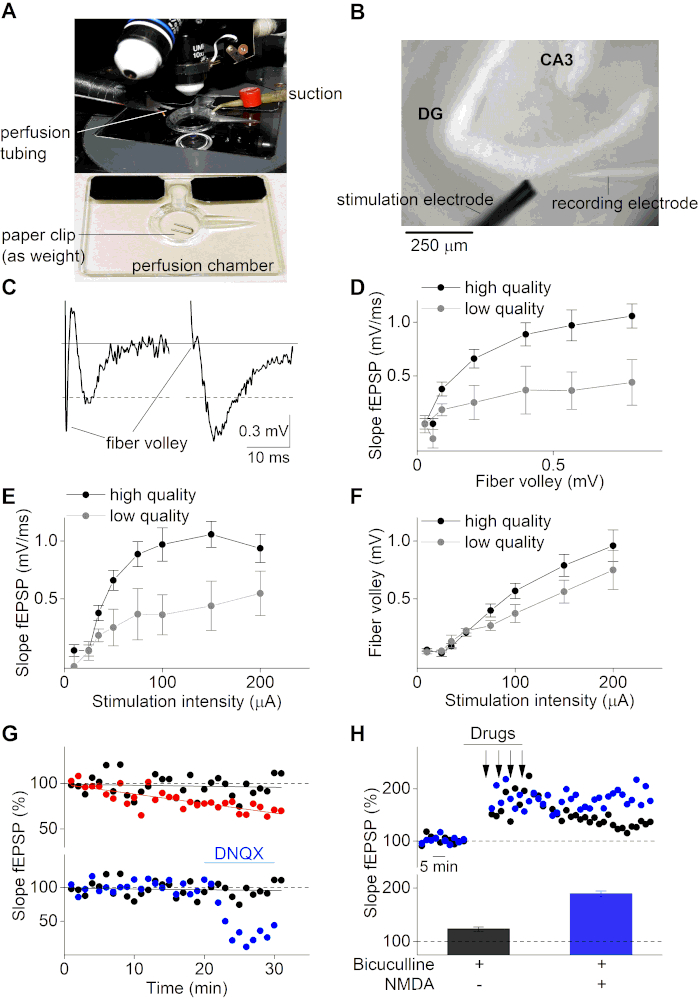
Abbildung 3: Elektrophysiologische Aufnahmen von Hippocampus-Gehirnscheiben. (A) Bild einer Aufnahmekammer mit Perfusion und Absaugung, die unter einem aufrechten Mikroskop verwendet wird. Eine Gehirnscheibe wird in die Kammer gelegt und vor Beginn der Aufnahmen mit einem Stück Einer Büroklammer immobilisiert. (B) Helles Feldbild einer Hippocampus-Gehirnscheibe unter einem aufrechten Mikroskop (10-faches Objektiv). Die Dentat-Gyrus-(DG) und CA3-Region sind ebenso angezeigt wie die Stimulations- (unten links) und Aufnahmeelektroden (unten rechts), die während der fEPSP-Aufnahmen auf den medialen Perforantenpfad abzielen. (C) Links: Darstellung eines minderwertigen Slice-Beispiels einer fEPSP-Aufnahme mit einem robusten Faservolley und einer kleinen Amplitude. Rechts: hochwertiges Slice-Beispiel einer fEPSP-Aufnahme. Die graue Linie gibt die Basislinie an. Die gepunkteten Linien weisen auf die Abgeschnittener Amplitude von 0,5 mV hin. (D) Diagramm der fEPSP-Neigung im Vergleich zur FV-Amplitude für hochwertige (schwarz; n=10) und minderwertige Gehirnscheiben (grau; n=4). Daten, die als Mittelwert ± SEM. (E) Input-Output-Diagramm (fEPSP-Neigung) für unterschiedliche Stimulationsintensitäten (A) für hochwertige Slices (schwarz; n = 10) und minderwertige Slices (grau; n = 4)) dargestellt werden. (F) Gleiches wie in (E), aber für die FV-Amplituden gegen die Stimulusintensitäten. (G) Zeitverlauf von drei verschiedenen Basis-fEPSP-Aufnahmen (Neigung von fEPSP in %; normalisiert auf die mittlere fEPSP-Steigung der ersten 5 min). Das obere Panel stellt ein positives (schwarzes) und negatives (rotes) Beispiel dar, bei dem letztere seither aufgrund von Carbogen-Auslassungen eine instabile Ausgangsbasis hat. Unteres Panel zeigt zwei stabile Ausgangsaufnahmen in behandelten (nach 20 min stabiler Ausgangsbasis wurden AMPA-Rezeptoren durch Anwendung des AMPA-Rezeptor-Antagonisten DNQX (10 m)) (blau) und unbehandelt (schwarz) blockiert. (H) Zeitverlauf von LTP-Aufnahmen für unterschiedliche Behandlungsbedingungen (im unteren Bereich angegeben). Schwarze Farbe für die Anwendung von Bicuculline (20 m) während der Konditionierung und blau für die gleichzeitige Anwendung von Bicuculline (20 m) und NMDA (10 m) während der Konditionierung. Pfeile im oberen Panel zeigen die Zeitpunkte an, an denen hochfrequente Stimulation angewendet wurde (4 x 1s von 100Hz). Balkendiagramm im unteren Bereich stellt die durchschnittlichen fEPSP-Abhänge dar (%) 50–60 min nach LTP-Induktion der im oberen Panel gezeigten Experimente (einzelne repräsentative Aufzeichnung für jede Bedingung). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
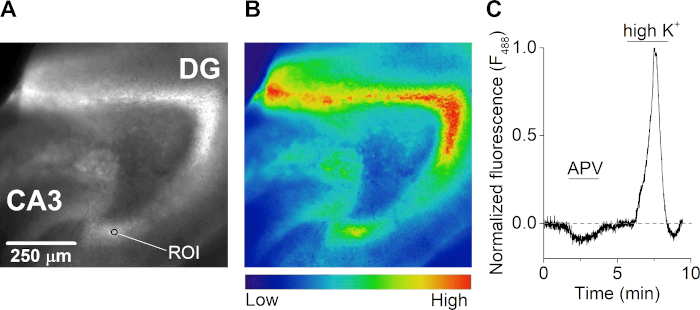
Abbildung 4: Calcium-Mikrofluoridmetrie von Hippocampus-Gehirnscheiben. (A und B) Fluoreszenzbild (aufgeregt bei 488 nm) (A) und entsprechender Heatmap (B) einer horizontalen Hippocampus-Gehirnscheibe des Maushirns. Der Dentat-Gyrus (DG), die CA3-Region und ein Beispiel für eine Region von Interesse (ROI) sind in Panel A angegeben. (C) Zeitverlauf der Calciumantworten (F488 nm) aus einem ROI im Dentat-Gyrus einer akuten Hippocampus-Gehirnscheibe während der Behandlung mit dem NMDA-Rezeptor-Antagonisten APV (50 m) und einer Lösung, die hoch extrazelluläres Kalium (K+) enthält. Die Spur wird bei hoher K+-Perfusion auf die höchste Kalziumantwort normalisiert und wird für Photobleichungen korrigiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Obwohl häufig in der neurowissenschaftlichen Gemeinschaft verwendet, Gehirn Scheibenpräparate sind auch mit mehreren Nachteilen konfrontiert. Zum Beispiel sind Eingangs- und Ausgangsverbindungen zu den von Interesse interessierten Hirnbereichen nicht mehr in einem Gehirnsegment verbunden. Darüber hinaus beginnt das Gewebe, sobald es isoliert ist, langsam im Laufe der Zeit zu abbauen und dieser Prozess könnte die physiologischen Bedingungen der Gehirnscheibe verändern. Dieses Thema ist besonders deshalb sehr besorgniserregend, weil die meisten Hirnschnittaufnahmen mehrere Minuten bis Stunden dauern, was zu langen Versuchstagen mit Aufnahmen führt, die an Geweben durchgeführt wurden, die bis zu 6-8 h vor Beginn des Experiments isoliert wurden. Darüber hinaus werden die Zerebrospinalflüssigkeit und die Durchblutung während der Scheibenpräparate unterbrochen, was zum Mangel an wichtigen endogene Verbindungen innerhalb einer Gehirnscheibe führen kann. Und am offensichtlichsten, das Schneidverfahren selbst kann mechanische Gewebeschäden verursachen, die die erzielten Ergebnisse beeinträchtigen könnten. Die tatsächlichen Vorteile von Hirnscheibenpräparaten überwiegen jedoch immer noch ihre Nachteile, weshalb sie eine hoch geschätzte und eingesetzte Technik in der neurowissenschaftlichen Forschung darstellen.
Akute Hippocampus-Gehirnscheiben stellen eine leistungsfähige und daher weit verbreitete Technik zur Untersuchung neuronaler Prozesse von molekularer Ebene bis hin zu komplexen Hirnkreisstudien dar. Dies basiert auf der idealen Neuroanatomie des Hippocampus, die leicht in einer Scheibenzubereitung18erhalten werden kann. Folglich, Hippocampus GehirnScheiben werden in einer Vielzahl von wissenschaftlichen Forschungsprojekten verwendet, einschließlich Arzneimittel-Screenings17, Studien der neuronalen und synaptischen Eigenschaften in kognitiven Funktionenbeteiligt 40,41, und Untersuchungen von pathologischen Hirnerkrankungen14,42,43. Ein breites Spektrum unterschiedlicher Anwendungen bewirkt jedoch auch eine breite Palette verfügbarer Slice-Vorbereitungsprotokolle, die sich in verschiedenen Parametern wie Sezierbedingungen und Schnittebenenausrichtung unterscheiden können. Daher muss die genaue Forschungsfrage eines wissenschaftlichen Projekts ermittelt werden, um ein geeignetes Slice-Vorbereitungsprotokoll zu wählen.
Der Gewebe-Chopper präsentiert eine der ältesten verwendeten Techniken, um Hippocampus-Gehirnscheibenvorzubereiten 44,45. Zu den Hauptvorteilen dieser Zubereitungsmethode gehören die geringen Kosten des Choppers und die schnelle und einfache Anwendung46. Allerdings verursachen Gewebehäcksler mechanische Belastung, die zu morphologischen Veränderungen und Zelltod führt47. Im Vergleich dazu ist das Vibratome eine ziemlich teure Maschine und die Zeit für die Scheibenaufbereitung wird deutlich erhöht, was sich auf die Qualität der Scheibe auswirken könnte. Jedoch, das Vibratome bietet in der Regel eine sanftere Art der Trennung der Scheiben aus dem Gewebe und ermöglicht es, das Gehirn schön gekühlt und sauerstoffarm über den gesamten Isolationsvorgang zu halten, wodurch die Scheibeneigenschaftenverbessert 46. Daher verwenden mehrere Gruppen standardmäßig diese Technik und haben Protokolle für die Herstellung von akuten Hippocampus-Gehirnscheiben mit dem Vibratom16,30,48vorgelegt. Während einige Protokolle nur wenige Details für das Schneiden selbst enthalten, sich aber eher auf eine spezifische Anwendung solcher Slice-Vorbereitung48konzentrieren, bieten andere detaillierte Slice-Protokolle, die sich in der Schnittebene oder anderen Protokolldetails unterscheiden (z. B. Agarose-Einbettung oder Slice/Recovery-Lösungen), die in diesem Artikel27,30enthalten sind.
Das hier beschriebene Protokoll stellt eine einfache Methode dar, um hochwertige akute horizontale Hippocampus-Maus-Gehirnscheiben von Jungen Tieren vorzubereiten. Das Protokoll ist besonders nützlich, um den perforanten Pfad (medial und seitlich) zu erhalten, der den Hippocampus-Eingangsweg darstellt, der vom entorhinalen Kortex zum Hippocampus8,49,50projiziert. Sagittale, koronale, sowie isolierte Hippocampus-Transverkonverscheibenpräparate bewahren den Perforantenweg, der hauptsächlich aus den Schichten II und V des entorhinalen Kortex stammt und in mehrere Bereiche innerhalb des Hippocampus18geht, nicht richtig. Aufgrund der anatomischen Positionierung des entorhinalen Kortex in Bezug auf den Hippocampus sind horizontale Hirnscheiben eine Notwendigkeit, um vollständig intakte Perforantenpfadfasern innerhalb der Scheibenpräparation zu erhalten31. Darüber hinaus bewahrt horizontales Schneiden ideal die moosigen Fasern, die vom Dentate-Gyrus zu den CA3-Neuronen innerhalb des Hippocampus9,30,50projizieren. Daher ist diese Präparationsmethode von hohem Wert für Studien, die Hippocampus-Eingangswege und DG-bezogene Prozesse untersuchen. Darüber hinaus ermöglicht dieses Protokoll die Untersuchung des Schaffer-Kollateralwegs50. Sagittal und koronare Gehirnscheibenpräparate werden jedoch häufiger bei der Untersuchung von CA3- bis CA1-Faserprojektionen verwendet, vermutlich aufgrund ihrer etwas schnelleren Vorbereitungszeit, die die Wahrscheinlichkeit erhöhen kann, qualitativ hochwertige Scheiben zu erhalten. Dennoch stellen horizontale Hippocampus-Scheibenpräparate ein leistungsfähiges Forschungswerkzeug dar, da es die Erhaltung und Untersuchung aller Hippocampus-Faserwege innerhalb einer Scheibenhalbkugel ermöglicht. Dies kann besonders nützlich sein, wenn Schaltungsreaktionen untersucht werden, z. B. in Multi-Elektroden-Assay-Aufnahmen.
Ein großes Problem bei der Vorbereitung von Gehirnscheiben ist die richtige Erhaltung des Gehirngewebes. Dies wird durch mehrere kritische Schritte in unserem Protokoll erreicht, einschließlich einer schnellen Zerlegung, der kontinuierlichen und ausreichenden Sauerstoffversorgung und Kühlung des Gewebes und dem Schutz des Hirngewebes durch den Einsatz der schützenden Schneidmethode mit einer natriumarmen, hochsonserischen Schneidlösung39,51. Trotz der Tatsache, dass das hier beschriebene Protokoll eine Erfolgsquote von rund 90 % ergibt, könnten möglicherweise zusätzliche Schutzmaßnahmen erforderlich sein, wenn sie mit Geweben arbeiten, die von älteren oder genetisch unterschiedlichen Tieren stammen, oder wenn Sie versuchen, eine bestimmte Zellpopulation zu erhalten. Mehrere Methoden wurden bereits berichtet, um empfindliche Hirngewebepräparate zu schützen. Diese Methoden umfassen den Einsatz von NMDG-basierten Schneidlösungen zur Reduzierung der Natriumpermeation52,die Verwendung hoher Magnesiumgehalte in der Schneidlösung, um die NMDA-Rezeptoraktivität53zu blockieren, und die längere Verwendung von Schutzlösungen auch während der Erholungsphase23. Alle diese Maßnahmen werden zu einer verminderten Exzitotoxizität führen. Darüber hinaus wird oft eine transkardiale Perfusion mit eiskalten Schutz-ACSF-Lösungen eingesetzt und ist bei der Arbeit mit älteren Tierennotwendig 27.
Akute Hippocampus-Gehirnscheiben eignen sich ideal und werden aus Gründen wie den hohen Amplitudensignalen, die aus einer relativ dicken (300–500 m) akuten Hirnscheibe gewonnen werden können, die ein hohes Signal-Rausch-Verhältnis11garantiert, umfassend für elektrophysiologische Studien eingesetzt. Zu den standardgenutzten elektrophysiologischen Anwendungen gehören extrazelluläre Feldaufzeichnungen und intrazelluläre Ganzzellaufnahmen im Spannungs- oder Stromklemmenmodus. Um hochwertige elektrophysiologische Daten zu erhalten, ist die Slice-Gesundheit von vorrangiger Bedeutung und kann durch strikte Befolgung des vorgestellten Protokolls gewährleistet werden. Da Slice-Präparate jedoch eine hochsensible Technik aufweisen, sollte vor Beginn jedes Experiments routinemäßig eine Qualitätskontrolle durchgeführt werden. Mehrere Parameter können als Qualitätskontrolle des Slices verwendet werden und werden standardmäßig über Input-Output-Kurven und Basis-fEPSP- oder EPSC-Aufnahmen19bewertet. Dennoch ist zu beachten, dass suboptimale elektrophysiologische Eigenschaften durch experimentelle Fehler wie Elektrodenpositionierung, Orientierung oder sogar Beschädigung entstehen können und nicht nur die Gesundheit der vorbereiteten Scheibe darstellen. Daher ist es ratsam, zusätzliche Qualitätskontrollen durchzuführen, wie z. B. einfache Visualisierung und Bewertung der Zellen unter einem 40-fachen Objektiv oder einer DAPI-Kernfärbung. Solche Qualitätsprüfungen können verwendet werden, um die konstante Slice-Integrität über mehrere Slice-Vorbereitungssitzungen zu bestätigen.
Die Calciummikrofluorimetry stellt eine weniger häufig verwendete Technik zur Untersuchung von Hippocampus-Gehirnscheiben dar. Diese Technik ist jedoch von zusätzlichem Wert für die standardmäßigen extrazellulären und intrazellulären Elektrodenaufzeichnungen, da sie es ermöglicht, intrazelluläre Kalziumflüsse zu visualisieren und zu quantifizieren, die bei der neuronalen und synaptischen Signalisierung von großer Bedeutung sind. Veränderungen der intrazellulären Kalziumkonzentrationen sind an der Freisetzung von Neurotransmittern Vesikel, postsynaptische Potenzialerzeugung, Regulierung der synaptischen Plastizität und axonalen Nervenleitung54,55,56beteiligt. Zur Veranschaulichung dieser Technik (Abbildung 4) haben wir einen handelsüblichen Kalziumfarbstoff verwendet. Zweifellos kann die Behandlung von Gewebescheiben mit Kalziumfarbstoffen zu Schwierigkeiten führen, wie z. B. einem erhöhten experimentellen Zeitrahmen sowie einer ineffizienten Belastung von niedriger gelegenen neuronalen Zellen. Allerdings könnten Variationen dieser Technik verwendet werden, um diese technischen Herausforderungen zu umgehen. So ist es beispielsweise möglich, Kalziummessungen und Patchklemmenaufnahmen in Hippocampusscheiben zu kombinieren. Auf diese Weise könnte ein Kalziumfluoreszenzfarbstoff durch die Patchpipette in eine bestimmte Zelle geladen werden, was die Messung der Kalziumdynamik in einer bestimmten Zelle von Interesse ermöglicht57. Alternativ könnten gentechnisch veränderte Tiere, die den Kalziumindikator GCaMP58exemittieren, entweder im gesamten Gehirn oder angetrieben von einem zellspezifischen Promotor verwendet werden. Interessanterweise könnte Hirngewebe von GCaMP-Tieren mit einem direkten Bezug zu einem Protein von Interesse Möglichkeiten bieten, das neuronale Expressionsmuster zu bestimmen oder die Beteiligung an Kalziumfunken und Wellen zu untersuchen.
Insgesamt stellen wir die Richtlinien für die erfolgreiche Vorbereitung gesunder und lebensfähiger horizontaler Hippocampus-Gehirnscheiben von Mäusen für elektrophysiologische und bildgebende Aufnahmen zur Verfügung. Diese Methode ist sehr nützlich, um auf neurologische Veränderungen zuzugreifen, die in Hirnpathologien auftreten, die im Dentate-Gyrus beschrieben werden.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken der Abteilung Elektrophysiologie des VIB-KU Leuven Center for Brain and Disease Research unter der Leitung von Dr. Keimpe Wierda und Prof. Dr. Joris De Wit für die Nutzung ihrer Forschungseinrichtungen. Darüber hinaus danken wir allen Mitgliedern des Labors für Ionenkanalforschung und des Labors für Endometrium, Endometriose und Reproduktionsmedizin an der KU Leuven für ihre hilfreichen Diskussionen und Kommentare.
Dieses Projekt wurde von der Forschungsstiftung Flandern (G.084515N und G.0B1819N an J.V.) und dem Forschungsrat der KU Leuven (C1-Förderung C14/18/106 bis J.V.) gefördert. K.P. ist ein FWO [PEGASUS]2 Marie Skodowska-Curie Fellow und erhielt Mittel aus dem Forschungs- und Innovationsprogramm Horizont 2020 der Europäischen Union im Rahmen der Marie-Skodowska-Curie-Zuschussvereinbarung (665501) mit der Forschungsstiftung Flandern (FWO) (12T0317N). K.H. ist Postdoktorand der Forschungsstiftung Flandern, Belgien (12U7918N).
Materialien
| Name | Company | Catalog Number | Comments |
| Anesthesia chamber | home made - Generic | N/A | plexiglas |
| Anesthesia vaporizer | Dräger & MSS International Ltd | Isoflurane Vapor 19.3 & MSS Isoflurane | to vaporize isoflurane for rodent anesthetization |
| Barrels for the perfusion system | TERUMO | Hypodermic syringes without needle | https://www.terumotmp.com/products/hypodermics/terumo-hypodermic-syringes-without-needle.html |
| Bicuculline methiodide | hellobio | HB0893 | https://www.hellobio.com/bicuculline-methiodide.html |
| Borosilcate glass capillaries | Science Products | GB150F-8P | https://science-products.com/en/shop/micropipette-fabrication-1/capillary-glass-for-micropipette-pullers/borosilicate-glass-capillaries/borosilicate-filament-polished |
| Calcium chlorid dihydrate | Merck | 102382 | https://www.merckmillipore.com/BE/en/product/Calcium-chloride-dihydrate,MDA_CHEM-102382?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Calcium Imaging software | Till Photonics | LiveAcquisition v2.3.0.18 | |
| Carbogen tank | Air Liquide | Alphagaz mix B50 | Gasmixture CO2/O2: 5/95, purity 5 |
| Cluster microelectrode | FHC | CE2C55 | https://www.fh-co.com/product/cluster-microelectrodes/ |
| Culture dish (35 mm) | Corning Life Sciences | 353001 | https://ecatalog.corning.com/life-sciences/b2c/US/en/Cell-Culture/Cell-Culture-Vessels/Dishes%2C-Culture/Falcon®-Cell-Culture-Dishes/p/353001 |
| Culture dish (90 mm) | Thermo Fisher Scientific | 101VR20 | https://www.thermofisher.com/order/catalog/product/101R20#/101R20 |
| Curved forceps | Fine Science tools | 11270-20 | https://www.finescience.de/de-DE/Products/Forceps-Hemostats/Dumont-Forceps/Dumont-7b-Forceps/11270-20 |
| D-AP5 | hellobio | HB0225 | https://www.hellobio.com/dap5.html |
| D-(+)-Glucose monohydrate | Sigma Aldrich | 16301 | https://www.sigmaaldrich.com/catalog/product/sial/16301?lang=en®ion=BE |
| Digital CMOS camera | HAMAMATSU | ORCA-spark C11440-36U | https://www.hamamatsu.com/eu/en/product/type/C11440-36U/index.html |
| Dissection scissors | Fine Science tools | 14058-09 | https://www.finescience.de/de-DE/Products/Scissors/Standard-Scissors/Fine-Scissors-ToughCut®/14058-09 |
| DNQX | hellobio | HB0262 | https://www.hellobio.com/dnqx-disodium-salt.html |
| EMCCD camera | Andor | iXon TM + DU-897E-CSO-#BV | https://andor.oxinst.com/products/ixon-emccd-cameras?gclid=CjwKCAjw97P5BRBQEiwAGflV6ULsKjXfhN2YZxtvsWAmF4QghyXZKuqYHVMa6KU9JyS80ATQkSKeBBoCIM0QAvD_BwE |
| EPC10 USB Double Patch Clamp Amplifier | HEKA Elektronik | 895278 | https://www.heka.com/sales/brochures_down/bro_epc10usb.pdf |
| Filter paper | VWR | 516-0818 | grade 413 |
| Fine brush | Raphael Kaerell | 8204 | Size #1 |
| 18G needle | Henke Sass Wolf Fine-Ject | 18G X 1 1/2" 4710012040 | https://www.henkesasswolf.de/cms/de/veterinaer_produkte/produkte_vet/einmalkanuelen/hsw_henke_ject_einmalkanuelen/ |
| Isoflurane | Dechra Veterinary Products | Iso-Vet 1000mg/g | 250 ml bottle |
| Loctite 406 | Henkel Adhesive technologies | Loctite 406 | Super glue |
| Magnesium sulfate heptahydrate | Merck | 105886 | https://www.merckmillipore.com/BE/en/product/Magnesium-sulfate-heptahydrate,MDA_CHEM-105886?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Micromanipulator | Luigs & Neumann | SM-10 with SM-7 remote control system | https://www.luigs-neumann.org |
| Microscope (for calcium imaging) | Olympus | BX51WI | https://www.olympus-lifescience.com/de/microscopes/upright/bx61wi/ |
| Microscope (for ephys recordings) | Zeiss | Axio Examiner.A1 | https://www.micro-shop.zeiss.com/de/de/system/axio+examiner-axio+examiner.a1-aufrechte+mikroskope/10185/ |
| Microscope light source | CAIRN Research | dual OptoLed power supply | https://www.cairn-research.co.uk/product/optoled/ |
| Monochromator | Till Photonics | Polychrome V | |
| N-Methyl-D-aspartic acid (NMDA) | Sigma Aldrich | M3262 | https://www.sigmaaldrich.com/catalog/product/sigma/m3262?lang=en®ion=BE |
| Oregon Green® 488 BAPTA-1 | Invitrogen Molecular Probes | #06807 | 10x50ug |
| Osmometer | Wescor | 5500 vapor pressure osmometer | to verify osmolarity of salt solutions |
| Peristaltic pump | Thermo Fisher Scientific | Masterflex C/L 77120-62 | https://www.fishersci.be/shop/products/masterflex-peristaltic-c-l-dual-channel-pump-2/p-8004229 |
| pH meter | WTW | inoLab series pH 720 | https://www.geminibv.nl/wp-content/uploads/manuals/wtw-720-ph-meter/wtw-inolab-ph-720-manual-eng.pdf |
| Pipette puller | Sutter Instrument | P-1000 | https://www.sutter.com/MICROPIPETTE/p-1000.html |
| Potassium chlorid | Chem-lab | CL00.1133 | https://www.chem-lab.be/#/en-gb/prod/1393528 |
| Potassium dihydrogen phosphate | Merck | 104873 | https://www.merckmillipore.com/BE/en/product/Potassium-dihydrogen-phosphate,MDA_CHEM-104873?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Razor blade to prepare hemispheres | SPI supplies | Safety Cartridge Dispenser - Pkg/10 | GEM Scientific Single Edge Razor Blades |
| Razor blade for vibratome | Ted Pella Inc | 121-6 | double edge breakable style razor blades (PTFE-coated stainless steel) |
| Recovery chamber | home made - Generic | N/A | to collect and store brain slices in (see details in manuscript) |
| Scissors | Any company | N/A | Blade should be well sharpened and at least 15 cm long for easy decapitation |
| Silver electrode wire | Any company | for recording and reference electrodes | |
| Sodium dihydrogen phosphate dihydrate | Merck | 106342 | https://www.merckmillipore.com/BE/en/product/Sodium-dihydrogen-phosphate-dihydrate,MDA_CHEM-106342?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Sodium hydrogen carbonate | Alfa Aesar | 14707 | https://www.alfa.com/en/catalog/014707/ |
| Sodium chlorid | Fisher Scientific | S/3160/60 | https://www.fishersci.co.uk/shop/products/sodium-chloride-certified-ar-analysis-meets-analytical-specification-ph-eur/10428420 |
| Software for field recordings | HEKA Elektronik | PatchMaster | https://www.heka.com/downloads/software/manual/m_patchmaster.pdf |
| Spatula | Sigma Aldrich | S9147-12EA | https://www.sigmaaldrich.com/catalog/product/sigma/s9147?lang=en®ion=BE |
| Stimulator | A.M.P.I | ISO-FLEX | http://www.ampi.co.il/isoflex.html |
| Sucrose | VWR International Ltd. | 102745C | https://es.vwr-cmd.com/ex/downloads/magazine/lupc_userguide_uk.pdf |
| Tubing for carbogen, perfusion and suction lines 1 | Warner Instruments | 64-0167 | Tygon tubing (TY-50) for standard valve systems |
| Tubing for carbogen, perfusion and suction lines 2 | Fisher Scientific | 800/100/200 & 800/100/280 | Smiths Medical Portex Fine Bore LDPE Tubing |
| Vacuum pump | home made - Generic | N/A | |
| 8 valve multi-barrel perfusion system | home made | N/A | consists of barrels, tubing and a self-made automated valve control (specifications of all purchased parts can be found in this Table) |
| Magnetic valves (to control the perfusion lines) | NResearch Inc. | p/n 161P011 | https://nresearch.com/ |
| Vibratome | Leica | 14912000001 | Semi-automatic vibrating blade microomei VT1200 |
| Water bath | Memmert | WNB 7 | https://www.memmert.be/wp-content/uploads/2019/09/Memmert-Waterbath-WNB-7.en_.pdf |
| Water purification system | Merck | Synergy millipore | to obtain highly purified water |
| 12-well plates | Greiner Bio-One | CELLSTAR, 665180 | http://www.greinerbioone.com/UserFiles/File/Catalogue%202010_11/UK/3680_005-Kapitel1_UK.pdf |
Referenzen
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neurology, Neurosurgery, and Psychiatry. 20 (1), 11-21 (1957).
- Cavarsan, C. F., Malheiros, J., Hamani, C., Najm, I., Covolan, L. Is mossy fiber sprouting a potential therapeutic target for epilepsy. Frontiers in Neurology. 9, 1023 (2018).
- Nadler, J. V. The recurrent mossy fiber pathway of the epileptic brain. Neurochemical Research. 28 (11), 1649-1658 (2003).
- Raimondo, J. V., et al. Methodological standards for in vitro models of epilepsy and epileptic seizures. A TASK1-WG4 report of the AES/ILAE translational task force of the ILAE. Epilepsia. 58, 40-52 (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. , 86-98 (2015).
- Tohno, Y., et al. Relationships among the hippocampus, dentate gyrus, mammillary body, fornix, and anterior commissure from a viewpoint of elements. Biological Trace Element Research. 140 (1), 35-52 (2011).
- Maclean, P. D. The limbic system and its hippocampal formation; studies in animals and their possible application to man. Journal of Neurosurgery. 11 (1), 29-44 (1954).
- Petersen, R. P., et al. Electrophysiological identification of medial and lateral perforant path inputs to the dentate gyrus. Neuroscience. 252, 154-168 (2013).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in Brain Research. 163, 3-22 (2007).
- Szirmai, I., Buzsaki, G., Kamondi, A. 120 years of hippocampal schaffer collaterals. Hippocampus. 22 (7), 1508-1516 (2012).
- Cho, S., Wood, A., Bowlby, M. R. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Current Neuropharmacology. 5 (1), 19-33 (2007).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. Journal of Visualized Experiments. (49), e2330 (2011).
- Papouin, T., Haydon, P. G. Obtaining Acute Brain Slices. Bio-protocol. 8 (2), 2699 (2018).
- Li, Q., Han, X., Wang, J. Organotypic hippocampal slices as models for stroke and traumatic brain injury. Molecular Neurobiology. 53 (6), 4226-4237 (2016).
- Lo, D. C., McAllister, A. K., Katz, L. C. Neuronal transfection in brain slices using particle-mediated gene transfer. Neuron. 13 (6), 1263-1268 (1994).
- Lein, P. J., Barnhart, C. D., Pessah, I. N. Acute hippocampal slice preparation and hippocampal slice cultures. Methods in Molecular Biology. 758, 115-134 (2011).
- Magalhaes, D. M., et al. Ex vivo model of epilepsy in organotypic slices-a new tool for drug screening. Journal of Neuroinflammation. 15 (1), 203 (2018).
- Bliss, T., Andersen, P., Morris, R., Amaral, D., O'Keefe, J. . The hippocampus book. , 37-114 (2007).
- Bortolotto, Z. A., Amici, M., Anderson, W. W., Isaac, J. T. R., Collingridge, G. L. Synaptic plasticity in the hippocampal slice preparation. Current Protocols in Neuroscience. 54 (1), 11-26 (2011).
- Al-Osta, I., et al. Imaging calcium in hippocampal presynaptic terminals with a ratiometric calcium sensor in a novel transgenic mouse. Frontiers in Cellular Neuroscience. 12, 209 (2018).
- McLeod, F., Marzo, A., Podpolny, M., Galli, S., Salinas, P. Evaluation of synapse density in hippocampal rodent brain slices. Journal of Visualized Experiments. (128), e56153 (2017).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. 1183, 221-242 (2014).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording synaptic plasticity in acute hippocampal slices maintained in a small-volume recycling-, perfusion-, and submersion-type chamber system. Journal of Visualized Experiments. (131), e55936 (2018).
- Zhou, Q., Abe, H., Nowak, T. S. Immunocytochemical and in situ hybridization approaches to the optimization of brain slice preparations. Journal of Neuroscience Methods. 59 (1), 85-92 (1995).
- Koike-Tani, M., Tominaga, T., Oldenbourg, R., Tani, T. Birefringence changes of dendrites in mouse hippocampal slices revealed with polarizing microscopy. Biophysical Journal. 110 (10), 2366-2384 (2020).
- Ting, J. T., et al. Preparation of acute brain slices using an optimized N-Methyl-D-glucamine protective recovery method. Journal of Visualized Experiments. (132), e53825 (2018).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8 (9), 745-752 (2011).
- Hua, Y., Keep, R. F., Hoff, J. T., Xi, G. Brain injury after intracerebral hemorrhage: the role of thrombin and iron. Stroke. 38, 759-762 (2007).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Paxinos, G., Franklin, K. . The Mouse Brain In Stereotaxic Coordinates. 3 edn. , 256 (2008).
- Lacar, B., Young, S. Z., Platel, J. C., Bordey, A. Preparation of acute subventricular zone slices for calcium imaging. Journal of Visualized Experiments. (67), e4071 (2012).
- Schauer, C., Leinders-Zufall, T. Imaging calcium responses in GFP-tagged neurons of hypothalamic mouse brain slices. Journal of Visualized Experiments. (66), e4213 (2012).
- Tetteh, H., Lee, J., Lee, J., Kim, J. G., Yang, S. Investigating Long-term Synaptic Plasticity in Interlamellar Hippocampus CA1 by Electrophysiological Field Recording. Journal of Visualized Experiments. (150), e59879 (2019).
- Smith, C. J., et al. Investigations on alterations of hippocampal circuit function following mild traumatic brain injury. Journal of Visualized Experiments. (69), e4411 (2012).
- McNaughton, B. L. Evidence for two physiologically distinct perforant pathways to the fascia dentata. Brain Research. 199 (1), 1-19 (1980).
- Colino, A., Malenka, R. C. Mechanisms underlying induction of long-term potentiation in rat medial and lateral perforant paths in vitro. Journal of Neurophysiology. 69 (4), 1150-1159 (1993).
- Coulter, D. A., Carlson, G. C. Functional regulation of the dentate gyrus by GABA-mediated inhibition. Progress in Brain Research. 163, 235-243 (2007).
- Kuenzi, F. M., Fitzjohn, S. M., Morton, R. A., Collingridge, G. L., Seabrook, G. R. Reduced long-term potentiation in hippocampal slices prepared using sucrose-based artificial cerebrospinal fluid. Journal of Neuroscience Methods. 100 (1-2), 117-122 (2000).
- Connor, S. A., et al. Loss of synapse repressor MDGA1 enhances perisomatic inhibition, confers resistance to network excitation, and impairs cognitive function. Cell Reports. 21 (13), 3637-3645 (2017).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Moodley, K. K., Chan, D. The hippocampus in neurodegenerative disease. Frontiers of Neurology and Neuroscience. 34, 95-108 (2014).
- Kong, H., et al. Inhibition of miR-181a-5p reduces astrocyte and microglia activation and oxidative stress by activating SIRT1 in immature rats with epilepsy. Laboratory Investigation; A Journal of Technical Methods and Pathology. , (2020).
- Skrede, K. K., Westgaard, R. H. The transverse hippocampal slice: a well-defined cortical structure maintained in vitro. Brain Research. 35 (2), 589-593 (1971).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Wang, T., Kass, I. S. Preparation of brain slices. Methods in Molecular Biology. 72, 1-14 (1997).
- Garthwaite, J., Woodhams, P. L., Collins, M. J., Balazs, R. On the preparation of brain slices: morphology and cyclic nucleotides. Brain Research. 173 (2), 373-377 (1979).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments: JoVE. (91), e51706 (2014).
- Aydin-Abidin, S., Abidin, &. #. 3. 0. 4. ;. 7,8-Dihydroxyflavone potentiates ongoing epileptiform activity in mice brain slices. Neuroscience Letters. 703, 25-31 (2019).
- Xiong, G., Metheny, H., Johnson, B. N., Cohen, A. S. A comparison of different slicing planes in preservation of major hippocampal pathway fibers in the mouse. Frontiers in Neuroanatomy. 11, 107 (2017).
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Reid, K. H., Edmonds, H. L., Schurr, A., Tseng, M. T., West, C. A. Pitfalls in the use of brain slices. Progress in Neurobiology. 31 (1), 1-18 (1988).
- Brini, M., Calì, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences: CMLS. 71 (15), 2787-2814 (2014).
- Gleichmann, M., Mattson, M. P. Neuronal calcium homeostasis and dysregulation. Antioxidants & Redox Signaling. 14 (7), 1261-1273 (2011).
- Padamsey, Z., Foster, W. J., Emptage, N. J. Intracellular Ca(2+) release and synaptic plasticity: a tale of many stores. The Neuroscientist: A Review Journal Bringing Neurobiology, Neurology and Psychiatry. 25 (3), 208-226 (2019).
- Chen-Engerer, H. J., et al. Two types of functionally distinct Ca2+ stores in hippocampal neurons. Nature Communications. 10 (1), 3223 (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 32 (40), 13819-13840 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten