Method Article
Fare Beyninin Yatay Hipokampal Dilimleri
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu makale, farelerde yatay hipokampal beyin dilimleri elde etmek için sistematik bir protokolü tanımlamayı amaçlamaktadır. Bu metodolojinin amacı, dentat girus ile ilgili nörolojik süreçleri değerlendirmek için perforant yol ve yosunlu lif yolu gibi hipokampal lif yollarının bütünlüğünü korumaktır.
Özet
Hipokampus, beyinde limbik sistemin bir parçası olan ve alzheimer hastalığı ve epilepsi de dahil olmak üzere ağır beyin bozukluklarının tezahürünün yanı sıra hafıza oluşumu ve konsolidasyonunda yer alan son derece organize bir yapıdır. Hipokampus, iç ve dış beyin yapıları ile uygun bir iletişimi güvence altına alarak yüksek derecede bağlantı içi ve ara bağlantı alır. Bu bağlantı, fiber yollar şeklinde farklı bilgi akışları ile gerçekleştirilir. Beyin dilimleri hipokampüsün nörofizyolojik fonksiyonlarını keşfederken sıkça kullanılan bir metodolojidir. Hipokampal beyin dilimleri, elektrofizyolojik kayıtlar, hafif mikroskobik ölçümlerin yanı sıra çeşitli moleküler biyolojik ve histokimyasal teknikler de dahil olmak üzere birkaç farklı uygulama için kullanılabilir. Bu nedenle, beyin dilimleri protein fonksiyonlarını değerlendirmek, nörolojik bozukluklarda yer alan patofizyolojik süreçleri araştırmak ve ilaç bulma amacıyla ideal bir model sistemi temsil eder.
Dilim hazırlamanın birkaç farklı yolu vardır. Vibratomlu beyin dilimi preparatları, doku yapısının daha iyi korunmasını sağlar ve dilimleme sırasında yeterli oksijen kaynağını garanti eder, bu da bir doku helikopterinin geleneksel kullanımına göre avantajlar sunar. Ayrıca vibratom beyin dilimi preparatları için farklı kesme düzlemleri uygulanabilir. Burada, fare beyinlerinin vibratom kesimli yatay hipokampal dilimlerinin başarılı bir şekilde hazırlanması için ayrıntılı bir protokol sağlanmaktadır. Diğer dilim preparatlarının aksine, yatay dilimleme, hipokampal giriş yolunun liflerini (perforant yol) bir dilim içinde tamamen bozulmamış bir durumda tutmaya izin verir, bu da entorhinal-hipokampal etkileşimlerin araştırılmasını kolaylaştırır. Burada, murine beyninin diseksiyonu, ekstraksiyonu ve akut yatay dilimlemesi için kapsamlı bir protokol sunuyoruz ve bu tekniğin zorluklarını ve potansiyel tuzaklarını tartışıyoruz. Son olarak, diğer uygulamalarda beyin dilimlerinin kullanımı için bazı örnekler göstereceğiz.
Giriş
Hipokampüsün kapsamlı keşfi, Scoville ve Milner'ın şiddetli epilepsi tedavisi olarak hipokampus ve yakındaki temporal lob yapılarının cerrahi olarak çıkarılmasından sonra bir hastanın (H.M.) yeni, bildirimsel hafıza oluşturamadığı bildirildiğinde başladı1. O andan itibaren, hipokampus genel nöronal özelliklerden ve işlevlerden başlayarak epilepsi ve Alzheimer hastalığı 2 ,3,4,5gibi ağır beyin bozukluklarının gelişimine kadar kapsamlı bir şekilde incelenmiştir. Hipokampus, duygu ve hafıza oluşumunda yer alan bir grup ilgili beyin yapısından oluşan limbik sistemin bir parçasıdır6,7. Birkaç fiber yoldan oluşan yoğun bir ağ, iç ve dış beyin yapılarına sıkı bir hipokampal bağlantı sağlar. Bu yollar medial ve lateral perforant yolu (girus, CA3 – CA1 ve subiculum dentate için entorhinal korteks)8,yosunlu lif yolu (dentat girus CA3)9 ve Schaffer kollateral/derneksel komiser yolu (CA3 ila CA1)10 (Şekil 1). Hipokampus, nöronal tabaka oluşumunun yüksek oranda korunmuş laminar organizasyonu ve hayati nöronal kültürleri ve beyin dilimlerini göreceli kolaylıkla elde etme imkanı nedeniyle şimdiye kadar en geniş olarak keşfedilen beyin alanlarından birini sunar5.
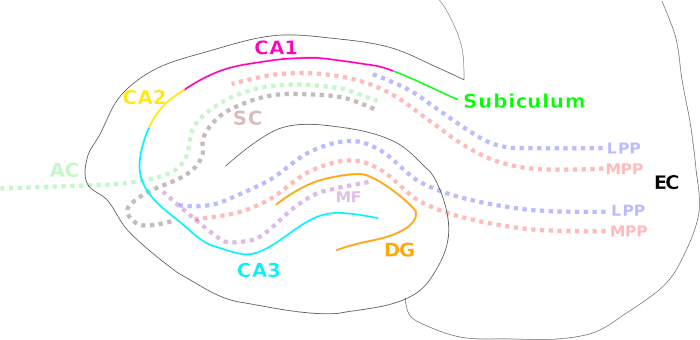
Şekil 1: Farklı hipokampal bölgeleri ve ana lif yollarını gösteren karikatür. Farklı hipokampal bölgeler düz renkli çizgilerle belirtilir: entorhinal korteks (EC; siyah), dentat girus (DG; turuncu), Cornu Ammonis (CA) 3 (siyan), 2 (sarı) ve 1 (macenta) ve subikülum (yeşil). Lif yolları renkli noktalı bir çizgi ile gösterilir: medial (MPP, kırmızı) ve lateral perforant yolu (LPP, mavi) (entorhinal korteksten dentat girusa, CA3, CA1 ve subiculum), yosunlu lif yolu (MF, mor) (dentat girusundan CA3'e) ve Schaffer teminatı (SC, kahverengi) (CA3'ten CA1'e kadar ipsilateral)/ilişkisel komiserlik yolları (AC, açık yeşil) (CA3'ten CA1'e karşıt). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Beyin dilimi protokolleri genellikle daha uzak beyin bölgelerinden ilgi alanına bağlantıların kaybolmasına neden sonuçlanır5. Ayrıca, kılcal damarlar artık işlevseldeğildir 5 ve kan dolaşımı11. Bu sınırlamalara rağmen, beyin dilimleri bir dizi avantaj nedeniyle hipokampüsün nörofizyolojik işlevlerinin araştırılması için hala kullanılmaktadır. İlk olarak, hipokampüsün ekstraksiyonu hızlı12'dir ve çok fazla malzeme gerektirmez. Tek temel aletler arasında diseksiyon kiti, laboratuvar su banyosu, karbojene erişim ve titreşimli mikrotom (vibratom)13bulunur. Beyin dilimi tekniğinin diğer varlıkları, kan-beyin bariyerinin (BBB) atlatılması ve deney başlamadan önce endojen olarak salınan moleküllerinyıkanmasıdır 5, bu da nispeten hassas dozaj kontrolü ile ilaçların etkisini incelemeyi mümkün kılar14. Ayrıca, beyin dilimleri hipokampus15,16içindeki sito mimarisini ve sinaptik devreleri korur Nöroanatomi ve nöronal bağlantı ve karmaşık nöron-glia etkileşimleri ile yerel çevre4,11,17korunur. Ek olarak, hipokampal lif bağlantıları ağırlıklı olarak tek yönlüdür ve hipokampal nöronlar, nörolojik süreçleri anlamak için yüksek kaliteli elektrofizyolojik kayıtların toplanmasını ve yorumlanmasını muazzam derecede basitleştiren yüksek sinaptik plastisiteye sahiptir18,19. Daha da önemlisi, beyin dilimleri, moleküler biyolojik tekniklerden görüntüleme kayıtlarına kadar elektrofizyolojik ölçümlere kadar çok çeşitli bilimsel tekniklerde uygulanabilir değerli bir varlık sunar12,20,21,22,23,24,25,26.
Yukarıda özetlendiği gibi, hipokampal beyin dilimleri sinaptik bağlantının yapısal ve fonksiyonel özelliklerini incelemek için güçlü bir deneysel araç sunar. Bu, kimyasalların veya mutasyonların nöronal genişletilebilirlik ve plastisite üzerindeki etkilerini değerlendirme fırsatı sunar16.
Akut beyin dilimi preparatları nispeten hassas bir teknik sunuyor ve optimal dilim kalitesi, hayvanın yaşı, ötanazi yöntemi, diseksiyon ve dilimleme hızı, dilimleme çözeltileri ve parametreleri (örneğin, dilimleme hızı) ve dilim kurtarma koşulları da dahil olmak üzere ideal deneysel koşullara oldukça bağlıdır4. Bu nedenle, iyi tasarlanmış bir protokol son derece önemlidir ve farklı araştırma birimlerinde tekrarlanabilirliği güvence altına13.
Burada, hipokampal lateral ve medial perforant yolun bütünlüğünü ve yosunlu lif yolunu korumak amacıyla akut yatay hipokampal dilim preparatları için ayrıntılı bir protokol sunuyoruz, dentat girus ile ilgili süreçlerin araştırılmasına izin veriyoruz9. Temel koşullar altında ve vahşi tip C57BL/6J farelerdeki beyin dilimlerinde LTP indüksiyon protokolleri sırasında kalsiyum-mikroflüorimetrik kayıtların ve alan uyarıcı postsinaptik potansiyel kayıtların (fEPSP' ler) temsili sonuçlarının ardından, murine beynini parçalamak, ayıklamak ve yatay olarak dilimlemenin temel adımlarını ayrıntılı olarak açıklayacağız.
Protokol
Bu çalışma için tüm hayvan deneyleri KU Leuven (Belçika) etik inceleme komitesi (P021/2012) tarafından onaylanmıştır.
1. Yüksek sakkaroz dilim çözeltisi ve yapay beyin omurilik sıvısının (ACSF) hazırlanması
- Deneysel günden önce
- 10x dilim ön çözeltinin 1 L'sini laboratuvar sınıfı Tip 1 su içeren (mM olarak) hazırlayın: 25 KCl, 20 CaCl2, 10 MgSO4, 12.5 KH2PO4 (Tablo 1). Kalsiyum fosfat çökeltisini önlemek için, kimyasalları manyetik bir karıştırıcı ile sürekli karıştırırken 800 mL H2O ile önceden doldurulmuş bir beherde yavaşça karıştırın. Çözeltiyi 4 °C veya oda sıcaklığında (RT) saklayın.
- Deneysel günde
- 1x ACSF'nin 1 L'sini laboratuvar sınıfı Tip 1 su içeren (mM olarak): 125 NaCl, 2,5 KCl, 2 CaCl2, 1 MgSO4, 1,25 NaH2PO4, 26 NaHCO3, 25 Glikoz (Tablo 2)ile hazırlayın. 305-315 mOsm (pH ~ 7.55–7.6) arasındaki ozmolariteyi doğrulamak için buhar basıncı kilometre sayacı kullanın.
NOT: Kalsiyum fosfat çökeltisini önlemek için, manyetik bir karıştırıcı ile sürekli karıştırırken, 800 mL H2O ile önceden doldurulmuş bir beherde tüm katı kimyasalları yavaşça karıştırın. 1 M stok çözümlerinden gerekli miktarda yavaşça damlayan MgSO4 ve CaCl2'yi en sonuna ekleyin. - RT'de sürekli kabarcık 1x ACSF çözümü, pH'ı 7,3–7,4 arasında ayarlamak için karbojen ile.
NOT: pH biraz fazla yüksek veya çok düşükse, karbojenasyon mukavemetinde küçük ayarlamalar yeterli olacaktır. pH karbojenasyon ile 7,45'ten yüksekse, birkaç damla 1 M NaH2PO4 çözeltisi ekleyerek ayarlayın. - 25 mL 10x dilim ön çözelti ve (mM olarak): 252 Sakkaroz, 26 NaHCO3ve 10 Glikoz(Tablo 3)içeren bir beherde 250 mL (beyin başına) 1x yüksek sakkaroz dilim çözeltisi hazırlayın. Osmolaritenin 320-325 mOsm (pH ~ 7,55–7,6) arasında olduğunu doğrulayın.
- pH'ı 7.3–7.4 arasında kontrol etmek için yüksek sakkaroz dilim çözeltisini karbojen ile 10-15 dakika kabarcıklayın.
NOT: pH karbojenasyon ile 7,45'ten yüksekse, birkaç damla 1 M KH2PO4 çözeltisi ekleyerek ayarlayın. - Yüksek sakkaroz dilim çözeltisini kısmen donana kadar ultra dondurucuda (-80 °C) 20-30 dakika saklayın.
- 1x ACSF'nin 1 L'sini laboratuvar sınıfı Tip 1 su içeren (mM olarak): 125 NaCl, 2,5 KCl, 2 CaCl2, 1 MgSO4, 1,25 NaH2PO4, 26 NaHCO3, 25 Glikoz (Tablo 2)ile hazırlayın. 305-315 mOsm (pH ~ 7.55–7.6) arasındaki ozmolariteyi doğrulamak için buhar basıncı kilometre sayacı kullanın.
2. Beyin diseksiyonu için çalışma alanının hazırlanması
- Yüksek sakkaroz dilim çözeltisinin soğuması sırasında aşağıdakileri hazırlayın.
- Su banyoyu 32 °C'ye ısıtın.
- Geri kazanım odasını (Şekil 2A) karbojen acsf çözeltisi ile doldurun ve odayı su banyosuna yerleştirin. Ana ACSF şişesine ve kurtarma odasındaki ACSF'ye sürekli karbojen uygulayın.
- Hayvanı deney odasına yerle bir et.
NOT: Hayvanın yaşı, cinsiyeti ve suşu bireysel deneyci tarafından belirlenmek zorunda ve belirli bir çalışma sorusuna bağlıdır. Bununla birlikte, hayvanın parametreleri, farklı deneysel günler arasında karşılaştırılabilmeyi garanti etmek için bir çalışma içinde sabit kalmalıdır. Bu protokol 2-6 haftalıkken C57BL/6J erkek farelerin kullanımı için tasarlanmıştır. Yaşlı hayvanlar kullanılacaksa, akut dilimlerin beyin sağlığını korumak için dilim ve iyileşme çözeltilerinin buna göre uyarlanmış olması gerekebilir4,27 (örneğin, NMDG+bazlı çözeltiler 23,28). - Anestezi odasını hazırlayın.
- Kağıt mendil, geniş açıklıklı plastik Pasteur pipet (açık kesilmiş), buzla dolu 90 mm kültür yemeği, soğutulmuş kültür çanağının üstünde bir filtre kağıdı karesi, kafa kesme için güçlü makas, diseksiyon makası, kavisli forseps, spatula, 35 mm kültür çanağı, ince fırça, bıçak, numune plakası (vibratom ile birlikte gelir), süper tutkal, pipet ucu, dört filtre kağıdı kayışı (~ 2 cm x 0,5 cm) (Şekil 2A).
- Vibratomu ayarlayın: İlk olarak, vibratomu doğru ayarlar için programlayın (bıçak hareket hızı: 0,08 mm / s, kesme genliği: 1,4 mm, kesme frekansı: 85 Hz) ve karbojen çizgisini dilim odasına takın. Daha sonra, dilim odasını tutucuya yerleştirin, dilim odasını çevreleyen tutucuyu buzla doldurun ve her şeyi vibratome takın. Son olarak, jiletleri vibratom bıçağı tutucusuna yerleştirin (Şekil 2B).
- Yüksek sakkaroz çözeltisinin dondurulmasının ardından aşağıdaki adımları uygulayın.
- 20-30 dakika sonra, yüksek sakkaroz dilim çözeltisini -80 °C ultra dondurucudan alın ve kabı buzda tutun.
- Yüksek sakkaroz çözeltisini tezgahınızdaki vibratozun yanına yerleştirin, kısmen donmuş çözeltiyi ezin ve güzel bir çamur elde etmek ve karbojenle köpürmeye başlamak için bir spatula ile karıştırın.
- Soğutulmuş 90 mm'lik kültür yemeğinin üzerine kare filtre kağıdını batırmak için plastik Pasteur pipet ile bazı yüksek sakkaroz dilim çözeltisi alın.
- 35 mm'lik kültür çanağı (veya tüm beyni depolamaya uygun herhangi bir eşdeğer küçük kabı) yüksek sakkaroz dilim çözeltisi (tüm beyni örtmek için yeterli) ile% 75'e kadar doldurun ve kültür yemeğini çözeltinin geri kalanıyla birlikte kabın yanında tutulan buz üzerinde soğutun. Çözeltiyi 35 mm'lik kültür çanağına koyun.
3. Murine beyninin diseksiyonu ve konumlandırılması
- Hayvanı% 5 izofluran ile uyuşturun. Pençeyi sıkıştırarak uygun anestezi derinliğini belirleyin. Pençe çekme refleksi oluşmamalıdır.
- Hayvanı kağıt mendile aktarın ve güçlü makas veya küçük bir hayvan giyotini ile kafasını koparın.
- Kafa derisini kesmek için diseksiyon makası kullanın.
- Sagittal dikiş boyunca calvaria'yı kesin ve koku ampulleri de dahil olmak üzere tüm beyin görünene kadar kavisli dikintiler yardımıyla çıkarın.
NOT: Calvaria veya tostu keskin kenarları ile beyne zarar vermemeye dikkat edin. - Beyni dikkatlice çıkarmak için bir spatula kullanın (koku ampulleri bağlı kalmalıdır).
- Soğutulmuş 35 mm'lik kültür çanağındaki beyni aktarın ve beyni ACSF dolu bir Pasteur pipetle hafifçe yıkayarak dokudaki tüm saç veya kan parçacıklarını çıkarın (kanın beyin dokusu üzerinde sitotoksik etkileri vardır29).
- Soğutulmuş 90 mm kültür çanağının üzerine ıslatılmış filtre kağıdındaki spatula yardımıyla beyni aktarın (Şekil 2A).
- Beyni ikiye bölerek iki yarımküreyi ayırmak için bir bıçak kullanın ve her iki yarımküreyi de yeni kesilmiş medial tarafa yerleştirin.
- Sırt kısmını çıkarmak için bıçak kullanın (%5-%10) beynin her yarımküreden sırt üstüne paralel bir kesikle (Şekil 2C)30 ve her iki yarımküreyi de beynin ventral kısmı yukarı bakacak şekilde taze kesilmiş tarafa yerleştirin.
- Numune plakasına bir damla süper tutkal yerleştirin ve her iki yarımküreyi de barındırmak için bir pipet ucuyla düzgün bir şekilde yayın.
- Filtre kağıdı kayışı ile ventral tarafa dokunarak kılcal kuvvetlere sahip bir yarımküreyi almak için bir filtre kağıdı kayışı kullanın, böylece dokuya zarar vermeyin.
- Yarımküreyi sırt tarafı ile numune plakasındaki tutkalın üzerine yerleştirmeden önce beynin sırt tarafını dikkatlice yarı kurutmak için başka bir filtre kağıdı kayışı kullanın. aynı prosedürü ikinci yarımküre ile tekrarlayın.
NOT: Yarımküreler, vibratom plakası üzerinde aynalı bir şekilde yatay hizalamada, rostral taraflar dışarıya bakacak şekilde ve kaudal taraflar ortada birbirine bakacak (ancak dokunmayan) olarak konumlandırılmalıdır. Her iki yarımkürenin medial tarafları vibratom bıçağına, yanal tarafları ise deneyciye doğru göstermelidir (Şekil 2D). - Numune plakasını dilimleme odasına yerleştirin ve hızlı, ancak dikkatlice, buz gibi yüksek sakkaroz dilim çözeltisi çamuru ile örtün. Çözelti tutkallara dokunduğunda, yarımküreleri katılaştıracak ve numune plakasına uygun şekilde yapıştıracaktır.
- Yarımkürelerin yüksek sakkaroz dilim çözeltisi ile düzgün bir şekilde kaplandığını garanti edin ve çözeltinin karbojen ile kabarcıklandığını onaylayın.
NOT: Diseksiyon prosedürünün tamamı mümkün olduğunca hızlı yapılmalıdır. Lütfen beynin çok uzun süre oksijen kaynağı olmadan kalmadığından emin olun. Yüksek sakkaroz dilim çözeltisi çamurunda kafa kesmeden beyin batırmasına kadar sadece 1-1,5 dakika sürmelidir. Bu, dilimin yüksek kalitesini garanti etmek için akut beyin dilimi preparatları için en kritik gereksinimdir.
4. Beynin yatay dilimlenerek
- Vibratom bıçağını yarımkürelerin medial tarafının önüne yerleştirin ve şu anda yukarı bakan yarımkürelerin ventral taraflarıyla aynı yüksekliğe indirin. Vibratom kontrolü yardımıyla bıçağı sırt yönünde 600 μm daha aşağı 200 metreye küs ve dilimlemeye başlayın. Bıçak dokuya çarpmalıdır (değilse, bıçağı ters çevirin ve biraz daha dirin). İlk iki dilim iki yarımküreden tamamen ayrılana kadar dilimleyin.
- Bıçağı ters çevirin ve 300 μm daha alıp tekrar dilimleyin.
- Hipokampus görünür hale geldiğinde (gerekirse yardım için fare31 beyin atlasını kullanın) (Şekil 2E) genişlemiş plastik Pasteur pipet ile dilimleri toplayın. Kaudat putamen hipokampus yanında görünür hale gelene kadar dilimleri toplayın. Tipik olarak, fare beyni için 8-12 dilim 300 μm (yarımküre başına 4-6) toplanabilir.
- Dilimleri toplamak ve su banyosundaki geri kazanım odasına aktarmak için plastik Pasteur pipetini kullanın(Şekil 2F) (dilim odasında dolaşmalarını önlemek için her dilimleme turundan sonra dilimleri toplayın).
NOT: Mümkün olduğunca hızlı çalışın ve yüksek sakkaroz dilim çözeltisinin tüm prosedür boyunca buz gibi ve karbojen olduğundan emin olun. Gerekirse, dilim haznesini çevreleyen buzu yeniden doldurun.
5. Elektrofizyolojik kayıtlar için beyin dilimlerinin kurtarılması
- Dilimleri ACSF dolu geri kazanım odasında 32 °C su banyosunda 1 saat bekletin.
NOT: Kurtarma odaları da ticari olarak mevcuttur. - Kurtarma odasını su banyosundan çıkar.
- Başka bir uygulamaya başlamadan önce dilimleri kurtarma için en az 30 dakika daha RT'ye yerleştirin.
6. hipokampüsün medial perforant yolundaki (MPP) fEPSP kayıtları
- ACSF çözeltisi ile doldurulup ACSF dolu kayıt odasına daldırıldığında ~2 MΩ boyutunda pipet almak için yatay pipet çekeceği ile borosilikat cam kılcal damarlardan kayıt pipetlerini çekin.
- Kayıt odasına bağlı yerçekimi kontrollü çok namlulu perfüzyon sisteminde uygun kimyasalları (örneğin Biküculline) içeren ACSF banyo çözeltisini ve ACSF solüsyonunu doldurun. Tüm çözümleri sürekli olarak karbogenat.
- Kayıt odasındaki perfüzyon hattının karşısında biten bir emme tüpüne bağlı peristaltik veya vakum pompasını açın. ACSF dolu namluyu açın ve sürekli bir akış kurmaya başlayın (saniyede 1-2 damla). Referans elektronun ACSF çözümüne batırdığını doğrulayın.
- Kurulum bilgisayarını, amplifikatörü, mikromanipülatörü, uyarıcıyı, mikroskop ışıklarını, kamerayı ve monitörü (varsa) çalıştırın.
- Elektrofizyolojik kayıtlar için uygun yazılımı açın (elektrofizyolojik ekipmanlar için birkaç farklı donanım ve yazılım sağlayıcısı vardır).
- Bir beyin dilimi yarımküresini kurtarma odasından dilim kurulumunun kayıt odasına aktarın ve dentat girus granül hücre tabakası ve görüş alanındaki moleküler tabaka ile doğru yönde konumlandırın. Stimülasyon elektrodunun entorhinal korteks yönünden dilim içinde MPP'ye ulaşabildiğinden ve kayıt elektrodunun MPP'ye CA3 yönünden tam karşı taraftan erişebildiğinden emin olun.
- Kayıt odasındaki dilimi bir ataş (Şekil 3A) veya piyasada bulunan bir beyin dilimi ızgarası ile stabilize edin.
NOT: Dilim aktarımı ve konumlandırma sırasında perfüzyonu kapatmak yararlı olabilir. Bununla birlikte, beyin diliminin kalitesini garanti etmek için bu çok uzun sürmemelidir. - MPP'deki kayıt ve stimülasyon elektrotlarını granül hücre tabakasına yakın moleküler tabakanın alt üçte birine(Şekil 3B)düşürüp konumlandırın, yaklaşık 100-150 μm mesafede birbirine bakacak şekilde yerleştirin. Stimülasyon elektrodu yüzeye minimum düzeyde temas etmeli, kayıt elektrodu ise üst dilim tabakasına hafifçe sızmalıdır.
- fEPSP sinyalini elde etmek için beyin dilimine düşük yoğunluklu bir uyaran (0,1 ms için 30-50 μA) uygulayın. Gerekirse elektrotların konumunu uyarlamak (örneğin, düşük veya atipik şekilli fEPSP sinyali).
- Giriş-Çıkış eğrilerini kaydetmeye başlayın: beyin dilimine 30 s aralıklarla artan uyaran yoğunlukları uygulayın.
- Uyaran yoğunluğunu maksimum fEPSP yanıtının % 50'sine ayarlayın ve beyin dilimine 30 s aralıklarla 20-40 dakika boyunca% 50 uyaran yoğunluğunu uygulayan temel fEPSP kayıtlarını başlatın.
- Taban çizgisi kararlı görünüyorsa, ek kayıtlara (örneğin, LTP/LTD protokolleri ve/veya ilaç uygulamaları) devam edin. (MPP'de LTP indüksiyonu için burada 5 dk aralıklarla uygulanan dört çarpı 1 sn 100 Hz darbeden oluşan bir protokol kullanılmıştır. Bikükülin, şartlandırma aşamasından 10 dk önce ve 10 dk uygulandı.)
NOT: Tüm kayıtlar geçerli kelepçe modunda uygun düşük geçişli filtreleme (<5 kHz) ve örnekleme hızları (>10 kHz) ile yapılmalıdır. - Verileri uygun bir dosya biçiminde ayıklayın ve fiber vole, fEPSP genliği ve fEPSP eğimi gibi fEPSP parametrelerini analiz edin.
7. Beyin dilimlerinin kalsiyum görüntüleme kayıtları
- Bir beyin dilimi yarımküreyi 12 kuyulu bir odaya aktarın ve uygun bir kalsiyum boyası ile 30 dakika ila 1 saat boyunca yükleyin. 12 kuyulu plakanın kapağına kendi kendine yapılmış bir delikten (sıcak bir 18G iğnesi ile) bir karbojenasyon tüpü yerleştirerek yükleme çözeltisini sürekli olarak karbogenatlayın.
NOT: GCaMP gibi floresan bir muhabiri endojen olarak ifade eden genetiği değiştirilmiş hayvanlardan beyin dilimi preparatları durumunda bu adım gerekli değildir. - Kayıt kurulumunu 6.2–6.5 adımlarında açıklandığı gibi hazırlayın.
NOT: Mikrofizometrik görüntüleme deneyleri için amplifikatör veya mikromanipülatör gerekmez. Bir uyarıcının kullanımı deneye bağlıdır. Floresan görüntüleme deneyleri için özel yazılımlar gereklidir. - Yazılımı doğru görüntüleme ayarlarına ayarlayın: bu, kamera amplifikatörü ve binning ayarı, dalga boyunun ayarlanması, pozlama süresi ve zamanlama protokolünü içerir. Ayarlar tam denemelere bağlı olarak değişebilir. (Örnek izler için, deney süresince her 500 ms'de tekrarlanan 1 x 1 binning, 2,4x ön amplifikatör kazancı, 300 EM kamera kazancı, 488 nm'de 50 ms pozlama kullanılmıştır.)
- Kalsiyum boyası ile yüklendikten sonra beyin dilimi yarımküresini 12 kuyudan kayıt odasına aktarın ve mikroskop aşamasına yerleştirin.
- Kayıt odasındaki dilimi bir ataş (Şekil 3A) veya 6.7 adımında açıklanana benzer ticari olarak kullanılabilir bir beyin dilimi ızgarası ile stabilize edin.
- İlgi alanının doğru mikroskobik alanda ve odakta olduğundan emin olun.
- Diliminizde ilgi çekici birkaç bölge (ROI) seçmek için floresan görüntüleme yazılımını kullanın.
NOT: Fotobleaching nedeniyle parlaklıktaki genel dalgalanmaları takip etmek için tüm görüş alanını seçmek yararlı olabilir. - Kaydı başlatın ve deneysel test ilaçlarını seçilen zaman noktalarında uygulayın.
NOT: Hücrelerin nöronal karakterini ve dilim kalitesini doğrulamak için her deneyin sonunda yüksek bir K+ çözeltisi uygulanması önerilir. - Verileri uygun bir dosya biçiminde ayıklayın ve tüm ölçüm boyunca ROI'lerde meydana gelen floresan sinyal değişikliklerini analiz edin. ROI'ler off-line analiz sırasında da uyarlanabilir.
NOT: Beyin dilimlerindeki fEPSP kayıtlarını ve kalsiyum mikroflüorimetrisini tanımlayan diğer protokoller literatür24 , 32,33,34,35'te mevcuttur.
Sonuçlar
Protokol için gereken araçlara ve kritik adımlara genel bakış
Şekil 2, bu protokolde açıklandığı gibi yatay akut hipokampal beyin dilimlerinin hazırlanması için gerekli tüm araçları ve kritik adımları sunun. Genellikle, birkaç diseksiyon aleti ve bir dilim geri kazanım odası (Şekil 2A),bir laboratuvar su banyosu ve bir vibratom (Şekil 2B) dahil olmak üzere sınırlı sayıda anahtar enstrüman gereklidir. Şekil 2C–E, dilim hazırlama protokolü sırasında beynin ve yarımkürenin önemli adımlarını ve yönelimlerini görselleştirir. Şekil 2F, yatay beyin dilimlerinin beklenen bir sonucunun bir örneğidir.
medial perforant yolundaki fEPSP kayıtları
İyileşme döneminden sonra, beyin dilimleri fEPS'lerin elektrofizyolojik kayıtları için kullanılabilir. Burada, çok kanallı yerçekimi kontrollü perfüzyon sistemi(Şekil 3A ve Şekil 3B)ile donatılmış dik bir mikroskop kullandık. Bir cam mikropipette (~ 2 MΩ) ACSF çözeltisi ile dolduruldu ve klorlu bir banyo elektrodu ile devredeki operasyonel bir amplifikatöre monte edilen klorür kaplı gümüş bir elektrodun üzerine tutturuldu. fEPSP'ler, cam mikropipti beyin diliminin üst tabakasındaki hipokampüsün MPP'sine yerleştirilerek amplifikatör ve uygun bir kayıt yazılımı ile kaydedildi ve görselleştirildi. fEPSP'ler, kayıt elektrodunun MPP yukarı akışına farklı akım yoğunlukları uygulanarak 2 temaslı bir küme mikroelekrodu ile uyarılarak indüklendi. Bu protokolün MPP kayıtlarının nasıl elde edildiğini açıklamak için tasarlanmadığını, ancak burada açıklanan dilim hazırlama protokolünün başarısını göstermek için örnek olarak MPP'deki kayıtları kullandığını unutmayın. Birisi MPP kayıtlarını gerçekleştirmeye çalışırsa, uygun kayıt sitesini sağlamak ve MPP'yi LPP 8 , 36,37'den ayırt etmek için belirli kontroller (örneğin, eşleştirilmiş darbe kayıtları) gerekebilir.
Şekil 3C, fEPSP kaydının negatif (sol panel, düşük kaliteli dilim) ve pozitif (sağ panel, yüksek kaliteli dilim) örneğini göstermektedir. Negatif örnek izleme, gerçek fEPSP genliğinden (≈0,5 mV) daha yüksek olan büyük bir fiber vole (FV) genliği gösterir. Buna karşılık, yüksek kaliteli dilim örneği (sağ panel) küçük bir FV - fEPSP oranı ve yüksek fEPSP genliği (>0,5 mV) gösterir. Fiber vole, uyarılmış nöronal liflerin depolarizasyonu üzerine oluşan ve bu nedenle postsinaptik potansiyasyondan (fEPSP) önce gelen sinyaldir. FV'nin fEPSP özellikleri ile ilişkisi, aksonal ve sinaptik özelliklerin korunması hakkında önemli bilgiler sağlar. Bozulmamış sinir liflerine sahip yüksek kaliteli dilimler FV oranına yüksek fEPSP genliği göstermelidir. Aksine, iletim özellikleri bozulmuş düşük kaliteli dilimler fEPSP ila FV oranında azalacaktır. Benzer şekilde, bir beyin diliminin uygulanabilirliği fEPSP eğimleri fiber vole genliklerine göre çizilerek analiz edilebilir (Şekil 3D).
Ayrıca, dilim kalitesini belirlemek için Giriş-Çıkış eğrileri (fEPSP eğimi ve uyaran yoğunluğu üzerinde FV genliği) standart olarak kullanılmaktadır. Bu eğriler, beyin dilimine artan akım uyaranları uygulanarak ve sonraki fEPSP yanıtları izlenerek elde edilir. Düşük kaliteli beyin dilimleri, kötü korunmuş beyin dokusunun yetersiz iletim özellikleri nedeniyle düşük bir Giriş-Çıkış eğrisi gösterir(Şekil 3E,F). Ayrıca, sinaptik süreçlerin araştırılması için ideal stimülasyon yoğunluk aralığını tanımlamak için Giriş-Çıkış eğrileri gereklidir. İdeal olarak, uyaran yoğunluğu maksimum yanıtlar için yoğunluğun yaklaşık% 50'si olarak ayarlanmalıdır. Seçilen bu uyaran yoğunluğunda, fEPSP yanıtları sinaptik plastisitedeki herhangi bir değişiklik için oldukça hassastır, bu da hem uzun vadeli potansiyasyonu (LTP) hem de uzun süreli depresyonu (LTD) araştırma fırsatı sunar.
Sinaptik plastisiteyi incelemek için, seçilen% 50 uyaran yoğunluğunda beyin diliminin (fEPSP eğimi) sinaptik iletimi, koşullandırma aşamasından önce daha uzun bir süre (genellikle 20-40 dakika arasında) izlenir. Uygulanabilir beyin dilimleri sabit taban çizgilerine sahip olurken, kararsız bir taban çizgisine sahip beyin dilimleri, beyin devrelerinin sinaptik plastisitesini incelemek için daha fazla koşullandırma protokolü için kullanılamaz(Şekil 3G, üst panel). fEPSP taban çizgisi kayıtları, sinaptik iletimin kendisi üzerindeki ilaç etkilerini izlemek için de yararlı olabilir(Şekil 3G, alt panel). Kaydedilen fEPSP taban çizgisi sinyallerinin ortalaması genellikle bir fEPSP zaman kursunu normalleştirmek için kullanılır ve standart olarak%100 olarak ayarlanır.
Sinaptik plastisite, beyin dilimlerine özel şartlandırma protokolleri uygulanarak incelenebilir. Bu protokoller araştırılan beyin devresine ve ilgi mekanizmasına (örneğin, LTP veya LTD) bağlıdır. Dentat girusunun MPP'sinde LTP'yi teşvik etmek için, MPP sinapslarında bulunan güçlü GABAerjik inhibisyon nedeniyle güçlü bir şartlandırma protokolügereklidir 38. GabAergic inhibisyonun yüksek sakkaroz dilimleme çözeltileri ile hazırlanan beyin dilimlerinde daha da belirgin olduğu bildirilmektedir39. Burada, GABAA reseptör antagonisti Bicuculline (Şekil 3H)ile tedavi edilirken 5 dakika aralıklarla uygulanan 1 s uzunluğunda 100 Hz darbelerin dört stimülasyonundan oluşan bir protokol kullanıyoruz. Kondisyon döneminde NMDA ve Biküllin'in birlikte eklenmesi LTP'nin artmasına neden olur (Şekil 3H). Dilimin düşük kalitesi ve kararsız sinaptik iletim (fEPSP taban çizgisi) ltp ve LTD indüksiyonunun değişmesine veya başarısız hale düşmesine neden olabilir. Bu nedenle, yüksek kaliteli dilim preparatları ile çalışmak ve sıkı dışlama kriterleri (fiber vole oranına düşük fEPSP genliği (<3), küçük fEPSP eğimi (<0,5 mV/ms) veya genlik (<0,5 mV) ve kararsız fEPSP taban çizgisi (%5'ten fazla değişiklik) kullanmak büyük önem taşımaktadır. sinaptik süreçler araştırılırken dayanılmaz dilimler için.
Dentat girusunun granül hücre tabakasında kalsiyum mikroflüorimetrik ölçümleri
İyileştikten sonra, oda sıcaklığında bir beyin dilimi, ışıktan korunan karbojene ASCF'de 1 saat boyunca kalsiyuma duyarlı bir boyanın 2 μM'si ile inkübe edildi. Dilim, çok kanallı yerçekimi kontrollü perfüzyon sistemi ile donatılmış dik bir floresan mikroskop üzerinde bir kayıt odasına (Şekil 3A) aktarıldı. Floresan emisyon görüntüleri 488 nm'de(Şekil4A,B)aydınlatmadan sonra her 500 milisaniyede bir elde edilmiştir. Bir Xenon lamba ve tarayıcıya monte edilmiş kırınım ızgara monokromatörü ile heyecanlandırma yapıldı ve bilgisayar kontrollü bir CCD kamera ile görüntü alımı gerçekleştirildi. Ölçümler sırasında, dilim NMDA reseptör antagonisti APV ile tedavi edildi ve bu da hücre içi kalsiyum konsantrasyonunda bir azalmaya neden oldu. Dilimin yüksek potasyum konsantrasyonu (50 mM) içeren hücre dışı bir çözelti ile uyarılması, nöronların depolarizasyonu ve voltaj kapılı iyon kanallarının açılması nedeniyle büyük bir hücre dışı kalsiyum akışına neden oldu (Şekil 4C).
| Bileşik | Konsantrasyon (mM) | Moleküler ağırlık (g/mol) | Tutar (g) |
| Kartal | 25 | 74.55 | 1.86 |
| CaCl2 * 2H2O | 20 | 147.01 | 2.94 |
| MgSO4 * 7H2O | 10 | 246.48 | 2.46 |
| KH2PO4 | 12.5 | 136.08 | 1.7 |
Tablo 1: 10 x dilim ön çözelti (1 L).
| Bileşik | Konsantrasyon (mM) | Moleküler ağırlık (g/mol) | Tutar (g) |
| Nacl | 125 | 58.44 | 7.3 |
| Kartal | 2.5 | 74.55 | 0.19 |
| CaCl2 * 2H2O | 2 | 1 M CaCl2 çözümünden | 2 mL |
| MgSO4 * 7H2O | 1 | 1 M MgSO4 çözümünden | 1 mL |
| NaH2PO4 * 2H2O | 1.25 | 156.02 | 0.2 |
| NaHCO3 | 26 | 84.01 | 2.18 |
| Glikoz * H2O | 25 | 198.17 | 4.95 |
Tablo 2: 1x ACSF (1 L) (305-315 mOsm arasında osmolarite).
| Bileşik | Konsantrasyon (mM) | Moleküler ağırlık (g/mol) | Tutar (g) |
| 10x dilim presolution | Yok | Yok | 25 mL |
| Sakaroz | 252 | 342.3 | 21.57 |
| NaHCO3 | 26 | 84.01 | 0.55 |
| Glikoz * H2O | 10 | 198.17 | 0.49 |
Tablo 3: 1x yüksek sakkaroz dilim çözeltisi (250 mL) (320-325 mOsm arasında ozmolarite).
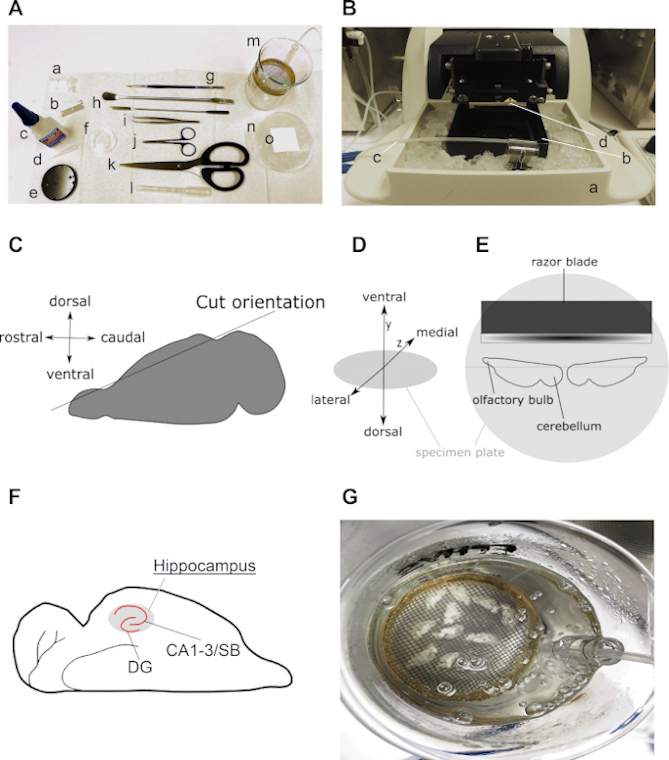
Şekil 2: Yatay hipokampal beyin dilimlerinin hazırlanması hakkında detaylı bilgi. (A) Kemirgen beyninin diseksiyonu ve dilimlemesi için gerekli aletlerin görüntüsü: (a) ±2 cm uzunluğunda ve ±0,5 cm genişliğinde filtre kağıdı kayışları (örneğin, sınıf 413); (b) bıçak; (c) süper tutkal; (d) pipet ucu; (e) numune plakası (vibratom ile birlikte gelir); (f) 35 mm kültür yemeği; (g) ince fırça; (h) spatula; (i) kavisli kümesler; (j) diseksiyon makası; (k) güçlü makas (bıçak uzunluğu 10 cm'nin üzerinde); (l) geniş açıklıklı plastik Pasteur pipet (çapı 0,6 ila 0,8 cm arasında); (m) geri kazanım odası (250 mL beher, plastik halka, naylon ağ, 10 mL serolojik pipet parçası ile kendi kendine yapılır); (n) Soğutulmuş kültür yemeğinin üzerine buz ve (o) kare filtre kağıdı ile dolu 90 mm kültür yemeği. (B) (a) buzla dolu dilim odası tutuculu bir vibratozun resmi; (b) dilim odası; (c) karbojen hattı ve (d) jilet dilimleme. (C) Beyni yatay dilimleme için hazırlamak için bir yarımkürenin dorsal tarafının kesiminin yönünü gösteren karikatür (bkz. adım 3.9). (D) Vibratom numune plakası üzerinde beyin yönünün izometrik projeksiyonu. (E) İki yarımkürenin numune plakası üzerindeki konumunu gösteren karikatür. (F) Hipokampüsün yatay beyin dilimindeki konumunu gösteren karikatür. Hipokampüsün dentat girus (DG) ve Cornu Ammonis (CA)–Subiculum (SB) bölgeleri endikedir. (G) On taze dilimlenmiş yatay beyin dilimi içeren karbojen acsf ile bir kurtarma odasının resmi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
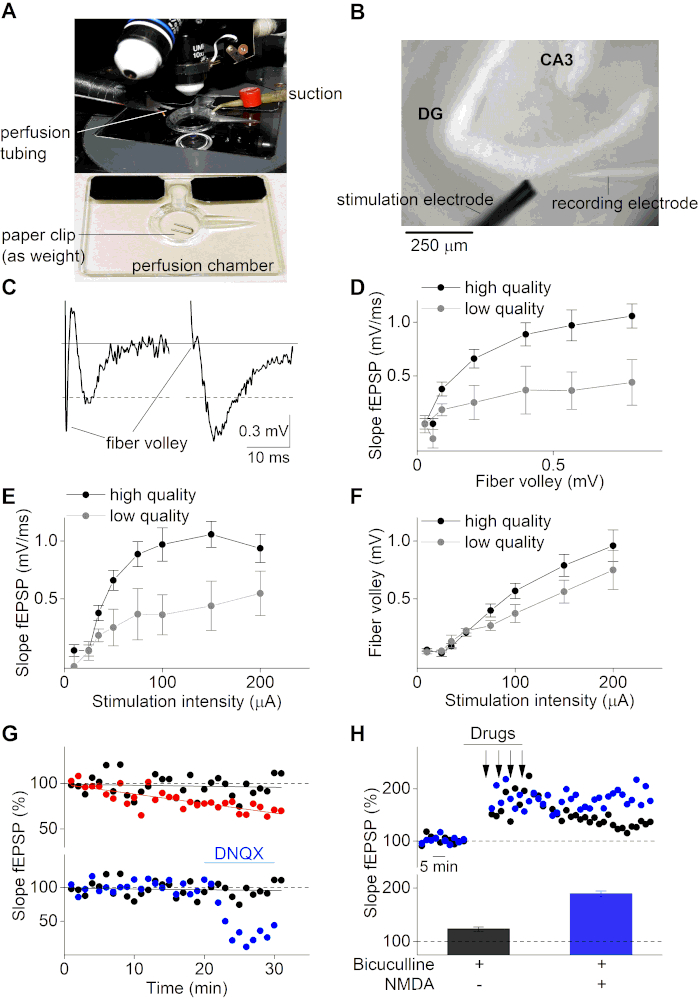
Şekil 3: Hipokampal beyin dilimlerinin elektrofizyolojik kayıtları. (A) Dik mikroskop altında kullanılan perfüzyon ve emişli bir kayıt odasının görüntüsü. Kayıtlar başlamadan önce odaya bir beyin dilimi yerleştirilecek ve bir ataş parçası ile hareketsiz hale getirilecektir. (B) Dik mikroskop altında hipokampal beyin diliminin parlak alan resmi (10x amaç). Dentat girus (DG) ve CA3 bölgesi, fEPSP kayıtları sırasında medial perforant yolunu hedef alan stimülasyon (sol alt) ve kayıt (sağ alt) elektrotlarının yanı sıra gösterilir. (C) Sol: sağlam bir fiber vole ve küçük bir genlik ile fEPSP kaydının düşük kaliteli bir dilim örneğinin temsili. Sağ: fEPSP kaydının yüksek kaliteli dilim örneği. Gri çizgi taban çizgisi düzeyini gösterir. Noktalı çizgiler 0,5 mV'lik kesme genliğini işaret eder. (D) Yüksek kalite (siyah; n=10) ve düşük kaliteli beyin dilimleri (gri; n=4) için FV genliğine karşı fEPSP eğiminin arsası. Veriler, yüksek kaliteli dilimler (siyah; n = 10) ve düşük kaliteli dilimler (gri; n = 4)) için farklı stimülasyon yoğunlukları (μA) için ortalama ± SEM. (E) Giriş-Çıkış grafiği (fEPSP eğimi) olarak temsil edilir. (F) Aynı içinde olduğu gibi (E) ama FV genlikleri için uyaran yoğunlukları karşı. (G) Üç farklı temel fEPSP kaydının zaman dilimi (fEPSP eğimi %; ilk 5 dakikanın ortalama fEPSP eğimine normalleştirilmiş). Üst panel, ikincisinin kayıt sırasında karbojen ihmali nedeniyle kararsız bir taban çizgisine sahip olduğu pozitif (siyah) ve negatif (kırmızı) bir örneği temsil eder. Alt panelde tedavi edilen iki kararlı taban çizgisi kaydı gösterilir (20 dakikalık kararlı taban çizgisi sonrasında AMPA reseptörleri AMPA reseptör antagonisti DNQX (10 μM)) (mavi) ve tedavi edilmemiş durum (siyah) uygulaması ile engellenmiştir). (H) LTP kayıtlarının farklı tedavi koşulları için zaman seyri (alt panelde belirtilir). Şartlandırma sırasında Biküllin (20 μM) uygulaması için siyah renk ve koşullandırma sırasında Bikülin (20 μM) ve NMDA (10 μM) birlikte uygulanması için mavi. Üst paneldeki oklar, yüksek frekanslı stimülasyonun uygulandığı zaman noktalarını gösterir (100Hz'in 4 x 1'i). Alt paneldeki çubuk grafik ortalama fEPSP eğimlerini temsil eder (%) üst panelde gösterilen deneylerin LTP indüksiyonu sonrası 50-60 dakika boyunca (her koşul için tek temsili kayıt). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
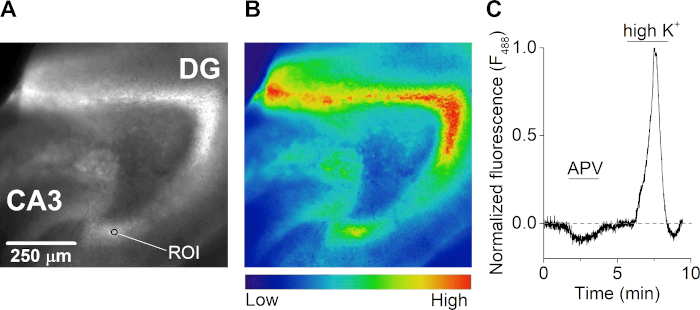
Şekil 4: Hipokampal beyin dilimlerinin kalsiyum-mikroflüorimetrisi. (A ve B) Fare beyninin yatay hipokampal beyin diliminin floresan görüntüsü (488 nm'de heyecanlı) (A) ve karşılık gelen ısı haritası (B). Dentat girus (DG), CA3 bölgesi, ve ilgi çekici bir bölgeye (ROI) örnek olarak panel A. (C) NMDA reseptör antagonisti APV (50 μM) ve yüksek hücre dışı potasyum (K+) (50 mM) içeren çözelti ile tedavi sırasında akut hipokampal beyin diliminin dentat girusunda bir yatırım getirisinin (F488nm) zaman seyri belirtilir. İz, yüksek K+ perfüzyon sırasında en yüksek kalsiyum yanıtına normalleştirilir ve fotobleaching için taban çizgisi düzeltilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Nörobilim topluluğu arasında yaygın olarak kullanılmasına rağmen, beyin dilimi preparatları da çeşitli dezavantajlarla karşı karşıyadır. Örneğin, ilgi çekici beyin alanlarına giriş ve çıkış bağlantıları artık bir beyin diliminde bağlı değildir. Ayrıca, izole edildikten sonra, doku zamanla yavaşça bozulmaya başlar ve bu işlem beyin diliminin fizyolojik koşullarını değiştirebilir. Özellikle bu konu çok endişe vericidir, çünkü çoğu beyin dilimi kaydı birkaç dakika ila saatler sürer, bu da deney başlamadan önce 6-8 saate kadar izole edilen doku üzerinde gerçekleştirilen kayıtlarla uzun deneysel günlerle sonuçlanır. Ayrıca, beyin omurilik sıvısı ve kan dolaşımı dilim preparatları sırasında kesilir ve bu da bir beyin dilimi içinde önemli endojen bileşiklerin olmamasına neden olabilir. Ve en açık şekilde, dilimleme prosedürünün kendisi elde edilen sonuçları tehlikeye atabilecek mekanik doku hasarına neden olabilir. Bununla birlikte, beyin dilimi preparatlarının gerçek yararları hala dezavantajlarından daha ağır basmaktadır, bu yüzden nörobilim araştırmalarında çok değerli ve kullanılan bir teknik sunarlar.
Akut hipokampal beyin dilimleri, nöronal süreçleri moleküler düzeyden karmaşık beyin devresi çalışmalarına kadar araştırmak için güçlü ve bu nedenle yaygın olarak kullanılan bir teknik sunar. Bu, bir dilim hazırlamada kolayca korunabilen hipokampüsün ideal nöroanatomisini temel18. Sonuç olarak, hipokampal beyin dilimleri, ilaç taramaları17, bilişsel işlevlerde yer alan nöronal ve sinaptik özelliklerin çalışmaları40 , 41ve patolojik beyin durumlarının araştırılması14,42,43dahil olmak üzere çok çeşitli bilimsel araştırma projelerinde kullanılmaktadır. Bununla birlikte, geniş bir farklı uygulama yelpazesi, diğerlerinin yanı sıra diseksiyon koşulları ve kesme düzlemi yönlendirmesi gibi çeşitli parametrelerde farklılık gösterebilen çok çeşitli kullanılabilir dilim hazırlama protokollerine de neden olur. Bu nedenle, uygun bir dilim hazırlama protokolünün seçilebilmesi için bilimsel bir projenin tam araştırma sorusunun belirlenmesi gerekir.
Doku helikopteri hipokampal beyin dilimlerini hazırlamak için kullanılan en eski tekniklerden birini sunar44,45. Bu hazırlık yönteminin en büyük avantajları arasında helikopterin düşük maliyeti ve hızlı ve kolay kullanımı46. Bununla birlikte, doku helikopterleri morfolojik değişikliklere ve hücre ölümüne neden olan mekanik strese neden olur47. Buna karşılık, vibratom oldukça pahalı bir makinedir ve dilim hazırlama süresi önemli ölçüde artar ve bu da dilimin kalitesi üzerinde bir etkiye sahip olabilir. Bununla birlikte, vibratom genellikle dilimleri dokudan ayırmak için daha yumuşak bir şekilde sunar ve beynin tüm izolasyon prosedürü boyunca güzelce soğutulmasını ve oksijenlenmesini sağlar, böylece dilim özelliklerini geliştirir46. Bu nedenle, birkaç grup bu tekniği standart olarak kullanmaktadır ve vibratom16,30,48 kullanılarak akut hipokampal beyin dilimlerinin hazırlanması için protokollergetirmiştir. Bazı protokoller dilimlemenin kendisi için sadece birkaç ayrıntı sağlarken, bunun yerine bu tür dilim hazırlığının belirli bir uygulamasına odaklanır48, diğerleri bu maddede verilen kesme düzlemi veya diğer protokol ayrıntılarında (örneğin, agarose gömme veya dilimleme / kurtarma çözümleri) farklılık gösteren ayrıntılı dilim protokolleri sağlar27,30.
Burada açıklanan protokol, genç hayvanlardan yüksek kaliteli akut yatay hipokampal fare beyin dilimleri hazırlamak için basit bir yöntem sunar. Protokol, entorhinal korteksten hipokampus8,49,50'ye kadar projelenen hipokampal giriş yolunu sunan perforant yolu (medial ve lateral) korumak için özellikle yararlıdır. Sagittal, koronal ve izole hipokampus enine dilim preparatları, çoğunlukla entorhinal korteksin Katman II ve V'sinden kaynaklanan ve hipokampus18içindeki çeşitli alanlara projelenen perforant yolu düzgün bir şekilde korumaz. Entorhinal korteksin hipokampusa göre anatomik olarak konumlandırılması nedeniyle, yatay beyin dilimleri, dilim hazırlığı içinde tamamen bozulmamış perforant yol liflerini korumak için bir gerekliliktir31. Ek olarak, yatay dilimleme ideal olarak dentat girusundan hipokampus 9,30,50içindekiCA3nöronlarına kadar projelendirici yosunlu lifleri korur. Bu nedenle, bu hazırlık yöntemi hipokampal giriş yollarını ve DG ile ilgili süreçleri araştıran çalışmalar için yüksek değerlidir. Ek olarak, bu protokol Schaffer teminat yolunun araştırılmasına izin verir50. Bununla birlikte, sagittal ve koronal beyin dilimi preparatları, CA3 ila CA1 lif projeksiyonları araştırılırken, muhtemelen yüksek kaliteli dilimler elde etme şansını artırabilecek biraz daha hızlı hazırlık süreleri nedeniyle daha yaygın olarak kullanılmaktadır. Bununla birlikte, yatay hipokampal dilim preparatları, tek dilim yarımküre içindeki tüm hipokampal lif yollarının korunmasına ve araştırılmasına izin verdiğinden güçlü bir araştırma aracı sunar. Bu, özellikle devre yanıtları incelendiğinde, örneğin çoklu elektrot tahlil kayıtlarında yararlı olabilir.
Beyin dilimleri hazırlanırken önemli bir endişe, beyin dokusunun uygun şekilde korunmasıdır. Bu, hızlı bir diseksiyon, dokunun sürekli ve yeterli oksijenlenmesi ve soğutulması ve düşük sodyumlu, yüksek sakkaroz dilimleme çözeltisi39,51ile koruyucu kesme yöntemi kullanılarak beyin dokusunun korunması dahil olmak üzere protokolümüzdeki birkaç kritik adımla gerçekleştirilir. Burada açıklanan protokolün % 90 civarında bir başarı oranı vermesine rağmen, yaşlı veya genetik olarak çeşitli hayvanlardan elde edilen dokularla çalışırken veya belirli bir hücre popülasyonu korunmaya çalışırken potansiyel olarak ek koruyucu adımlar gerekebilir. Hassas beyin dokusu preparatlarını korumak için çeşitli yöntemler zaten bildirilmiştir. Bu yöntemler arasında sodyum geçirgenliğini azaltmak için NMDG bazlı dilimleme çözeltilerinin kullanılması52, NMDA reseptör aktivitesini engellemek için dilimleme çözeltisinde yüksek magnezyum seviyelerinin kullanılması53ve kurtarma süresi boyunca koruyucu çözeltilerin uzun süreli kullanımı23. Tüm bu önlemler eksotoksisitenin azalmasına neden olacaktır. Ek olarak, buz gibi koruyucu ACSF çözeltileri ile trans-kardiyak perfüzyon genellikle yaşlı hayvanlarla çalışırken kullanılır ve gereklidir27.
Akut hipokampal beyin dilimleri, nispeten kalın (300-500 μm) akut beyin diliminden elde edilebilen ve yüksek sinyalden gürültü oranı11'igaranti eden yüksek genlik sinyalleri gibi nedenlerle elektrofizyolojik çalışmalar için idealdir ve yaygın olarak kullanılır. Standart olarak kullanılan elektrofizyolojik uygulamalar arasında hücre dışı alan kayıtları ve gerilim veya akım kelepçe modunda hücre içi tam hücre kayıtları bulunur. Yüksek kaliteli elektrofizyolojik veriler elde etmek için, dilim sağlığı birincil endişe kaynağıdır ve sunulan protokole kesinlikle uyularak garanti edilebilir. Bununla birlikte, dilim preparatları son derece hassas bir teknik sunduğundan, her deney başlamadan önce rutin olarak bir kalite kontrolü eklenmelidir. Çeşitli parametreler dilimin kalite kontrolü olarak kullanılabilir ve standart olarak Giriş-Çıkış eğrileri ve temel fEPSP veya EPSC kayıtları19ile değerlendirilir. Bununla birlikte, yetersiz elektrofizyolojik özelliklerin elektrot konumlandırma, oryantasyon ve hatta hasar gibi deneysel hatalardan kaynaklanabileceği ve sadece hazırlanan dilimin sağlığını temsil etmediğini belirtilmelidir. Bu nedenle, basit görselleştirme ve hücrelerin 40x amaç veya DAPI çekirdeği boyama altında değerlendirilmesi gibi ek kalite kontrollerinin yapılması önerilir. Bu tür kalite kontrolleri, birkaç dilim hazırlama oturumu boyunca sabit dilim sağlığını onaylamak için kullanılabilir.
Kalsiyum mikroflüorimetrisi hipokampal beyin dilimlerini incelemek için daha az kullanılan bir teknik sunar. Bununla birlikte, bu teknik, nöronal ve sinaptik sinyalizasyonda yüksek öneme sahip hücre içi kalsiyum akılarını görselleştirmeye ve ölçmeye izin verdiği için standart hücre dışı ve hücre içi elektrot kayıtlarına ek değerdedir. Hücre içi kalsiyum konsantrasyonlarındaki değişiklikler nörotransmitter vezikül salınımı, postsinaptik potansiyel nesil, sinaptik plastisitenin düzenlenmesi ve aksonal sinir iletiminde rol oynar54,55,56. Bu tekniğin bir örneği olarak (Şekil 4), piyasada bulunan bir kalsiyum boyası kullandık. Tartışmasız, doku dilimlerinin kalsiyum boyalarla tedavisi, daha yüksek deneysel zaman diliminin yanı sıra alt konumdaki nöronal hücrelerin verimsiz yüklenmesi gibi zorluklar doğurabilir. Bununla birlikte, bu teknik teknik üzerindeki varyasyonlar bu teknik zorlukları atlatmak için kullanılabilir. Örneğin, kalsiyum ölçümlerini ve yama kelepçe kayıtlarını hipokampal dilimlerde birleştirmek mümkündür. Bu şekilde, bir kalsiyum floresan boyası yama pipet aracılığıyla belirli bir hücreye yüklenebilir ve belirli bir ilgi hücresindeki kalsiyum dinamiklerinin ölçülebilmesini sağlar57. Alternatif olarak, kalsiyum göstergesini ifade eden genetik olarak tasarlanmış hayvanlar, GCaMP58, tüm beyinde veya hücreye özgü bir promotör tarafından yönlendirilebilir. İlginçtir ki, GCaMP hayvanlarından gelen ve ilgi çekici bir proteine doğrudan bağlantı sağlayan beyin dokusu, nöronal ekspresyon modelini belirlemek veya kalsiyum kıvılcımlarına ve dalgalarına katılımı araştırmak için fırsatlar sağlayabilir.
Tamamen, elektrofizyolojik ve görüntüleme kayıtları için farelerden sağlıklı ve uygulanabilir yatay hipokampal beyin dilimlerinin başarılı bir şekilde hazırlanması için kılavuzlar sunuyoruz. Bu metodoloji, dentat girusunda tanımlanan beyin patolojilerinde meydana gelen nörolojik değişikliklere erişmek için çok yararlıdır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Dr. Keimpe Wierda ve Prof. Dr. Joris De Wit gözetimindeki VIB-KU Leuven Beyin ve Hastalık Araştırmaları Merkezi Elektrofizyoloji birimine araştırma olanaklarını kullandıkları için teşekkür ederiz. Ayrıca, KU Leuven'deki İyon Kanalı Araştırma Laboratuvarı ve Endometrium, Endometriozis ve Üreme Tıbbı Laboratuvarı'nın tüm üyelerine yararlı tartışmaları ve yorumları için teşekkür ederiz.
Bu proje Araştırma Vakfı-Flanders (G.084515N ve G.0B1819N'den J.V.'ye) ve KU Leuven Araştırma Konseyi'nden (C1-funding C14/18/106 to J.V.) fon almıştır. K.P. bir FWO [PEGASUS]2 Marie Skłodowska-Curie Fellow ve Araştırma Vakfı Flanders (FWO) (12T0317N) ile Marie Skłodowska-Curie hibe anlaşması (665501) kapsamında Avrupa Birliği'nin Horizon 2020 araştırma ve inovasyon programından fon aldı. K.H., Belçika Flanders Araştırma Vakfı'nın Doktora Sonrası Üyesidir (12U7918N).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anesthesia chamber | home made - Generic | N/A | plexiglas |
| Anesthesia vaporizer | Dräger & MSS International Ltd | Isoflurane Vapor 19.3 & MSS Isoflurane | to vaporize isoflurane for rodent anesthetization |
| Barrels for the perfusion system | TERUMO | Hypodermic syringes without needle | https://www.terumotmp.com/products/hypodermics/terumo-hypodermic-syringes-without-needle.html |
| Bicuculline methiodide | hellobio | HB0893 | https://www.hellobio.com/bicuculline-methiodide.html |
| Borosilcate glass capillaries | Science Products | GB150F-8P | https://science-products.com/en/shop/micropipette-fabrication-1/capillary-glass-for-micropipette-pullers/borosilicate-glass-capillaries/borosilicate-filament-polished |
| Calcium chlorid dihydrate | Merck | 102382 | https://www.merckmillipore.com/BE/en/product/Calcium-chloride-dihydrate,MDA_CHEM-102382?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Calcium Imaging software | Till Photonics | LiveAcquisition v2.3.0.18 | |
| Carbogen tank | Air Liquide | Alphagaz mix B50 | Gasmixture CO2/O2: 5/95, purity 5 |
| Cluster microelectrode | FHC | CE2C55 | https://www.fh-co.com/product/cluster-microelectrodes/ |
| Culture dish (35 mm) | Corning Life Sciences | 353001 | https://ecatalog.corning.com/life-sciences/b2c/US/en/Cell-Culture/Cell-Culture-Vessels/Dishes%2C-Culture/Falcon®-Cell-Culture-Dishes/p/353001 |
| Culture dish (90 mm) | Thermo Fisher Scientific | 101VR20 | https://www.thermofisher.com/order/catalog/product/101R20#/101R20 |
| Curved forceps | Fine Science tools | 11270-20 | https://www.finescience.de/de-DE/Products/Forceps-Hemostats/Dumont-Forceps/Dumont-7b-Forceps/11270-20 |
| D-AP5 | hellobio | HB0225 | https://www.hellobio.com/dap5.html |
| D-(+)-Glucose monohydrate | Sigma Aldrich | 16301 | https://www.sigmaaldrich.com/catalog/product/sial/16301?lang=en®ion=BE |
| Digital CMOS camera | HAMAMATSU | ORCA-spark C11440-36U | https://www.hamamatsu.com/eu/en/product/type/C11440-36U/index.html |
| Dissection scissors | Fine Science tools | 14058-09 | https://www.finescience.de/de-DE/Products/Scissors/Standard-Scissors/Fine-Scissors-ToughCut®/14058-09 |
| DNQX | hellobio | HB0262 | https://www.hellobio.com/dnqx-disodium-salt.html |
| EMCCD camera | Andor | iXon TM + DU-897E-CSO-#BV | https://andor.oxinst.com/products/ixon-emccd-cameras?gclid=CjwKCAjw97P5BRBQEiwAGflV6ULsKjXfhN2YZxtvsWAmF4QghyXZKuqYHVMa6KU9JyS80ATQkSKeBBoCIM0QAvD_BwE |
| EPC10 USB Double Patch Clamp Amplifier | HEKA Elektronik | 895278 | https://www.heka.com/sales/brochures_down/bro_epc10usb.pdf |
| Filter paper | VWR | 516-0818 | grade 413 |
| Fine brush | Raphael Kaerell | 8204 | Size #1 |
| 18G needle | Henke Sass Wolf Fine-Ject | 18G X 1 1/2" 4710012040 | https://www.henkesasswolf.de/cms/de/veterinaer_produkte/produkte_vet/einmalkanuelen/hsw_henke_ject_einmalkanuelen/ |
| Isoflurane | Dechra Veterinary Products | Iso-Vet 1000mg/g | 250 ml bottle |
| Loctite 406 | Henkel Adhesive technologies | Loctite 406 | Super glue |
| Magnesium sulfate heptahydrate | Merck | 105886 | https://www.merckmillipore.com/BE/en/product/Magnesium-sulfate-heptahydrate,MDA_CHEM-105886?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Micromanipulator | Luigs & Neumann | SM-10 with SM-7 remote control system | https://www.luigs-neumann.org |
| Microscope (for calcium imaging) | Olympus | BX51WI | https://www.olympus-lifescience.com/de/microscopes/upright/bx61wi/ |
| Microscope (for ephys recordings) | Zeiss | Axio Examiner.A1 | https://www.micro-shop.zeiss.com/de/de/system/axio+examiner-axio+examiner.a1-aufrechte+mikroskope/10185/ |
| Microscope light source | CAIRN Research | dual OptoLed power supply | https://www.cairn-research.co.uk/product/optoled/ |
| Monochromator | Till Photonics | Polychrome V | |
| N-Methyl-D-aspartic acid (NMDA) | Sigma Aldrich | M3262 | https://www.sigmaaldrich.com/catalog/product/sigma/m3262?lang=en®ion=BE |
| Oregon Green® 488 BAPTA-1 | Invitrogen Molecular Probes | #06807 | 10x50ug |
| Osmometer | Wescor | 5500 vapor pressure osmometer | to verify osmolarity of salt solutions |
| Peristaltic pump | Thermo Fisher Scientific | Masterflex C/L 77120-62 | https://www.fishersci.be/shop/products/masterflex-peristaltic-c-l-dual-channel-pump-2/p-8004229 |
| pH meter | WTW | inoLab series pH 720 | https://www.geminibv.nl/wp-content/uploads/manuals/wtw-720-ph-meter/wtw-inolab-ph-720-manual-eng.pdf |
| Pipette puller | Sutter Instrument | P-1000 | https://www.sutter.com/MICROPIPETTE/p-1000.html |
| Potassium chlorid | Chem-lab | CL00.1133 | https://www.chem-lab.be/#/en-gb/prod/1393528 |
| Potassium dihydrogen phosphate | Merck | 104873 | https://www.merckmillipore.com/BE/en/product/Potassium-dihydrogen-phosphate,MDA_CHEM-104873?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Razor blade to prepare hemispheres | SPI supplies | Safety Cartridge Dispenser - Pkg/10 | GEM Scientific Single Edge Razor Blades |
| Razor blade for vibratome | Ted Pella Inc | 121-6 | double edge breakable style razor blades (PTFE-coated stainless steel) |
| Recovery chamber | home made - Generic | N/A | to collect and store brain slices in (see details in manuscript) |
| Scissors | Any company | N/A | Blade should be well sharpened and at least 15 cm long for easy decapitation |
| Silver electrode wire | Any company | for recording and reference electrodes | |
| Sodium dihydrogen phosphate dihydrate | Merck | 106342 | https://www.merckmillipore.com/BE/en/product/Sodium-dihydrogen-phosphate-dihydrate,MDA_CHEM-106342?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Sodium hydrogen carbonate | Alfa Aesar | 14707 | https://www.alfa.com/en/catalog/014707/ |
| Sodium chlorid | Fisher Scientific | S/3160/60 | https://www.fishersci.co.uk/shop/products/sodium-chloride-certified-ar-analysis-meets-analytical-specification-ph-eur/10428420 |
| Software for field recordings | HEKA Elektronik | PatchMaster | https://www.heka.com/downloads/software/manual/m_patchmaster.pdf |
| Spatula | Sigma Aldrich | S9147-12EA | https://www.sigmaaldrich.com/catalog/product/sigma/s9147?lang=en®ion=BE |
| Stimulator | A.M.P.I | ISO-FLEX | http://www.ampi.co.il/isoflex.html |
| Sucrose | VWR International Ltd. | 102745C | https://es.vwr-cmd.com/ex/downloads/magazine/lupc_userguide_uk.pdf |
| Tubing for carbogen, perfusion and suction lines 1 | Warner Instruments | 64-0167 | Tygon tubing (TY-50) for standard valve systems |
| Tubing for carbogen, perfusion and suction lines 2 | Fisher Scientific | 800/100/200 & 800/100/280 | Smiths Medical Portex Fine Bore LDPE Tubing |
| Vacuum pump | home made - Generic | N/A | |
| 8 valve multi-barrel perfusion system | home made | N/A | consists of barrels, tubing and a self-made automated valve control (specifications of all purchased parts can be found in this Table) |
| Magnetic valves (to control the perfusion lines) | NResearch Inc. | p/n 161P011 | https://nresearch.com/ |
| Vibratome | Leica | 14912000001 | Semi-automatic vibrating blade microomei VT1200 |
| Water bath | Memmert | WNB 7 | https://www.memmert.be/wp-content/uploads/2019/09/Memmert-Waterbath-WNB-7.en_.pdf |
| Water purification system | Merck | Synergy millipore | to obtain highly purified water |
| 12-well plates | Greiner Bio-One | CELLSTAR, 665180 | http://www.greinerbioone.com/UserFiles/File/Catalogue%202010_11/UK/3680_005-Kapitel1_UK.pdf |
Referanslar
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neurology, Neurosurgery, and Psychiatry. 20 (1), 11-21 (1957).
- Cavarsan, C. F., Malheiros, J., Hamani, C., Najm, I., Covolan, L. Is mossy fiber sprouting a potential therapeutic target for epilepsy. Frontiers in Neurology. 9, 1023 (2018).
- Nadler, J. V. The recurrent mossy fiber pathway of the epileptic brain. Neurochemical Research. 28 (11), 1649-1658 (2003).
- Raimondo, J. V., et al. Methodological standards for in vitro models of epilepsy and epileptic seizures. A TASK1-WG4 report of the AES/ILAE translational task force of the ILAE. Epilepsia. 58, 40-52 (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. , 86-98 (2015).
- Tohno, Y., et al. Relationships among the hippocampus, dentate gyrus, mammillary body, fornix, and anterior commissure from a viewpoint of elements. Biological Trace Element Research. 140 (1), 35-52 (2011).
- Maclean, P. D. The limbic system and its hippocampal formation; studies in animals and their possible application to man. Journal of Neurosurgery. 11 (1), 29-44 (1954).
- Petersen, R. P., et al. Electrophysiological identification of medial and lateral perforant path inputs to the dentate gyrus. Neuroscience. 252, 154-168 (2013).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in Brain Research. 163, 3-22 (2007).
- Szirmai, I., Buzsaki, G., Kamondi, A. 120 years of hippocampal schaffer collaterals. Hippocampus. 22 (7), 1508-1516 (2012).
- Cho, S., Wood, A., Bowlby, M. R. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Current Neuropharmacology. 5 (1), 19-33 (2007).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. Journal of Visualized Experiments. (49), e2330 (2011).
- Papouin, T., Haydon, P. G. Obtaining Acute Brain Slices. Bio-protocol. 8 (2), 2699 (2018).
- Li, Q., Han, X., Wang, J. Organotypic hippocampal slices as models for stroke and traumatic brain injury. Molecular Neurobiology. 53 (6), 4226-4237 (2016).
- Lo, D. C., McAllister, A. K., Katz, L. C. Neuronal transfection in brain slices using particle-mediated gene transfer. Neuron. 13 (6), 1263-1268 (1994).
- Lein, P. J., Barnhart, C. D., Pessah, I. N. Acute hippocampal slice preparation and hippocampal slice cultures. Methods in Molecular Biology. 758, 115-134 (2011).
- Magalhaes, D. M., et al. Ex vivo model of epilepsy in organotypic slices-a new tool for drug screening. Journal of Neuroinflammation. 15 (1), 203 (2018).
- Bliss, T., Andersen, P., Morris, R., Amaral, D., O'Keefe, J. . The hippocampus book. , 37-114 (2007).
- Bortolotto, Z. A., Amici, M., Anderson, W. W., Isaac, J. T. R., Collingridge, G. L. Synaptic plasticity in the hippocampal slice preparation. Current Protocols in Neuroscience. 54 (1), 11-26 (2011).
- Al-Osta, I., et al. Imaging calcium in hippocampal presynaptic terminals with a ratiometric calcium sensor in a novel transgenic mouse. Frontiers in Cellular Neuroscience. 12, 209 (2018).
- McLeod, F., Marzo, A., Podpolny, M., Galli, S., Salinas, P. Evaluation of synapse density in hippocampal rodent brain slices. Journal of Visualized Experiments. (128), e56153 (2017).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. 1183, 221-242 (2014).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording synaptic plasticity in acute hippocampal slices maintained in a small-volume recycling-, perfusion-, and submersion-type chamber system. Journal of Visualized Experiments. (131), e55936 (2018).
- Zhou, Q., Abe, H., Nowak, T. S. Immunocytochemical and in situ hybridization approaches to the optimization of brain slice preparations. Journal of Neuroscience Methods. 59 (1), 85-92 (1995).
- Koike-Tani, M., Tominaga, T., Oldenbourg, R., Tani, T. Birefringence changes of dendrites in mouse hippocampal slices revealed with polarizing microscopy. Biophysical Journal. 110 (10), 2366-2384 (2020).
- Ting, J. T., et al. Preparation of acute brain slices using an optimized N-Methyl-D-glucamine protective recovery method. Journal of Visualized Experiments. (132), e53825 (2018).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8 (9), 745-752 (2011).
- Hua, Y., Keep, R. F., Hoff, J. T., Xi, G. Brain injury after intracerebral hemorrhage: the role of thrombin and iron. Stroke. 38, 759-762 (2007).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Paxinos, G., Franklin, K. . The Mouse Brain In Stereotaxic Coordinates. 3 edn. , 256 (2008).
- Lacar, B., Young, S. Z., Platel, J. C., Bordey, A. Preparation of acute subventricular zone slices for calcium imaging. Journal of Visualized Experiments. (67), e4071 (2012).
- Schauer, C., Leinders-Zufall, T. Imaging calcium responses in GFP-tagged neurons of hypothalamic mouse brain slices. Journal of Visualized Experiments. (66), e4213 (2012).
- Tetteh, H., Lee, J., Lee, J., Kim, J. G., Yang, S. Investigating Long-term Synaptic Plasticity in Interlamellar Hippocampus CA1 by Electrophysiological Field Recording. Journal of Visualized Experiments. (150), e59879 (2019).
- Smith, C. J., et al. Investigations on alterations of hippocampal circuit function following mild traumatic brain injury. Journal of Visualized Experiments. (69), e4411 (2012).
- McNaughton, B. L. Evidence for two physiologically distinct perforant pathways to the fascia dentata. Brain Research. 199 (1), 1-19 (1980).
- Colino, A., Malenka, R. C. Mechanisms underlying induction of long-term potentiation in rat medial and lateral perforant paths in vitro. Journal of Neurophysiology. 69 (4), 1150-1159 (1993).
- Coulter, D. A., Carlson, G. C. Functional regulation of the dentate gyrus by GABA-mediated inhibition. Progress in Brain Research. 163, 235-243 (2007).
- Kuenzi, F. M., Fitzjohn, S. M., Morton, R. A., Collingridge, G. L., Seabrook, G. R. Reduced long-term potentiation in hippocampal slices prepared using sucrose-based artificial cerebrospinal fluid. Journal of Neuroscience Methods. 100 (1-2), 117-122 (2000).
- Connor, S. A., et al. Loss of synapse repressor MDGA1 enhances perisomatic inhibition, confers resistance to network excitation, and impairs cognitive function. Cell Reports. 21 (13), 3637-3645 (2017).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Moodley, K. K., Chan, D. The hippocampus in neurodegenerative disease. Frontiers of Neurology and Neuroscience. 34, 95-108 (2014).
- Kong, H., et al. Inhibition of miR-181a-5p reduces astrocyte and microglia activation and oxidative stress by activating SIRT1 in immature rats with epilepsy. Laboratory Investigation; A Journal of Technical Methods and Pathology. , (2020).
- Skrede, K. K., Westgaard, R. H. The transverse hippocampal slice: a well-defined cortical structure maintained in vitro. Brain Research. 35 (2), 589-593 (1971).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Wang, T., Kass, I. S. Preparation of brain slices. Methods in Molecular Biology. 72, 1-14 (1997).
- Garthwaite, J., Woodhams, P. L., Collins, M. J., Balazs, R. On the preparation of brain slices: morphology and cyclic nucleotides. Brain Research. 173 (2), 373-377 (1979).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments: JoVE. (91), e51706 (2014).
- Aydin-Abidin, S., Abidin, &. #. 3. 0. 4. ;. 7,8-Dihydroxyflavone potentiates ongoing epileptiform activity in mice brain slices. Neuroscience Letters. 703, 25-31 (2019).
- Xiong, G., Metheny, H., Johnson, B. N., Cohen, A. S. A comparison of different slicing planes in preservation of major hippocampal pathway fibers in the mouse. Frontiers in Neuroanatomy. 11, 107 (2017).
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Reid, K. H., Edmonds, H. L., Schurr, A., Tseng, M. T., West, C. A. Pitfalls in the use of brain slices. Progress in Neurobiology. 31 (1), 1-18 (1988).
- Brini, M., Calì, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences: CMLS. 71 (15), 2787-2814 (2014).
- Gleichmann, M., Mattson, M. P. Neuronal calcium homeostasis and dysregulation. Antioxidants & Redox Signaling. 14 (7), 1261-1273 (2011).
- Padamsey, Z., Foster, W. J., Emptage, N. J. Intracellular Ca(2+) release and synaptic plasticity: a tale of many stores. The Neuroscientist: A Review Journal Bringing Neurobiology, Neurology and Psychiatry. 25 (3), 208-226 (2019).
- Chen-Engerer, H. J., et al. Two types of functionally distinct Ca2+ stores in hippocampal neurons. Nature Communications. 10 (1), 3223 (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 32 (40), 13819-13840 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır