Method Article
Rebanadas hipocampales horizontales del cerebro del ratón
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo tiene como objetivo describir un protocolo sistemático para obtener rebanadas cerebrales hipocampales horizontales en ratones. El objetivo de esta metodología es preservar la integridad de las vías de fibra del hipocampo, como la trayectoria perforante y el tracto de fibra musgo para evaluar los procesos neurológicos relacionados con el giro desánido.
Resumen
El hipocampo es una estructura altamente organizada en el cerebro que es una parte del sistema límbico y está involucrado en la formación y consolidación de la memoria, así como la manifestación de trastornos cerebrales graves, incluyendo la enfermedad de Alzheimer y epilepsia. El hipocampo recibe un alto grado de intra- e interconectividad, asegurando una comunicación adecuada con las estructuras cerebrales internas y externas. Esta conectividad se logra a través de diferentes flujos informativos en forma de vías de fibra. Las rebanadas cerebrales son una metodología de uso frecuente al explorar las funciones neurofisiológicas del hipocampo. Las rebanadas cerebrales hipocampales se pueden utilizar para varias aplicaciones diferentes, incluyendo grabaciones electrofisiológicas, mediciones microscópicas ligeras, así como varias técnicas biológicas moleculares e histoquímicas. Por lo tanto, las rodajas cerebrales representan un sistema modelo ideal para evaluar las funciones de las proteínas, para investigar los procesos fisiológicos involucrados en trastornos neurológicos, así como con fines de descubrimiento de fármacos.
Existen varias formas diferentes de preparación de rebanadas. Las preparaciones de rebanadas cerebrales con un vibratome permiten una mejor preservación de la estructura tisular y garantizan un suministro suficiente de oxígeno durante el corte, que presentan ventajas sobre el uso tradicional de un helicóptero tisular. Además, se pueden aplicar diferentes planos de corte para preparaciones de rodajas cerebrales de vibratome. Aquí, se proporciona un protocolo detallado para una preparación exitosa de rebanadas hipocampales horizontales cortadas en vitome de cerebros de ratón. A diferencia de otras preparaciones de rebanadas, el corte horizontal permite mantener las fibras de la trayectoria de entrada del hipocampo (camino perforante) en un estado completamente intacto dentro de una rebanada, lo que facilita la investigación de interacciones entorrino-hipocampales. Aquí, proporcionamos un protocolo exhaustivo para la disección, extracción y corte horizontal agudo del cerebro murino, y discutimos los desafíos y posibles escollos de esta técnica. Por último, mostraremos algunos ejemplos para el uso de rebanadas cerebrales en otras aplicaciones.
Introducción
La extensa exploración del hipocampo comenzó cuando Scoville y Milner informaron de la incapacidad de un paciente (H.M.) para formar una nueva memoria declarativa después de la extirpación quirúrgica del hipocampo y las estructuras de lóbulos temporales cercanas como tratamiento para la epilepsia grave1. A partir de ese momento, el hipocampo se ha estudiado ampliamente a partir de propiedades neuronales generales y funciones hasta el desarrollo de trastornos cerebrales graves, como epilepsia y enfermedad de Alzheimer2,3,4,5. El hipocampo es parte del sistema límbico, que consiste en un grupo de estructuras cerebrales relacionadas implicadas en la formación de emociones y memoria6,7. Una densa red de varias vías de fibra logra una estrecha conectividad hipocampal a estructuras cerebrales internas y externas. Estas vías incluyen el camino perforador medial y lateral (corteza entorrinal para dentario gyrus, CA3 – CA1 y subiculum)8,el camino de fibra musgo (dentate gyrus a CA3)9 y la vía colateral/asociativa de Schaffer (CA3 a CA1)10 (Figura 1). El hipocampo presenta una de las áreas cerebrales más ampliamente exploradas hasta ahora debido a su organización laminar altamente conservada de la formación de capas neuronales, y la posibilidad de obtener cultivos neuronales vitales y rebanadas cerebrales con relativa facilidad5.
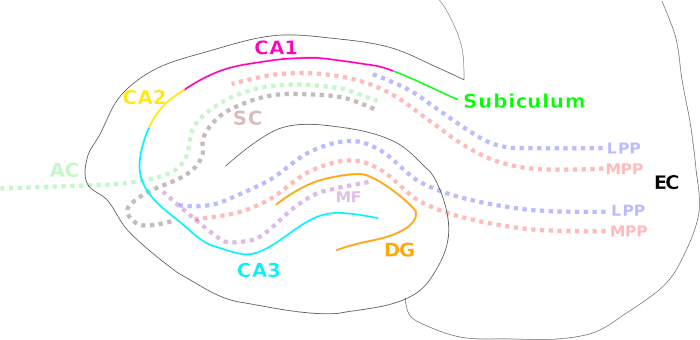
Figura 1: Dibujos animados que ilustran las diferentes regiones del hipocampo y las principales vías de fibra. Las diferentes regiones del hipocampo están indicadas por líneas de color sólido: corteza entorrinal (EC; negro), giroscopio dentario (DG; naranja), Cornu Amonis (CA) 3 (cian), 2 (amarillo) y 1 (magenta) y el subiculum (verde). Las vías de fibra se muestran con una línea punteada de color: la trayectoria medial (MPP, rojo) y perforante lateral (LPP, azul) (desde la corteza entorrinal hasta el giro dentario, CA3, CA1 y subiculum), la vía de fibra musgo (MF, violeta) (del giro dentado a CA3) y el colateral Schaffer (SC, marrón) (ipsilateral de CA3 a CA1)/vías commissurales asociacionales (AC, verde claro) (contralaterales de CA3 a CA1). Haga clic aquí para ver una versión más grande de esta figura.
Los protocolos de corte cerebral a menudo resultan en la pérdida de conexiones de áreas cerebrales más distantes al área de interés5. Además, los capilares ya no son funcionales5 y la circulación sanguínea se ve privada11. A pesar de estas limitaciones, las rebanadas cerebrales todavía se utilizan principalmente para la investigación de las funciones neurofisiológicas del hipocampo debido a una serie de ventajas. En primer lugar, la extracción del hipocampo es rápida12 y no requiere muchos materiales. Los únicos instrumentos esenciales incluyen un kit de disección, un baño de agua de laboratorio, acceso a carbógeno y un microtome vibratorio (vibratome)13. Otros activos de la técnica de la rebanada cerebral son la elusión de la barrera hematoencefálica (BBB) y el lavado de moléculas liberadas endógenamente antes del inicio del experimento5,lo que permite estudiar el efecto de los fármacos con control de dosificación relativamente preciso14. Además, las rodajas cerebrales conservan la arquitectura cito y los circuitos sinápticos dentro del hipocampo15,16,donde se conserva la neuroanatomía y el entorno local con conectividad neuronal e interacciones complejas neuronas-glia4,11,17. Además, las conexiones de fibra hipocampal son predominantemente neuronas unidireccionales e hipocampales tienen una alta plasticidad sináptica, lo que simplifica enormemente la colección e interpretación de grabaciones electrofisiológicas de alta calidad con el fin de entender los procesos neurológicos18,19. Es importante destacar que las rebanadas cerebrales presentan un valioso activo aplicable en una amplia gama de técnicas científicas diferentes, que abarcan desde técnicas biológicas moleculares sobre grabaciones de imágenes hasta mediciones electrofisiológicas12,20,21,22,23,24,25,26.
Como se describió anteriormente, las rebanadas cerebrales hipocampales presentan una poderosa herramienta experimental para estudiar las características estructurales y funcionales de la conectividad sináptica. Esto ofrece la oportunidad de evaluar los efectos de los productos químicos o mutaciones en la excitabilidad neuronal y la plasticidad16.
Las preparaciones agudas de las rebanadas cerebrales están presentando una técnica relativamente sensible y la calidad óptima de la rebanada depende en gran medida de las condiciones experimentales ideales, incluyendo la edad del animal, el método de eutanasia, la velocidad de disección y corte, las soluciones y parámetros de corte (por ejemplo, velocidad de corte) así como las condiciones para la recuperación de rebanadas4. Por lo tanto, un protocolo bien diseñado es de suma importancia y asegura la reproducibilidad en diferentes unidades de investigación13.
Aquí, proporcionamos un protocolo detallado para la preparación de rodajas de hipocampo horizontal aguda, con el objetivo de preservar la integridad de la trayectoria perforante lateral y medial del hipocampo y la vía de fibra musgo, permitiendo la investigación de los procesos relacionados con el giro dentado9. Describiremos en detalle los pasos clave para diseccionar, extraer y cortar horizontalmente el cerebro murino, seguidos de resultados representativos de grabaciones calcio-microfluorimétricas y grabaciones potenciales postínapticas excitatorias de campo (FEPSP) en condiciones basales y durante los protocolos de inducción LTP en rodajas cerebrales de ratones salvajes tipo C57BL/6J.
Protocolo
Todos los experimentos con animales para este estudio fueron aprobados por el comité de revisión ética del KU Leuven (Bélgica) (P021/2012).
1. Preparación de solución de rodajas de sacarosa alta y líquido cefalorraquídeo artificial (ACSF)
- Antes del día experimental
- Preparar 1 L de pre-solución de rebanada de 10x con agua tipo 1 de grado de laboratorio que contenga (en mM): 25 KCl, 20 CaCl2,10 MgSO4, 12.5 KH2PO4 (Tabla 1). Con el fin de prevenir la precipitación de fosfato de calcio, mezcle lentamente los productos químicos en un vaso de precipitados precargado con 800 ml H2O mientras se agita constantemente con un agitador magnético. Almacene la solución a 4 °C o temperatura ambiente (RT).
- En el día experimental
- Preparar 1 L de 1x ACSF con agua tipo 1 de laboratorio que contenga (en mM): 125 NaCl, 2,5 KCl, 2 CaCl2,1 MgSO4,1,25 NaH2PO4,26 NaHCO3,25 Glucosa (Tabla 2). Utilice un cuentakilómetros de presión de vapor para validar la osmolaridad entre 305-315 mOsm (pH ~ 7.55–7.6).
NOTA: Con el fin de prevenir la precipitación de fosfato de calcio, mezcle lentamente todos los productos químicos sólidos en un vaso de precipitados precargado con 800 ml de H2O mientras se agita constantemente con un agitador magnético. Añadir MgSO4 y CaCl2 al final, goteando lentamente en la cantidad necesaria de soluciones de stock de 1 M. - Burbuja continua 1x solución ACSF en RT con carbógeno para ajustar el pH entre 7.3–7.4.
NOTA: Si el pH es ligeramente demasiado alto o demasiado bajo, pequeños ajustes en la resistencia a la carbogenación serían suficientes. Si el pH es superior a 7,45 con carbogenación, ajúselo añadiendo pocas gotas de solución NaH2PO4 de 1 M. - Preparar 250 ml (por cerebro) de 1x solución de rebanada de sacarosa alta en un vaso de precipitados que contenga 25 ml de pre-solución de rebanada de 10x y (en mM): 252 sacarosa, 26 NaHCO3y 10 glucosa(Tabla 3). Verifique que la osmolaridad esté entre 320-325 mOsm (pH ~ 7.55–7.6).
- Burbujee la solución de rebanada de sacarosa alta durante 10-15 min con carbógeno para controlar el pH entre 7,3–7,4.
NOTA: Si el pH es superior a 7,45 con carbogenación, ajúselo añadiendo unas gotas de solución kh2PO4 de 1 M. - Almacene la solución de rebanada de sacarosa alta durante 20-30 minutos en el congelador ultra (-80 °C) hasta que esté parcialmente congelado.
- Preparar 1 L de 1x ACSF con agua tipo 1 de laboratorio que contenga (en mM): 125 NaCl, 2,5 KCl, 2 CaCl2,1 MgSO4,1,25 NaH2PO4,26 NaHCO3,25 Glucosa (Tabla 2). Utilice un cuentakilómetros de presión de vapor para validar la osmolaridad entre 305-315 mOsm (pH ~ 7.55–7.6).
2. Preparación del espacio de trabajo para la disección cerebral
- Durante el enfriamiento de la solución de rebanada de sacarosa alta, prepare lo siguiente.
- Caliente el baño de agua a 32 °C.
- Llene la cámara de recuperación(Figura 2A)con la solución ACSF carbogenada y coloque la cámara en el baño de agua. Aplique continuamente carburógeno a la botella principal de ACSF y al ACSF en la cámara de recuperación.
- Lleva al animal a la sala experimental.
NOTA: La edad, el sexo y la cepa del animal tienen que ser determinados por el experimentador individual y depende de la pregunta específica del estudio. Sin embargo, los parámetros del animal deben permanecer constantes dentro de un estudio con el fin de garantizar la comparabilidad entre los diferentes días experimentales. Este protocolo fue diseñado para el uso de ratones macho C57BL/6J a la edad de 2-6 semanas. Si se utilizan animales mayores, las soluciones de corte y recuperación pueden tener que adaptarse en consecuencia4,27 (por ejemplo, NMDG + soluciones basadas en NMDG+23,28)con el fin de preservar la salud cerebral de las rodajas agudas. - Prepara la cámara de anestesia.
- Coloque papel tisú, pipeta pasteur de plástico con abertura ancha (cortada abierta), plato de cultivo de 90 mm lleno de hielo, un cuadrado de papel de filtro en la parte superior del plato de cultivo frío, tijeras fuertes para decapitación, tijeras de disección, fórceps curvas, espátula, plato de cultivo de 35 mm, cepillo fino, hoja, placa de muestra (viene con vibratome), súper pegamento, punta de pipeta, cuatro correas de papel de filtro (~ 2 cm x 0,5 cm) (Figura 2A).
- Configurar el vibratome: En primer lugar, programar el vibratome para los ajustes correctos (velocidad de desplazamiento de la hoja: 0,08 mm/s, amplitud de corte: 1,4 mm, frecuencia de corte: 85 Hz) y fijar la línea carbógena en la cámara de la rebanada. A continuación, coloque la cámara de rodajas en el soporte, llene el soporte que rodea la cámara de la rebanada con hielo y coloque todo en el vibratome. Por último, coloque la cuchilla de afeitar en el soporte de la hoja de vibratome (Figura 2B).
- Después de la congelación de la solución de sacarosa alta, realice los pasos siguientes.
- Después de 20-30 min, saque la solución de rebanada de sacarosa alta del ultra-congelador -80 °C y mantenga el vaso de precipitados en hielo.
- Coloque la solución de gran sacarosa junto al vibratome en su banco, machaque y mezcle la solución parcialmente congelada con una espátula para obtener un buen aguanieve y comience a burbujear con carbógeno.
- Tome una solución de rodajas de sacarosa alta con la pipeta pasteur de plástico para remojar el papel de filtro cuadrado en la parte superior del plato de cultivo frío de 90 mm.
- Llene el plato de cultivo de 35 mm (o cualquier recipiente pequeño equivalente que sea adecuado para almacenar todo el cerebro) hasta un 75% con la solución de rebanada de sacarosa alta (suficiente para cubrir todo el cerebro) y enfríe el plato de cultivo sobre hielo mantenido junto al vaso de precipitados con el resto de la solución. Caragenar la solución en el plato de cultivo de 35 mm.
3. Disección y posicionamiento del cerebro murino
- Anestesiar al animal con un 5% de isoflurano. Determine la profundidad adecuada de la anestesia pellizcando la pata. No se debe producir ningún reflejo de retirada de pata.
- Transfiera al animal sobre papel tisú y decapéralo con tijeras fuertes o una guillotina animal pequeña.
- Use tijeras de disección para abrir el cuero cabelludo.
- Abre la calvaria a lo largo de la sutura sagital y retírala con la ayuda de fórceps curvos hasta que todo el cerebro, incluidas las bombillas olfativas, sea visible.
NOTA: Tenga cuidado de no dañar el cerebro con los bordes afilados de la calvaria o fórceps. - Utilice una espátula para sacar cuidadosamente el cerebro (las bombillas olfativas deben permanecer unidas).
- Transfiera el cerebro en el plato de cultivo frío de 35 mm y retire todo el cabello o partículas de sangre del tejido lavando suavemente el cerebro con una pipeta Pasteur llena de ACSF (la sangre tiene efectos citotóxicos en el tejido cerebral29).
- Transfiera el cerebro con la ayuda de la espátula en el papel filtrante empapado en la parte superior del plato de cultivo frío de 90 mm (Figura 2A).
- Usa una hoja para cortar el cerebro por la mitad, separando los dos hemisferios, y coloca ambos hemisferios en el lado medial recién cortado.
- Utilice una cuchilla para quitar la parte dorsal (5%–10 %) del cerebro de cada hemisferio con un corte paralelo a la parte superior dorsal (Figura 2C)30 y colocar ambos hemisferios en el lado recién cortado con la parte ventral del cerebro mirando hacia arriba.
- Coloque una gota de súper pegamento en la placa de la muestra y extienda correctamente con una punta de pipeta para acomodar ambos hemisferios.
- Utilice una correa de papel de filtro para recoger un hemisferio con fuerzas capilares tocando el lado ventral con la correa de papel filtrante, dañando así el tejido.
- Utilice otra correa de papel de filtro para secar cuidadosamente el lado dorsal del cerebro antes de colocar el hemisferio con el lado dorsal hacia abajo en la parte superior del pegamento en la placa de la muestra. Repita el mismo procedimiento con el segundo hemisferio.
NOTA: Los hemisferios deben colocarse en alineación horizontal de forma espejada en la placa de vibratome, con los lados rosales apuntando hacia el exterior y los lados caudales mirando (pero no tocando) entre sí en el medio. Los lados medios de ambos hemisferios deben apuntar hacia la hoja de vibratome y los lados laterales hacia el experimentador (Figura 2D). - Coloque la placa del espécimen en la cámara de corte y cúbrala rápidamente, pero con cuidado, con solución de rodajas de sacarosa alta helada. Tan pronto como la solución toque el pegamento, se solidificará y pegará correctamente los hemisferios a la placa de la muestra.
- Asegúrese de que los hemisferios estén correctamente cubiertos con solución de rodajas de sacarosa alta y confirme que la solución está burbujeada con carbógeno.
NOTA: Todo el procedimiento de disección debe realizarse lo más rápido posible. Por favor, asegúrese de que el cerebro no se queda sin el suministro de oxígeno durante mucho tiempo. Debe tomar sólo alrededor de 1-1.5 minutos de la decapitación a la inmersión cerebral en la solución de rebanada de sacarosa alta slush. Este es el requisito más crítico para los preparativos agudos de las rebanadas cerebrales con el fin de garantizar una alta calidad de la rebanada.
4. Corte horizontal del cerebro
- Coloque la hoja de vibratome delante del lado medial de los hemisferios y bájala a la misma altura que los lados ventrales de los hemisferios que ahora están mirando hacia arriba. Baje la hoja con la ayuda del control del vibratome a 600 μm más en la dirección dorsal y comience a cortar. La hoja debe golpear el tejido (si no, invertir la hoja y bajarla un poco más). Corte hasta que las dos primeras rebanadas estén completamente separadas de los dos hemisferios.
- Invierta la hoja y baje otros 300 μm y corte de nuevo.
- Cuando el hipocampo se haga visible (utilice el atlas cerebral del ratón31 para obtener ayuda, si es necesario)(Figura 2E)recoger las rodajas con la pipeta pasteur de plástico ensanchada. Recoge las rodajas hasta que los putamen caudados se hacen visibles junto al hipocampo. Por lo general, se pueden recolectar entre 8-12 rebanadas de 300 μm (4-6 por hemisferio) para el cerebro del ratón.
- Utilice la pipeta pasteur de plástico para recoger las rodajas y transferirlas a la cámara de recuperación en el baño de agua(Figura 2F)(recoger rodajas después de cada ronda de corte para evitar que flote en la cámara de la rebanada).
NOTA: Trabaje lo más rápido posible y asegúrese de que la solución de rodajas de sacarosa alta esté helada y carbogenada durante todo el procedimiento. Si es necesario, vuelva a rellenar el hielo que rodea la cámara de rodajas.
5. Recuperación de rodajas cerebrales para grabaciones electrofisiológicas
- Deje las rodajas en la cámara de recuperación llena de ACSF en el baño de agua de 32 °C durante 1 h.
NOTA: Las cámaras de recuperación también están disponibles comercialmente. - Saca la cámara de recuperación del baño de agua.
- Coloque los sectores en RT durante al menos otros 30 minutos para su recuperación antes de iniciar cualquier aplicación adicional.
6. grabaciones fEPSP en el camino perforante medial (MPP) del hipocampo
- Tire de pipetas de grabación de capilares de vidrio de borosilicato con un extractor de pipeta horizontal para recibir pipetas del tamaño de ~ 2 MΩ cuando se llenan con solución ACSF y se sumergen en la cámara de grabación llena de ACSF.
- Llene la solución de baño ACSF y la solución ACSF que contengan los productos químicos adecuados (por ejemplo, Bicucullina) en un sistema de perfusión multi-barril controlado por gravedad que está conectado a la cámara de grabación. Carboxear continuamente todas las soluciones.
- Encienda una bomba peristáltica o de vacío conectada a un tubo de succión que termine enfrente de la línea de perfusión en la cámara de grabación. Abra el barril lleno de ACSF y comience a establecer un flujo continuo (1-2 gotas por segundo). Verifique que el electrodo de referencia esté sumergido en la solución ACSF.
- Encienda el ordenador de configuración, el amplificador, el micromanipulador, el estimulador, las luces del microscopio, la cámara y el monitor (si corresponde).
- Abra el software adecuado para grabaciones electrofisiológicas (existen varios proveedores diferentes de hardware y software para equipos electrofisiológicos).
- Transfiera un hemisferio de corte cerebral de la cámara de recuperación a la cámara de grabación de la configuración del sector y colóquelo en la orientación correcta con la capa de células de gránulos de giroscopio dentario y la capa molecular en el campo de visión. Asegúrese de que el electrodo de estimulación pueda alcanzar el MPP en la rebanada desde la dirección de la corteza entorrina y de que el electrodo de grabación tenga acceso al MPP desde el lado opuesto exacto desde la dirección de CA3.
- Estabilice la rebanada en la cámara de grabación con un clip de papel(Figura 3A)o una rejilla de corte cerebral disponible comercialmente.
NOTA: Puede ser útil apagar la perfusión durante la transferencia y posicionamiento de la rebanada. Sin embargo, esto no debe tomar demasiado tiempo con el fin de garantizar la calidad de la rebanada del cerebro. - Baje y coloque los electrodos de grabación y estimulación en el MPP en el tercio inferior de la capa molecular cerca de la capa celular del gránulo(Figura 3B),uno frente al otro a una distancia de aproximadamente 100-150 μm. El electrodo de estimulación debe entrar mínimamente en contacto con la superficie, mientras que el electrodo de grabación debe infiltrarse ligeramente en la capa superior de la rebanada.
- Aplicar un estímulo de baja intensidad (30–50 μA para 0,1 ms) a la rebanada cerebral con el fin de obtener la señal fEPSP. Adaptar la posición de los electrodos si es necesario (por ejemplo, señal fEPSP de forma baja o atípica).
- Comience a grabar curvas de entrada-salida: aplique intensidades de estímulo crecientes a la rebanada cerebral en intervalos de 30 s.
- Ajuste la intensidad del estímulo al 50% de la respuesta fEPSP máxima e inicie las grabaciones fEPSP basales aplicando la intensidad de estímulo del 50% durante 20-40 minutos en intervalos de 30 s a la rebanada cerebral.
- Si la línea base parece ser estable, proceda con grabaciones adicionales (por ejemplo, protocolos LTP/LTD y/o aplicaciones de medicamentos). (Para la inducción LTP en el MPP, aquí se utilizó un protocolo que consta de cuatro pulsos de 1 s 100 Hz aplicados en un intervalo de 5 min. Bicucullina se aplicó 10 minutos antes y durante la fase de acondicionamiento.)
NOTA: Todas las grabaciones deben realizarse en el modo de abrazadera actual con filtrado de paso bajo adecuado (<5 kHz) y velocidades de muestreo (>10 kHz). - Extraiga los datos en un formato de archivo adecuado y analice los parámetros fEPSP, como la volea de fibra, la amplitud fEPSP y la pendiente fEPSP.
7. Grabaciones de imágenes de calcio de rebanadas cerebrales
- Transfiera un hemisferio de rebanada cerebral en una cámara de 12 pozos y cárguelo durante 30 min a 1 h con un tinte de calcio apropiado. Carboxear continuamente la solución de carga insertando un tubo de carbogenación a través de un agujero hecho a sí mismo (con una aguja 18G caliente) en la tapa de la placa de 12 pozos.
NOTA: Este paso no es necesario en caso de preparaciones de rebanadas cerebrales de animales genéticamente modificados que expresan endógenamente a un reportero fluorescente como GCaMP. - Prepare la configuración de grabación como se describe en los pasos 6.2–6.5.
NOTA: No es necesario ningún amplificador o micromanipulador para experimentos de imágenes microfluorimétricas. El uso de un estimulador depende del experimento. El software específico para experimentos de imágenes de fluorescencia es esencial. - Ajuste el software a la configuración de imagen correcta: esto incluye el amplificador de cámara y el ajuste binning, el ajuste de la longitud de onda, el tiempo de exposición y el protocolo de sincronización. La configuración puede variar dependiendo de los experimentos exactos. (Para las trazas de ejemplo, se utilizó 1 x 1 binning, ganancia de preamplificador de 2,4x, ganancia de cámara de 300 EM, exposición de 50 ms a 488 nm repetida cada 500 ms durante el experimento.)
- Después de cargar con el tinte de calcio, transfiera el hemisferio de la rebanada cerebral del pozo 12 a la cámara de grabación y colóquelo en el escenario del microscopio.
- Estabilice la rebanada en la cámara de grabación con un clip de papel(Figura 3A)o una rejilla de corte cerebral disponible comercialmente similar a la descrita en el paso 6.7.
- Asegúrese de que el área de interés está en el campo microscópico correcto y en el enfoque.
- Utilice el software de imágenes de fluorescencia para seleccionar varias regiones de interés (ROIs) en el sector.
NOTA: Puede ser útil seleccionar todo el campo de visión para seguir las fluctuaciones generales en el brillo, debido al fotobleaching. - Inicie la grabación y aplique los fármacos experimentales de prueba en los puntos de tiempo elegidos.
NOTA: Es recomendable aplicar una solución K+ alta al final de cada experimento para verificar el carácter neuronal de las células y la calidad de la rebanada. - Extraiga los datos en un formato de archivo adecuado y analice los cambios de señal de fluorescencia que se producen en los ROI durante toda la medición. Las ROIs también se pueden adaptar durante el análisis fuera de línea.
NOTA: Otros protocolos que describen las grabaciones fEPSP y la microfluorimetría de calcio en las rebanadas cerebrales están disponibles en la literatura24,32,33,34,35.
Resultados
Visión general de las herramientas y los pasos críticos necesarios para el protocolo
La Figura 2 presenta todas las herramientas necesarias y pasos críticos para la preparación de rodajas cerebrales hipocampales agudas horizontales como se describe en este protocolo. Por lo general, se requiere un número limitado de instrumentos clave, incluyendo algunas herramientas de disección y una cámara de recuperación de rebanadas(Figura 2A),un baño de agua de laboratorio, y un vibratome (Figura 2B). Figura 2C–E visualizar pasos y orientaciones importantes del cerebro y los hemisferios durante el protocolo de preparación de la rebanada. La Figura 2F es una ilustración del resultado esperado de las rebanadas cerebrales horizontales.
grabaciones fEPSP en la trayectoria perforante medial
Después del período de recuperación, las rodajas cerebrales se pueden utilizar para grabaciones electrofisiológicas de fEPSP. Aquí, utilizamos un microscopio vertical equipado con un sistema de perfusión controlado por gravedad multicanal(Figura 3A y Figura 3B). Un micropipette de vidrio (~ 2 MΩ) se llenó con solución ACSF y se unió encima de un electrodo de plata recubierto de cloruro que está montado en un amplificador operativo en circuito con un electrodo de baño clorado. fEPSPs fueron grabados y visualizados con un amplificador y un software de grabación apropiado mediante la inserción del micropipette de vidrio en el MPP del hipocampo en la capa superior de la rebanada cerebral. Los fEPSP fueron inducidos por estimulación con un microelectrodo de racimo de 2 contactos, aplicando diferentes intensidades de corriente al MPP aguas arriba del electrodo de grabación. Tenga en cuenta que este protocolo no está destinado a explicar cómo obtener grabaciones MPP, sino que simplemente utiliza grabaciones en el MPP como ejemplo para demostrar el éxito del protocolo de preparación de sectores descrito aquí. Si alguien intenta realizar grabaciones MPP, ciertos controles (por ejemplo, grabaciones de pulso emparejadas) pueden ser necesarios para garantizar el sitio de grabación adecuado y distinguir el MPP de los LPP8,36,37.
La Figura 3C ilustra un ejemplo negativo (panel izquierdo, sector de baja calidad) y positivo (panel derecho, sector de alta calidad) de una grabación fEPSP. La traza de ejemplo negativa muestra una amplitud de volea de fibra grande (FV) que es incluso mayor que la amplitud fEPSP real (≈0,5 mV). Por el contrario, el ejemplo de sector de alta calidad (panel derecho) muestra una pequeña relación FV a fEPSP y una amplitud fEPSP alta (>0,5 mV). La volea de fibra es la señal que se produce tras la despolarización de las fibras neuronales estimuladas y, por lo tanto, precede a la potenciación postsináptica (fEPSP). La relación de FV con las propiedades fEPSP proporciona información importante sobre la preservación de las propiedades axonal y sináptica. Las rodajas de alta calidad con fibras nerviosas intactas deben mostrar una alta proporción de amplitud fEPSP a FV. Por el contrario, las rodajas de baja calidad con propiedades de conducción deterioradas tendrán una disminución de la relación fEPSP a FV. Del mismo modo, la viabilidad de una rebanada cerebral se puede analizar trazando pendientes fEPSP frente a las amplitudes de volea de fibra (Figura 3D).
Además, las curvas de entrada-salida (pendiente fEPSP y amplitud FV sobre intensidad de estímulo) se utilizan de forma estándar para determinar la calidad del sector. Tales curvas se obtienen mediante la aplicación de estímulos de corriente crecientes a la rebanada del cerebro y mediante el seguimiento de las respuestas fEPSP posteriores. Las rodajas cerebrales de baja calidad muestran una curva de entrada-salida reducida debido a las propiedades de conducción subópttimas del tejido cerebral mal conservado (Figura 3E,F). Además, las curvas de entrada-salida son necesarias para definir el rango de intensidad de estimulación ideal para la investigación de procesos sinápticos. Idealmente, la intensidad del estímulo debe establecerse alrededor del 50% de la intensidad para las respuestas máximas. En esta intensidad de estímulo elegida, las respuestas fEPSP son altamente sensibles para cualquier cambio en la plasticidad sináptica, que ofrece la oportunidad de investigar la potenciación a largo plazo (LTP) y la depresión a largo plazo (LTD).
Con el fin de estudiar la plasticidad sináptica, la transmisión sináptica de la rebanada cerebral (pendiente fEPSP) a la intensidad de estímulo elegida del 50% se controla durante un período de tiempo más largo (generalmente entre 20-40 min) antes de la fase de acondicionamiento. Las rodajas cerebrales viables tendrán líneas base estables, mientras que las rodajas cerebrales con una línea base inestable no se pueden utilizar para protocolos de acondicionamiento adicionales con el fin de estudiar la plasticidad sináptica de los circuitos cerebrales(Figura 3G,panel superior). Las grabaciones de línea base fEPSP también pueden ser útiles para monitorear los efectos farmacológicos sobre la transmisión sináptica en sí(Figura 3G,panel inferior). La media de las señales de línea base fEPSP registradas se utiliza típicamente para normalizar un curso de tiempo fEPSP y se establece de forma estándar en 100%.
Plasticidad sináptica se puede estudiar mediante la aplicación de protocolos de acondicionamiento específicos a las rebanadas cerebrales. Estos protocolos dependen del circuito cerebral investigado y del mecanismo de interés (por ejemplo, LTP o LTD). Con el fin de inducir LTP en el MPP del gyrus dentario, un protocolo de acondicionamiento fuerte es necesario debido a la fuerte inhibición GABAérgica que está presente en las sinapsis MPP38. Se informa que la inhibición GABAérgica es aún más pronunciada en rodajas cerebrales preparadas con soluciones de corte de alto sacarosa39. Aquí, utilizamos un protocolo que consiste en cuatro estimulaciones de 1 s pulsos largos de 100 Hz aplicados en un intervalo de 5 minutos mientras se trata con el antagonista del receptor GABAA Bicuculline (Figura 3H). La co-adición de NMDA y Bicucullina durante el período de acondicionamiento resulta en un aumento LTP (Figura 3H). La baja calidad de la rebanada y la transmisión sináptica inestable (línea base fEPSP) podrían dar lugar a una inducción LTP y LTD alterada o infructuosa. Por lo tanto, es de gran importancia trabajar con preparaciones de sectores de alta calidad y utilizar criterios de exclusión rigurosos (baja proporción de amplitud fEPSP a la relación de volea de fibra (<3), pendiente fEPSP pequeña (<0,5 mV/ms) o amplitud (<0,5 mV) y línea base fEPSP inestable (cambio de más del 5%) para sectores inviables al investigar procesos sinápticos.
Mediciones microfluorimétricas de calcio en la capa celular del gránulo del giro desntario
Después de la recuperación, una rebanada cerebral fue incubada a temperatura ambiente con 2 μM de un tinte sensible al calcio durante 1 h en ASCF cartogenado, protegido de la luz. La rebanada fue transferida a una cámara de grabación(Figura 3A)en un microscopio de fluorescencia vertical equipado con un sistema de perfusión multicanal controlado por gravedad. Las imágenes de emisión de fluorescencia se adquirieron cada 500 milisegundos después de la iluminación a 488 nm(Figura 4A,B). La excitación se realizó con una lámpara de xenón y se realizó una rejilla de difracción montada en escáner monocroma y adquisición de imágenes con una cámara CCD controlada por computadora. Durante las mediciones, la rebanada fue tratada con el antagonista del receptor NMDA APV, que resultó en una disminución en la concentración de calcio intracelular. La estimulación de la rebanada con una solución extracelular que contiene una alta concentración de potasio (50 mM) dio lugar a una afluencia masiva de calcio extracelular debido a la despolarización de las neuronas y la apertura de canales de iones cerrados por voltaje(Figura 4C).
| Compuesto | Concentración (mM) | Peso molecular (g/mol) | Cantidad (g) |
| HCO | 25 | 74.55 | 1.86 |
| CaCl2 * 2H2O | 20 | 147.01 | 2.94 |
| MgSO4 * 7H2O | 10 | 246.48 | 2.46 |
| KH2PO4 | 12.5 | 136.08 | 1.7 |
Tabla 1: 10 x pre-solución de sector (1 L).
| Compuesto | Concentración (mM) | Peso molecular (g/mol) | Cantidad (g) |
| NaCl | 125 | 58.44 | 7.3 |
| HCO | 2.5 | 74.55 | 0.19 |
| CaCl2 * 2H2O | 2 | de 1 M CaCl2 solución | 2 ml |
| MgSO4 * 7H2O | 1 | de 1 M MgSO4 solución | 1 ml |
| NaH2PO4 * 2H2O | 1.25 | 156.02 | 0.2 |
| NaHCO3 | 26 | 84.01 | 2.18 |
| Glucosa * H2O | 25 | 198.17 | 4.95 |
Tabla 2: 1x ACSF (1 L) (osmolaridad entre 305-315 mOsm).
| Compuesto | Concentración (mM) | Peso molecular (g/mol) | Cantidad (g) |
| 10x presolución de rebanada | N/A | N/A | 25 mL |
| sacarosa | 252 | 342.3 | 21.57 |
| NaHCO3 | 26 | 84.01 | 0.55 |
| Glucosa * H2O | 10 | 198.17 | 0.49 |
Tabla 3: Solución de rebanada de sacarosa alta de 1x (250 ml) (osmolaridad entre 320-325 mOsm).
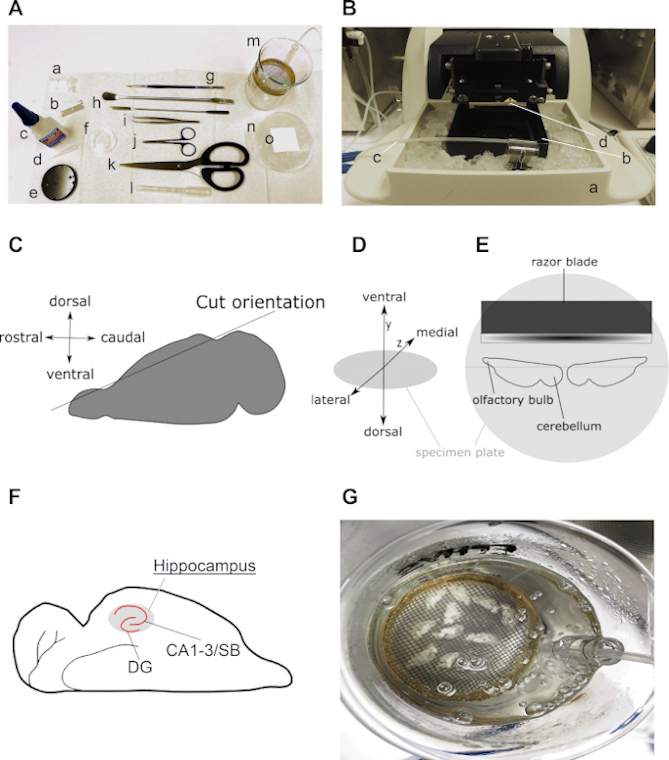
Figura 2: Información detallada sobre la preparación de rebanadas cerebrales hipocampales horizontales. (A) Imagen de las herramientas necesarias para la disección y el corte del cerebro del roedor: (a) ±2 cm de largo y ±0,5 cm de ancho de correas de papel filtrante (por ejemplo, grado 413); (b) hoja; (c) súper pegamento; (d) punta de pipeta; (e) placa de muestra (viene con vibratome); (f) plato de cultivo de 35 mm; (g) cepillo fino; (h) espátula; (i) fórceps curvas; (j) tijeras de disección; (k) tijeras fuertes (longitud de la hoja por encima de 10 cm); (l) pipeta pasteur de plástico con abertura ancha (entre 0,6 y 0,8 cm de diámetro); (m) cámara de recuperación (auto-hecha con vaso de precipitados de 250 ml, anillo de plástico, malla de nylon, pieza de una pipeta serológica de 10 ml); (n) Plato de cultivo de 90 mm lleno de hielo y (o) cuadrado de papel filtrante encima del plato de cultivo frío. (B) Imagen de un vibratome con (a) soporte de cámara de rodajas llena de hielo; (b) cámara de rodajas; (c) línea de carburógenos y (d) cuchilla de afeitar cortante. (C) Caricatura que ilustra la orientación del corte del lado dorsal de un hemisferio con el fin de preparar el cerebro para el corte horizontal (ver paso 3.9). (D) Proyección isométrica de la orientación cerebral en la placa de la muestra del vibratome. (E) Dibujos animados que ilustran una vista superior de la posición de los dos hemisferios en la placa del espécimen. (F) Caricatura que muestra la posición del hipocampo en una rebanada cerebral horizontal. Se indican las regiones desándulas (DG) y Cornu Ammonis (CA)–Subiculum (SB) del hipocampo. (G) Imagen de una cámara de recuperación con ACSF carbogenado que contiene diez rebanadas cerebrales horizontales recién cortadas. Haga clic aquí para ver una versión más grande de esta figura.
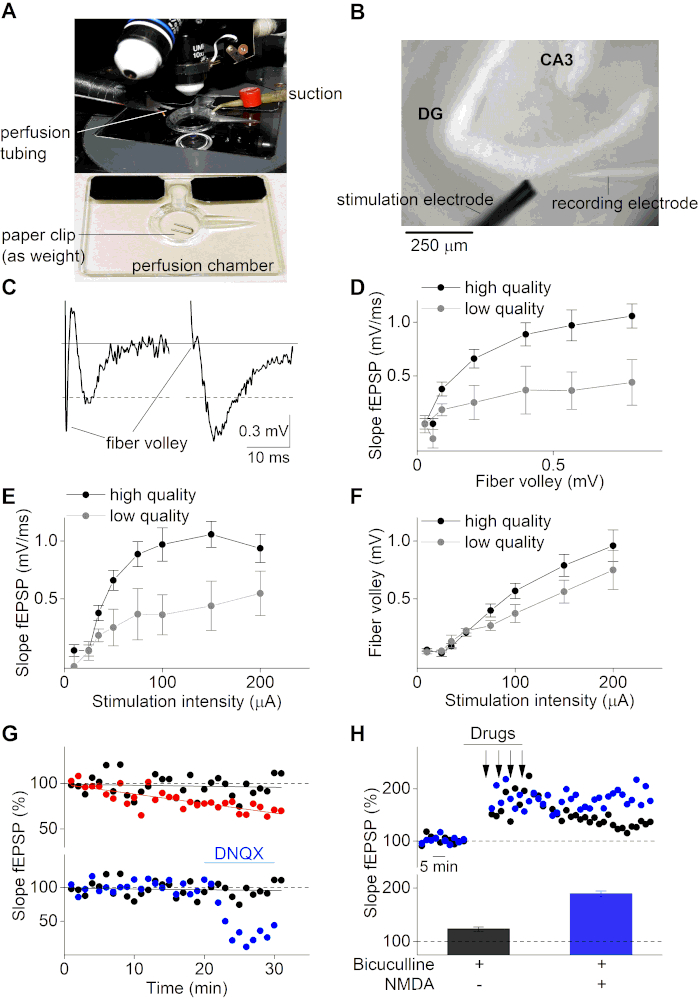
Figura 3: Grabaciones electrofisiológicas de rebanadas cerebrales hipocampales. (A) Imagen de una cámara de grabación con perfusión y succión, utilizada bajo un microscopio vertical. Una rebanada cerebral se colocará en la cámara e inmovilizará con un pedazo de un clip de papel antes del inicio de las grabaciones. (B) Imagen de campo brillante de una rebanada cerebral hipocampal bajo un microscopio vertical (objetivo 10x). Se indican los electrodos de estimulación (inferior izquierda) y grabación (inferior derecha), dirigidos a la trayectoria perforante medial durante las grabaciones fEPSP. (C) Izquierda: representación de un ejemplo de rebanada de baja calidad de una grabación fEPSP con una volea de fibra robusta y una pequeña amplitud. Derecha: ejemplo de sector de alta calidad de una grabación fEPSP. La línea gris indica el nivel de línea base. Las líneas punteadas señalan la amplitud de corte de 0,5 mV. (D) Trazado de la pendiente fEPSP frente a la amplitud FV para rodajas cerebrales de alta calidad (negro; n=10) y de baja calidad (gris; n=4). Datos representados como media ± sem. (E) Trazado de entrada-salida (pendiente fEPSP) para diferentes intensidades de estimulación (μA) para rodajas de alta calidad (negro; n = 10) y rodajas de baja calidad (gris; n = 4)). (F) Igual que en (E) pero para las amplitudes FV frente a las intensidades de estímulo. (G) Curso de tiempo de tres grabaciones fEPSP de línea base diferentes (pendiente de fEPSP en %; normalizada a la pendiente fEPSP media de los primeros 5 minutos). El panel superior representa un ejemplo positivo (negro) y negativo (rojo), donde este último tiene una línea base inestable debido a la omisión de carbógeno durante la grabación. El panel inferior muestra dos grabaciones basales estables en tratados (después de 20 minutos de línea base estable, los receptores AMPA fueron bloqueados por la aplicación del antagonista del receptor AMPA DNQX (10 μM)) (azul) y la condición no tratada (negro). (H) Curso de tiempo de las grabaciones LTP para diferentes condiciones de tratamiento (indicado en panel inferior). Color negro para la aplicación de Bicucullina (20 μM) durante el acondicionamiento y azul para la co-aplicación de Bicuculline (20 μM) y NMDA (10 μM) durante el acondicionamiento. Las flechas en el panel superior indican los puntos de tiempo donde se aplicó la estimulación de alta frecuencia (4 x 1s de 100Hz). Gráfico de barras en panel inferior representa las pendientes fEPSP medias (%) durante 50-60 minutos después de la inducción LTP de los experimentos mostrados en el panel superior (grabación representativa única para cada condición). Haga clic aquí para ver una versión más grande de esta figura.
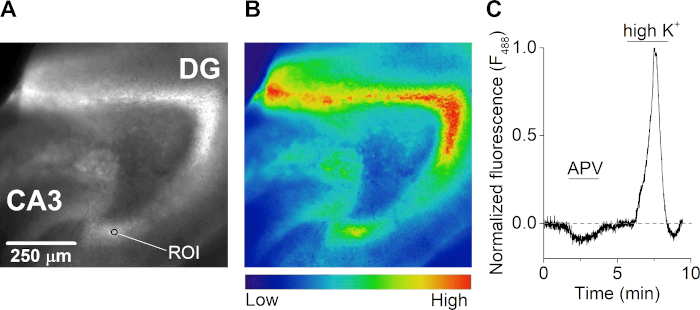
Figura 4: Calcio-microfluorimetría de rodajas cerebrales hipocampales. (A y B) Imagen de fluorescencia (excitada a 488 nm) (A) y el mapa de calor correspondiente (B) de una porción cerebral hipocampal horizontal del cerebro del ratón. El giroscopio de dentario (DG), la región CA3 y un ejemplo de región de interés (ROI) se indican en el panel A. (C) Curso de tiempo de respuestas de calcio (F488 nm)a partir de un ROI en el giroscopio desntario de una rebanada cerebral hipocampal aguda durante el tratamiento con el antagonista del receptor NMDA APV (50 μM) y solución que contiene alto potasio extracelular (K+) (50 mM). El rastro se normaliza a la respuesta de calcio más alta durante la perfusión alta de K+ y se corrige la línea de base para el fotobleaching. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aunque se utiliza comúnmente entre la comunidad de neurociencia, preparaciones de rebanadas cerebrales también se enfrentan a varias desventajas. Por ejemplo, las conexiones de entrada y salida a las áreas de interés cerebral ya no están conectadas en una rebanada cerebral. Además, una vez aislado, el tejido comienza a degradarse lentamente con el tiempo y este proceso podría alterar las condiciones fisiológicas de la rebanada cerebral. Este tema en particular es muy preocupante porque la mayoría de las grabaciones de cortes cerebrales están tardando varios minutos a horas, lo que resulta en largos días experimentales con grabaciones realizadas en tejidos que fueron aislados hasta 6-8 h antes del inicio del experimento. Además, el líquido cefalorraquídeo y la circulación sanguínea se interrumpen durante los preparativos de la rebanada, lo que puede conducir a la falta de compuestos endógenos importantes dentro de una rebanada cerebral. Y lo más obvio es que el procedimiento de corte en sí puede causar daños mecánicos en los tejidos que podrían comprometer los resultados obtenidos. Sin embargo, los beneficios reales de los preparados de las rebanadas cerebrales todavía están superando sus desventajas, razón por la cual presentan una técnica altamente valorada y empleada en la investigación de la neurociencia.
Las rebanadas cerebrales hipocampales agudas presentan una técnica potente y por lo tanto ampliamente utilizada para investigar procesos neuronales desde un nivel molecular hasta estudios complejos de circuito cerebral. Esto se basa en la neuroanatomía ideal del hipocampo que se puede conservar fácilmente en una preparación derebanadas 18. En consecuencia, las rebanadas cerebrales hipocampales se utilizan en una amplia variedad de proyectos de investigación científica, incluyendo cribado de drogas17,estudios de propiedades neuronales y sinápticas implicadas en las funciones cognitivas40,41,e investigaciones de condiciones cerebrales patológicas14,42,43. Sin embargo, un amplio espectro de diferentes aplicaciones también provoca una amplia gama de protocolos de preparación de sectores disponibles que pueden diferir en varios parámetros, como las condiciones de disección y la orientación del plano de corte, entre otros. Por lo tanto, la cuestión exacta de la investigación de un proyecto científico debe determinarse para elegir un protocolo de preparación de rebanadas adecuado.
El helicóptero tisular presenta una de las técnicas más antiguas utilizadas para preparar las rebanadas cerebrales del hipocampo44,45. Las principales ventajas de este método de preparación incluyen el bajo costo del helicóptero y el uso rápido y fácil46. Sin embargo, los helicópteros tisulares causan estrés mecánico que resulta en alteraciones morfológicas y muerte celular47. En comparación, el vibratome es una máquina bastante cara y el tiempo para la preparación de la rebanada se incrementa significativamente, lo que podría tener un impacto en la calidad de la rebanada. Sin embargo, el vibratome generalmente ofrece una manera más suave de separar las rodajas del tejido y permite mantener el cerebro bien enfriado y oxigenado durante todo el procedimiento de aislamiento, mejorando así las propiedades de la rebanada46. Por lo tanto, varios grupos están empleando esta técnica de forma estándar y han presentado protocolos para la preparación de rebanadas cerebrales hipocampales agudas utilizando el vibratome16,30,48. Si bien algunos protocolos proporcionan sólo unos pocos detalles para el corte en sí, sino que se centran en una aplicación específica de dicha preparación de sectores48, otros proporcionan protocolos detallados de sector que difieren en el plano de corte u otros detalles del protocolo (por ejemplo, soluciones de incrustación o sector/recuperación de agarose) dados en este artículo27,30.
El protocolo descrito aquí presenta un método sencillo con el fin de preparar rebanadas de cerebro de ratón hipocampo horizontal aguda de alta calidad de animales jóvenes. El protocolo es particularmente útil para preservar el camino perforante (medial y lateral) que presenta la vía de entrada del hipocampo, que proyecta desde la corteza entorrinal hasta el hipocampo8,49,50. Los preparaciones de rodajas transversales sagitales, coronales, así como los preparados aislados de la corteza transversal del hipocampo no conservan adecuadamente el camino perforante, que se origina principalmente en las capas II y V de la corteza entorrinal y los proyectos a varias áreas dentro del hipocampo18. Debido al posicionamiento anatómico de la corteza entorrinal en relación con el hipocampo, las rodajas cerebrales horizontales son una necesidad para mantener completamente intactas las fibras perforantes del camino dentro de la preparación de la rebanada31. Además, el corte horizontal preserva idealmente las fibras musgosas que se proyectan desde el giro desntario hasta las neuronas CA3 dentro del hipocampo9,30,50. Por lo tanto, este método de preparación es de alto valor para los estudios que investigan las vías de entrada del hipocampo y los procesos relacionados con la DG. Además, este protocolo permite la investigación de la vía colateral Schaffer50. Sin embargo, preparaciones de rodajas cerebrales sagitales y coronales se utilizan más comúnmente al investigar proyecciones de fibra CA3 a CA1, presumiblemente debido a su tiempo de preparación ligeramente más rápido que puede aumentar la posibilidad de obtener rodajas de alta calidad. Sin embargo, los preparativos horizontales de la rebanada de hipocampo presentan una poderosa herramienta de investigación ya que permite la preservación e investigación de todas las vías de fibra del hipocampo dentro de un hemisferio de una rebanada. Esto puede ser particularmente útil cuando se estudian las respuestas de circuito, por ejemplo, en grabaciones de ensayos multi electrodos.
Una de las principales preocupaciones a la hora de preparar las rebanadas cerebrales es la preservación adecuada del tejido cerebral. Esto se logra mediante varios pasos críticos en nuestro protocolo, incluyendo una disección rápida, la oxigenación y enfriamiento continuos y suficientes del tejido, y la protección del tejido cerebral mediante el uso del método de corte protector con una solución de corte bajo en sodio y gran sacarosa39,51. A pesar del hecho de que el protocolo descrito aquí produce una tasa de éxito alrededor del 90%, podrían ser necesarias medidas de protección potencialmente adicionales cuando se trabaja con tejido derivado de animales mayores o genéticamente diversos o cuando se intenta preservar una población celular específica. Ya se notificaron varios métodos para proteger las preparaciones sensibles del tejido cerebral. Estos métodos incluyen el uso de soluciones de corte basadas en NMDG para reducir la permeación de sodio52,el uso de altos niveles de magnesio en la solución de corte con el fin de bloquear la actividad del receptor NMDA53,y el uso prolongado de soluciones protectoras también durante el período de recuperación23. Todas estas medidas darán lugar a una reducción de la excitotoxicidad. Además, a menudo se emplea y necesita una perfusión transcardial con soluciones ACSF protectoras contra el hielo y frío cuando se trabaja con animales mayoresde 27 años.
Las rodajas cerebrales hipocampales agudas son ideales y se utilizan ampliamente para estudios electrofisiológicos por razones tales como las señales de alta amplitud que se pueden obtener de una rebanada cerebral aguda relativamente gruesa (300-500 μm), que garantiza una alta relación señal-ruido11. Las aplicaciones electrofisiológicas de uso estándar incluyen grabaciones de campo extracelulares y grabaciones intracelulares de células enteras en un modo de sujeción de voltaje o corriente. Con el fin de adquirir datos electrofisiológicos de alta calidad, la salud de la rebanada es de interés primario y puede garantizarse siguiendo estrictamente el protocolo presentado. Sin embargo, a medida que los preparados de corte presentan una técnica altamente sensible, una comprobación de calidad debe incluirse rutinariamente antes del inicio de cada experimento. Varios parámetros se pueden utilizar como comprobación de calidad del sector y se evalúan de forma estándar a través de curvas de entrada-salida y grabaciones fEPSP o EPSC de línea base19. No obstante, cabe señalar que las propiedades electrofisiológicas subóptimas pueden surgir de errores experimentales como el posicionamiento de electrodos, la orientación o incluso el daño y no representan únicamente la salud de la rebanada preparada. Por lo tanto, es aconsejable realizar controles de calidad adicionales como la visualización simple y la evaluación de las células bajo un objetivo de 40x o una tinción del núcleo DAPI. Estas comprobaciones de calidad se pueden utilizar para confirmar el estado constante de la rebanada durante varias sesiones de preparación de sectores.
La microfluorimetría de calcio presenta una técnica menos utilizada para estudiar las rebanadas cerebrales hipocampales. Sin embargo, esta técnica tiene un valor adicional a las grabaciones estándar de electrodos extracelulares e intracelulares, ya que permite visualizar y cuantificar los fundentes de calcio intracelulares, que son de gran importancia en la señalización neuronal y sináptica. Los cambios en las concentraciones intracelulares de calcio están implicados en la liberación de vesícula neurotransmisor, generación potencial postsináptica, regulación de plasticidad sináptica y conducción nerviosa axonal54,55,56. Como ilustración de esta técnica(Figura 4),hicimos uso de un tinte de calcio disponible comercialmente. Inarguablemente, el tratamiento de las rodajas de tejido con tintes de calcio puede producir dificultades como un mayor período de tiempo experimental, así como una carga ineficiente de células neuronales situadas más abajo. Sin embargo, las variaciones en esta técnica podrían utilizarse para eludir estos desafíos técnicos. Por ejemplo, es posible combinar mediciones de calcio y grabaciones de abrazaderas de parches en rodajas de hipocampo. De esta manera, un tinte fluorescente de calcio podría cargarse en una célula específica a través de la pipeta de parche, permitiendo las mediciones de la dinámica del calcio en una célula específica de interés57. Alternativamente, animales genéticamente modificados que expresan el indicador de calcio, GCaMP58, ya sea en todo el cerebro, o impulsado por un promotor específico de la célula, podrían ser utilizados. Curiosamente, el tejido cerebral de animales GCaMP con un vinculador directo a una proteína de interés podría proporcionar oportunidades para determinar el patrón de expresión neuronal o investigar la participación en chispas y ondas de calcio.
En conjunto, proporcionamos las pautas para la preparación exitosa de rebanadas cerebrales hipocampales horizontales sanas y viables de ratones para grabaciones electrofisiológicas e imágenes. Esta metodología es muy útil para acceder a los cambios neurológicos que se producen en patologías cerebrales que se describen en el giro dentado.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a la unidad de Electrofisiología del Centro vib-KU leuven para la investigación del cerebro y las enfermedades bajo la supervisión del Dr. Keimpe Wierda y el Profesor Dr. Joris De Wit por el uso de sus instalaciones de investigación. Además, agradecemos a todos los miembros del Laboratorio de Investigación del Canal Ion y al Laboratorio de Endometrio, Endometriosis y Medicina Reproductiva del KU Leuven por sus útiles discusiones y comentarios.
Este proyecto ha recibido financiación de la Research Foundation-Flanders (G.084515N y G.0B1819N a J.V.) y del Consejo de Investigación del KU Leuven (C1-funding C14/18/106 a J.V.). K.P. es becaria de FWO [PEGASUS]2 Marie Skłodowska-Curie y recibió financiación del programa de investigación e innovación Horizonte 2020 de la Unión Europea en el marco del acuerdo de subvención Marie Skłodowska-Curie (665501) con la Research Foundation Flanders (FWO) (12T0317N). K.H. es becario postdoctoral de la Research Foundation Flanders, Bélgica (12U7918N).
Materiales
| Name | Company | Catalog Number | Comments |
| Anesthesia chamber | home made - Generic | N/A | plexiglas |
| Anesthesia vaporizer | Dräger & MSS International Ltd | Isoflurane Vapor 19.3 & MSS Isoflurane | to vaporize isoflurane for rodent anesthetization |
| Barrels for the perfusion system | TERUMO | Hypodermic syringes without needle | https://www.terumotmp.com/products/hypodermics/terumo-hypodermic-syringes-without-needle.html |
| Bicuculline methiodide | hellobio | HB0893 | https://www.hellobio.com/bicuculline-methiodide.html |
| Borosilcate glass capillaries | Science Products | GB150F-8P | https://science-products.com/en/shop/micropipette-fabrication-1/capillary-glass-for-micropipette-pullers/borosilicate-glass-capillaries/borosilicate-filament-polished |
| Calcium chlorid dihydrate | Merck | 102382 | https://www.merckmillipore.com/BE/en/product/Calcium-chloride-dihydrate,MDA_CHEM-102382?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Calcium Imaging software | Till Photonics | LiveAcquisition v2.3.0.18 | |
| Carbogen tank | Air Liquide | Alphagaz mix B50 | Gasmixture CO2/O2: 5/95, purity 5 |
| Cluster microelectrode | FHC | CE2C55 | https://www.fh-co.com/product/cluster-microelectrodes/ |
| Culture dish (35 mm) | Corning Life Sciences | 353001 | https://ecatalog.corning.com/life-sciences/b2c/US/en/Cell-Culture/Cell-Culture-Vessels/Dishes%2C-Culture/Falcon®-Cell-Culture-Dishes/p/353001 |
| Culture dish (90 mm) | Thermo Fisher Scientific | 101VR20 | https://www.thermofisher.com/order/catalog/product/101R20#/101R20 |
| Curved forceps | Fine Science tools | 11270-20 | https://www.finescience.de/de-DE/Products/Forceps-Hemostats/Dumont-Forceps/Dumont-7b-Forceps/11270-20 |
| D-AP5 | hellobio | HB0225 | https://www.hellobio.com/dap5.html |
| D-(+)-Glucose monohydrate | Sigma Aldrich | 16301 | https://www.sigmaaldrich.com/catalog/product/sial/16301?lang=en®ion=BE |
| Digital CMOS camera | HAMAMATSU | ORCA-spark C11440-36U | https://www.hamamatsu.com/eu/en/product/type/C11440-36U/index.html |
| Dissection scissors | Fine Science tools | 14058-09 | https://www.finescience.de/de-DE/Products/Scissors/Standard-Scissors/Fine-Scissors-ToughCut®/14058-09 |
| DNQX | hellobio | HB0262 | https://www.hellobio.com/dnqx-disodium-salt.html |
| EMCCD camera | Andor | iXon TM + DU-897E-CSO-#BV | https://andor.oxinst.com/products/ixon-emccd-cameras?gclid=CjwKCAjw97P5BRBQEiwAGflV6ULsKjXfhN2YZxtvsWAmF4QghyXZKuqYHVMa6KU9JyS80ATQkSKeBBoCIM0QAvD_BwE |
| EPC10 USB Double Patch Clamp Amplifier | HEKA Elektronik | 895278 | https://www.heka.com/sales/brochures_down/bro_epc10usb.pdf |
| Filter paper | VWR | 516-0818 | grade 413 |
| Fine brush | Raphael Kaerell | 8204 | Size #1 |
| 18G needle | Henke Sass Wolf Fine-Ject | 18G X 1 1/2" 4710012040 | https://www.henkesasswolf.de/cms/de/veterinaer_produkte/produkte_vet/einmalkanuelen/hsw_henke_ject_einmalkanuelen/ |
| Isoflurane | Dechra Veterinary Products | Iso-Vet 1000mg/g | 250 ml bottle |
| Loctite 406 | Henkel Adhesive technologies | Loctite 406 | Super glue |
| Magnesium sulfate heptahydrate | Merck | 105886 | https://www.merckmillipore.com/BE/en/product/Magnesium-sulfate-heptahydrate,MDA_CHEM-105886?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Micromanipulator | Luigs & Neumann | SM-10 with SM-7 remote control system | https://www.luigs-neumann.org |
| Microscope (for calcium imaging) | Olympus | BX51WI | https://www.olympus-lifescience.com/de/microscopes/upright/bx61wi/ |
| Microscope (for ephys recordings) | Zeiss | Axio Examiner.A1 | https://www.micro-shop.zeiss.com/de/de/system/axio+examiner-axio+examiner.a1-aufrechte+mikroskope/10185/ |
| Microscope light source | CAIRN Research | dual OptoLed power supply | https://www.cairn-research.co.uk/product/optoled/ |
| Monochromator | Till Photonics | Polychrome V | |
| N-Methyl-D-aspartic acid (NMDA) | Sigma Aldrich | M3262 | https://www.sigmaaldrich.com/catalog/product/sigma/m3262?lang=en®ion=BE |
| Oregon Green® 488 BAPTA-1 | Invitrogen Molecular Probes | #06807 | 10x50ug |
| Osmometer | Wescor | 5500 vapor pressure osmometer | to verify osmolarity of salt solutions |
| Peristaltic pump | Thermo Fisher Scientific | Masterflex C/L 77120-62 | https://www.fishersci.be/shop/products/masterflex-peristaltic-c-l-dual-channel-pump-2/p-8004229 |
| pH meter | WTW | inoLab series pH 720 | https://www.geminibv.nl/wp-content/uploads/manuals/wtw-720-ph-meter/wtw-inolab-ph-720-manual-eng.pdf |
| Pipette puller | Sutter Instrument | P-1000 | https://www.sutter.com/MICROPIPETTE/p-1000.html |
| Potassium chlorid | Chem-lab | CL00.1133 | https://www.chem-lab.be/#/en-gb/prod/1393528 |
| Potassium dihydrogen phosphate | Merck | 104873 | https://www.merckmillipore.com/BE/en/product/Potassium-dihydrogen-phosphate,MDA_CHEM-104873?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Razor blade to prepare hemispheres | SPI supplies | Safety Cartridge Dispenser - Pkg/10 | GEM Scientific Single Edge Razor Blades |
| Razor blade for vibratome | Ted Pella Inc | 121-6 | double edge breakable style razor blades (PTFE-coated stainless steel) |
| Recovery chamber | home made - Generic | N/A | to collect and store brain slices in (see details in manuscript) |
| Scissors | Any company | N/A | Blade should be well sharpened and at least 15 cm long for easy decapitation |
| Silver electrode wire | Any company | for recording and reference electrodes | |
| Sodium dihydrogen phosphate dihydrate | Merck | 106342 | https://www.merckmillipore.com/BE/en/product/Sodium-dihydrogen-phosphate-dihydrate,MDA_CHEM-106342?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Sodium hydrogen carbonate | Alfa Aesar | 14707 | https://www.alfa.com/en/catalog/014707/ |
| Sodium chlorid | Fisher Scientific | S/3160/60 | https://www.fishersci.co.uk/shop/products/sodium-chloride-certified-ar-analysis-meets-analytical-specification-ph-eur/10428420 |
| Software for field recordings | HEKA Elektronik | PatchMaster | https://www.heka.com/downloads/software/manual/m_patchmaster.pdf |
| Spatula | Sigma Aldrich | S9147-12EA | https://www.sigmaaldrich.com/catalog/product/sigma/s9147?lang=en®ion=BE |
| Stimulator | A.M.P.I | ISO-FLEX | http://www.ampi.co.il/isoflex.html |
| Sucrose | VWR International Ltd. | 102745C | https://es.vwr-cmd.com/ex/downloads/magazine/lupc_userguide_uk.pdf |
| Tubing for carbogen, perfusion and suction lines 1 | Warner Instruments | 64-0167 | Tygon tubing (TY-50) for standard valve systems |
| Tubing for carbogen, perfusion and suction lines 2 | Fisher Scientific | 800/100/200 & 800/100/280 | Smiths Medical Portex Fine Bore LDPE Tubing |
| Vacuum pump | home made - Generic | N/A | |
| 8 valve multi-barrel perfusion system | home made | N/A | consists of barrels, tubing and a self-made automated valve control (specifications of all purchased parts can be found in this Table) |
| Magnetic valves (to control the perfusion lines) | NResearch Inc. | p/n 161P011 | https://nresearch.com/ |
| Vibratome | Leica | 14912000001 | Semi-automatic vibrating blade microomei VT1200 |
| Water bath | Memmert | WNB 7 | https://www.memmert.be/wp-content/uploads/2019/09/Memmert-Waterbath-WNB-7.en_.pdf |
| Water purification system | Merck | Synergy millipore | to obtain highly purified water |
| 12-well plates | Greiner Bio-One | CELLSTAR, 665180 | http://www.greinerbioone.com/UserFiles/File/Catalogue%202010_11/UK/3680_005-Kapitel1_UK.pdf |
Referencias
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neurology, Neurosurgery, and Psychiatry. 20 (1), 11-21 (1957).
- Cavarsan, C. F., Malheiros, J., Hamani, C., Najm, I., Covolan, L. Is mossy fiber sprouting a potential therapeutic target for epilepsy. Frontiers in Neurology. 9, 1023(2018).
- Nadler, J. V. The recurrent mossy fiber pathway of the epileptic brain. Neurochemical Research. 28 (11), 1649-1658 (2003).
- Raimondo, J. V., et al. Methodological standards for in vitro models of epilepsy and epileptic seizures. A TASK1-WG4 report of the AES/ILAE translational task force of the ILAE. Epilepsia. 58, Suppl 4 40-52 (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. , 86-98 (2015).
- Tohno, Y., et al. Relationships among the hippocampus, dentate gyrus, mammillary body, fornix, and anterior commissure from a viewpoint of elements. Biological Trace Element Research. 140 (1), 35-52 (2011).
- Maclean, P. D. The limbic system and its hippocampal formation; studies in animals and their possible application to man. Journal of Neurosurgery. 11 (1), 29-44 (1954).
- Petersen, R. P., et al. Electrophysiological identification of medial and lateral perforant path inputs to the dentate gyrus. Neuroscience. 252, 154-168 (2013).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in Brain Research. 163, 3-22 (2007).
- Szirmai, I., Buzsaki, G., Kamondi, A. 120 years of hippocampal schaffer collaterals. Hippocampus. 22 (7), 1508-1516 (2012).
- Cho, S., Wood, A., Bowlby, M. R. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Current Neuropharmacology. 5 (1), 19-33 (2007).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. Journal of Visualized Experiments. (49), e2330(2011).
- Papouin, T., Haydon, P. G. Obtaining Acute Brain Slices. Bio-protocol. 8 (2), 2699(2018).
- Li, Q., Han, X., Wang, J. Organotypic hippocampal slices as models for stroke and traumatic brain injury. Molecular Neurobiology. 53 (6), 4226-4237 (2016).
- Lo, D. C., McAllister, A. K., Katz, L. C. Neuronal transfection in brain slices using particle-mediated gene transfer. Neuron. 13 (6), 1263-1268 (1994).
- Lein, P. J., Barnhart, C. D., Pessah, I. N. Acute hippocampal slice preparation and hippocampal slice cultures. Methods in Molecular Biology. 758, Clifton, N.J. 115-134 (2011).
- Magalhaes, D. M., et al. Ex vivo model of epilepsy in organotypic slices-a new tool for drug screening. Journal of Neuroinflammation. 15 (1), 203(2018).
- Bliss, T. The hippocampus book. Andersen, P., Morris, R., Amaral, D., O'Keefe, J. , Oxford University Press. Ch. 3 37-114 (2007).
- Bortolotto, Z. A., Amici, M., Anderson, W. W., Isaac, J. T. R., Collingridge, G. L. Synaptic plasticity in the hippocampal slice preparation. Current Protocols in Neuroscience. 54 (1), 11-26 (2011).
- Al-Osta, I., et al. Imaging calcium in hippocampal presynaptic terminals with a ratiometric calcium sensor in a novel transgenic mouse. Frontiers in Cellular Neuroscience. 12, 209(2018).
- McLeod, F., Marzo, A., Podpolny, M., Galli, S., Salinas, P. Evaluation of synapse density in hippocampal rodent brain slices. Journal of Visualized Experiments. (128), e56153(2017).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments. (112), e54024(2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. 1183, Clifton, N.J. 221-242 (2014).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording synaptic plasticity in acute hippocampal slices maintained in a small-volume recycling-, perfusion-, and submersion-type chamber system. Journal of Visualized Experiments. (131), e55936(2018).
- Zhou, Q., Abe, H., Nowak, T. S. Immunocytochemical and in situ hybridization approaches to the optimization of brain slice preparations. Journal of Neuroscience Methods. 59 (1), 85-92 (1995).
- Koike-Tani, M., Tominaga, T., Oldenbourg, R., Tani, T. Birefringence changes of dendrites in mouse hippocampal slices revealed with polarizing microscopy. Biophysical Journal. 110 (10), 2366-2384 (2020).
- Ting, J. T., et al. Preparation of acute brain slices using an optimized N-Methyl-D-glucamine protective recovery method. Journal of Visualized Experiments. (132), e53825(2018).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8 (9), 745-752 (2011).
- Hua, Y., Keep, R. F., Hoff, J. T., Xi, G. Brain injury after intracerebral hemorrhage: the role of thrombin and iron. Stroke. 38, 2 Suppl 759-762 (2007).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Paxinos, G., Franklin, K. The Mouse Brain In Stereotaxic Coordinates. 3 edn. , Academic Press. 256(2008).
- Lacar, B., Young, S. Z., Platel, J. C., Bordey, A. Preparation of acute subventricular zone slices for calcium imaging. Journal of Visualized Experiments. (67), e4071(2012).
- Schauer, C., Leinders-Zufall, T. Imaging calcium responses in GFP-tagged neurons of hypothalamic mouse brain slices. Journal of Visualized Experiments. (66), e4213(2012).
- Tetteh, H., Lee, J., Lee, J., Kim, J. G., Yang, S. Investigating Long-term Synaptic Plasticity in Interlamellar Hippocampus CA1 by Electrophysiological Field Recording. Journal of Visualized Experiments. (150), e59879(2019).
- Smith, C. J., et al. Investigations on alterations of hippocampal circuit function following mild traumatic brain injury. Journal of Visualized Experiments. (69), e4411(2012).
- McNaughton, B. L. Evidence for two physiologically distinct perforant pathways to the fascia dentata. Brain Research. 199 (1), 1-19 (1980).
- Colino, A., Malenka, R. C. Mechanisms underlying induction of long-term potentiation in rat medial and lateral perforant paths in vitro. Journal of Neurophysiology. 69 (4), 1150-1159 (1993).
- Coulter, D. A., Carlson, G. C. Functional regulation of the dentate gyrus by GABA-mediated inhibition. Progress in Brain Research. 163, 235-243 (2007).
- Kuenzi, F. M., Fitzjohn, S. M., Morton, R. A., Collingridge, G. L., Seabrook, G. R. Reduced long-term potentiation in hippocampal slices prepared using sucrose-based artificial cerebrospinal fluid. Journal of Neuroscience Methods. 100 (1-2), 117-122 (2000).
- Connor, S. A., et al. Loss of synapse repressor MDGA1 enhances perisomatic inhibition, confers resistance to network excitation, and impairs cognitive function. Cell Reports. 21 (13), 3637-3645 (2017).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Moodley, K. K., Chan, D. The hippocampus in neurodegenerative disease. Frontiers of Neurology and Neuroscience. 34, 95-108 (2014).
- Kong, H., et al. Inhibition of miR-181a-5p reduces astrocyte and microglia activation and oxidative stress by activating SIRT1 in immature rats with epilepsy. Laboratory Investigation; A Journal of Technical Methods and Pathology. , (2020).
- Skrede, K. K., Westgaard, R. H. The transverse hippocampal slice: a well-defined cortical structure maintained in vitro. Brain Research. 35 (2), 589-593 (1971).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Wang, T., Kass, I. S. Preparation of brain slices. Methods in Molecular Biology. 72, Clifton, N.J. 1-14 (1997).
- Garthwaite, J., Woodhams, P. L., Collins, M. J., Balazs, R. On the preparation of brain slices: morphology and cyclic nucleotides. Brain Research. 173 (2), 373-377 (1979).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments: JoVE. (91), e51706(2014).
- Aydin-Abidin, S., Abidin, İ 7,8-Dihydroxyflavone potentiates ongoing epileptiform activity in mice brain slices. Neuroscience Letters. 703, 25-31 (2019).
- Xiong, G., Metheny, H., Johnson, B. N., Cohen, A. S. A comparison of different slicing planes in preservation of major hippocampal pathway fibers in the mouse. Frontiers in Neuroanatomy. 11, 107(2017).
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Reid, K. H., Edmonds, H. L., Schurr, A., Tseng, M. T., West, C. A. Pitfalls in the use of brain slices. Progress in Neurobiology. 31 (1), 1-18 (1988).
- Brini, M., Calì, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences: CMLS. 71 (15), 2787-2814 (2014).
- Gleichmann, M., Mattson, M. P. Neuronal calcium homeostasis and dysregulation. Antioxidants & Redox Signaling. 14 (7), 1261-1273 (2011).
- Padamsey, Z., Foster, W. J., Emptage, N. J. Intracellular Ca(2+) release and synaptic plasticity: a tale of many stores. The Neuroscientist: A Review Journal Bringing Neurobiology, Neurology and Psychiatry. 25 (3), 208-226 (2019).
- Chen-Engerer, H. J., et al. Two types of functionally distinct Ca2+ stores in hippocampal neurons. Nature Communications. 10 (1), 3223(2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 32 (40), 13819-13840 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados