Method Article
Fatias hipocampais horizontais do cérebro do rato
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo tem como objetivo descrever um protocolo sistemático para obter fatias cerebrais hipocampais horizontais em camundongos. O objetivo desta metodologia é preservar a integridade das vias de fibra hipocampal, como o caminho perfurante e o trato de fibra de musgo para avaliar processos neurológicos relacionados ao giro dento.
Resumo
O hipocampo é uma estrutura altamente organizada no cérebro que faz parte do sistema límbico e está envolvida na formação e consolidação da memória, bem como na manifestação de doenças cerebrais graves, incluindo doença de Alzheimer e epilepsia. O hipocampo recebe um alto grau de intra e interconectividade, garantindo uma comunicação adequada com estruturas cerebrais internas e externas. Essa conectividade é realizada através de diferentes fluxos informacionais na forma de vias de fibra. As fatias cerebrais são uma metodologia frequentemente utilizada ao explorar funções neurofisiológicas do hipocampo. As fatias cerebrais hipocampais podem ser usadas para várias aplicações diferentes, incluindo gravações eletrofisiológicas, medidas microscópicas leves, bem como várias técnicas biológicas moleculares e histoquímicas. Portanto, as fatias cerebrais representam um sistema modelo ideal para avaliar funções proteicas, para investigar processos fisiofisiológicos envolvidos em distúrbios neurológicos, bem como para fins de descoberta de drogas.
Existem várias formas diferentes de preparos de fatias. As preparações de fatias cerebrais com um vibratome permitem uma melhor preservação da estrutura tecidual e garantem um suprimento suficiente de oxigênio durante o corte, que apresentam vantagens sobre o uso tradicional de um helicóptero de tecido. Além disso, diferentes planos de corte podem ser aplicados para preparações de fatias cerebrais vibratome. Aqui, um protocolo detalhado para uma preparação bem sucedida de fatias hipocampais horizontais de cérebros de camundongos com corte de vibratome é fornecido. Em contraste com outras preparações de fatias, o corte horizontal permite manter as fibras do caminho de entrada hipocampal (caminho perfurante) em um estado totalmente intacto dentro de uma fatia, o que facilita a investigação de interações entorhinal-hipocampal. Aqui, fornecemos um protocolo minucioso para a dissecção, extração e corte horizontal agudo do cérebro murino, e discutimos desafios e potenciais armadilhas desta técnica. Finalmente, mostraremos alguns exemplos para o uso de fatias cerebrais em outras aplicações.
Introdução
A extensa exploração do hipocampo começou quando Scoville e Milner relataram a incapacidade de um paciente (H.M.) de formar uma nova memória declarativa após a remoção cirúrgica do hipocampo e das estruturas do lobo temporal próximo como tratamento para epilepsia grave1. A partir desse momento, o hipocampo tem sido estudado extensivamente desde propriedades neuronais gerais e funções até o desenvolvimento de doenças cerebrais graves, como epilepsia e doença de Alzheimer2,3,4,5. O hipocampo faz parte do sistema límbico, consistindo de um grupo de estruturas cerebrais relacionadas envolvidas na formação de emoção e memória6,7. Uma densa rede de várias vias de fibra realiza uma conectividade hipocampal apertada com estruturas cerebrais internas e externas. Essas vias incluem o caminho perforante medial e lateral (córtex entorhinal para dento gyrus, CA3 – CA1 e subiculum)8, o caminho de fibra de musgo (giro dento para CA3)9 e a via bilateral/associacional Schaffer (CA3 a CA1)10 (Figura 1). O hipocampo apresenta uma das áreas cerebrais mais amplamente exploradas até agora devido à sua organização laminar altamente conservada da formação de camadas neuronais, e a possibilidade de obter culturas neuronais vitais e fatias cerebrais com relativa facilidade5.
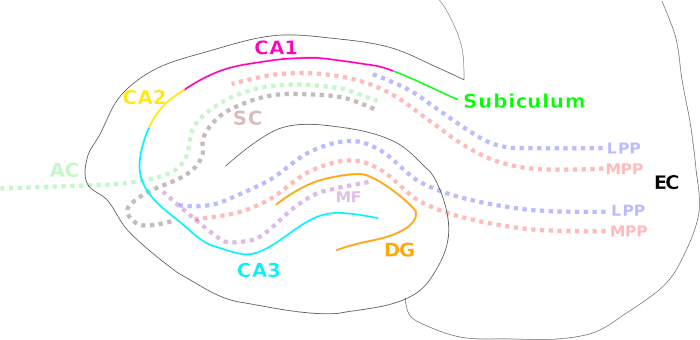
Figura 1: Desenho animado ilustrando as diferentes regiões hipocampais e principais caminhos de fibra. As diferentes regiões hipocampais são indicadas por linhas coloridas sólidas: córtex entorhinal (CE; preto), giro dento (DG; laranja), Cornu Ammonis (CA) 3 (ciano), 2 (amarelo) e 1 (magenta), e o subiculum (verde). As vias de fibra são mostradas com uma linha pontilhada colorida: o caminho medial (MPP, vermelho) e perforante lateral (LPP, azul) (do córtex entorhinal ao giro dentado, CA3, CA1 e subiculum), a via de fibra de musgo (MF, violeta) (do giro dentado ao CA3) e a garantia Schaffer (SC, marrom) (ipsilateral de CA3 a CA1)/vias comissurais associacionais (AC, verde claro) (contralateral de CA3 a CA1). Clique aqui para ver uma versão maior desta figura.
Protocolos de fatia cerebral muitas vezes resultam na perda de conexões de áreas cerebrais mais distantes para a área de interesse5. Além disso, os capilares não são mais funcionais5 e a circulação sanguínea é privada11. Apesar dessas limitações, as fatias cerebrais ainda são usadas principalmente para a investigação de funções neurofisiológicas do hipocampo devido a uma série de vantagens. Primeiro, a extração do hipocampo é rápida12 e não requer muitos materiais. Os únicos instrumentos essenciais incluem um kit de dissecção, um banho de água de laboratório, acesso ao carbogen e um microtome vibratório (vibratome)13. Outros ativos da técnica de fatia cerebral são a evasão da barreira hemencefálica -cérebro (BBB) e a lavagem de moléculas liberadas endógenamente antes do início do experimento5, o que torna possível estudar o efeito de drogas com controle de dosagem relativamente preciso14. Além disso, as fatias cerebrais preservam a cito-arquitetura e os circuitos sinápticos dentro do hipocampo15,16, onde a neuronatomia e o ambiente local com conectividade neuronal e interações complexas neurônio-glia são preservados4,11,17. Além disso, as conexões de fibra hipocampal são predominantemente unidirecionais e os neurônios hipocampais têm uma alta plasticidade sináptica, o que simplifica tremendamente a coleta e interpretação de gravações eletrofisiológicas de alta qualidade para entender os processos neurológicos18,19. É importante ressaltar que as fatias cerebrais apresentam um valioso ativo aplicável em uma ampla gama de diferentes técnicas científicas, abrangendo desde técnicas biológicas moleculares sobre registros de imagens até medições eletrofisiológicas12,20,21,22,23,24,25,26.
Como descrito acima, as fatias cerebrais hipocampais apresentam uma poderosa ferramenta experimental para estudar características estruturais e funcionais da conectividade sináptica. Isso oferece a oportunidade de avaliar os efeitos de produtos químicos ou mutações na excitabilidade neuronal e plasticidade16.
Preparações agudas de fatias cerebrais estão apresentando uma técnica relativamente sensível e a qualidade ideal da fatia é altamente dependente de condições experimentais ideais, incluindo a idade do animal, o método de eutanásia, a velocidade de dissecção e fatiamento, as soluções e parâmetros de corte (por exemplo, velocidade de corte) bem como as condições para recuperação de fatias4. Portanto, um protocolo bem desenhado é de maior importância e garante a reprodutibilidade em diferentes unidades de pesquisa13.
Aqui, fornecemos um protocolo detalhado para preparações agudas de fatias hipocampais horizontais horizontais, com o objetivo de preservar a integridade do caminho de perfuração lateral e medial hipocampal e da via de fibra de musgo, permitindo a investigação dos processos relacionados ao giro dento9. Descreveremos em detalhes os principais passos para dissecar, extrair e fatiar horizontalmente o cérebro murino, seguido por resultados representativos de gravações microfluorimétricas de cálcio e gravações potenciais postinos (fEPSPs) em condições básicas e durante protocolos de indução de LTP em fatias cerebrais de camundongos tipo selvagem C57BL/6J.
Protocolo
Todos os experimentos em animais para este estudo foram aprovados pelo comitê de revisão ética do KU Leuven (Bélgica) (P021/2012).
1. Preparação de solução de fatia de alta sacarose e fluido cerebrospinal artificial (ACSF)
- Antes do dia experimental
- Prepare 1 L de pré-solução de fatia de 10x com água tipo 1 de grau laboratorial contendo (em mM): 25 KCl, 20 CaCl2, 10 MgSO4, 12,5 KH2PO4 (Tabela 1). Para evitar a precipitação do fosfato de cálcio, misture lentamente os produtos químicos em um béquer pré-preenchido com 800 mL H2O enquanto mexe constantemente com um agitador magnético. Armazene a solução a 4 °C ou temperatura ambiente (RT).
- No dia experimental
- Prepare 1 L de 1x ACSF com grau laboratorial Tipo 1 de água contendo (em mM): 125 NaCl, 2,5 KCl, 2 CaCl2, 1 MgSO4, 1.25 NaH2PO4, 26 NaHCO3, 25 Glicose(Tabela 2). Use um osmômetro de pressão de vapor para validar a osmolaridade entre 305-315 mOsm (pH ~ 7,55-7,6).
NOTA: Para evitar a precipitação do fosfato de cálcio, misture lentamente todos os produtos químicos sólidos em um béquer pré-preenchido com 800 mL de H2O enquanto mexe constantemente com um agitador magnético. Adicione MgSO4 e CaCl2 no final, pingando lentamente na quantidade necessária de soluções de estoque de 1 M. - Bolha contínua 1x solução ACSF em RT com carbogen para definir pH entre 7.3 e 7.4.
NOTA: Se o pH for ligeiramente alto ou muito baixo, pequenos ajustes na força da carbogenação seriam suficientes. Se o pH for superior a 7,45 com carbogenação, ajuste-o adicionando algumas gotas de 1 M NaH2PO4 solução. - Prepare 250 mL (por cérebro) de solução de fatia de alta sacarose 1x em um béquer contendo 25 mL de pré-solução de fatia de 10x e (em mM): 252 sacarose, 26 NaHCO3e 10 Glicose(Tabela 3). Verifique se a osmolaridade está entre 320-325 mOsm (pH ~ 7,55-7.6).
- Bolha a solução de fatia de alta sacarose por 10-15 min com carbogen para controlar o pH entre 7,3 e 7,4.
NOTA: Se o pH for superior a 7,45 com carbogenação, ajuste-o adicionando algumas gotas de 1 M KH2PO4 solução. - Guarde a solução de fatia de alta sacarose por 20-30 min no ultra freezer (-80 °C) até que esteja parcialmente congelado.
- Prepare 1 L de 1x ACSF com grau laboratorial Tipo 1 de água contendo (em mM): 125 NaCl, 2,5 KCl, 2 CaCl2, 1 MgSO4, 1.25 NaH2PO4, 26 NaHCO3, 25 Glicose(Tabela 2). Use um osmômetro de pressão de vapor para validar a osmolaridade entre 305-315 mOsm (pH ~ 7,55-7,6).
2. Preparação do espaço de trabalho para a dissecação cerebral
- Durante o resfriamento da solução de fatia de sacarose alta, prepare o seguinte.
- Aqueça o banho de água a 32 °C.
- Encha a câmara de recuperação (Figura 2A) com a solução acsf carbogenada e coloque a câmara no banho de água. Aplique continuamente carbogen à garrafa ACSF principal e à ACSF na câmara de recuperação.
- Levar o animal para a sala experimental.
NOTA: A idade, o sexo e a tensão do animal devem ser determinados pelo experimentador individual e dependem da questão específica do estudo. No entanto, os parâmetros do animal devem permanecer constantes dentro de um estudo, a fim de garantir a comparabilidade entre os diferentes dias experimentais. Este protocolo foi projetado para o uso de camundongos machos C57BL/6J com idade de 2 a 6 semanas. Se os animais mais velhos forem utilizados, as soluções de fatia e recuperação podem ter que ser adaptadas em conformidade4,27 (por exemplo, soluções baseadas em NMDG+23,28) a fim de preservar a saúde cerebral das fatias agudas. - Prepare a câmara de anestesia.
- Coloque papel de tecido, pipeta pasteur de plástico com abertura larga (cortada aberta), prato de cultura de 90 mm cheio de gelo, um quadrado de papel filtro em cima do prato de cultura resfriado, tesoura forte para decapitação, tesoura de dissecção, fórceps curvas, espátula, prato de cultura de 35 mm, escova fina, lâmina, placa de espécime (vem com vibratome), super cola, ponta da pipeta, quatro alças de papel filtro (~ 2 cm x 0,5 cm)(Figura 2A).
- Configure o vibratome: Primeiro, programe o vibratome para as configurações corretas (velocidade de viagem da lâmina: 0,08 mm/s, amplitude de corte: 1,4 mm, frequência de corte: 85 Hz) e conecte a linha carbogen na câmara de corte. Em seguida, coloque a câmara de fatia no suporte, encha o suporte ao redor da câmara de fatia com gelo e anexe tudo ao vibratome. Por fim, coloque a lâmina de barbear no suporte da lâmina vibratome(Figura 2B).
- Após o congelamento da solução de alta sacarose, execute as seguintes etapas.
- Depois de 20-30 min, pegue a solução de fatia de alta sacarose do ultracongelado de -80 °C e mantenha o béquer no gelo.
- Coloque a solução de alta sacarose ao lado do vibratome no seu banco, esmague e misture a solução parcialmente congelada com uma espátula para obter uma slush agradável e comece a borbulhar com carbogen.
- Pegue uma solução de fatia de alta sacarose com a pipeta pasteur de plástico para absorver o papel de filtro quadrado em cima do prato de cultura de 90 mm refrigerado.
- Encha o prato de cultura de 35 mm (ou qualquer recipiente pequeno equivalente que seja adequado para armazenar todo o cérebro) até 75% com a solução de fatia de alta sacarose (suficiente para cobrir todo o cérebro) e esfrie o prato de cultura no gelo mantido ao lado do béquer com o resto da solução. Carbogenar a solução no prato de cultura de 35 mm.
3. Dissecção e posicionamento do cérebro murino
- Anestesiar o animal com 5% de isoflurane. Determine a profundidade adequada da anestesia beliscando a pata. Nenhum reflexo de abstinência da pata deve ocorrer.
- Transfira o animal em papel de tecido e decapite-o com uma tesoura forte ou uma guilhotina animal pequena.
- Use uma tesoura de dissecção para abrir o couro cabeludo.
- Corte a calvaria ao longo da sutura sagital e remova-a com a ajuda de fórceps curvas até que todo o cérebro, incluindo as lâmpadas olfativas, seja visível.
NOTA: Tenha cuidado para não danificar o cérebro com as bordas afiadas da calvaria ou fórceps. - Use uma espátula para colher cuidadosamente o cérebro (lâmpadas olfativas devem permanecer presas).
- Transfira o cérebro no prato de cultura resfriado de 35 mm e remova todas as partículas de cabelo ou sangue do tecido lavando suavemente o cérebro com uma pipeta Pasteur preenchida com ACSF (o sangue tem efeitos citotóxicos no tecido cerebral29).
- Transfira o cérebro com a ajuda da espátula no papel filtro encharcado em cima do prato de cultura refrigerado de 90 mm(Figura 2A).
- Use uma lâmina para cortar o cérebro ao meio, separando os dois hemisférios, e coloque ambos os hemisférios no lado medial recém-cortado.
- Use uma lâmina para remover a parte dorsal (5%-10%) do cérebro de cada hemisfério com um corte paralelo ao topo dorsal (Figura 2C)30 e coloque ambos os hemisférios no lado recém-cortado com a parte ventral do cérebro voltada para cima.
- Posicione uma gota de super cola na placa do espécime e espalhe corretamente com uma ponta de pipeta para acomodar ambos os hemisférios.
- Use uma correia de papel filtro para pegar um hemisfério com forças capilares tocando o lado ventral com a correia de papel do filtro, não danificando assim o tecido.
- Use outra correia de papel filtro para secar cuidadosamente o lado dorsal do cérebro antes de posicionar o hemisfério com o lado dorsal para baixo na parte superior da cola na placa do espécime. Repita o mesmo procedimento com o segundo hemisfério.
NOTA: Os hemisférios devem ser posicionados em alinhamento horizontal de forma espelhada na placa vibratome, com os lados rostral apontando para o lado externo e os lados caudais voltados (mas não se tocando) no meio. Os lados medial de ambos os hemisférios devem apontar para a lâmina vibratome e os lados laterais em direção ao experimentador(Figura 2D). - Coloque a placa do espécime na câmara de corte e rapidamente, mas com cuidado, cubra-a com a solução de fatia de alta sacarose gelada. Assim que a solução tocar a cola, ela solidificará e colará adequadamente os hemisférios à placa de espécime.
- Certifique-se de que os hemisférios estão devidamente cobertos com solução de fatia de alta sacarose e confirme que a solução é borbulhada com carbogen.
NOTA: Todo o procedimento de dissecção deve ser realizado o mais rápido possível. Por favor, certifique-se de que o cérebro não fique sem o fornecimento de oxigênio por muito tempo. Deve levar apenas cerca de 1-1,5 minutos de decapitação para submersão cerebral na solução de alta sacarose. Este é o requisito mais crítico para preparações agudas de fatias cerebrais, a fim de garantir alta qualidade da fatia.
4. Corte horizontal do cérebro
- Posicione a lâmina vibratome na frente do lado medial dos hemisférios e abaixe-a para a mesma altura que os lados ventral dos hemisférios que agora estão voltados para cima. Abaixe a lâmina com a ajuda do controle do vibratome para 600 μm ainda mais na direção dorsal e comece a cortar. A lâmina deve acertar o tecido (se não, inverta a lâmina e abaixe-a um pouco mais). Corte até que as duas primeiras fatias estejam completamente separadas dos dois hemisférios.
- Inverta a lâmina e baixe mais 300 μm e corte novamente.
- Quando o hipocampo se tornar visível (use o atlas cerebral do mouse31 para ajudar, se necessário)(Figura 2E) colete as fatias com a pipeta pasteur de plástico alargada. Colete as fatias até que o putamen caudate se torne visível ao lado do hipocampo. Normalmente, entre 8-12 fatias de 300 μm (4-6 por hemisfério) podem ser coletadas para o cérebro do camundongo.
- Use a pipeta pasteur de plástico para coletar as fatias e transferi-las para a câmara de recuperação no banho de água(Figura 2F) (coletar fatias após cada rodada de corte para evitar que elas flutuam na câmara de corte).
NOTA: Trabalhe o mais rápido possível e certifique-se de que a solução de fatia de alta sacarose seja gelada e carbogenada durante todo o procedimento. Se necessário, reabasteje o gelo ao redor da câmara de fatias.
5. Recuperação de fatias cerebrais para gravações eletrofisiológicas
- Deixe as fatias na câmara de recuperação cheia de ACSF no banho de água de 32 °C por 1h.
NOTA: As câmaras de recuperação também estão disponíveis comercialmente. - Tire a câmara de recuperação do banho de água.
- Coloque as fatias no RT por pelo menos mais 30 minutos para recuperação antes de iniciar qualquer aplicação adicional.
6. gravações fEPSP no caminho medial perforant (MPP) do hipocampo
- Puxe pipetas de gravação de capilares de vidro borossilicato com um puxador de pipeta horizontal para receber pipetas do tamanho de ~2 MΩ quando preenchidos com solução ACSF e imersos na câmara de gravação cheia de ACSF.
- Encha a solução de banho ACSF e a solução ACSF contendo os produtos químicos apropriados (por exemplo, Bicuculline) em um sistema de perfusão de vários canos controlado pela gravidade que está conectado à câmara de gravação. Carbogenar continuamente todas as soluções.
- Ligue uma bomba peristáltica ou de vácuo que esteja conectada a uma tubulação de sucção que termina em frente à linha de perfusão na câmara de gravação. Abra o barril cheio de ACSF e comece a estabelecer um fluxo contínuo (1-2 gotas por segundo). Verifique se o eletrodo de referência está submerso na solução ACSF.
- Ligue o computador de configuração, o amplificador, o micromanipulador, o estimulador, a luz do microscópio, a câmera e o monitor (se aplicável).
- Abra o software apropriado para gravações eletrofisiológicas (existem vários provedores diferentes de hardware e software para equipamentos eletrofisiológicos).
- Transfira um hemisfério de fatia cerebral da câmara de recuperação para a câmara de gravação da configuração da fatia e posicione-o na orientação correta com a camada de célula de grânulo desnada e a camada molecular no campo de visão. Certifique-se de que o eletrodo de estimulação pode atingir o MPP na fatia da direção do córtex entorhinal e que o eletrodo de gravação tenha acesso ao MPP exatamente do lado oposto da direção do CA3.
- Estabilize a fatia na câmara de gravação com um clipe de papel(Figura 3A) ou uma grade de fatias cerebrais comercialmente disponível.
NOTA: Pode ser útil desligar a perfusão durante a transferência e posicionamento da fatia. No entanto, isso não deve demorar muito para garantir a qualidade da fatia cerebral. - Abaixe e posicione os eletrodos de gravação e estimulação no MPP no terço inferior da camada molecular próxima à camada celular do grânulo(Figura 3B),de frente para o outro a uma distância de aproximadamente 100-150 μm. O eletrodo de estimulação deve entrar em contato minimamente com a superfície, enquanto o eletrodo de gravação deve se infiltrar ligeiramente na camada superior da fatia.
- Aplique um estímulo de baixa intensidade (30-50 μA por 0,1 ms) na fatia cerebral, a fim de obter o sinal fEPSP. Adapte a posição dos eletrodos, se necessário (por exemplo, sinal fEPSP de forma baixa ou atípica).
- Comece a registrar curvas de saída de entrada: aplique intensidades de estímulo crescentes à fatia cerebral em intervalos de 30 s.
- Defina a intensidade de estímulo para 50% da resposta máxima fEPSP e inicie gravações de fEPSP de linha de base aplicando a intensidade de estímulo de 50% para 20-40 min em intervalos de 30 s para a fatia cerebral.
- Se a linha de base parecer estável, proceda com gravações adicionais (por exemplo, protocolos LTP/LTD e/ou aplicações de medicamentos). (Para a indução de LTP no MPP, aqui foi utilizado um protocolo composto de quatro vezes 1 s 1 s 100 Hz de pulsos aplicados em um intervalo de 5 min. A bicucullina foi aplicada 10 min antes e durante a fase de condicionamento.)
NOTA: Todas as gravações devem ser realizadas no modo de fixação atual com filtragem low-pass apropriada (<5 kHz) e taxas de amostragem (>10 kHz). - Extrair os dados em um formato de arquivo apropriado e analisar parâmetros fEPSP, como voleio de fibra, amplitude fEPSP e inclinação fEPSP.
7. Gravações de imagem de cálcio de fatias cerebrais
- Transfira um hemisfério de fatia cerebral em uma câmara de 12 poços e carregue-o por 30 minutos a 1 h com um corante de cálcio apropriado. Carbogenar continuamente a solução de carregamento inserindo um tubo de carbogenação através de um orifício auto-feito (com uma agulha 18G quente) na tampa da placa de 12 poços.
NOTA: Esta etapa não é necessária no caso de preparações de fatias cerebrais de animais geneticamente modificados que expressam endógenamente um repórter fluorescente como o GCaMP. - Prepare a configuração de gravação conforme descrito nas etapas 6.2-6.5.
NOTA: Nenhum amplificador ou micromanipulador é necessário para experimentos de imagem microfluormétrica. O uso de um estimulador é dependente de experimentos. Software específico para experimentos de imagem de fluorescência é essencial. - Ajuste o software às configurações corretas de imagem: isso inclui amplificador de câmera e configuração de binning, configuração do comprimento de onda, tempo de exposição e protocolo de tempo. As configurações podem variar dependendo dos experimentos exatos. (Para o exemplo, 1 x 1 binning, ganho pré-amplificador de 2,4x, ganho de câmera EM de 300, exposição de 50 ms a 488 nm repetida a cada 500 ms durante a duração do experimento.)
- Depois de carregar com o corante de cálcio, transfira o hemisfério de fatia cerebral do 12-well para a câmara de gravação e posicione-o no estágio do microscópio.
- Estabilize a fatia na câmara de gravação com um clipe de papel (Figura 3A) ou uma grade de fatia cerebral comercialmente disponível semelhante à descrita na etapa 6.7.
- Assegurar que a área de interesse está no campo microscópico correto e em foco.
- Use o software de imagem fluorescência para selecionar várias regiões de interesse (ROIs) em sua fatia.
NOTA: Pode ser útil selecionar todo o campo de visão para seguir as flutuações gerais no brilho, devido ao fotobleaching. - Inicie a gravação e aplique os testes experimentais em pontos de hora escolhidos.
NOTA: É aconselhável aplicar uma solução K+ alta no final de cada experimento para verificar o caráter neuronal das células e a qualidade da fatia. - Extrair os dados em um formato de arquivo apropriado e analisar as alterações de sinal de fluorescência que ocorrem nos ROIs durante toda a medição. Os ROIs também podem ser adaptados durante a análise off-line.
NOTA: Outros protocolos que descrevem gravações de fEPSP e microfluormetria de cálcio em fatias cerebrais estão disponíveis na literatura24,32,33,34,35.
Resultados
Visão geral das ferramentas e passos críticos necessários para o protocolo
A Figura 2 apresenta todas as ferramentas e etapas críticas necessárias para a preparação de fatias cerebrais hipocampais agudas horizontais, conforme descrito neste protocolo. Geralmente, são necessários um número limitado de instrumentos-chave, incluindo algumas ferramentas de dissecção e uma câmara de recuperação de fatias(Figura 2A),um banho de água de laboratório e um vibratome(Figura 2B). Figura 2C-E visualizar passos e orientações importantes do cérebro e hemisférios durante o protocolo de preparação da fatia. Figura 2F é uma ilustração de um resultado esperado de fatias cerebrais horizontais.
gravações fEPSP no caminho perforant medial
Após o período de recuperação, as fatias cerebrais podem ser usadas para gravações eletrofisiológicas de fEPSPs. Aqui, usamos um microscópio vertical equipado com um sistema de perfusão controlado pela gravidade multicanal(Figura 3A e Figura 3B). Uma micropipette de vidro (~ 2 MΩ) foi preenchida com solução ACSF e anexada em cima de um eletrodo de prata revestido de cloreto que é montado em um amplificador operacional em circuito com um eletrodo de banho clorado. fEPSPs foram gravados e visualizados com um amplificador e software de gravação apropriado, inserindo a micropipette de vidro no MPP do hipocampo na camada superior da fatia cerebral. fEPSPs foram induzidos pela estimulação com uma microeletromes de cluster de 2 contatos, aplicando diferentes intensidades de corrente ao MPP a montante do eletrodo de gravação. Observe que este protocolo não se destina a explicar como obter gravações de MPP, mas simplesmente usa gravações no MPP como exemplo para demonstrar o sucesso do protocolo de preparação de fatias descrito aqui. Se alguém tentar realizar gravações MPP, certos controles (por exemplo, gravações de pulso emparelhadas) podem ser necessários para garantir o local de gravação adequado e distinguir o MPP da LPP8,36,37.
A Figura 3C ilustra um exemplo negativo (painel esquerdo, fatia de baixa qualidade) e positivo (painel direito, fatia de alta qualidade) de uma gravação fEPSP. O traço de exemplo negativo mostra uma grande amplitude de voleio de fibra (FV) que é ainda maior do que a amplitude real fEPSP (≈0,5 mV). Em contraste, o exemplo de fatia de alta qualidade (painel direito) mostra uma pequena relação FV para fEPSP e uma alta amplitude fEPSP (>0,5 mV). A fibra de voleio é o sinal que ocorre após a despolarização das fibras neuronais estimuladas e, portanto, precede a potencialização postiática (fEPSP). A relação da FV com as propriedades da FEPSP fornece informações importantes sobre a preservação das propriedades axonais e sinápticas. Fatias de alta qualidade com fibras nervosas intactas devem mostrar uma alta amplitude fEPSP para a razão FV. Pelo contrário, fatias de baixa qualidade com propriedades de condução prejudicadas terão uma relação fEPSP para FV reduzida. Da mesma forma, a viabilidade de uma fatia cerebral pode ser analisada plotando encostas fEPSP versus as amplitudes de fibra de voleio(Figura 3D).
Além disso, as curvas de saída de entrada (inclinação fEPSP e amplitude FV sobre intensidade de estímulo) são usadas de forma padrão para determinar a qualidade da fatia. Tais curvas são obtidas aplicando estímulos atuais crescentes na fatia cerebral e monitorando as respostas subsequentes do FEPSP. As fatias cerebrais de baixa qualidade mostram uma curva reduzida de entrada-saída devido às propriedades de condução subótima do tecido cerebral mal preservado(Figura 3E,F). Além disso, as curvas de entrada-saída são necessárias para definir o intervalo ideal de intensidade de estimulação para a investigação de processos sinápticos. Idealmente, a intensidade do estímulo deve ser fixada em torno de 50% da intensidade para respostas máximas. Nesta intensidade de estímulo escolhida, as respostas fEPSP são altamente sensíveis para quaisquer mudanças na plasticidade sináptica, o que oferece a oportunidade de investigar tanto a potencialização de longo prazo (LTP) quanto a depressão a longo prazo (LTD).
Para estudar a plasticidade sináptica, a transmissão sináptica da fatia cerebral (inclinação fEPSP) na intensidade de estímulo escolhida de 50% é monitorada por um período de tempo mais longo (geralmente entre 20-40 min) antes da fase de condicionamento. As fatias cerebrais viáveis terão linhas de base estáveis, enquanto as fatias cerebrais com uma linha de base instável não podem ser usadas para protocolos de condicionamento adicionais, a fim de estudar a plasticidade sináptica dos circuitos cerebrais(Figura 3G, painel superior). gravações de linha de base fEPSP também podem ser úteis para monitorar os efeitos da droga na própria transmissão sináptica(Figura 3G, painel inferior). A média dos sinais de linha de base fEPSP registrados é normalmente usada para normalizar um curso de tempo fEPSP e é padronizadamente definida em 100%.
A plasticidade sináptica pode ser estudada aplicando protocolos de condicionamento específicos nas fatias cerebrais. Esses protocolos dependem do circuito cerebral investigado e do mecanismo de interesse (por exemplo, LTP ou LTD). Para induzir a LTP no MPP do giro dentado, é necessário um protocolo de condicionamento forte devido à forte inibição gabaérgica presente nas sinapsesMPP 38. Relata-se que a inibição gabaérgica é ainda mais pronunciada em fatias cerebrais preparadas com soluções de corte de alta sacarose39. Aqui, utilizamos um protocolo composto por quatro estimulações de pulsos de 1 s longos e 100 Hz aplicados em um intervalo de 5 minutos enquanto são tratados com o antagonista do receptor GABAA Bicuculline(Figura 3H). A co-adição de NMDA e Bicuculline durante o período de condicionamento resulta em um aumento da LTP (Figura 3H). A baixa qualidade da transmissão sináptica fatiada e instável (linha de base fEPSP) pode resultar em indução de LTP e LTD alteradas ou mal sucedidas. Portanto, é de alta importância trabalhar com preparações de fatias de alta qualidade e usar critérios rigorosos de exclusão (baixa amplitude fEPSP à relação de voleio de fibra (<3), pequena inclinação fEPSP (<0,5 mV/ms) ou amplitude (<0,5 mV) e linha de base fEPSP instável (mudança de mais de 5%) para fatias inviáveis ao investigar processos sinápticos.
Medições microfluormétricas de cálcio na camada celular do giro dento
Após a recuperação, uma fatia cerebral foi incubada à temperatura ambiente com 2 μM de um corante sensível ao cálcio por 1 h em ASCF carbogenado, protegido da luz. A fatia foi transferida para uma câmara de gravação (Figura 3A) em um microscópio de fluorescência vertical equipado com um sistema de perfusão controlado pela gravidade multicanal. Imagens de emissão de fluorescência foram adquiridas a cada 500 milissegundos após a iluminação a 488 nm(Figura 4A,B). A excitação foi feita com uma lâmpada Xenon e um scanner montado em monocromador de grade de difração e aquisição de imagem foi realizado com uma câmera CCD controlada por computador. Durante as medições, a fatia foi tratada com o antagonista do receptor NMDA APV, o que resultou em uma diminuição na concentração de cálcio intracelular. A estimulação da fatia com uma solução extracelular contendo alta concentração de potássio (50 mM) resultou em um grande fluxo de cálcio extracelular devido à despolarização dos neurônios e à abertura de canais de íons fechados de tensão(Figura 4C).
| composto | Concentração (mM) | Peso molecular (g/mol) | Quantidade (g) |
| HCO | 25 | 74.55 | 1.86 |
| CaCl2 * 2H2O | 20 | 147.01 | 2.94 |
| MgSO4 * 7H2O | 10 | 246.48 | 2.46 |
| KH2PO4 | 12.5 | 136.08 | 1.7 |
Tabela 1: 10 x fatia pré-solução (1 L).
| composto | Concentração (mM) | Peso molecular (g/mol) | Quantidade (g) |
| NaCl | 125 | 58.44 | 7.3 |
| Kcl | 2.5 | 74.55 | 0.19 |
| CaCl2 * 2H2O | 2 | a partir de 1 M CaCl2 solução | 2 mL |
| MgSO4 * 7H2O | 1 | a partir de 1 M MgSO4 solução | 1 mL |
| NaH2PO4 * 2H2O | 1.25 | 156.02 | 0.2 |
| NaHCO3 | 26 | 84.01 | 2.18 |
| Glicose * H2O | 25 | 198.17 | 4.95 |
Tabela 2: 1x ACSF (1 L) (osmolaridade entre 305-315 mOsm).
| composto | Concentração (mM) | Peso molecular (g/mol) | Quantidade (g) |
| 10x de pré-lubrificação de fatia | N/A | N/A | 25 mL |
| sacarose | 252 | 342.3 | 21.57 |
| NaHCO3 | 26 | 84.01 | 0.55 |
| Glicose * H2O | 10 | 198.17 | 0.49 |
Tabela 3: 1x solução de fatia de sacarose alta (250 mL) (osmolaridade entre 320-325 mOsm).
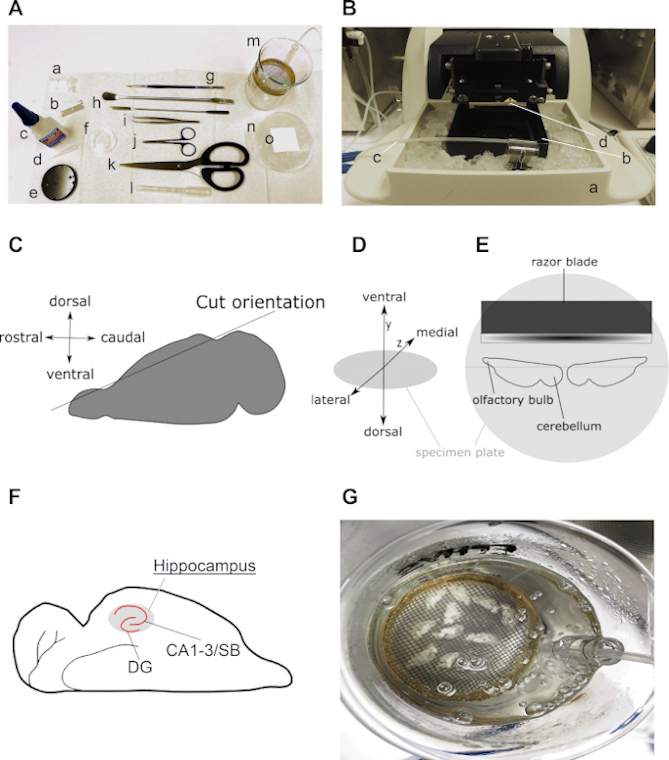
Figura 2: Informações detalhadas sobre a preparação de fatias cerebrais hipocampais horizontais. (A) Imagem das ferramentas necessárias para dissecção e corte do cérebro de roedores: (a) ±2 cm de comprimento e ±0,5 cm de correias largas de papel filtro (por exemplo, grau 413); b Lâmina; c Super cola; d Ponta de pipeta; e Placa de espécime (vem com vibratome); f Prato de cultura de 35 mm; g Escova fina; h espátula; i Fórceps curvados; j Tesoura de dissecção; (k) tesoura forte (comprimento da lâmina acima de 10 cm); (l) pipeta pasteur de plástico com abertura larga (entre 0,6 a 0,8 cm de diâmetro); (m) câmara de recuperação (auto-fabricada com béquer de 250 mL, anel plástico, malha de nylon, pedaço de uma pipeta sorológica de 10 mL); n Prato de cultura de 90 mm recheado com gelo e (o) quadrado de papel filtro em cima do prato de cultura resfriado. (B) Imagem de um vibratome com (a) porta-caixa de câmara de fatias cheia de gelo; b Câmara de fatias; c Linha carbogen e (d) lâmina de barbear fatiada. (C) Desenho animado ilustrando a orientação do corte do lado dorsal de um hemisfério, a fim de preparar o cérebro para o corte horizontal (ver passo 3.9). (D) Projeção isométrica da orientação cerebral na placa de espécime do vibratome. (E) Desenho animado ilustrando uma visão superior da posição dos dois hemisférios na placa de espécime. (F) Desenho animado mostrando a posição do hipocampo em uma fatia horizontal do cérebro. As regiões desntos gyrus (DG) e Cornu Ammonis (CA)-Subiculum (SB) do hipocampo são indicadas. (G) Imagem de uma câmara de recuperação com ACSF carbogenado contendo dez fatias horizontais horizontais recém-fatiadas. Clique aqui para ver uma versão maior desta figura.
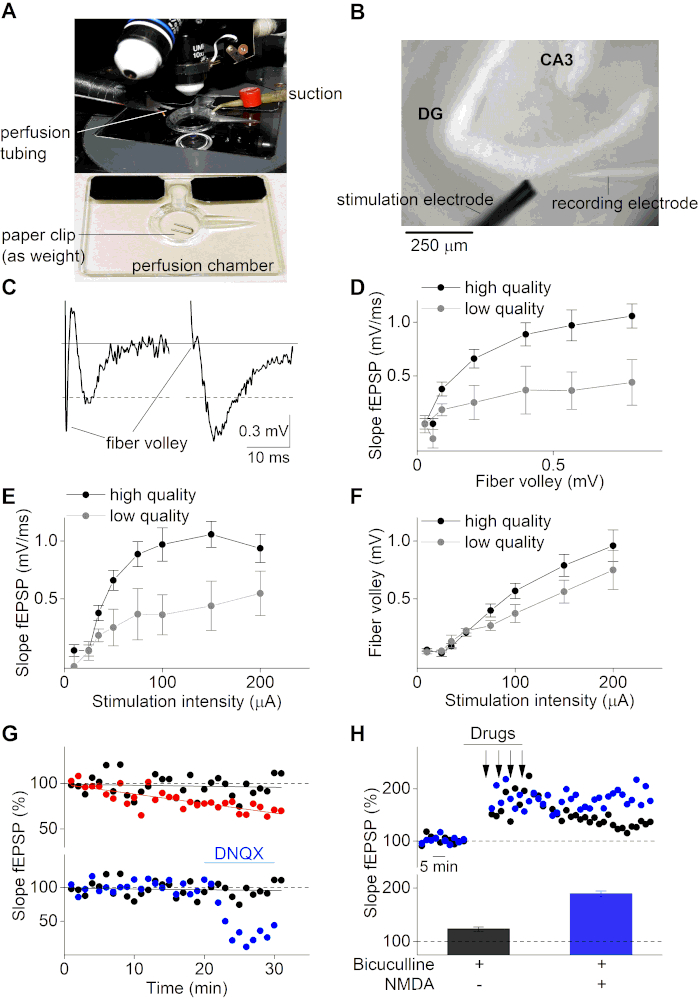
Figura 3: Gravações eletrofisiológicas de fatias cerebrais hipocampais. (A) Imagem de uma câmara de gravação com perfusão e sucção, usada sob um microscópio vertical. Uma fatia cerebral será colocada na câmara e imobilizada com um pedaço de um clipe de papel antes do início das gravações. (B) Imagem de campo brilhante de uma fatia cerebral hipocampal sob um microscópio vertical (objetivo de 10x). O giro dento (DG) e a região ca3 são indicados, bem como os eletrodos de estimulação (inferior esquerdo) e gravação (inferior direito), visando o caminho medial perforante durante as gravações de fEPSP. (C) Esquerda: representação de um exemplo de fatia de baixa qualidade de uma gravação fEPSP com uma voleibol de fibra robusta e uma pequena amplitude. Direito: exemplo de fatia de alta qualidade de uma gravação fEPSP. A linha cinza indica o nível da linha de base. As linhas pontilhadas apontam a amplitude de corte de 0,5 mV. (D) Parcela da inclinação fEPSP versus a amplitude FV para alta qualidade (preto; n=10) e fatias cerebrais de baixa qualidade (cinza; n=4). Os dados representados como ± médios SEM. (E) Gráfico de Entrada-Saída (inclinação fEPSP) para diferentes intensidades de estimulação (μA) para fatias de alta qualidade (preto; n = 10) e fatias de baixa qualidade (cinza; n = 4)). (F) Mesmo que em (E) mas para as amplitudes FV versus as intensidades de estímulo. (G) Curso de tempo de três diferentes gravações de fEPSP de linha de base (inclinação de fEPSP em %; normalizado para a inclinação média fEPSP dos primeiros 5 min). O painel superior representa um exemplo positivo (preto) e negativo (vermelho), onde este último tem uma linha de base instável devido à omissão de carbogen durante a gravação. O painel inferior mostra duas gravações estáveis da linha de base em tratamento (após 20 minutos de linha de base estável, os receptores AMPA foram bloqueados por aplicação do antagonista do receptor AMPA DNQX (10 μM)) (azul) e condição não tratada (preto). (H) Curso de tempo de gravações de LTP para diferentes condições de tratamento (indicado no painel inferior). Cor preta para aplicação de Bicucullina (20 μM) durante o condicionamento e azul para co-aplicação de Bicucullina (20 μM) e NMDA (10 μM) durante o condicionamento. Setas no painel superior indicam os pontos de tempo onde a estimulação de alta frequência foi aplicada (4 x 1s de 100Hz). Gráfico de barras no painel inferior representa as inclinações médias fEPSP (%) para 50-60 min após a indução de LTP dos experimentos mostrados no painel superior (gravação de representante único para cada condição). Clique aqui para ver uma versão maior desta figura.
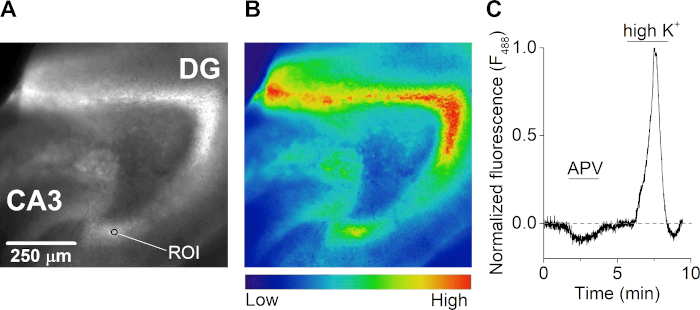
Figura 4: Microfluormetria de cálcio de fatias cerebrais hipocampais. (A e B) Imagem de fluorescência (excitada a 488 nm) (A) e mapa de calor correspondente(B) de uma fatia cerebral hipocampal horizontal do cérebro do camundongo. O giro dento (DG), região ca3, e um exemplo de região de interesse (ROI) são indicados no painel A. (C) Curso de tempo de respostas de cálcio (F488 nm) a partir de um ROI no giro dentado de uma fatia cerebral hipocampal aguda durante o tratamento com o antagonista do receptor NMDA APV (50 μM) e solução contendo alto potássio extracelular (K+) (50 mM). O traço é normalizado para a maior resposta de cálcio durante a alta perfusão K+ e é corrigido para fotobleaching. Clique aqui para ver uma versão maior desta figura.
Discussão
Embora comumente usado entre a comunidade neurociência, as preparações de fatias cerebrais também são confrontadas com várias desvantagens. Por exemplo, as conexões de entrada e saída para as áreas de interesse do cérebro não estão mais conectadas em uma fatia cerebral. Além disso, uma vez isolado, o tecido começa a se degradar lentamente ao longo do tempo e esse processo pode alterar as condições fisiológicas da fatia cerebral. Este tópico, em particular, é muito preocupante porque a maioria das gravações de fatias cerebrais estão levando vários minutos a horas, o que resulta em longos dias experimentais com gravações realizadas em tecido que foi isolado até 6-8 h antes do início do experimento. Além disso, o fluido cefalorraquidiano e a circulação sanguínea são interrompidos durante as preparações de fatias, o que pode levar à falta de compostos endógenos importantes dentro de uma fatia cerebral. E, obviamente, o procedimento de corte em si pode causar danos nos tecidos mecânicos que podem comprometer os resultados obtidos. No entanto, os benefícios reais das preparações de fatias cerebrais ainda estão superando suas desvantagens, e é por isso que eles apresentam uma técnica altamente valorizada e empregada em pesquisas de neurociência.
As fatias cerebrais hipocampais agudas apresentam uma técnica poderosa e, portanto, amplamente utilizada para investigar processos neuronais de um nível molecular até estudos complexos de circuito cerebral. Isso é baseado na neuronatomia ideal do hipocampo que pode ser facilmente preservada em uma preparação de fatia18. Consequentemente, as fatias cerebrais hipocampais são usadas em uma ampla variedade de projetos de pesquisa científica, incluindo triagens de medicamentos17, estudos de propriedades neuronais e sinápticas envolvidas nas funções cognitivas40,41, e investigações das condições cerebrais patológicas14,42,43. No entanto, um amplo espectro de diferentes aplicações também causa uma ampla gama de protocolos de preparação de fatias disponíveis que podem diferir em vários parâmetros, como condições de dissecção e orientação de plano de corte, entre outros. Portanto, a questão exata da pesquisa de um projeto científico deve ser determinada para escolher um protocolo adequado de preparação de fatias.
O helicóptero de tecido apresenta uma das técnicas mais antigas usadas para preparar as fatias cerebrais hipocampais44,45. As principais vantagens deste método de preparação incluem o baixo custo do helicóptero e o uso rápido e fácil46. No entanto, os helicópteros de tecido causam estresse mecânico que resulta em alterações morfológicas e morte celular47. Em comparação, o vibratome é uma máquina bastante cara e o tempo de preparação da fatia é significativamente aumentado, o que pode ter um impacto na qualidade da fatia. No entanto, o vibratome geralmente oferece uma maneira mais suave de separar as fatias do tecido e permite manter o cérebro bem resfriado e oxigenado durante todo o procedimento de isolamento, melhorando assim as propriedades da fatia46. Portanto, vários grupos estão utilizando normalmente essa técnica e apresentaram protocolos para a preparação de fatias cerebrais hipocampais agudas usando o vibratome16,30,48. Enquanto alguns protocolos fornecem apenas alguns detalhes para o fatiamento em si, mas sim se concentram em uma aplicação específica de tal preparação defatias 48, outros fornecem protocolos de fatias detalhados que diferem em cortar planos ou outros detalhes de protocolo (por exemplo, agarose incorporando ou fatiando/recuperação de soluções) dadas neste artigo27,30.
O protocolo descrito aqui apresenta um método simples a fim de preparar fatias cerebrais de camundongos hipocampais horizontais de alta qualidade de animais jovens. O protocolo é particularmente útil para preservar o caminho perfurante (medial e lateral) que apresenta a via de entrada hipocampal, que projeta desde o córtex entorhinal até o hipocampo8,49,50. As preparações isoladas de fatias transversais do hipocampo não preservam adequadamente o caminho perfurante, que se origina principalmente das camadas II e V do córtex entorhinal e projeta várias áreas dentro do hipocampo18. Devido ao posicionamento anatômico do córtex entorhinal em relação ao hipocampo, as fatias horizontais do cérebro são uma necessidade para manter fibras de caminho perfurantes totalmente intactas dentro da preparação da fatia31. Além disso, o corte horizontal preserva idealmente as fibras musgosas que projetam desde o giro dento até os neurônios CA3 dentro do hipocampo9,30,50. Portanto, este método de preparação é de alto valor para estudos que investiguem vias de entrada hipocampal e processos relacionados ao DG. Além disso, este protocolo permite a investigação da via colateral schaffer50. No entanto, as preparações de fatias cerebrais sagitas e coronais são mais comumente usadas ao investigar projeções de fibras CA3 para CA1, presumivelmente devido ao seu tempo de preparação ligeiramente mais rápido que pode aumentar a chance de obter fatias de alta qualidade. No entanto, as preparações horizontais de fatias hipocampais apresentam uma poderosa ferramenta de pesquisa, uma vez que permite a preservação e investigação de todas as vias de fibra hipocampal dentro de um hemisfério fatiado. Isso pode ser particularmente útil quando as respostas do circuito são estudadas, por exemplo, em gravações de ensaio de vários eletrodos.
Uma grande preocupação ao preparar fatias cerebrais é a preservação adequada do tecido cerebral. Isso é realizado por várias etapas críticas em nosso protocolo, incluindo uma dissecção rápida, a oxigenação contínua e suficiente e o resfriamento do tecido, e a proteção do tecido cerebral pelo uso do método de corte protetor com uma solução de corte de baixa sódio e alta sacarose39,51. Apesar do fato de que o protocolo descrito aqui produz uma taxa de sucesso em torno de 90%, medidas de proteção potencialmente adicionais podem ser necessárias ao trabalhar com tecidos derivados de animais mais velhos ou geneticamente diversos ou quando se tenta preservar uma população celular específica. Vários métodos já foram relatados para proteger preparações sensíveis de tecidos cerebrais. Esses métodos incluem o uso de soluções de corte baseadas em NMDG para reduzir a permeação de sódio52,o uso de altos níveis de magnésio na solução de corte, a fim de bloquear a atividade do receptor NMDA53,e o uso prolongado de soluções protetoras também durante o períodode recuperação 23. Todas essas medidas resultarão em uma redução da excitoxicidade. Além disso, uma perfusão trans-cardíaca com soluções ACSF protetoras geladas é frequentemente empregada e necessária ao trabalhar com animais mais velhos27.
As fatias cerebrais hipocampais agudas são idealmente adequadas e amplamente utilizadas para estudos eletrofisiológicos por razões como os sinais de alta amplitude que podem ser obtidos a partir de uma fatia cerebral aguda relativamente grossa (300-500 μm), o que garante um alto sinal à razão de ruído11. Aplicações eletrofisiológicas usadas de forma padronizada incluem gravações de campo extracelulares e gravações de células inteiras intracelulares em um modo de tensão ou fixação corrente. Para adquirir dados eletrofisiológicos de alta qualidade, a saúde da fatia é de preocupação primária e pode ser garantida seguindo rigorosamente o protocolo apresentado. No entanto, como os preparos de fatias apresentam uma técnica altamente sensível, uma verificação de qualidade deve ser rotineiramente incluída antes do início de cada experimento. Vários parâmetros podem ser usados como verificação de qualidade da fatia e são avaliados de forma padronizada através de curvas de saída de entrada e gravações de fEPSP ou EPSC de linha de base19. No entanto, deve-se notar que as propriedades eletrofisiológicas subótimas podem surgir de erros experimentais como posicionamento de eletrodos, orientação ou mesmo danos e não representam apenas a saúde da fatia preparada. Portanto, é aconselhável realizar controles adicionais de qualidade, como visualização simples e avaliação das células sob um objetivo de 40x ou uma coloração do núcleo DAPI. Essas verificações de qualidade podem ser usadas para confirmar a saúde constante da fatia em várias sessões de preparação de fatias.
A microfluorimetria de cálcio apresenta uma técnica menos usada para estudar as fatias cerebrais hipocampais. No entanto, essa técnica é de valor adicional às gravações padrão de eletrodos extracelulares e intracelulares, pois permite visualizar e quantificar fluxos de cálcio intracelulares, que são de alta importância na sinalização neuronal e sináptica. Alterações nas concentrações intracelulares de cálcio estão envolvidas na liberação de vesículas neurotransmissores, geração potencial postsintáptica, regulação da plasticidade sináptica e condução do nervo axonal54,55,56. Como ilustração desta técnica (Figura 4), fizemos uso de um corante de cálcio comercialmente disponível. Indiscutivelmente, o tratamento de fatias de tecido com corantes de cálcio pode produzir dificuldades como um aumento do tempo experimental, bem como o carregamento ineficiente de células neuronais mais baixas. No entanto, variações nesta técnica poderiam ser usadas para contornar esses desafios técnicos. Por exemplo, é possível combinar medidas de cálcio e gravações de grampos em fatias hipocampais. Dessa forma, um corante fluorescente de cálcio poderia ser carregado em uma célula específica através da pipeta de remendo, permitindo as medidas da dinâmica do cálcio em uma célula específica de interesse57. Alternativamente, animais geneticamente modificados expressando o indicador de cálcio, GCaMP58, seja em todo o cérebro, ou conduzidos por um promotor específico de células, poderiam ser usados. Curiosamente, o tecido cerebral de animais GCaMP com um linker direto a uma proteína de interesse poderia fornecer oportunidades para determinar o padrão de expressão neuronal ou investigar o envolvimento em faíscas e ondas de cálcio.
Ao todo, fornecemos as diretrizes para a preparação bem sucedida de fatias cerebrais hipocampais horizontais saudáveis e viáveis de camundongos para gravações eletrofisiológicas e de imagem. Essa metodologia é muito útil para acessar alterações neurológicas que ocorrem em patologias cerebrais descritas no giro dentado.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos à unidade de Eletrofisiologia do VIB-KU Leuven Center for Brain and Disease Research sob a supervisão do Dr. Keimpe Wierda e do Prof. Dr. Joris De Wit pelo uso de suas instalações de pesquisa. Além disso, agradecemos a todos os membros do Laboratório de Pesquisa do Canal de Íons e do Laboratório de Endométrio, Endometriose e Medicina Reprodutiva do KU Leuven por suas discussões e comentários úteis.
Este projeto recebeu financiamento da Research Foundation-Flanders (G.084515N e G.0B1819N para J.V.) e do Conselho de Pesquisa do KU Leuven (C1-funding C14/18/106 a J.V.). K.P. é uma FWO [PEGASUS]2 Marie Skłodowska-Curie Fellow e recebeu financiamento do programa de pesquisa e inovação Horizon 2020 da União Europeia sob o acordo de subvenção Marie Skłodowska-Curie (665501) com a Research Foundation Flanders (FWO) (12T0317N). K.H. é pós-doutorando da Fundação de Pesquisa Flandres, Bélgica (12U7918N).
Materiais
| Name | Company | Catalog Number | Comments |
| Anesthesia chamber | home made - Generic | N/A | plexiglas |
| Anesthesia vaporizer | Dräger & MSS International Ltd | Isoflurane Vapor 19.3 & MSS Isoflurane | to vaporize isoflurane for rodent anesthetization |
| Barrels for the perfusion system | TERUMO | Hypodermic syringes without needle | https://www.terumotmp.com/products/hypodermics/terumo-hypodermic-syringes-without-needle.html |
| Bicuculline methiodide | hellobio | HB0893 | https://www.hellobio.com/bicuculline-methiodide.html |
| Borosilcate glass capillaries | Science Products | GB150F-8P | https://science-products.com/en/shop/micropipette-fabrication-1/capillary-glass-for-micropipette-pullers/borosilicate-glass-capillaries/borosilicate-filament-polished |
| Calcium chlorid dihydrate | Merck | 102382 | https://www.merckmillipore.com/BE/en/product/Calcium-chloride-dihydrate,MDA_CHEM-102382?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Calcium Imaging software | Till Photonics | LiveAcquisition v2.3.0.18 | |
| Carbogen tank | Air Liquide | Alphagaz mix B50 | Gasmixture CO2/O2: 5/95, purity 5 |
| Cluster microelectrode | FHC | CE2C55 | https://www.fh-co.com/product/cluster-microelectrodes/ |
| Culture dish (35 mm) | Corning Life Sciences | 353001 | https://ecatalog.corning.com/life-sciences/b2c/US/en/Cell-Culture/Cell-Culture-Vessels/Dishes%2C-Culture/Falcon®-Cell-Culture-Dishes/p/353001 |
| Culture dish (90 mm) | Thermo Fisher Scientific | 101VR20 | https://www.thermofisher.com/order/catalog/product/101R20#/101R20 |
| Curved forceps | Fine Science tools | 11270-20 | https://www.finescience.de/de-DE/Products/Forceps-Hemostats/Dumont-Forceps/Dumont-7b-Forceps/11270-20 |
| D-AP5 | hellobio | HB0225 | https://www.hellobio.com/dap5.html |
| D-(+)-Glucose monohydrate | Sigma Aldrich | 16301 | https://www.sigmaaldrich.com/catalog/product/sial/16301?lang=en®ion=BE |
| Digital CMOS camera | HAMAMATSU | ORCA-spark C11440-36U | https://www.hamamatsu.com/eu/en/product/type/C11440-36U/index.html |
| Dissection scissors | Fine Science tools | 14058-09 | https://www.finescience.de/de-DE/Products/Scissors/Standard-Scissors/Fine-Scissors-ToughCut®/14058-09 |
| DNQX | hellobio | HB0262 | https://www.hellobio.com/dnqx-disodium-salt.html |
| EMCCD camera | Andor | iXon TM + DU-897E-CSO-#BV | https://andor.oxinst.com/products/ixon-emccd-cameras?gclid=CjwKCAjw97P5BRBQEiwAGflV6ULsKjXfhN2YZxtvsWAmF4QghyXZKuqYHVMa6KU9JyS80ATQkSKeBBoCIM0QAvD_BwE |
| EPC10 USB Double Patch Clamp Amplifier | HEKA Elektronik | 895278 | https://www.heka.com/sales/brochures_down/bro_epc10usb.pdf |
| Filter paper | VWR | 516-0818 | grade 413 |
| Fine brush | Raphael Kaerell | 8204 | Size #1 |
| 18G needle | Henke Sass Wolf Fine-Ject | 18G X 1 1/2" 4710012040 | https://www.henkesasswolf.de/cms/de/veterinaer_produkte/produkte_vet/einmalkanuelen/hsw_henke_ject_einmalkanuelen/ |
| Isoflurane | Dechra Veterinary Products | Iso-Vet 1000mg/g | 250 ml bottle |
| Loctite 406 | Henkel Adhesive technologies | Loctite 406 | Super glue |
| Magnesium sulfate heptahydrate | Merck | 105886 | https://www.merckmillipore.com/BE/en/product/Magnesium-sulfate-heptahydrate,MDA_CHEM-105886?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Micromanipulator | Luigs & Neumann | SM-10 with SM-7 remote control system | https://www.luigs-neumann.org |
| Microscope (for calcium imaging) | Olympus | BX51WI | https://www.olympus-lifescience.com/de/microscopes/upright/bx61wi/ |
| Microscope (for ephys recordings) | Zeiss | Axio Examiner.A1 | https://www.micro-shop.zeiss.com/de/de/system/axio+examiner-axio+examiner.a1-aufrechte+mikroskope/10185/ |
| Microscope light source | CAIRN Research | dual OptoLed power supply | https://www.cairn-research.co.uk/product/optoled/ |
| Monochromator | Till Photonics | Polychrome V | |
| N-Methyl-D-aspartic acid (NMDA) | Sigma Aldrich | M3262 | https://www.sigmaaldrich.com/catalog/product/sigma/m3262?lang=en®ion=BE |
| Oregon Green® 488 BAPTA-1 | Invitrogen Molecular Probes | #06807 | 10x50ug |
| Osmometer | Wescor | 5500 vapor pressure osmometer | to verify osmolarity of salt solutions |
| Peristaltic pump | Thermo Fisher Scientific | Masterflex C/L 77120-62 | https://www.fishersci.be/shop/products/masterflex-peristaltic-c-l-dual-channel-pump-2/p-8004229 |
| pH meter | WTW | inoLab series pH 720 | https://www.geminibv.nl/wp-content/uploads/manuals/wtw-720-ph-meter/wtw-inolab-ph-720-manual-eng.pdf |
| Pipette puller | Sutter Instrument | P-1000 | https://www.sutter.com/MICROPIPETTE/p-1000.html |
| Potassium chlorid | Chem-lab | CL00.1133 | https://www.chem-lab.be/#/en-gb/prod/1393528 |
| Potassium dihydrogen phosphate | Merck | 104873 | https://www.merckmillipore.com/BE/en/product/Potassium-dihydrogen-phosphate,MDA_CHEM-104873?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Razor blade to prepare hemispheres | SPI supplies | Safety Cartridge Dispenser - Pkg/10 | GEM Scientific Single Edge Razor Blades |
| Razor blade for vibratome | Ted Pella Inc | 121-6 | double edge breakable style razor blades (PTFE-coated stainless steel) |
| Recovery chamber | home made - Generic | N/A | to collect and store brain slices in (see details in manuscript) |
| Scissors | Any company | N/A | Blade should be well sharpened and at least 15 cm long for easy decapitation |
| Silver electrode wire | Any company | for recording and reference electrodes | |
| Sodium dihydrogen phosphate dihydrate | Merck | 106342 | https://www.merckmillipore.com/BE/en/product/Sodium-dihydrogen-phosphate-dihydrate,MDA_CHEM-106342?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Sodium hydrogen carbonate | Alfa Aesar | 14707 | https://www.alfa.com/en/catalog/014707/ |
| Sodium chlorid | Fisher Scientific | S/3160/60 | https://www.fishersci.co.uk/shop/products/sodium-chloride-certified-ar-analysis-meets-analytical-specification-ph-eur/10428420 |
| Software for field recordings | HEKA Elektronik | PatchMaster | https://www.heka.com/downloads/software/manual/m_patchmaster.pdf |
| Spatula | Sigma Aldrich | S9147-12EA | https://www.sigmaaldrich.com/catalog/product/sigma/s9147?lang=en®ion=BE |
| Stimulator | A.M.P.I | ISO-FLEX | http://www.ampi.co.il/isoflex.html |
| Sucrose | VWR International Ltd. | 102745C | https://es.vwr-cmd.com/ex/downloads/magazine/lupc_userguide_uk.pdf |
| Tubing for carbogen, perfusion and suction lines 1 | Warner Instruments | 64-0167 | Tygon tubing (TY-50) for standard valve systems |
| Tubing for carbogen, perfusion and suction lines 2 | Fisher Scientific | 800/100/200 & 800/100/280 | Smiths Medical Portex Fine Bore LDPE Tubing |
| Vacuum pump | home made - Generic | N/A | |
| 8 valve multi-barrel perfusion system | home made | N/A | consists of barrels, tubing and a self-made automated valve control (specifications of all purchased parts can be found in this Table) |
| Magnetic valves (to control the perfusion lines) | NResearch Inc. | p/n 161P011 | https://nresearch.com/ |
| Vibratome | Leica | 14912000001 | Semi-automatic vibrating blade microomei VT1200 |
| Water bath | Memmert | WNB 7 | https://www.memmert.be/wp-content/uploads/2019/09/Memmert-Waterbath-WNB-7.en_.pdf |
| Water purification system | Merck | Synergy millipore | to obtain highly purified water |
| 12-well plates | Greiner Bio-One | CELLSTAR, 665180 | http://www.greinerbioone.com/UserFiles/File/Catalogue%202010_11/UK/3680_005-Kapitel1_UK.pdf |
Referências
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neurology, Neurosurgery, and Psychiatry. 20 (1), 11-21 (1957).
- Cavarsan, C. F., Malheiros, J., Hamani, C., Najm, I., Covolan, L. Is mossy fiber sprouting a potential therapeutic target for epilepsy. Frontiers in Neurology. 9, 1023 (2018).
- Nadler, J. V. The recurrent mossy fiber pathway of the epileptic brain. Neurochemical Research. 28 (11), 1649-1658 (2003).
- Raimondo, J. V., et al. Methodological standards for in vitro models of epilepsy and epileptic seizures. A TASK1-WG4 report of the AES/ILAE translational task force of the ILAE. Epilepsia. 58, 40-52 (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. , 86-98 (2015).
- Tohno, Y., et al. Relationships among the hippocampus, dentate gyrus, mammillary body, fornix, and anterior commissure from a viewpoint of elements. Biological Trace Element Research. 140 (1), 35-52 (2011).
- Maclean, P. D. The limbic system and its hippocampal formation; studies in animals and their possible application to man. Journal of Neurosurgery. 11 (1), 29-44 (1954).
- Petersen, R. P., et al. Electrophysiological identification of medial and lateral perforant path inputs to the dentate gyrus. Neuroscience. 252, 154-168 (2013).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in Brain Research. 163, 3-22 (2007).
- Szirmai, I., Buzsaki, G., Kamondi, A. 120 years of hippocampal schaffer collaterals. Hippocampus. 22 (7), 1508-1516 (2012).
- Cho, S., Wood, A., Bowlby, M. R. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Current Neuropharmacology. 5 (1), 19-33 (2007).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. Journal of Visualized Experiments. (49), e2330 (2011).
- Papouin, T., Haydon, P. G. Obtaining Acute Brain Slices. Bio-protocol. 8 (2), 2699 (2018).
- Li, Q., Han, X., Wang, J. Organotypic hippocampal slices as models for stroke and traumatic brain injury. Molecular Neurobiology. 53 (6), 4226-4237 (2016).
- Lo, D. C., McAllister, A. K., Katz, L. C. Neuronal transfection in brain slices using particle-mediated gene transfer. Neuron. 13 (6), 1263-1268 (1994).
- Lein, P. J., Barnhart, C. D., Pessah, I. N. Acute hippocampal slice preparation and hippocampal slice cultures. Methods in Molecular Biology. 758, 115-134 (2011).
- Magalhaes, D. M., et al. Ex vivo model of epilepsy in organotypic slices-a new tool for drug screening. Journal of Neuroinflammation. 15 (1), 203 (2018).
- Bliss, T., Andersen, P., Morris, R., Amaral, D., O'Keefe, J. . The hippocampus book. , 37-114 (2007).
- Bortolotto, Z. A., Amici, M., Anderson, W. W., Isaac, J. T. R., Collingridge, G. L. Synaptic plasticity in the hippocampal slice preparation. Current Protocols in Neuroscience. 54 (1), 11-26 (2011).
- Al-Osta, I., et al. Imaging calcium in hippocampal presynaptic terminals with a ratiometric calcium sensor in a novel transgenic mouse. Frontiers in Cellular Neuroscience. 12, 209 (2018).
- McLeod, F., Marzo, A., Podpolny, M., Galli, S., Salinas, P. Evaluation of synapse density in hippocampal rodent brain slices. Journal of Visualized Experiments. (128), e56153 (2017).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. 1183, 221-242 (2014).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording synaptic plasticity in acute hippocampal slices maintained in a small-volume recycling-, perfusion-, and submersion-type chamber system. Journal of Visualized Experiments. (131), e55936 (2018).
- Zhou, Q., Abe, H., Nowak, T. S. Immunocytochemical and in situ hybridization approaches to the optimization of brain slice preparations. Journal of Neuroscience Methods. 59 (1), 85-92 (1995).
- Koike-Tani, M., Tominaga, T., Oldenbourg, R., Tani, T. Birefringence changes of dendrites in mouse hippocampal slices revealed with polarizing microscopy. Biophysical Journal. 110 (10), 2366-2384 (2020).
- Ting, J. T., et al. Preparation of acute brain slices using an optimized N-Methyl-D-glucamine protective recovery method. Journal of Visualized Experiments. (132), e53825 (2018).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8 (9), 745-752 (2011).
- Hua, Y., Keep, R. F., Hoff, J. T., Xi, G. Brain injury after intracerebral hemorrhage: the role of thrombin and iron. Stroke. 38, 759-762 (2007).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Paxinos, G., Franklin, K. . The Mouse Brain In Stereotaxic Coordinates. 3 edn. , 256 (2008).
- Lacar, B., Young, S. Z., Platel, J. C., Bordey, A. Preparation of acute subventricular zone slices for calcium imaging. Journal of Visualized Experiments. (67), e4071 (2012).
- Schauer, C., Leinders-Zufall, T. Imaging calcium responses in GFP-tagged neurons of hypothalamic mouse brain slices. Journal of Visualized Experiments. (66), e4213 (2012).
- Tetteh, H., Lee, J., Lee, J., Kim, J. G., Yang, S. Investigating Long-term Synaptic Plasticity in Interlamellar Hippocampus CA1 by Electrophysiological Field Recording. Journal of Visualized Experiments. (150), e59879 (2019).
- Smith, C. J., et al. Investigations on alterations of hippocampal circuit function following mild traumatic brain injury. Journal of Visualized Experiments. (69), e4411 (2012).
- McNaughton, B. L. Evidence for two physiologically distinct perforant pathways to the fascia dentata. Brain Research. 199 (1), 1-19 (1980).
- Colino, A., Malenka, R. C. Mechanisms underlying induction of long-term potentiation in rat medial and lateral perforant paths in vitro. Journal of Neurophysiology. 69 (4), 1150-1159 (1993).
- Coulter, D. A., Carlson, G. C. Functional regulation of the dentate gyrus by GABA-mediated inhibition. Progress in Brain Research. 163, 235-243 (2007).
- Kuenzi, F. M., Fitzjohn, S. M., Morton, R. A., Collingridge, G. L., Seabrook, G. R. Reduced long-term potentiation in hippocampal slices prepared using sucrose-based artificial cerebrospinal fluid. Journal of Neuroscience Methods. 100 (1-2), 117-122 (2000).
- Connor, S. A., et al. Loss of synapse repressor MDGA1 enhances perisomatic inhibition, confers resistance to network excitation, and impairs cognitive function. Cell Reports. 21 (13), 3637-3645 (2017).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Moodley, K. K., Chan, D. The hippocampus in neurodegenerative disease. Frontiers of Neurology and Neuroscience. 34, 95-108 (2014).
- Kong, H., et al. Inhibition of miR-181a-5p reduces astrocyte and microglia activation and oxidative stress by activating SIRT1 in immature rats with epilepsy. Laboratory Investigation; A Journal of Technical Methods and Pathology. , (2020).
- Skrede, K. K., Westgaard, R. H. The transverse hippocampal slice: a well-defined cortical structure maintained in vitro. Brain Research. 35 (2), 589-593 (1971).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Wang, T., Kass, I. S. Preparation of brain slices. Methods in Molecular Biology. 72, 1-14 (1997).
- Garthwaite, J., Woodhams, P. L., Collins, M. J., Balazs, R. On the preparation of brain slices: morphology and cyclic nucleotides. Brain Research. 173 (2), 373-377 (1979).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments: JoVE. (91), e51706 (2014).
- Aydin-Abidin, S., Abidin, &. #. 3. 0. 4. ;. 7,8-Dihydroxyflavone potentiates ongoing epileptiform activity in mice brain slices. Neuroscience Letters. 703, 25-31 (2019).
- Xiong, G., Metheny, H., Johnson, B. N., Cohen, A. S. A comparison of different slicing planes in preservation of major hippocampal pathway fibers in the mouse. Frontiers in Neuroanatomy. 11, 107 (2017).
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Reid, K. H., Edmonds, H. L., Schurr, A., Tseng, M. T., West, C. A. Pitfalls in the use of brain slices. Progress in Neurobiology. 31 (1), 1-18 (1988).
- Brini, M., Calì, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences: CMLS. 71 (15), 2787-2814 (2014).
- Gleichmann, M., Mattson, M. P. Neuronal calcium homeostasis and dysregulation. Antioxidants & Redox Signaling. 14 (7), 1261-1273 (2011).
- Padamsey, Z., Foster, W. J., Emptage, N. J. Intracellular Ca(2+) release and synaptic plasticity: a tale of many stores. The Neuroscientist: A Review Journal Bringing Neurobiology, Neurology and Psychiatry. 25 (3), 208-226 (2019).
- Chen-Engerer, H. J., et al. Two types of functionally distinct Ca2+ stores in hippocampal neurons. Nature Communications. 10 (1), 3223 (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 32 (40), 13819-13840 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados