Method Article
התגבשות וקביעת מבנה של אנזים:קומפלקס מצע על ידי התגבשות סדרתית בשבב מיקרופלואידי רב-תכליתי
In This Article
Summary
מתואר מכשיר מיקרופלואידי רב-תכליתי המאפשר התגבשות של אנזים בשיטת דיפוזיה נגדית, הכנסת מצע בגבישים על ידי השרייה, וקביעת המבנה בתלת-ממד של האנזים: קומפלקס מצע על ידי ניתוח סדרתי של גבישים בתוך השבב בטמפרטורת החדר.
Abstract
הכנת גבישים מפזרים היטב והטיפול בהם לפני ניתוח הרנטגן שלהם הם שני שלבים קריטיים של מחקרים ביו-קריסטלוגרפיים. אנו מתארים שבב מיקרופלואידי רב-תכליתי המאפשר ייצור גבישים בשיטה היעילה של דיפוזיה נגדית. הסביבה נטולת הסעה המסופקת על ידי הערוצים המיקרופלואידיים אידיאלית לצמיחת גבישים ושימושית לפיזור מצע לאתר הפעיל של האנזים הגבישי. כאן יישמנו גישה זו על האנזים מוסיף CCA של החיידק הפסיכיאטרי Planococcus halocryophilus בדוגמה המוצגת. לאחר התגבשות ופיזור/השרייה של המצע, מבנה הגביש של האנזים:קומפלקס המצע נקבע בטמפרטורת החדר על ידי קריסטלוגרפיה סדרתית וניתוח גבישים מרובים ישירות בתוך השבב. ההליך כולו משמר את תכונות עקיפה מקוריות של הדגימות כי זה לא דורש טיפול בגביש.
Introduction
קריסטלוגרפיה היא שיטה לפענח את הארכיטקטורה תלת-ממדית של מקרומולקולות ביולוגיות. האחרון חשוב להבין כיצד אנזים בוחר ומעבד את המצעים שלו. קביעת מבנה גביש דורשת התגבשות של מקרומולקולה היעד ואת מיזוג הגבישים לניתוח שלהם על ידי עקיפת רנטגן1. הן הכנת גביש והן טיפול הם צעדים חיוניים אך עדינים שיכולים להשפיע על איכות הגביש ועל תכונות עקיפה, ובכך, את הרזולוציה (כלומר, את הדיוק) של המבנה 3D וכתוצאה מכך. כדי להקל על הכנת גבישים באיכות גבוהה ולמנוע טיפול מיותר כדי לשמר את תכונות עקיפתם, עיצבנו מכשיר מיקרופלואידי ידידותי למשתמש ורב-תכליתי בשם ChipX2,3,4.
במאמר זה, נדגים כיצד לטעון את פתרון החלבון לערוצי ChipX באמצעות חומר מעבדה קונבנציונלי להכנת גבישים על ידי דיפוזיה נגדית. שיטת התגבשות זו מספקת סינון יעיל של רוויית-על ותנאי גרעין פוטנציאליים לאורך הערוצים המיקרופלואידיים המכילים את פתרון האנזים בשל שיפוע הריכוז שנוצר על ידי דיפוזיה של הסוכן המתגבש5,6.
הגדרת השבב היא פשוטה, היא משתמשת רק בצינורות מעבדה סטנדרטיים ואינה דורשת ציוד יקר. כאשר גבישים גדלו ב ChipX, ליגנדים של האנזים יכול להיות הציג על ידי דיפוזיה. לאחר מכן נתוני עקיפה נאספים בטמפרטורת החדר על סדרה של גבישים הכלולים בערוצי השבב באמצעות מקור רנטגן synchrotron. המחקר המבני המתואר כאן הוביל לקביעת מבנים של אנזים התבגרות tRNA בצורתו apo ובמורכבות עם אנלוגי של מצע CTP שלה הציג על ידי השרייה. חלבון זה הנקרא אנזים מוסיף CCA polymerizes זנב CCA trinucleotide בקצה 3 ' של tRNAs. ההשוואה בין שתי התמונות בתלת-ממד המתקבלות על-ידי קריסטלוגרפיה סדרתית חושפת את השינויים הקונפורמיים המקומיים הקשורים לכריכת הליגנד בתנאים פיזיולוגיים יותר מאלה המשמשים בקריו-קריסטלוגרפיה. הפרוטוקול המתואר בסרטון זה חל בדרך כלל על כל ביומולקולה, בין אם זה חלבון, חומצת גרעין או קומפלקס רב רכיבים.
Protocol
1. הגדרת מבחני התגבשות בצ'יפX
הערה: ניתן להשיג את המכשיר המיקרופלואידי של ChipX מהמחברים. תיאור השבב ניתן באיור 1. פתרונות המכילים את התגבשות (או חומר מתגבש) המשמשים להפעלת התגבשות עשויים להיות ממוצא מסחרי או שהוכנו על ידי הנסיין.
- טעינת דגימת הביומולקולה
הערה: נפח הדגימה הנדרש למעשה כדי לבצע בדיקה נגדית אינדיבידואלית של דיפוזיה בחלק הישר של כל ערוץ של ChipX הוא 300 nL. עם זאת לנוחות אנו מציעים לטעון 5 μL כדי למלא לחלוטין את שמונת הערוצים תוך התחשבות באורך המשתנה של החלק המעוקל שלהם ונפחים מתים כניסה.- פיפט 5 μL של פתרונות אנזימים באמצעות צינור סטנדרטי 10 μL וטיפ.
- הציגו את הקצה אנכית במפרצון המדגם והזריקו את הפתרון עד ששמונה הערוצים יתמלאו עד לקצה הנגדי שלהם (כניסה של המאגר הגבישי).
- להזריק 1 μL של שמן פרפין במפרצון המדגם על מנת לנתק את הערוצים אחד מהשני.
- לשחזר את הפתרון הנוסף במאגר גבישי בקצה של כל ערוץ באמצעות צינור μL 10 סטנדרטי.
- לאטום את כניסת המדגם עם 1 ס"מ x 1 ס"מ חתיכת קלטת.
- טעינת פתרונות ההתגבשות
- צינור 5 μL של פתרון התגבשות באמצעות צינור סטנדרטי 10 μL וטיפ. נפח המאגר הוא 10 μL, אבל טעינת רק חצי ממנו מונע גלישה בעת איטום עם קלטת ומאפשר תוספת נוספת של ליגנד לניסויי השרייה. אם תנאי התגבשות ראשוניים התקבלו על ידי דיפוזיה אדים, להגדיל את הריכוז התגבשות על ידי גורם של 1.5 - 2. פתרונות יכולים להיות שונים בכל מאגר (במקרה המוצג, 1 M דיאמוניום מימן פוספט, 100 מ"מ נתרן אצטט, pH 4.5 שימש לאורך).
- לכוון את קצה הצינור לכיוון הכניסה של הערוץ בחלק בצורת משפך של המאגר, כדי למנוע היווצרות של בועת אוויר על תצהיר פתרון. זה ימנע את המגע בין שני הפתרונות וההתפזרות הקריסטלית לתוך הערוץ.
- הזריקו את התמיסה הגבישית לתוך המאגר.
- לאטום את המאגרים עם 2.5 ס"מ x 1 ס"מ חתיכת סרט.
- דגירה השבב ב 20 °C (הטמפרטורה יכולה להיות מותאמת בהתאם ליעד, בדרך כלל בין 4 ל 37 °C (69 °F) 4).
2. תיוג חלבונים עם קרבוקסירהודמין לגילוי פלואורסצנטיות
הערה: שלב זה הוא אופציונלי. זה חייב להתבצע לפני טעינת מדגם כדי להקל על זיהוי של גבישים בשבב באמצעות פלואורסצנטיות. השיטה המפורטת של תיוג פלואורסצנטי קורט תוארה על ידי ועמיתים לעבודה7. כל השלבים מתבצעים בטמפרטורת החדר.
- להמיס 5 מ"ג של אבקת אסתר קרבוקסירהודמין ב 1 מ"ל דימתיל-formamide נטול מ"ל, לפצל את הפתרון 0.6 μL aliquots להיות מאוחסן ב -20 °C (60 °F).
- הכן פתרון 1 M Na-borate pH 8.75 המניה.
- לדלל את המניה כדי להכין את מאגר התגובה ב 0.05 M Na-borate pH 8.75.
- יש לשטוף עמודת התפלה (7 kDa MWCO, 0.5 מ"ל) עם מאגר תגובה של 800 μL.
- צנטריפוגה העמודה במשך דקה אחת ב 1400 x g, להסיר את הסינון.
- חזור על פעולה זו פעמיים (שלבים 2.4-2.5) כדי לשטוף את העמודה.
- הפקדת 80 μL של חלבון במאגר האחסון שלו בעמודה (ניתן לדלל את החלבון עד 1 מ"ג / מ"ל כדי להגדיל את הנפח במידת הצורך).
- צנטריפוגה העמודה במשך דקה אחת ב 1400 x g. שלב זה נועד להעביר את החלבון ממאגר האחסון שלו למאגר התגובה.
- לשחזר את הזרימה דרך (המכיל את החלבון במאגר התגובה) ומערבבים אותו עם 0.6 μL של פתרון קרבוקסירהודמין.
- דגירה 5 דקות בטמפרטורת החדר.
- בינתיים, שטוף את העמודה 3 x עם מאגר האחסון, צנטריפוגה העמודה במשך דקה אחת ב 1400 x g ולהשליך את הסינון.
- הפקד את פתרון התגובה בעמודה.
- צנטריפוגה העמודה במשך 1 דקות ב 1400 x g ולשחזר את הזרימה דרך (כלומר, פתרון של חלבון שכותרתו במאגר האחסון שלה).
- להשלים את פתרון החלבון במלאי עם 0.1-1 % (w/w) של חלבון שכותרתו.
- הגדר את מבחני התגבשות ChipX כמתואר בסעיף 1.
- בדוק את נוכחותם של גבישי חלבון בבדיקות על ידי מרגש את החללית פלואורסצנטית עם מקור אור באורך גל 520 ננומטר.
3. התבוננות בקריסטל
הערה: ניתן לטפל במכשיר ChipX ללא טיפול מיוחד, אפילו עם גבישים בפנים, למעט אם יש צורך לשלוט בטמפרטורה.
- השתמש בכל סטריאומיקרוסקופ כדי לבדוק את התוצאה של מבחני התגבשות בצ'יפX. טביעת הרגל שלו כוללת את הממדים הסטנדרטיים של שקופיות מיקרוסקופ ותואמת לכל מערכת ומחזיק שקופיות.
- בדוק את התוכן של ערוצים מיקרופלואידיים החל מהמאגר שבו הריכוז הגבישי הוא הגבוה ביותר למפרצון המדגם שבו הריכוז הגבישי הוא הנמוך ביותר. חומר ChipX שקוף לאור נראה, תואם לשימוש בקיטובים, כמו גם עם תאורת UV לזיהוי גביש חלבון על ידי פלואורסצנטיות טריפטופןמהותית 8.
- רשום מיקומי גביש באמצעות התוויות המובלטות לאורך הערוצים או סמן מיקומי קריסטל עם סמן קבוע על-ידי ציור נקודות צבע לידם על משטח השבב.
4. השריית קריסטל עם ליגנדים
הערה: הליך זה הוא אופציונלי. הוא משמש כדי להציג ליגנדים, מצעים אנזים או אטומים כבדים לתוך הגבישים צריך להתבצע לפחות 24-48 שעות לפני ניתוח רנטגן כדי לאפשר דיפוזיה מורכבת לאורך הערוצים לתוך הגבישים.
- הסר בעדינות את סרט האיטום מהמאגרים.
- הוסף עד 5 μL של פתרון ליגנד במאגר אחד או יותר באמצעות מיקרופיפט μL 10 (בדוגמה, 3 μL של 10 mM cytidine-5'-[(α,β)-מתילנו] פתרון טריפוספט (CMPcPP) נוסף כדי להשיג ריכוז סופי של 3.75 מ '). CMPcPP הוא אנלוגי שאינו הידרוליזה של CTP, מצע טבעי של האנזים.
- לאטום את המאגרים עם 2.5 ס"מ x 1 ס"מ חתיכת סרט.
- דגירה השבב בטמפרטורה מבוקרת עבור 24-48 שעות כדי לאפשר דיפוזיה ליגנד לאורך ערוצי השבב.
5. ניתוח קריסטל על ידי קריסטלוגרפיה סדרתית
הערה: חלק זה של הפרוטוקול צריך להיות מותאם בהתאם להתקנת קו הקרן ואת תכונות עקיפה של הגבישים. רק אינדיקציות כלליות ניתנות לניתוח הקריסטלוגרפי המבוסס על ניסויים שבוצעו ב- X06DA beamline (SLS, ויליגן, שוויץ).
- הרכבה של ChipX על הגוניומטר של קו הקרן
הערה: הקובץ להדפסה בתלת-ממד של מחזיק ChipX מסופק ב- ref4.- כבה את סילון ההקפאה של קו הקורה. הניתוח כאן מתבצע בטמפרטורת החדר.
- הר ChipX על מחזיק ייעודי עם הערוץ המכיל את הגבישים להיות מנותח ממוקם במרכז המחזיק. מחזיק הצ'יפ-אקס4 אינו דורש בורג או חלק נוסף, שכן הוא תוכנן לספק התאמה מושלמת לצ'יפ-אקס.
- חבר את המחזיק לגוניומטר.
- איסוף נתונים
- כוון את השכבה העבה ביותר (שכבה עליונה, איור 1)של ChipX (בתוויות אוריינטציה זו לאורך הערוצים ניתן לקרוא ישירות באמצעות המצלמה המרכזית של קו הקרן), לכיוון הקרן הישירה והפנים הדקות ביותר מאחורי הגביש כדי למזער את הנחתת האות המפורק כמתואר ב- ref3.
- כדי למנוע התנגשות של ChipX עם החומר שמסביב (beamstop, collimator), להגביל תנועות goniometer בטווח ±30 ° (0 ° המתאים הערוצים להיות בניצב לקרן רנטגן).
- מצא מיקום גבישים בעזרת התוויות המובלטות לאורך הערוצים.
- בחר מיקום גביש.
- מרכז את הגביש או על ידי רשת רגילה במינון נמוך / הקרנת רסטר או הליך לחיצה אחת (הווידאו מראה דוגמה של הקרנת רשת).
- לאסוף נתוני עקיפה בתוך הטווח -30° / +30°.
- הפעל מחדש את ההליך בשלבים 5.2.4-5.2.6 על גביש אחר באותו ערוץ לאחר תרגום השבב.
- באופן ידני ליישר מחדש ערוץ ChipX אחר במרכז המחזיק ולהמשיך איסוף נתונים על גבישים נוכחים בערוץ זה.
- השתמש בחבילות והליכים קריסטלוגרפיים סטנדרטיים כדי לעבד ולמזג את הנתונים, ולאחר מכן כדי לפתור ולמקד את המבנה.
תוצאות
השבב המיקרופלואידי המתואר כאן נועד לאפשר התקנה קלה של מבחני התגבשות וניתוח קריסטל בטמפרטורת החדר. ההליך המתואר לעיל בסרטון יושם במסגרת האפיון המבני של האנזים מוסיף CCA מן החיידק המותאם קר Planococcus halocryophilus. אנזים זה שייך למשפחת פולימראז חיונית המזרזת את התוספת הרציפה של רצף CCA 3 ' על tRNAs באמצעות CTP ו- ATP9,10.
השבב שימש לראשונה להכנת גבישים של האנזים לניתוח מבני בשיטת דיפוזיה נגדית. לשם כך, פתרון האנזים נטען בשמונת הערוצים המיקרופלואידיים (תאי התגבשות) על ידי זריקה אחת במפרצון המדגם של השבב (ראו איור 1). האנזים שימש ב 5.5 מ"ג / מ"ל במאגר האחסון שלה המכיל 20 מ"מ Tris / HCl pH 7.5, 200 mM NaCl ו 5 מ"מ MgCl2. שלב זה בוצע באופן ידני עם מיקרופיפט μL סטנדרטי 10. פתרונות התגבשות (100 מ"מ נתרן אצטט pH 4.5,1 M דיאמוניום מימן פוספט) הופקדו אז במאגרים בקצה השני של הערוצים.
הליך הטעינה פשוט ואינו משך יותר מחמש דקות (איור 2). לאחר מכן הקריסטל מתפזר לתוך הערוצים, יוצר שיפוע של ריכוז המפעיל התגרענות גביש וצמיחה. שיפוע זה מתפתח באופן דינמי ובוחן רצף של מצבירוויה-על 5,6 עד להגעה לשיווי משקל של ריכוז גבישי בין הערוצים למאגר. מבחני התגבשות נבדקים בדרך כלל תחת micoscope על פני תקופה של 2 - 4 שבועות כדי לעקוב אחר הצמיחה של גבישים. גבישי Bipyramidal של אנזים CCA הוספת הופיעו בכל הערוצים לאחר כמה ימים של דגירה ב 20 °C(איור 3). התיוג הפלואורסצנטי האופציונלי7 של החלבון מקל מאוד על זיהוי גבישי החלבון ואפלייתם מגבישי מלח(איור 4).
ניצלנו את הסביבה המפוזרת בערוצי שבבים כדי לספק מצע לאנזים שבונה את הגבישים. במקרה הנוכחי, CMPcPP, אנלוגי CTP, נוסף לפתרונות המאגר בריכוז סופי של 3.75 מ"מ (איור 5). תוספת זו בוצעה יומיים לפני הניתוח הקריסטלוגרפי כדי לאפשר ל- CMPcPP להגיע ולכבוש את האתר הקטליטי של האנזים, כפי שאושר מאוחר יותר על ידי מבנה הגביש (ראה להלן).
ייצרנו מחזיק שבבים (איור 6) בחומצה פולילקטית באמצעות מדפסת תלת מימד. המחזיק מאפשר הרכבה שבב על goniometers באמצעות ראשים מגנטיים סטנדרטיים. לפיכך השבב יכול להיות ממוקם בקלות מתורגם קרן רנטגן להביא את הגבישים במצב עקיפה. אסטרטגיית איסוף הנתונים צריכה להיות מותאמת בהתאם למאפייני קרן ועל תכונות גביש. במקרה של האנזים מוסיף CCA, הנתונים נאספו ב- X06DA ו- X10SA, מקור אור שוויצרי (SLS), עם אורך גל רנטגן של 1.0 Å ו Pilatus 2M-F ו 6M גלאי פיקסלים, בהתאמה. 30-60° סיבוב נאספו על כל גביש בטמפרטורת החדר עם תמונות של 0.1° או 0.2° ו 0.1 s חשיפה (ראה טבלה 1). ערכות נתונים חלקיות עובדו בנפרד ונחתכו כאשר הרזולוציה של דפוסי עקיפה החלה להירקב עקב נזקי קרינה (זוהו על ידי ירידה ביחס אות לרעש 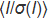 ו- CC1/2, ועלייה של Rmeas במעטפת ברזולוציה גבוהה). ערכות נתונים מלאות שוחזרו על ידי מיזוג נתונים מ- 5 גבישים (טבלה 1). מבני קריסטל נגזרו על ידי החלפה מולקולרית באמצעות חבילות קריסטלוגרפיות סטנדרטיות ונהלים לעיבוד נתונים11 ועידון12. השוואת המבנים של האנזים ושל המתחם שלו עם CMPcPP חושפת את ההתאמה הקונפורמית המקומית המלווה את כריכת המצע באתר הפעיל של האנזים המוסיף CCA (איור 7).
ו- CC1/2, ועלייה של Rmeas במעטפת ברזולוציה גבוהה). ערכות נתונים מלאות שוחזרו על ידי מיזוג נתונים מ- 5 גבישים (טבלה 1). מבני קריסטל נגזרו על ידי החלפה מולקולרית באמצעות חבילות קריסטלוגרפיות סטנדרטיות ונהלים לעיבוד נתונים11 ועידון12. השוואת המבנים של האנזים ושל המתחם שלו עם CMPcPP חושפת את ההתאמה הקונפורמית המקומית המלווה את כריכת המצע באתר הפעיל של האנזים המוסיף CCA (איור 7).
איור 1: עיצוב צ'יפקס. השבב מורכב משכבה עליונה העשויה מ- COC (עובי: 1 מ"מ) שבה מוטבעים שמונה ערוצים ומאגרים מיקרופלואידיים. השבב כולו אטום בשכבה של COC (עובי: 0.1 מ"מ). כל הערוצים מחוברים למפרצון יחיד בצד שמאל להזרקת מדגם בו זמנית ולמאגרים בודדים בצד ימין שבהם מופקדים פתרונות התגבשות. הערוצים, המהווים את תאי התגבשות בפועל של השבב, הם 4 ס"מ אורך ויש להם חתך רוחב של 80 מיקרומטר x 80 מיקרומטר. תוויות (A1, A2, A3, וכו ') מובלט לאורך הערוצים להקל על מיקום גביש מתחת למיקרוסקופ והכנת רשימת מדגם לאיסוף נתונים. לצ'יפ-אקס יש גודל של שקופית מיקרוסקופ סטנדרטית (7.5 ס"מ x 2.5 ס"מ). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
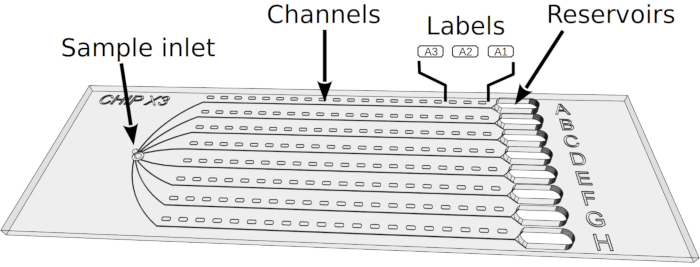
איור 2: הגדרת מבחני התגבשות בצ'יפX. 1) הפקדה של 5.6 מיקרו-ל' של פתרונות אנזימים באמצעות פילט וקצה סטנדרטיים של 10 μL. 2) הציגו את הקצה אנכית במפרצון המדגם והזריקו את הפתרון בשמונת הערוצים. 3) פיפט 1 μL של שמן פרפין. 4) הציגו את הקצה אנכית במפרצון המדגם והזריקו את השמן כדי לנתק את הערוצים זה מזה. 5) לאטום את המפרצון עם פיסת קלטת. 6) פיפט 5 μL של פתרון התגבשות באמצעות צינור סטנדרטי 10 μL וטיפ. הפתרונות יכולים להיות שונים בכל מאגר (למשל, מערכת סינון). 7) לכוון את קצה הצנרת לכיוון הכניסה של הערוץ בחלק בצורת משפך של המאגר (כדי למנוע היווצרות של בועת אוויר על תצהיר פתרון) ולהזריק את הפתרון הקריסטלי במאגר. 8) לאטום את המאגרים עם פיסת סרט ולדגור את השבב בטמפרטורה מבוקרת. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: גבישים של אנזים מוסיף CCA הגדלים על ידי דיפוזיה נגדית בערוצים המיקרופלואידיים של ChipX. סרגל קנה המידה הוא 0.1 מ"מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
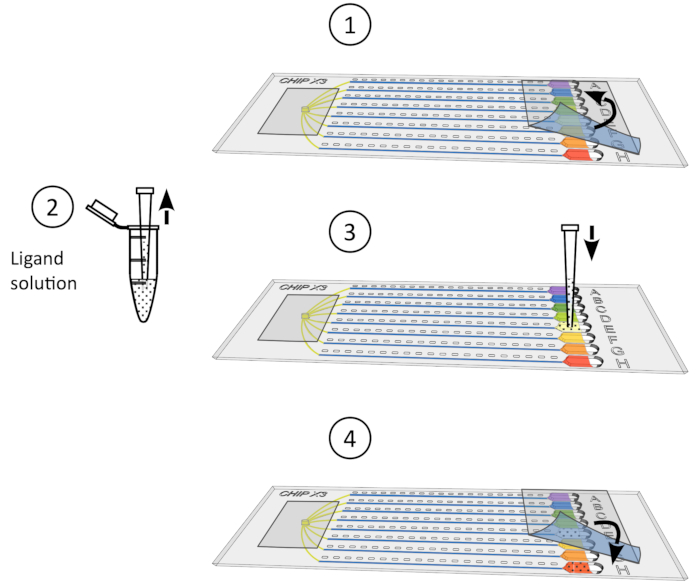
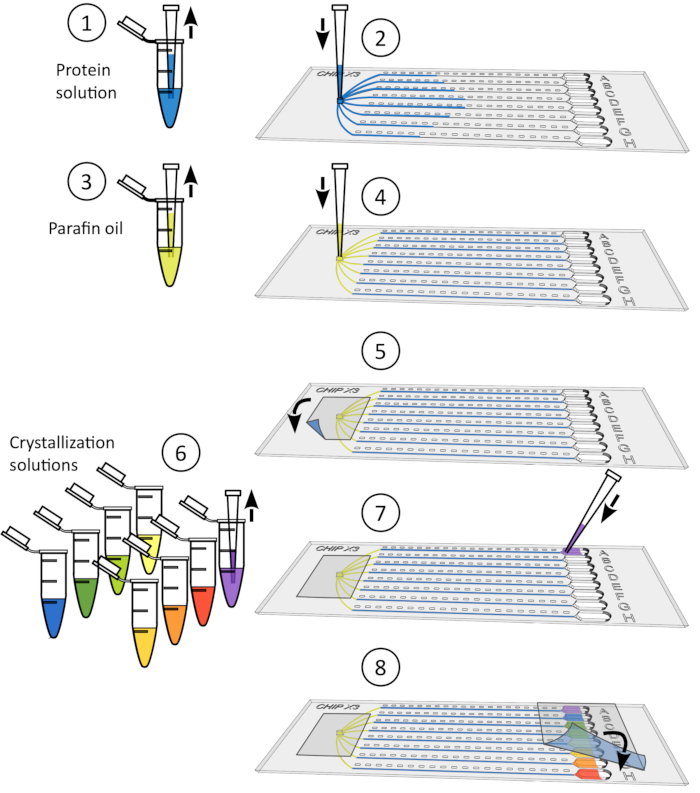
איור 4: הליך השריית קריסטל. 1) הסר בעדינות את הקלטת מהמאגרים. 2) הפקדה של עד 5 μL של פתרון ליגנד באמצעות מיקרופיפט μL 10. 3) מוסיפים את הליגנד למאגר אחד או יותר. 4) לאטום שוב את המאגרים עם פיסת קלטת להדגיר את השבב בטמפרטורה מבוקרת במשך 24-48 שעות לפני איסוף הנתונים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: תיוג פלואורסצנטי של עקבות מפלה חלבון (משמאל) מגבישים מלח (מימין). פתרון האנזים המוסיף CCA הכיל 0.4 % (w/w) של חלבון המסומן עם קרבוקסירואמין. בצד ימין, גבישים מוארים עם מקור אור באורך גל 520 ננומטר והתמונה נלקחת עם מסנן מעבר נמוך ב 550 ננומטר (LP550); (inset) מבנה של קרבוקסירהודמין-סוקינימידיל אסתר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 6: (משמאל) ציור של מחזיק ChipX ו -ChipX (מימין) רכוב על הגוניומטר של Beamline X06DA ב SLS (ויליגן, שוויץ) לניתוח קריסטל סדרתי.
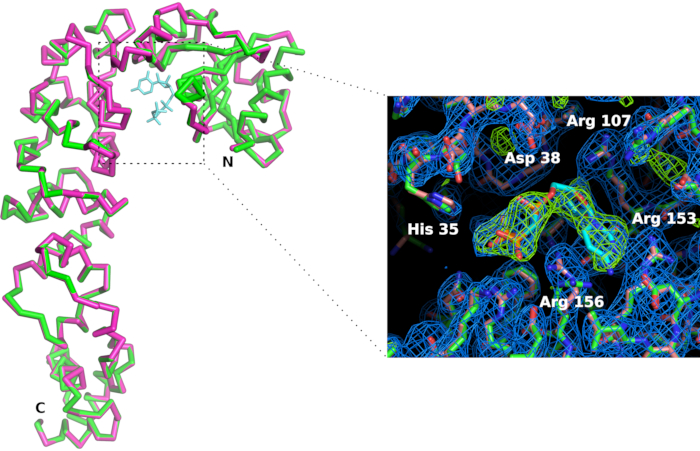
איור 7: השוואה בין אתר פעיל של אנזים מוסיף CCA בצורת אפו (בוורוד) ובמתחם עם אנלוגי CTP (בירוק). למרות ההתאמה הכוללת של האנזים אינו מושפע, הכריכה של ליגנד CMPcPP מלווה ארגון מחדש קל של שרשראות צד באתר הפעיל. מפת צפיפות האלקטרונים של2 Fo-Fc (בכחול) מתארת ב- 1.2 סיגמא. מפת צפיפות האלקטרונים ההבדל מתאר ב 4 סיגמא (בירוק) מאשר את נוכחותו של ligand באתר הפעיל. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| מדגם מגובש | אנזים מוסיף CCA | אנזים מוסיף CCA + CMPcPP |
| ניתוח קריסטל | ||
| קו קרן רנטגן | SLS – X06DA | SLS – X10SA |
| אורך גל (Å) | 1.000 | 1.000 |
| טמפרטורה (K) | 293 | 293 |
| גלאי | פילאטוס 2M-F | פילטוס 6M |
| מרחק גלאי קריסטל (מ"מ) | 300 | 400 |
| גבישים שנאספו | 6 | 14 |
| קריסטלים נבחרו | 5 | 5 |
| טווח סיבובים לתמונה (°) | 0.1 | 0.2 |
| זמן חשיפה לתמונה (ים) | 0.1 | 0.1 |
| לא. של תמונות שנבחרו | 1000 | 540 |
| טווח סיבוב כולל ( °) | 100 | 108 |
| קבוצת חלל | P43212 | P43212 |
| a, c (Å) | 71.5, 293.8 | 71.4, 293.6 |
| פסיפס ממוצע (°) | 0.04 | 0.04 |
| טווח רזולוציה (Å) | 46 – 2.54 (2.6 – 2.54) | 48 – 2.3 (2.4 – 2.3) |
| סה"כ לא. של השתקפויות | 176105 (9374) | 232642 (32937) |
| לא. של השתקפויות ייחודיות | 23922 (1598) | 34862 (4066) |
| שלמות (%) | 90.6 (84.6) | 99.5 (100.0) |
| יתירות | 7.5 (6.0) | 6.7 (8.1) |
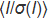 | 8.1 (1.3) | 6.9 (0.7) |
| רמיאס (%) | 18.6 (126.0) | 18.0 (231.2) |
| CC1/2 (%) | 98.7 (55.0) | 98.7 (46.9) |
| גורם B כולל מתוך העלילה וילסון (Å2) | 57.4 | 60.6 |
| עידון קריסטלוגרפי | ||
| לא. של השתקפויות, ערכת עבודה / ערכת בדיקה | 23583 / 1180 | 34840 / 3405 |
| Rcryst הסופי (%) / Rחינם (%) | 18.8 / 21.4 | 20.0 / 22.9 |
| לא. של אטומים שאינם H: הכולל / חלבון / ליגנד / ממס | 2998 / 2989 / 0 / 9 | 3057 / 2989 / 29 / 10 |
| סטיות R.m.s. לאג"ח (Å) / זוויות (°) | 0.009 / 1.23 | 0.010 / 1.22 |
| ממוצע B גורמים(Å 2): הכולל / חלבון / ligand / ממס | 60.1 / 60.1 / 0 / 52.7 | 62.5 / 62.6 / 60.1 / 55.5 |
| עלילה Ramachandran: המועדף ביותר (%) / מותר (%) | 98.1 / 1.9 | 97.2 / 2.8 |
| מזהה PDB | 6IBP (רת"מ) | 6Q52 |
טבלה 1: סטטיסטיקת איסוף ועידון נתונים
§ יתירות עצמאית Rmeas = Σhkl(N / N-1)1/2Σi | I(hkl)- (hkl)>| / ΣhklΣi i(hkl),כאשר N הוא ריבוי הנתונים 17.
£ נתונים עם 50%) כפי שהוצע על ידי קרפלוס & דידריך 18.
Discussion
הפרוטוקולים הנוכחיים בביו-קריסטלוגרפיה כוללים הכנת גבישים בשיטות כגון דיפוזיה של אדים אואצווה 13,14, והעברתם למיקרולופ לקירור קריו15,16 לפני ביצוע ניתוח עקיפה במטוס חנקן בתנאים קריוגניים. לעומת זאת, קירור קריסטלים ישיר אינו אפשרי בצ'יפX3 ולא ניתן לחלץ גבישים מהערוץ המיקרופלואידי שלהם, אשר ניתן לראות כמגבלות של התקנה זו. עם זאת, הפרוטוקול המתואר במאמר מספק צינור משולב לחלוטין לקביעת מבני גביש בטמפרטורת החדר (כלומר, בתנאים פיזיולוגיים יותר). למרות שאיסוף נתונים בטמפרטורת החדר גורם לעלייה בנזקיהקרינה 19, השפעה זו מאוזנת על ידי זמן רכישת נתונים מהיר (סיבוב מרבי של 60° נאסף על כל גביש) ועל ידי מיזוג של מספר ערכות נתונים חלקיות. הן עיצוב ChipX והן חומר היו אופטימיזציה כדי להפחית פיזור רקע הנחתה אות עקיפה3, ואיסוף נתונים יכול להתבצע על גבישים עם ממדים שווה ערך למחצית מגודל הערוצים (40 מיקרומטר)4.
לסיכום, היתרונות העיקריים של הפרוטוקול הם כדלקמן. הגבישים מיוצרים בסביבה נטולת הסעה (ערוצים מיקרופלואידיים), שהיא חיובית מאוד לצמיחה של גבישים באיכות גבוהה. שיטת הדיפוזיה הנגדית המיושמת בצ'יפ-אקס יעילה מאוד בסינון נוף רוויית העל; דיפוזיה של גבישים לתוך ערוץ השבב יוצר גל ריכוז רוויה המסייע לקבוע תנאי התגרענות וצמיחה מתאימים5. גבישים לעולם אינם מטופלים ישירות, אך מנותחים במקום, בתוך השבב, המשמר את תכונות עקיפתם האמיתיות (כלומר, אינו משנה את פסיפס הגבישים על ידי אינטראקציה פיזית או קריוקולינג)20. ניתוח עקיפה מבוצע על סדרה של גבישים המופצים לאורך ערוצי השבבים עם חשיפה במינון נמוך כדי למזער את נזקי הקרינה, וערכות נתונים מלאות מורכבות על ידי מיזוג נתונים חלקיים מהסדרה. טביעת הרגל הסטנדרטית והעיצוב הפשוט של ChipX יאפשרו בעתיד אוטומציה מלאה של איסוף נתונים באתרו באמצעות מתקני synchrotron או XFEL. כל השלבים של הפרוטוקול מתבצעים בצ'יפ-אקס. מנקודת המבט של הנסיין, הגדרת שבב היא פשוטה וקלה לביצוע עם צינורות סטנדרטיים ואינה דורשת כל ציוד נוסף. חיבור הערוץ דמוי העץ במפרצון המדגם ממזער אמצעי אחסון מתים במערכת, דבר שחשוב בעת עבודה עם דגימות שקשה לטהר או הזמינות רק בכמות מוגבלת.
לסיכום, גישת המעבדה על שבב המיושמת ב- ChipX מפשטת וממזערת ביעילות את תהליך ההתגבשות על ידי דיפוזיה נגדית וקביעת מבנה גביש, ומאפשרת לעבור מהמדגם למבנה תלת-ממדי במכשיר יחיד. הוא ישים באופן נרחב ומציע פתרון ידידותי למשתמש וחסכוני לחקירות ביו-קריסטלוגרפיה סדרתיות שגרתיות בטמפרטורת החדר.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מכירים במקור האור השוויצרי (ויליגן, שוויץ) להקצאת זמן קרן לפרויקט על קורות X10SA (PXII) ו- X06DA (PXIII), אלכסנדרה בלום על תרומתה לעידון המבנה, קלריסה וורסדייל להקלטה של הקריינות ופרנסואה שנל (אוניברסיטת שטרסבורג) על עזרתו בעריכת וידאו ו- SFX. עבודה זו נתמכה על ידי המרכז הצרפתי הלאומי דה לה Recherche Scientifique (CNRS), אוניברסיטת שטרסבורג, קונסורציום LabEx "NetRNA" (ANR-10-LABX-0036_NETRNA), מימון דוקטורט ל- R.dW מיוזמת המצוינות (IdEx) של אוניברסיטת שטרסבורג במסגרת התוכנית הלאומית הצרפתית "Investissements d'Avenir", מימון דוקטורט ל- K.R. מהאוניברסיטה הצרפתית-גרמנית (UFA-DFH, מענק לא. CT-30-19), דויטשה Forschungsgemeinschaft (מענק לא. מו 634/10-1). המחברים נהנו מתוכנית שיתוף הפעולה PROCOPE הוברט קוריין (משרד החוץ הצרפתי דויטשר Akademischer Austauschdienst).
Materials
| Name | Company | Catalog Number | Comments |
| Axioscope A1 stereomicroscope | Zeiss | Crystal observation (step 3) | |
| Carboxyrhodamine succinimidyl ester | Invitrogen | C-6157 | Protein labeling (step 2) |
| CMPcPP | Jena Bioscience | NU-438 | Crystal soaking (step 4) |
| Crystal clear sealing tape | Hampton research | HR3-511 | ChipX sealing (step 1) |
| Parafin oil | Hampton research | HR3-411 | ChipX loading (step 1) |
| Ultimaker 2 extended+ | Ultimaker | 3D printer - Representative results | |
| UV light source | Xtal Concepts Gmbh | XtalLight100c | Crystal observation (step 3) |
| Zeba spin desalting column 7K MWCO | ThermoFisher Scientific | 89882 | Protein labeling (step 2) |
References
- Giegé, R., Sauter, C. Biocrystallography: past, present, future. HFSP Journal. 4 (3-4), 109-121 (2010).
- Dhouib, K., et al. Microfluidic chips for the crystallization of biomacromolecules by counter-diffusion and on-chip crystal X-ray analysis. Lab on a Chip. 9 (10), 1412-1421 (2009).
- Pinker, F., et al. ChipX: A Novel Microfluidic Chip for Counter-Diffusion Crystallization of Biomolecules and in Situ Crystal Analysis at Room Temperature. Crystal Growth & Design. 13 (8), 3333-3340 (2013).
- de Wijn, R., et al. A simple and versatile microfluidic device for efficient biomacromolecule crystallization and structural analysis by serial crystallography. IUCrJ. 6 (3), 454-464 (2019).
- García-Ruiz, J. M. A supersaturation wave of protein crystallization. Journal of Crystal Growth. 232 (1-4), 149-155 (2001).
- Otálora, F., Gavira, J. A., Ng, J. D., García-Ruiz, J. M. Counterdiffusion methods applied to protein crystallization. Progress in Biophysics and Molecular Biology. 101 (1-3), 26-37 (2009).
- Pusey, M., Barcena, J., Morris, M., Singhal, A., Yuan, Q., Ng, J. Trace fluorescent labeling for protein crystallization. Acta Crystallographica Section F Structural Biology Communications. 71 (7), 806-814 (2015).
- Meyer, A., Betzel, C., Pusey, M. Latest methods of fluorescence-based protein crystal identification. Acta Crystallographica Section F Structural Biology Communications. 71 (2), 121-131 (2015).
- Betat, H., Rammelt, C., Mörl, M. tRNA nucleotidyltransferases: ancient catalysts with an unusual mechanism of polymerization. Cellular and Molecular Life Sciences. 67 (9), 1447-1463 (2010).
- Ernst, F. G. M., Erber, L., Sammler, J., Jühling, F., Betat, H., Mörl, M. Cold adaptation of tRNA nucleotidyltransferases: A tradeoff in activity, stability and fidelity. RNA Biology. 15 (1), 144-155 (2018).
- Kabsch, W. XDS. Acta Crystallographica. Section D, Biological Crystallography. 66 (2), 125-132 (2010).
- Adams, P. D., et al. PHENIX: a comprehensive Python-based system for macromolecular structure solution. Acta Crystallographica. Section D, Biological Crystallography. 66 (2), 213-221 (2010).
- Dessau, M. A., Modis, Y. Protein Crystallization for X-ray Crystallography. Journal of Visualized Experiments. (47), e2285 (2011).
- Sauter, C., Lorber, B., McPherson, A., Giegé, R., Arnold, E., Himmel, D. M., Rossmann, M. G. Crystallization - General Methods. International Tables of Crystallography, Vol. F, Crystallography of Biological Macromolecules. , 99-120 (2012).
- Garman, E. "Cool" crystals: macromolecular cryocrystallography and radiation damage. Current Opinion in Structural Biology. 13 (5), 545-551 (2003).
- Li, D., Boland, C., Aragao, D., Walsh, K., Caffrey, M. Harvesting and Cryo-cooling Crystals of Membrane Proteins Grown in Lipidic Mesophases for Structure Determination by Macromolecular Crystallography. Journal of Visualized Experiments. (67), e4001 (2012).
- Diederichs, K., Karplus, P. A. Improved R-factors for diffraction data analysis in macromolecular crystallography. Nature Structural Biology. 4 (4), 269-275 (1997).
- Karplus, P. A., Diederichs, K. Linking Crystallographic Model and Data Quality. Science. 336 (6084), 1030-1033 (2012).
- de la Mora, E., Coquelle, N., Bury, C. S., Rosenthal, M., Holton, J. M., Carmichael, I., Garman, E. F., Burghammer, M., Colletier, J. -. P., Weik, M. Radiation damage and dose limits in serial synchrotron crystallography at cryo- and room temperatures. Proceedings of the National Academy of Sciences of the United States of America. 117 (8), 4142-4151 (2020).
- Nave, C. A. Description of Imperfections in Protein Crystals. Acta Crystallographica. Section D, Biological Crystallography. 54 (5), 848-853 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved