Method Article
Kristallisation und strukturelle Bestimmung eines Enzyms: Substratkomplex durch serielle Kristallisation in einem vielseitigen mikrofluidischen Chip
In diesem Artikel
Zusammenfassung
Es wird ein vielseitiges mikrofluidisches Gerät beschrieben, das die Kristallisation eines Enzyms mittels der Gegendiffusionsmethode, das Einbringen eines Substrats in die Kristalle durch Einweichen und die 3D-Strukturbestimmung des Enzyms:Substrat-Komplex durch eine serielle Analyse von Kristallen im Inneren des Chips bei Raumtemperatur ermöglicht.
Zusammenfassung
Die Herstellung von gut diffrierenden Kristallen und deren Handhabung vor ihrer Röntgenanalyse sind zwei kritische Schritte biokristallographischer Studien. Wir beschreiben einen vielseitigen mikrofluidischen Chip, der die Herstellung von Kristallen durch die effiziente Methode der Gegendiffusion ermöglicht. Die konvektionsfreie Umgebung der mikrofluidischen Kanäle ist ideal für Kristallwachstum und nützlich, um ein Substrat in die aktive Stelle des kristallinen Enzyms zu diffundieren. Hier haben wir diesen Ansatz auf das CCA-addierte Enzym des psychrophilen Bakteriums Planococcus halocryophilus im vorgestellten Beispiel angewendet. Nach Kristallisation und Substratdiffusion/Einweichung wurde die Kristallstruktur des Enzyms:Substrat-Komplexes bei Raumtemperatur durch serielle Kristallographie und die Analyse mehrerer Kristalle direkt im Inneren des Chips bestimmt. Das gesamte Verfahren bewahrt die echten Beugungseigenschaften der Proben, da es keine Kristallbehandlung erfordert.
Einleitung
Crystallography ist eine Methode, um die 3D-Architektur biologischer Makromoleküle zu entschlüsseln. Letzteres ist wichtig zu verstehen, wie ein Enzym seine Substrate auswählt und verarbeitet. Die Bestimmung einer Kristallstruktur erfordert die Kristallisation des Zielmakromoleküls und die Konditionierung der Kristalle für deren Analyse durch Röntgenbeugung1. Sowohl die Kristallaufbereitung als auch die Handhabung sind entscheidende, aber empfindliche Schritte, die die Kristallqualität und die Beugungseigenschaften und damit die Auflösung (d. h. die Genauigkeit) der resultierenden 3D-Struktur beeinflussen können. Um die Herstellung von hochwertigen Kristallen zu erleichtern und unnötige Handhabung zu vermeiden, um ihre Beugungseigenschaften zu erhalten, haben wir ein benutzerfreundliches und vielseitiges mikrofluidisches Gerät namens ChipX2,3,4entwickelt.
In diesem Artikel zeigen wir, wie die Proteinlösung mit konventionellem Labormaterial in ChipX-Kanäle geladen wird, um Kristalle durch Gegendiffusion herzustellen. Diese Kristallisationsmethode ermöglicht ein effizientes Screening der Übersättigung und der potentiellen Keimbedingungen entlang der mikrofluidischen Kanäle, die die Enzymlösung enthalten, aufgrund des Konzentrationsgradienten, der durch die Diffusion des Kristallisationsmittels5,6erzeugt wird.
Die Chip-Einrichtung ist einfach, es verwendet nur Standard-Laborpipetten und erfordert keine teure Ausrüstung. Wenn Kristalle in ChipX gewachsen sind, können Liganden des Enzyms durch Diffusion eingeführt werden. Beugungsdaten werden dann bei Raumtemperatur auf einer Reihe von Kristallen gesammelt, die in den Kanälen des Chips mit einer Synchrotron-Röntgenquelle enthalten sind. Die hier beschriebene Strukturstudie führte zur Bestimmung von Strukturen eines tRNA-Reifungsenzyms in seiner Apo-Form und in Komplex mit einem Analogon seines CTP-Substrats, das durch Einweichen eingeführt wurde. Dieses Protein, das CCA-addierte Enzym, polymerisiert den CCA-Trinukleotidschwanz am 3'-Ende von tRNAs. Der Vergleich der beiden 3D-Bilder, die durch serielle Kristallographie gewonnen wurden, zeigt die lokalen Konformationsveränderungen im Zusammenhang mit der Bindung des Liganden unter Bedingungen, die physiologischer sind als die in der Kryokristallographie verwendeten. Das in diesem Video beschriebene Protokoll ist allgemein auf jedes Biomolekül anwendbar, sei es ein Protein, eine Nukleinsäure oder ein Mehrkomponentenkomplex.
Protokoll
1. Einrichten von Kristallisations-Assays in ChipX
HINWEIS: Das Mikrofluidgerät ChipX ist bei den Autoren erhältlich. Eine Beschreibung des Chips ist in Abbildung 1angegeben. Lösungen, die das kristalline (oder kristallisierende Mittel) enthalten, das zur Auslösung der Kristallisation verwendet wird, können kommerziellen Ursprungs sein oder vom Experimentator hergestellt werden.
- Beladen der Biomolekülprobe
HINWEIS: Das Tatsächlich benötigte Probenvolumen, um einen individuellen Gegendiffusionstest im geraden Abschnitt jedes ChipX-Kanals durchzuführen, beträgt 300 nL. Aus Gründen der Bequemlichkeit empfehlen wir jedoch, 5 l zu laden, um die acht Kanäle unter Berücksichtigung der variablen Länge ihres gekrümmten Abschnitts und der einlasstoten Volumina vollständig zu füllen.- Pipetten Sie 5 L Enzymlösungen mit Standard-10-L-Pipetten und -Spitzen.
- Führen Sie die Spitze vertikal in den Probeneingang ein und injizieren Sie die Lösung, bis die acht Kanäle bis zum gegenüberliegenden Ende gefüllt sind (Eingang des kristallisierenden Reservoirs).
- In den Probeneinlass 1 L Paraffinöl injizieren, um die Kanäle voneinander zu trennen.
- Stellen Sie die zusätzliche Lösung im kristallinen Reservoir an der Extremität jedes Kanals mit einer Standard-Pipette von 10 L wieder her.
- Versiegeln Sie den Probeneinlass mit einem 1 cm x 1 cm großen Klebeband.
- Laden der Kristallisationslösungen
- Pipetten 5 l Kristallisationslösung mit Standard 10 L Pipette und Spitze. Das Reservoirvolumen beträgt 10 l, aber nur die Hälfte davon vermeidet überlaufenbeim Abdichten mit Klebeband und erleichtert die weitere Zugabe von Liganden für Einweichversuche. Wenn anfängliche Kristallisationsbedingungen durch Dampfdiffusion erhalten wurden, erhöhen Sie die kristallane Konzentration um den Faktor 1,5 - 2. Die Lösungen können in jedem Reservoir unterschiedlich sein (im vorliegenden Fall wurde 1 M Diammoniumhydrogenphosphat, 100 mM Natriumacetat, pH 4,5 durchgängig verwendet).
- Richten Sie die Pipettenspitze auf den Eingang des Kanals im trichterförmigen Teil des Reservoirs aus, um die Bildung einer Luftblase bei Lösungsabscheidung zu vermeiden. Es würde den Kontakt zwischen den beiden Lösungen und kristalline Diffusion in den Kanal verhindern.
- Injizieren Sie die kristalline Lösung in das Reservoir.
- Versiegeln Sie die Reservoirs mit einem 2,5 cm x 1 cm Großen Klebeband.
- Inkubieren Sie den Chip bei 20 °C (temperatur kann je nach Ziel eingestellt werden, typischerweise zwischen 4 und 37 °C 4).
2. Proteinkennzeichnung mit Carboxyrhodamin zur Fluoreszenzdetektion
HINWEIS: Dieser Schritt ist optional. Sie muss vor der Probenbelastung durchgeführt werden, um die Detektion von Kristallen im Chip mittels Fluoreszenz zu erleichtern. Die detaillierte Methode der Spurenfluoreszenzkennzeichnung wurde von Pusey und Kollegen7beschrieben. Alle Schritte werden bei Raumtemperatur durchgeführt.
- 5 mg Carboxyrhodaminesterpulver in 1 ml wasserfreiem Dimethylformamid auflösen, die Lösung in 0,6 L Aliquots spalten, die bei -20 °C gelagert werden.
- Bereiten Sie eine 1 M Na-borate pH 8.75 Lagerlösung vor.
- Verdünnen Sie den Bestand, um den Reaktionspuffer bei 0,05 M Na-Borate pH 8,75 vorzubereiten.
- Spülen Sie eine Entsalzungssäule (7 kDa MWCO, 0,5 ml) mit 800 l Reaktionspuffer.
- Zentrifugieren Sie die Säule für 1 min bei 1400 x g, entfernen Sie das Filtrat.
- Wiederholen Sie diesen Vorgang zweimal (Schritte 2.4-2.5), um die Säule zu waschen.
- Hinterlegen Sie 80 l Protein in seinem Speicherpuffer auf der Säule (das Protein kann bis zu 1 mg/ml verdünnt werden, um das Volumen bei Bedarf zu erhöhen).
- Zentrifugieren Sie die Säule für 1 min bei 1400 x g. Dieser Schritt soll das Protein aus seinem Speicherpuffer in den Reaktionspuffer übertragen.
- Stellen Sie den Durchfluss (mit dem Protein im Reaktionspuffer) wieder her und mischen Sie ihn mit 0,6 l Carboxyrhodinlösung.
- 5 min bei Raumtemperatur inkubieren.
- In der Zwischenzeit die Säule 3 x mit dem Speicherpuffer abspülen, die Säule für 1 min bei 1400 x g zentrieren und das Filtrat entsorgen.
- Legen Sie die Reaktionslösung auf der Säule ab.
- Zentrifugieren Sie die Säule für 1 min bei 1400 x g und gewinnen Sie den Durchfluss (d.h. Lösung des markierten Proteins in seinem Speicherpuffer).
- Ergänzen Sie die Proteinlösung mit 0,1-1 % (w/w) etikettiertem Protein.
- Richten Sie die ChipX-Kristallisationstests ein, wie in Abschnitt 1 beschrieben.
- Prüfen Sie das Vorhandensein von Proteinkristallen in den Assays, indem Sie die fluoreszierende Sonde mit einer 520 nm Wellenlängenlichtquelle spannend machen.
3. Kristallbeobachtung
HINWEIS: Das ChipX-Gerät kann ohne besondere Sorgfalt behandelt werden, auch mit Kristallen im Inneren, es sei denn, die Temperatur muss kontrolliert werden.
- Verwenden Sie ein Stereomikroskop, um das Ergebnis von Kristallisationstests in ChipX zu überprüfen. Seine Grundfläche hat die Standardabmessungen von Mikroskopschlitten und ist mit jedem System und Diahalter kompatibel.
- Überprüfen Sie den Gehalt an mikrofluidischen Kanälen, beginnend mit dem Reservoir, in dem die kristalline Konzentration am höchsten ist, bis zum Probeneinlass, wo die kristalline Konzentration die niedrigste ist. Das ChipX-Material ist transparent für sichtbares Licht, kompatibel mit der Verwendung von Polarisatoren, sowie mit UV-Beleuchtung zur Proteinkristallidentifikation durch intrinsische Tryptophanfluoreszenz8.
- Zeichnen Sie Kristallpositionen mit den Beschriftungen auf, die entlang der Kanäle geprägt sind, oder markieren Sie Kristallpositionen mit einem permanenten Marker, indem Sie Farbpunkte neben ihnen auf der Chipoberfläche zeichnen.
4. Kristalleinweichen mit Liganden
HINWEIS: Dieses Verfahren ist optional. Es wird verwendet, um Liganden, Enzymsubstrate oder schwere Atome in die Kristalle einzuführen und sollte mindestens 24-48 h vor der Röntgenanalyse durchgeführt werden, um die zusammengesetzte Diffusion entlang der Kanäle und in die Kristalle zu ermöglichen.
- Entfernen Sie das Dichtband vorsichtig aus den Reservoirs.
- Addieren Sie bis zu 5 l Ligandlösung in einem oder mehreren Reservoirs mit einer 10-L-Mikropipet (im Beispiel wurde eine Endkonzentration von 3 l 10 ml 10 mM Cytidin-5'-[(α,β)-methyleno]-Triphosphat (CMPcPP) hinzugefügt, um eine Endkonzentration von 3,75 mM zu erreichen). CMPcPP ist ein nicht hydrolizierbares Analogon von CTP, einem natürlichen Substrat des Enzyms.
- Versiegeln Sie die Reservoirs mit einem 2,5 cm x 1 cm Großen Klebeband.
- Inkubieren Sie den Chip unter kontrollierter Temperatur für 24-48 h, um Ligandendiffusion entlang der Kanäle des Chips zu ermöglichen.
5. Kristallanalyse durch serielle Kristallographie
HINWEIS: Dieser Teil des Protokolls muss in Abhängigkeit von der Beamline-Einrichtung und den Beugungseigenschaften der Kristalle angepasst werden. Für die kristallographische Analyse auf Basis von X06DA-Beamline-Experimenten (SLS, Villigen, Schweiz) werden nur allgemeine Indikationen gegeben.
- ChipX-Montage am Beamline-Goniometer
HINWEIS: Die Datei zum 3D-Druck des ChipX-Halters ist inRef. 4angegeben.- Schalten Sie den Kryo-Jet der Beamline aus. Die Analyse erfolgt hier bei Raumtemperatur.
- Montieren Sie den ChipX auf einem speziellen Halter mit dem Kanal, der die zu analysierenden Kristalle in der Mitte des Halters enthält. Der ChipX Halter4 benötigt keine Schraube oder zusätzliches Teil, da er für eine perfekte Passform für ChipX entwickelt wurde.
- Befestigen Sie den Halter am Goniometer.
- Datenerfassung
- Richten Sie die dickste Schicht (obere Schicht, Abbildung 1)von ChipX (in dieser Ausrichtung sind Beschriftungen entlang der Kanäle direkt mit der Zentrierkamera der Strahllinie lesbar), auf den direkten Strahl und die dünnste Fläche hinter dem Kristall, um die Dämpfung des diffrierten Signals zu minimieren, wie in Ref3beschrieben.
- Um eine Kollision von ChipX mit dem umgebenden Material (Beamstop, Kollimator) zu vermeiden, beschränken Sie die Goniometerbewegungen im Bereich ±30° (0° entsprechen den Kanälen, die senkrecht zum Röntgenstrahl sind).
- Finden Sie Kristallposition mit Hilfe der Etiketten entlang der Kanäle geprägt.
- Wählen Sie eine Kristallposition aus.
- Zentrieren Sie den Kristall entweder durch Standard-Low-Dosis-Raster-/Raster-Screening oder 1-Klick-Verfahren (das Video zeigt ein Beispiel für Raster-Screening).
- Sammeln Sie Beugungsdaten im Bereich -30° / +30°.
- Starten Sie das Verfahren bei den Schritten 5.2.4-5.2.6 auf einem anderen Kristall im gleichen Kanal nach der Übersetzung des Chips neu.
- Richten Sie manuell einen anderen ChipX-Kanal in der Mitte des Halters aus und führen Sie die Datenerfassung auf Kristallen in diesem Kanal fort.
- Verwenden Sie kristallographische Standardpakete und -prozeduren, um die Daten zu verarbeiten und zusammenzuführen und dann die Struktur zu lösen und zu verfeinern.
Ergebnisse
Der hier beschriebene mikrofluidische Chip wurde entwickelt, um eine einfache Einrichtung von Kristallisationstests und Kristallanalysen bei Raumtemperatur zu ermöglichen. Das oben beschriebene Verfahren und im Video wurde im Rahmen der strukturellen Charakterisierung des CCA-addierten Enzyms aus dem kalt angepassten Bakterium Planococcus halocryophilus angewendet. Dieses Enzym gehört zu einer essentiellen Polymerase-Familie, die die sequenzielle Zugabe der 3' CCA-Sequenz auf tRNAs mit CTP und ATP9,10katalysiert.
Der Chip wurde zuerst verwendet, um Kristalle des Enzyms für die Strukturanalyse durch die Methode der Gegendiffusion vorzubereiten. Zu diesem Zweck wurde die Enzymlösung in die acht mikrofluidischen Kanäle (Kristallisationskammern) durch eine einzige Injektion in den Probeneingang des Chips geladen (siehe Abbildung 1). Das Enzym wurde mit 5,5 mg/ml in seinem Speicherpuffer mit 20 mM Tris/HCl pH 7,5, 200 mM NaCl und 5 mM MgCl2verwendet. Dieser Schritt wurde manuell mit einem Standard-Mikropipet von 10 L durchgeführt. Kristallisationslösungen (100 mM Natriumacetat pH 4,5,1 M Diammoniumhydrogenphosphat) wurden dann in den Reservoirs an der anderen Extremität der Kanäle abgelagert.
Der Ladevorgang ist einfach und dauert nicht länger als fünf Minuten(Abbildung 2). Das Kristallmittel diffundiert dann in die Kanäle, erzeugt einen Gradienten der Konzentration, der Kristallkernbildung und Wachstum auslöst. Dieser Gradient entwickelt sich dynamisch und erforscht ein Kontinuum der Übersättigungszustände5,6 bis zu einem Gleichgewicht der kristallinen Konzentration zwischen den Kanälen und dem Reservoir. Kristallisations-Assays werden in der Regel unter dem Micoscope über einen Zeitraum von 2 - 4 Wochen überprüft, um das Wachstum von Kristallen zu verfolgen. Bipyramidale Kristalle des CCA-addierenden Enzyms traten nach einigen Tagen inkubationszeit bei 20 °C(Abbildung 3) in den Kanälen auf. Die optionale Fluoreszenzkennzeichnung7 des Proteins erleichtert die Identifizierung von Proteinkristallen und deren Diskriminierung von Salzkristallen erheblich (Abbildung 4).
Wir nutzten die diffusive Umgebung in Chipkanälen, um dem Enzym, das die Kristalle aufbaut, ein Substrat zu liefern. Im vorliegenden Fall wurde CMPcPP, ein CTP-Analog, mit einer Endkonzentration von 3,75 mM zu den Reservoirlösungen hinzugefügt (Abbildung 5). Diese Zugabe wurde zwei Tage vor der kristallographischen Analyse durchgeführt, damit CMPcPP die katalytische Stelle des Enzyms erreichen und besetzen konnte, wie später durch die Kristallstruktur bestätigt wurde (siehe unten).
Wir stellten einen Chiphalter(Abbildung 6) in Polymilchsäure mit einem 3D-Drucker her. Der Halter ermöglicht die Spanmontage auf Goniometern mit Standard-Magnetköpfen. Dadurch kann der Chip einfach positioniert und im Röntgenstrahl übersetzt werden, um die Kristalle in Beugungsposition zu bringen. Die Datenerfassungsstrategie muss je nach Beamline-Eigenschaften und Kristalleigenschaften angepasst werden. Beim CCA-Addieren wurden Daten an X06DA- und X10SA-Strahllinien, Swiss Light Source (SLS), mit einer Röntgenwellenlänge von 1,0 % bzw. Pilatus 2M-F bzw. 6M Pixeldetektoren gesammelt. 30-60° Der Rotation wurden auf jedem Kristall bei Raumtemperatur mit Bildern von 0,1° oder 0,2° und 0,1 s Belichtung (siehe Tabelle 1) gesammelt. Teildatensätze wurden einzeln verarbeitet und geschnitten, wenn die Auflösung von Beugungsmustern aufgrund von Strahlungsschäden zu zerfallen begann (erfasst durch die Abnahme des Signal-Rausch-Verhältnisses 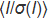 und CC1/2, und eine Erhöhung der R-Messwerte in der hochauflösenden Schale). Vollständige Datensätze wurden durch Zusammenführen von Daten aus 5 Kristallen (Tabelle 1) rekonstruiert. Kristallstrukturen wurden durch molekularen Ersatz mit standardkristallographischen Verpackungen und Verfahren für die Datenverarbeitung abgeleitet11 und Verfeinerung12. Der Vergleich der Strukturen des Enzyms und seines Komplexes mit CMPcPP zeigt die lokale Konformationsanpassung, die die Substratbindung an der aktiven Stelle des CCA-addierenden Enzyms begleitet (Abbildung 7).
und CC1/2, und eine Erhöhung der R-Messwerte in der hochauflösenden Schale). Vollständige Datensätze wurden durch Zusammenführen von Daten aus 5 Kristallen (Tabelle 1) rekonstruiert. Kristallstrukturen wurden durch molekularen Ersatz mit standardkristallographischen Verpackungen und Verfahren für die Datenverarbeitung abgeleitet11 und Verfeinerung12. Der Vergleich der Strukturen des Enzyms und seines Komplexes mit CMPcPP zeigt die lokale Konformationsanpassung, die die Substratbindung an der aktiven Stelle des CCA-addierenden Enzyms begleitet (Abbildung 7).
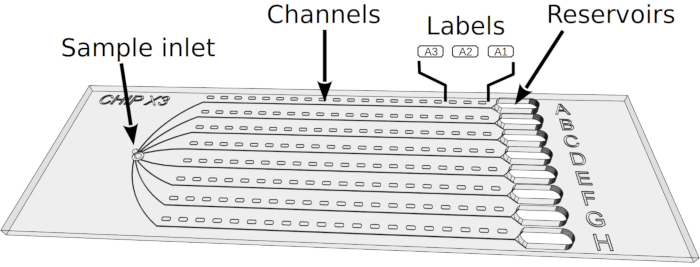
Abbildung 1:ChipX-Design. Der Chip besteht aus einer Deckschicht aus COC (Dicke: 1 mm), in die acht mikrofluidische Kanäle und Reservoirs eingeprägt sind. Der gesamte Chip ist mit einer COC-Schicht (Dicke: 0,1 mm) versiegelt. Alle Kanäle sind zur gleichzeitigen Probeninjektion mit einem einzigen Einlass auf der linken Seite und mit einzelnen Reservoirs auf der rechten Seite verbunden, in denen Kristallisationslösungen abgelagert werden. Die Kanäle, die die eigentlichen Kristallisationskammern des Chips bilden, sind 4 cm lang und haben einen Querschnitt von 80 x 80 m. Etiketten (A1, A2, A3, etc.), die entlang der Kanäle geprägt sind, erleichtern die Kristallpositionierung unter dem Mikroskop und die Erstellung einer Probenliste für die Datenerfassung. ChipX hat die Größe eines Standard-Mikroskopschlittens (7,5 cm x 2,5 cm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
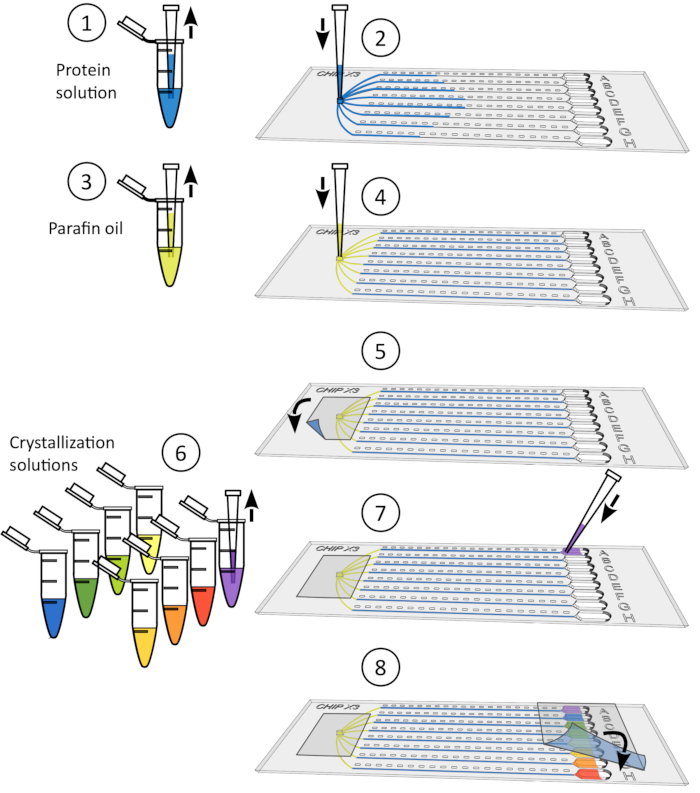
Abbildung 2: Einrichten von Kristallisationstests in ChipX. 1) Hinterlegung von Enzymlösungen mit 5-6 l Enzymlösungen mit Standard-Pipetten und Spitzen von 10 l. 2) Führen Sie die Spitze vertikal in den Probeneinlass ein und injizieren Sie die Lösung in die acht Kanäle. 3) Pipette 1 l Paraffinöl. 4) Führen Sie die Spitze vertikal in den Probeneinlass ein und injizieren Sie das Öl, um die Kanäle voneinander zu trennen. 5) Versiegeln Sie den Einlass mit einem Stück Klebeband. 6) Pipette 5 l Kristallisationslösung mit Standard 10 L Pipette und Spitze. Die Lösungen können in jedem Reservoir unterschiedlich sein (z.B. von einem Screening-Kit). 7) Richten Sie die Pipettenspitze auf den Eingang des Kanals im trichterförmigen Teil des Reservoirs aus (um die Bildung einer Luftblase bei Lösungsabscheidung zu vermeiden) und injizieren Sie die kristalline Lösung in das Reservoir. 8) Versiegeln Sie die Reservoirs mit einem Stück Klebeband und inkubieren Sie den Chip bei kontrollierter Temperatur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Kristalle des CCA-addierenden Enzyms, das durch Gegendiffusion in den mikrofluidischen Kanälen von ChipX angebaut wird. Die Maßstabsleiste ist 0,1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 4: Crystal Soaking Procedure. 1) Entfernen Sie das Band vorsichtig aus den Reservoirs. 2) Legen Sie bis zu 5 l Ligandlösung mit einem 10-L-Mikropipet ab. 3) Fügen Sie den Liganden zu einem oder mehreren Reservoirs hinzu. 4) Versiegeln Sie die Reservoirs erneut mit einem Stück Klebeband und inkubieren Sie den Chip unter kontrollierter Temperatur für 24-48 h vor der Datenerfassung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Die Spurenfluoreszenzkennzeichnung unterscheidet Protein (links) von Salzkristallen (rechts). Die CCA-addierte Enzymlösung enthielt 0,4 % (w/w) Protein, das mit Carboxyrhodamin gekennzeichnet war. Auf der rechten Seite werden Kristalle mit einer 520 nm Wellenlängenlichtquelle beleuchtet und das Bild wird mit einem Tiefpassfilter bei 550 nm (LP550) aufgenommen; (Einbau-)Struktur von Carboxyrhodamin-Succinimidylester. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: (links) Zeichnung des ChipX-Halters und (rechts) ChipX, montiert auf dem Goniometer der Beamline X06DA bei SLS (Villigen, Schweiz) zur seriellen Kristallanalyse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
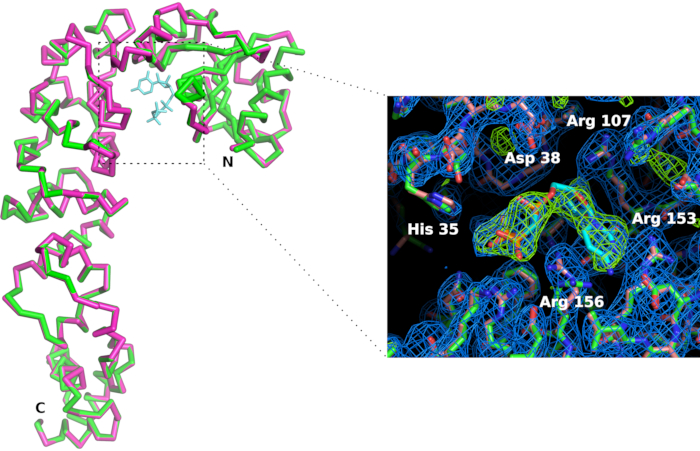
Abbildung 7: Vergleich der CCA-addierung der enzymaktiven Stelle in apo-Form (in rosa) und im Komplex mit einem CTP-Analog (in grün). Obwohl die Gesamtkonformation des Enzyms nicht beeinflusst wird, geht die Bindung des CMPcPP-Ligands mit einer leichten Reorganisation der Seitenketten an der aktiven Stelle einher. Die 2Fo-Fc-Elektronendichtekarte (blau) ist mit 1,2 Sigma konturiert. Die Differenz Elektronendichtekarte, konturiert bei 4 Sigma (in grün), bestätigt das Vorhandensein des Liganden in der aktiven Stelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Kristallisierte Probe | CCA-addierende Enzym | CCA-Zusatzenzym + CMPcPP |
| Kristallanalyse | ||
| Röntgenstrahllinie | SLS – X06DA | SLS – X10SA |
| Wellenlänge () | 1.000 | 1.000 |
| Temperatur (K) | 293 | 293 |
| Detektor | Pilatus 2M-F | Pilatus 6M |
| Kristalldetektorabstand (mm) | 300 | 400 |
| Kristalle gesammelt | 6 | 14 |
| Kristalle ausgewählt | 5 | 5 |
| Rotationsbereich pro Bild (°) | 0.1 | 0.2 |
| Belichtungszeit pro Bild (s) | 0.1 | 0.1 |
| Nein. der ausgewählten Bilder | 1000 | 540 |
| Gesamtrotationsbereich (°) | 100 | 108 |
| Weltraumgruppe | P43212 | P43212 |
| a, c () | 71.5, 293.8 | 71.4, 293.6 |
| Mittlere Mosaik (°) | 0.04 | 0.04 |
| Auflösungsbereich (A) | 46 – 2.54 (2.6 – 2.54) | 48 – 2.3 (2.4 – 2.3) |
| Gesamt-Nr. der Reflexionen | 176105 (9374) | 232642 (32937) |
| Nein. von einzigartigen Reflexionen | 23922 (1598) | 34862 (4066) |
| Vollständigkeit (%) | 90.6 (84.6) | 99.5 (100.0) |
| Redundanz | 7.5 (6.0) | 6.7 (8.1) |
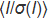 | 8.1 (1.3) | 6.9 (0.7) |
| Rmeas (%) | 18.6 (126.0) | 18.0 (231.2) |
| CC1/2 (%) | 98.7 (55.0) | 98.7 (46.9) |
| Gesamt-B-Faktor aus Wilson-Plot(2) | 57.4 | 60.6 |
| Kristallographische Verfeinerung | ||
| Nein. Reflexionen, Arbeitsset / Testsatz | 23583 / 1180 | 34840 / 3405 |
| Final Rcryst (%) / Rfrei (%) | 18.8 / 21.4 | 20.0 / 22.9 |
| Nein. von Nicht-H-Atomen: gesamt / Protein / Liganden / Lösungsmittel | 2998 / 2989 / 0 / 9 | 3057 / 2989 / 29 / 10 |
| R.m.s. Abweichungen für Bindungen (B) / Winkel (°) | 0.009 / 1.23 | 0.010 / 1.22 |
| Durchschnittliche B-Faktoren(2) insgesamt / Protein / Liganden / Lösungsmittel | 60.1 / 60.1 / 0 / 52.7 | 62.5 / 62.6 / 60.1 / 55.5 |
| Ramachandran Grundstück: am meisten bevorzugt (%) / erlaubt (%) | 98.1 / 1.9 | 97.2 / 2.8 |
| PDB-ID | 6IBP | 6Q52 |
Tabelle 1: Datenerhebungs- und Verfeinerungsstatistiken
• Redundanz-unabhängige Rmeas =hkl(N/N-1)1/2-i | Ii(hkl)- (hkl)>| /hkli ii(hkl), wobei N die Datenvielfalt 17ist.
Daten mit niedrigem in der äußeren Schale (<2.0) wurden auf der Grundlage des CC1/2-Kriteriums (Korrelation zwischen zwei zufälligen Hälften des Datensatzes > 50%) wie vorgeschlagen von Karplus & Diederichs 18.
Diskussion
Aktuelle Protokolle in der Biokristallographie beinhalten die Herstellung von Kristallen unter Verwendung von Methoden wie Dampfdiffusion oder Charge13,14, und deren Übertragung in einen Mikroschlaufen zur Kryokühlung15,16 vor der Durchführung der Beugungsanalyse in einem Stickstoffstrahl unter kryogenen Bedingungen. Im Gegensatz dazu ist eine direkte Kristallkryokühlung in ChipX3 nicht möglich und Kristalle können nicht aus ihrem mikrofluidischen Kanal extrahiert werden, was als Einschränkung dieses Setups angesehen werden kann. Das in diesem Artikel beschriebene Protokoll bietet jedoch eine vollständig integrierte Rohrleitung zur Bestimmung von Kristallstrukturen bei Raumtemperatur (d. h. unter physiologischeren Bedingungen). Auch wenn die Datenerfassung bei Raumtemperatur einen Anstieg des Strahlungsschadens19verursacht, wird dieser Effekt durch eine schnelle Datenerfassungszeit (an jedem Kristall wird maximal 60° Drehung gesammelt) und durch Zusammenführen mehrerer Teildatensätze ausgeglichen. Sowohl Das ChipX-Design als auch das Material wurden optimiert, um die Hintergrundstreuung und Beugungssignaldämpfung3zu reduzieren, und die Datenerfassung kann auf Kristallen durchgeführt werden, deren Abmessungen der halben Größe der Kanäle (40 m)4entsprechen.
Zusammenfassend lässt sich sagen, dass die Hauptvorteile des Protokolls die folgenden sind. Die Kristalle werden in einer konvektionsfreien Umgebung (mikrofluidische Kanäle) hergestellt, was sehr günstig für das Wachstum von hochwertigen Kristallen ist. Die in ChipX implementierte Gegendiffusionsmethode ist sehr effizient beim Screening der Übersättigungslandschaft; die Diffusion von Kristallen in den Spankanal erzeugt eine Konzentrations- und Übersättigungswelle, die hilft, geeignete Keim- und Wachstumsbedingungen zu bestimmen5. Kristalle werden nie direkt behandelt, sondern werden vor Ort im Inneren des Chips analysiert, was ihre echten Beugungseigenschaften bewahrt (d.h. die Kristallmosaikität durch physikalische Interaktion oder Kryokühlung nicht verändert)20. Die Beugungsanalyse wird an einer Reihe von Kristallen durchgeführt, die entlang der Chipkanäle verteilt sind und eine niedrige Dosisexposition aufweist, um Strahlungsschäden zu minimieren, und ein vollständiger Datensatz wird durch Zusammenführen von Teildaten aus der Reihe zusammengesetzt. Der Standard-Fußabdruck und das einfache Design von ChipX ermöglichen in Zukunft eine vollständige Automatisierung der In-situ-Datenerfassung mit Synchrotron- oder XFEL-Anlagen. Alle Schritte des Protokolls werden in ChipX ausgeführt. Aus der Sicht des Experimentierers ist die Chip-Einrichtung einfach und einfach mit Standardpipetten durchzuführen und erfordert keine zusätzliche Ausrüstung. Die baumartige Kanalverbindung am Probeneinlass minimiert tote Volumina im System, was bei der Arbeit mit Proben wichtig ist, die schwer zu reinigen sind oder nur in begrenzter Menge verfügbar sind.
Zusammenfassend lässt sich sagen, dass der in ChipX implementierte Lab-on-a-Chip-Ansatz den Kristallisationsprozess durch Gegendiffusion und Kristallstrukturbestimmung vereinfacht und effizient miniaturisiert, so dass von der Probe in einer einzigen Vorrichtung die 3D-Struktur aufsieben kann. Es ist weit verbreitet und bietet eine benutzerfreundliche, kostengünstige Lösung für routinemäßige serielle Biokristallographieuntersuchungen bei Raumtemperatur.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren würdigen die Swiss Light Source (Villigen, Schweiz) für die Beamtime-Zuweisung an das Projekt über die Beamlines X10SA (PXII) und X06DA (PXIII), Alexandra Bluhm für ihren Beitrag zur Strukturveredelung, Clarissa Worsdale für die Aufnahme des Voiceovers und Francois Schnell (Université de Strasbourg) für seine Unterstützung bei der Videobearbeitung und SFX. Diese Arbeit wurde vom französischen Centre National de la Recherche Scientifique (CNRS), der Universität Straßburg, das LabEx-Konsortium "NetRNA" (ANR-10-LABX-0036_NETRNA), eine Promotionsförderung an R.dW von der Exzellenzinitiative (IdEx) der Universität Straßburg im Rahmen des französischen Nationalprogramms "Investissements d'Avenir", einer Promotionsförderung an K.R. von der Deutsch-Französischen Universität (UFA-DFH, Grant-Nr. CT-30-19), die Deutsche Forschungsgemeinschaft (Zuschuss-Nr. Mo 634/10-1). Die Autoren profitierten vom Kooperationsprogramm PROCOPE Hubert Curien (französisches Ministerium für auswärtige Angelegenheiten und Deutscher Akademischer Austauschdienst).
Materialien
| Name | Company | Catalog Number | Comments |
| Axioscope A1 stereomicroscope | Zeiss | Crystal observation (step 3) | |
| Carboxyrhodamine succinimidyl ester | Invitrogen | C-6157 | Protein labeling (step 2) |
| CMPcPP | Jena Bioscience | NU-438 | Crystal soaking (step 4) |
| Crystal clear sealing tape | Hampton research | HR3-511 | ChipX sealing (step 1) |
| Parafin oil | Hampton research | HR3-411 | ChipX loading (step 1) |
| Ultimaker 2 extended+ | Ultimaker | 3D printer - Representative results | |
| UV light source | Xtal Concepts Gmbh | XtalLight100c | Crystal observation (step 3) |
| Zeba spin desalting column 7K MWCO | ThermoFisher Scientific | 89882 | Protein labeling (step 2) |
Referenzen
- Giegé, R., Sauter, C. Biocrystallography: past, present, future. HFSP Journal. 4 (3-4), 109-121 (2010).
- Dhouib, K., et al. Microfluidic chips for the crystallization of biomacromolecules by counter-diffusion and on-chip crystal X-ray analysis. Lab on a Chip. 9 (10), 1412-1421 (2009).
- Pinker, F., et al. ChipX: A Novel Microfluidic Chip for Counter-Diffusion Crystallization of Biomolecules and in Situ Crystal Analysis at Room Temperature. Crystal Growth & Design. 13 (8), 3333-3340 (2013).
- de Wijn, R., et al. A simple and versatile microfluidic device for efficient biomacromolecule crystallization and structural analysis by serial crystallography. IUCrJ. 6 (3), 454-464 (2019).
- García-Ruiz, J. M. A supersaturation wave of protein crystallization. Journal of Crystal Growth. 232 (1-4), 149-155 (2001).
- Otálora, F., Gavira, J. A., Ng, J. D., García-Ruiz, J. M. Counterdiffusion methods applied to protein crystallization. Progress in Biophysics and Molecular Biology. 101 (1-3), 26-37 (2009).
- Pusey, M., Barcena, J., Morris, M., Singhal, A., Yuan, Q., Ng, J. Trace fluorescent labeling for protein crystallization. Acta Crystallographica Section F Structural Biology Communications. 71 (7), 806-814 (2015).
- Meyer, A., Betzel, C., Pusey, M. Latest methods of fluorescence-based protein crystal identification. Acta Crystallographica Section F Structural Biology Communications. 71 (2), 121-131 (2015).
- Betat, H., Rammelt, C., Mörl, M. tRNA nucleotidyltransferases: ancient catalysts with an unusual mechanism of polymerization. Cellular and Molecular Life Sciences. 67 (9), 1447-1463 (2010).
- Ernst, F. G. M., Erber, L., Sammler, J., Jühling, F., Betat, H., Mörl, M. Cold adaptation of tRNA nucleotidyltransferases: A tradeoff in activity, stability and fidelity. RNA Biology. 15 (1), 144-155 (2018).
- Kabsch, W. XDS. Acta Crystallographica. Section D, Biological Crystallography. 66 (2), 125-132 (2010).
- Adams, P. D., et al. PHENIX: a comprehensive Python-based system for macromolecular structure solution. Acta Crystallographica. Section D, Biological Crystallography. 66 (2), 213-221 (2010).
- Dessau, M. A., Modis, Y. Protein Crystallization for X-ray Crystallography. Journal of Visualized Experiments. (47), e2285 (2011).
- Sauter, C., Lorber, B., McPherson, A., Giegé, R., Arnold, E., Himmel, D. M., Rossmann, M. G. Crystallization - General Methods. International Tables of Crystallography, Vol. F, Crystallography of Biological Macromolecules. , 99-120 (2012).
- Garman, E. "Cool" crystals: macromolecular cryocrystallography and radiation damage. Current Opinion in Structural Biology. 13 (5), 545-551 (2003).
- Li, D., Boland, C., Aragao, D., Walsh, K., Caffrey, M. Harvesting and Cryo-cooling Crystals of Membrane Proteins Grown in Lipidic Mesophases for Structure Determination by Macromolecular Crystallography. Journal of Visualized Experiments. (67), e4001 (2012).
- Diederichs, K., Karplus, P. A. Improved R-factors for diffraction data analysis in macromolecular crystallography. Nature Structural Biology. 4 (4), 269-275 (1997).
- Karplus, P. A., Diederichs, K. Linking Crystallographic Model and Data Quality. Science. 336 (6084), 1030-1033 (2012).
- de la Mora, E., Coquelle, N., Bury, C. S., Rosenthal, M., Holton, J. M., Carmichael, I., Garman, E. F., Burghammer, M., Colletier, J. -. P., Weik, M. Radiation damage and dose limits in serial synchrotron crystallography at cryo- and room temperatures. Proceedings of the National Academy of Sciences of the United States of America. 117 (8), 4142-4151 (2020).
- Nave, C. A. Description of Imperfections in Protein Crystals. Acta Crystallographica. Section D, Biological Crystallography. 54 (5), 848-853 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten