Method Article
Кристаллизация и структурное определение фермента: Субстратный комплекс по серийной кристаллографии в универсальном микрофлюидной чипе
В этой статье
Резюме
Описано универсальное микрофлюидное устройство, позволяющее кристаллизовать фермент с использованием метода контрдиффузии, введение субстрата в кристаллы путем замачивания и определение 3D-структуры фермента: субстратный комплекс путем последовательного анализа кристаллов внутри чипа при комнатной температуре.
Аннотация
Подготовка кристаллов диффрактинга и их обработка перед рентген-анализом являются двумя критическими шагами биокристаллографических исследований. Мы описываем универсальный микрофлюидный чип, который позволяет производство кристаллов эффективным методом борьбы с диффузией. Среда, свободная от конвекции, предоставляемая микрофлюидными каналами, идеально подходит для роста кристаллов и полезна для распространения субстрата в активное место кристаллического фермента. Здесь мы применили этот подход к ферменту CCA-добавления психофильной бактерии Planococcus halocryophilus в представленном примере. После кристаллизации и субстратной диффузии/замачивания кристаллическая структура фермента: субстратный комплекс определялся при комнатной температуре по серийной кристаллографии и анализу нескольких кристаллов непосредственно внутри чипа. Вся процедура сохраняет подлинные дифракционные свойства образцов, поскольку она не требует обработки кристалла.
Введение
Кристаллография является методом расшифровки 3D-архитектуры биологических макромолекул. Последнее важно понять, как фермент подбирает и обрабатывает свои субстраты. Определение кристаллической структуры требует кристаллизации целевого макромолекулы и кондиционирования кристаллов для их анализа рентгеновской дифракцией1. Как подготовка кристалла, так и обработка являются важными, но деликатными шагами, которые могут повлиять на качество кристалла и дифракционные свойства, и, таким образом, разрешение (т.е. точность) полученной 3D структуры. Для облегчения подготовки высококачественных кристаллов и устранения ненужной обработки для сохранения их дифракционных свойств, мы разработали удобное и универсальное микрофлюидное устройство под названием ChipX2,3,4.
В этой статье мы продемонстрируем, как загрузить белковый раствор в каналы ChipX с использованием обычного лабораторного материала для подготовки кристаллов путем контр-диффузии. Этот метод кристаллизации обеспечивает эффективный скрининг супернасыщения и потенциальных условий нуклеации вдоль микрофлюидных каналов, содержащих ферментный раствор из-за градиента концентрации, генерируемого диффузией кристаллизирующегоагента 5,6.
Установка чипа проста, она использует только стандартные лабораторные пипетки и не требует дорогостоящего оборудования. Когда кристаллы выросли в ChipX, лиганды фермента могут быть введены путем диффузии. Затем данные дифракции собираются при комнатной температуре по ряду кристаллов, содержащихся в каналах чипа с помощью синхротронного рентгеновского источника. Описанное здесь структурное исследование привело к определению структур фермента созревания тРНК в форме апо и в комплексе с аналогом его субстрата CTP, введенного путем замачивания. Этот белок под названием фермент, добавляемый к CCA, полимеризирует тринуклеотидный хвост CCA на 3'конце tRNAs. Сравнение двух 3D-изображений, полученных с помощью серийной кристаллографии, показывает локальные конформациальные изменения, связанные с связыванием лиганда в условиях, которые являются более физиологическими, чем те, которые используются в криокристаллографии. Протокол, описанный в этом видео, как правило, применим к любой биомолекуле, будь то белок, нуклеиновой кислоты или многокомпонентный комплекс.
протокол
1. Настройка анализов кристаллизации в ChipX
ПРИМЕЧАНИЕ: Микрофлюидное устройство ChipX можно получить у авторов. Описание чипа дается на рисунке 1. Решения, содержащие кристаллизирующийся (или кристаллизирующийся агент), используемые для запуска кристаллизации, могут иметь коммерческое происхождение или быть подготовлены экспериментатором.
- Загрузка образца биомолекулы
ПРИМЕЧАНИЕ: Объем выборки, фактически необходимый для выполнения индивидуального контр-диффузионные анализы в прямом разделе каждого канала ChipX составляет 300 nL. Однако для удобства мы предлагаем загрузить 5 МЛ, чтобы полностью заполнить восемь каналов с учетом переменной длины их изогнутого сечения и введать мертвые тома.- Pipet 5 йл ферментных растворов, используя стандартные 10 МКЛ пипетки и наконечник.
- Ввести наконечник вертикально в вход образца и вводить раствор до тех пор, пока восемь каналов не будут заполнены до их противоположного конца (вход в кристаллическое водохранилище).
- Ввись 1 МКЛ парафинового масла в пробу вход для того, чтобы отключить каналы друг от друга.
- Восстановите дополнительное решение в кристаллическом резервуаре на конечности каждого канала, используя стандартный трубоуправляемый 10 йл.
- Печать образца вход с 1 см х 1 см кусок ленты.
- Загрузка решений кристаллизации
- Pipet 5 йл раствора кристаллизации с использованием стандартных 10 МКЛ пипетки и наконечника. Объем резервуара составляет 10 мкл, но загрузка только половины его позволяет избежать переполнения при уплотнению лентой и облегчает дальнейшее добавление лиганда для замачивания экспериментов. Если начальные условия кристаллизации были получены путем диффузии пара, увеличьте концентрацию кристалланта в 1,5 - 2. Решения могут быть разными в каждом резервуаре (в представленном случае во всем использовался 1 М диаммоний водородный фосфат, ацетат натрия 100 мМ, рН 4,5).
- Ориентация наконечника трубы к входу канала в воронку формы части резервуара, чтобы избежать образования воздушного пузыря при осаждении раствора. Это предотвратило бы контакт между этими двумя решениями и кристаллическое распространение в канал.
- Введать кристаллический раствор в резервуар.
- Печать резервуаров с 2,5 см х 1 см кусок ленты.
- Инкубировать чип при температуре 20 градусов по Цельсию (температура может быть скорректирована в зависимости от цели, как правило, между 4 и 37 градусов по Цельсию 4).
2. Белковая маркировка карбоксиродамином для обнаружения флуоресценции
ПРИМЕЧАНИЕ: Этот шаг является необязательным. Она должна быть выполнена до загрузки образца для облегчения обнаружения кристаллов в чипе с помощью флуоресценции. Подробный метод отслеживания флуоресцентной маркировки был описан Pusey и коллегами7. Все шаги выполняются при комнатной температуре.
- Растворите 5 мг порошка карбоксиродамина в 1 мл ангидроуса диметил-формамид, разделите раствор на 0,6 л алицитов, которые будут храниться при -20 градусов по Цельсию.
- Приготовьте 1 M Na-borate рН 8,75 бульонного раствора.
- Разбавить запас для подготовки буфера реакции на 0,05 М На-борат рН 8,75.
- Промыть десалирование колонны (7 кДа MWCO, 0,5 мл) с 800 мл буфера реакции.
- Центрифуга колонки в течение 1 мин при 1400 х г, удалить фильтрат.
- Повторите эту операцию дважды (шаги 2.4-2.5), чтобы вымыть столбец.
- Депозит 80 мл белка в буфере хранения на колонке (белок может быть разбавлен до 1 мг/мл, чтобы увеличить объем, если это необходимо).
- Центрифуга колонки в течение 1 мин при 1400 х г. Этот шаг предназначен для переноса белка из буфера хранения в буфер реакции.
- Восстановите поток через (содержащий белок в буфере реакции) и смешайте его с 0,6 МЛ карбоксиродаминового раствора.
- Инкубация 5 мин при комнатной температуре.
- Между тем, промыть столбец 3 х с буфером хранения, центрифуга колонки в течение 1 мин на 1400 х г и отказаться от фильтрата.
- Ввемите решение реакции на столбец.
- Центрифуга колонки в течение 1 мин при 1400 х г и восстановить поток через (т.е. раствор помеченного белка в буфере хранения).
- Дополните раствор стокового белка 0,1-1% (w/w) помеченного белка.
- Настройка анализа кристаллизации ChipX, как описано в разделе 1.
- Проверьте наличие кристаллов белка в анализах, захватывающий флуоресцентный зонд с 520 нм длина волны источника света.
3. Хрустальное наблюдение
ПРИМЕЧАНИЕ: Устройство ChipX может быть обработано без особого ухода, даже с кристаллами внутри, за исключением случаев, когда температура должна контролироваться.
- Используйте любой стереомикроскоп, чтобы проверить результаты анализа кристаллизации в ChipX. Его след имеет стандартные размеры слайдов микроскопа и совместим с любой системой и держателем слайдов.
- Проверьте содержание микрофлюидных каналов, начиная с резервуара, где концентрация кристалла является самой высокой в пробный вход, где концентрация кристалла является самой низкой. Материал ChipX прозрачный для видимого света, совместимый с использованием поляризаторов, а также с УЛЬТРАФИОЛЕТОВЫм освещением для идентификации белкового кристалла внутренней триптофаной флуоресценцией8.
- Запись кристаллических позиций с помощью этикетки тиснением вдоль каналов или знак кристаллических местах с постоянным маркером, рисуя цветные точки рядом с ними на поверхности чипа.
4. Кристалл замачивания с лигандами
ПРИМЕЧАНИЕ: Эта процедура необязательна. Он используется для введения лигандов, ферментных субстратов или тяжелых атомов в кристаллы и должен быть проведен по крайней мере 24-48 ч до рентгеновского анализа, чтобы соединение диффузии вдоль каналов и в кристаллы.
- Аккуратно удалите уплотнительную ленту из резервуаров.
- Добавьте до 5 МЛ лигандового раствора в одном или нескольких резервуарах, используя микропайп (например, 3 МКЛ из 10 мм цитидина-5'-α,β)-метилено-трифосфат (CMPcPP) решение было добавлено для достижения окончательной концентрации 3,75 мМ). CMPcPP является негидролизируемым аналогом CTP, естественного субстрата фермента.
- Печать резервуаров с 2,5 см х 1 см кусок ленты.
- Инкубировать чип под контролируемой температурой 24-48 ч, чтобы лиганд диффузии по каналам чипа.
5. Кристаллический анализ по серийной кристаллографии
ПРИМЕЧАНИЕ: Эта часть протокола должна быть адаптирована в зависимости от установки луча и дифракционных свойств кристаллов. Для кристаллографического анализа, основанного на экспериментах, проведенных на лучевой линии X06DA (SLS, Villigen, Швейцария), даются только общие показания.
- ЧипX монтаж на гониометре балки
ПРИМЕЧАНИЕ: Файл для 3D-печати держателя ChipX предоставляется в ref4.- Выключите крио-струйную линию балки. Анализ здесь проводится при комнатной температуре.
- Намонтировать ChipX на специальном держателе с каналом, содержащим кристаллы для анализа, расположенным в центре держателя. Держатель ChipX4 не требует винта или дополнительной части, так как он был разработан, чтобы обеспечить идеально подходит для ChipX.
- Прикрепите держатель к гониометру.
- Сбор данных
- Ориентируйте самый толстый слой (верхний слой, рисунок 1)ChipX (в этой ориентации этикетки вдоль каналов непосредственно читаемы с помощью центрирования камеры луча), к прямому лучу и тончайшему лицу за кристаллом, чтобы свести к минимуму затухание диффрактированного сигнала, описанного в ref3.
- Чтобы избежать столкновения ChipX с окружающим материалом (луч, коллиматор), ограничь движения гониометра в диапазоне ±30 "(0 " (0 ", соответствующие каналам перпендикулярно рентгеновского луча).
- Найти кристаллы позиции с помощью этикетки тиснением вдоль каналов.
- Выберите хрустальную позицию.
- Центр кристалла либо стандартной низкой дозы сетки / raster скрининга или 1-клик процедуры (видео показывает пример сетки скрининга).
- Сбор дифракционных данных в пределах диапазона -30 "/ 30".
- Перезапустить процедуру на ступенях 5.2.4-5.2.6 на другом кристалле в том же канале после перевода чипа.
- Вручную перестроить другой канал ChipX в центре держателя и вести сбор данных о кристаллах, присутствующих в этом канале.
- Используйте стандартные кристаллографические пакеты и процедуры для обработки и слияния данных, а затем для решения и уточнения структуры.
Результаты
Описанный здесь микрофлюидный чип был разработан для легкой установки анализов кристаллизации и кристаллического анализа при комнатной температуре. Процедура, описанная выше и в видео, была применена в рамках структурной характеристики фермента CCA-добавления из холодной адаптированной бактерии Planococcus halocryophilus. Этот фермент принадлежит к важному семейство полимеразы, которая катализует последовательное добавление последовательности 3' CCA на tRNAs с использованием CTP и ATP9,10.
Чип был впервые использован для подготовки кристаллов фермента для структурного анализа методом контрдиффузии. С этой целью ферментный раствор был загружен в восемь микрофлюидных каналов (камеры кристаллизации) одной инъекцией в образец ввеся чипа (см. рисунок 1). Фермент использовался при 5,5 мг/мл в буфере хранения, содержащем 20 мМ Трис/HCl pH 7,5, 200 мМ НаКл и 5 мМ MgCl2. Этот шаг был выполнен вручную со стандартным микропайпом 10 йл. Кристаллические растворы (100 мМ ацетат натрия рН 4,5,1 М диаммония фосфат водорода) затем откладываются в резервуарах на другой конечности каналов.
Процедура погрузки проста и не занимает больше пяти минут(рисунок 2). Кристаллизум затем рассеивается в каналах, создает градиент концентрации, который вызывает кристаллическое ядро и рост. Этот градиент развивается динамически и исследует континуум состоянийсупернасыщения 5,6 до достижения равновесия кристаллической концентрации между каналами и резервуаром. Анализы кристаллизации обычно проверяются под микоскопом в течение 2 - 4 недель для отслеживания роста кристаллов. Бипирамидные кристаллы фермента, добавляемого CCA, появились по всем каналам после нескольких дней инкубации при 20 градусах по Цельсию(рисунок 3). Необязательнаяфлуоресцентная маркировка 7 белка значительно облегчает идентификацию кристаллов белка и их дискриминацию от кристаллов соли(рисунок 4).
Мы использовали диффузную среду в чиповых каналах для доставки субстрата ферменту, который создает кристаллы. В данном случае к растворам резервуара при окончательной концентрации 3,75 мМ (рисунок5)был добавлен аналог КТП CMPcPP. Это дополнение было выполнено за два дня до кристаллографического анализа, чтобы позволить CMPcPP достичь и занять каталитический участок фермента, как позже подтверждается кристаллической структурой (см. ниже).
Мы изготовили держатель чипа(рисунок 6)в полилактической кислоте с помощью 3D-принтера. Держатель позволяет чип монтаж на гониометрах с использованием стандартных магнитных головок. Таким образом, чип может быть легко расположен и переведен в рентгеновский луч, чтобы привести кристаллы в положение дифракции. Стратегия сбора данных должна быть адаптирована в зависимости от характеристик луча и кристаллических свойств. В случае фермента, добавляемого к CCA, данные были собраны на лучах X06DA и X10SA, Swiss Light Source (SLS), с рентгеновской длиной волны 1,0 и Pilatus 2M-F и 6M пиксельных детекторов, соответственно. 30-60 "вращения были собраны на каждом кристалле при комнатной температуре с изображениями 0,1" или 0,2 "и 0,1 с экспозиции (см. таблицу 1). Частичные наборы данных обрабатывались индивидуально и разрезались, когда разрешение дифракционных моделей начало распадаться из-за повреждения радиацией (обнаружено снижение соотношения сигнала к шуму 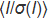 и CC1/2,а также увеличение Rmeas в оболочке высокого разрешения). Полные наборы данных были восстановлены путем слияния данных из 5 кристаллов(таблица 1). Кристаллические структуры были получены путем молекулярной замены с использованием стандартных кристаллографических пакетов ипроцедур для обработки данных 11 иуточнения 12. Сравнение структур фермента и его комплекса с CMPcPP показывает локальную конформацию, которая сопровождает связывание субстрата в активном месте фермента CCA-добавления(рисунок 7).
и CC1/2,а также увеличение Rmeas в оболочке высокого разрешения). Полные наборы данных были восстановлены путем слияния данных из 5 кристаллов(таблица 1). Кристаллические структуры были получены путем молекулярной замены с использованием стандартных кристаллографических пакетов ипроцедур для обработки данных 11 иуточнения 12. Сравнение структур фермента и его комплекса с CMPcPP показывает локальную конформацию, которая сопровождает связывание субстрата в активном месте фермента CCA-добавления(рисунок 7).
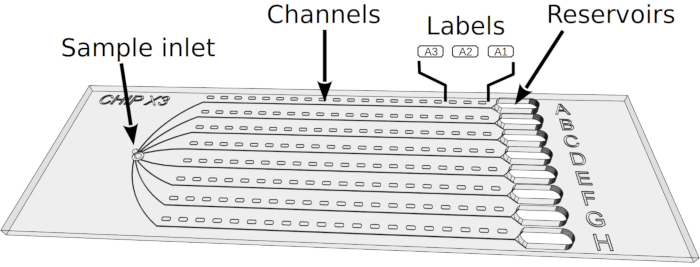
Рисунок 1: Дизайн ChipX. Чип состоит из верхнего слоя из COC (толщина: 1 мм), в котором запечатлены восемь микрофлюидных каналов и резервуаров. Весь чип запечатан слоем КОК (толщина: 0,1 мм). Все каналы соединены с одним входом на левой стороне для одновременной инъекции образца и к отдельным резервуарам с правой стороны, в которых откладываются растворы кристаллизации. Каналы, которые составляют фактические камеры кристаллизации чипа, имеют длину 4 см и имеют поперечное сечение 80 мкм х 80 мкм. Этикетки (A1, A2, A3 и т.д.) тиснением вдоль каналов облегчают кристаллическое позиционирование под микроскопом и подготовку списка образцов для сбора данных. ChipX имеет размер стандартного слайда микроскопа (7,5 см x 2,5 см). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
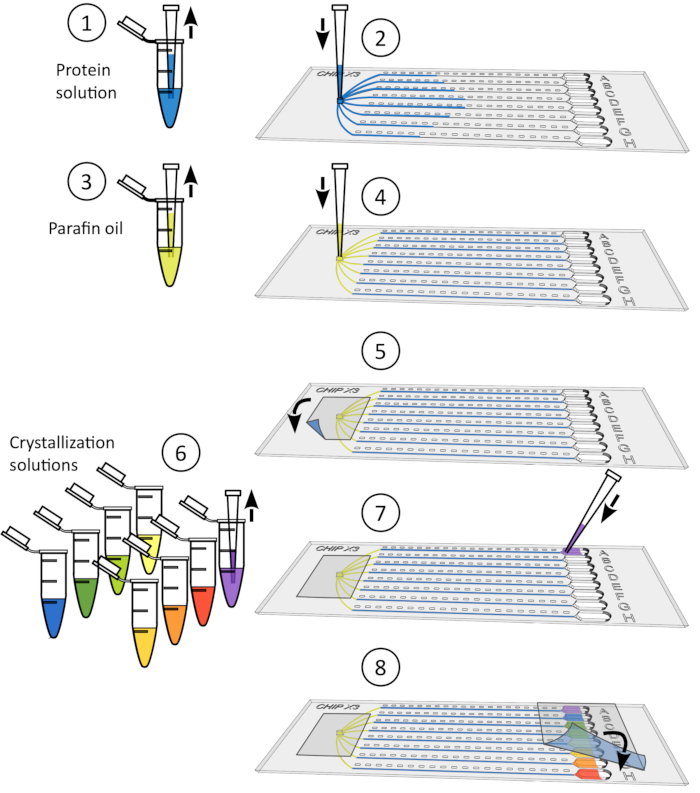
Рисунок 2: Настройка анализов кристаллизации в ChipX. 1) Депозит 5-6 МКЛ ферментных растворов с использованием стандартных 10 МКЛ пипетки и наконечника. 2) Введать наконечник вертикально в вводимый образец и ввести раствор в восьми каналах. 3) Пипет 1 йл парафинового масла. 4) Введать наконечник вертикально в образец вход и вводить масло для того, чтобы отключить каналы друг от друга. 5) Запечатать вход с куском ленты. 6) Pipet 5 йл раствора кристаллизации с использованием стандартных 10 МКЛ пипетки и наконечника. Решения могут отличаться в каждом резервуаре (например, от скринингового комплекта). 7) Ориентация наконечника трубы к входу канала в воронку в форме части резервуара (чтобы избежать образования воздушного пузыря при осаждении раствора) и впрыснуть кристаллический раствор в резервуар. 8) Печать резервуаров с куском ленты и инкубировать чип при контролируемой температуре. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Кристаллы фермента, добавляемого CCA, выращенного путем контрдиффузии в микрофлюидных каналах ChipX. Масштаб бара составляет 0,1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Рисунок 4: Процедура замачивания кристаллов. 1) Аккуратно удалите ленту из резервуаров. 2) Депозит до 5 МКЛ лигандового раствора с помощью микропайпа 10 МКЛ. 3) Добавить лиганд к одному или нескольким резервуарам. 4) Печать снова резервуаров с куском ленты и инкубировать чип под контролируемой температурой в течение 24-48 ч до сбора данных. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: След флуоресцентной маркировки дискриминирует белок (слева) от соли (справа) кристаллов. Ферментный раствор, добавляемый к CCA, содержал 0,4% (w/w) белка, помеченного карбоксиродом. Справа кристаллы освещаются источником света длиной 520 нм, а изображение делается с фильтром с низким проходом на уровне 550 нм (LP550); (вставка) структура карбоксиродамина-сукчинимидилестера. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 6: (Слева) Рисунок держателя ChipX и (справа) ChipX установлен на гониометре лучевой линии X06DA на SLS (Villigen, Швейцария) для серийного кристаллического анализа. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
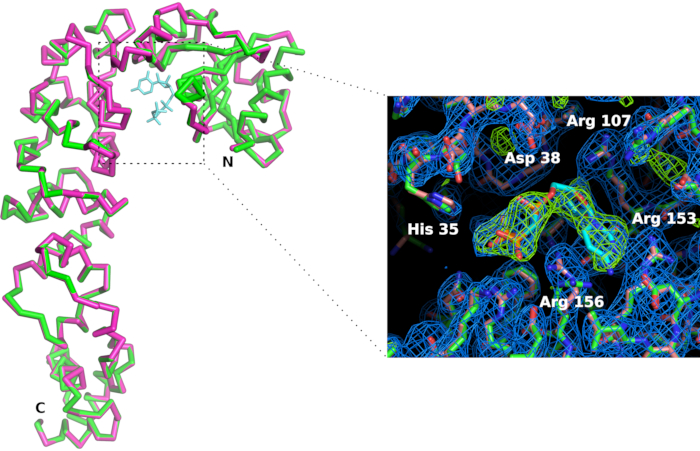
Рисунок 7: Сравнение фермента, добавляемого к CCA, активного участка в форме апо (розовый) и в комплексе с аналогом CTP (зеленым цветом). Хотя общая конформация фермента не влияет, связывание лиганда CMPcPP сопровождается небольшой реорганизацией боковых цепей в активном месте. Карта плотностиэлектронов Fo-Fc (синий цвет) очерчена на уровне 1,2 сигмы. Разница электронной плотности карты, очерченная на 4 сигмы (зеленым цветом), подтверждает наличие лиганда в активном участке. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Кристаллизованный образец | Фермент, добавляемый в CCA | Фермент, добавляемый в CCA, и CMPcPP |
| Кристаллический анализ | ||
| Рентгеновская лучевая линия | SLS - X06DA | SLS - X10SA |
| Длина волны (к) | 1.000 | 1.000 |
| Температура (K) | 293 | 293 |
| Детектор | Пилатус 2M-F | Пилатус 6М |
| Расстояние кристаллоискателя (мм) | 300 | 400 |
| Собранные кристаллы | 6 | 14 |
| Выбранные кристаллы | 5 | 5 |
| Диапазон вращения на изображение (к) | 0.1 | 0.2 |
| Время экспозиции на изображение (ы) | 0.1 | 0.1 |
| Нет. изображений, выбранных | 1000 | 540 |
| Общий диапазон вращения (к) | 100 | 108 |
| Космическая группа | P43212 | P43212 |
| a, c (к) | 71.5, 293.8 | 71.4, 293.6 |
| Средняя мозаичность (к) | 0.04 | 0.04 |
| Диапазон разрешения (к) | 46 – 2.54 (2.6 – 2.54) | 48 – 2.3 (2.4 – 2.3) |
| Итого Номер отражений | 176105 (9374) | 232642 (32937) |
| Нет. уникальных отражений | 23922 (1598) | 34862 (4066) |
| Полнота (%) | 90.6 (84.6) | 99.5 (100.0) |
| Избыточности | 7.5 (6.0) | 6.7 (8.1) |
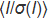 | 8.1 (1.3) | 6.9 (0.7) |
| Rmeas (%) | 18.6 (126.0) | 18.0 (231.2) |
| CC1/2 (%) | 98.7 (55.0) | 98.7 (46.9) |
| Общий коэффициент B из сюжета Уилсона(No 2) | 57.4 | 60.6 |
| Кристаллографическая утонченность | ||
| Нет. отражений, рабочего набора / тестового набора | 23583 / 1180 | 34840 / 3405 |
| Окончательный Rcryst (%) / Rбесплатно (%) | 18.8 / 21.4 | 20.0 / 22.9 |
| Нет. не-H атомов: общий / белок / лиганд / растворитель | 2998 / 2989 / 0 / 9 | 3057 / 2989 / 29 / 10 |
| R.m.s. отклонения для облигаций (я) / углы (к) | 0.009 / 1.23 | 0.010 / 1.22 |
| Средние факторы B(No 2): общий / белок / лиганд / растворитель | 60.1 / 60.1 / 0 / 52.7 | 62.5 / 62.6 / 60.1 / 55.5 |
| Рамачандран участок: наиболее благоприятствования (%) / разрешено (%) | 98.1 / 1.9 | 97.2 / 2.8 |
| Идентификатор PDB | 6IBP | от 6 до 52 евро |
Таблица 1: Статистика сбора и уточнения данных
- Независимая от избыточности Rmeas иHkl(N/N-1)1/2я | Ii(hkl)- Lt;I(hkl| ) /хкл яi i (hkl), где N является множественность данных 17.
Данные с низким уровнем «lt;I/σ(I)»gt; во внешнюю оболочку (Lt;2.0) были включены на основе критерия CC1/2 (корреляция между двумя случайными половинками набора данных в предложенном Karplus и Diederichs 18.
Обсуждение
Текущие протоколы в биокристаллографии включают в себя подготовку кристаллов с использованиемтаких методов, как диффузияпара или партия 13,14 , и их передача в микролупе длякрио-охлаждения 15,16 перед выполнением дифракции анализа в азотной струи в криогенных условиях. В отличие от этого, прямое кристаллическое крио-охлаждение не возможно в ChipX3 и кристаллы не могут быть извлечены из их микрофлюидного канала, который можно рассматривать как ограничения этой установки. Однако протокол, описанный в статье, предусматривает полностью интегрированный трубопровод для определения кристаллических структур при комнатной температуре (т.е. в более физиологических условиях). Несмотря на то, что сбор данных при комнатной температуреприводит к увеличению радиационного ущерба 19,этот эффект уравновешивается быстрым временем сбора данных (на каждом кристалле собирается максимальное вращение 60 градусов) и слиянием нескольких частичных наборов данных. Оба ChipX дизайн и материал были оптимизированы для уменьшения рассеяния фона и дифракциисигнала затухания 3, и сбор данных может быть выполнен на кристаллах с размерами, эквивалентными половине размера каналов (40 мкм)4.
Подводя итог, можно сказать, что основные преимущества протокола следующие. Кристаллы производятся в конвекционной среде (микрофлюидных каналах), что очень благоприятно для роста высококачественных кристаллов. Метод борьбы с диффузией, внедренный в ChipX, очень эффективен при скрининге ландшафта супернасыщения; диффузия кристаллантов в канал чипа создает концентрацию и волны супернасыщения, которая помогает определить соответствующие условия нуклеации и роста5. Кристаллы никогда непосредственно обрабатываются, но анализируются на месте, внутри чипа, который сохраняет их подлинные дифракционные свойства (т.е. не изменяет кристаллическую мозаику физическим взаимодействием или криоколированием)20. Дифракционный анализ проводится на серии кристаллов, распределенных по каналам чипа с низкой дозой воздействия, чтобы свести к минимуму повреждение излучения, и полный набор данных собирается путем слияния частичных данных из серии. Стандартный след и простой дизайн ChipX позволят в будущем полностью автоматизировать сбор данных на месте с использованием синхротрона или XFEL объектов. Все этапы протокола выполняются в ChipX. С точки зрения экспериментатора, установка чипов проста и проста в работе со стандартными трубами и не требует дополнительного оборудования. Соединение канала, похожее на дерево, на входе образца сводит к минимуму мертвые объемы в системе, что важно при работе с образцами, которые трудно очистить или которые доступны только в ограниченном количестве.
В заключение, подход «лаборатория-на-чипе», реализованный в ChipX, упрощает и эффективно миниатюризирует процесс кристаллизации путем определения контрдиффузии и кристаллической структуры, что позволяет перейти от образца к его 3D-структуре в одном устройстве. Он широко применим и предлагает удобное, экономически эффективное решение для обычных серийных исследований биокристаллографии при комнатной температуре.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Авторы признают Швейцарский Источник Света (Villigen, Швейцария) за выделение времени луча для проекта на лучах X10SA (PXII) и X06DA (PXIII), Александра Блюм за ее вклад в усовершенствование структуры, Кларисса Уорсдейл для записи закадрового голоса и Франсуа Шнелл (Страсбургский университет) за помощь в редактировании видео и SFX. Эта работа была поддержана Французским центром Национального де ла Recherche Scientifique (CNRS), Страсбургский университет, консорциум LabEx "NetRNA" (ANR-10-LABX-0036_NETRNA), phD-финансирование R.dW от инициативы Excellence (IdEx) Страсбургского университета в рамках французской национальной программы "Инвестиции д'Авенир", кандидат финансирования К.Р. от Франко-германского университета (UFA-DFH, грант нет. CT-30-19), Deutsche Forschungsgemeinschaft (грант No. Mo 634/10-1). Авторы воспользовались программой сотрудничества PROCOPE Hubert Curien (Министерство иностранных дел Франции и Deutscher Akademischer Austauschdienst).
Материалы
| Name | Company | Catalog Number | Comments |
| Axioscope A1 stereomicroscope | Zeiss | Crystal observation (step 3) | |
| Carboxyrhodamine succinimidyl ester | Invitrogen | C-6157 | Protein labeling (step 2) |
| CMPcPP | Jena Bioscience | NU-438 | Crystal soaking (step 4) |
| Crystal clear sealing tape | Hampton research | HR3-511 | ChipX sealing (step 1) |
| Parafin oil | Hampton research | HR3-411 | ChipX loading (step 1) |
| Ultimaker 2 extended+ | Ultimaker | 3D printer - Representative results | |
| UV light source | Xtal Concepts Gmbh | XtalLight100c | Crystal observation (step 3) |
| Zeba spin desalting column 7K MWCO | ThermoFisher Scientific | 89882 | Protein labeling (step 2) |
Ссылки
- Giegé, R., Sauter, C. Biocrystallography: past, present, future. HFSP Journal. 4 (3-4), 109-121 (2010).
- Dhouib, K., et al. Microfluidic chips for the crystallization of biomacromolecules by counter-diffusion and on-chip crystal X-ray analysis. Lab on a Chip. 9 (10), 1412-1421 (2009).
- Pinker, F., et al. ChipX: A Novel Microfluidic Chip for Counter-Diffusion Crystallization of Biomolecules and in Situ Crystal Analysis at Room Temperature. Crystal Growth & Design. 13 (8), 3333-3340 (2013).
- de Wijn, R., et al. A simple and versatile microfluidic device for efficient biomacromolecule crystallization and structural analysis by serial crystallography. IUCrJ. 6 (3), 454-464 (2019).
- García-Ruiz, J. M. A supersaturation wave of protein crystallization. Journal of Crystal Growth. 232 (1-4), 149-155 (2001).
- Otálora, F., Gavira, J. A., Ng, J. D., García-Ruiz, J. M. Counterdiffusion methods applied to protein crystallization. Progress in Biophysics and Molecular Biology. 101 (1-3), 26-37 (2009).
- Pusey, M., Barcena, J., Morris, M., Singhal, A., Yuan, Q., Ng, J. Trace fluorescent labeling for protein crystallization. Acta Crystallographica Section F Structural Biology Communications. 71 (7), 806-814 (2015).
- Meyer, A., Betzel, C., Pusey, M. Latest methods of fluorescence-based protein crystal identification. Acta Crystallographica Section F Structural Biology Communications. 71 (2), 121-131 (2015).
- Betat, H., Rammelt, C., Mörl, M. tRNA nucleotidyltransferases: ancient catalysts with an unusual mechanism of polymerization. Cellular and Molecular Life Sciences. 67 (9), 1447-1463 (2010).
- Ernst, F. G. M., Erber, L., Sammler, J., Jühling, F., Betat, H., Mörl, M. Cold adaptation of tRNA nucleotidyltransferases: A tradeoff in activity, stability and fidelity. RNA Biology. 15 (1), 144-155 (2018).
- Kabsch, W. XDS. Acta Crystallographica. Section D, Biological Crystallography. 66 (2), 125-132 (2010).
- Adams, P. D., et al. PHENIX: a comprehensive Python-based system for macromolecular structure solution. Acta Crystallographica. Section D, Biological Crystallography. 66 (2), 213-221 (2010).
- Dessau, M. A., Modis, Y. Protein Crystallization for X-ray Crystallography. Journal of Visualized Experiments. (47), e2285 (2011).
- Sauter, C., Lorber, B., McPherson, A., Giegé, R., Arnold, E., Himmel, D. M., Rossmann, M. G. Crystallization - General Methods. International Tables of Crystallography, Vol. F, Crystallography of Biological Macromolecules. , 99-120 (2012).
- Garman, E. "Cool" crystals: macromolecular cryocrystallography and radiation damage. Current Opinion in Structural Biology. 13 (5), 545-551 (2003).
- Li, D., Boland, C., Aragao, D., Walsh, K., Caffrey, M. Harvesting and Cryo-cooling Crystals of Membrane Proteins Grown in Lipidic Mesophases for Structure Determination by Macromolecular Crystallography. Journal of Visualized Experiments. (67), e4001 (2012).
- Diederichs, K., Karplus, P. A. Improved R-factors for diffraction data analysis in macromolecular crystallography. Nature Structural Biology. 4 (4), 269-275 (1997).
- Karplus, P. A., Diederichs, K. Linking Crystallographic Model and Data Quality. Science. 336 (6084), 1030-1033 (2012).
- de la Mora, E., Coquelle, N., Bury, C. S., Rosenthal, M., Holton, J. M., Carmichael, I., Garman, E. F., Burghammer, M., Colletier, J. -. P., Weik, M. Radiation damage and dose limits in serial synchrotron crystallography at cryo- and room temperatures. Proceedings of the National Academy of Sciences of the United States of America. 117 (8), 4142-4151 (2020).
- Nave, C. A. Description of Imperfections in Protein Crystals. Acta Crystallographica. Section D, Biological Crystallography. 54 (5), 848-853 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены