A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש באלקטרופורציה לאחר הלידה של In Vivo לחקר מורפולוגיה של נוירון גרגיר המוח הקטן והתפתחות סינפסה
In This Article
Erratum Notice
Summary
כאן אנו מתארים שיטה לדמיין סינפטוגנזה של נוירונים גרגיריים במוח הקטן של העכבר במהלך הזמן של התפתחות המוח לאחר הלידה, כאשר תאים אלה משכללים את המבנים הסינפטיים שלהם ויוצרים סינפסות כדי לשלב את עצמם במעגל המוח הכולל.
Abstract
תאי עצב עוברים שינויים דינמיים במבנה ובתפקוד שלהם במהלך התפתחות המוח כדי ליצור קשרים מתאימים עם תאים אחרים. המוח הקטן של המכרסם הוא מערכת אידיאלית למעקב אחר התפתחות ומורפוגנזה של סוג תא יחיד, נוירון הגרגיר הקטן (CGN), לאורך זמן. כאן, אלקטרופורציה in vivo של אבות נוירונים גרגיריים במוח הקטן המתפתח של עכבר שימשה כדי לתייג תאים בדלילות עבור ניתוחים מורפולוגיים הבאים. יעילותה של טכניקה זו מודגמת ביכולתה להציג שלבי התפתחות מרכזיים של הבשלת CGN, תוך התמקדות ספציפית בהיווצרות טפרים דנדריטיים, שהם מבנים מיוחדים שבהם תאים אלה מקבלים את רוב הקלט הסינפטי שלהם. בנוסף לאספקת תמונות של מבנים סינפטיים של CGN במהלך התפתחות המוח הקטן, טכניקה זו יכולה להיות מותאמת למניפולציה גנטית של נוירונים גרגיריים באופן אוטונומי של התא כדי לחקור את תפקידו של כל גן מעניין ואת השפעתו על מורפולוגיה של CGN, התפתחות טופרים וסינפטוגנזה.
Introduction
התפתחות המוח היא תהליך ממושך המשתרע מאמבריוגנזה לחיים שלאחר הלידה. במהלך הזמן הזה, המוח משלב שילוב של גירויים פנימיים וחיצוניים שמפסלים את החיווט של סינפסות בין דנדריטים ואקסונים כדי בסופו של דבר לכוון התנהגות. המוח הקטן המכרסם הוא מערכת מודל אידיאלית לחקר התפתחות הסינפסות מאחר שניתן לעקוב אחר התפתחותו של סוג נוירון יחיד, נוירון הגרגיר הקטן (CGN), כשהוא עובר מתא אב לתא עצב בוגר. זה נובע, בין השאר, מהעובדה שרוב קליפת המוח הקטן מתפתחת לאחר הלידה, מה שמאפשר מניפולציה גנטית קלה ותיוג תאים לאחר הלידה1.
ביונקים, התמיינות CGN מתחילה בסוף ההתפתחות העוברית כאשר תת-קבוצה של תאים מתרבים במוח האחורי נודדת מעל השפה המעוינת ויוצרת אזור נבט משני על פני המוח הקטן 2,3,4. למרות שהם מחויבים באופן מלא לזהות אב נוירון גרגיר (GNP), תאים אלה ממשיכים להתרבות בתוך החלק החיצוני של שכבת הגרגיר החיצונית (EGL) עד היום שלאחר הלידה 14 (P14). התפשטות שכבה זו גורמת להתרחבות מסיבית של המוח הקטן מכיוון שתאים אלה יוצרים באופן בלעדי CGNs5. ברגע ש-CGNs שזה עתה נולדו יוצאים ממחזור התא ב-EGL, הם נודדים פנימה לכיוון שכבת הגרגיר הפנימית (IGL), ומשאירים אחריהם אקסון שיתפצל וינוע בשכבה המולקולרית של המוח הקטן, ויוצר סיבים מקבילים שסינפסות על תאי Purkinje6. מיקומם של סיבים אלה בתוך השכבה המולקולרית תלוי בתזמון היציאה של מחזור התא.
CGNs שמתמיינים ראשונים משאירים את הסיבים המקבילים שלהם לכיוון תחתית השכבה המולקולרית, בעוד שהאקסונים של CGNs שמתמיינים מאוחר יותר מקובציםב-7,8 העליונים. ברגע שגופי תאי CGN מגיעים ל-IGL, הם מתחילים לפרט דנדריטים וליצור סינפסות עם נוירונים מעכבים ומעוררים סמוכים. העץ הדנדריטי הבוגר של CGN מציג ארכיטקטורה סטריאוטיפית עם ארבעה תהליכים עיקריים. במהלך הבשלת CGN, המבנים בקצה הדנדריטים הללו יוצרים טופר המועשר בחלבונים פוסט-סינפטיים 9,10. מבנים מיוחדים אלה, הנקראים טפרים דנדריטיים, מכילים את רוב הסינפסות על תאי עצב גרגיריים והם חשובים לקבלת קלט מעורר מעצבובים של סיבי טחב שמקורם בפונס, כמו גם קלט מעכב מתאי גולג'י מקומיים. לאחר ההגדרה המלאה, הקשרים הסינפטיים של CGNs מאפשרים לתאים אלה להעביר קלט מגרעיני קדם-המוח הקטן לתאי Purkinje, אשר מקרינים מתוך קליפת המוח הקטן אל גרעיני המוח הקטן העמוקים.
אלקטרופורציה לאחר הלידה של תל"ג לאחר הלידה היא יתרון על פני שיטות אחרות מבוססות תיוג, כגון זיהום ויראלי ויצירת קווי עכברים טרנסגניים, מכיוון שניתן להשיג את הביטוי של מבנים רצויים על ציר זמן מהיר, והשיטה מכוונת לאוכלוסייה קטנה של תאים, שימושי בחקר השפעות אוטונומיות של תאים. שיטה זו שימשה במחקרים קודמים לחקר התפתחות מורפולוגית של CGNs; עם זאת, מחקרים אלה התמקדו בנקודת זמן אחת או בחלון זמן קצר 9,10,11,12,13. שיטת תיוג זו שולבה עם ניתוח תמונה כדי לתעד את השינויים במורפולוגיית CGN המתרחשים לאורך כל מהלך התמיינות CGN במהלך שלושת השבועות הראשונים לחיים שלאחר הלידה. נתונים אלה חושפים את הדינמיקה של התפתחות דנדריט CGN העומדת בבסיס בניית מעגלים צרבלריים.
Protocol
הערה: כל ההליכים בוצעו תחת פרוטוקולים שאושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת דיוק (IACUC).
1. הכנת DNA לאלקטרופורציה in vivo או IVE (יום אחד לפני הניתוח)
- אספו את החומרים הבאים: DNA מטוהר (0.5-25 מיקרוגרם לכל חיה), 3 M נתרן אצטט, אתנול, צבע ירוק מהיר, מים מזוקקים טהורים במיוחד, תמיסת חיץ פוספט (PBS) (ראה טבלת חומרים).
הערה: עבור DNA, מבנה המבטא חלבון פלואורסצנטי ירוק (GFP) תחת מקדם יוביקוויטין אנושי התקבל מ- Addgene (FUGW, https://www.addgene.org/14883/). כל מבנה המבטא GFP או חלבון פלואורסצנטי אחר תחת שליטה של מקדם בכל מקום צריך לעבוד. תיוג ספציפי ל-CGN בטכניקה זו אינו תלוי במבנה, אלא באלקטרופורציה. - הכינו את הדנ"א לאלקטרופורציה על ידי ערבוב כמות הדנ"א הרצויה, 10% בנפח של 3 M נתרן אצטט ו-250% בנפח של 100% אתנול קר כקרח. שימו לב שהדנ"א ייצא מהתמיסה באופן מיידי.
- המשך לזרז את תערובת ה- DNA לילה ב -20 ° C או במשך שעה ב -80 ° C.
- גלולה זירזה DNA בצנטריפוגה שולחנית במשקל של >16,000 × גרם ושטפה פעמיים עם 70% אתנול.
- יש לאפשר לכדורית הדנ"א להתייבש לחלוטין, וליצור אותה מחדש בתמיסה 1x PBS + 0.02% Fast Green.

איור 1: הגבלת עומק ההזרקה ל-1.5 מ"מ באמצעות ספייסר. (A) קטע של 11.2 מ"מ נחתך פיפטת העמסה באמצעות סכין גילוח. (B) הספייסר מותקן על קצה מזרק המילטון (האורך הכולל הוא 1.27 ס"מ או 0.5 אינץ') ומאובטח באמצעות דבק או פרפילם. הקצה החשוף צריך להיות באורך 1.5 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. אלקטרופורציה In vivo של אבות נוירונים גרגיריים בעכברים בני שבעה ימים לאחר הלידה
הערה: כל ניתוחי האלקטרופורציה בוצעו בחדר ניתוחים סטרילי ומאוורר מאוד, וכל אנשי הצוות לבשו ציוד מגן אישי מלא כולל כפפות, מסכת פנים, מצנפת לשיער, חלוק וכיסויי נעליים. לחילופין, ניתן לבצע את הניתוחים במכסה מנוע מונשם וסטרילי.
- אספו את החומרים הבאים: DNA לאלקטרופורציה, מספריים כירורגיים קטנים, פינצטה כירורגית קטנה, מזרק המילטון בהתאמה אישית, מוליך קצה כותנה, כרית חימום, בטדין, אתנול 70%, 1x PBS, פרפילם, דבק רקמות (n-butyl-ester cyanoacrylate), איזופלורן, אלקטרופורטור ואלקטרודות מסוג טוויטר (ראו טבלת חומרים).
- חתכו ספייסר מקצה העמסה מעוקר כדי להתאים מעל מזרק המילטון כדי להגביל את עומק ההזרקה ל-1.5 מ"מ (איור 1A,B). אבטחו את הספייסר באמצעות דבק או פרפילם.
- מרדימים את גור P7 בתא איזופלורן בקצב לידה של 0.8 ליטר/דקה. אשרו הרדמה מלאה על-ידי ניטור החיה לירידה בנשימה והיעדר תגובת צביטה בבוהן או בזנב (איור 2A).
- לאחר הרדמה מלאה, הניחו את הגורים על כן המצויד בחרוט אף, המספק איזופלורן קבוע של 4% בקצב אספקה של 0.8 ליטר/דקה. נקו את החלק העליון של ראש הגור 3 פעמים עם מקלון סטרילי של בטאדין ואז 70% אתנול, לסירוגין בין השניים, כדי להכין את האתר. הניחו לתמיסה להתייבש לפני שתמשיכו.
- באמצעות זוג מספריים מעוקרים, בצעו חתך קטן עם חתך אחד שמשתרע על פני המרחק מהחלק העליון לבסיס האוזניים כדי לחשוף את המוח האחורי (איור 2B).
- אתרו את המוח הקטן (איור 2C), הכניסו את הקצה החשוף של מזרק המילטון דרך הגולגולת, בניצב למוח, והזריקו 1.5 מיקרוליטר של תערובת דנ"א לתוך הפרנכימה של המוח הקטן על-ידי דחיפה איטית של הבוכנה האחורית של המזרק. לאחר מסירת תערובת הדנ"א, משכו באיטיות את המחט לאחור כדי למנוע שפיכת גב, ואפשרו לתמיסת הדנ"א להתפזר במשך 30 שניות.
- כבו את האיזופלורן והניחו את הגור על כרית חימום בטמפרטורה של 37 מעלות צלזיוס. הכינו את האלקטרודה מסוג טוויטר לאלקטרופורציה על ידי טבילת שני הקצוות לתוך PBS סטרילי 1x.
הערה: הרטבת האלקטרודה מסוג טוויטר תמנע כוויות מגע על עור הגור במהלך מתן הפולסים החשמליים. - כוונו את אלקטרודת הטוויטר מעל אתר ההזרקה, כאשר קצה הפלוס פונה כלפי מטה והקצה השלילי מעל ראשה של החיה (איור 2D). נהל חמישה פולסים חשמליים מהאלקטרופורטור עם ההגדרות הבאות: מרווח בין פולסים של 50 אלפיות השנייה, 130 וולט ו- 950 אלפיות השנייה.
הערה: במידת הצורך, בצעו הזרקת בדיקה כדי לוודא שאתר ההזרקה ממוקם על ורמיס המוח הקטן (איור 2E). - צבטו את החתך סגור, ואטמו את הפצע בדבק רקמת ציאנואקרילט n-butyl-ester לא רעיל. נקה את הפצע עם אתנול 70% כמו כל כמות זעירה של דם מגדיל את הסבירות של רצח תינוקות ההורים קניבליזם.
- אפשרו לבעל החיים להתאושש על כרית חימום בטמפרטורה של 37 מעלות צלזיוס לפני שתחזירו את הגור לסכר. יש לעקוב אחר הגור(ים) כל 30 דקות במשך שעתיים לפחות לאחר הניתוח כדי להבטיח החלמה מלאה.
הערה: רצח תינוקות על ידי כל אחד מההורים הוא די נפוץ. כדי למנוע קניבליזם, אכסנו את הצופר בכלוב אחר לפני תחילת ההתחשמלות, ותמיד החזירו גורים נקיים והתאוששו (כלומר , ללא כתם דם, ניידים לחלוטין) לכלוב המקורי על המצע המקורי. ניתן גם לנגב גורים עם גללים מהכלוב המקורי כדי למזער את ריח הדם. השימוש בסכר חלופי עשוי להיות נחוץ אם הסכר המקורי ימשיך לבצע קניבליזציה לגורים שלה.
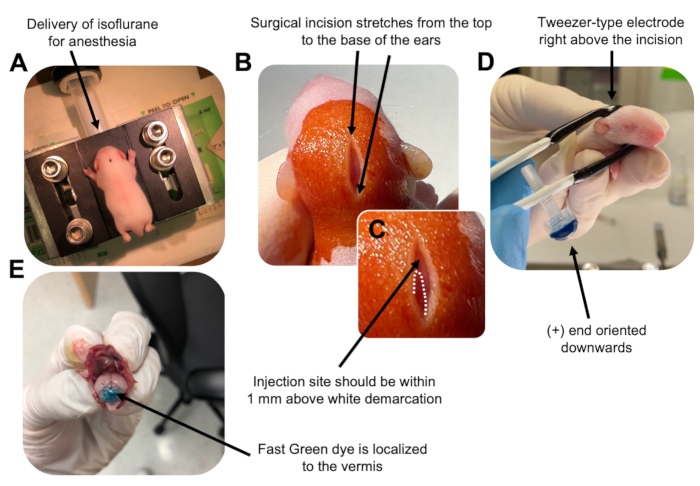
איור 2: אלקטרופורציה במוח הקטן In vivo של אבות נוירונים גרגיריים בגורי עכברים מסוג פרא P7. (A) גורים מורדמים עם 4% איזופלורן המועבר בקצב של 0.8L/min כדי להבטיח הרדמה לאורך כל הזרקת תמיסת ה- DNA. איזופלורן מועבר בקצב של 0.8 ליטר/דקה. (B) לאחר עיקור העכבר 3 פעמים עם בטאדין ו-70% אתנול, נעשה חתך המשתרע על פני מרחק האוזניים, וחושף את המוח האחורי. (C) תמונה מוגדלת של תיחום לבן על הגולגולת, נקודת ציון לאתר ההזרקה. מבנה DNA צריך להיות מוזרק בתוך 1 מ"מ מעל הסימן; קווים מקווקוים מתארים את התיחום, וחץ שחור מציין את אתר ההזרקה. הרכסים של ורמיס המוח הקטן עשויים להיות גלויים לעין ויכולים להיות שימושיים למציאת אתר ההזרקה. (D) כיוון אלקטרודה מסוג פינצטה לאלקטרופורציה יעילה. קצה פלוס (+) חייב להיות מכוון כלפי מטה כדי למשוך DNA טעון שלילית לתוך פרנכימה cerebellar לפני מתן פולסים חשמליים. (E) הזרקת בדיקה של 1 μL של 0.02% צבע ירוק מהיר מראה שההזרקה ממוקמת לאמצע ורמיס המוח הקטן בין אונות 5-7. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. אימונוהיסטוכימיה של CGNs מחושמלים
- אספו את החומרים הבאים: איזופלורן, 1x PBS, 4% פרפורמלדהיד (PFA), 30% סוכרוז, סרום עיזים רגיל, חומר ניקוי לא יוני, שקופיות זכוכית, כיסויי זכוכית, לק, מצעי הרכבה, צבע גרעיני Hoechst ונוגדנים ראשוניים ומשניים מתאימים (ראו טבלת חומרים).
- מרדימים את חיית הניסוי עם isoflurane, ולאשר הרדמה מלאה עם בוהן וזנב צביטה.
- בצע זילוח לב על ידי הזרקה איטית של 1x PBS ו 4% PFA לחדר השמאלי של הלב של החיה. אפשר את הדם להתנקז מן החיה על ידי חיתוך vena cava.
- תקן את המוח בן לילה על ידי טבילתו ב 4% PFA ב 4 ° C. למחרת, שטפו במהירות את המוח עם PBS 1x, והעבירו את המוח ל-30% סוכרוז ב-1x PBS להגנה קריואקטיבית למשך 24 שעות לפחות.
- במידת הצורך, חתכו את המוח לשניים לאורך הציר הרוסטרלי-קאודלי, ואשרו את ביטוי מבנה הכתב הנגוע באמצעות מיקרוסקופ ניתוח פלואורסצנטי זקוף.
הערה: שמור את המוח שקוע ב 1x PBS בצלחת קטנה כדי למנוע ממנו להתייבש. - הרכיבו את המוח על מיקרוטום מקפיא, חתכו 25 מיקרומטר של קטעי קשת, ואפשרו למקטעים להתפתח בתערובת של 1:1 של 1x PBS וגליצרול.
הערה: ניתן לאחסן מקטעים בתמיסת הגנה קריופרוטקטורית זו בטמפרטורה של -20°C לאחסון לטווח ארוך. - יש לשטוף את המקטעים שלוש פעמים ב-1x PBS למשך 10 דקות כל אחד כדי להסיר חומר הגנה קריופרוטקטיבי, ולחסום את הרקמה ב-1x PBS + סרום עיזים רגיל 10% + 0.2% חומר ניקוי לא יוני על שייקר אורביטלי בטמפרטורת החדר למשך שעה אחת.
- הכינו תמיסת נוגדנים ראשונית: 1x PBS, 10% סרום עיזים רגיל, 0.2% חומר ניקוי לא יוני ונוגדן נגד GFP, וצנטריפוגה את התמיסה למשך 5 דקות ב >16,000 × גרם. לדגור על חלקים בתמיסת הנוגדנים ב 4 ° C על שייקר מסלולית במשך 48 שעות.
- יש לשטוף את תמיסת הנוגדנים הראשונית למשך 15 דקות חמש פעמים עם 1x PBS + 0.2% חומר ניקוי לא יוני.
- הכינו תמיסת נוגדנים משנית: 1x PBS, 10% סרום עיזים רגיל, 0.2% חומר ניקוי לא יוני, ונוגדן משני מתאים לזיהוי GFP; צנטריפוגה התמיסה ב >16,000 × גרם. יש לדגור על חלקים בתמיסת הנוגדנים על שייקר אורביטלי בטמפרטורת החדר למשך 2-3 שעות. יש להגן על המקטעים מפני חשיפה לאור כדי למנוע הלבנה.
- יש לשטוף את תמיסת הנוגדנים המשנית שלוש פעמים עם 1x PBS + 0.2% חומר ניקוי לא יוני למשך 15 דקות בכל פעם. יש לדגור על מקטעים ב-1x PBS + Hoechst למשך 5 דקות כדי להכתים גרעינים.
- יש לשטוף את תמיסת Hoechst עם 1x PBS + 0.2% חומר ניקוי לא יוני ולהרכיב על מגלשות זכוכית. כסו את המקטעים באמצעי הרכבה, כסו את המגלשות ואטמו את המגלשה בלק כדי למנוע אידוי.
4. אנליזות מורפולוגיות של CGNs - שחזור תלת מימדי (3D) ושטח פנים ונפח תאי
- צלם CGNs מחושמלים בודדים במיקרוסקופ קונפוקלי ביעד של 63x עם זום של 2x, וצלם תמונות מחסנית z במהירות של 0.5 מיקרומטר לערימה. צייר תא אחד בכל חלון תמונה כדי לאפשר ניתוח ושחזור תמונה בקלות.
- התקן את התוסף Simple Neurite Tracer עבור FIJI באמצעות הקישור הבא (https://imagej.net/Simple_Neurite_Tracer:_Basic_Instructions) כדי לעקוב בקלות וביעילות אחר המבנה של CGNs מחושמלים במרחב תלת-ממדי (3D).
הערה: קיימת גרסה מעודכנת של התוסף (https://imagej.net/SNT). - נתח את אורך הנוירוט ואת היווצרות הטופר הדנדריטי באופן עיוור באמצעות מעקב נוריט פשוט. העלה תמונות z-stack חד-ערוציות של CGNs מחושמלים לפיג'י, ולחץ על תוספים | סגמנטציה | פשוט Neurite Tracer (איור 3D).
- גש לתפריט הנפתח ובחר צור מציג תלת-ממד חדש (איור 3D).
- גלול לבסיס של דנדריט, שם הוא מתחבר לסומה התא והתחל נתיב על ידי לחיצה על הצומת. עקוב ידנית אחר הנתיב על-ידי לחיצה בין המקטעים שבהם אות מילוי התא בהיר ביותר, והקש [y] כדי לשמור על המעקב. עקבו עד סוף הדנדריט אם הוא אינו מכיל טופר או עד בסיס הטופר ואשרו את הנתיב על-ידי לחיצה על [f] (איור 4D).
- לאחר מכן, עקוב אחר הטופר על ידי התחלת נתיב בבסיס המבנה ומעקב עד סוף הנוריץ הארוך ביותר. עקוב אחר ענפים משניים ושלישוניים על-ידי החזקת [ctrl] לחוץ ב- Windows או [alt] ב- Mac OS ולחיצה על הנתיב. אשר את הנתיב על-ידי הקשה על [f].
- שימו לב שהמדידות לעקבות נראות בחלון נפרד; חבר את כל המדידות של ענפי הטופר (ראשוני, משני, שלישוני) כדי לקבל את האורך הכולל של כל טופר.
- לניתוח שטח הפנים והנפח התאי של CGNs מחושמלים, הורד את תוכנת ניתוח תאי Imaris (https://imaris.oxinst.com/).
הערה: ניתן להשתמש בפיג'י גם כדי לבנות מחדש תאים בתלת-ממד מתמונות מחסנית z באמצעות תוספים זמינים וחינמיים. בנוסף, קיימת תכונת עיבוד נפחי ב- Simple Neurite Tracer אך נעשה שימוש ב- Imaris מהסיבות המפורטות להלן. - העלה תמונת z-stack של CGN מחושמל ל- Imaris. גש לערכת הכלים לשחזור תלת-ממד על-ידי הקשה על Surpass.
- לבנייה מחדש של ה- CGN, הקש Surfaces ובחר אזור עניין המקיף את כל התא בחלון התמונה. לאחר שתסיים, לחץ על החץ הכחול קדימה בפינה השמאלית התחתונה תחת צור.
- אם התמונה כוללת ערוצים מרובים לאותות שונים, בחרו בערוץ הכולל את ה-CGN המחושל ולחצו על החץ הכחול קדימה.
- באמצעות סרגל השקופיות, הגדר סף רצוי המתאים בצורה המדויקת ביותר לאות של התא המחושמל. התקרב לפני השטח של התא כדי לקבוע במדויק את הסף. לאחר שתסיים, הקש על החץ הירוק הכפול כדי לבנות מחדש את התא ולקבל את שטח הפנים וגודל הנפח מהמטה-נתונים.
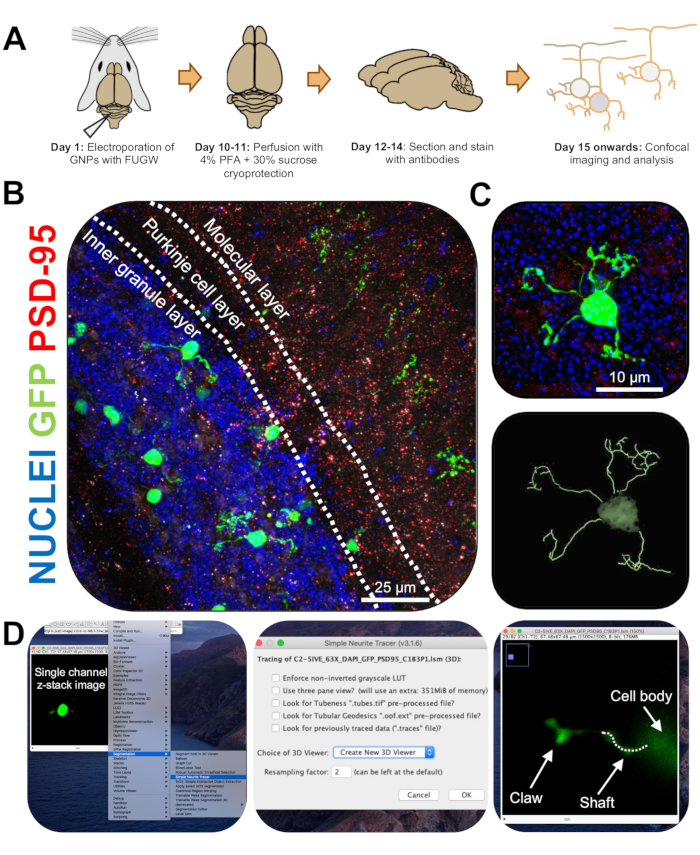
איור 3: אנליזה אימונוהיסטוכימית ושחזור תלת-ממדי של נוירונים גרגיריים מחושמלים. עכברי P7 CD-1 התחשמלו באמצעות מבנה המבטא GFP. המוחות נאספו ועברו אימונוהיסטוכימיה, מיקרוסקופ קונפוקלי ושחזור תלת-ממדי לצורך ניתוח מורפולוגי. (A) ציר זמן מאלקטרופורציה לעיבוד תמונה של עכבר 10-DPI. (B) תמונת הקרנה מרבית של חתך סגיטלי של המוח הקטן המחושמל 10-DPI; קווים לבנים תוחמים שכבות צרבלריות, וסרגל קנה המידה הוא 25 מיקרומטר. (C) תמונת הקרנה מרבית של נוירון גרגיר מחושמל יחיד 10-DPI והעקבה התלת-ממדית המתאימה סרגל קנה המידה הוא 10 מיקרומטר. (D) שחזורים תלת-ממדיים נוצרו באמצעות תוסף FIJI Simple Neurite Tracer. כל המדידות אותרו דרך ערימת z, בעקבות אות מילוי התא. מדידות פיר וטופר אותרו בנפרד עבור כל דנדריט; קו מקווקו מציין חלק מהדנדריט בתוך המישור הנוכחי. קיצורים: תלת מימד = תלת מימדי; GFP = חלבון פלואורסצנטי ירוק; DPI = ימים לאחר ההזרקה; PSD-95 = חלבון צפיפות פוסט-סינפטית 95; GNPs = אבות נוירונים גרגיריים; PFA = paraformaldehyde. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
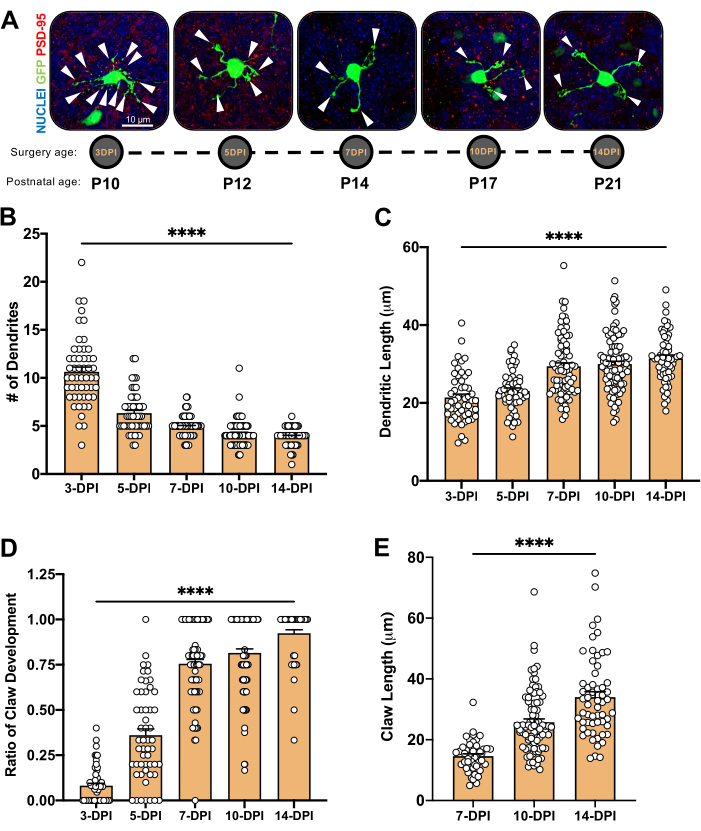
איור 4: ניתוח המורפולוגיה של נוירוני הגרגיר במהלך התפתחות המוח הקטן. (A) תמונות הקרנה מרביות של CGNs מחושמלים מ-3-DPI עד 14-DPI (גיל P10 עד P21 לאחר הלידה), גרעינים (כחול) ו-GFP (ירוק); ראשי חץ מציינים דנדריט בודד, וסרגל קנה המ?...
Discussion
נוירוני גרגיר המוח הקטן הם תאי העצב הנפוצים ביותר במוח היונקים, ומהווים כמעט 60-70% מכלל אוכלוסיית תאי העצב במוח המכרסם 1,14. המוח הקטן נמצא בשימוש נרחב כדי להבהיר מנגנונים של התפשטות תאים, נדידה, היווצרות דנדריטים והתפתחות סינפסות 6,9,10,11,15,16,17,18,19,20
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
העבודה נתמכה על ידי מענקי NIH R01NS098804 (A.E.W.), F31NS113394 (U.C.), ותוכנית הקיץ למדעי המוח של אוניברסיטת דיוק (D.G).
Materials
| Name | Company | Catalog Number | Comments |
| Betadine | Purdue Production | 67618-150-17 | |
| Cemented 10 µL needle | Hamilton | 1701SN (80008) | 33 gauge, 1.27 cm (0.5 in), 4 point style |
| Chicken anti-GFP | Millipore Sigma | AB16901 | Our lab uses this antibody at a 1:1000 concentration |
| Cotton-tip applicator | |||
| Donkey anti-chicken Cy2 | Jackson ImmunoResearch | 703-225-155 | Our lab uses this antibody at a 1:500 concentration |
| Ethanol (200 proof) | Koptec | V1016 | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0052 | |
| Fast Green FCF | Sigma | F7252-5G | |
| FUGW plasmid | Addgene | 14883 | |
| Glass slides | VWR | 48311-703 | Superfrost plus |
| Glycerol | Sigma-Aldrich | G5516 | |
| Heating pad | Softheat | ||
| Hoescht 33342 fluorescent dye | Invitrogen | 62249 | |
| Imaris | Bitplane | ||
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Micro cover glass | VWR | 48382-138 | |
| Nail polish | Sally Hansen | Color 109 | |
| Normal goat serum | Gibco | 16210064 | |
| O.C.T. embedding compound | Tissue-Tek | 4583 | |
| Olympus MVX10 Dissecting Scope | Olympus | MVX10 | |
| P200 pipette reach tip | Fisherbrand | 02-707-138 | Used for needle spacer |
| Parafilm | Bemis | PM-996 | |
| PBS pH 7.4 (10x) | Gibco | 70011-044 | |
| Simple Neurite Tracer | FIJI | https://imagej.net/Simple_Neurite_Tracer:_Basic_ Instructions | |
| Sucrose | Sigma | S0389 | |
| Surgical tools | RWD Life Science | Small scissors and tweezers | |
| Triton X-100 | Roche | 11332481001 | non-ionic detergent |
| Tweezertrodes | BTX Harvard Apparatus | 45-0489 | 5 mm, platinum plated tweezer-type electrodes |
| Ultrapure distilled water | Invitrogen | 10977-015 | |
| Vectashield mounting media | Vectashield | H1000 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Zeiss 780 Upright Confocal | Zeiss | 780 |
References
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- Rahimi-Balaei, M., Bergen, H., Kong, J., Marzban, H. Neuronal migration during development of the cerebellum. Frontiers in Cellular Neuroscience. 12, 484 (2018).
- Alder, J., Cho, N. K., Hatten, M. E. Embryonic precursor cells from the rhombic lip are specified to a cerebellar granule neuron identity. Neuron. 17 (3), 389-399 (1996).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annual Review of Neuroscience. 18, 385-408 (1995).
- Ben-Arie, N., et al. Math1 is essential for genesis of cerebellar granule neurons. Nature. 390 (6656), 169-172 (1997).
- Borghesani, P. R., et al. BDNF stimulates migration of cerebellar granule cells. Development. 129 (6), 1435-1442 (2002).
- Espinosa, J. S., Luo, L. Timing neurogenesis and differentiation: insights from quantitative clonal analyses of cerebellar granule cells. Journal of Neuroscience. 28 (10), 2301-2312 (2008).
- Markwalter, K. H., Yang, Y., Holy, T. E., Bonni, A. Sensorimotor coding of vermal granule neurons in the developing mammalian cerebellum. Journal of Neuroscience. 39 (34), 6626-6643 (2019).
- Shalizi, A., et al. PIASx is a MEF2 SUMO E3 ligase that promotes postsynaptic dendritic morphogenesis. Journal of Neuroscience. 27 (37), 10037-10046 (2007).
- Shalizi, A., et al. A Calcium-regulated MEF2 sumoylation switch controls poststynaptic differentiation. Science. 311 (5763), 1012-1017 (2006).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303 (5660), 1026-1030 (2004).
- Holubowska, A., Mukherjee, C., Vadhvani, M., Stegmuller, J. Genetic manipulation of cerebellar granule neurons in vitro and in vivo to study neuronal morphology and migration. Journal of Visualized Experiments: JoVE. (85), e51070 (2014).
- Yang, Y., et al. Chromatin remodeling inactivates activity genes and regulates neural coding. Science. 353 (6296), 300-305 (2016).
- Herculano-Houzel, S. Coordinated scaling of cortical and cerebellar numbers of neurons. Frontiers in Neuroanatomy. 4, 12 (2010).
- Wilson, P. M., Fryer, R. H., Fang, Y., Hatten, M. E. Astn2, a novel member of the astrotactin gene family, regulates the trafficking of ASTN1 during glial-guided neuronal migration. Journal of Neuroscience. 30 (25), 8529-8540 (2010).
- Kokubo, M., et al. BDNF-mediated cerebellar granule cell development is impaired in mice null for CaMKK2 or CaMKIV. Journal of Neuroscience. 29 (28), 8901-8913 (2009).
- Schwartz, P. M., Borghesani, P. R., Levy, R. L., Pomeroy, S. L., Segal, R. A. Abnormal cerebellar development and foliation in BDNF-/- mice reveals a role for neurotrophins in CNS patterning. Neuron. 19 (2), 269-281 (1997).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. Journal of Neuroscience. 15 (7), 4970-4981 (1995).
- Zhou, P., et al. Polarized signaling endosomes coordinate BDNF-induced chemotaxis of cerebellar precursors. Neuron. 55 (1), 53-68 (2007).
- Dhar, M., Hantman, A. W., Nishiyama, H. Developmental pattern and structural factors of dendritic survival in cerebellar granule cells in vivo. Scientific Reports. 8 (1), 17561 (2018).
- Ito, M. Synaptic plasticity in the cerebellar cortex and its role in motor learning. Canadian Journal of Neurological Sciences. 20, 70-74 (1993).
- Jorntell, H., Hansel, C. Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron. 52 (2), 227-238 (2006).
- Nakanishi, S. Genetic manipulation study of information processing in the cerebellum. Neuroscience. 162 (3), 723-731 (2009).
- Chang, C. H., et al. Atoh1 controls primary cilia formation to allow for SHH-triggered granule neuron progenitor proliferation. Developmental Cell. 48 (2), 184-199 (2019).
Erratum
Formal Correction: Erratum: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development
Posted by JoVE Editors on 4/06/2023. Citeable Link.
An erratum was issued for: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development. A figure was updated.
Figure 2 was updated from:
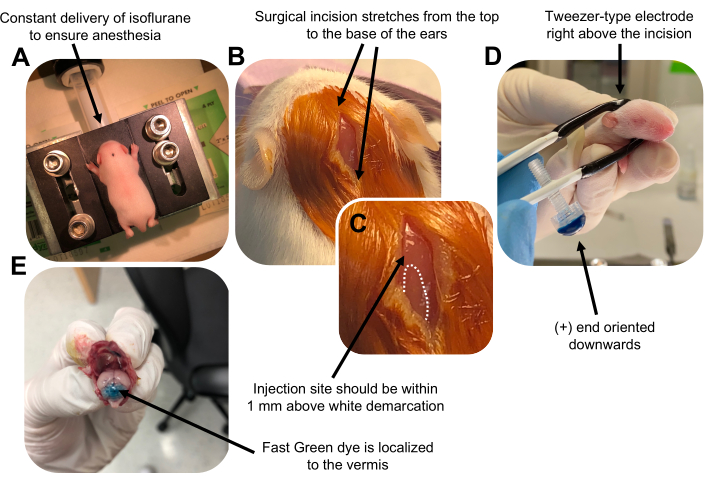
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
to:

Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved