Method Article
הדמיה של קוצים דנדריטיים בקאנורהבדיטיס אלגנס
In This Article
Summary
עמודי שדרה דנדריטים הם מאפיינים תאיים חשובים של מערכת העצבים. כאן מתוארות שיטות הדמיה חיות להערכת המבנה והתפקוד של קוצים דנדריטיים ב - C. elegans. גישות אלה תומכות בפיתוח מסכים מוטנטיים לגנים המגדירים צורה או תפקוד של עמוד שדרה דנדריטי.
Abstract
קוצים דנדריטיים הם אתרים מיוחדים של עצבנות סינפטית המווסתת על ידי פעילות ומשמשים כמצעים ללמידה ולזיכרון. לאחרונה, קוצים דנדריטיים תוארו עבור נוירונים DD GABAergic כאתרי קלט של נוירונים כולינרגיים presynaptic במעגל המוטורי של Caenorhabditis elegans. מעגל סינפטי זה יכול כעת לשמש כמודל in vivo חדש ורב עוצמה של מורפוגנזה ותפקוד של עמוד השדרה המנצל את הגנטיקה הפאסילית ואת הנגישות המוכנה של C. elegans להדמיית תאים חיים.
פרוטוקול זה מתאר אסטרטגיות ניסיוניות להערכת המבנה והתפקוד של עמוד השדרה DD. בגישה זו, נעשה שימוש באסטרטגיית הדמיה ברזולוציה גבוהה במיוחד כדי להמחיש את הצורות המורכבות של קוצים דנדריטיים עשירים באקטין. כדי להעריך את תפקוד עמוד השדרה DD, האופסין המופעל על ידי אור, Chrimson, מגרה את הנוירונים הכולינרגיים הקדם-סינפטיים, ומחוון הסידן, GCaMP, מדווח על ארעי הסידן המעוררים בקוצים DD פוסט-סינפטיים. יחד, שיטות אלה מרכיבות גישות רבות עוצמה לזיהוי דטרמיננטות גנטיות של קוצים דנדריטיים ב - C. elegans שיכולים גם לכוון את המורפוגנזה של עמוד השדרה ולתפקד במוח.
Introduction
קוצים דנדריטיים הם מבנים תאיים מיוחדים המקבלים קלט מתאי עצב שכנים להעברה סינפטית. הפעלה של קולטני מוליכים עצביים מעלה את מסלולי הסידן והאיתות התוך-תאיים במורד הזרם בבליטות עצביות אופייניותאלה 1. בגלל החשיבות הבסיסית של קוצים דנדריטיים להעברה עצבית והרגולציה השגויה שלהם במחלות נוירו-התפתחותיות1, גילוי הגורמים המווסתים את המורפוגנזה והתפקוד של עמוד השדרה הדנדריטי מעניין מאוד את תחום מדעי המוח.
לאחרונה זוהו קוצים דנדריטיים במערכת העצבים C. elegans בהתבסס על מאפיינים מרכזיים המשותפים לקוצים של יונקים2. קביעה זו היא חיונית משום שהיא פותחת את האפשרות לנצל את היתרונות של C. elegans כדי לחקור ביולוגיה של עמוד השדרה. עמודי שדרה דנדריטיים בתאי עצב מוטוריים מסוג Dorsal D (DD) מקבלים קלט מנוירונים כולינרגיים (VA ו-VB) בחוט העצב הגחוני (איור 1A)2,3,4. כאן מוצגות שיטות הדמיה כדי לחקור את המבנה של קוצים דנדריטיים DD ואת תפקודם in vivo במערכת עצבים שלמה הנגישה בקלות להדמיה חיה ולניתוח גנטי. לניטור צורת הקוצים הדנדריטיים, (1) חלבונים פלואורסצנטיים ציטוזוליקים, הממלאים את התהליך הדנדריטי ואת עמודי השדרה; (2) חלבונים פלואורסצנטיים הקשורים לממברנה, המעטרים את גבול הקוצים הדנדריטים והדנדריטים; או (3) נעשה שימוש בסמני האטין, LifeAct5 או Utrophin6, המועשרים בעמוד השדרה הדנדריטי, ובכך לחשוף את צורתם. כדי לנטר את הפונקציונליות של קוצים DD, נעשה שימוש בפלואורסצנציה של GCaMP כדי לזהות ארעי Ca++ המעוררים על ידי הפעלת האופסין המוסט אדום, כרימזון, בנוירונים כולינרגיים קדם-סינפטיים7. שתי האסטרטגיות צפויות להקל על חקר עמוד השדרה הדנדריטי DD בחיות בר ומוטנטיות.
Protocol
1. קביעת המבנה של קוצים דנדריטיים DD
- צור תולעים מהונדסות כדי לתייג קוצים DD
- השתמש במקדם flp-13 כדי לבנות וקטור ביטוי עבור תווית העניין (לדוגמה, mCherry ציטופלסמי, MYR::mRuby, LifeAct::GFP, GFP::utrophin) (איור 1). ראה את הרשימה המלאה של פלסמידים בקובץ משלים 1.
- השתמש בשיטות מבוססות כדי ליצור קו מהונדס המסמן עמודי שדרה DD 8,9.
- הכינו את חומר האיטום
- הכינו תערובת 1:1 של הטמעת מדיום10 על בסיס פרפין (ראו טבלת חומרים).
- מחממים את המדיום ב-60 מעלות צלזיוס עד להמסה, ואז מעלים בצינורות מיקרוצנטריפוגה מכוסים ב-1.5 מ"ל ושומרים על בלוק חימום ב-60-70 מעלות צלזיוס.
הערה: חומר איטום יכול להחזיק מעמד 4 שבועות בבלוק החימום.
- הכינו חומר הרדמה.
- הכינו פתרונות מלאי ב-H2O מזוקק של 1% טריקאין ו-1 M לבאמיזול (ראו טבלת חומרים). יש לאחסן בטמפרטורה של -20°C.
- הכן פתרון עובד של 0.05% Tricaine ו 15 mM הרדמה levamisolo, כמתואר בשלבים 1.3.3-1.3.511.
- מערבבים 75 μL של 1% מלאי טריקאין ו-22.5 μL של 1 M levamisole.
- הוסף מאגר M9 לנפח סופי של 1.5 מ"ל.
- Aliquot 10 μL של 0.05% טריקאין, 15 mM levamisole לתוך צינורות microcentrifuge 0.5 מ"ל ולאחסן ב -20 °C.
הערה: תערובת ההרדמה רגישה לטמפרטורה, ואין להקפיא מחדש את החלקיקים הבודדים של התמיסה העובדת לאחר הפשרה עבור כל ניסוי. ראה קובץ משלים 2 למתכון למאגר M9.
- קבלת תמונות ברזולוציה גבוהה
- הכינו 10% אגרוז ושמרו עליו באמבט המים בטמפרטורה של 60 מעלות צלזיוס.
הערה: ראה את הדו"ח של מוניקה דריסקול ב- WormBook12. - הרכיבו 15-20 צעירים על רפידות אגרוז 10% והוסיפו 3 מיקרון הרדמה (ראו שלב 3).
- יש למרוח את הכיסוי (התולעים משותקות תוך 5 דקות).
- אטמו את שולי הכיסוי עם תערובת חומרי איטום דביקה מומסת (ראו טבלת חומרים).
- רכישת תמונות
- רכישה ברזולוציה גבוהה במיוחד
- השתמש במיקרוסקופ קונפוקלי לסריקת לייזר המצויד במיקרוסקופיה ברזולוציה גבוהה במיוחד עם עדשת המטרה של שמן Plan-Apochromat 63x/1.40 כדי להשיג גודל פיקסל קטן (לדוגמה, < 50 ננומטר). רכוש ערימות Z באמצעות גודל הצעד המומלץ על-ידי תוכנת היצרן (ראה טבלת חומרים).
- אסוף סדרה של מקטעים אופטיים המשתרעים על פני הנפח הכולל של תהליך הגחון של DD (לדוגמה, 15-20 פרוסות בגודל צעד של 0.19 מיקרומטר או בעובי 2-3 מיקרומטר). שלח ערימות Z לעיבוד תמונה באמצעות התוכנה של היצרן ונתח תמונות עם ציון גבוה מ- 7 (איור 1B, איור 2 ואיור 3).
- רכישת ניקוויסט
- השתמש במיקרוסקופ קונפוקלי לסריקת לייזר כדי לבחור את גודל הפיקסלים האופטימלי עבור אורך הגל של האור והצמצם המספרי של העדשה האובייקטיבית שבשימוש (לדוגמה, 40x/1.4 תכנן שמן פלואור).
הערה: גודל הפיקסלים הקטן יותר יחשוף את המבנה העדין של קוצים DD. - שלח ערימה לפירוק תלת-ממדי באמצעות אלגוריתם אוטומטי (ראה טבלת חומרים) (איור 3).
- השתמש במיקרוסקופ קונפוקלי לסריקת לייזר כדי לבחור את גודל הפיקסלים האופטימלי עבור אורך הגל של האור והצמצם המספרי של העדשה האובייקטיבית שבשימוש (לדוגמה, 40x/1.4 תכנן שמן פלואור).
- השתמש בשלב Z הקטן ביותר האפשרי (לדוגמה, נקבע על-ידי שלב Piezo) מכיוון שדגימת יתר ב-Z יכולה להניב תמונות חדות יותר לאחר פירוק תלת-ממדי13.
- רכישה ברזולוציה גבוהה במיוחד
- הכינו 10% אגרוז ושמרו עליו באמבט המים בטמפרטורה של 60 מעלות צלזיוס.
- ניתוח תמונות
- השתמש בתוכנת עיבוד תמונה מתאימה (ראה טבלת חומרים) כדי ליצור הקרנות בעוצמה מרבית של Z-stacks14.
- לספור ידנית את הבליטות על DD דנדריט.
הערה: בליטות הן הרחבות מאונכות מהפיר הראשי (איור 1B, ראשי חץ). - קבעו את אורך דנדריט DD שקיבל ניקוד כדי לחשב את צפיפות הקוצים לכל 10 מיקרומטר של דנדריט DD (איור 1C).
- סווגו קוצים כדקים/פטריות, פילופודיאליים, סתמיים או מסועפים (איור 2A).
הערה: קוצים דקים/פטריות מפגינים בסיס צר (צוואר) וקצה (ראש) רחב יותר. קוצים פילופודיאליים אינם מציגים בסיס מכווץ (ללא צוואר) אך יש להם רוחב קבוע. קוצים סתומים הם בעלי בסיס וקצה רחבים. קוצים מסועפים הם בליטות עם יותר מקצה אחד.
2. הערכת הפעלה של קוצים דנדריטיים DD על ידי איתות כולינרגי קדם-סינפטי
- יצירת תולעים מהונדסות בטכניקות קונבנציונליות (למשל, מיקרו-הזרקה)8,9
- השתמשו במקדם flp-13 כדי להניע ביטוי של חיישן Ca++ , GCaMP6s, בתאי עצב DD ומקדם unc-4 כדי להניע ביטוי של Chrimson, ערוץ תעלות עם הזזה אדומה, בנוירוני VA קדם-סינפטיים (איור 4A). ראה רשימת הפלסמידים בקובץ משלים 1.
- הכן רשתית All-trans (ATR) ולוחות בקרה.
הערה: ATR הוא גורם משלים נדרש כדי שארגמן יתפקד כתעלת יונים המופעלת באופן אופטוגנטי.- הכן תמיסת מלאי ATR של 100 mM באתנול (100%). יש לאחסן בטמפרטורה של -20°C ב-1 מ"ל aliquots.
- מתחת למכסה מנוע זרימה למינרית, יש להוסיף 300 μL של תרבית חיידקים OP50 בלילה ו-0.25 μL של ATR לכל צלחת אגר מזין של 60 מ"מ NGM (Nematode Growth Medium) ולמרוח עם מוט זכוכית סטרילי.
- עבור בקרות, הוסף 300 μL של חיידקי OP50 ו- 0.25 μL של אתנול (100%) לקבוצה נפרדת של לוחות NGM.
- תנו לצלחות לשבת במכסה המנוע בטמפרטורת החדר למשך 24 שעות (מוגנות מפני אור הסביבה) כדי לאפשר צמיחת חיידקים.
הערה: ניתן להשתמש בצלחות לאחר הדגירה הראשונית של 24 שעות או לשמור על טמפרטורה של 4 מעלות צלזיוס לשימוש תוך 5 ימים.
- הגדרת הניסוי
- הניחו חמישה זחלים בשלב L4 מדגם NC3569 על לוחות ATR או לוחות בקרה מזרעים OP50 חסרי ATR וגדלים בחושך בטמפרטורה של 23 מעלות צלזיוס.
- שלושה ימים לאחר מכן, השתמש במיקרוסקופ ניתוח סטריאו כדי לאשר את התפתחות הפות כדי לבחור צאצאי שלב L4 מ- ATR ולוחות בקרה להדמיה כמתואר בשלבים 2.4.1-2.4.3.
- בשקופית מיקרוסקופ, מקם 2 μL של פוליבאדים של 0.05 מיקרומטר (2.5% מוצקים w/v) (ראה טבלת חומרים).
- השתמש בחוט פלטינה ("תולעת פיק") כדי להוסיף כדורית קטנה של דבק-על לתמיסה, והסתחרר בעדינות כדי ליצור "גדילים" נימה של דבק. לאחר מכן הוסיפו 3 μL של מאגר M9 (איור 4B).
- מניחים כעשרה זחלי L4 בתמיסה ומורחים כיסוי.
הערה: סיבי דבק יבואו במגע אקראי עם תולעים וישתקו אותן לאחר החלת הכיסוי. תולעים המוטבעות בגלובוסים גדולים של דבק נראות מיובשות ואין לדמותן. - אטמו את קצוות הכיסוי כפי שצוין בשלב 1.4.4.
- הקלטה של ארעי Ca++ מעוררים בעמוד השדרה הדנדריטי.
- השתמש במיקרוסקופ קונפוקלי דיסק מסתובב המצויד במצלמת CCD רגישה, עדשת מטרת שמן TIRF 100x וקווי לייזר של 488 ננומטר ו-561 ננומטר (ראו טבלת חומרים).
- התאם את שלב המיקרוסקופ למיקום עמודי השדרה של DD במישור המוקד.
- הגדרת רכישת קיטועי זמן כדי להאיר את הדגימה עם קו לייזר של 488 ננומטר בכל פריים (לזיהוי פלואורסצנציה של GCaMP6s) וקו לייזר של 561 ננומטר במרווחים מחזוריים (עבור עירור Chrimson).
הערה: לדוגמה, השתמש באור של 488 ננומטר כדי ללכוד תמונות רצופות (200 אלפיות השנייה) של אות GCaMP6s בשילוב עם פולס של 200 אלפיות השנייה של אור 561 ננומטר בכל מסגרת חמישית (איור 4C-E). עם תצורה זו, רמות GCaMP לפני ואחרי כל פעימה של 561 ננומטר מזוהות ~ 1 שניות זו מזו (200 אלפיות השנייה של לייזר 488 ננומטר כדי לזהות GCaMP לפני הפעלת VA, 200 אלפיות השנייה של פולס 561 ננומטר להפעלת VA ו~ 600 אלפיות השנייה כדי לעבור בין קווי לייזר ומסנני פליטה. עם הגדרה זו, נוירוני VA מופעלים כל 2.5 שניות.
- ניתוח הדמיית in vivo Ca++
- השתמש בפירוק דו-ממדי וביישור תמונה כדי לתקן סטיות קלות הנובעות מתנועת התולעת במהלך הרכישה (ראה טבלת חומרים).
- הגדר את עמוד השדרה הדנדריטי DD כאזור העניין (ROI באיורים 4C-D).
- שכפלו את ההחזר על ההשקעה ועברו לאזור שכן בתוך התולעת כדי לאסוף אות רקע (כלומר, רעש).
- השתמש בתוכנה מתאימה (ראה טבלת חומרים) כדי לייצא עוצמות GCaMP6s למצוינות עבור כל נקודת זמן. הפחת פלואורסצנציה של רקע מ- ROI פלואורסצנציה של עמוד השדרה.
- קבע את השינוי בפלואורסצנטיות על-ידי חיסור הפלואורסצנציה של GCaMP6s במסגרת מיד לפני עירור של 561 ננומטר (F0) מכל נקודת זמן לאחר עירור (ΔF), ולאחר מכן חלוקה ב-F0 כדי לקבוע ΔF/F0 (איור 4E).
- גרף את העקבות המנורמלים (ראו טבלת חומרים).
- בצע בדיקה סטטיסטית זוגית עבור כל מדידה של פלואורסצנציה של GCaMP6s לפני ואחרי כל פולס של אור 561 ננומטר.
הערה: גישה זו שוללת למעשה תנודות אקראיות בפלואורסצנטיות GCaMP6s שאחרת מפחיתות את העוצמה הסטטיסטית של השוואת האות הממוצע של GCaMP6s מכל המדידות לפני ואחרי עירור 561 ננומטר (איור 4F). - עבור מדידות המציגות התפלגות נורמלית או התפלגות גאוסית, השתמש במבחן ANOVA פרמטרי מזווג ותקן עבור השוואות מרובות עבור כל אחת משתי הקבוצות (ATR לפני לעומת אחרי, ללא ATR לפני לעומת אחרי). לחלופין, עבור נתונים שאינם מופצים בדרך כלל, השתמש ב- ANOVA לא פרמטרי עם תיקון posthoc לבדיקות מרובות.
הערה: תולעים הגדלות על צלחות חסרות ATR ("ללא ATR") הן בקרות הכרחיות ואינן אמורות להראות ארעי Ca++ המופעלים על-ידי 561 ננומטר, מכיוון ש- ATR נדרש לתפקוד הארגמן.
תוצאות
מדידות עם שלושה סמנים בלתי תלויים (mCherry ציטוזולי, LifeAct::GFP, MYR::mRuby) הניבו צפיפות ממוצעת של 3.4 ± 1.03 קוצים דנדריטיים DD לכל 10 מיקרומטר של דנדריט DD במבוגרים צעירים מסוג בר (איור 1B,C). לצורך ניתוח זה, המדידות שהתקבלו עם סמן GFP::Utrophin שהניב צפיפות עמוד שדרה נמוכה משמעותית לא נכללו (2.4 ± 0.74, איור 1) עקב אינטראקציות של Utrophin עם שלד האקטין6 שעשוי להניע את מורפוגנזה של עמוד השדרה15. מדידות צפיפות עמוד השדרה במיקרוסקופ האור דומות לערך של 4.2 קוצים/10 מיקרומטר דנדריט המתקבל משחזור של 12 קוצים ממיקרוגרפים אלקטרונים של נוירון DD12. גישת ההדמיה של תאים חיים אישרה שהמורפולוגיה הדקה/פטריות של עמודי השדרה DD שולטת בצורות עמוד השדרה הבוגר לעומת צורות עמוד השדרה החלופיות (למשל, פילופודיאלית, סתומה, מסועפת) (איור 2B), האופיינית גם לעמודי שדרה במערכת העצבים של יונקים בוגרים16.
אסטרטגיה אופטוגנטית שימשה כדי לשאול אם עמודי השדרה הדנדריטיים המשוערים שזוהו על-ידי מיקרוסקופיית אור ברזולוציה גבוהה (איור 1 ואיור 2) מגיבים לשחרור מוליכים עצביים מאתרים קדם-סינפטיים, סימן היכר אופייני של קוצים דנדריטיים בתאי עצב של יונקים. אור ירוק (561 ננומטר) שימש להפעלת וריאנט של תעלותרודופסין, כרימזון, בנוירונים כולינרגיים קדם-סינפטיים ובאור כחול (488 ננומטר) כדי לזהות פלואורסצנציה תלוית Ca++ הנפלטת על ידי בדיקה ציטופלסמית GCaMP בעמוד שדרה דנדריטי DD פוסט-סינפטי. הניסוי הזה זיהה התפרצויות חולפות של אות GCaMP בעמוד השדרה של DD מיד לאחר ההפעלה האופטוגנטית של Chrimson בתאי עצב VA קדם-סינפטיים (איור 3). ההצלחה של ניסוי זה תלויה בביטוי אמין של Chrimson בכל נוירוני VA presynaptic. במקרה זה, נעשה שימוש באינטגרנט כרומוזומלי17 של סמןP unc-4::Chrimson כדי להבטיח ביטוי VA עקבי. ניסוי זה יכול להתבצע גם עם מערך חוץ-כרומוזומלי. ביטוי ארגמן בנוירון VA ספציפי יכול להיות מאושר באופן עצמאי, לדוגמה, על ידי צימוד טרנסגן Chrimson לרצף מנהיג מתמרן SL2 עם GFP מקומי גרעיני במורד הזרם כסמן ביטוי משותף2. חיוני לבצע ניסוי בקרה בהיעדר ATR כדי לאשר שאות GCaMP שנמדד תלוי בהפעלה אופטוגנטית של Chrimson, שהיא תלוית ATR בלבד (איור 4D). לבסוף, מכיוון שאותות Ca++ מעוררים הם זמניים, חיוני לאמץ פרוטוקול הדמיה המאפשר מיתוג מהיר (<1 שניות) בין עירור של 561 ננומטר לבין רכישת אותות GCaMP עם לייזר 488 ננומטר (איור 4).

איור 1: תיוג של קוצים דנדריטיים DD . (A) (למעלה) שישה נוירונים דורסליים D (DD1-DD6) בחוט העצבים הגחוני של C. elegans. (למטה) במבוגרים, עמודי שדרה DD מכוונים גחון (ראש חץ) יוצרים מגע עם הדקים קדם-סינפטיים של נוירונים מוטוריים גחוניים A (VA) וגחון B (VB) (מגנטה), ותאי DD מתרחבים לחוט העצבים הגבי כדי לספק פלט GABAergic לשרירי הגוף (חץ)18. נתון זה שונה מהפניה2. (B) מיקרוגרפים פלואורסצנטיים (Airyscan) של קוצים DD המסומנים עם mCherry ציטוזולי, mRuby מיריסטוילי (MYR::mRuby), LifeAct::GFP ו-GFP::Utrophin בתולעים בוגרות צעירות. ראשי חץ אפורים מצביעים על קוצים. סרגל קנה מידה = 2 מיקרומטר. (C) צפיפות (קוצים/10 מיקרומטר) של קוצים דנדריטיים של נוירוני DD המסומנים ב-mCherry ציטוזולי (3.77 ± 0.9), MYR::mRuby (3.09 ± 0.8), LifeAct::GFP (3.44 ± 1.1) או GFP::Utrophin (2.41 ± 0.8). כל הדגימות מופצות בדרך כלל. ANOVA חד-כיוונית מראה כי צפיפויות עמוד השדרה עבור mCherry ציטוזולי, MYR::mRuby, ו- LifeAct::GFP אינן שונות באופן משמעותי (NS), בעוד שצפיפות עמוד השדרה מופחתת עבור GFP::Utrophin לעומת מסומן ציטוזולי mCherry (p = 0.0016) ו- LifeAct::GFP (p = 0.0082). הקו האדום המקווקו מייצג את צפיפות עמוד השדרה של נוירוני DD שהוערכו משחזור EM תלת-ממדי (4.2 קוצים/10 מיקרומטר). נתון זה שונה מהפניה2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: הדמיית קוצים דנדריטיים DD. (A) (למעלה) סכמטי של צורות עמוד שדרה. (למטה) תמונות Airyscan של כל סוג של עמוד שדרה (סרגל קנה מידה = 500 ננומטר) המסומנות ב- LifeAct::GFP (ירוק) ושחזורים תלת-ממדיים על ידי מיקרוגרפים אלקטרונים סדרתיים של מבוגר קפוא בלחץ גבוה (כחול). (B) תדירות עמוד השדרה לפי סוג, המתוארת באמצעות LifeAct::GFP: רזה/פטריות (55.5 ±-14.5%), פילופודיאלית (10.3 ± 8.70%), סטובי (18.8 ±-10.7%), מסועפת (15.42 ± 6.01%). תדירות הקוצים לפי סוג ההדמיה עם MYR::mRuby: דק/פטריות (52.2 ±-16.5%), פילופודיאלית (5.68 ±-7.0%), סטובי (33.1 ±-14.8%), מסועפת (9.02 ±-9.6%). מבחן T לא מזווג, פילופודיאלי (p = 0.0339); קוצים סתמיים (p = 0.0009) ומסועפים (p = 0.011) המסומנים בסמן MYR::mRuby שונים באופן משמעותי מ- LifeAct::GFP. נתון זה שונה מהפניה2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
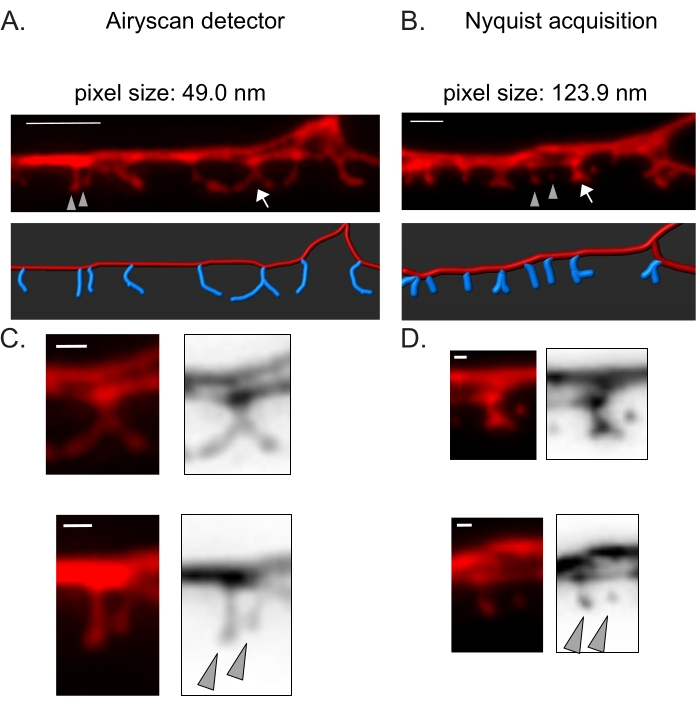
איור 3: אסטרטגיות לרכישת תמונות ברזולוציה גבוהה של קוצים מסוג DD . (A-B) (למעלה) תמונות פלואורסצנטיות של דנדריטים DD1 המסומנות בסמן ציטוזולי (mCherry) על ידי (A) גלאי Airyscan ו-(B) רכישת Nyquist. (למטה) DD dendrite (אדום) מתואר באמצעות תוכנה לניתוח תמונה (אפשרות נתיב אוטומטי של מעקב אחר נימה), וקוצים DD (כחול) מודגמים באופן גרפי באמצעות מודול זיהוי הקוצים האוטומטי למחצה. חץ מצביע על עמוד שדרה מסועף מוגדל ב- C ו- D. ראשי חץ מציינים קוצים דקים/פטריות שכנים מוגדלים ב- C ו- D. סרגל קנה מידה = 2 מיקרומטר. (C-D) דוגמאות מוגדלות של עמוד שדרה מסועף (עליון) (חץ) ו(למטה) שני קוצים דקים/פטריות שכנים (ראשי חץ) המתקבלים עם (C) גלאי Airyscan או על ידי (D) רכישת Nyquist. סרגל קנה מידה = 500 ננומטר. נתונים שהועתקומ-2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: הערכת התפקוד של קוצים DD. (A) נוירונים מוטוריים DD מבטאים את מחוון Ca++ GCaMP6s (ירוק), ונוירונים מוטוריים VA מבטאים את גרסת הערוץ-רודופסין, Chrimson (מגנטה)7. (B) שיטת תיאור סכמטית להרכבת תולעים למדידות Ca++ . (1) במגלשה נקייה במיקרוסקופ, (2) מניחים 2 μL של חרוזי פולי של 0.05 מיקרומטר, (3) משתמשים בחוט פלטינה ("תולעת פיק") כדי להוסיף כדורית קטנה של דבק-על ו-(4) מערבלים לתוך התמיסה כדי ליצור גדילים נימה של דבק. (5) הוסף 3μL של מאגר M9. (6) הכניסו לתמיסה כעשרה זחלי L4, (7) מרחו את הכיסוי ואטמו את הקצוות עם וזלין/שעווה. (ג-ד) הפעלה של נוירוני VA מתואמת עם ארעי Ca++ בעמוד השדרה DD1. פלואורסצנציה של GCaMP6s בתמונה (במרווחים של 0.5 שניות) עם הפעלת אור מחזורית של Chrimson (מרווחים של 2.5 שניות) מעוררת ארעיות Ca++ עם (C) +ATR (n = 12) אך לא בפקדים (D) (-ATR, n = 12). לוחות הם תמונות לאורך זמן (ים), לפני ואחרי פולס של 561 ננומטר אור (קו ורוד אנכי). פסי קנה מידה = 2 מיקרומטר. אות GCaMP6s נרכש מ- ROI (אזור עניין) בקצה כל עמוד שדרה. (E) פלואורסצנטיות GCaMP6s במהלך תקופת ההקלטה של 10 שניות שהתוותה עבור +ATR (ירוק) לעומת -ATR (בקרה, אפור) (n = 12 סרטונים). פסים ורודים אנכיים מציינים תאורה של 561 ננומטר (למשל, הפעלת ארגמן). כל חיה הייתה מגורה 4 פעמים עם אור 561 ננומטר. המדידות נאספו לפני ואחרי כל פעימה של אור 561 ננומטר. (F) העלילה של הפלואורסצנציה של GCaMP6s לפני ואחרי כל פולס של אור 561 ננומטר. פלואורסצנטיות GCaMP6s נמדדה 1 שניות לאחר כל פעימה של אור 561 ננומטר. מכיוון שדגימות אינן מתפלגות בדרך כלל, מבחן פרידמן זוגי שאינו פרמטרי הוחל כדי לתקן השוואות מרובות של פלואורסצנציה GCaMP6s לפני לעומת לאחר גירוי אור של 561 ננומטר עבור תולעים שגדלו עם ATR (+ATR, ירוק) (*** p = 0.0004, n = 48 מדידות) או בהיעדר ATR (-ATR, אפור) (NS, לא משמעותי, p = 0.0962, n = 48 מדידות). נתון זה שונה מהפניה2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
קובץ משלים 1: רשימת הפלסמידים ששימשו במחקר. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 2: הרכב והכנה של מאגר M9. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
גלאי Airyscan נבחר כדי לקבל תמונות של קוצים DD מכיוון שהוא מעניק יחס אות לרעש גבוה יותר ורזולוציה טובה יותר מאשר מיקרוסקופים קונפוקליים קונבנציונליים19,20. הדמיית AiryScan מאפשרת גם שימוש בחלבונים פלואורסצנטיים קונבנציונליים (למשל, GFP, mCherry וכו'), הזמינים כיום באופן נרחב עבור C. elegans. למרות שניתן להשיג תמונות ברזולוציה גבוהה יותר בשיטות אחרות ברזולוציה גבוהה יותר (למשל, STORM, STED, PALM), שיטות אלה דורשות חלבונים פלואורסצנטיים הניתנים להפעלה או לפוטו-מתג21. כחלופה ל- Airyscan, מומלץ מיקרוסקופים קונפוקליים קונבנציונליים. לדוגמה, הדמיה עם רכישת Nyquist (איור 3) משיגה את גודל הפיקסלים באמצעות מטרה של 40x/1.3 של 123.9 ננומטר, מספיק כדי להבחין בין הסוגים המורפולוגיים של עמוד השדרה (איור 2).
לקביעת צפיפות עמוד השדרה, מומלץ להשתמש בחלבון פלואורסצנטי ציטוזולי כגון (1) mCherry או GFP, (2) LifeAct כדי לסמן את שלד האקטין הציטוסקנטי, או (3) חלבון פלואורסצנטי מיריסטוילאט (לדוגמה, MYR::mRuby) כדי לסמן את קרום הפלזמה (איור 1B). לשם השוואה, החלבון הקושר F-actin Utrophin מפחית את צפיפות עמוד השדרה (איור 1C), מה שמצביע על השפעה שלילית על מורפוגנזה של עמוד השדרה כאשר Utrophin מתבטא יתר על המידה.
שיטות ההדמיה הנוכחיות אמורות לסייע בזיהוי וריאנטים גנטיים השולטים במורפולוגיה של עמוד השדרה 1,16. ניתן להעריך את המורפולוגיה של עמוד השדרה DD (כלומר, דק/פטריות, פילופודיאליות, סתמיות, מסועפות, ראו איור 2) מהקרנות דו-ממדיות בודדות של התמונות הצדדיות של חוט העצב הגחוני מאחר שרוב עמודי השדרה של DD מאמצים כיוון גחון אופייני. בהשוואות אלה, חיוני להשתמש באותו סמן פלואורסצנטי עבור כל מצב, שכן נראה כי סוגים מורפולוגיים של עמוד השדרה לכאורה מושפעים משיטת התיוג (למשל, MYR::mRuby vs. חוק החיים::GFP). בנוסף, צוין כי צורות עמוד השדרה הן דינמיות וככל הנראה משנות את צורתן בתגובה לאותות החיצוניים 2,16. לכן, חיוני גם להשוות את צורות עמוד השדרה בין גנוטיפים בשלבי התפתחות דומים ובתנאים דומים.
הכיוון של כבל הגחון C. elegans חיוני ביותר לרכישת תמונה מדויקת. גם החוט הגחוני וגם החוט הגבי בצדדים מנוגדים של החיה אמורים להיות גלויים באותו מישור Z, מה שמצביע על כך שהתולעת מכוונת על צדה (איור 1B). עדיף לא לאסוף תמונות של תולעים נעות או במגע עם תולעים או בועות אחרות ליד כבל הגחון, שכן זה יכול להשפיל תמונות של קוצים.
להדמיית סידן in vivo , יש להכין שקופיות טריות מיד לפני כל רכישה. עדיף לדמות תולעים במגע עם סיבי דבק דקים בלבד לעומת "גושים" של דבק שנוטים לייבש תולעים ולהשפיל את התמונה (איור 4B). בניסוי שמוצג באיור 4, הפולס של אור בגודל 561 ננומטר מפעיל את כל שדה הראייה. להגדלת הרזולוציה הטמפורלית והמרחבית כדי לזהות ארעי Ca++ מקומיים, לדוגמה, בתוך קוצים בודדים של DD, ניתן להשתמש בסורק גלבו מיני המוגדר עבור קו הלייזר של 561 ננומטר כדי לעורר אזור עניין קטן יותר17.
Disclosures
אנו מצהירים על היעדר ניגוד עניינים.
Acknowledgements
הדמיה וניתוח על Imaris בוצעו במשאב המשותף להדמיית תאים של ונדרבילט (CIRS) הנתמך על ידי NIH (CA68485, DK20593, DK58404, DK59637 ו- EY08126). LSM 880 נתמך על ידי מענק 1S10OD201630. הדמיה בדיסק מסתובב של Nikon בוצעה במרכז המצוינות של Nikon. אנו מודים לג'ני שפר, מנהלת CISR, ולבריאן מיליס על ההכשרה והדיונים מלאי התובנות ולחברי מעבדת ברנט: דילן ברנט, איידן פניקס ונילאי טנג'ה על העצות. עבודה זו נתמכה על ידי מענקי המכונים הלאומיים לבריאות ל- DMM (R01NS081259 ו- R01NS106951) ומענק של איגוד הלב האמריקאי ל- ACC (18PRE33960581).
Materials
| Name | Company | Catalog Number | Comments |
| All-trans retinal (ATR) | Sigma-Aldrich | R2500-100MG | Necessary cofactor for neuronal excitation with Chrimson |
| diH2O | MilliQ | To prepare M9 buffer | |
| Ethanol 100% | Sigma | 64-17-5 | To dilute ATR and make control plates for neuronal excitation |
| Ethyl 3-aminobenzoate methanesulfonate salt (tricaine) | To immobilize animals for imaging dendritic spines | ||
| ImageJ | NIH | (Schindelin J et al., 2012) | Open source image processing software |
| KH2PO4 | Fisher Bioreagents | 7758-11-4 | To prepare M9 buffer |
| Levamisole hydrochloride | Sigma | 16595-80-5 | To immobilize animals for imaging dendritic spines |
| MgSO4 | Fisher Chemical | M63-500 | To prepare M9 buffer |
| Microscope cover glass | Fisherbrand | 12542B | To mount animals for microscopy acquisition |
| Na2HPO4 | Fisher Scientific | S369-500 | To prepare M9 buffer |
| NaCl | Fisher Chemical | S671-3 | To prepare M9 buffer |
| NIS Elements version 05.21 | Nikon | To analyze images and movies (e.g., Deconvolution, image alignment) | |
| Polybeads carboxylate 0.05um microspheres | Polysciences, Inc | 15913-10 | To immobilize animals for imaging Ca++ transients |
| Prism | For statistical analysis and graphing normalized Ca++ transients | ||
| SeaKen ME agarose | Lonza | 50014 | To make agarose pads to mount animals for imaging |
| Super Glue | The gorilla company | To immobilize animals for imaging Ca++ transients | |
| Superfrost microscope slides | Fisherbrand | 22-034-980 | To mount animals for microscopy acquisition |
| vaseline | Covidien | 8884430300 | To seal sample for confocal snapshots |
| Wax | Fisherbrand | 23-021-399 | Paraplast tissue embedding medium |
| Microscope for super-resolution imaging | |||
| LSM880 | Zeiss | ||
| AiryScan detector | Zeiss | ||
| Plan Apochromat (oil) 63x/ 1.40 NA, WD = 0.19 mm | |||
| Laser lines | |||
| Stage controller | |||
| Microscope for Nyquist image acquisition | |||
| A1R Confocal | Nikon | ||
| Plan Fluor (oil) 40x/1.3 NA, WD 0.24 mm | |||
| 488 nm, 16mW | |||
| 561 nm, 17mW | |||
| Microscope to monitor evoked Ca++ transients in dendritic spines | |||
| Spinning Disk Confocal | Nikon | ||
| Andor DU-897 EMCCD camera | |||
| Spinning disk Head CSU-X1 | Yokogawa | ||
| Apo TIRF (oil) 100x/1.49 NA ,WD 0.12 mm | |||
| 488 nm, 65mW | |||
| 561 nm, 86mW | |||
| 525 nm (+/- 18 nm) | |||
| 605 nm (+/- 35 nm) |
References
- Sala, C., Segal, M. Dendritic Spines: The Locus of Structural and Functional Plasticity. Physiological Reviews. 94 (1), 141-188 (2014).
- Cuentas-Condori, A., et al. C. elegans neurons have functional dendritic spines. Elife. 8, 47918 (2019).
- Philbrook, A., et al. Neurexin directs partner-specific synaptic connectivity in C. Elegans. Elife. 7, 35692 (2018).
- Oliver, D., Alexander, K., Francis, M. M. Molecular Mechanisms Directing Spine Outgrowth and Synaptic Partner Selection in Caenorhabditis elegans. Journal of Experimental Neuroscience. 12, 10-13 (2018).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5, 605-607 (2008).
- Ladt, K., Ganguly, A., Roy, S. Axonal actin in action: Imaging actin dynamics in neurons. Methods of Cell Biology. 131, 91-106 (2016).
- Schild, L. C., Glauser, D. A. Dual color neural activation and behavior control with chrimson and CoChR in Caenorhabditis elegans. Genetics. 200 (4), 1029-1034 (2015).
- Mello, C., Kramer, J., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrahcormosomal maintenance and integration of transforming sequences. The EMBO Journal. 10 (12), 3959-3970 (1991).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C . elegans Using Microinjection. Journal of Visualized Experiments. (18), e833 (2008).
- Smith, C. J., et al. Time-lapse imaging and cell-specific expression profiling reveal dynamic branching and molecular determinants of a multi-dendritic nociceptor in C. elegans. Developemntal Biology. 345 (1), 18-33 (2010).
- Mccarter, J., Bartlett, B., Dang, T., Schedl, T. Soma - Germ Cell Interactions in Caenorhabditis elegans : Multiple Events of Hermaphrodite Germline Development Require the Somatic Sheath and Spermathecal Lineages. Developemntal Biology. 181 (2), 121-143 (1997).
- Driscoll, M. Mounting animals for observation with Nomarski DIC optics. WormBook. , (2008).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. Journal of Cell Biology. 172 (1), 9-18 (2006).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Hotulainen, P., Hoogenraad, C. C. Actin in dendritic spines connecting dynamics to function. Journal of Cell Biology. 189 (4), 619-629 (2010).
- Berry, K. P., Nedivi, E. Spine Dynamics: Are They All the Same. Neuron. 96 (1), 43-55 (2017).
- Miller, D. M., Niemeyer, C. J. Expression of the unc-4 homeoprotein in Caenorhabditis elegans motor neurons specifies presynaptic input. Development. 121 (9), 2877-2886 (1995).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Ventral Nerve Cord of Caenorhadbitis elegans. Philosophical Transactions of the Royal Society. 275 (938), 327-348 (1976).
- Huff, J. The Airyscan detector from ZEISS confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, (2015).
- Huff, J. The Fast mode for ZEISS LSM 880 with Airyscan high-speed confocal imaging with super-resolution and improved signal-to-noise ratio. Nature Methods. 13, (2016).
- Jacquemet, G., Carisey, A. F., Hamidi, H., Henriques, R., Leterrier, C. The cell biologist's guide to super-resolution microscopy. Journal of Cell Science. 133 (11), 240713 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved