Method Article
カエノラブディティス・エレガンスにおける樹状突起棘のイメージング
要約
樹状突起棘は神経系の重要な細胞の特徴です。ここでは、 C. elegansにおける樹状突起スパインの構造および機能を評価するためのライブイメージング法について説明する。これらのアプローチは、樹状突起スパインの形状または機能を定義する遺伝子の変異スクリーニングの開発をサポートします。
要約
樹状突起棘は、活動によって調節されるシナプス神経支配の特殊な部位であり、学習と記憶の基質として機能します。近年、DD GABA作動性ニューロンに対して樹状突起スパインが、 カエノラブディティス・エレガンスの運動回路におけるシナプス前コリン作動性ニューロンからの入力部位として記載されている。このシナプス回路は、脊椎の形態形成と機能の強力な 新しいin vivo モデルとして機能し、Cの容易な遺伝学とすぐにアクセスできるものを利用することができます 。 生細胞イメージングへのエレガンス。
このプロトコルは、DDスパインの構造と機能を評価するための実験戦略について説明しています。このアプローチでは、超解像イメージング戦略を使用して、アクチンに富む樹状突起スパインの複雑な形状を視覚化します。DDスパイン機能を評価するために、光活性化オプシンであるクリムゾンはシナプス前コリン作動性ニューロンを刺激し、カルシウムインジケーターGCaMPはシナプス後DDスパインの誘発されたカルシウム過敏性を報告します。一緒に、これらの方法は、脳内の脊椎の形態形成と機能を指示する可能性のある C.エレガンスの 樹状突起スパインの遺伝的決定要因を特定するための強力なアプローチで構成されています。
概要
樹状突起スパインは、シナプス伝達のために隣接するニューロンからの入力を受け取る特殊な細胞構造です。神経伝達物質受容体の活性化は、これらの特徴的な神経突起における細胞内カルシウムおよび下流のシグナル伝達経路を上昇させる1。神経伝達に対する樹状突起スパインの基本的な重要性と神経発達疾患におけるそれらの誤制御1のために、樹状突起スパインの形態形成と機能を調節する因子の発見は、神経科学の分野にとって非常に興味深いものです。
最近、樹状突起棘は、哺乳類の棘と共有される重要な特性に基づいて、C.エレガンス神経系で同定されました2。この決定は、脊椎生物学を調査するためにC.エレガンスの利点を利用する可能性を開くため、非常に重要です。背側D(DD)運動ニューロンの樹状突起スパインは、腹側神経索のコリン作動性ニューロン(VAおよびVB)から入力を受け取ります(図1A)2,3,4。ここでは、DD樹状突起スパインの構造と、ライブイメージングと遺伝子分析に容易にアクセスできる無傷の神経系におけるin vivoでのそれらの機能を探索するためのイメージング方法を紹介します。樹状突起スパインの形状をモニタリングするために、(1)樹状突起およびスパインを満たす細胞質蛍光タンパク質;(2)樹状突起スパインと樹状突起の境界を飾る膜結合蛍光タンパク質;または(3)樹状突起棘に富むアクチンマーカーであるLifeAct5またはUtrophin6を使用して、それらの形状を明らかにします。DDスパインの機能を監視するために、GCaMP蛍光を使用して、シナプス前コリン作動性ニューロン7における赤方偏移オプシンクリムゾンの活性化によって引き起こされるCa++トランジェントを検出します。どちらの戦略も、野生型および変異動物におけるDD樹状突起スパインの研究を促進することが期待されています。
プロトコル
1. DD樹状突起スパインの構造決定
- DDスパインを標識するためのトランスジェニックワームの作成
- flp-13プロモーターを使用して、目的の標識用の発現ベクターを構築します(例:細胞質mCherry、MYR::mRuby、LifeAct::GFP、GFP::utrophin)(図1)。プラスミドの完全なリストは、補足ファイル1を参照してください。
- 確立された方法を使用して、DDスパイン8、9を標識するトランスジェニックラインを生成します。
- シーラントを準備する
- パラフィンベースの包埋媒体10 の1:1混合物を作ります( 材料の表を参照)。
- 溶融するまで培地を60°Cで加熱し、次に1.5 mLキャップ付きマイクロ遠心チューブに分注し、加熱ブロックを60〜70°Cに維持します。
注意: シーラントは加熱ブロックで4週間持続する可能性があります。
- 麻酔薬を準備します。
- 1%トリカインと1 Mレバミゾールの蒸留H2Oでストック溶液を作ります( 材料の表を参照)。-20°Cで保存してください。
- 手順1.3.3-1.3.5 11に記載されているように、0.05%トリカインと15 mMレバミゾール麻酔薬の作業溶液を調製します。
- 75 μLの1%トリカインストックと22.5 μLの1 Mレバミゾールを混合します。
- M9バッファーを最終容量1.5 mLまで添加します。
- 10 μLの0.05%トリカイン、15 mMレバミゾールを0.5 mLの微量遠心チューブに分注し、-20°Cで保存します。
注:麻酔薬の混合物は温度に敏感であり、各実験の解凍後に作業溶液の個々のアリコートを再凍結しないでください。M9 バッファーのレシピについては、 補足ファイル 2 を参照してください。
- 高解像度画像の取得
- 10%アガロースを調製し、60°Cの水浴中に維持します。
注: WormBook12 の Monica Driscoll によるレポートを参照してください。 - 15〜20人の若年成人を10%アガロースパッドにマウントし、3μLの麻酔薬を追加します(手順3を参照)。
- カバーガラスを適用します(ワームは5分以内に固定されます)。
- カバーガラスの端を溶融した接着剤シーラント混合物でシールします(材料の表を参照)。
- 画像の取得
- 超解像取得
- 63倍/1.40平面アポクロマート油性対物レンズを備えた超解像顕微鏡用のレーザー走査型共焦点顕微鏡を使用して、小さなピクセルサイズ(<50nmなど)を実現します。製造元のソフトウェアが推奨するステップサイズを使用してZスタックを取得します(材料表を参照)。
- DD腹側突起の総体積にまたがる一連の光学切片を収集します(たとえば、0.19μmステップサイズまたは2〜3μmの厚さで15〜20スライス)。メーカーのソフトウェアを使用して画像処理用のZスタックを提出し、7を超えるスコアの画像を解析します(図1B、図 2 、 および図3)。
- ナイキスト買収
- レーザー走査型共焦点顕微鏡を使用して、光の波長と使用する対物レンズの開口数に最適なピクセルサイズを選択します(例:40倍/1.4プラン蛍光対物レンズ)。
注:ピクセルサイズが小さいほど、DDスパインの微細構造が明らかになります。 - 自動アルゴリズムを使用して3Dデコンボリューションのスタックを送信します( 材料表を参照)(図3)。
- レーザー走査型共焦点顕微鏡を使用して、光の波長と使用する対物レンズの開口数に最適なピクセルサイズを選択します(例:40倍/1.4プラン蛍光対物レンズ)。
- Zでのオーバーサンプリングは3Dデコンボリューション13の後により鮮明な画像を生成することができるため、可能な限り最小のZステップ(例えば、ピエゾステージによって決定される)を使用してください。
- 超解像取得
- 10%アガロースを調製し、60°Cの水浴中に維持します。
- 画像解析
- 適切な画像処理ソフトウェア( 材料表を参照)を使用して、Zスタック14の最大強度投影を作成します。
- DD樹状突起の突起を手動で数えます。
注意: 突起は、メインシャフトから垂直に延長されています(図1B、矢印)。 - DDデンドライトの長さを決定し、DDデンドライト10μmあたりのスパイン密度を計算しました(図1C)。
- 棘を細い/キノコ、糸状、ずんぐりした、または枝分かれしたものに分類します(図2A)。
注意: 細い/キノコの棘は、狭い基部(首)と広い先端(頭)を示します。フィロポディアルスパインは、くびれた基部(首なし)を表示しませんが、一定の幅を持っています。ずんぐりした棘は広い基部と先端を持っています。分岐した棘は、複数の先端を持つ突起です。
2. シナプス前コリン作動性シグナル伝達によるDD樹状突起スパインの活性化評価
- 従来の技術(マイクロインジェクションなど)を使用してトランスジェニックワームを作成する8,9
- flp-13プロモーターを使用してDDニューロンにおけるCa++センサーGCaMP6sの発現を駆動し、unc-4プロモーターを使用してシナプス前VAニューロンにおける赤方偏移チャネルロドプシンであるクリムゾンの発現を駆動します(図4A)。補足ファイル1のプラスミドのリストを参照してください。
- オールトランスレチナール(ATR)とコントロールプレートを準備します。
注:ATRは、クリムゾンが光遺伝学的に活性化されたイオンチャネルとして機能するために必要な補因子です。- エタノール(100%)中の100 mM ATRストック溶液を調製します。1 mLアリコートで-20°Cで保存します。
- 層流フードの下で、300 μLの一晩OP50細菌培養物と0.25 μLのATRを各60 mm NGM(線虫増殖培地)栄養寒天プレートに加え、滅菌ガラス棒で広げます。
- 対照の場合は、300 μLのOP50細菌と0.25 μLのエタノール(100%)を別のNGMプレートグループに追加します。
- プレートを室温で24時間(周囲光から保護)フードに入れて、細菌の増殖を可能にします。
注:プレートは、最初の24時間のインキュベーション後に使用することも、4°Cに維持して5日以内に使用することもできます。
- 実験のセットアップ
- 5匹のNC3569 L4ステージ幼虫をOP50シードのATRまたはATRがなく、23°Cの暗闇で成長するコントロールプレートに置きます。
- 3日後、ステレオ解剖顕微鏡を使用して外陰部の発達を確認し、手順2.4.1〜2.4.3で説明されているように、ATRおよびコントロールプレートからL4ステージの子孫を選択してイメージングします。
- 顕微鏡スライド上に、2 μLの0.05 μmポリビーズ(2.5%固形分w/v)を置き ます(材料表を参照)。
- プラチナワイヤー(「ワームピック」)を使用して、瞬間接着剤の小さな小球を溶液に追加し、穏やかに渦巻いて糸状の接着剤の「ストランド」を生成します。次に、3 μLのM9バッファーを追加します(図4B)。
- 溶液に約10匹のL4幼虫を置き、カバーガラスを適用します。
注意: 接着剤繊維は、カバーガラスが適用された後、ワームにランダムに接触し、それらを固定します。接着剤の大きな小球に埋め込まれたワームは乾燥しているように見えるため、画像化しないでください。 - 手順1.4.4で説明したようにカバーガラスの端をシールします。
- 樹状突起スパインにおける誘発Ca++ トランジェントの記録。
- 高感度CCDカメラ、100倍TIRF油対物レンズ、488nmおよび561nmのレーザーラインを備えたスピニングディスク共焦点顕微鏡を使用します( 材料表を参照)。
- 顕微鏡ステージを調整して、DDスパインを焦点面に配置します。
- フレームごとに488 nmのレーザーライン(GCaMP6s蛍光を検出するため)と561 nmのレーザーライン(クリムゾン励起用)でサンプルを照らすタイムラプス取得を設定します。
注:たとえば、488 nmの光を使用して、5番目のフレームごとに561 nmの光の200 msパルスと組み合わせたGCaMP6s信号の連続スナップショット(200 ms)をキャプチャします(図4C-E)。この構成では、各561 nmパルスの前後のGCaMPレベルが~1秒間隔で検出されます(VA活性化前にGCaMPを検出するために488nmレーザーを200ミリ秒、VAを活性化するために561nmパルスを200ミリ秒、レーザーラインと発光フィルターを切り替えるために~600ミリ秒)。この設定では、VAニューロンは2.5秒ごとに活性化されます。
- in vivo Ca++イメージングの解析
- 2Dデコンボリューションと画像アライメントを使用して、取得中のワームの動きから生じるわずかな偏差を修正します( 材料表を参照)。
- DD樹状突起スパインを関心領域(図4C-DのROI)として定義します。
- ROIを複製し、ワーム内の隣接する領域に移動して、バックグラウンド信号(つまり、ノイズ)を収集します。
- 適切なソフトウェア( 材料表を参照)を使用してGCaMP6の強度をエクスポートし、各時点で優れています。スパインROI蛍光からバックグラウンド蛍光を差し引きます。
- 励起後の各時点(ΔF)から561 nm励起直前のフレーム内のGCaMP6s蛍光(F0)を減算し、F0で除算してΔF/F0を求めることにより、蛍光の変化を求めます(図4E)。
- 正規化されたトレースをグラフ化します(材料表を参照)。
- 561 nm光の各パルス前後のGCaMP6s蛍光の測定ごとに対応のある統計的検定を実行します。
注:このアプローチは、561 nm励起前後のすべての測定値からの平均GCaMP6sシグナルを比較する統計的検出力を低下させるGCaMP6s蛍光のランダムな変動を効果的に排除します(図4F)。 - 正規分布またはガウス分布を示す測定値の場合は、対応のあるパラメトリック分散分析検定を使用し、2つのグループのそれぞれについて多重比較を補正します(ATR前と後、ATRなし前と後)。または、正規分布していないデータの場合は、複数の検定に事後補正付きのノンパラメトリック分散分析を使用します。
注:ATRのないプレートで増殖したワーム(「ATRなし」)は必要なコントロールであり、クリムゾン機能にはATRが必要であるため、561 nm活性化Ca++ トランジェントを示すべきではありません。
結果
3つの独立したマーカー(細胞質mCherry、LifeAct::GFP、MYR::mRuby)による測定では、野生型若年成人のDD樹状突起10 μmあたり3.4 ± 1.03 DD樹状突起スパインの平均密度が得られました(図1B、C)。この解析では、有意に低い脊椎密度をもたらしたGFP::Utrophinマーカーで得られた測定値は、ウトロフィンとアクチン細胞骨格6との相互作用により除外されました(2.4 ± 0.74、図1)脊椎の形態形成15。光学顕微鏡でのスパイン密度の測定は、DD1ニューロン2の電子顕微鏡写真から12本のスパインの再構成から得られた4.2スパイン/ 10μmデンドライトの値に匹敵します。生細胞イメージングアプローチにより、DDスパインの細い/キノコ形の形態が、成体の脊椎の形状と代替の脊椎の形状(糸状、ずんぐりした、分岐した脊椎など)で優勢であることが確認されました(図2B)、これは成熟哺乳類神経系の棘にも典型的です16。
光遺伝学的戦略を使用して、高解像度光学顕微鏡(図1および図2)によって検出された推定樹状突起棘が、哺乳類ニューロンの樹状突起棘の特徴であるシナプス前部位からの神経伝達物質の放出に応答するかどうかを尋ねました。緑色光(561 nm)を使用してシナプス前コリン作動性ニューロンのチャネルロドプシン変異体であるクリムゾンを活性化し、青色光(488 nm)を使用して、シナプス後DD樹状突起スパインの細胞質GCaMPプローブから放出されるCa++依存性蛍光を検出しました。この実験では、シナプス前VAニューロンにおけるクリムゾンの光遺伝学的活性化の直後に、DDスパインにおけるGCaMPシグナルの一時的なバーストを検出しました(図3)。この実験の成功は、すべてのシナプス前VAニューロンにおけるクリムゾンの信頼できる発現にかかっています。この場合、Punc-4::Chrimsonマーカーの染色体インテグラント17を使用して、一貫したVA発現を確保しました。この実験は、染色体外アレイでも行うことができます。特定のVAニューロンにおけるクリムゾン発現は、例えば、クリムゾン導入遺伝子をSL2トランスプライシングリーダー配列に結合させることによって、共発現マーカーとして下流の核局在GFPと結合させることによって独立して確認することができる2。測定されたGCaMPシグナルが厳密にATRに依存するクリムゾンの光遺伝学的活性化に依存することを確認するために、ATRの非存在下で対照実験を行うことが不可欠です(図4D)。最後に、誘発Ca++信号は過渡的であるため、488nmレーザーによる561 nm励起とGCaMP信号取得の間の迅速な切り替え(<1秒)を可能にするイメージングプロトコルを採用することが重要です(図4)。

図1:DD樹状突起スパインの標識 。 (A) (上) C.エレガンスの腹側神経索にある6つの背側D(DD1-DD6)ニューロン。(下)成人では、腹側A(VA)および腹側B(VB)運動ニューロン(マゼンタ)のシナプス前終末に腹側指向のDD棘(矢じり)が接触し、DD交連が背側神経索まで伸びて、体の筋肉にGABA作動性出力を提供します(矢印)18。この図は、参考文献2から修正されています。(B)若年成虫の細胞質mCherry、ミリストイル化mRuby(MYR::mRuby)、LifeAct::GFPおよびGFP::ウトロフィンで標識されたDDスパインの蛍光顕微鏡写真(Airyscan)。灰色の矢印は棘を指しています。スケールバー = 2 μm. (C) 細胞質mCherry(3.77 ± 0.9)、MYR::mRuby(3.09 ± 0.8)、LifeAct::GFP(3.44 ± 1.1)またはGFP::ウトロフィン(2.41 ± 0.8)で標識されたDDニューロン樹状突起スパインの密度(スパイン/10μm)。すべてのサンプルは正規分布しています。一元配置分散分析では、細胞質mCherry、MYR::mRuby、LifeAct::GFPのスパイン密度は有意差(NS)ではないのに対し、GFP::ウトロフィン 対スパイン密度は低下していることを示しています。細胞質ゾル標識されたmCherry(p = 0.0016)およびLifeAct::GFP(p = 0.0082)。赤い破線は、3D EM再構成から評価されたDDニューロンのスパイン密度(4.2スパイン/ 10μm)を表します。この図は、参考文献2から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。

図2:DD樹状突起スパインのイメージング。 (A)(上)背骨形状の模式図。(下)LifeAct::GFP(緑)で標識された各タイプの脊椎(スケールバー= 500 nm)のAiryscan画像と、高圧凍結成人(青)の連続電子顕微鏡写真による3D再構成。(B)LifeAct::GFPで視覚化されたタイプ別の脊椎頻度:薄い/キノコ(55.5±14.5%)、糸状(10.3 ± 8.70%)、スタビー(18.8 ± 10.7%)、分岐(15.42 ± 6.01%)。MYR::mRubyで視覚化されたタイプ別のスパイン頻度:薄い/キノコ(52.2±16.5%)、フィロポディアル(5.68 ± 7.0%)、スタビー(33.1 ± 14.8%)、分岐(9.02 ± 9.6%)。対応のないT検定、フィロポディアル(p = 0.0339);MYR::mRubyマーカーで標識されたスタビー(p = 0.0009)および分岐(p = 0.011)スパインは、LifeAct::GFPとは大きく異なります。この図は、参考文献2から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
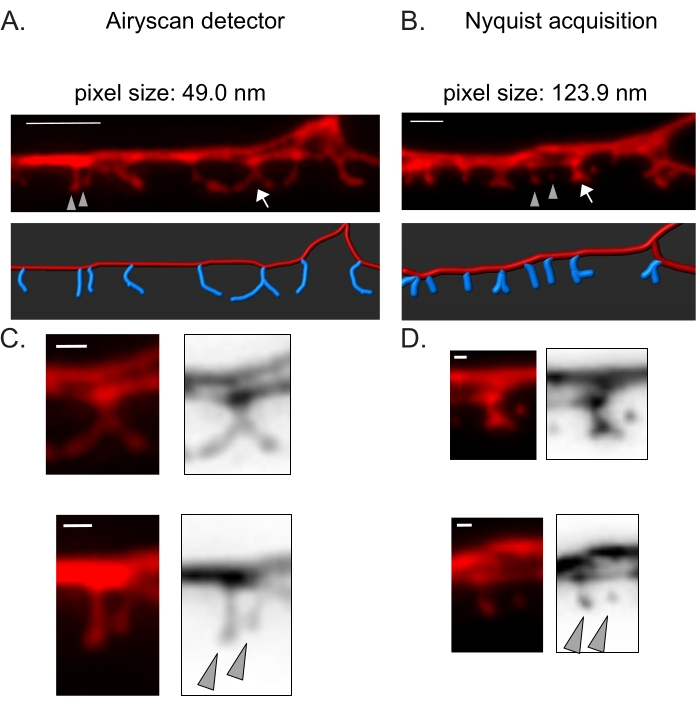
図3:DDスパインの高解像度画像を取得するための戦略 。 (A-B) (上)細胞質マーカー(mCherry)で標識したDD1樹状突起の蛍光画像(A)エアリスカン検出器および(B)ナイキスト取得による。(下)DDデンドライト(赤)は画像解析ソフトウェア(フィラメントトレーサーの自動パスオプション)で描かれ、DDスパイン(青)は半自動スパイン検出モジュールを使用してグラフィカルに示されています。矢印はCとDで拡大された分岐した棘を指し、矢尻はCとDで拡大された隣接する細い/キノコの棘を示します。 スケールバー= 2μm。 (C-D)(上)分岐した棘(矢印)と(下)2つの隣接する細い/キノコの棘(矢じり)の拡大例(C)エアリスカン検出器または(D)ナイキストの取得によって取得。スケールバー= 500 nm。2から再現したデータ。 この図の拡大版を表示するには、ここをクリックしてください。

図4:DDスパインの機能の評価。 (A)DD運動ニューロンはCa++指標GCaMP6(緑)を発現し、VA運動ニューロンはチャネルロドプシン変異体であるクリムゾン(マゼンタ)7を発現します。(B)Ca++測定用ワームの取り付け方法を模式図。(1)きれいな顕微鏡スライド上に、(2)2 μLの0.05 μmポリビーズを置き、(3)白金線(「ワームピック」)を使用して瞬間接着剤の小さな小球を追加し、(4)溶液に渦巻いて糸状の接着剤ストランドを生成します。(5)M9バッファーを3μL添加する。(6)溶液に約10匹のL4幼虫を入れ、(7)カバーガラスを塗り、ワセリン/ワックスで端を密封します。(C-D)VAニューロンの活性化は、DD1スパインのCa++トランジェントと相関しています。クリムゾンの周期的な光活性化(2.5秒間隔)で(0.5秒間隔で)画像化されたGCaMP6s蛍光は、(C)+ATR(n = 12)ではCa++トランジェントを誘発しますが、(D)コントロール(-ATR、n = 12)では誘発しません。パネルは、561nmの光(縦のピンク色の線)のパルス前後の経時的なスナップショットです。スケールバー = 2 μm。 GCaMP6s信号は、各スパインの先端にあるROI(関心領域)から取得されます。(E)+ATR(緑)対-ATR(対照、灰色)についてプロットした10秒間の記録期間中のGCaMP6s蛍光(n = 12ビデオ)。ピンク色の縦のバーは、561 nmの照明(クリムゾンの活性化など)を示します。各動物を561nmの光で4回刺激した。測定値は、561nm光の各パルスの前後に収集した。(f)561nm光の各パルス前後のGCaMP6s蛍光のプロット。GCaMP6s蛍光は、561nm光の各パルスの1秒後に測定した。サンプルは正規分布していないため、対応のあるノンパラメトリックフリードマン検定を適用して、GCaMP6の蛍光の多重比較を補正しました。ATR(+ATR、緑)(** p = 0.0004、n = 48測定)またはATRの非存在下(-ATR、灰色)(NS、有意ではない、p = 0.0962、n = 48測定)のいずれかで増殖したワームの561nm光刺激後。この図は、参考文献2から修正されています。この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル1:研究で使用されたプラスミドのリスト。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:M9バッファーの組成と調製。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
Airyscan検出器は、従来の共焦点顕微鏡よりも高い信号対雑音比と優れた解像度を提供するため、DDスパインのスナップショットを取得するために選択されました19,20。AiryScanイメージングでは、従来の蛍光タンパク質(GFP、mCherryなど)の使用も可能になり、現在ではC.エレガンスに広く利用可能です。他の超解像法(例えば、STORM、STED、PALM)を用いてより高い解像度の画像を得ることができるが、これらの方法は、光活性化可能または光切り替え可能な蛍光タンパク質を必要とする21。Airyscanに代わるものとして、従来の共焦点顕微鏡が推奨されます。例えば、ナイキスト取得によるイメージング(図3)では、40倍/1.3対物レンズの123.9 nmを使用してピクセルサイズを達成し、脊椎の形態タイプを区別するのに十分です(図2)。
スパイン密度を決定するには、(1)mCherryやGFPなどの細胞質蛍光タンパク質を使用してアクチン細胞骨格を標識するか、(2)LifeActを使用してアクチン細胞骨格を標識するか、(3)ミリストイル化蛍光タンパク質(MYR::mRubyなど)を使用して原形質膜を標識することが推奨されます(図1B)。比較すると、F-アクチン結合タンパク質ウトロフィンは脊椎密度を低下させ(図1C)、ウトロフィンが過剰発現すると脊椎の形態形成に悪影響を与えることを示しています。
現在のイメージング法は、脊椎の形態を支配する遺伝的変異を特定するのに役立つはずです1,16。DDスパインの形態(すなわち、薄い/キノコ、糸状、ずんぐりした、分岐した、図2を参照)は、ほとんどのDDスパインが特徴的な腹側向きの向きを採用しているため、腹側神経索の外側画像の単一の2D投影から評価できます。これらの比較では、明らかな脊椎の形態型が標識方法の影響を受けているように見えるため、各条件に同じ蛍光マーカーを使用することが不可欠です(例:MYR::mRuby vs.ライフアクト::GFP)。さらに、スパイン形状は動的であり、外部信号に応答して形状が変化する可能性が高いことに留意した2,16。したがって、同様の発生段階および同様の条件下での遺伝子型間で脊椎の形状を比較することも不可欠です。
C.エレガンスの腹側の向きは、正確な画像取得に非常に重要です。動物の反対側の腹側と背側の両方のコードが同じZ平面に見えるはずであり、ワームがその側に向けられていることを示しています(図1B)。腹帯の近くで他の虫や泡と動いたり接触したりする虫の画像は、棘の画像を劣化させる可能性があるため、収集しないことをお勧めします。
in vivoカルシウムイメージングでは、各取得の直前に新鮮なスライドを準備する必要があります。細い接着剤繊維のみと接触しているワームを画像化するのが最善です。ワームを乾燥させ、画像を劣化させる傾向がある接着剤の「塊」(図4B)。図4に示す実験では、561nmの光のパルスが視野全体を活性化します。例えば、個々のDDスパイン内の局所的なCa++過渡現象を検出するために時間的および空間的分解能を増加させるために、561nmレーザーライン用にセットアップされたガルボミニスキャナーを使用して、より小さな関心領域を刺激することができる17。
開示事項
利益相反はないと宣言します。
謝辞
Imarisのイメージングと分析は、NIHがサポートするヴァンダービルト細胞イメージング共有リソース(CIRS)で実行されました(CA68485、DK20593、DK58404、DK59637、およびEY08126)。LSM 880 は助成金 1S10OD201630 でサポートされています。ニコンのスピニングディスクでのイメージングは、ニコンセンターオブエクセレンスで行われました。CISRディレクターのジェニー・シェーファーとブライアン・ミリスには、トレーニングと洞察に満ちた議論をしてくれたこと、そしてバーネットラボのメンバーであるディラン・バーネット、エイダン・フェニックス、ニレイ・タネハにアドバイスをいただき、感謝します。この研究は、DMMへの国立衛生研究所の助成金(R01NS081259およびR01NS106951)およびACCへの米国心臓協会の助成金(18PRE33960581)によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| All-trans retinal (ATR) | Sigma-Aldrich | R2500-100MG | Necessary cofactor for neuronal excitation with Chrimson |
| diH2O | MilliQ | To prepare M9 buffer | |
| Ethanol 100% | Sigma | 64-17-5 | To dilute ATR and make control plates for neuronal excitation |
| Ethyl 3-aminobenzoate methanesulfonate salt (tricaine) | To immobilize animals for imaging dendritic spines | ||
| ImageJ | NIH | (Schindelin J et al., 2012) | Open source image processing software |
| KH2PO4 | Fisher Bioreagents | 7758-11-4 | To prepare M9 buffer |
| Levamisole hydrochloride | Sigma | 16595-80-5 | To immobilize animals for imaging dendritic spines |
| MgSO4 | Fisher Chemical | M63-500 | To prepare M9 buffer |
| Microscope cover glass | Fisherbrand | 12542B | To mount animals for microscopy acquisition |
| Na2HPO4 | Fisher Scientific | S369-500 | To prepare M9 buffer |
| NaCl | Fisher Chemical | S671-3 | To prepare M9 buffer |
| NIS Elements version 05.21 | Nikon | To analyze images and movies (e.g., Deconvolution, image alignment) | |
| Polybeads carboxylate 0.05um microspheres | Polysciences, Inc | 15913-10 | To immobilize animals for imaging Ca++ transients |
| Prism | For statistical analysis and graphing normalized Ca++ transients | ||
| SeaKen ME agarose | Lonza | 50014 | To make agarose pads to mount animals for imaging |
| Super Glue | The gorilla company | To immobilize animals for imaging Ca++ transients | |
| Superfrost microscope slides | Fisherbrand | 22-034-980 | To mount animals for microscopy acquisition |
| vaseline | Covidien | 8884430300 | To seal sample for confocal snapshots |
| Wax | Fisherbrand | 23-021-399 | Paraplast tissue embedding medium |
| Microscope for super-resolution imaging | |||
| LSM880 | Zeiss | ||
| AiryScan detector | Zeiss | ||
| Plan Apochromat (oil) 63x/ 1.40 NA, WD = 0.19 mm | |||
| Laser lines | |||
| Stage controller | |||
| Microscope for Nyquist image acquisition | |||
| A1R Confocal | Nikon | ||
| Plan Fluor (oil) 40x/1.3 NA, WD 0.24 mm | |||
| 488 nm, 16mW | |||
| 561 nm, 17mW | |||
| Microscope to monitor evoked Ca++ transients in dendritic spines | |||
| Spinning Disk Confocal | Nikon | ||
| Andor DU-897 EMCCD camera | |||
| Spinning disk Head CSU-X1 | Yokogawa | ||
| Apo TIRF (oil) 100x/1.49 NA ,WD 0.12 mm | |||
| 488 nm, 65mW | |||
| 561 nm, 86mW | |||
| 525 nm (+/- 18 nm) | |||
| 605 nm (+/- 35 nm) |
参考文献
- Sala, C., Segal, M. Dendritic Spines: The Locus of Structural and Functional Plasticity. Physiological Reviews. 94 (1), 141-188 (2014).
- Cuentas-Condori, A., et al. C. elegans neurons have functional dendritic spines. Elife. 8, 47918 (2019).
- Philbrook, A., et al. Neurexin directs partner-specific synaptic connectivity in C. Elegans. Elife. 7, 35692 (2018).
- Oliver, D., Alexander, K., Francis, M. M. Molecular Mechanisms Directing Spine Outgrowth and Synaptic Partner Selection in Caenorhabditis elegans. Journal of Experimental Neuroscience. 12, 10-13 (2018).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5, 605-607 (2008).
- Ladt, K., Ganguly, A., Roy, S. Axonal actin in action: Imaging actin dynamics in neurons. Methods of Cell Biology. 131, 91-106 (2016).
- Schild, L. C., Glauser, D. A. Dual color neural activation and behavior control with chrimson and CoChR in Caenorhabditis elegans. Genetics. 200 (4), 1029-1034 (2015).
- Mello, C., Kramer, J., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrahcormosomal maintenance and integration of transforming sequences. The EMBO Journal. 10 (12), 3959-3970 (1991).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C . elegans Using Microinjection. Journal of Visualized Experiments. (18), e833 (2008).
- Smith, C. J., et al. Time-lapse imaging and cell-specific expression profiling reveal dynamic branching and molecular determinants of a multi-dendritic nociceptor in C. elegans. Developemntal Biology. 345 (1), 18-33 (2010).
- Mccarter, J., Bartlett, B., Dang, T., Schedl, T. Soma - Germ Cell Interactions in Caenorhabditis elegans : Multiple Events of Hermaphrodite Germline Development Require the Somatic Sheath and Spermathecal Lineages. Developemntal Biology. 181 (2), 121-143 (1997).
- Driscoll, M. Mounting animals for observation with Nomarski DIC optics. WormBook. , (2008).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. Journal of Cell Biology. 172 (1), 9-18 (2006).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Hotulainen, P., Hoogenraad, C. C. Actin in dendritic spines connecting dynamics to function. Journal of Cell Biology. 189 (4), 619-629 (2010).
- Berry, K. P., Nedivi, E. Spine Dynamics: Are They All the Same. Neuron. 96 (1), 43-55 (2017).
- Miller, D. M., Niemeyer, C. J. Expression of the unc-4 homeoprotein in Caenorhabditis elegans motor neurons specifies presynaptic input. Development. 121 (9), 2877-2886 (1995).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Ventral Nerve Cord of Caenorhadbitis elegans. Philosophical Transactions of the Royal Society. 275 (938), 327-348 (1976).
- Huff, J. The Airyscan detector from ZEISS confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, (2015).
- Huff, J. The Fast mode for ZEISS LSM 880 with Airyscan high-speed confocal imaging with super-resolution and improved signal-to-noise ratio. Nature Methods. 13, (2016).
- Jacquemet, G., Carisey, A. F., Hamidi, H., Henriques, R., Leterrier, C. The cell biologist's guide to super-resolution microscopy. Journal of Cell Science. 133 (11), 240713 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved