Method Article
Imagem de espinhas dendríticas em Caenorhabditis elegans
Neste Artigo
Resumo
As espinhas dendríticas são características celulares importantes do sistema nervoso. Aqui são descritos métodos de imagem vivos para avaliar a estrutura e a função dos espinhos dendríticos em C. elegans. Essas abordagens apoiam o desenvolvimento de telas mutantes para genes que definem a forma ou a função da coluna dendrítica.
Resumo
Os espinhos dendríticos são locais especializados de inervação sináptica modulados pela atividade e servem como substratos para a aprendizagem e a memória. Recentemente, espinhas dendríticas têm sido descritas para neurônios DD GABAérgicos como os locais de entrada de neurônios colinérgicos pré-sinápticos no circuito motor de Caenorhabditis elegans. Este circuito sináptico pode agora servir como um novo e poderoso modelo in vivo de morfogênese e função da coluna vertebral que explora a genética fácil e a pronta acessibilidade do C. elegans para imagens de células vivas.
Este protocolo descreve estratégias experimentais para avaliar a estrutura e a função da coluna vertebral DD. Nesta abordagem, uma estratégia de imagem de super-resolução é usada para visualizar as formas intrincadas de espinhas dendríticas ricas em actina. Para avaliar a função da coluna vertebral DD, a opsina ativada pela luz, Chrimson, estimula os neurônios colinérgicos pré-sinápticos, e o indicador de cálcio, GCaMP, relata os transientes de cálcio evocados em espinhas DD pós-sinápticas. Juntos, esses métodos compreendem abordagens poderosas para identificar determinantes genéticos de espinhos dendríticos em C. elegans que também poderiam direcionar a morfogênese e a função da coluna vertebral no cérebro.
Introdução
As espinhas dendríticas são estruturas celulares especializadas que recebem entrada de neurônios vizinhos para transmissão sináptica. A ativação de receptores de neurotransmissores eleva o cálcio intracelular e as vias de sinalização a jusante nessas saliências neuronais características1. Devido à importância fundamental das espinhas dendríticas para a neurotransmissão e sua desregulação nas doenças do neurodesenvolvimento1, a descoberta de fatores que modulam a morfogênese e a função da coluna dendrítica é de alto interesse para o campo da neurociência.
Recentemente, espinhos dendríticos foram identificados no sistema nervoso de C. elegans com base em características-chave compartilhadas com espinhos de mamíferos2. Essa determinação é crucial porque abre a possibilidade de explorar as vantagens de C. elegans para investigar a biologia da coluna. Espinhos dendríticos em neurônios motores Dorsal D (DD) recebem entrada de neurônios colinérgicos (VA e VB) no cordão nervoso ventral (Figura 1A)2,3,4. Aqui, métodos de imagem são apresentados para explorar a estrutura dos espinhos dendríticos DD e sua função in vivo em um sistema nervoso intacto que é prontamente acessível a imagens vivas e análises genéticas. Para monitorar a forma das espinhas dendríticas, (1) proteínas fluorescentes citosólicas, que preenchem o processo dendrítico e os espinhos; (2) proteínas fluorescentes ligadas à membrana, que decoram a borda de espinhos dendríticos e dendritos; ou (3) são utilizados os marcadores de actina, LifeAct5 ou Utrophin6, que são enriquecidos em espinhos dendríticos, revelando assim a sua forma. Para monitorar a funcionalidade das espinhas DD, a fluorescência GCaMP é usada para detectar transientes Ca++ evocados pela ativação da opsina desviada para o vermelho, Chrimson, em neurônios colinérgicos pré-sinápticos7. Espera-se que ambas as estratégias facilitem o estudo de espinhos dendríticos DD em animais selvagens e mutantes.
Protocolo
1. Determinação da estrutura dos espinhos dendríticos DD
- Criar vermes transgênicos para rotular espinhos DD
- Use o promotor flp-13 para construir um vetor de expressão para o rótulo de interesse (por exemplo, mCherry citoplasmático, MYR::mRuby, LifeAct::GFP, GFP::utrophin) (Figura 1). Veja a lista completa de plasmídeos no Arquivo Suplementar 1.
- Utilizar métodos estabelecidos para gerar uma linha transgênica marcando espinhos DD 8,9.
- Prepare o selante
- Faça uma mistura 1:1 de meio de incorporação à base de parafina10 (consulte Tabela de Materiais).
- Aquecer o meio a 60 °C até à fusão, depois alíquota em tubos de microcentrífuga tampados de 1,5 ml e manter um bloco de aquecimento a 60-70 °C.
NOTA: O selante pode durar 4 semanas no bloco de aquecimento.
- Prepare um anestésico.
- Fazer soluções-mãe em H2O destilado de 1% de tricaína e 1 M de levamisol (ver Tabela de Materiais). Conservar a -20 °C.
- Preparar uma solução de trabalho de tricaína a 0,05% e anestésico levamisole a 15 mM, conforme descrito nas etapas 1.3.3-1.3.511.
- Misture 75 μL de 1% de tricaína e 22,5 μL de 1 M levamisole.
- Adicionar tampão M9 a um volume final de 1,5 ml.
- Aliquot 10 μL de tricaína a 0,05%, levamisol 15 mM em tubos de microcentrífuga de 0,5 ml e conservar a -20 °C.
NOTA: A mistura anestésica é sensível à temperatura e as alíquotas individuais da solução de trabalho não devem ser refrozendas após o descongelamento para cada experiência. Consulte Arquivo suplementar 2 para obter uma receita para o buffer M9.
- Adquira imagens de alta resolução
- Preparar 10% de agarose e mantê-la em banho-maria a 60 °C.
NOTA: Veja o relatório de Monica Driscoll no WormBook12. - Monte 15-20 adultos jovens em almofadas de agarose a 10% e adicione 3 μL de anestésico (ver passo 3).
- Aplique o coverslip (os vermes são imobilizados dentro de 5 min).
- Sele as bordas da folha de cobertura com uma mistura de selante adesivo derretido (consulte Tabela de materiais).
- Adquira imagens
- Aquisição de super-resolução
- Use um microscópio confocal de varredura a laser equipado para microscopia de super-resolução com uma lente objetiva de óleo Plan-Apochromat de 63x/1,40 para alcançar um tamanho de pixel pequeno (por exemplo, < 50 nm). Adquira Pilhas Z usando o tamanho de etapa recomendado pelo software do fabricante (consulte Tabela de materiais).
- Colete uma série de seções ópticas que abrangem o volume total do processo ventral DD (por exemplo, 15-20 fatias com 0,19 μm de tamanho de passo ou 2-3μm de espessura). Envie pilhas Z para processamento de imagens usando o software do fabricante e analise imagens com pontuação superior a 7 (Figura 1B, Figura 2 e Figura 3).
- Aquisição da Nyquist
- Use um microscópio confocal de varredura a laser para selecionar o tamanho ideal de pixel para o comprimento de onda da luz e abertura numérica da lente objetiva em uso (por exemplo, objetiva de óleo Fluor Plan 40x/1.4).
NOTA: O tamanho de pixel menor revelará a estrutura fina das espinhas DD. - Envie a pilha para deconvolução 3D usando o algoritmo Automatic (consulte Tabela de materiais) (Figura 3).
- Use um microscópio confocal de varredura a laser para selecionar o tamanho ideal de pixel para o comprimento de onda da luz e abertura numérica da lente objetiva em uso (por exemplo, objetiva de óleo Fluor Plan 40x/1.4).
- Use o menor passo Z possível (por exemplo, determinado pelo estágio Piezo) porque a superamostragem em Z pode produzir imagens mais nítidas após a deconvolução 3D13.
- Aquisição de super-resolução
- Preparar 10% de agarose e mantê-la em banho-maria a 60 °C.
- Análise de imagem
- Use um software de processamento de imagem apropriado (consulte Tabela de Materiais) para criar projeções de intensidade máxima das pilhas Z14.
- Conte manualmente as saliências no dendrito DD.
NOTA: As saliências são extensões perpendiculares do eixo principal (Figura 1B, pontas de seta). - Determinar o comprimento do dendrito DD pontuado para calcular a densidade dos espinhos por 10 μm de dendrito DD (Figura 1C).
- Classificar os espinhos em finos/cogumelos, filopodianos, grossos ou ramificados (Figura 2A).
NOTA: Os espinhos finos / cogumelos exibem uma base estreita (pescoço) e uma ponta mais larga (cabeça). Os espinhos filopodiais não exibem uma base contraída (sem pescoço), mas têm uma largura constante. Os espinhos grossos têm uma base e ponta largas. Espinhos ramificados são saliências com mais de uma ponta.
2. Avaliação da ativação de espinhos dendríticos DD por sinalização colinérgica pré-sináptica
- Criar vermes transgênicos usando técnicas convencionais (por exemplo, microinjeção)8,9
- Use o promotor flp-13 para impulsionar a expressão do sensor Ca++ , GCaMP6s, em neurônios DD e o promotor unc-4 para impulsionar a expressão de Chrimson, uma canalrodopsina deslocada para o vermelho, em neurônios VA pré-sinápticos (Figura 4A). Consulte a lista de plasmídeos no Arquivo Suplementar 1.
- Prepare placas All-trans Retinal (ATR) e controle.
NOTA: ATR é um cofator necessário para Chrimson funcionar como um canal iônico optogeneticamente ativado.- Preparar solução de estoque de ATR 100 mM em etanol (100%). Conservar a -20 °C em alíquotas de 1 ml.
- Sob um exaustor de fluxo laminar, adicione 300 μL de cultura bacteriana OP50 durante a noite e 0,25 μL de ATR a cada placa de ágar nutriente NGM (Nematode Growth Medium) de 60 mm e espalhe com uma haste de vidro estéril.
- Para controles, adicione 300 μL de bactérias OP50 e 0,25 μL de etanol (100%) a um grupo separado de placas de NGM.
- Deixe as placas assentarem no exaustor à temperatura ambiente durante 24 horas (protegidas da luz ambiente) para permitir o crescimento bacteriano.
NOTA: As placas podem ser utilizadas após a incubação inicial de 24 h ou mantidas a 4 °C para utilização no prazo de 5 dias.
- Configurando o experimento
- Coloque cinco larvas de estágio NC3569 L4 em ATR com sementes OP50 ou placas de controle que não possuem ATR e crescem na escuridão a 23 ° C.
- Três dias depois, use um microscópio de dissecação estéreo para confirmar o desenvolvimento da vulva para escolher a progênie do estágio L4 do ATR e placas de controle para imagem, conforme descrito nas etapas 2.4.1-2.4.3.
- Em uma lâmina de microscópio, coloque 2 μL de poliesferas de 0,05 μm (2,5% de sólidos p/v) (ver Tabela de Materiais).
- Use um fio de platina ("picareta de minhoca") para adicionar um pequeno glóbulo de super cola à solução e gire suavemente para gerar "fios" filamentosos de cola. Em seguida, adicione 3 μL de buffer M9 (Figura 4B).
- Coloque aproximadamente dez larvas de L4 na solução e aplique um deslizamento de cobertura.
NOTA: As fibras de cola entrarão em contato aleatoriamente com os vermes e os imobilizarão após a aplicação da lâmina de cobertura. Vermes que estão embutidos em grandes glóbulos de cola parecem desidratados e não devem ser fotografados. - Bordas de vedação da folha de cobertura, tal como mencionado na etapa 1.4.4.
- Registro de transientes evocados de Ca++ em espinhos dendríticos.
- Use um microscópio confocal de disco giratório equipado com uma câmera CCD sensível, uma lente objetiva de óleo TIRF de 100x e linhas de laser de 488 nm e 561 nm (consulte Tabela de Materiais).
- Ajuste o estágio do microscópio para posicionar as espinhas DD no plano focal.
- Configure a aquisição de lapso de tempo para iluminar a amostra com a linha de laser de 488 nm a cada quadro (para detectar a fluorescência GCaMP6s) e a linha de laser de 561 nm em intervalos periódicos (para excitação de Chrimson).
NOTA: Por exemplo, use luz de 488 nm para capturar instantâneos consecutivos (200 ms) de sinal GCaMP6s juntamente com um pulso de 200 ms de luz de 561 nm a cada 5º quadro (Figura 4C-E). Com essa configuração, os níveis de GCaMP antes e depois de cada pulso de 561 nm são detectados ~1 s de distância (200 ms de laser de 488 nm para detectar GCaMP antes da ativação do VA, 200 ms de pulso de 561 nm para ativar o VA e ~600 ms para alternar entre linhas de laser e filtros de emissão. Com essa configuração, os neurônios VA são ativados a cada 2,5 s.
- Análise de imagens Ca++ in vivo
- Use a deconvolução 2D e o alinhamento da imagem para corrigir pequenos desvios decorrentes do movimento do verme durante a aquisição (consulte a Tabela de Materiais).
- Defina a coluna dendrítica DD como a Região de Interesse (ROI nas Figuras 4C-D).
- Duplique o ROI e realoque para uma região vizinha dentro do worm para coletar o sinal de fundo (ou seja, ruído).
- Use o software apropriado (consulte Tabela de materiais) para exportar as intensidades do GCaMP6s para se destacarem para cada ponto de tempo. Subtraia a fluorescência de fundo da fluorescência do ROI da coluna.
- Determine a mudança na fluorescência subtraindo a fluorescência GCaMP6s no quadro imediatamente antes da excitação de 561 nm (F0) de cada ponto de tempo após a excitação (ΔF), dividindo por F0 para determinar ΔF/F0 (Figura 4E).
- Represente graficamente os traços normalizados (Consulte Tabela de Materiais).
- Realizar um teste estatístico emparelhado para cada medição de fluorescência GCaMP6s antes e depois de cada pulso de luz de 561 nm.
NOTA: Esta abordagem exclui efetivamente flutuações aleatórias na fluorescência de GCaMP6s que, de outra forma, reduzem o poder estatístico de comparação do sinal médio de GCaMP6s de todas as medições antes e depois da excitação de 561 nm (Figura 4F). - Para medidas que mostram uma distribuição normal ou gaussiana, use um teste de ANOVA paramétrica emparelhada e corrija comparações múltiplas para cada um dos dois grupos (ATR antes vs. depois, sem ATR antes vs. depois). Como alternativa, para dados que normalmente não são distribuídos, use uma ANOVA não paramétrica com correção posthoc para testes múltiplos.
NOTA: Worms cultivados em placas que não possuem ATR ("sem ATR") são controles necessários e não devem mostrar transientes Ca++ ativados por 561 nm porque o ATR é necessário para a função Chrimson.
Resultados
Medidas com três marcadores independentes (mCherry citosólico, LifeAct::GFP, MYR::mRuby) produziram uma densidade média de 3,4 ± 1,03 espinhos dendríticos DD por 10 μm de dendrito DD em adultos jovens do tipo selvagem (Figura 1B,C). Para esta análise, foram excluídas as medidas obtidas com o marcador GFP::Utrophin que produziu uma densidade de coluna significativamente menor (2,4 ± 0,74, Figura 1) devido às interações da Utrophin com o citoesqueleto da actina6 que potencialmente impulsiona a morfogênese da coluna vertebral15. As medidas da densidade da coluna vertebral no microscópio de luz são comparáveis ao valor de 4,2 espinhos/dendrito de 10 μm obtido a partir da reconstrução de 12 espinhos a partir de micrografias eletrônicas do neurônio DD12. A abordagem de imagem de células vivas confirmou que a morfologia fina/em forma de cogumelo dos espinhos DD predomina nas formas de coluna adulta versus alternativa (por exemplo, filopodial, teimosa, ramificada) (Figura 2B), o que também é típico para espinhos no sistema nervoso de mamíferos maduros16.
Uma estratégia optogenética foi utilizada para perguntar se as espinhos dendríticos presuntivos detectados por microscopia de luz de alta resolução (Figura 1 e Figura 2) respondem à liberação de neurotransmissores de sítios pré-sinápticos, uma característica característica dos espinhos dendríticos em neurônios de mamíferos. A luz verde (561 nm) foi usada para ativar uma variante de canalrhodopsina, Chrimson, em neurônios colinérgicos pré-sinápticos e luz azul (488 nm) para detectar fluorescência dependente de Ca++ emitida por uma sonda citoplasmática GCaMP em espinhas dendríticas DD pós-sinápticas. Este experimento detectou explosões transitórias de sinal GCaMP em espinhas DD imediatamente após a ativação optogenética de Chrimson em neurônios VA pré-sinápticos (Figura 3). O sucesso deste experimento depende da expressão confiável de Chrimson em todos os neurônios AV pré-sinápticos. Neste caso, um integrante cromossômico17 do marcador Punc-4::Chrimson foi usado para garantir a expressão consistente do VA. Este experimento também poderia ser conduzido com uma matriz extracromossômica. A expressão de Chrimson em um neurônio VA específico pode ser confirmada de forma independente, por exemplo, acoplando o transgene de Chrimson a uma sequência de líderes transplicados SL2 com uma GFP localizada nuclear a jusante como um marcador de co-expressão2. É essencial realizar um experimento de controle na ausência de ATR para confirmar que o sinal de GCaMP medido depende da ativação optogenética de Chrimson, que é estritamente dependente de ATR (Figura 4D). Finalmente, como os sinais evocados de Ca++ são transitórios, é crucial adotar um protocolo de imagem que permita a comutação rápida (<1 s) entre a excitação de 561 nm e a aquisição do sinal GCaMP com o laser de 488 nm (Figura 4).

Figura 1: Marcação de espinhos dendríticos DD . (A) (Top) Seis neurônios Dorsal D (DD1-DD6) no cordão nervoso ventral de C. elegans. (Abaixo) Em adultos, as espinhas DD direcionadas ventralmente (cabeça de seta) entram em contato com os terminais pré-sinápticos dos neurônios motores ventrais A (VA) e Ventral B (VB) (magenta), e as comissuras DD se estendem ao cordão nervoso dorsal para fornecer saída GABAérgica aos músculos do corpo (seta)18. Este valor foi modificado a partir da referência2. (B) Micrografias fluorescentes (Airyscan) de espinhos DD marcados com mCherry citosólico, mRuby miristoilado (MYR::mRuby), LifeAct::GFP e GFP::Utrophin em vermes adultos jovens. As pontas de seta cinza apontam para as espinhos. Barra de escala = 2 μm. (C) Densidade (espinhos/10 μm) de espinhas dendríticas de neurônios DD marcadas com mCherry citosólica (3,77 ± 0,9), MYR::mRuby (3,09 ± 0,8), LifeAct::GFP (3,44 ± 1,1) ou GFP::Utrophin (2,41 ± 0,8). Todas as amostras são normalmente distribuídas. A ANOVA One-Way mostra que as densidades da coluna vertebral para mCherry citosólico, MYR::mRuby e LifeAct::GFP não são significativamente (NS) diferentes, enquanto a densidade da coluna vertebral é reduzida para GFP::Utrophin vs. mCherry marcado citosolicamente (p = 0,0016) e LifeAct::GFP (p = 0,0082). A linha vermelha tracejada representa a densidade da coluna vertebral dos neurônios DD avaliados a partir da reconstrução 3D EM (4,2 espinhos/10 μm). Este valor foi modificado a partir da referência2. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2: Imagem das espinhas dendríticas DD. (A) (Topo) Esquema das formas das colunas. (Abaixo) Imagens airyscan de cada tipo de coluna vertebral (barra de escala = 500 nm) rotuladas com LifeAct::GFP (verde) e reconstruções 3D por micrografias eletrônicas seriais de um adulto congelado de alta pressão (azul). (B) Frequência da coluna vertebral por tipo, visualizada com LifeAct::GFP: Filopodial (55,5 ± 14,5%), Filopodial (10,3 ± 8,70%), Teimosa (18,8 ± 10,7%), Ramificada (15,42 ± 6,01%). Frequência de espinhos por tipo visualizada com MYR::mRuby: Filopodial (52,2 ± 16,5%), Filopodial (5,68 ± 7,0%), Stubby (33,1 ± 14,8%), Ramificado (9,02 ± 9,6%). Teste T não pareado, Filopodial (p = 0,0339); Os espinhos Stubby (p = 0,0009) e Branched (p = 0,011) rotulados com o marcador MYR::mRuby são significativamente diferentes do LifeAct::GFP. Este valor foi modificado a partir da referência2. Por favor, clique aqui para ver uma versão maior desta figura.
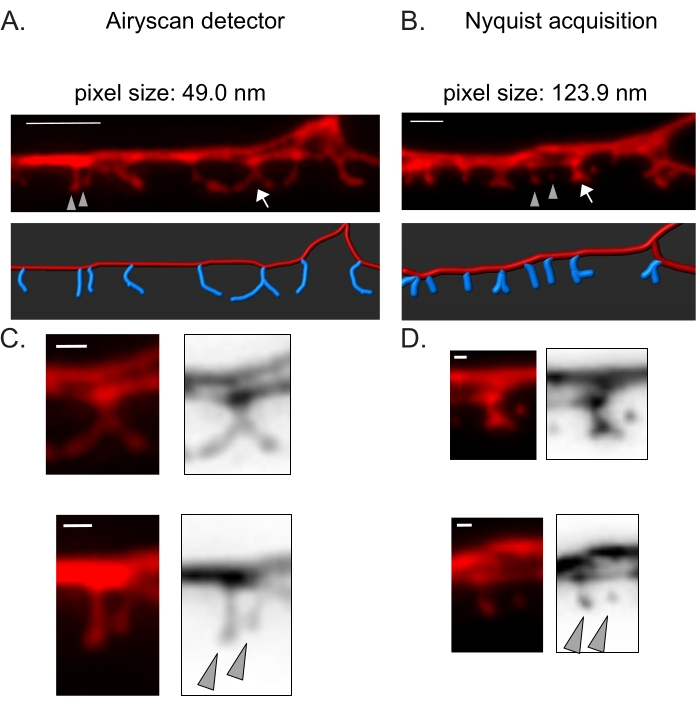
Figura 3: Estratégias para aquisição de imagens de alta resolução de espinhos DD . (A-B) (Top) Imagens fluorescentes de dendritos DD1 marcados com um marcador citosólico (mCherry) por (A) detector Airyscan e (B) aquisição de Nyquist. (Abaixo) O dendrito DD (vermelho) é representado com um software de análise de imagem (opção de caminho automático do traçador de filamento), e os espinhos DD (azul) são ilustrados graficamente usando o módulo de detecção de espinhos semi-automatizado. A seta aponta para a coluna ramificada ampliada em C e D. As pontas de seta denotam espinhos finos/cogumelos vizinhos ampliados em C e D. Barra de escala = 2 μm. (C-D) Exemplos ampliados de espinha ramificada (seta) (seta) e (inferior) dois espinhos finos / cogumelos vizinhos (pontas de seta) obtidos com (C) detector Airyscan ou por (D) aquisição de Nyquist. Barra de escala = 500 nm. Dados reproduzidos de2. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 4: Avaliação da função das espinhas DD. (A) Os neurônios motores DD expressam o indicador Ca++ GCaMP6s (verde), e os neurônios motores VA expressam a variante channelrhodopsin-, Chrimson (magenta)7. (B) Método de representação esquemática para montagem de worms para medições de Ca++ . (1) Em uma lâmina de microscópio limpa, (2) coloque 2 μL de contas poli de 0,05 μm, (3) use um fio de platina ("picareta de minhoca") para adicionar um pequeno glóbulo de super cola e (4) gire na solução para gerar filamentos de cola. (5) Adicionar 3μL de tampão M9. (6) Coloque aproximadamente dez larvas de L4 na solução, (7) aplique a lâmina de cobertura e as bordas de vedação com vaselina/cera. (C-D) A ativação de neurônios VA se correlaciona com transientes Ca++ em espinhas DD1. A fluorescência GCaMP6s fotografada (em intervalos de 0,5 s) com ativação periódica de luz de Chrimson (intervalos de 2,5 s) evoca transientes Ca++ com (C) +ATR (n = 12), mas não em controles (D) (-ATR, n = 12). Os painéis são instantâneos ao longo do(s) tempo(s), antes e depois do pulso de 561 nm de luz (linha rosa vertical). Barras de escala = 2 μm. O sinal GCaMP6s é adquirido a partir de um ROI (Região de Interesse) na ponta de cada coluna vertebral. (E) Fluorescência GCaMP6s durante o período de gravação de 10 s plotado para +ATR (verde) vs -ATR (controle, cinza) (n = 12 vídeos). Barras verticais rosa denotam iluminação de 561 nm (por exemplo, ativação de Chrimson). Cada animal foi estimulado 4 vezes com luz de 561 nm. As medidas foram coletadas antes e após cada pulso de luz de 561 nm. (F) Gráfico da fluorescência GCaMP6s antes e depois de cada pulso de luz de 561 nm. A fluorescência do GCaMP6s foi medida 1 s após cada pulso de luz de 561 nm. Como as amostras não são normalmente distribuídas, um teste de Friedman não paramétrico pareado foi aplicado para corrigir comparações múltiplas de fluorescência de GCaMP6s antes vs. após estimulação luminosa de 561 nm para vermes cultivados com ATR (+ATR, verde) (*** p = 0,0004, n = 48 medições) ou na ausência de ATR (-ATR, cinza) (NS, Não Significativo, p = 0,0962, n = 48 medições). Este valor foi modificado a partir da referência2. Por favor, clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1: Lista de plasmídeos utilizados no estudo. Clique aqui para baixar este arquivo.
Arquivo Suplementar 2: Composição e preparação do buffer M9. Clique aqui para baixar este arquivo.
Discussão
O detector Airyscan foi selecionado para adquirir instantâneos de espinhos DD por proporcionar maior relação sinal-ruído e melhor resolução do que os microscópios confocais convencionais19,20. A imagem AiryScan também permite o uso de proteínas fluorescentes convencionais (por exemplo, GFP, mCherry, etc.), agora amplamente disponíveis para C. elegans. Embora imagens de maior resolução possam ser obtidas com outros métodos de super-resolução (por exemplo, STORM, STED, PALM), esses métodos requerem proteínas fluorescentes fotoativáveis ou fotocomutáveis21. Como alternativa ao Airyscan, recomendam-se microscópios confocais convencionais. Por exemplo, a imagem com aquisição de Nyquist (Figura 3) atinge o tamanho do pixel usando um objetivo de 40x/1,3 de 123,9 nm, suficiente para distinguir os tipos morfológicos da coluna vertebral (Figura 2).
Para determinar a densidade da coluna, recomenda-se o uso de uma proteína fluorescente citosólica como (1) mCherry ou GFP, (2) LifeAct para marcar o citoesqueleto de actina ou (3) uma proteína fluorescente miristoilada (por exemplo, MYR::mRuby) para marcar a membrana plasmática (Figura 1B). Em comparação, a proteína de ligação à actina F Utrophin reduz a densidade da coluna vertebral (Figura 1C), indicando um efeito negativo na morfogênese da coluna vertebral quando a Utrophin é superexpressa.
Os métodos de imagem atuais devem ajudar a identificar variantes genéticas que regem a morfologia da coluna vertebral 1,16. A morfologia da coluna DD (isto é, fina/cogumelo, filopodial, teimosa, ramificada, ver Figura 2) pode ser avaliada a partir de projeções 2D únicas das imagens laterais da medula nervosa ventral, uma vez que a maioria das espinhas DD adota uma orientação caracteristicamente direcionada ventralmente. Nessas comparações, é essencial usar o mesmo marcador fluorescente para cada condição, uma vez que os tipos morfológicos aparentes da coluna vertebral parecem ser influenciados pelo método de marcação (por exemplo, MYR::mRuby vs. LifeAct::GFP). Além disso, observou-se que as formas da coluna vertebral são dinâmicas e provavelmente mudam de forma em resposta aos sinais externos 2,16. Assim, também é essencial comparar as formas da coluna vertebral entre genótipos em estágios de desenvolvimento semelhantes e em condições semelhantes.
A orientação do cordão ventral de C. elegans é criticamente vital para a aquisição precisa da imagem. Tanto os cordões ventrais quanto os dorsais em lados opostos do animal devem ser visíveis no mesmo plano Z, indicando que o verme está orientado de lado (Figura 1B). É melhor não coletar imagens de vermes em movimento ou em contato com outros vermes ou bolhas perto do cordão ventral, pois isso pode degradar imagens de espinhos.
Para imagens de cálcio in vivo, as lâminas frescas precisam ser preparadas imediatamente antes de cada aquisição. É melhor criar imagens de vermes em contato apenas com fibras de cola finas vs. "bolhas" de cola que tendem a desidratar vermes e degradar a imagem (Figura 4B). No experimento mostrado na Figura 4, o pulso de luz de 561 nm ativa todo o campo de visão. Para aumentar a resolução temporal e espacial para detectar transientes locais de Ca++ , por exemplo, dentro de espinhos DD individuais, um mini scanner galvo configurado para a linha laser de 561 nm pode ser usado para estimular uma região menor de interesse17.
Divulgações
Declaramos não haver conflitos de interesse.
Agradecimentos
A imagem e a análise do Imaris foram realizadas no Vanderbilt Cell Imaging Shared Resource (CIRS) suportado pelo NIH (CA68485, DK20593, DK58404, DK59637 e EY08126). O LSM 880 é suportado pela concessão 1S10OD201630. A imagem em um disco giratório Nikon foi realizada no Centro de Excelência Nikon. Agradecemos a Jenny Schafer, diretora do CISR, e a Bryan Millis pelo treinamento e discussões perspicazes e aos membros do laboratório de Burnette: Dylan Burnette, Aidan Fenix e Nilay Taneja por conselhos. Este trabalho foi apoiado por subsídios do National Institutes of Health para DMM (R01NS081259 e R01NS106951) e uma doação da American Heart Association para ACC (18PRE33960581).
Materiais
| Name | Company | Catalog Number | Comments |
| All-trans retinal (ATR) | Sigma-Aldrich | R2500-100MG | Necessary cofactor for neuronal excitation with Chrimson |
| diH2O | MilliQ | To prepare M9 buffer | |
| Ethanol 100% | Sigma | 64-17-5 | To dilute ATR and make control plates for neuronal excitation |
| Ethyl 3-aminobenzoate methanesulfonate salt (tricaine) | To immobilize animals for imaging dendritic spines | ||
| ImageJ | NIH | (Schindelin J et al., 2012) | Open source image processing software |
| KH2PO4 | Fisher Bioreagents | 7758-11-4 | To prepare M9 buffer |
| Levamisole hydrochloride | Sigma | 16595-80-5 | To immobilize animals for imaging dendritic spines |
| MgSO4 | Fisher Chemical | M63-500 | To prepare M9 buffer |
| Microscope cover glass | Fisherbrand | 12542B | To mount animals for microscopy acquisition |
| Na2HPO4 | Fisher Scientific | S369-500 | To prepare M9 buffer |
| NaCl | Fisher Chemical | S671-3 | To prepare M9 buffer |
| NIS Elements version 05.21 | Nikon | To analyze images and movies (e.g., Deconvolution, image alignment) | |
| Polybeads carboxylate 0.05um microspheres | Polysciences, Inc | 15913-10 | To immobilize animals for imaging Ca++ transients |
| Prism | For statistical analysis and graphing normalized Ca++ transients | ||
| SeaKen ME agarose | Lonza | 50014 | To make agarose pads to mount animals for imaging |
| Super Glue | The gorilla company | To immobilize animals for imaging Ca++ transients | |
| Superfrost microscope slides | Fisherbrand | 22-034-980 | To mount animals for microscopy acquisition |
| vaseline | Covidien | 8884430300 | To seal sample for confocal snapshots |
| Wax | Fisherbrand | 23-021-399 | Paraplast tissue embedding medium |
| Microscope for super-resolution imaging | |||
| LSM880 | Zeiss | ||
| AiryScan detector | Zeiss | ||
| Plan Apochromat (oil) 63x/ 1.40 NA, WD = 0.19 mm | |||
| Laser lines | |||
| Stage controller | |||
| Microscope for Nyquist image acquisition | |||
| A1R Confocal | Nikon | ||
| Plan Fluor (oil) 40x/1.3 NA, WD 0.24 mm | |||
| 488 nm, 16mW | |||
| 561 nm, 17mW | |||
| Microscope to monitor evoked Ca++ transients in dendritic spines | |||
| Spinning Disk Confocal | Nikon | ||
| Andor DU-897 EMCCD camera | |||
| Spinning disk Head CSU-X1 | Yokogawa | ||
| Apo TIRF (oil) 100x/1.49 NA ,WD 0.12 mm | |||
| 488 nm, 65mW | |||
| 561 nm, 86mW | |||
| 525 nm (+/- 18 nm) | |||
| 605 nm (+/- 35 nm) |
Referências
- Sala, C., Segal, M. Dendritic Spines: The Locus of Structural and Functional Plasticity. Physiological Reviews. 94 (1), 141-188 (2014).
- Cuentas-Condori, A., et al. C. elegans neurons have functional dendritic spines. Elife. 8, 47918 (2019).
- Philbrook, A., et al. Neurexin directs partner-specific synaptic connectivity in C. Elegans. Elife. 7, 35692 (2018).
- Oliver, D., Alexander, K., Francis, M. M. Molecular Mechanisms Directing Spine Outgrowth and Synaptic Partner Selection in Caenorhabditis elegans. Journal of Experimental Neuroscience. 12, 10-13 (2018).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5, 605-607 (2008).
- Ladt, K., Ganguly, A., Roy, S. Axonal actin in action: Imaging actin dynamics in neurons. Methods of Cell Biology. 131, 91-106 (2016).
- Schild, L. C., Glauser, D. A. Dual color neural activation and behavior control with chrimson and CoChR in Caenorhabditis elegans. Genetics. 200 (4), 1029-1034 (2015).
- Mello, C., Kramer, J., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrahcormosomal maintenance and integration of transforming sequences. The EMBO Journal. 10 (12), 3959-3970 (1991).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C . elegans Using Microinjection. Journal of Visualized Experiments. (18), e833 (2008).
- Smith, C. J., et al. Time-lapse imaging and cell-specific expression profiling reveal dynamic branching and molecular determinants of a multi-dendritic nociceptor in C. elegans. Developemntal Biology. 345 (1), 18-33 (2010).
- Mccarter, J., Bartlett, B., Dang, T., Schedl, T. Soma - Germ Cell Interactions in Caenorhabditis elegans : Multiple Events of Hermaphrodite Germline Development Require the Somatic Sheath and Spermathecal Lineages. Developemntal Biology. 181 (2), 121-143 (1997).
- Driscoll, M. Mounting animals for observation with Nomarski DIC optics. WormBook. , (2008).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. Journal of Cell Biology. 172 (1), 9-18 (2006).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Hotulainen, P., Hoogenraad, C. C. Actin in dendritic spines connecting dynamics to function. Journal of Cell Biology. 189 (4), 619-629 (2010).
- Berry, K. P., Nedivi, E. Spine Dynamics: Are They All the Same. Neuron. 96 (1), 43-55 (2017).
- Miller, D. M., Niemeyer, C. J. Expression of the unc-4 homeoprotein in Caenorhabditis elegans motor neurons specifies presynaptic input. Development. 121 (9), 2877-2886 (1995).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Ventral Nerve Cord of Caenorhadbitis elegans. Philosophical Transactions of the Royal Society. 275 (938), 327-348 (1976).
- Huff, J. The Airyscan detector from ZEISS confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, (2015).
- Huff, J. The Fast mode for ZEISS LSM 880 with Airyscan high-speed confocal imaging with super-resolution and improved signal-to-noise ratio. Nature Methods. 13, (2016).
- Jacquemet, G., Carisey, A. F., Hamidi, H., Henriques, R., Leterrier, C. The cell biologist's guide to super-resolution microscopy. Journal of Cell Science. 133 (11), 240713 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados