Method Article
Визуализация дендритных шипов при Caenorhabditis elegans
В этой статье
Резюме
Дендритные шипы являются важными клеточными особенностями нервной системы. Здесь описаны методы визуализации в реальном времени для оценки структуры и функции дендритных шипов у C. elegans. Эти подходы поддерживают разработку мутантных экранов для генов, которые определяют форму или функцию дендритного позвоночника.
Аннотация
Дендритные шипы являются специализированными участками синаптической иннервации, модулированной активностью, и служат субстратами для обучения и памяти. Недавно дендритные шипы были описаны для DD GABAergic нейронов как входные участки от пресинаптических холинергических нейронов в двигательном контуре Caenorhabditis elegans. Эта синаптическая схема теперь может служить мощной новой моделью морфогенеза и функции позвоночника in vivo , которая использует поверхностную генетику и доступность C. элеганс к визуализации живых клеток.
Этот протокол описывает экспериментальные стратегии оценки структуры и функции позвоночника DD. В этом подходе стратегия визуализации со сверхвысоким разрешением используется для визуализации сложных форм дендритных шипов, богатых актинами. Чтобы оценить функцию позвоночника DD, активированный светом опсин, Chrimson, стимулирует пресинаптические холинергические нейроны, а индикатор кальция, GCaMP, сообщает о вызванных переходных процессах кальция в постсинаптических шипах DD. Вместе эти методы включают в себя мощные подходы к выявлению генетических детерминант дендритных шипов у C. elegans , которые также могут направлять морфогенез и функцию позвоночника в мозге.
Введение
Дендритные шипы являются специализированными клеточными структурами, которые получают входные данные от соседних нейронов для синаптической передачи. Активация рецепторов нейротрансмиттеров повышает внутриклеточный кальций и нисходящие сигнальные пути в этих характерных нейронных протрузиях1. Из-за фундаментального значения дендритных шипов для нейротрансмиссии и их неправильной регуляции при заболеваниях нервного развития1, открытие факторов, модулирующих дендритный морфогенез и функцию позвоночника, представляет высокий интерес для области неврологии.
Недавно дендритные шипы были идентифицированы в нервной системе C. elegans на основе ключевых характеристик, общих с шипами млекопитающих2. Это определение имеет решающее значение, потому что оно открывает возможность использования преимуществ C. elegans для исследования биологии позвоночника. Дендритные шипы на дорсальных D (DD) двигательных нейронах получают входные данные от холинергических нейронов (VA и VB) в вентральном нервном канатике (рисунок 1A)2,3,4. Здесь представлены методы визуализации для изучения структуры дендритных шипов DD и их функции in vivo в неповрежденной нервной системе, которая легко доступна для живой визуализации и генетического анализа. Для контроля формы дендритных шипов, (1) цитозольных флуоресцентных белков, которые заполняют дендритный отросток и шипы; (2) мембранно-связанные флуоресцентные белки, которые украшают границу дендритных шипов и дендритов; или (3) используются актиновые маркеры, LifeAct5 или Utrophin6, которые обогащены дендритными шипами, тем самым выявляя их форму. Для мониторинга функциональности шипов DD флуоресценция GCaMP используется для обнаружения переходных процессов Ca++, вызванных активацией опсина с красным смещением, Chrimson, в пресинаптических холинергических нейронах7. Ожидается, что обе стратегии облегчат изучение дендритных шипов DD у диких и мутантных животных.
протокол
1. Определение строения дендритных шипов ДД
- Создание трансгенных червей для маркировки шипов DD
- Используйте промоутер flp-13 для построения вектора выражения для интересующей метки (например, цитоплазматический mCherry, MYR::mRuby, LifeAct::GFP, GFP::utrophin) (рисунок 1). Полный список плазмид приведен в дополнительном файле 1.
- Используют устоявшиеся методы для генерации трансгенной линии маркировки DD spines 8,9.
- Подготовьте герметик
- Сделайте смесь 1:1 из встраивающей среды10 на основе парафина (см. Таблицу материалов).
- Нагреть среду при 60 °C до плавления, затем аликвотировать в 1,5 мл закрытых микроцентрифужных трубок и поддерживать нагревательный блок при 60-70 °C.
ПРИМЕЧАНИЕ: Герметик может храниться в течение 4 недель в нагревательном блоке.
- Приготовьте анестетик.
- Изготавливают стоковые растворы в дистиллированномH2O1% трикаина и 1 М левамизола (см. Таблицу материалов). Хранить при -20 °C.
- Готовят рабочий раствор 0,05% трикаина и 15 мМ левамизола анестетика, как описано в шагах 1.3.3-1.3.511.
- Смешайте 75 мкл 1% трикаина и 22,5 мкл 1 М левамизола.
- Добавьте буфер M9 к конечному объему 1,5 мл.
- Аликвот 10 мкл 0,05% трикаина, 15 мМ левамизола в микроцентрифужные трубки 0,5 мл и хранить при -20 °C.
ПРИМЕЧАНИЕ: Обезболивающая смесь чувствительна к температуре, и отдельные аликвоты рабочего раствора не следует повторно замораживать после размораживания для каждого эксперимента. Рецепт для буфера M9 см. в дополнительном файле 2 .
- Получение изображений с высоким разрешением
- Приготовьте 10% агарозы и выдержите ее на водяной бане при 60 °C.
ПРИМЕЧАНИЕ: См. отчет Моники Дрисколл в WormBook12. - Установите 15-20 молодых людей на 10% агарозные прокладки и добавьте 3 мкл анестетика (см. шаг 3).
- Нанесите покров (глисты иммобилизуются в течение 5 мин).
- Запечатайте края крышки расплавленной клейкой герметизирующей смесью (см. Таблицу материалов).
- Получение изображений
- Приобретение сверхвысокого разрешения
- Используйте лазерно-сканирующий конфокальный микроскоп, оснащенный для микроскопии сверхвысокого разрешения с масляным объективом 63x/1.40 Plan-Apochromat для достижения небольшого размера пикселя (например, < 50 нм). Приобретайте Z-стеки, используя размер шага, рекомендованный программным обеспечением производителя (см. Таблицу материалов).
- Соберите серию оптических секций, которые охватывают общий объем вентрального процесса DD (например, 15-20 срезов с шагом 0,19 мкм или толщиной 2-3 мкм). Отправляйте Z-стеки для обработки изображений с помощью программного обеспечения производителя и анализируйте изображения с оценкой выше 7 (рисунок 1B, рисунок 2 и рисунок 3).
- Приобретение Nyquist
- Используйте лазерный сканирующий конфокальный микроскоп для выбора оптимального размера пикселя для длины волны света и числовой диафрагмы используемого объектива (например, объектив 40x/1.4 Plan Fluor oil).
ПРИМЕЧАНИЕ: Меньший размер пикселя покажет тонкую структуру шипов DD. - Отправьте стек для 3D-деконволюции с помощью алгоритма Automatic (см. Таблицу материалов) (рисунок 3).
- Используйте лазерный сканирующий конфокальный микроскоп для выбора оптимального размера пикселя для длины волны света и числовой диафрагмы используемого объектива (например, объектив 40x/1.4 Plan Fluor oil).
- Используйте наименьший Z-шаг (например, определяемый пьезо-стадией), потому что передискретизация в Z может дать более четкие изображения после 3D-деконволюции13.
- Приобретение сверхвысокого разрешения
- Приготовьте 10% агарозы и выдержите ее на водяной бане при 60 °C.
- Анализ изображений
- Используйте соответствующее программное обеспечение для обработки изображений (см. Таблицу материалов) для создания проекций максимальной интенсивности Z-стеков14.
- Вручную подсчитайте выступы на дендрите DD.
ПРИМЕЧАНИЕ: Выступы являются перпендикулярными расширениями от главного вала (рисунок 1B, наконечники стрел). - Определите длину набранного дендрита DD для расчета плотности шипов на 10 мкм дендрита DD (рисунок 1C).
- Классифицируйте колючки как тонкие/грибные, филоподиальные, корявые или разветвленные (рисунок 2А).
ПРИМЕЧАНИЕ: Тонкие/грибные колючки имеют узкое основание (шея) и более широкий кончик (голова). Филоподиальные шипы не имеют суженного основания (без шеи), но имеют постоянную ширину. Корявые колючки имеют широкое основание и кончик. Разветвленные шипы представляют собой выступы с более чем одним кончиком.
2. Оценка активации дендритных шипов DD пресинаптической холинергической сигнализацией
- Создание трансгенных червей с помощью обычных методов (например, микроинъекция)8,9
- Используйте промотор flp-13 для управления экспрессией датчика Ca++ , GCaMP6s, в нейронах DD и промотора unc-4 для управления экспрессией Chrimson, каналародопсина с красным смещением, в пресинаптических нейронах VA (рисунок 4A). Смотрите список плазмид в дополнительном файле 1.
- Подготовьте All-trans Retinal (ATR) и контрольные пластины.
ПРИМЕЧАНИЕ: ATR является обязательным кофактором для Chrimson, чтобы функционировать как оптогенетически активированный ионный канал.- Готовят 100 мМ раствора ATR в этаноле (100%). Хранить при -20 °C в 1 мл аликвоты.
- Под ламинарным проточным капюшоном добавьте 300 мкл ночной бактериальной культуры OP50 и 0,25 мкл ATR к каждой 60-миллиметровой питательной агаровой пластине NGM (Nematode Growth Medium) и разложите стерильным стеклянным стержнем.
- Для контроля добавьте 300 мкл бактерий OP50 и 0,25 мкл этанола (100%) в отдельную группу пластин NGM.
- Пусть пластины сидят в капюшоне при комнатной температуре в течение 24 часов (защищенные от окружающего света), чтобы обеспечить рост бактерий.
ПРИМЕЧАНИЕ: Пластины можно использовать после первоначальной инкубации через 24 ч или поддерживать при 4 °C для использования в течение 5 дней.
- Настройка эксперимента
- Поместите пять личинок NC3569 L4-стадии на OP50-семенные ATR или контрольные пластины, которые не имеют ATR и растут в темноте при 23 °C.
- Три дня спустя используйте стереопарирующий микроскоп для подтверждения развития вульвы, чтобы выбрать потомство стадии L4 из ATR и контрольные пластины для визуализации, как описано в шагах 2.4.1-2.4.3.
- На предметное стекло микроскопа поместите 2 мкл 0,05 мкм полишарик (2,5% твердых веществ масс/об.) (см. Таблицу материалов).
- Используйте платиновую проволоку («червячок»), чтобы добавить небольшую шарик суперклея в раствор и осторожно закрутить, чтобы создать нитчатые «пряди» клея. Затем добавьте 3 мкл буфера M9 (рисунок 4B).
- Поместите в раствор примерно десять личинок L4 и нанесите крышку.
ПРИМЕЧАНИЕ: Клеевые волокна будут случайным образом контактировать с червями и обездвиживать их после наложения крышки. Черви, которые встроены в большие шарики клея, кажутся высохшими и не должны быть изображены. - Края уплотнения крышки, как указано на этапе 1.4.4.
- Запись вызванных ca++ переходных процессов в дендритных шипах.
- Используйте вращающийся дисковый конфокальный микроскоп, оснащенный чувствительной ПЗС-камерой, 100-кратным масляным объективом TIRF и лазерными линиями 488 нм и 561 нм (см. Таблицу материалов).
- Отрегулируйте ступень микроскопа для позиционирования шипов DD в фокальной плоскости.
- Настройка покадрового сбора для освещения образца лазерной линией 488 нм каждый кадр (для обнаружения флуоресценции GCaMP6s) и лазерной линией 561 нм с периодическими интервалами (для возбуждения Кримсона).
ПРИМЕЧАНИЕ: Например, используйте свет 488 нм для захвата последовательных снимков (200 мс) сигнала GCaMP6s в сочетании с импульсом 200 мс 561 нм света каждые 5-й кадр (рисунок 4C-E). При такой конфигурации уровни GCaMP до и после каждого импульса 561 нм обнаруживаются на расстоянии ~ 1 с друг от друга (200 мс лазера 488 нм для обнаружения GCaMP до активации VA, 200 мс импульса 561 нм для активации VA и ~ 600 мс для переключения между лазерными линиями и эмиссионными фильтрами). При такой настройке нейроны VA активируются каждые 2,5 с.
- Анализ изображений in vivo Ca++
- Используйте 2D-деконволюцию и выравнивание изображения для коррекции незначительных отклонений, возникающих при движении червя во время захвата (см. Таблицу материалов).
- Определите дендритный позвоночник DD как область интереса (ROI на рисунках 4C-D).
- Дублируйте ROI и перемещайтесь в соседний регион внутри червя для сбора фонового сигнала (т. Е. Шума).
- Используйте соответствующее программное обеспечение (см. Таблицу материалов) для экспорта интенсивностей GCaMP6s, чтобы превзойти каждую точку времени. Вычтите фоновую флуоресценцию из флуоресценции ROI позвоночника.
- Определите изменение флуоресценции, вычитая флуоресценцию GCaMP6s в кадре непосредственно перед возбуждением 561 нм (F0) из каждой временной точки после возбуждения (ΔF), затем разделяя на F0 для определения ΔF/F0 (рисунок 4E).
- График нормализованных следов (см. Таблицу материалов).
- Выполните парный статистический тест для каждого измерения флуоресценции GCaMP6s до и после каждого импульса 561 нм света.
ПРИМЕЧАНИЕ: Этот подход эффективно исключает случайные флуктуации флуоресценции GCaMP6s, которые в противном случае уменьшают статистическую мощность сравнения среднего сигнала GCaMP6s из всех измерений до и после возбуждения 561 нм (рисунок 4F). - Для измерений, которые показывают нормальное или гауссово распределение, используйте парный параметрический тест ANOVA и корректируйте для нескольких сравнений для каждой из двух групп (ATR до и после, нет ATR до и после). В качестве альтернативы для данных, которые обычно не распределены, используйте непараметрическую ANOVA с постхоковой коррекцией для многократного тестирования.
ПРИМЕЧАНИЕ: Черви, выращенные на пластинах, в которых отсутствует ATR («нет ATR»), являются необходимыми элементами управления и не должны показывать переходные процессы Ca++ с активацией 561 нм, поскольку ATR требуется для функции Chrimson.
Результаты
Измерения с тремя независимыми маркерами (цитозольный mCherry, LifeAct::GFP, MYR::mRuby) дали среднюю плотность 3,4 ± 1,03 дендритных шипов DD на 10 мкм дендрита DD у молодых людей дикого типа (рисунок 1B, C). Для этого анализа были исключены измерения, полученные с помощью маркера GFP::Utrophin, которые дали значительно более низкую плотность позвоночника (2,4 ± 0,74, рисунок 1) из-за взаимодействия утрофина с актиновым цитоскелетом6 , который потенциально управляет морфогенезом позвоночника15. Измерения плотности позвоночника в световом микроскопе сопоставимы со значением 4,2 шипов/10 мкм дендрита, полученным при реконструкции 12 шипов из электронных микроснимков нейрона DD12. Подход к визуализации живых клеток подтвердил, что тонкая/грибовидная морфология шипов DD преобладает во взрослой и альтернативной формах позвоночника (например, филоподиальная, короткая, разветвленная) (рисунок 2B), что также характерно для шипов в зрелой нервной системе млекопитающих16.
Оптогенетическая стратегия была использована, чтобы спросить, реагируют ли предполагаемые дендритные шипы, обнаруженные с помощью световой микроскопии с высоким разрешением (рисунок 1 и рисунок 2), на высвобождение нейротрансмиттеров из пресинаптических участков, характерную отличительную черту дендритных шипов в нейронах млекопитающих. Зеленый свет (561 нм) использовался для активации канального варианта родопсина, Chrimson, в пресинаптических холинергических нейронах и синего света (488 нм) для обнаружения Ca++-зависимой флуоресценции, излучаемой цитоплазматическим зондом GCaMP в постсинаптических дендритных шипах DD. Этот эксперимент обнаружил переходные всплески сигнала GCaMP в позвоночниках DD сразу после оптогенетической активации Хримсона в пресинаптических нейронах VA (рисунок 3). Успех этого эксперимента зависит от достоверной экспрессии Хримсона во всех пресинаптических нейронах ВА. В этом случае для обеспечения последовательной экспрессии VA использовался хромосомный интегрант17 маркера Punc-4::Chrimson. Этот эксперимент также может быть проведен с внехромосомным массивом. Экспрессия Хримсона в конкретном нейроне VA может быть независимо подтверждена, например, путем соединения трансгена Хримсона с транспликированной ведущей последовательностью SL2 с последующим ядерно-локализованным GFP в качестве маркера коэкспрессии2. Важно провести контрольный эксперимент при отсутствии ATR, чтобы подтвердить, что измеренный сигнал GCaMP зависит от оптогенетической активации Хримсона, которая строго зависит от ATR (рисунок 4D). Наконец, поскольку вызванные сигналы Ca++ являются переходными, крайне важно принять протокол визуализации, который позволяет быстро переключаться (<1 с) между возбуждением 561 нм и получением сигнала GCaMP с помощью лазера 488 нм (рисунок 4).

Рисунок 1: Маркировка дендритных шипов DD. (A) (Top) Шесть дорсальных D (DD1-DD6) нейронов в вентральном нервном канатике C. elegans. (Внизу) У взрослых вентрально направленные шипы DD (наконечник стрелы) контактируют с пресинаптическими терминалями моторных нейронов Ventral A (VA) и Ventral B (VB) (пурпурный), а ДД-комиссуры распространяются на спинной нервный канатик, чтобы обеспечить ГАМАэргический выход в мышцы тела (стрелка)18. Этот рисунок был изменен по сравнению со ссылкой2. (B) Флуоресцентные микроснимки (Airyscan) шипов DD, помеченных цитозольным mCherry, миристоилированным mRuby (MYR::mRuby), LifeAct::GFP и GFP::Utrophin у молодых взрослых червей. Серые наконечники стрел указывают на шипы. Шкала бара = 2 мкм. (C) Плотность (шипы/10 мкм) дендритных шипов нейронов DD, помеченных цитозолью mCherry (3,77 ± 0,9), MYR::mRuby (3,09 ± 0,8), LifeAct::GFP (3,44 ± 1,1) или GFP::Utrophin (2,41 ± 0,8). Все образцы обычно распределяются. Односторонняя ANOVA показывает, что плотность позвоночника для цитозольных mCherry, MYR::mRuby и LifeAct::GFP существенно не отличается (NS), тогда как плотность позвоночника снижается для GFP::Utrophin vs. цитозольно меченые mCherry (p = 0,0016) и LifeAct::GFP (p = 0,0082). Пунктирная красная линия представляет плотность позвоночника нейронов DD, оцененную по реконструкции 3D EM (4,2 шипа / 10 мкм). Этот рисунок был изменен по сравнению со ссылкой2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Визуализация дендритных шипов DD. (A) (Вверху) Схема форм позвоночника. (Внизу) Изображения Airyscan каждого типа позвоночника (шкала = 500 нм), помеченные LifeAct::GFP (зеленый) и 3D-реконструкции серийными электронными микроснимками замороженного взрослого человека высокого давления (синий). (B) Частота позвоночника по типу, визуализированная с помощью LifeAct::GFP: Thin/Mushroom (55,5 ± 14,5%), Filopodial (10,3 ± 8,70%), Stubby (18,8 ± 10,7%), Branched (15,42 ± 6,01%). Частота колючек по типу, визуализированная с помощью MYR::mRuby: Thin/Mushroom (52,2 ± 16,5%), Filopodial (5,68 ± 7,0%), Stubby (33,1 ± 14,8%), Branched (9,02 ± 9,6%). Непарный Т-тест, филоподиальный (p = 0,0339); Корявые (p = 0,0009) и разветвленные (p = 0,011) шипы, помеченные маркером MYR::mRuby, значительно отличаются от LifeAct::GFP. Этот рисунок был изменен по сравнению со ссылкой2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
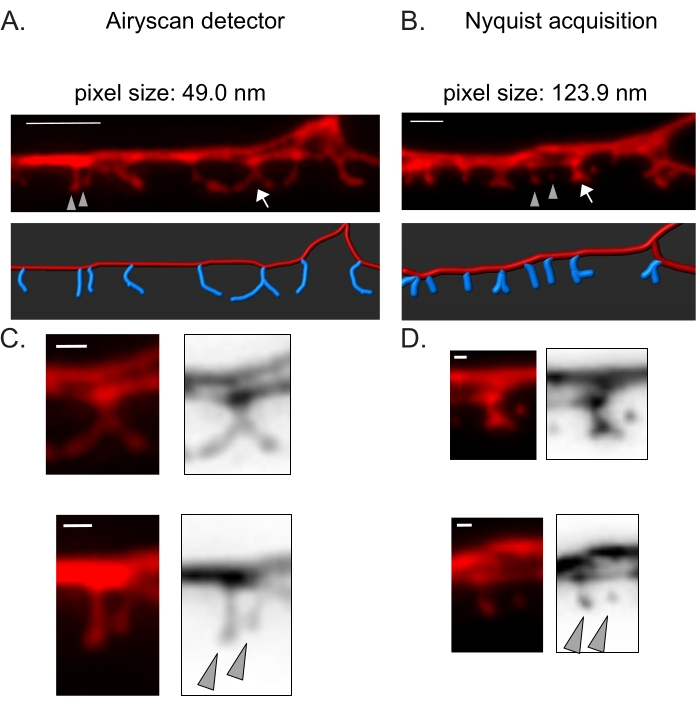
Рисунок 3: Стратегии получения изображений с высоким разрешением шипов DD. (A-B) (Top) Флуоресцентные изображения дендритов DD1, помеченных цитозольным маркером (mCherry) с помощью (A) детектора Airyscan и (B) захвата Nyquist. (Внизу) Дендрит DD (красный) изображен с помощью программного обеспечения для анализа изображений (опция автоматического пути трассировки нити), а шипы DD (синий) графически проиллюстрированы с помощью полуавтоматического модуля обнаружения шипов. Стрелка указывает на разветвленный позвоночник, увеличенный в C и D. Наконечники стрел обозначают соседние тонкие/грибные шипы, увеличенные в C и D. Шкала бара = 2 мкм. (C-D) Увеличенные примеры (верхнего) разветвленного позвоночника (стрелка) и (внизу) двух соседних тонких/грибных шипов (наконечников стрел), полученных с помощью (C) детектора Airyscan или (D) приобретения Найквиста. Шкала = 500 нм. Данные, воспроизведенные из2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Оценка функции шипов DD. (A) Моторные нейроны DD экспрессируют индикатор Ca++ GCaMP6s (зеленый), а моторные нейроны VA экспрессируют каналродопсин-вариант, Chrimson (пурпурный)7. (B) Схематическое изображение метода крепления червей для измерений Ca++ . (1) На предметном стекле чистого микроскопа (2) поместите 2 мкл полишарики 0,05 мкм, (3) используйте платиновую проволоку («червячная кирка»), чтобы добавить небольшую шарик суперклея и (4) закрутиться в раствор для создания нитевидных нитей клея. (5) Добавьте 3 мкл буфера M9. (6) Поместите в раствор примерно десять личинок L4, (7) нанесите на крышку и запечатайте края вазелином/воском. (С-Д) Активация нейронов VA коррелирует с переходными процессами Ca++ в шипах DD1. Флуоресценция GCaMP6s, визуализируемая (с интервалом 0,5 с) с периодической световой активацией Chrimson (интервалы 2,5 с), вызывает переходные процессы Ca++ с (C) + ATR (n = 12), но не в (D) элементах управления (-ATR, n = 12). Панели представляют собой снимки во времени (с), до и после импульса света 561 нм (вертикальная розовая линия). Шкала баров = 2 мкм. Сигнал GCaMP6s получается из ROI (область интереса) на кончике каждого позвоночника. (E) Флуоресценция GCaMP6s в течение периода записи 10 с, построенная для +ATR (зеленый) против -ATR (контрольный, серый) (n = 12 видео). Вертикальные розовые полосы обозначают освещенность 561 нм (например, активация Chrimson). Каждое животное стимулировали 4 раза светом 561 нм. Измерения собирались до и после каждого импульса света 561 нм. (F) График флуоресценции GCaMP6s до и после каждого импульса 561 нм света. Флуоресценцию GCaMP6s измеряли через 1 с после каждого импульса 561 нм света. Поскольку образцы обычно не распределены, был применен парный непараметрический тест Фридмана для исправления множественных сравнений флуоресценции GCaMP6s до и против. после световой стимуляции 561 нм для червей, выращенных либо с ATR (+ATR, зеленый) (*** p = 0,0004, n = 48 измерений), либо при отсутствии ATR (-ATR, серый) (NS, Not Significant, p = 0,0962, n = 48 измерений). Этот рисунок был изменен по сравнению со ссылкой2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Список плазмид, используемых в исследовании. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Состав и подготовка буфера M9. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Детектор Airyscan был выбран для получения снимков шипов DD, потому что он обеспечивает более высокое отношение сигнал/шум и лучшее разрешение, чем обычные конфокальные микроскопы19,20. Визуализация AiryScan также позволяет использовать обычные флуоресцентные белки (например, GFP, mCherry и т. Д.), В настоящее время широко доступные для C. elegans. Хотя изображения с более высоким разрешением могут быть получены с помощью других методов сверхвысокого разрешения (например, STORM, STED, PALM), для этих методов требуются фотоактивируемые или фотопереключаемые флуоресцентные белки21. В качестве альтернативы Airyscan рекомендуются обычные конфокальные микроскопы. Например, визуализация с помощью захвата Найквиста (рисунок 3) достигает размера пикселя с использованием объектива 40x/1.3 123,9 нм, достаточного для различения морфологических типов позвоночника (рисунок 2).
Для определения плотности позвоночника рекомендуется использовать цитозольный флуоресцентный белок, такой как (1) mCherry или GFP, (2) LifeAct для маркировки актинового цитоскелета или (3) миритоилированный флуоресцентный белок (например, MYR::mRuby) для маркировки плазматической мембраны (рисунок 1B). Для сравнения, F-актин-связывающий белок Утрофин снижает плотность позвоночника (Рисунок 1С), что указывает на негативное влияние на морфогенез позвоночника при чрезмерной экспрессии Утрофина.
Современные методы визуализации должны помочь идентифицировать генетические варианты, которые управляют морфологией позвоночника 1,16. Морфология позвоночника DD (т.е. тонкий/грибной, филоподиальный, короткий, разветвленный, см. Рисунок 2) может быть оценена по одиночным 2D-проекциям боковых изображений спинного мозга вентрального нерва, поскольку большинство шипов DD принимают характерно вентрально направленную ориентацию. В этих сравнениях важно использовать один и тот же флуоресцентный маркер для каждого состояния, поскольку кажущиеся морфологические типы позвоночника, по-видимому, зависят от метода маркировки (например, MYR::mRuby vs. LifeAct::GFP). Кроме того, было отмечено, что формы позвоночника динамичны и, вероятно, меняют форму в ответ на внешние сигналы 2,16. Таким образом, также важно сравнивать формы позвоночника между генотипами на одинаковых стадиях развития и в аналогичных условиях.
Ориентация вентрального шнура C. elegans критически важна для точного получения изображения. Как вентральный, так и спинной шнуры на противоположных сторонах животного должны быть видны в одной Z-плоскости, что указывает на то, что червь ориентирован на бок (рисунок 1B). Лучше всего не собирать изображения червей, движущихся или контактирующих с другими червями или пузырьками вблизи вентрального шнура, так как это может ухудшить изображения шипов.
Для визуализации кальция in vivo свежие слайды должны быть подготовлены непосредственно перед каждым приобретением. Лучше всего изображать червей, контактирующих только с тонкими клеевыми волокнами против. «шарики» клея, которые имеют тенденцию высушивать червей и ухудшать изображение (рисунок 4B). В эксперименте, показанном на рисунке 4, импульс света 561 нм активирует все поле зрения. Для увеличения временного и пространственного разрешения для обнаружения локальных переходных процессов Ca++ , например, в пределах отдельных шипов DD, мини-сканер galvo, настроенный для лазерной линии 561 нм, может быть использован для стимуляции меньшей области интереса17.
Раскрытие информации
Мы заявляем об отсутствии конфликта интересов.
Благодарности
Визуализация и анализ на Imaris были выполнены в общем ресурсе визуализации клеток Вандербильта (CIRS), поддерживаемом NIH (CA68485, DK20593, DK58404, DK59637 и EY08126). LSM 880 поддерживается грантом 1S10OD201630. Создание изображений на вращающемся диске Nikon выполнялось в Центре передового опыта Nikon. Мы благодарим Дженни Шафер, директора CISR, и Брайана Миллиса за обучение и проницательные дискуссии, а также членов лаборатории Burnette: Дилана Бернетта, Эйдана Феникса и Нилая Танеджу за советы. Эта работа была поддержана грантами Национальных институтов здравоохранения для DMM (R01NS081259 и R01NS106951) и грантом Американской кардиологической ассоциации ACC (18PRE33960581).
Материалы
| Name | Company | Catalog Number | Comments |
| All-trans retinal (ATR) | Sigma-Aldrich | R2500-100MG | Necessary cofactor for neuronal excitation with Chrimson |
| diH2O | MilliQ | To prepare M9 buffer | |
| Ethanol 100% | Sigma | 64-17-5 | To dilute ATR and make control plates for neuronal excitation |
| Ethyl 3-aminobenzoate methanesulfonate salt (tricaine) | To immobilize animals for imaging dendritic spines | ||
| ImageJ | NIH | (Schindelin J et al., 2012) | Open source image processing software |
| KH2PO4 | Fisher Bioreagents | 7758-11-4 | To prepare M9 buffer |
| Levamisole hydrochloride | Sigma | 16595-80-5 | To immobilize animals for imaging dendritic spines |
| MgSO4 | Fisher Chemical | M63-500 | To prepare M9 buffer |
| Microscope cover glass | Fisherbrand | 12542B | To mount animals for microscopy acquisition |
| Na2HPO4 | Fisher Scientific | S369-500 | To prepare M9 buffer |
| NaCl | Fisher Chemical | S671-3 | To prepare M9 buffer |
| NIS Elements version 05.21 | Nikon | To analyze images and movies (e.g., Deconvolution, image alignment) | |
| Polybeads carboxylate 0.05um microspheres | Polysciences, Inc | 15913-10 | To immobilize animals for imaging Ca++ transients |
| Prism | For statistical analysis and graphing normalized Ca++ transients | ||
| SeaKen ME agarose | Lonza | 50014 | To make agarose pads to mount animals for imaging |
| Super Glue | The gorilla company | To immobilize animals for imaging Ca++ transients | |
| Superfrost microscope slides | Fisherbrand | 22-034-980 | To mount animals for microscopy acquisition |
| vaseline | Covidien | 8884430300 | To seal sample for confocal snapshots |
| Wax | Fisherbrand | 23-021-399 | Paraplast tissue embedding medium |
| Microscope for super-resolution imaging | |||
| LSM880 | Zeiss | ||
| AiryScan detector | Zeiss | ||
| Plan Apochromat (oil) 63x/ 1.40 NA, WD = 0.19 mm | |||
| Laser lines | |||
| Stage controller | |||
| Microscope for Nyquist image acquisition | |||
| A1R Confocal | Nikon | ||
| Plan Fluor (oil) 40x/1.3 NA, WD 0.24 mm | |||
| 488 nm, 16mW | |||
| 561 nm, 17mW | |||
| Microscope to monitor evoked Ca++ transients in dendritic spines | |||
| Spinning Disk Confocal | Nikon | ||
| Andor DU-897 EMCCD camera | |||
| Spinning disk Head CSU-X1 | Yokogawa | ||
| Apo TIRF (oil) 100x/1.49 NA ,WD 0.12 mm | |||
| 488 nm, 65mW | |||
| 561 nm, 86mW | |||
| 525 nm (+/- 18 nm) | |||
| 605 nm (+/- 35 nm) |
Ссылки
- Sala, C., Segal, M. Dendritic Spines: The Locus of Structural and Functional Plasticity. Physiological Reviews. 94 (1), 141-188 (2014).
- Cuentas-Condori, A., et al. C. elegans neurons have functional dendritic spines. Elife. 8, 47918 (2019).
- Philbrook, A., et al. Neurexin directs partner-specific synaptic connectivity in C. Elegans. Elife. 7, 35692 (2018).
- Oliver, D., Alexander, K., Francis, M. M. Molecular Mechanisms Directing Spine Outgrowth and Synaptic Partner Selection in Caenorhabditis elegans. Journal of Experimental Neuroscience. 12, 10-13 (2018).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5, 605-607 (2008).
- Ladt, K., Ganguly, A., Roy, S. Axonal actin in action: Imaging actin dynamics in neurons. Methods of Cell Biology. 131, 91-106 (2016).
- Schild, L. C., Glauser, D. A. Dual color neural activation and behavior control with chrimson and CoChR in Caenorhabditis elegans. Genetics. 200 (4), 1029-1034 (2015).
- Mello, C., Kramer, J., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrahcormosomal maintenance and integration of transforming sequences. The EMBO Journal. 10 (12), 3959-3970 (1991).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C . elegans Using Microinjection. Journal of Visualized Experiments. (18), e833 (2008).
- Smith, C. J., et al. Time-lapse imaging and cell-specific expression profiling reveal dynamic branching and molecular determinants of a multi-dendritic nociceptor in C. elegans. Developemntal Biology. 345 (1), 18-33 (2010).
- Mccarter, J., Bartlett, B., Dang, T., Schedl, T. Soma - Germ Cell Interactions in Caenorhabditis elegans : Multiple Events of Hermaphrodite Germline Development Require the Somatic Sheath and Spermathecal Lineages. Developemntal Biology. 181 (2), 121-143 (1997).
- Driscoll, M. Mounting animals for observation with Nomarski DIC optics. WormBook. , (2008).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. Journal of Cell Biology. 172 (1), 9-18 (2006).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Hotulainen, P., Hoogenraad, C. C. Actin in dendritic spines connecting dynamics to function. Journal of Cell Biology. 189 (4), 619-629 (2010).
- Berry, K. P., Nedivi, E. Spine Dynamics: Are They All the Same. Neuron. 96 (1), 43-55 (2017).
- Miller, D. M., Niemeyer, C. J. Expression of the unc-4 homeoprotein in Caenorhabditis elegans motor neurons specifies presynaptic input. Development. 121 (9), 2877-2886 (1995).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Ventral Nerve Cord of Caenorhadbitis elegans. Philosophical Transactions of the Royal Society. 275 (938), 327-348 (1976).
- Huff, J. The Airyscan detector from ZEISS confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, (2015).
- Huff, J. The Fast mode for ZEISS LSM 880 with Airyscan high-speed confocal imaging with super-resolution and improved signal-to-noise ratio. Nature Methods. 13, (2016).
- Jacquemet, G., Carisey, A. F., Hamidi, H., Henriques, R., Leterrier, C. The cell biologist's guide to super-resolution microscopy. Journal of Cell Science. 133 (11), 240713 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены