Method Article
Caenorhabditis elegans'ta Dendritik Dikenleri Görüntüleme
Bu Makalede
Özet
Dendritik dikenler sinir sisteminin önemli hücresel özellikleridir. Burada C. elegans'ta dendritik dikenlerin yapısını ve işlevini değerlendirmek için canlı görüntüleme yöntemleri tanımlanmıştır. Bu yaklaşımlar, dendritik omurga şeklini veya işlevini tanımlayan genler için mutant ekranların geliştirilmesini desteklemektedir.
Özet
Dendritik dikenler, aktivite tarafından modüle edilen sinaptik innervasyonun uzmanlaşmış bölgeleridir ve öğrenme ve hafıza için substratlar olarak hizmet eder. Son zamanlarda, DD GABAerjik nöronlar için dendritik dikenler, Caenorhabditis elegans'ın motor devresindeki presinaptik kolinerjik nöronlardan giriş bölgeleri olarak tanımlanmıştır. Bu sinaptik devre şimdi omurga morfogenezinin güçlü bir in vivo modeli ve kolay genetiğinden ve C'nin hazır erişilebilirliğinden yararlanan fonksiyon olarak hizmet edebilir . elegans canlı hücre görüntülemeye.
Bu protokol, DD omurga yapısını ve fonksiyonunu değerlendirmek için deneysel stratejileri açıklar. Bu yaklaşımda, aktin bakımından zengin dendritik dikenlerin karmaşık şekillerini görselleştirmek için süper çözünürlüklü bir görüntüleme stratejisi kullanılmaktadır. DD omurga fonksiyonunu değerlendirmek için, ışıkla aktive olan opsin, Chrimson, presinaptik kolinerjik nöronları uyarır ve kalsiyum göstergesi GCaMP, postsinaptik DD dikenlerinde uyarılmış kalsiyum geçicilerini bildirir. Birlikte, bu yöntemler, C. elegans'taki dendritik dikenlerin genetik belirleyicilerini tanımlamak için güçlü yaklaşımlar içerir ve bu da omurga morfogenezini ve beyindeki işlevi yönlendirebilir.
Giriş
Dendritik dikenler, sinaptik iletim için komşu nöronlardan girdi alan özel hücresel yapılardır. Nörotransmitter reseptörlerinin aktivasyonu, bu karakteristik nöronal çıkıntılarda hücre içi kalsiyum ve aşağı akış sinyal yollarını yükseltir1. Dendritik omurgaların nörotransmisyon için temel önemi ve nörogelişimsel hastalıklarda yanlış düzenlenmesi nedeniyle1, dendritik omurga morfogenezini ve fonksiyonunu modüle eden faktörlerin keşfi nörobilim alanına büyük ilgi duymaktadır.
Son zamanlarda, C. elegans sinir sisteminde, memeli dikenleri 2 ile paylaşılan temel özelliklere dayanan dendritikdikenler tanımlanmıştır. Bu kararlılık çok önemlidir, çünkü omurga biyolojisini araştırmak için C. elegans'ın avantajlarından yararlanma olasılığını ortaya çıkarmaktadır. Dorsal D (DD) motor nöronlarındaki dendritik dikenler, ventral sinir kordonundaki kolinerjik nöronlardan (VA ve VB) girdi alırlar (Şekil 1A)2,3,4. Burada, DD dendritik dikenlerin yapısını ve canlı görüntüleme ve genetik analiz için kolayca erişilebilen sağlam bir sinir sisteminde in vivo işlevlerini araştırmak için görüntüleme yöntemleri sunulmaktadır. Dendritik dikenlerin şeklini izlemek için, (1) dendritik süreci ve dikenleri dolduran sitozolik floresan proteinler; (2) dendritik dikenlerin ve dendritlerin sınırını süsleyen membrana bağlı floresan proteinler; veya (3) dendritik dikenlerle zenginleştirilmiş aktin belirteçleri, LifeAct5 veya Utrophin6 kullanılır, böylece şekilleri ortaya çıkar. DD dikenlerinin işlevselliğini izlemek için, GCaMP floresansı, presinaptik kolinerjik nöronlarda kırmızıya kaymış opsin, Chrimson'un aktivasyonu ile uyarılan Ca ++ geçicilerini tespit etmek için kullanılır7. Her iki stratejinin de vahşi tip ve mutant hayvanlarda DD dendritik dikenlerin incelenmesini kolaylaştırması beklenmektedir.
Protokol
1. DD dendritik dikenlerin yapısının belirlenmesi
- DD dikenlerini etiketlemek için transgenik solucanlar oluşturun
- İlgilenilen etiket için bir ifade vektörü oluşturmak üzere flp-13 promotörünü kullanın (örneğin, sitoplazmik mCherry, MYR::mRuby, LifeAct::GFP, GFP::utrophin) (Şekil 1). Plazmidlerin tam listesini Ek Dosya 1'de görebilirsiniz.
- DD dikenleri 8,9'u etiketleyen transgenik bir çizgi oluşturmak için yerleşik yöntemleri kullanın.
- Sızdırmazlık maddesini hazırlayın
- 1: 1 oranında parafin bazlı gömme ortamı10 karışımı yapın (bkz.
- Ortamı eriyene kadar 60 ° C'de ısıtın, daha sonra 1,5 mL kapaklı mikrosantrifüj tüplerinde aliquot yapın ve 60-70 ° C'de bir ısıtma bloğu bulundurun.
NOT: Sızdırmazlık maddesi ısıtma bloğunda 4 hafta dayanabilir.
- Bir anestezi hazırlayın.
- DamıtılmışH2O'da %1 Trikain ve 1 M levamisolde stok çözeltileri yapın (bakınız Malzeme Tablosu). -20 °C'de saklayın.
- Adım 1.3.3-1.3.5 11'de açıklandığı gibi% 0.05 Trikain ve 15 mM levamisol anestezik çalışma çözeltisihazırlayın.
- 75 μL% 1 Trikain stoğu ve 22.5 μL 1 M levamisol karıştırın.
- M9 arabelleğini 1,5 mL'lik son birime ekleyin.
- Aliquot 10 μL% 0.05 Trikain, 0.5 mL mikrosantrifüj tüplerine 15 mM levamisol ve -20 ° C'de saklayın.
NOT: Anestezik karışım sıcaklığa duyarlıdır ve çalışma çözeltisinin ayrı ayrı alikotları her deney için çözüldükten sonra tekrar dondurulmamalıdır. M9 arabelleği tarifi için Ek Dosya 2'ye bakın.
- Yüksek çözünürlüklü görüntüler elde edin
- % 10 agaroz hazırlayın ve 60 ° C'de su banyosunda saklayın.
NOT: Monica Driscoll'un WormBook12'deki raporuna bakın. - 15-20 genç yetişkini% 10 agaroz pedlerine monte edin ve 3 μL anestezik ekleyin (bkz. adım 3).
- Coverslip uygulayın (solucanlar 5 dakika içinde hareketsiz hale getirilir).
- Kapak kapağının kenarlarını eritilmiş yapışkan sızdırmazlık maddesi karışımı ile kapatın (bkz.
- Görüntü edinme
- Süper çözünürlük kazanımı
- Küçük bir piksel boyutu elde etmek için 63x/1.40 Plan-Apochromat yağ objektif lensli süper çözünürlüklü mikroskopi için donatılmış bir lazer taramalı konfokal mikroskop kullanın (örneğin, < 50 nm). Üreticinin yazılımı tarafından önerilen adım boyutunu kullanarak Z-yığınları edinin (bkz.
- DD ventral işleminin toplam hacmini kapsayan bir dizi optik bölüm toplayın (örneğin, 0,19 μm adım boyutunda veya 2-3μm kalınlığında 15-20 dilim). Üreticinin yazılımını kullanarak görüntü işleme için Z-yığınları gönderin ve 7'den yüksek puan alan görüntüleri analiz edin (Şekil 1B, Şekil 2 ve Şekil 3).
- Nyquist satın alma
- Kullanılan objektif lensin ışık dalga boyu ve sayısal diyaframı için en uygun piksel boyutunu seçmek üzere lazer taramalı konfokal mikroskop kullanın (örneğin, 40x/1.4 Plan Fluor yağı hedefi).
NOT: Daha küçük piksel boyutu, DD dikenlerinin ince yapısını ortaya çıkaracaktır. - Otomatik algoritmayı kullanarak 3B dekonvolüsyon için yığın gönderin (bkz. Malzeme Tablosu) (Şekil 3).
- Kullanılan objektif lensin ışık dalga boyu ve sayısal diyaframı için en uygun piksel boyutunu seçmek üzere lazer taramalı konfokal mikroskop kullanın (örneğin, 40x/1.4 Plan Fluor yağı hedefi).
- Mümkün olan en küçük Z-adımını kullanın (örneğin, Piezo aşaması tarafından belirlenir) çünkü Z'de aşırı örnekleme, 3D dekonvolüsyon13'ten sonra daha keskin görüntüler verebilir.
- Süper çözünürlük kazanımı
- % 10 agaroz hazırlayın ve 60 ° C'de su banyosunda saklayın.
- Görüntü analizi
- Z-yığınları 14'ün maksimum yoğunluk projeksiyonlarını oluşturmak için uygun görüntü işleme yazılımını kullanın (bkz.
- DD dendrit üzerindeki çıkıntıları manuel olarak sayın.
NOT: Çıkıntılar ana şafttan dik uzantılardır (Şekil 1B, ok uçları). - 10 μm DD dendrit başına dikenlerin yoğunluğunu hesaplamak için puanlanan DD dendritinin uzunluğunu belirleyin (Şekil 1C).
- Dikenleri ince/mantar, filopodial, inatçı veya dallı olarak sınıflandırın (Şekil 2A).
NOT: İnce / mantar dikenleri dar bir taban (boyun) ve daha geniş bir uç (kafa) sergiler. Filopodial dikenler daralmış bir taban (boyunsuz) göstermez, ancak sabit bir genişliğe sahiptir. İnatçı dikenler geniş bir tabana ve uca sahiptir. Dallı dikenler, birden fazla ucu olan çıkıntılardır.
2. DD dendritik dikenlerin aktivasyonunun presinaptik kolinerjik sinyalizasyon ile değerlendirilmesi
- Geleneksel teknikleri kullanarak transgenik solucanlar oluşturun (örneğin, mikroenjeksiyon)8,9
- DD nöronlarında Ca++ sensörünün, GCaMP6'ların ekspresyonunu sürmek için flp-13 promotörünü ve presinaptik VA nöronlarında kırmızıya kaymış bir kanalrodopsin olan Chrimson'un ekspresyonunu sürmek için unc-4 promotörünü kullanın (Şekil 4A). Ek Dosya 1'deki plazmidlerin listesine bakın.
- All-trans Retinal (ATR) ve kontrol plakalarını hazırlayın.
NOT: ATR, Chrimson'un optogenetik olarak aktive edilmiş bir iyon kanalı olarak işlev görmesi için gerekli bir kofaktördür.- Etanol içinde 100 mM ATR stok çözeltisi hazırlayın (%100). 1 mL aliquots içinde -20 ° C'de saklayın.
- Bir laminer akış başlığı altında, her 60 mm NGM (Nematod Büyüme Ortamı) besin agar plakasına 300 μL gece OP50 bakteri kültürü ve 0.25 μL ATR ekleyin ve steril bir cam çubukla yayın.
- Kontroller için, ayrı bir NGM plaka grubuna 300 μL OP50 bakteri ve 0.25 μL etanol (%100) ekleyin.
- Bakteri üremesine izin vermek için plakaları oda sıcaklığında 24 saat (ortam ışığından korunan) kaputta bekletin.
NOT: Plakalar ilk 24 saatlik inkübasyondan sonra kullanılabilir veya 5 gün içinde kullanılmak üzere 4 ° C'de muhafaza edilebilir.
- Denemeyi ayarlama
- OP50 tohumlu ATR veya ATR'siz ve 23 ° C'de karanlıkta büyüyen kontrol plakalarına beş NC3569 L4 aşamalı larva yerleştirin.
- Üç gün sonra, ATR'den L4 evre soyunu seçmek için vulva gelişimini doğrulamak için bir stereo diseksiyon mikroskobu kullanın ve 2.4.1-2.4.3 adımlarında açıklandığı gibi görüntüleme için plakaları kontrol edin.
- Bir mikroskop slaytı üzerine, 2 μL 0,05 μm poliboncuk (% 2,5 katı w / v) yerleştirin (bkz.
- Çözeltiye küçük bir süper yapıştırıcı küresi eklemek için bir platin tel ("solucan toplama") kullanın ve filamentli tutkal "telleri" oluşturmak için hafifçe döndürün. Ardından 3 μL M9 tamponu ekleyin (Şekil 4B).
- Çözeltiye yaklaşık on L4 larva yerleştirin ve bir örtü parçası uygulayın.
NOT: Tutkal lifleri solucanlarla rastgele temas edecek ve kapak kayması uygulandıktan sonra onları hareketsiz hale getirecektir. Büyük tutkal küreciklerine gömülü solucanlar kurutulmuş görünür ve görüntülenmemelidir. - Adım 1.4.4'te belirtildiği gibi kapak kaymasının kenarlarını kapatın.
- Dendritik dikenlerde uyarılmış Ca++ geçicilerinin kaydedilmesi.
- Hassas bir CCD kamera, 100x TIRF yağı objektif lens ve 488 nm ve 561 nm lazer çizgileri ile donatılmış bir dönen disk konfokal mikroskop kullanın (bkz.
- DD dikenlerini odak düzleminde konumlandırmak için mikroskop aşamasını ayarlayın.
- Numuneyi her karede 488 nm lazer çizgisi (GCaMP6s floresansını tespit etmek için) ve periyodik aralıklarla 561 nm lazer hattı (Chrimson uyarımı için) ile aydınlatmak için hızlandırılmış alımı ayarlayın.
NOT: Örneğin, GCaMP6s sinyalinin ardışık anlık görüntülerini (200 ms) yakalamak için 488 nm ışık kullanın ve her 5. karede bir 561 nm ışığın 200 ms darbesini yakalayın (Şekil 4C-E). Bu konfigürasyonla, her 561 nm darbeden önce ve sonra GCaMP seviyeleri ~1 s aralıklarla algılanır (VA aktivasyonundan önce GCaMP'yi algılamak için 200 ms 488 nm lazer, VA'yı etkinleştirmek için 200 ms 561 nm darbe ve lazer hatları ve emisyon filtreleri arasında geçiş yapmak için ~600 ms. Bu kurulumla, VA nöronları her 2.5 saniyede bir aktive edilir.
- İn vivo Ca++ görüntüleme analizi
- Edinme sırasında solucan hareketinden kaynaklanan küçük sapmaları düzeltmek için 2B dekonvolüsyon ve görüntü hizalaması kullanın (bkz.
- DD dendritik omurgayı İlgi Bölgesi olarak tanımlayın (Şekil 4C-D'deki ROI).
- Yatırım getirisini çoğaltın ve arka plan sinyalini (yani gürültü) toplamak için solucanın içindeki komşu bir bölgeye taşıyın.
- GCaMP6s yoğunluklarını her zaman noktası için mükemmel olacak şekilde dışa aktarmak için uygun yazılımı kullanın ( Malzeme Tablosuna bakın). Arka plan floresanını omurga ROI floresansından çıkarın.
- 561 nm uyarımdan (F0) hemen önce çerçevedeki GCaMP6s floresanını uyarmadan sonraki her zaman noktasından (ΔF) çıkarıp ardından ΔF/F0'ı belirlemek için F0'a bölerek floresandaki değişimi belirleyin (Şekil 4E).
- Normalleştirilmiş izlerin grafiğini çıkarın ( Bkz. Malzeme Tablosu).
- 561 nm ışığın her darbesinden önce ve sonra GCaMP6s floresansının her ölçümü için eşleştirilmiş bir istatistiksel test gerçekleştirin.
NOT: Bu yaklaşım, GCaMP6s floresanında, 561 nm uyarımdan önceki ve sonraki tüm ölçümlerden ortalama GCaMP6s sinyalini karşılaştırmanın istatistiksel gücünü azaltan rastgele dalgalanmaları etkili bir şekilde hariç tutar (Şekil 4F). - Normal veya Gauss dağılımını gösteren ölçümler için, eşleştirilmiş bir parametrik ANOVA testi kullanın ve iki grubun her biri için çoklu karşılaştırmalar için düzeltin (ATR öncesi ve sonrası, önce ve sonra ATR yok). Alternatif olarak, normalde dağıtılmayan veriler için, çoklu testler için posthoc düzeltmeli parametrik olmayan bir ANOVA kullanın.
NOT: ATR'si olmayan ("ATR yok") plakalarda yetiştirilen solucanlar gerekli kontrollerdir ve Chrimson işlevi için ATR gerekli olduğundan 561 nm etkinleştirilmiş Ca++ geçicilerini göstermemelidir.
Sonuçlar
Üç bağımsız belirteç (sitozolik mCherry, LifeAct::GFP, MYR::mRuby) ile yapılan ölçümler, vahşi tip genç erişkinlerde 10 μm DD dendrit başına ortalama 3.4 ± 1.03 DD dendritik diken yoğunluğu vermiştir (Şekil 1B, C). Bu analiz için, GFP::Utrophin marker ile elde edilen ve önemli ölçüde daha düşük omurga yoğunluğu veren ölçümler, Utrophin'in potansiyel olarak omurga morfogenezi15'i yönlendiren aktin sitoiskelet6 ile etkileşimleri nedeniyle hariç tutulmuştur (2.4 ± 0.74, Şekil 1). Işık mikroskobundaki omurga yoğunluğu ölçümleri, DD1 nöron 2'nin elektron mikrograflarından 12 dikenin yeniden yapılandırılmasından elde edilen 4.2 diken / 10 μm dendritdeğeri ile karşılaştırılabilir. Canlı hücre görüntüleme yaklaşımı, DD dikenlerinin ince / mantar şeklindeki morfolojisinin, yetişkin ve alternatif omurga şekillerinde (örneğin, filopodial, inatçı, dallanmış) baskın olduğunu doğrulamıştır (Şekil 2B), bu da olgun memeli sinir sistemindeki dikenler için tipiktir16.
Yüksek çözünürlüklü ışık mikroskobu (Şekil 1 ve Şekil 2) ile tespit edilen varsayımsal dendritik dikenlerin, memeli nöronlarındaki dendritik dikenlerin karakteristik bir özelliği olan presinaptik bölgelerden nörotransmitter salınımına yanıt verip vermediğini sormak için optogenetik bir strateji kullanılmıştır. Yeşil ışık (561 nm), presinaptik kolinerjik nöronlarda bir kanalrodopsin varyantı olan Chrimson'u ve postsinaptik DD dendritik dikenlerde sitoplazmik GCaMP probu tarafından yayılan Ca ++ bağımlı floresanı tespit etmek için mavi ışığı (488 nm) aktive etmek için kullanıldı. Bu deney, presinaptik VA nöronlarında Chrimson'un optogenetik aktivasyonundan hemen sonra DD dikenlerinde GCaMP sinyalinin geçici patlamalarını tespit etti (Şekil 3). Bu deneyin başarısı, Chrimson'un tüm presinaptik VA nöronlarında güvenilir ifadesine bağlıdır. Bu durumda, tutarlı VA ekspresyonunu sağlamak için Punc-4::Chrimson markerinin kromozomal integrant17'si kullanıldı. Bu deney ekstrakromozomal bir dizi ile de yapılabilir. Belirli bir VA nöronundaki Chrimson ekspresyonu, örneğin, Chrimson transgenini, bir eş-ekspresyon belirteci 2 olarak aşağı akış nükleer lokalize GFP ileSL2 transpliced lider dizisine bağlayarak bağımsız olarak doğrulanabilir. Ölçülen GCaMP sinyalinin kesinlikle ATR'ye bağımlı olan Chrimson'un optogenetik aktivasyonuna bağlı olduğunu doğrulamak için ATR'nin yokluğunda bir kontrol deneyi yapmak önemlidir (Şekil 4D). Son olarak, uyarılan Ca++ sinyalleri geçici olduğundan, 488 nm lazer ile 561 nm uyarma ve GCaMP sinyal alımı arasında hızlı anahtarlamaya (<1 s) izin veren bir görüntüleme protokolünün benimsenmesi çok önemlidir (Şekil 4).

Şekil 1: DD dendritik dikenlerinin etiketlenmesi . (A) (Üst) C. elegans'ın ventral sinir kordonunda altı Dorsal D (DD1-DD6) nöronu. (Altta) Yetişkinlerde, ventral olarak yönlendirilmiş DD dikenleri (ok ucu) Ventral A (VA) ve Ventral B (VB) motor nöronlarının (macenta) presinaptik terminalleri ile temas eder ve DD komissürleri, vücut kaslarına GABAerjik çıkış sağlamak için dorsal sinir kordonuna uzanır (ok)18. Bu şekil Referans2'den değiştirilmiştir. (B) Genç yetişkin solucanlarda sitozolik mCherry, myristoylated mRuby (MYR::mRuby), LifeAct::GFP ve GFP::Utrophin ile etiketlenmiş DD dikenlerinin floresan mikrografları (Airyscan). Gri ok uçları dikenleri işaret eder. Ölçek çubuğu = 2 μm. (C) Sitozolik mCherry (3.77 ± 0.9), MYR::mRuby (3.09 ± 0.8), LifeAct::GFP (3.44 ± 1.1) veya GFP::Utrophin (2.41 ± 0.8) ile etiketlenmiş DD nöron dendritik dikenlerinin yoğunluğu (dikenler/10 μm). Tüm numuneler normal olarak dağıtılır. Tek Yönlü ANOVA, sitozolik mCherry, MYR::mRuby ve LifeAct::GFP için omurga yoğunluklarının anlamlı derecede farklı (NS) olmadığını, oysa GFP::Utrophin ve diğerleri için omurga yoğunluğunun azaldığını göstermektedir. sitozolik olarak etiketlenmiş mCherry (p = 0.0016) ve LifeAct::GFP (p = 0.0082). Kesikli kırmızı çizgi, 3D EM rekonstrüksiyonundan (4.2 diken / 10 μm) değerlendirilen DD nöronlarının omurga yoğunluğunu temsil eder. Bu şekil Referans2'den değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: DD dendritik dikenlerin görüntülenmesi. (A) (Üstte) Omurga şekillerinin şeması. (Altta) LifeAct::GFP (yeşil) ile etiketlenmiş her omurga tipinin (Ölçek çubuğu = 500 nm) havari görüntüleri ve yüksek basınçlı donmuş bir yetişkinin (mavi) seri elektron mikrografları ile 3D rekonstrüksiyonlar. (B) LifeAct ile görselleştirilen türe göre omurga sıklığı::GFP: İnce/Mantar (55.5 ± %14.5), Filopodial (10.3 ± %8.70), İnatçı (18.8 ± %10.7), Dallanmış (15.42 ± %6.01). MYR ile görselleştirilen türe göre diken sıklığı::mRuby: İnce/Mantar (52.2 ± %16.5), Filopodial (5.68 ± %7.0), İnatçı (33.1 ± %14.8), Dallanmış (9.02 ± %9.6). Eşlenmemiş T-testi, Filopodial (p = 0.0339); MYR::mRuby işaretleyicisi ile etiketlenmiş saplama (p = 0.0009) ve Dallanmış (p = 0.011) dikenler, LifeAct::GFP'den önemli ölçüde farklıdır. Bu şekil Referans2'den değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
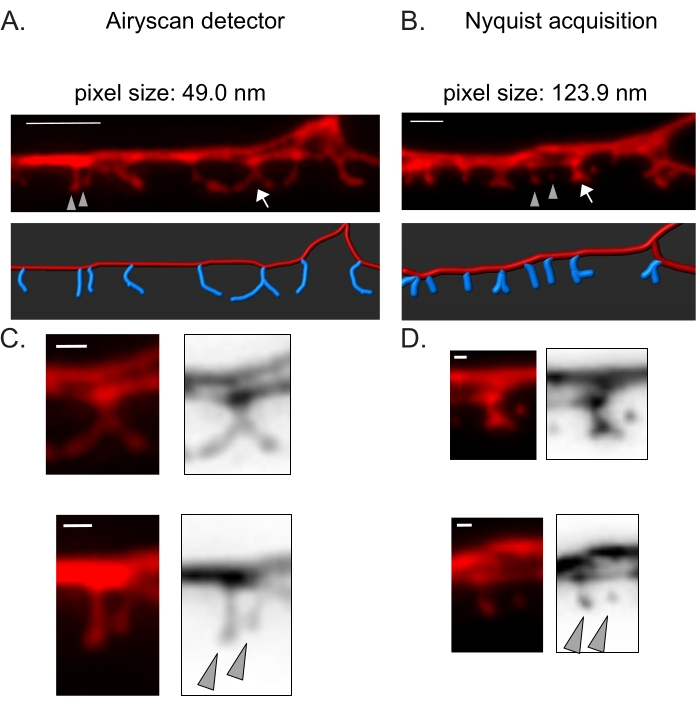
Şekil 3: DD dikenlerinin yüksek çözünürlüklü görüntülerini elde etme stratejileri . (A-B) (Üstte) DD1 dendritlerinin (A) Airyscan dedektörü ve (B) Nyquist edinimi ile sitozolik bir belirteç (mCherry) ile etiketlenmiş floresan görüntüleri. (Altta) DD dendrit (kırmızı) bir görüntü analiz yazılımı (filament izleyicinin otomatik yol seçeneği) ile tasvir edilmiştir ve DD dikenleri (mavi) yarı otomatik diken tespit modülü kullanılarak grafiksel olarak gösterilmiştir. Ok işaretleri C ve D'de genişlemiş dallanmış omurgaya işaret eder Ok uçları, C ve D'de büyütülmüş komşu ince/mantar dikenlerini gösterir. ölçek çubuğu = 2 μm. (C-D) (üstte) dallanmış omurganın (ok) ve (altta) (C) Airyscan dedektörü veya (D) Nyquist edinimi ile elde edilen iki komşu ince/mantar dikeninin (ok uçları) büyütülmüş örnekleri. Ölçek çubuğu = 500 nm. Veriler2'den çoğaltıldı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: DD dikenlerinin fonksiyonunun değerlendirilmesi. (A) DD motor nöronları Ca++ göstergesi GCaMP6'ları (yeşil) ifade eder ve VA motor nöronları channelrhodopsin varyantı Chrimson (macenta)7'yi ifade eder. (B) Ca++ ölçümleri için solucanları monte etmek için şematik tasvir yöntemi. (1) Temiz bir mikroskop slaytında, (2) 2 μL 0.05 μm poli boncuk yerleştirin, (3) küçük bir süper tutkal küresi eklemek için bir platin tel ("solucan toplama") kullanın ve (4) filamentli tutkal iplikçikleri oluşturmak için çözeltiye girdap yapın. (5) 3μL M9 tamponu ekleyin. (6) Çözeltiye yaklaşık on L4 larva yerleştirin, (7) kapak kayması uygulayın ve kenarları Vazelin / balmumu ile kapatın. (C-D) VA nöronlarının aktivasyonu, DD1 dikenlerindeki Ca ++ geçicileri ile ilişkilidir. Chrimson'un periyodik ışık aktivasyonu (2,5 s aralıklarla) ile görüntülenen GCaMP6s floresansı, (C) +ATR (n = 12) ile Ca++ geçicilerini çağrıştırır, ancak (D) kontrollerinde (-ATR, n = 12) değildir. Paneller, 561 nm ışığın darbesinden önce ve sonra (dikey pembe çizgi) zaman içinde anlık görüntülerdir. Ölçek çubukları = 2 μm. GCaMP6s sinyali, her omurganın ucundaki bir ROI'den (İlgi Alanı) alınır. (E) +ATR (yeşil) ve -ATR (kontrol, gri) (n = 12 video) için çizilen 10 s kayıt süresi boyunca GCaMP6s floresansı. Dikey pembe çubuklar 561 nm aydınlatmayı gösterir (örneğin, Chrimson aktivasyonu). Her hayvan 561 nm ışıkla 4 kez uyarıldı. Ölçümler, 561 nm ışığın her darbesinden önce ve sonra toplandı. (F) GCaMP6'ların 561 nm ışığın her darbesinden önce ve sonra floresansının grafiği. GCaMP6s floresansı, 561 nm ışığın her darbesinden sonra 1 s ölçüldü. Numuneler normal olarak dağıtılmadığından, GCaMP6s floresansının daha önce ve daha önce yapılan çoklu karşılaştırmalarını düzeltmek için eşleştirilmiş bir parametrik olmayan Friedman testi uygulanmıştır. ATR (+ATR, yeşil) (*** p = 0.0004, n = 48 ölçüm) veya ATR (-ATR, gri) yokluğunda (NS, Anlamlı Değil, p = 0.0962, n = 48 ölçüm) yetiştirilen solucanlar için 561 nm ışık stimülasyonundan sonra. Bu şekil Referans2'den değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Çalışmada kullanılan plazmidlerin listesi. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 2: M9 tamponunun bileşimi ve hazırlanması. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Airyscan dedektörü, DD dikenlerinin anlık görüntülerini elde etmek için seçildi, çünkü geleneksel konfokal mikroskoplardan daha yüksek bir sinyal-gürültü oranı ve daha iyi çözünürlük sağlıyor19,20. AiryScan görüntüleme ayrıca, artık C. elegans için yaygın olarak bulunan geleneksel floresan proteinlerinin (örneğin, GFP, mCherry, vb.) kullanılmasına izin verir. Diğer süper çözünürlüklü yöntemlerle (örneğin, STORM, STED, PALM) daha yüksek çözünürlüklü görüntüler elde edilebilse de, bu yöntemler foto-aktive edilebilir veya foto-değiştirilebilir floresan proteinleri gerektirir21. Airyscan'a alternatif olarak, geleneksel konfokal mikroskoplar önerilir. Örneğin, Nyquist edinimi ile görüntüleme (Şekil 3), omurga morfolojik tiplerini ayırt etmek için yeterli olan 123.9 nm'lik 40x/1.3 hedefini kullanarak piksel boyutuna ulaşır (Şekil 2).
Omurga yoğunluğunu belirlemek için, (1) mCherry veya GFP, (2) Aktin sitoiskeletini etiketlemek için LifeAct veya (3) plazma zarını etiketlemek için bir miristotelize floresan proteini (örneğin, MYR::mRuby) kullanılması önerilir (Şekil 1B). Buna karşılık, F-aktin bağlayıcı protein Utrophin, omurga yoğunluğunu azaltır (Şekil 1C), Utrophin aşırı eksprese edildiğinde omurga morfogenezi üzerinde olumsuz bir etki olduğunu gösterir.
Mevcut görüntüleme yöntemleri, omurga morfolojisini yöneten genetik varyantların tanımlanmasına yardımcı olmalıdır 1,16. DD omurga morfolojisi (yani, ince / mantar, filopodial, inatçı, dallı, bakınız Şekil 2), ventral sinir kordonu lateral görüntülerinin tek 2D projeksiyonlarından değerlendirilebilir, çünkü çoğu DD dikeni karakteristik olarak ventralal olarak yönlendirilmiş bir oryantasyon benimser. Bu karşılaştırmalarda, her koşul için aynı floresan belirtecinin kullanılması esastır, çünkü görünür omurga morfolojik tipleri etiketleme yönteminden etkilenmiş gibi görünmektedir (örneğin, MYR::mRuby vs. LifeAct::GFP). Ek olarak, omurga şekillerinin dinamik olduğu ve muhtemelen dış sinyallere yanıt olarak şekil değiştirdiği belirtildi 2,16. Bu nedenle, benzer gelişim aşamalarında ve benzer koşullar altında genotipler arasındaki omurga şekillerini karşılaştırmak da önemlidir.
C. elegans ventral kordonunun oryantasyonu, doğru görüntü elde etmek için kritik öneme sahiptir. Hayvanın zıt taraflarındaki hem ventral hem de dorsal kordonlar, solucanın kendi tarafına yönlendirildiğini gösteren aynı Z-düzleminde görülmelidir (Şekil 1B). Ventral kordonun yakınındaki diğer solucanlar veya kabarcıklarla hareket eden veya temas halinde olan solucanların görüntülerini toplamamak en iyisidir, çünkü bu dikenlerin görüntülerini bozabilir.
İn vivo kalsiyum görüntüleme için, her edinimden hemen önce taze slaytların hazırlanması gerekir. Solucanları sadece ince tutkal lifleri ile temas halinde görüntülemek en iyisidir. Solucanları kurutmaya ve görüntüyü bozmaya meyilli tutkalın "globları" (Şekil 4B). Şekil 4'te gösterilen deneyde, 561 nm ışığın darbesi tüm görüş alanını aktive eder. Yerel Ca++ geçicilerini tespit etmek için zamansal ve uzamsal çözünürlüğü artırmak için, örneğin, bireysel DD dikenlerinde, 561 nm lazer hattı için kurulmuş bir galvo mini tarayıcı, daha küçük bir ilgi alanını uyarmak için kullanılabilir17.
Açıklamalar
Çıkar çatışması olmadığını beyan ediyoruz.
Teşekkürler
Imaris üzerinde görüntüleme ve analizler NIH tarafından desteklenen Vanderbilt Hücre Görüntüleme Paylaşımlı Kaynağında (CIRS) gerçekleştirilmiştir (CA68485, DK20593, DK58404, DK59637 ve EY08126). LSM 880, hibe 1S10OD201630 tarafından desteklenir. Nikon dönen diskte görüntüleme Nikon Center of Excellence'ta gerçekleştirildi. CISR direktörü Jenny Schafer'e ve Bryan Millis'e eğitim ve anlayışlı tartışmalar için ve Burnette laboratuvarı üyelerine teşekkür ederiz: Dylan Burnette, Aidan Fenix ve Nilay Taneja tavsiye için. Bu çalışma, DMM'ye Ulusal Sağlık Enstitüleri hibeleri (R01NS081259 ve R01NS106951) ve ACC'ye Amerikan Kalp Derneği hibesi (18PRE33960581) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| All-trans retinal (ATR) | Sigma-Aldrich | R2500-100MG | Necessary cofactor for neuronal excitation with Chrimson |
| diH2O | MilliQ | To prepare M9 buffer | |
| Ethanol 100% | Sigma | 64-17-5 | To dilute ATR and make control plates for neuronal excitation |
| Ethyl 3-aminobenzoate methanesulfonate salt (tricaine) | To immobilize animals for imaging dendritic spines | ||
| ImageJ | NIH | (Schindelin J et al., 2012) | Open source image processing software |
| KH2PO4 | Fisher Bioreagents | 7758-11-4 | To prepare M9 buffer |
| Levamisole hydrochloride | Sigma | 16595-80-5 | To immobilize animals for imaging dendritic spines |
| MgSO4 | Fisher Chemical | M63-500 | To prepare M9 buffer |
| Microscope cover glass | Fisherbrand | 12542B | To mount animals for microscopy acquisition |
| Na2HPO4 | Fisher Scientific | S369-500 | To prepare M9 buffer |
| NaCl | Fisher Chemical | S671-3 | To prepare M9 buffer |
| NIS Elements version 05.21 | Nikon | To analyze images and movies (e.g., Deconvolution, image alignment) | |
| Polybeads carboxylate 0.05um microspheres | Polysciences, Inc | 15913-10 | To immobilize animals for imaging Ca++ transients |
| Prism | For statistical analysis and graphing normalized Ca++ transients | ||
| SeaKen ME agarose | Lonza | 50014 | To make agarose pads to mount animals for imaging |
| Super Glue | The gorilla company | To immobilize animals for imaging Ca++ transients | |
| Superfrost microscope slides | Fisherbrand | 22-034-980 | To mount animals for microscopy acquisition |
| vaseline | Covidien | 8884430300 | To seal sample for confocal snapshots |
| Wax | Fisherbrand | 23-021-399 | Paraplast tissue embedding medium |
| Microscope for super-resolution imaging | |||
| LSM880 | Zeiss | ||
| AiryScan detector | Zeiss | ||
| Plan Apochromat (oil) 63x/ 1.40 NA, WD = 0.19 mm | |||
| Laser lines | |||
| Stage controller | |||
| Microscope for Nyquist image acquisition | |||
| A1R Confocal | Nikon | ||
| Plan Fluor (oil) 40x/1.3 NA, WD 0.24 mm | |||
| 488 nm, 16mW | |||
| 561 nm, 17mW | |||
| Microscope to monitor evoked Ca++ transients in dendritic spines | |||
| Spinning Disk Confocal | Nikon | ||
| Andor DU-897 EMCCD camera | |||
| Spinning disk Head CSU-X1 | Yokogawa | ||
| Apo TIRF (oil) 100x/1.49 NA ,WD 0.12 mm | |||
| 488 nm, 65mW | |||
| 561 nm, 86mW | |||
| 525 nm (+/- 18 nm) | |||
| 605 nm (+/- 35 nm) |
Referanslar
- Sala, C., Segal, M. Dendritic Spines: The Locus of Structural and Functional Plasticity. Physiological Reviews. 94 (1), 141-188 (2014).
- Cuentas-Condori, A., et al. C. elegans neurons have functional dendritic spines. Elife. 8, 47918 (2019).
- Philbrook, A., et al. Neurexin directs partner-specific synaptic connectivity in C. Elegans. Elife. 7, 35692 (2018).
- Oliver, D., Alexander, K., Francis, M. M. Molecular Mechanisms Directing Spine Outgrowth and Synaptic Partner Selection in Caenorhabditis elegans. Journal of Experimental Neuroscience. 12, 10-13 (2018).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5, 605-607 (2008).
- Ladt, K., Ganguly, A., Roy, S. Axonal actin in action: Imaging actin dynamics in neurons. Methods of Cell Biology. 131, 91-106 (2016).
- Schild, L. C., Glauser, D. A. Dual color neural activation and behavior control with chrimson and CoChR in Caenorhabditis elegans. Genetics. 200 (4), 1029-1034 (2015).
- Mello, C., Kramer, J., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrahcormosomal maintenance and integration of transforming sequences. The EMBO Journal. 10 (12), 3959-3970 (1991).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C . elegans Using Microinjection. Journal of Visualized Experiments. (18), e833 (2008).
- Smith, C. J., et al. Time-lapse imaging and cell-specific expression profiling reveal dynamic branching and molecular determinants of a multi-dendritic nociceptor in C. elegans. Developemntal Biology. 345 (1), 18-33 (2010).
- Mccarter, J., Bartlett, B., Dang, T., Schedl, T. Soma - Germ Cell Interactions in Caenorhabditis elegans : Multiple Events of Hermaphrodite Germline Development Require the Somatic Sheath and Spermathecal Lineages. Developemntal Biology. 181 (2), 121-143 (1997).
- Driscoll, M. Mounting animals for observation with Nomarski DIC optics. WormBook. , (2008).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. Journal of Cell Biology. 172 (1), 9-18 (2006).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Hotulainen, P., Hoogenraad, C. C. Actin in dendritic spines connecting dynamics to function. Journal of Cell Biology. 189 (4), 619-629 (2010).
- Berry, K. P., Nedivi, E. Spine Dynamics: Are They All the Same. Neuron. 96 (1), 43-55 (2017).
- Miller, D. M., Niemeyer, C. J. Expression of the unc-4 homeoprotein in Caenorhabditis elegans motor neurons specifies presynaptic input. Development. 121 (9), 2877-2886 (1995).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Ventral Nerve Cord of Caenorhadbitis elegans. Philosophical Transactions of the Royal Society. 275 (938), 327-348 (1976).
- Huff, J. The Airyscan detector from ZEISS confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12, (2015).
- Huff, J. The Fast mode for ZEISS LSM 880 with Airyscan high-speed confocal imaging with super-resolution and improved signal-to-noise ratio. Nature Methods. 13, (2016).
- Jacquemet, G., Carisey, A. F., Hamidi, H., Henriques, R., Leterrier, C. The cell biologist's guide to super-resolution microscopy. Journal of Cell Science. 133 (11), 240713 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır