Method Article
התאמת Organoids במערכת העיכול עבור זיהום פתוגן ורצף תא יחיד תחת בטיחות ביולוגית רמה 3 (BSL-3) תנאים
In This Article
Summary
פרוטוקול זה מתאר כיצד להדביק organoids מעיים אנושיים מהצד apical או basolateral שלהם כדי לאפיין אינטראקציות מארח / פתוגן ברמת תא יחיד באמצעות טכנולוגיית רצף RNA של תא יחיד (scRNAseq).
Abstract
אורגנוידים במעיים אנושיים מהווים את המודל התאי הטוב ביותר לחקר זיהומים פתוגן של מערכת העיכול. אורגנוידים אלה יכולים להיגזר מכל חלקי מערכת העיכול (קיבה, ג'ונום, תריסריון, איליאום, המעי הגס, פי הטבעת) ועל פי הבחנה, מכילים את רוב סוגי התאים שנמצאים באופן טבעי בכל סעיף בודד. לדוגמה, אורגנוידים במעיים מכילים אנרוטיטים סופגי חומרים מזינים, תאי הפרשה (גביע, פאנית ואנטרונדוקריני), תאי גזע, כמו גם כל ביניים בידול ספציפיים לשושלת היוחז (למשל, סוגי תאים מוקדמים או לא בוגרים). היתרון הגדול ביותר בשימוש organoids נגזר מערכת העיכול כדי לחקור מחלות זיהומיות היא האפשרות לזהות במדויק איזה סוג התא ממוקד על ידי פתוגן המעית ולטפל אם החלקים השונים של מערכת העיכול וסוגי התאים הספציפיים שלהם מגיבים באופן דומה לאתגרי פתוגן. במהלך השנים האחרונות, מודלים במערכת העיכול, כמו גם organoids מרקמות אחרות, שימשו לחקר טרופיזם ויראלי ואת המנגנונים של פתוגנזה. עם זאת, ניצול כל היתרונות של שימוש organoids בעת שימוש וירוסים פתוגניים מאוד מייצג אתגר טכני ודורש שיקולים בטיחות ביולוגית קפדנית. בנוסף, כמו organoids גדלים לעתים קרובות בשלושה ממדים, הצד basolateral של התאים פונה החלק החיצוני של organoid בעוד הצד האפילי שלהם פונה פנימה (לומן) של organoids. ארגון זה מהווה אתגר עבור פתוגנים אנטריים כמו זיהומים אנטריים רבים ליזום מהצד apical / זוהר של התאים בעקבות בליעה. כתב היד הבא יספק פרוטוקול מקיף להכנת organoids מעיים אנושיים לזיהום עם פתוגנים אנטריים על ידי התחשבות בצד הזיהום (apical לעומת basolateral) לבצע רצף RNA חד-תאי כדי לאפיין אינטראקציות מארח /פתוגן ספציפיים לתא. שיטה זו מפרטת את הכנת האורגנוידים, כמו גם את השיקולים הדרושים לביצוע עבודה זו בתנאי בלימה ברמה ביולוגית 3 (BSL-3).
Introduction
חקר הטרופיזם הספציפי לסוג התא ותגובה חיסונית ספציפית לסוג התא לווירוסים המעיתים האנושיים היה מאתגר מבחינה היסטורית בשל היעדר מודלים תאיים אנושיים ראשוניים. מגבלה זו הושמדה כעת חלקית עם התפתחות האורגנוידים1. במקרה של מערכת העיכול, מודלים organoid קיבה ומעיים פותחו עבור בני אדם וכמה מינים אחרים (למשל., מורין, שור, חתול, עטלף)2,3,4,5,6. אורגנוידים במעיים משחזרים את הארכיטקטורה המבנית של אפיתל המעי האנושי ומכילים מבנים דמויי קריפטה וווילי, שושלות מעיים פונקציונליות ואף שימשו לזיהוי שושלות תאים שלא היו ידועות קודם לכן. שתי גישות שונות ניתן להשתמש כדי לגדל organoids מעיים. ראשית, תאי גזע מעיים המכילים קריפטות מבודדים כריתות רקמות או ביופסיות וגדלים בתנאי תרבית ספציפיים (למשל, Wnt3A, R-spondin, Noggin ו- EGF) כדי להתרחב, ולאחר מכן להבדיל את תאי הגזע לרוב שושלות תאי המעי (למשל. שיטה זו מאפשרת בידוד של organoids מכל חלקי מערכת העיכול(למשל,הבטן, התריסריון, jejunum, איליאום, ומעי הגס). השיטה השנייה מסתמכת על תאי גזע פלוריפוטנטים או עובריים הנגרמים על ידי האדם, אשר מובחנים לאחר מכן בתהליך צעד לתוך תאי אפיתל מעיים8. אורגנוידים אלה מבוססי תאי גזע מושרים מתוארים לעתים קרובות כעובריים יותר בטבע בהשוואה לאורגנואידים שמקורם במטופל. בעוד כל המודלים האורגנוידים האלה היו קריטיים לפריקת רמזים התפתחותיים הדרושים כדי ליצור את מערכת העיכול, השימוש שלהם במחקר מחלות זיהומיות עדיין בחיתוליו.
וירוס אנטרי הוא מונח רחב המכסה את כל הווירוסים, אשר להדביק דרך מערכת העיכול, כגוןpicornaviruses (למשל, EV-71), reoviruses (למשל, rotavirus), ו caliciviruses (למשל, norovirus)9. וירוסים אנטריים יוזמים את מחזור החיים הזיהומי שלהם באמצעות בליעה של מזון ומים מזוהמים, מה שמשאיר אנשים במדינות מתפתחות בסיכון גבוה עקב פריקה של פסולת לא מטופלת לסביבה וחוסר טיפול רפואי לאחר תחילת זיהום10. בהתאם לסוג של פתוגן, הזיהום יכול להוביל דלקת גסטרואנטריטיס, הקאות, ו/או שלשול מימי עקב דליפה של רירית המעי. noroviruses אנושי הם פתוגן אנטרי נפוץ מאוד זיהומיות מאוד, שמובילים מעל 600 מיליון זיהומים ו 15 מיליון אשפוזים ברחבי העולם11. Organoids היו המפתח למחקר norovirus כפי שהם תומכים זיהום ושכפול של norovirus אנושי, אשר בעבר לא היה מסוגל להיות תרבותי במודלים סטנדרטיים של תרבות התא12.
בשני העשורים האחרונים, נגיפי קורונה התגלו כפתוגנים אנושיים מרכזיים13. משפחה זו כוללת את MERS פתוגניים מאוד, SARS-CoV-1, ו SARS-CoV-2, אשר דורשים בלימות רמת בטיחות קפדנית בעת ביצוע מחקר על וירוסים אלה. מעניין, בעוד כל שלושת הפתוגנים האלה מוכרים בעיקר בשל הסימפטומים הנשימתיים המושרים שלהם ומצוקה, כעת ברור כי וירוסים אלה אינם מדביקים רק את דרכי הנשימה אלא גם איברים אחרים. פתולוגיה חשובה המושרה בחולים נגועים SARS-CoV-2 מלבד המצוקה הנשימתית היא נוכחות של תסמינים במערכת העיכול14. חלק קטן מהחולים הנגועים SARS-CoV-2 מציג תסמינים כאלה, החל משלשול קל מאוד עד חמור. בנוסף, גנומים SARS-CoV-2 ניתן לזהות ביופסיות צואה ומערכת העיכול של חולים נגועים15. חשוב לציין את נוכחותם של תסמינים במערכת העיכול אינו מוגבל SARS-CoV-2 כפי שהם נצפו גם בחולים נגועים MERS ו SARS-CoV-1. כדי להבין כיצד SARS-CoV-2 גורם למצוקה במערכת העיכול ולזהות במדויק את הטרופיזם של SARS-CoV-2 במערכת העיכול, אורגנוידים במעיים אנושיים היו כלי מרכזי וכעת מנוצלים כדי לפענח תגובות ספציפיות לסוג התא לפתוגן זה16,17.
פרופיל תמלול של אוכלוסיית תאים (ריצוף RNA בתפזורת) היה נוהג מקובל בעת הערכת זיהומים פתוגן של שני קווי תאים מונצחים, כמו גם עם organoids. בעוד זה מאפשר לנו לקבוע שינויים גלובליים בתגובה פתוגנים (למשל, upregulation של ציטוקינים), בתפזורת RNAseq אינו מאפשר לנו לקבוע מדוע תאים ספציפיים באוכלוסייה נוטים יותר לזיהום מאחרים. רצף RNA חד-תאי (scRNAseq) הפך לכלי רב עוצמה כדי לפענח תוכניות תמלול ספציפיות לשושלת תאים וניתן להשתמש בו כדי לקבוע כיצד תוכניות אלה תומכות או מדחיקות זיהום וירוס18,19. התיאור הראשון של scRNAseq היה בשנת 2009 ושימש להערכת פרופילי התמלול של התאים השונים שנמצאו בפיצוץ עכבר20. טכנולוגיות אלה הורחבו כעת וניתן ליישם אותן באמצעות מספר פלטפורמות שונות. גרסאות מוקדמות של טכנולוגיה זו יישמו ממיין תאים המופעל על-ידי פלואורסצנטיות (FACS) כדי להפריד תאים בודדים לרצף, אשר הוגבל לעתים קרובות לוחות 96- או 384-well, ובכך לתת 300 תאים בודדים לנתח לכל מדגם21. שיטות אלה קודמו כעת על ידי פלטפורמות ריצוף תא יחיד, המשתמשות במכשיר מיקרופלואידי כדי לתמצת תאים בודדים לתוך טיפות בודדות עם ברקוד המכיל חרוזים. טכנולוגיה זו מאפשרת ללכוד עד 10,000 תאים לפי תנאי דגימה.
שילוב טכנולוגיית organoids עם scRNAseq מאפשר לנו לחקור כיצד פתוגנים אנטריים משפיעים על מערכת העיכול באופן ספציפי לסוג התא. עם זאת, יש לקחת מספר שיקולים טכניים וביו-בטיחותיים. בראש ובראשונה, שיטות תרבות האורגנוידים הקלאסיים (אורגנוידים תלת-ממדיים), המוטמעים במטריצה חוץ-תאית (ECM)) חושפות את הצד הבסולטרי של תאי האפיתל לחלק החיצוני של האורגנויד. כמו פתוגנים אנטריים ליזום את הזיהום שלהם באמצעות בליעה של מזון / מים מזוהמים, הזיהום לרוב יוזם מהצד האפילי של התאים, אשר אינו נגיש אלה organoids מעיים 3D. לכן, organoids צריך להיות מוכן כדי להפוך את הצד apical נגיש עבור זיהום פתוגן או באמצעות זריעה 2D, ובכך לחשוף ישירות את הצד האפירי של התאים, או באמצעות microinjection22,23. שנית, כדי לבצע scRNAseq של דגימות ביולוגיות נגועות, חשוב לשקול את האופי הזיהומי שלהם. בעוד שיטות לתיקון תאים ולהפעלת פתוגנים לפני בידוד תא יחיד עבור RNAseq הבאים הוצעו, שיטות אלה מובילות לעתים קרובות לירידה באיכותהרצף 18. הפרוטוקול שלהלן יתאר מספר גישות להדבקת אורגנוידים במעיים בווירוסים אנטריים בהתחשב בצד הזיהום (זיהום apical לעומת basolateral) (איור 1). בנוסף, הפרוטוקול יכלול זרימת עבודה לניתוק ולבודד תאים בודדים מאורגנואידים נגועים בווירוסים פתוגניים מאוד עבור scRNAseq. הפרוטוקול ידגיש את השלבים העיקריים שיש ליישם בעת עבודה בתנאי בלימה ברמת בטיחות ביולוגית-3 (BSL-3) כדי למנוע ייצור אירוסולים וזיהום פוטנציאלי.
Protocol
רקמה אנושית התקבלה כריתה המעי הגס או ביופסיות אילום מבית החולים האוניברסיטאי היידלברג לפרוטוקול הבא. מחקר זה נערך בהמלצת בית החולים האוניברסיטאי היידלברג בהסכמה מדעת ובכתב מכל המקצועות בהתאם להצהרת הלסינקי. כל הדגימות התקבלו והתוחזקו בצורה אנונימית. הפרוטוקול אושר על ידי ועדת האתיקה של בית החולים האוניברסיטאי היידלברג על פי פרוטוקול S-443/2017.
1. תחזוקה ועברת אורגנוידים במעיים ובמעי הגס
זהירות: אורגנוידים במעיים אנושיים נגזרים מרקמה אנושית או מתאי גזע פלוריפוטנטים/עובריים, וככאלה נדרש אישור אתי. יש לציית לתקנות ספציפיות למדינה. חומר אנושי בדרך כלל לא נבדק ולכן נחשב לעתים קרובות חומר BSL-2. תנאי בלימה נאותים צריכים להיות מאושרים במדינה שבה הניסוי מתקיים.
- הכן אורגנוידים מעיים ומעשיית מרקמות מבודדות ו/או ביופסיות בשיטות שתוארו בעבר2. בנוסף, פרטים טכניים נוספים על איך להכין organoids מחומר שמקורו בחולה או מ- IPSCs ניתן למצוא Lees et al. ו מאהה ואח'24,25.
- לאחר תרבויות organoid הוקמו, בצע את שגרת הפיצול המתוארת להלן כדי להכין organoids לבצע זיהומים עם פתוגנים אנטריים.
- זרע 20-100 organoids ב 50 μL של 100% פתרון ECM ב 24-היטב לא רקמה תרבית מטופלים צלחות. הוסף 500 μL של מדיה צמיחה (טבלה 1) לבאר.
- שנה את המדיה כל יומיים על ידי הסרת 250 μL של המדיה הישנה והוספת 250 μL של מדיה צמיחה טרי לכל באר. מחממים את התקשורת לטמפרטורת החדר לפני שינוי התקשורת.
זהירות: מדיה קרה יהיה נוזלי פתרון ECM המכיל organoids. - מעבר האורגנוידים פעם בשבוע כאשר הפנים מתחיל להיות כהה בשל הצטברות של תאים מתים. דוגמה לכך ניתן למצוא באיור 2.
- ביום הפיצול, להסיר את פתרון ECM מ -20 °C (50 °F) ולהפשיר על קרח.
- מניחים את צלחת תרבית התא הריק החדש שישמש לזרע האורגנוידים לאחר פיצול ב 37 °C (זה דורש מינימום של 1 שעה כדי להיות חם יכול להיות מחומם לילה). לחמם את התקשורת התרבותית לטמפרטורת החדר.
- הסר את מדיית הצמיחה עם פיפטה P1000 ולהוסיף 500 μL של תמיסת מלח קר 1x פוספט חוצץ (PBS) לכל באר במשך 3 דקות כדי להמיס חלקית את פתרון ECM ולנתק מהצלחת.
- כדי להבטיח הפרעה מלאה של פתרון ECM, השתמש בצינור P1000 (מוגדר ב 450 μL). פיפטה למעלה ולמטה 10 פעמים כדי resuspend PBS, פתרון ECM, אורגנוידים, להעביר את organoids resuspended לתוך צינור חרוטי 15 מ"ל ולהניח אותם על קרח.
- לאסוף בארות מרובות של אותם organoids לתוך אותו צינור חרוט.
- אם אורגנוידים שונים מרובים (תורמים שונים, חלקים שונים, טיפול מקדים שונה וכו ') מפוצלים בו זמנית, אוספים אותם בצינורות חרוטיים שונים. תוך כדי איסוף, לשמור על צינורות חרוט על קרח.
- ספין את הדגימות ב 500 x g במשך 5 דקות ב 4 °C (70 °F). הסר בזהירות את PBS עם פיפטה כדי לשמור על גלולה organoid בתחתית.
- הימנע משימוש במערכת פסולת ואקום עם פיפטה מצוידת כמו גלולה של organoids הוא רופף מאוד יכול בקלות להיות שאיפה בעת הסרת PBS מהר מדי.
- הוסף 1 מ"ל של 0.05% טריפסין לצינור חרוטי ואורגנוידים resuspend על ידי צנרת למעלה ולמטה 10 פעמים עם פיפטה P1000. לדגור את הצינור החרוט המכיל organoids ב 37 °C (37 °F) במשך 3 דקות.
- הוסף 2 מ"ל של מדיה DMEM / F12 המכילה 10% סרום בקר עוברי (FBS) ו 1% פניצילין / סטרפטומיצין כדי לעצור את העיכול resuspend כדי לשבש את organoids על ידי צנרת למעלה ולמטה 10 פעמים עם פיפטה P1000.
- ספין את הדגימות ב 500 x g במשך 5 דקות ב 4 °C (70 °F). הסר צינורות חרוט מן הצנטריפוגה ולאחסן אותם על קרח.
- הסר בזהירות מדיה / טריפסין עם פיפטה חד פעמית 5 מ"ל כדי לשמור על גלולה organoid בתחתית. השאירו סביב 500 μL של מדיה ולהסיר את זה עם פיפטה P1000.
- לאחר מדיה / טריפסין הוסר מכל הצינורות חרוטיים, להסיר את 24-היטב לא תא תרבית מטופל צלחת מן החממה 37 °C ומניחים אותו מתחת למכסה המנוע תרבות התא.
- הוסף 100% פתרון ECM (נשמר על קרח) לצינור חרוט עם organoids פיצול ב 1:3 עד 1:5 יחס בהתאם להרגלי הצמיחה של organoids התורם בודדים. (לדוגמה, אם באר אחת המכילה 20-100 organoids ב 50 μL טיפה של פתרון ECM הועבר, resuspend הכדור organoid לתוך 150-250 μL של פתרון ECM קר כקרח.)
- זרע 50 μL של פתרון ECM / תערובת organoid לכל באר של 24-טוב לא תא תרבית מטופל צלחת מראש מחומם ל 37 °C (50 °F).
הערה: פתרון ECM יהיה פילמור מהר מאוד ברגע שהוא התחמם. שמור על פתרון ECM קר בכל עת (מאוחסן על קרח) במהלך השימוש. כאשר organoids כבר respended, לזרוע מיד על צלחת חדשה. למתחילים, מומלץ לאחסן קופסה של טיפים פיפטה ב -20 °C (70 °F) כדי לאפשר זמן נוסף עבור זריעה. - לדגור על צלחת 24-well ב 37 °C (55 °F) במשך 10-15 דקות כדי לאפשר פתרון ECM כדי פולימר.
- לאחר פילמור, להוסיף 500 μL של מדיה צמיחה (טבלה 1)26 לכל באר ולדגירה על organoids ב 37 °C (50 °F). בדוק את organoids מדי יום על ידי מיקרוסקופיה. שנה את המדיה כל יומיים כמו בשלב 1.4.
2. הכנת אורגנוידים בשני ממדים (2D) לזיהום אפיקלי
הערה: הפרוטוקול הבא יתאר כיצד לזרוע organoids מעיים כמו monolayer של תאים בצלחת תרבית התא להדביק תאי אפיתל מעיים מהצד האפיקלי שלהם. השתמש בצלחת 48 באר לניסויי הרצף ובמגלשת התאים התחתונה של 8 בארות כדי לשלוט בזיהום באמצעות גישות אימונופלואורסצנטיות.
- לגדל ולתחזק organoids כמתואר בסעיף 1.
- לפני זריעת אורגנוידים ב 2D, לצפות את לוחות 48 באר שקופית תא 8-באר זכוכית תחתון עם 200 μL של 2.5% קולגן אנושי במים לבאר עבור 1 שעה ב 37 °C (50 °F).
הערה: אורגנוידים במעיים הם הזרעים הטובים ביותר בצלחות 48-well ובמגלשה תא זכוכית 8-טוב. הניסיון הראה שהם לא מדביקים היטב בצלחות 96- well. תוספות Transwell יכול לשמש גם כדי לאפשר זיהום apical ו basolateral ב 2D. אם נעשה שימוש בטרנסוולים, יש לעקוב אחר ההתנגדות החשמלית הטרנס-אפיתל (TEER) לפני ההדבקה כדי לאשר מונו-שכבתית. בדרך כלל, organoids מעיים יש מחסום הדוק עם TEER של 450-600 אוהם / ס"מ2. - זרע 100-150 organoids בכל באר של צלחת 48-well או עבור באר אחת של שקופית תא זכוכית 8-טוב.
- כדי להעריך את מספר organoids, לספור את מספר organoids הנוכחי 50 μL של טיפת פתרון ECM של צלחת 24-well מוכן בסעיף 1. בממוצע, 1-2 בארות נדרשים, אשר ייתן כ 15,000-30,000 תאים.
- כדי לשבש את פתרון ECM ו trypsinize organoids, בצע את השלבים 1.8-1.17.
- הסר קולגן אנושי מהצלחות של 48 בארות ומגלשת התאים עם 8 הבאר מזכוכית.
- Resuspend גלולה organoid בצינור חרוט ב 250 μL של מדיה צמיחה / טוב ולהוסיף את התערובת לבארות מצופות קולגן. מניחים את הצלחת באינקובטור של 37 מעלות צלזיוס.
הערה: בעת ביצוע הניסויים, תנאים מרובים משווים (מדומה לעומת נגוע +/- טיפול עניין). כדי למזער את השונות בין כל באר של organoids זרעים 2D, לאסוף את המספר הכולל של organoids הדרוש באותו צינור חרוט. איסוף organoids של עד 12 בארות של צלחת 24-well יכול להשתמש 1 מ"ל של טריפסין ו 2 מ"ל של מדיה מנטרלת. בעת שימוש 12-24 בארות, להגדיל את זה ל 2 מ"ל של טריפסין ו 4 מ"ל של נטרול מדיה. - לאחר 48 שעות, להסיר את הצלחת מן האינקובטור ומניחים אותו במכסה המנוע תרבות התא. הסר את מדיית הצמיחה והחלף אותה ב- 250 μL לבאר של מדיית בידול (טבלה 1). חזור על שינוי מדיה זה 48 שעות מאוחר יותר.
- לאחר 48 שעות, אשר הבחנה (ארבעה ימים לאחר המעבר למדיית בידול) על-ידי חילוץ RNA, יצירת cDNA עם 250 ננוגרם של RNA, וביצוע qPCR מבוסס ירוק SYBR באמצעות פריימרים לתאי גזע (OLFM4 ו/ או SMOC2), תאי גביע (MUC2), תאים אנתרואנדוקריניים (CHGA) ואנטוציטים (SI ו/ או CYP3A4) (איור 3).
הערה: בעת המעבר ממדיית צמיחה למדיית בידול, organoids יקטין את הביטוי שלהם של סמני תאי גזע (OLFM4 ו/או SMOC2) ולהגדיל את הביטוי של תאי גביע (MUC2), תאים enteroendocrine (CHGA), ו enterocytes (SI ו / או CYP3A4) סמנים על ידי qPCR. הכן באר נוספת וחזק עם מדיית צמיחה כדי להשוות את רמת הביטוי של כל סמן ספציפי לסוג תא בצמיחה לעומת מדיית בידול. - עם אישור ההבחנה, organoids מוכנים לזיהום אפיקלי. העבר את organoids לרמת הבטיחות הביולוגית בלימה הנדרשת עבור הפתוגן של בחירה.
אזהרה: עיין בתקנות המקומיות של המכון ובהליכי ההפעלה הסטנדרטיים בעת טיפול בפתוגנים תחת בלימת BSL-2 או BSL-3. - כדי להדביק את האורגנוידים במעיים הגדלים בדו-ממדי מהצד האפילי שלהם, הסר מדיה עם פיפטה P1000 והוסף פתוגן מדולל בריבוי הזיהום הנדרש לניסוי במדיה בידול (נפח מינימלי של תערובת פתוגן / מדיה הוא 50 μL לבאר והנפח המרבי הוא 250 μL לבאר).
- אפשר לזיהום להמשיך במשך 2 שעות ב 37 °C (57 °F) עם שולחן רוקר הממוקם בחממת תרבית התא או על ידי נדנדה ידנית את הצלחת כל 15-20 דקות. מטב את הזמן הזה בהתבסס על הפתוגן של בחירה.
- לאחר 2 שעות, להסיר את המדיה עם פיפטה P1000 ולהחליף אותו עם 250 μL לכל באר של מדיה בידול טרי. דגירה תאים ב 37 °C (5 °F) עד לנקודת הזמן של רצף תא יחיד.
- כדי להכין תאים לרצף של תא בודד, המשך לסעיף 4.
3. הכנת אורגנוידים בשלושה ממדים (3D) לזיהום אפי ובסולטרי
- לגדל organoids כמתואר בסעיף 1 ב 24 היטב, לא תא תרבית מטופלת צלחת.
- יומיים לאחר ההעברה, הסירו את הצלחת מהאינקובטור והכניסו למכסה המנוע של תרבית התא.
- הסר את מדיה הצמיחה עם פיפטה P1000, להחליף אותו עם 500 μL / באר של מדיה בידול מראש מחומם לטמפרטורת החדר ומניחים את הצלחת בחממה 37 °C.
- לאחר 48 שעות, להחליף עם מדיית בידול טרי (500 μL / טוב).
הערה: Organoids נשמרים בתקשורת בידול במשך סך של 4 ימים לפני ההדבקה. - אשר הבחנה כמתואר בשלב 2.9.
- לאחר אישור כי הבחנה התרחשה, organoids מוכנים לזיהום.
- להפשיר ECM על קרח. מחממים את מדיית הבידול לטמפרטורת החדר ומחממים צלחת של 24 מעלות צלזיוס.
- כדי לבצע זיהומים, להסיר את organoids מפתרון ECM.
הערה: הסר פתרון ECM ככל האפשר כמו וירוסים מעדיפים לדבוק פתרון ECM ולא תאים. אם יש יותר מדי פתרון ECM שנותר סביב organoids, אז הדבקה תיפגע קשות. - לשבש את ECM על ידי הוספת 500 μL של PBS 1x קר ודגרה במשך 3 דקות. השתמש P1000 כדי pipette למעלה ולמטה 10x. שלבו אורגנוידים בצינור וצנטריפוגה ב-500 x גרם למשך 5 דקות. הסר PBS עם P1000.
הערה: כדי למזער את השונות בין כל מצב זיהום, לשלב את organoids מגיע מכמה בארות של צלחת 24-well לתוך אותו צינור חרוט. לדוגמה, אם נדרשים שמונה תנאים לזיהום, שמונה בארות של צלחת 24 באר (המכילה ~ 100 organoids כל אחד) ישולבו ולאחר מכן יחולקו לשמונה בארות של צלחת חדשה 24-well לאחר הפרעה מחט (ראה שלב 3.12). - resuspend organoids ב 1 מ"ל של מדיה בידול. לזיהום apical ו basolateral בצע את שלב 3.10.1 ועל זיהום בזולטריאלי רק בצע את שלב 3.10.2.
- חבר מחט 27 G למזרק 1 מ"ל ו resuspend הכדור שש פעמים כדי לאפשר הפרעה של organoids ועל זיהום להתרחש הן בצד apical ו basolateral. המשך לשלב 3.11.
הערה: האורגנוידים צריכים להיות האורגנוידים הקלאסיים למראה ציסטה ואורגנואידים עם ניצני תמנון עם מרכז כהה כאשר נצפו לפני הפרעה במחט. בעקבות ההפרעה, organoids אלה ייראו קטנים יותר עם פחות עד ללא פנים כהה. בעת ביצוע זיהום, תמיד יהיו מינימום של שני תנאים (מדומה וזיהום), מינימום של שתי בארות של צלחת 24-well יהיה משולב בתחילה לתוך צינור חרוט 15 מ"ל עבור הפרעה מבוססת מחט (להסביר מדוע מינימום של 1 מ"ל משמש resuspension). בעת ביצוע יותר משני תנאים, לשלב עד 10 בארות של צלחת 24-well בצינור חרוט יחיד 15 מ"ל resuspend ב 1 מ"ל של מדיה בידול עבור הפרעה מחט. לאחר ההפרעה, להוסיף 500 μL של מדיה בידול לכל n + 1 (לדוגמה, אם באמצעות 10 בארות, ולאחר מכן למעלה עם 4.5 מ"ל יש 5.5 מ"ל בסך הכל). אם יש צורך ביותר מ -10 תנאים, השתמש במספר צינורות חרוט. מזרק 1 מ"ל מומלץ כמו organoids הם שיבשו טוב יותר עם נפח זה של המזרק. חלופה למזרק היא להשתמש בטיפ P1000 שטוח היטב. - resuspend organoids ב 500 μL של מדיה בידול לבאר. היזהר לא לשבש את organoids ולוודא כי הצד apical אינו נגיש. המשך לשלב 3.11.
- חבר מחט 27 G למזרק 1 מ"ל ו resuspend הכדור שש פעמים כדי לאפשר הפרעה של organoids ועל זיהום להתרחש הן בצד apical ו basolateral. המשך לשלב 3.11.
- העבר 500 μL של השעיות organoid לבאר ללוח תרבית תאים 24-well באמצעות פיפטה P1000 ולהעביר את הצלחת לרמת הבטיחות הביולוגית בלימה הנדרשת עבור הפתוגן של בחירה.
אזהרה: עיין בתקנות המקומיות ובהליכי ההפעלה הסטנדרטיים של המכון בעת טיפול בפתוגנים תחת בלימת BSL-2 או BSL-3. תמיד לבצע את הפרעת המחט של organoids מחוץ BSL-3 כדי למנוע תאונות פוטנציאליות עם המחט. תקנות מקומיות עשויות גם למנוע את השימוש במחטים ב- BSL-3. - הוסף את הפתוגן מדולל למדיה בידול כדי להגיע לריבוי הזיהום הנדרש לניסוי. אין לחרוג מנפח כולל של 500 μL (יש 1 מ"ל סה"כ בלוח 24-well).
- אפשר לזיהום להמשיך במשך 2 שעות (הפעם יהיה צורך להתאים את הפתוגן של בחירה) ב 37 °C עם שולחן רוקר הממוקם בחממת תרבית התא או על ידי נדנדה ידנית את הצלחת כל 15-20 דקות.
- לאחר הדגירה 2 שעות, לאסוף את organoids לתוך צינור אחד 1.5 מ"ל לכל תנאי ולהסתובב ב 500 x g במשך 5 דקות ב 4 °C (70 °F).
- הסר את המדיה המכילה פתוגן עם פיפטה P1000 ולאחסן אותו על קרח. לשטוף את כדורי organoids פעם אחת עם PBS.
- Resuspend organoids ב 50 μL של פתרון 100% ECM (אשר הופשר בעבר על קרח), צלחת לתוך צלחת 24-טוב לא תאים מטופלים מראש 37 °C (37 °C) ולדגירה צלחת 24-well ב 37 °C (10-15 דקות כדי לאפשר פתרון ECM כדי פולימר.
- לאחר פילמור, להוסיף 500 μL של מדיה בידול בטמפרטורת החדר לכל באר לדגור ב 37 °C (57 °F) עד קציר עבור רצף תא יחיד.
הערה: אם הקציר צריך להתרחש יותר מ 48 שעות לאחר זריעה, לשנות את המדיה כל 2 ימים על ידי הסרת המדיה הישנה והחלפתה עם 500 μL של מדיה בידול טרי. עם זאת, הניסיון הראה כי מאז organoids גדלים תחת מדיה בידול, הם לא ישרדו הרבה יותר מ 48 שעות.
4. הכנת פתרון תא יחיד והכנת חרוזים-in-emulsion ג'ל (GEMs) במצבים של בטיחות ביולוגית 3 (BSL-3)
הערה: השלמת השלבים הבאים דורשת כי ציוד הריצוף של תא יחיד (טבלת החומרים) ומכונת PCR המסוגלת לטפל בתגובות 100 μL נמצאים בתוך מתקן BSL-3. Organoids גדלים כמתואר בסעיף 1 נגועים כמתואר בסעיפים 2-3 בהתאם לפתוגן ולנתיב הכניסה. בזמן שנקבע מראש לאחר ההדבקה, אורגנוידים נקצרים. מתחת לשיטה המשמשת לקצור organoids מעיים מתואר.
- לפני קצירת אורגנוידים נגועים, להסיר את חרוזי ג'ל תא יחיד(שולחן החומרים)מ -80 °C (50 °F) וחם לטמפרטורת החדר (לפחות 30 דקות לפני).
- בנוסף, ישיחל ריאגנט RT, הפחתת סוכן B ואנזים RT C (כולם מאוחסנים ב -20 °C)-C) לטמפרטורת החדר. תגדיל מחדש את מתג התבנית אוליגו כמתואר בהוראות היצרן.
הערה: כל השלבים הבאים צריכים להתבצע ביחס לתקנות הבטיחות הביולוגית המקומיות בעקבות נוהל ההפעלה הסטנדרטי שנקבע עבור הפתוגן הנחשב. ככלל אצבע לעבודה BSL-3, יש להבטיח כי החלק החיצוני של כל כלי הדם (צלחות, צינורות, וכו ') יציאה מכסה המנוע תרבית התאים מחוטאים כראוי. כנ"ל לגבי הידיים / הכפפות של האדם המבצע את הניסויים. - כדי לבצע זיהומים על organoids זרעים 2D (סעיף 2) להמשיך לשלב 4.4. כדי לבצע זיהומים על organoids 3D (סעיף 3) להמשיך לסעיפים 4.5.
- עבור זיהומים של organoids 2D, להביא את צלחת תרבית התא לתוך מכסה המנוע ולהסיר את מדיה בידול עם פיפטה P1000.
- הוסיפו 250 μL של 1x PBS בטמפרטורת החדר לכל באר.
- הסר PBS עם פיפטה P1000 ולהוסיף 250 μL של אנזים דיסוציאציה טמפרטורת החדר (למשל, טריפל אקספרס) לכל באר של צלחת 48 טוב. החליפו כפפות, נקו את הצלחת ומניחים את הצלחת עם אנזים הדיסוציאציה באינקובטור 37 מעלות צלזיוס.
- שימו לב לניתוק התא על ידי מיקרוסקופיה כל 5 דקות.
הערה: בערך, זה לוקח 15 דקות כדי לנתק אורגנוידים מעיים בתרבית 2D לתאים בודדים. הפעם יהיה צורך להתאים כפי שהוא יהיה תלוי כמה organoids היו בתחילה זרעו נגועים, כמו גם על הפתוגן כמו כמה פתוגנים הם ציטופתיים יותר ולגרום organoids להתנתק הרבה יותר מהר מאחרים. - לאחר אישור של השעיית תא יחיד לכאורה, להחזיר את הצלחת לתוך מכסה המנוע תרבית התא ולעצור את העיכול על ידי הוספת 250 μL של מדיה DMEM / F12 המכיל 10% FBS לכל באר של צלחת 48-well.
- לאסוף את התאים לתוך צינור חרוטי 15 מ"ל באמצעות פיפטה P1000.
- החלף כפפות, לנקות את הצינור, ולסובב את הדגימות ב 500 x g במשך 5 דקות ב 4 °C (70 °F).
- הסר בזהירות את האנזים מדיה/דיסוציאציה עם P1000 כדי לשמור על גלולה התא בתחתית. resuspend תאים בודדים בנפח מינימלי של PBS המכיל 0.1% BSA. עבור organoids מעיים, resuspend ב 250 μL עבור כל באר של צלחת 48-well.
- להעביר את מתלים התא לתוך צינור FACS עם מסנן כדי להסיר כל גושים גדולים ומניחים את צינור FACS המכיל תאים על קרח.
- המשך לשלב 4.6 כדי להמשיך עם ספירת תאים והכנת תערובת האב.
- עבור זיהומים של organoids 3D, להסיר את הצלחת מן האינקובטור ומניחים אותו במכסה המנוע תרבות התא.
- הסר את מדיית הבידול מכל באר של צלחת 24-well עם פיפטה P1000. הוסיפו 500 מיקרו-אל של PBS 1x קר כקרח לכל באר ודגרו במשך 3 דקות על קרח.
- כדי להבטיח הפרעה מלאה של פתרון ECM, השתמש בצינור P1000 (מוגדר ל- 450 μL). פיפטה למעלה ולמטה 10 פעמים כדי resuspend PBS, פתרון ECM ואורגנוידים; מעבירים את האורגנוידים המחודשים לצינור חרוט של 15 מ"ל ומניחים על קרח. לאסוף כל מצב זיהום בצינור חרוט 15 מ"ל משלו.
הערה: שימוש בצינור חרוטי 15 מ"ל נותן כדור תא טוב יותר, מובחן יותר מאשר צינור חרוטי 50 מ"ל או צינור 1.5 מ"ל. - החליפו כפפות והסירו את הצינור ממכסה המנוע של תרבית התאים. נקה את החלק החיצוני של הצינור.
- ספין את הדגימות ב 500 x g במשך 5 דקות ב 4 °C (70 °F).
- הזז את הצינור בחזרה לתוך מכסה המנוע תרבית התא ולהסיר PBS עם פיפטה P1000 כדי למנוע שימוש חוזר גלולה organoids מתחתית הצינור.
- resuspend הכדור ב 1 מ"ל של אנזים דיסוציאציה (למשל, טריפל אקספרס). החליפו כפפות, נקו את הצינור ודגרו את הדגימות ב-37 מעלות צלזיוס.
- כל 10 דקות במשך 30 דקות, להזיז את הצינור בחזרה במכסה המנוע תרבות התא ו respend organoids על ידי צנרת למעלה ולמטה עם פיפטה P1000 10 פעמים.
הערה: בדרך כלל, organoids מעיים דורשים סביב 30 דקות כדי ליצור השעיה תא יחיד כאשר נגוע בתלת-ממד. - כדי לקבוע מתי organoids מנותקים לתאים בודדים, לקחת 10 μL של השעיית organoid באמצעות פיפטה p10.
- מניחים את המתלים במגלשה חד פעמית של תאי פלסטיק. חותם את יציאת הקלט לדוגמה עם סרט ברור.
- תחליף כפפות ותנקה את החלק החיצוני של הדלפק. השתמש במיקרוסקופ Brightfield כדי לקבוע אם מתבצעת השעיית תא בודד.
- לאחר אישור של השעיית תא יחיד, להפסיק את העיכול על ידי הוספת 1 מ"ל של מדיה DMEM / F12 המכיל 10% FBS ו pipette למעלה ולמטה 10 פעמים עם פיפטה P1000.
- החלף כפפות, לנקות את הצינור, ולסובב את הדגימות ב 500 x g במשך 5 דקות ב 4 °C (70 °F).
- הסר בזהירות את האנזים מדיה / דיסוציאציה עם פיפטה P1000 כדי למנוע שימוש חוזר את גלולה התא מתחתית הצינור.
- תגדיל מחדש את התאים הבודדים בנפח מינימלי של PBS המכיל 0.1% BSA. עבור organoids מעיים resuspend ב 250 μL.
- להעביר את מתלים התא לתוך צינור FACS עם מסנן כדי להסיר כל גושים גדולים ולהניח את צינור FACS המכיל תאים על קרח.
- המשך לשלב 4.6 כדי להמשיך עם ספירת תאים והכנת תערובת האב.
- קבע את מספר התאים לכל μL על-ידי הוספת 10 μL של השעיית התא לתא ספירת תאי פלסטיק חד פעמי.
- חתמו את יציאת הקלט לדוגמה עם סרט ברור לפני הסרת המדגם ממכסה המנוע של תרבית התא, שכן בשלב זה, ההשעיה של התא עדיין מדבקת.
- החלף כפפות, נקה את תא ספירת התאים, וספור את מספר התא באמצעות מיקרוסקופ ברייטפילד.
- בתוך מכסה המנוע תרבית התא, להכין תערובת מאסטר של RT ריאגנט, תבנית מתג אוליגו, הפחתת סוכן B, ו RT אנזים C בצינור 1.5 מ"ל בהתאם להוראות היצרן בהתאם למספר הדגימות בניסוי. עבור כל מדגם, aliquot 33.4 μL של אמן לערבב לתוך צינור PCR ולאחסן על קרח.
- הוסף את התאים והמים לתערובת הראשית בהתאם למספר תא היעד כמתואר בהוראות היצרן.
הערה: 50%-60% מהתאים נמצאים בדרך כלל (כלומר, בעת טעינת 10,000 תאים על השבב, 5,000-6,000 תאים משמשים לניתוח). לכן, תמיד לטעון 10,000 תאים. אם צפיפות התא אינה מאפשרת זאת, צנטריפוגה התאים resuspend בנפח נמוך יותר. יש להחריד לא להעמיס על השבב כמו זה יגרום סתימה של השבב. בנוסף, אם תאים אינם מנותקים כראוי, יהיה סיכון מוגבר לקבל תאים מרובים לכל חרוז, אשר יהיה צורך להסיר בעיבוד ביו-אינפורמטיקה במורד הזרם. - החליפו את הכפפות, הזיזו את בקר התא הבודד למכסה המנוע של תרבית התאים והכנו את השבב מכיוון שהשבב מכוסה רק אטם שאינו אטום.
הערה: המכונה צריכה להיות בתוך מכסה המנוע כדי למנוע חשיפה להשעי תאים נגועים ותרסיסים פוטנציאליים. - הוסף את השבב של תא בודד למחזיק השבב ומלא את הנתיבים שאינם בשימוש בגליצריל 50%.
- הוסף את התערובת הראשית, החרוזים ושמן החלוקה לנתיבים המשמשים לדגימות בהתאם להוראות היצרן.
- לכסות את השבב עם האטם, לטעון את השבב לתוך הבקר, ולהתחיל את התוכנית.
הערה: מומלץ לטעון רק שישה מתוך שמונת הנתיבים. בעיות עם אמולסיות לא נאותות מתרחשות לעתים קרובות בנתיבים 1 ו -8. החברה אומרת כי כל הנתיבים הם עצמאיים, וזה לא צריך לקרות; עם זאת, במידת האפשר, הימנע משני נתיבים אלה ולהפעיל שני שבבים אם שמונה דגימות נדרשות. - עם השלמת התוכנית, להסיר את השבב ואת האטם.
- השתמש pipette רב ערוצי ולהעביר 100 μL של אמולסיות לצינור PCR נקי. ודא שלכל באר יש צבע לבן אחיד המציין שאירע אמולסיה מלאה.
- החלף כפפות, נקה את הצינורות והעבר את צינור ה- PCR למכונת PCR שיכולה לתמוך בתגובות 100 μL. הפעל את התוכנית: 53 °C (53 °F) למשך 45 דקות; 85 °C (5 דקות) ל-5 דקות.
- בסיום, לאחסן את הדגימות ב 4 °C (5 °F). בשלב זה, לעבד את התגובה על פי הוראות היצרן או לאחסן ב 4 °C (50 °F) במשך 3 ימים או -20 °C (70 °F) במשך שבוע אחד.
- לאחר 5 דקות ב 85 °C (85 °F), רוב הווירוסים עטופים יהיה מומת, להסיר את cDNA מן BSL-3 על פי הליך ההפעלה הרגיל ולבצע את ההכנות הספרייה במעבדה BSL-1.
הערה: ניסוי זה צריך להתבצע כשלושה העתקים ביולוגיים (למשל, בשלושה ימים שונים) מכיוון שהיקף ההבחנה של כל סוג תא יכול להשתנות מעט בין כל ניסוי. ספריות הרצף המתקבלות יכולות להיות בעלות אינדקס שונה ולרצף יחד בריצת רצף אחת.
תוצאות
הכנת organoids לרצף של תא בודד
תוצאות רצף של תא בודד תלויות מאוד בשימוש בתאים באיכות טובה. כדי להבטיח שאורגנואידים באיכות טובה, יש לתחזק אותו כראוי ונצפו על בסיס יומי כדי לקבוע מתי הם מוכנים לפיצול (איור 2). התזמון של פיצול האורגנוידים תלוי בתורם; חלק מהתורמים גדלים מהר יותר וצריכים להתחלק כל 5 ימים, בעוד שאחרים איטיים יותר וצריכים להתחלק כל 10 ימים. בממוצע, האורגנוידים מתחלקים פעם אחת בשבוע כשהמרכזים נעשים כהים(איור 2B). אם אורגנוידים מורשים להיות גדולים מדי ולצבור יותר מדי תאים מתים במרכז, האורגנויד ימות.
Organoids נשמרים במדיה המכילה כמויות גבוהות של Wnt3A. זה תומך בנישה של תאי גזע ומקדם את האורגנוידים להמשיך לגדול ולהתרבות. בתנאי גדילה אלה, האורגנוידים מכילים כמויות גבוהות של תאי גזע ותאים מגבירי מעבר וכמות נמוכה יותר של אוכלוסיות תאים מובחנות כגון enterocytes בוגרים, תאי גבל ותאים אנתרואנדוקריניים. עם זאת, כדי לחקות את המורכבות התאית שנמצאת בתוך המעי האנושי, חשוב לדחוף את בידול התא ולייצר יותר תאים אלה. זה מושג על ידי שינוי תנאי המדיה והסרת Wnt3A, והפחתת R-ספונדין ו Noggin(טבלה 1). בדרך כלל, הבחנה תאית כלפי אנטריציטים, תאי גופע ותאי אנטרונדוקריני דורשת 4 ימים של מדיית בידול(איור 3). זה המפתח כדי להשיג בידול טוב; אחרת, הערכת טרופיזם פתוגן ותגובות ספציפיות לסוג התא יהיה קשה.
אישור של BSL-3 אי-שבוית פתוגן
אי-הפעלה מלאה חייבת להיות מאושרת עם הפתוגן של בחירה ומאותמת כי זה בטוח להסיר את cDNA מן BSL-3. עבור SARS-CoV-2, חוסר הפעילות המלאה של הנגיף אומת על ידי לקיחת 100 μL של SARS-CoV-2 ודגורתו במכונת PCR במשך 5 דקות ב 85 °C (85 °F). לאחר מכן נוספה הנגיף בחזרה לתאי Vero נאיביים, והדבקה בנגיף הושוותה לנגיף שאינו מטופל בחום על ידי אימונופלואורסצנטיות ובבדיקות פלאק במהירות של 24 שעות, 48 שעות ו-72 שעות לאחר ההדבקה כדי להבטיח שכל החלקיקים כבר לא מדבקים. תוצאות אלה נשלחו לסוכנות הרגולציה המקומית, ועם אישורן בוצע הניסוי בעל התא הבודד ועיבוד cDNA.
תוצאות רצף של תא בודד
כדי להעריך כיצד SARS-CoV-2 מדביק את המעי הגס האנושי ואת organoids ileum, רצף תא יחיד בוצע. Organoids הוכנו כמתואר לעיל נגועים בפורמט 2D כדי לאפשר זיהום apical על ידי SARS-CoV-2. תאים נגועים נקצרו בשעה 12 שעות ו 24 שעות לאחר זיהום והם עובדו עבור רצף תא יחיד כמתואר לעיל. ניתוח נתוני הרצף של התא הבודד אפשר לנו לקבוע שרק תת-אכלוס (enterocyte לא בוגר 2) של תאי אפיתל מעיים אנושיים תמך בזיהום של SARS-CoV-2 (איור 4). בנוסף, מאחר שלא כל התאים באוכלוסייה נדבקו, הן תאים נגועים והן תאים לא נגועים של עוברי אורח נותחו(איור 5). תוצאות אלה הראו כי SARS-CoV-2 גרם מפל אות פרו דלקתי בתאים נגועים בעוד תאים עוברי אורח שאינם נגועים הראו תגובה חיסונית בתיווך אינטרפרון. בנוסף, scRNA-Seq הראה כי תאים נגועים לא הצליחו לחוש אינטרפרונים בשל חסימה בתיווך וירוס של המסלול (איור 5). לא ניתן היה להשיג מידע זה בעת שימוש ברצף RNA בצובר.

איור 1: שרטוט המתאר את שלוש השיטות השונות להכנת אורגנוידים במעיים אנושיים לזיהום בפתוגנים אנטריים. זיהום אפיקלי ניתן להשיג באמצעות זריעת organoids מעיים 2D. זיהום apical ו basolateral יכול להתבצע על ידי שיבוש האורגנויד 3D. לבסוף, זיהום בזולטריאל בלבד יכול להתבצע על ידי הדבקת אורגנוידים מעיים תלת-ממדיים שלמים. ניתן להשתמש בכל אחת משיטות אלה כדי ליצור דוגמאות עבור רצף תאים בודדים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
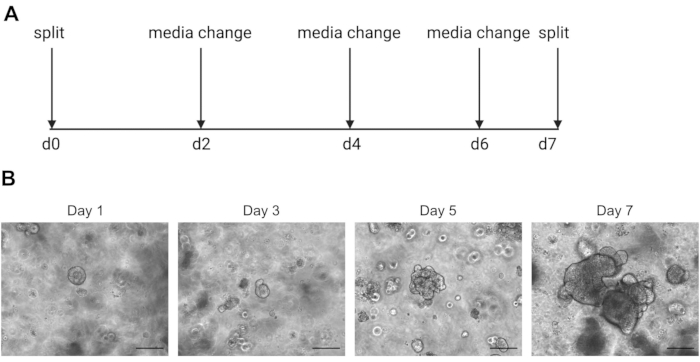
איור 2: תמונות סכמטיות ותחזוקה של אורגנויד ותמונות ברייטפילד מייצגות. (א)סכמטי לתחזוקה והעברת אורגנוידים במעיים אנושיים. (ב.תמונות ברייטפילד מייצגות של ימים 1, 3, 5 ו- 7 לאחר הפיצול. ביום 7 האורגנוידים הופכים גדולים וחשוכים בשל הצטברות של תאים מתים ומוכנים לפצל. סרגל קנה המידה מציין 25 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
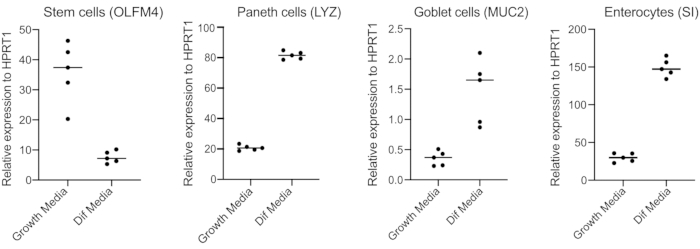
איור 3: qPCR מייצג של אורגנוידים במעיים אנושיים 4 ימים לאחר המעבר למדיית בידול. אורגנוידים מעיים נשמרו במדיה צמיחה או עבר מדיה בידול במשך 4 ימים. RNA נקצר ו- qPCR בוצע עבור סמנים של תאי גזע (OLFM4), תאי פאנית '(LYZ), תאי גביע (MUC2) ואנטרוציטים (SI). N = 5. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
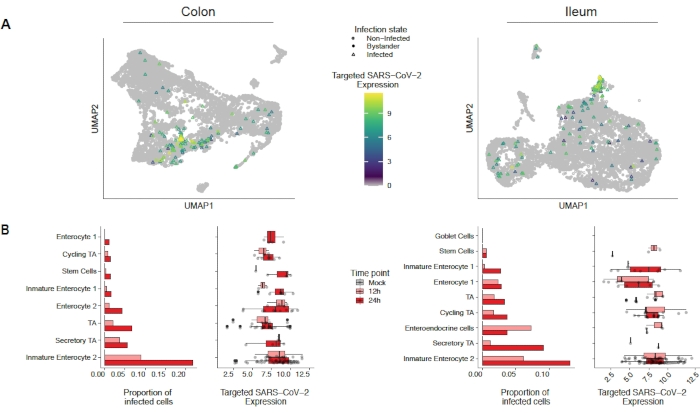
איור 4: זיהוי אוכלוסיית התאים שנדבקו בסארס-CoV-2. המעי הגס האנושי ואיליום נגזר אורגנוידים נדבקו SARS-CoV-2. לאחר 12 ו 24 שעות תאים לאחר זיהום נקצרו ונחשפו רצף RNA חד תא כדי לזהות אילו אוכלוסיות תאים תמכו בזיהום SARS-CoV-2. זיהום וירוס נמצא להגדיל עם הזמן בעיקר להדביק enterocyte לא בוגר 2. נתון זה שונה מטריאנה ואח '19. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
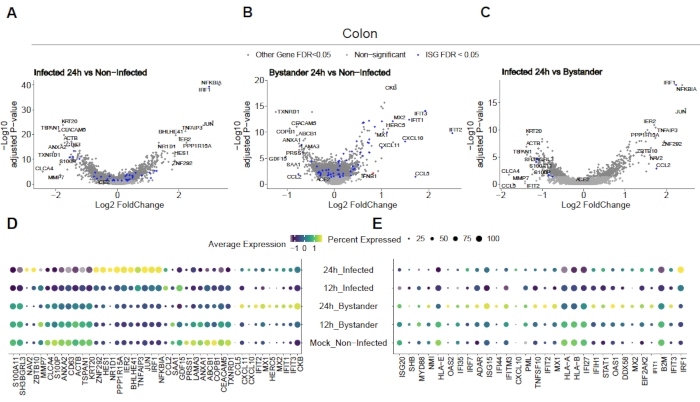
איור 5: קביעת תגובה חיסונית מולדת מהותית. אורגנוידים שמקורם במעי הגס האנושי נדבקו בסארס-CoV-2. לאחר 12 ו 24 שעות תאים לאחר זיהום נקצרו ונחשפו רצף RNA תא יחיד כדי לקבוע את התגובה החיסונית המולדת המהותית הן בתאים נגועים ויראלית ולא נגועים עוברי אורח. תאים נגועים SARS-CoV-2 הציגו תגובה פרו דלקתית חזקה בעוד שתאים לא נגועים של עוברי אורח הציגו תגובה בתיווך אינטרפרון. איור שונה מטריאנה ואח'19. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| מדיה לצמיחה | |
| תרכובת | ריכוז סופי |
| Ad DMEM/F12 | גלוטמקס (פי 1) |
| +גלוטמקס | HEPES 1 מ"מ |
| +HEPES | עט 10 U/mL |
| +P/S | סטרפטופט 10 מיקרוגרם/מ"ל |
| L-WRN | 50% לפי נפח |
| B27 | 01:50 |
| N-אצטיל-ציסטאין | 1 מ"מ |
| EGF | 50 ננוגרם/מ"ל |
| A83-01 | 500 ננומטר |
| IGF-1 | 100 ננוגרם/מ"ל |
| FGF בסיסי | 50 ננוגרם/מ"ל |
| גסטרין | 10 מ"ר |
| מדיית בידול | |
| תרכובת | ריכוז סופי |
| Ad DMEM/F12 | גלוטמקס (1x) |
| +גלוטמקס | HEPES 1 מ"מ |
| +HEPES | עט 10 U/mL |
| +P/S | סטרפטופט 10 מיקרוגרם/מ"ל |
| B27 | 01:50 |
| N-אצטיל-ציסטאין | 1 מ"מ |
| R-ספונדין | 5% לפי נפח |
| נוגין | 50 ננוגרם/מ"ל |
| EGF | 50 ננוגרם/מ"ל |
| גסטרין | 10 מ"ר |
| A83-01 | 500 ננומטר |
טבלה 1: הרכב מדיה למדיית צמיחה ובידול.
Discussion
פתוגנים אנטריים לרוב ליזום מחזור החיים שלהם על ידי הדבקת תאי אפיתל מעיים מהצד האפיקלי שלהם מול לומן של המעיים. בעוד organoids מוכרים היטב להיות מודל טוב כדי לשחזר את המורכבות התאית ואת הארגון של אפיתל המעי, הארגון שלהם כמו מבנים תלת ממדיים, סגור להפוך את הממברנה האפית שלהם נגיש לפתוגן. פרוטוקול זה תיאר שיטות להדבקת organoids מעיים מהצד האפילי שלהם, הצד הבסולטרי שלהם, או שניהם עם פתוגנים BLS-3. פרוטוקולים אלה יכולים להיות מותאמים בקלות כדי ללמוד כל פתוגן אנטרי תחת בלימת BSL-2 או BLS-3 או כל מודל organoid אחר על ידי ביצוע כמה צעדים קריטיים המודגשים להלן. השיטה המתוארת לעיל היא לבידוד והכנת טיפות חד-תאיות בהתאם לתקנות בגרמניה. כתב ויתור, פרוטוקול זה אינו מתאר את אמצעי הטיפול בבטיחות ביולוגית (הליכי הפעלה סטנדרטיים) שיש לנקוט בעת עבודה בתנאי BSL-3. כמו כן, חשוב לעמוד על כך שהתקנות עשויות להשתנות במדינות אחרות וכי יש לפנות לרשויות המקומיות כדי לוודא שכל התקנות המקומיות יכובדו.
אחד הצעדים הקריטיים בזריעת אורגנוידים בשני ממדים לזיהום אפיקלי הוא שליטה כי תאים יבדילו באופן דומה לעומת כאשר גדל כמו organoids תלת ממדי קלאסי. בהתאם לפתוגן המעית, טרופיזם יכול להיות מוגבל לתאים נדירים מאוד או לתאים שצריכים להיות מובחנים מאוד. במקרה זה, באמצעות organoid דו מימדי שלא הבדיל לחלוטין עלול לגרום לתקלה שגויה כי פתוגן אנטרי זה לא יכול להדביק organoids מעיים. מומלץ, אם אפשר, לבצע זיהומים באמצעות שלוש התצורות של פרוטוקול זה: אורגנויד 2D לזיהום apical בלבד (סעיף 2), סדוק פתוח 3D organoids עבור זיהום apical ו basolateral (סעיף 3), ואורגנוידים 3D מלא עבור זיהום בזולטר בלבד (סעיף 3). גישה זו תסייע להבחין בנתיב הכניסה של הפתוגן (apical לעומת basolateral) וגם תשלוט כי רמה דומה של בידול הושגה. חלופה לזיהום אפיקלי 2D היא microinjection, אשר ישתמש אורגנויד 3D אבל לספק את הפתוגן ישירות לתוך הצד apical (ראה Bartfeld ואח'27 לפרטים). שיטה זו דורשת מזרק מיומן כדי להבטיח כי הפתוגן ממוקם כראוי, ואת organoids להישאר שלם. Microinjection משמש בדרך כלל בלימת BSL-2 וייתכן שאינו מתאים לבלימת BSL-3.
שיקול חשוב נוסף בעת ביצוע ניסויי זיהום באורגנוידים זרעים 2D הוא צפיפות התא הסופית. כפי שהוזכר בשלב 2.3, 100-150 organoids יהיה זרע באר אחת של צלחת 48-well או באר אחת של שקופית תא זכוכית 8-טוב. בהתאם לקו האורגנויד ועל האדם המטפל באורגנוידים, גודל האורגנוידים האלה יכול להיות שונה באופן משמעותי. זה יכול לגרום לצפיפות תאים שונה מאוד בצלחת 48-well או 8-טוב זכוכית-בתחתית שקופית. בהתאם לנגיף המעית, וירוסים מסוימים מעדיפים תאים דלילים יותר, בעוד שאחרים יוכלו גם להדביק תאים מתמשכים. המקור המולקולרי של הבדלים כאלה בהדבקה עבור מפגשי תאים שונים אינו ברור; לכן, ניסויי פיילוט שמטרתם למצוא את צפיפות התא הטובה ביותר עבור הפתוגן המעינטי של בחירה צריך להתבצע לפני ביצוע אפיון במורד הזרם.
לעתים קרובות מיון FACS מתבצע לפני ביצוע אמולסיה טיפה של תא יחיד. שלב זה משמש לעתים קרובות כדי להפריד בין מתים לתאים חיים ותאים בודדים מכפילים. בעת עבודה עם פתוגנים BSL-3, זה דורש כי המתקן מצויד עם ממיין FACS מתאים, וזה לא לעתים קרובות המקרה. יתר על כן, לא כל התאים באורגנויד יש את אותו גודל, וזה לעתים קרובות קשה להפלות בין כפול או תא גדול יותר, ובכך גורם לסיכון של בחירה שלילית נגד סוג תא מסוים. כמו כן, עדיין יש דיון בתחום אם הזמן הדרוש למיון בין 5,000-10,000 עבור כל מדגם יכול לגרום לשינוי משמעותי בפרופיל התמליל של התאים הבודדים. בעוד שיטות קיבוע תאים התואמות רצף תא יחיד (למשל, מתנול ו RNAassist) תוארו, זה נצפתה כי זה מוביל לירידה באיכות הרצף18. לבסוף, יש חשד כי מיון תאים באמצעות סמני מוות תאים יכול גם להוביל להטיה. בהתחשב בהתפשטות הכיוונית וההבחנה של התאים דרך ציר הקריפטה-וילי, התאים המובחנים ביותר, אשר הולכים להי לשפך ולשחרר, ממוקמים בקצה הווילי. תאים אלה הם לעתים קרובות חיובי עבור סמנים שונים של מסלולי מוות תאים (למשל., אפופטוזיס, נמק, נמק); עם זאת, כאשר מסתכלים על זיהום rotavirus של מעי העכבר, קצה villi הוא האזור הנגוע ביותר28. לכן, סינון תאים שעשויים להיראות חיוביים עבור סמני מוות יגרום לבחירה שלילית של התאים הנגועים שעשויים לייצג את הזיהום הפיזיולוגי. נכון לעכשיו, אין פתרון טוב למיון ותיקון organoids לפני רצף תא יחיד. שימוש בתאים חיים, לא ממוינים מומלץ כמו מחקרים נוספים נדרשים כדי למצוא פרוטוקולים חלופיים מתאימים.
רצף של תא בודד חולל מהפכה באופן שבו ניתן להעריך תגובות תאיות. טכניקה זו מאפשרת זיהוי של תגובות ספציפיות שושלת התא הן בתנאים בסיסיים ותחת זיהומים פתוגן. שיטה זו פתחה דלתות בתחומים רבים שהוגבלו בעבר על-ידי קריאות בצובר. בעוד שיטה זו היא חזקה מאוד, יש לה מגבלותיה. מגבלה מרכזית היא ניתוח ביואינפורמטי נרחב הנדרש במורד הזרם של הרצף. זה מפתח במיוחד בעת ניתוח רקמות והקצאת סוגי תאים שבהם אין כרגע ביאור. לאחר ביואינפורמטיקה מיומנת נדרשת לתמוך בכל המחקרים של תא יחיד.
פרוטוקול זה מתאר כיצד לזרוע ולטפל organoids מעיים אנושיים, להדביק אותם עם פתוגנים אנטריים, ולבצע scRNAseq. התאמת גישה זו לאיברים אחרים אפשרית כעת, שכן פותחו מערכות מודל אורגנויד עבור רוב האיברים. אורגנוידים ריאות וכבד מאורגנים באופן דומה לעומת organoids מעיים, וככזה, באמצעות גישה אנלוגית יכול להיות מוחלף לאורגנואידים אלה. השליטה הקריטית תהיה לאמת כי כאשר גדל בשני ממדים או סדוק פתוח, organoids אלה להשיג הבחנה דומה כמו עמיתיהם האורגנויד 3D. התכונות והגנים הספציפיים המגדירים מצב מובחן הם ספציפיים לכל מודל איברים. מודלים organoid אחרים כגון organoids כליות וכלי דם, מבנים צפופים גדולים, יצטרך שיטות נוספות כדי לנתק מבנים אלה באופן סדרתי לתאים בודדים.
Disclosures
המחברים מצהירים שאין אינטרסים כלכליים מתחרים.
Acknowledgements
מייגן סטניפר וסטייב בולנט נתמכו על ידי מענקי מחקר של דויטשה Forschungsgemeinschaft (DFG): (מספר הפרויקט 240245660, 278001972, 415089553 272983813 לסטייב בולנט 416072091 למייגן סטניפר), מדינת באדן-וורטמברג והבונדסמיניסטריום פיור בילדונג ופורשונג BMBF 01KI20239B ל- MS ו- 01KI20198A ו - NUM-COVID 19, Organo-Strat 01KX2021) ל- SB. שרטוטים נוצרו ב- BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| Recombinant mouse noggin | Peprotech | Cat#250-38 | |
| [Leu15]-Gastrin I | Sigma-Aldrich | Cat# G9145 | |
| 0.05% Trypsin-EDTA | Thermo Fischer Scientific | Cat#25300054 | |
| 24-well non-cell culture treated plate | Corning | Cat#3738 | |
| 8-well glass bottom chamber slide | iBIDI | Cart#80827 | |
| A83-01 | Tocris | Cat#2939 | |
| Advanced DMEM/F12 | Thermo Fischer Scientific | Cat# 12634010 | |
| B27 | Thermo Fischer Scientific | Cat#17504-044 | |
| Chromium Controller & Next GEM Accessory Kit | 10X Genomics | Cat#1000202 | Used in the preparation of single cell solution and preparation of Gel beads-in-emulsion (GEM) |
| Chromium Next GEM Chip G Single Cell Kit | 10X Genomics | Cat #1000127 | Used in the preparation of single cell solution and preparation of Gel beads-in-emulsion (GEM) |
| Chromium Next GEM Single Cell 3′ Kit v3.1 | 10X Genomics | Cat#1000268 | Used in the preparation of single cell solution and preparation of Gel beads-in-emulsion (GEM) |
| Collagen from human placenta | Sigma Aldrich | Cat#C5533-5MG | |
| CYP34A forward | Eurofins | GATGGCTCTCATCCCAGACTT | Primers used to check for differentiation |
| CYP3A4 reverse | Eurofins | AGTCCATGTGAATGGGTTCC | Primers used to check for differentiation |
| DMEM/F12 | Thermo Fischer Scientific | Cat#11320074 | |
| EDTA | Sigma Aldrich | Car#E9884 | |
| Fast Read 102 counting slides | Biosigma | Cat# BVS100 | |
| Fetal Bovein Serum (FBS) | Capricorn | Cat#FBS-12A | |
| GlutaMAX | Thermo Fischer Scientific | Cat# 35050061 | |
| HEPES | Thermo Fischer Scientific | Cat3 15630080 | |
| L-WRN cells | ATCC | CRL-3276 | This cell line is used to make the conditioned media containg Wnt 3A, R-Spondin and Noggin. The protocol for the production of the conditioned media can be found on the manufacterures site. |
| MatriGel. GFR, LDEV free | Corning | Cat#354230 | |
| MUC-2 forward | Eurofins | TGTAGGCATCGCTCTTCTCA | Primers used to check for differentiation |
| MUC-2 reverse | Eurofins | GACACCATCTACCTCACCCG | Primers used to check for differentiation |
| N-acetyl-cysteine | Sigma Aldrich | Cat# A9165 | |
| OLMF4 forward | Eurofins | ACCTTTCCCGTGGACAGAGT | Primers used to check for differentiation |
| OLMF4 reverse | Eurofins | TGGACATATTCCCTCACTTTGGA | Primers used to check for differentiation |
| Penicillin/Streptomycin | Thermo Fischer Scientific | Cat#15140122 | |
| Recombinant human FGF basic | Peprotech | Cat#100-18B | |
| Recombinant human IGF-1 | BioLegend | Cat#590904 | |
| Recombinant mouse EGF | Thermo Fischer Scientific | Cat# PMG8043 | |
| SI forward | Eurofins | AATCCTTTTGGCATCCAGATT | Primers used to check for differentiation |
| SI reverse | Eurofins | GCAGCCAAGAATCCCAAT | Primers used to check for differentiation |
| TrypLE Express | Thermo Fischer Scientific | Cat#12605036 | |
| Y-27632 | Caymann Chemicals | Cat#10005583 |
References
- Kretzschmar, K., Clevers, H. Organoids: Modeling development and the stem cell niche in a dish. Developmental Cell. 38, 590-600 (2016).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Tekes, G., Ehmann, R., Boulant, S., Stanifer, M. L. Development of feline ileum- and colon-derived organoids and their potential use to support feline coronavirus infection. Cells. 9, (2020).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375, 409-424 (2019).
- Zhou, J., et al. Infection of bat and human intestinal organoids by SARS-CoV-2. Nature Medicine. 26, 1077-1083 (2020).
- Sato, T., Clevers, H. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications. Science. 340, 1190-1194 (2013).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470, 105-109 (2011).
- de Graaf, M., van Beek, J., Koopmans, M. P. Human norovirus transmission and evolution in a changing world. Nature Reviews Microbiology. 14, 421-433 (2016).
- Leshem, E., et al. Real-world effectiveness of pentavalent rotavirus vaccine among bedouin and jewish children in southern Israel. Clinical Infectious Diseases : An Official Publication of the Infectious Diseases Society Of America. 62, 155-160 (2016).
- Karst, S. M. The influence of commensal bacteria on infection with enteric viruses. Nature Reviews Microbiology. 14, 197-204 (2016).
- Ettayebi, K., et al. Replication of human noroviruses in stem cell-derived human enteroids. Science. 353, 1387-1393 (2016).
- de Wit, E., van Doremalen, N., Falzarano, D., Munster, V. J. SARS and MERS: recent insights into emerging coronaviruses. Nature Reviews Microbiology. 14, 523-534 (2016).
- Scaldaferri, F., et al. The thrilling journey of SARS-CoV-2 into the intestine: From pathogenesis to future clinical implications. Inflammatory Bowel Diseases. 26, 1306-1314 (2020).
- Kipkorir, V., Cheruiyot, I., Ngure, B., Misiani, M., Munguti, J. Prolonged SARS-CoV-2 RNA detection in anal/rectal swabs and stool specimens in COVID-19 patients after negative conversion in nasopharyngeal RT-PCR test. Journal of Medical Virology. 92, 2328-2331 (2020).
- Lamers, M. M., et al. SARS-CoV-2 productively infects human gut enterocytes. Science. 369, 50-54 (2020).
- Stanifer, M. L., et al. Critical role of type III interferon in controlling SARS-CoV-2 Infection in human intestinal epithelial cells. Cell Reports. 32, 107863 (2020).
- Triana, S., et al. Single-cell transcriptomics reveals immune response of intestinal cell types to viral infection. bioRxiv. , (2020).
- Triana, S., et al. Single-cell analyses reveal SARS-CoV-2 interference with intrinsic immune response in the human gut. Molecular Systems Biology. 17, 10232 (2021).
- Tang, F., et al. mRNA-Seq whole-transcriptome analysis of a single cell. Nature Methods. 6, 377-382 (2009).
- Hwang, B., Lee, J. H., Bang, D. Single-cell RNA sequencing technologies and bioinformatics pipelines. Experimental & Molecular Medicine. 50, 1-14 (2018).
- García-Rodríguez, I., Sridhar, A., Pajkrt, D., Wolthers, K. C. Put some guts into it: Intestinal organoid models to study viral infection. Viruses. 12, 1288 (2020).
- Stanifer, M. L., et al. Asymmetric distribution of TLR3 leads to a polarized immune response in human intestinal epithelial cells. Nature Microbiology. 5, 181-191 (2020).
- Lees, E. A., et al. Using human induced pluripotent stem cell-derived intestinal organoids to study and modify epithelial cell protection against salmonella and other pathogens. Journal of Visualized Experiments: JoVE. (147), e59478 (2019).
- Mahe, M. M., Sundaram, N., Watson, C. L., Shroyer, N. F., Helmrath, M. A. Establishment of human epithelial enteroids and colonoids from whole tissue and biopsy. Journal of Visualized Experiments: JoVE. (97), e52483 (2015).
- Fujii, M., et al. Human Intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Bartfeld, S., Clevers, H. Organoids as model for infectious diseases: Culture of human and murine stomach organoids and microinjection of Helicobacter Pylori. Journal of Visualized Experiments: JoVE. (105), e53359 (2015).
- Hernandez, P. P., et al. Interferon-lambda and interleukin 22 act synergistically for the induction of interferon-stimulated genes and control of rotavirus infection. Nature Immunology. 16, 698-707 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved