Method Article
생체 안전 수준 3 (BSL-3) 조건 하에서 병원체 감염 및 단일 세포 염기서열분석에 대한 위장 오르가노이드 적응
요약
이 프로토콜은 단세포 RNA 염기서열분석(scRNAseq) 기술을 사용하여 단세포 수준에서 숙주/병원균 상호 작용을 특성화하기 위해 자신의 apical 또는 바식측에서 인간 장 기관가를 감염시키는 방법을 설명합니다.
초록
인간 장 가구는 위장관의 병원균 감염을 연구하는 가장 좋은 세포 모델을 구성합니다. 이러한 오르가노이드는 기관의 모든 섹션(위, 제주, 십이지장, 일레움, 결장, 직장)에서 파생될 수 있으며, 분화시, 각 개별 섹션에서 자연적으로 발견되는 대부분의 세포 유형을 함유하고 있다. 예를 들어, 장 내 오르가노이드에는 영양 흡수 장세포, 분비 세포(잔, 창, 및 장내 분비), 줄기 세포뿐만 아니라 모든 계보별 분화 중간체(예: 조기 또는 미성숙 세포 유형)가 포함됩니다. 위장관 유래 오르가노이드를 사용하여 전염병을 연구하는 데 있어 가장 큰 장점은 장내 병원체가 어떤 세포 유형을 표적으로 하는지 정확하게 식별하고 위장관및 특정 세포 유형의 다른 섹션이 병원균 문제에 유사하게 반응하는지 여부를 해결할 수 있다는 것입니다. 지난 몇 년 동안, 위장 모델, 뿐만 아니라 다른 조직에서 organoids, 바이러스 성 트로피즘과 병인의 메커니즘을 공부 하기 위해 사용 되었습니다. 그러나 병원성 바이러스를 사용할 때 오르가노이드를 사용하는 모든 장점을 활용하는 것은 기술적 인 과제를 나타내며 엄격한 생물 안전 고려 사항이 필요합니다. 또한, 오르가노이드는 종종 3차원에서 재배되기 때문에 세포의 바소포측은 오르가노이드의 바깥쪽을 향하고 있으며, 그들의 압정면은 오르가노이드의 내부(lumen)를 향하고 있다. 이 조직은 많은 장내 감염이 섭취 다음 세포의 정모/발광 측에서 시작으로 장 내 병원체에 대 한 도전을 제기. 다음 원고는 세포 형 특정 숙주 / 병원균 상호 작용을 특성화하기 위해 단세포 RNA 염기서열분석을 수행하는 감염 측 (apical 대 basolateral)을 고려하여 장 내 병원체감염에 대한 인간 장 기관가노이드를 준비하는 포괄적 인 프로토콜을 제공합니다. 이 방법은 유기체의 준비뿐만 아니라 생물 안전 수준 3 (BSL-3) 봉쇄 조건하에서이 작업을 수행하는 데 필요한 고려 사항을 자세히 설명합니다.
서문
인간 장바이러스에 대한 세포 유형별 트로피즘 및 세포 유형 별 면역 반응을 연구하는 것은 1 차적인 인간 적인 세포 모형의 부족 때문에 역사적으로 도전적이고 있습니다. 이러한 제한은 이제 오가노이드1의개발로 부분적으로 근절되었습니다. 위장관의 경우, 위 및 장 가구형 모델은 인간 및 여러 다른 종(예:murine, 소, 고양이, 박쥐)2,3,4,5,6을위해 개발되었다. 장 내 오르가노이드는 인간의 장 상피의 구조 구조를 재현하고 토굴과 사악한 구조, 기능성 장 계보를 포함하고 심지어 이전에 알려지지 않은 세포 혈통을 식별하는 데 사용되었습니다. 두 가지 접근 법은 장 오르가노이드를 성장하기 위하여 이용될 수 있습니다. 첫째, 토굴을 함유한 장줄기 세포는 조직 절제술또는 생검으로부터 분리되고 특정 배양 조건(예를 들어, Wnt3A, R-spondin, Noggin, EGF)에서 재배하여 확장한 다음 줄기 세포를 대부분의 장내 세포 계보(예를들어, 장내 세포 계보, Paneth세포, 파네트세포)로분화하여 세포에 진입한다. 이 방법은 위장관의 모든 섹션에서 오르가노이드의분리를허용합니다 (예 : 위, 십이지장, 제주넘, 일레움 및 결장). 두 번째 방법은 인간 유도 만능 또는 배아 줄기 세포에 의존하며, 이는 후장 상피 세포로 단계적으로 분화된다8. 이러한 유도된 줄기 세포 기지를 둔 오르가노이드는 수시로 환자 유래 유기인에 비교된 자연에서 더 많은 배아인 것으로 기술됩니다. 이 모든 organoid 모형은 장관을 형성하는 데 필요한 발달 단서를 해명하는 데 중요했지만, 전염병 연구에서의 사용은 아직 초기 단계에 있습니다.
장내 바이러스는 피코나바이러스(예를들어, EV-71), 레오바이러스(예를 들어, 로타바이러스), 칼리시바이러스(예를 들어, 노로바이러스)9와같은 위장관을 통해 감염되는 모든 바이러스를 포함하는 광범위한 용어이다. 장내 바이러스는 오염된 음식과 물의 섭취를 통해 전염성 수명 주기를 개시하여 개발도상국의 사람들이 치료되지 않은 폐기물을 환경으로 배출하고감염 10이발병한 후 의료 서비스 부족으로 인해 고위험에 처하게 된다. 병원균의 종류에 따라, 감염은 장 안대기의 누설로 인한 위장염, 구토 및 /또는 물 설사로 이어질 수 있습니다. 인간 노로바이러스는 전세계적으로6억 건 이상의 감염과 1,500만 건의 입원으로 이어지는 매우 널리 퍼지고 전염성이 높은 장병원성 병원체입니다. 오르가노이드는 이전에 표준 세포 배양모델(12)에서배양될 수 없었던 인간 노로바이러스의 감염 및 복제를 지원하면서 노로바이러스 연구의 핵심이었다.
지난 2 년 동안, 코로나 바이러스는 주요 인간 병원체로등장했다 13. 이 가족은 고병원성 MERS, SARS-CoV-1 및 SARS-CoV-2를 포함하며, 이러한 바이러스에 대한 연구를 수행할 때 엄격한 안전 수준 봉쇄가 필요합니다. 흥미롭게도, 이 병원체의 세 가지 모두 주로 유도 된 호흡 증상과 고민에 대 한 인식 하는 동안, 그것은 지금 이 바이러스는 전적으로 호흡기를 감염 하지 않습니다 뿐만 아니라 다른 장기. SARS-CoV-2 감염환자에서 유도된 중요한 병리학은 호흡 곤란 이외에 위장증상(14)의존재이다. SARS-CoV-2 감염한 환자의 분수는 매우 온화한에서 가혹한 설사에 구역 수색하는 그 같은 현상을 표시합니다. 추가적으로, SARS-CoV-2 게놈은 감염된 환자의 대변 및 위장관 생검에서 검출될 수 있다15. 중요한 것은 위장 증상의 존재는 또한 MERS 및 SARS-CoV-1 감염된 환자에서 관찰되었기 때문에 SARS-CoV-2에 국한되지 않습니다. SARS-CoV-2가 위장관 고민을 유도하고 정확하게 위장에서 SARS-CoV-2의 트로피주의를 식별하는 방법을 이해하기 위해, 인간 장 내장 은 주요 도구였으며 이제이 병원체 에 대한 세포 유형 별 반응을 해명하기 위해 악용된다16,17.
세포 집단의 전사 프로파일링 (벌크 RNA 시퀀싱)은 유기체뿐만 아니라 불멸의 세포주 모두의 병원균 감염을 평가 할 때 표준 관행이었습니다. 이것은 우리가 병원체에 응하여 글로벌 변경을 결정하는 것을 허용하는 동안 (예를 들면, 사이토카인의 강화 조절), 벌크 RNAseq는 왜 인구에 있는 특정 세포가 그 외 보다는 감염하기 쉬운지 결정하는 것을 허용하지 않습니다. 단세포 RNA 시퀀싱(scRNAseq)은 세포 혈통 특이적 전사 프로그램을 해명하는 강력한 도구가 되었으며, 이러한 프로그램이 바이러스감염(18,19)을지원하거나 억압하는 방법을 결정하는 데 사용될 수 있다. scRNAseq의 첫 번째 설명은 2009년에 있었고 마우스 blastomere20에서찾아낸 다른 세포의 전사 프로파일을 평가하는 데 사용되었다. 이러한 기술은 이제 확장되었으며 여러 플랫폼을 통해 구현할 수 있습니다. 이 기술의 초기 버전은 형광 활성화 세포 선별기(FACS)를 적용하여 시퀀싱을 위해 개별 세포를 분리하여 종종 96- 또는 384웰 플레이트로 제한되어 300개의 개별 세포가 샘플21당분석하도록 하였다. 이러한 방법은 이제 단일 셀 시퀀싱 플랫폼에 의해 진행되었으며, 이는 미세 유체 장치를 사용하여 단일 세포를 구슬이 포함된 바코드가 포함된 개별 물방울로 캡슐화합니다. 이 기술을 통해 샘플 조건당 최대 10,000개의 셀을 포획할 수 있습니다.
오르가노이드 기술과 scRNAseq를 결합하면 장내 병원체가 세포 유형별 방식으로 위장관에 미치는 영향을 연구할 수 있습니다. 그러나 몇 가지 기술적 및 생물 안전 고려 사항을 고려해야 합니다. 무엇보다도, 고전적인 오르가노이드 배양 방법(3차원(3D) 오르가노이드, 세포외 매트릭스(ECM)에 내장된) 상피 세포의 바칼탈측을 오르가노이드의 바칼측을 외부에 노출한다. 장내 병원균이 오염된 음식/물의 섭취를 통해 감염을 시작하면 감염은 세포의 정면에서 가장 자주 시작되며, 이 3D 장 오르가노이드에서는 접근할 수 없습니다. 따라서, 오르가노이드는 2D 파종을 통해 병원체 감염에 접근할 수 있도록 준비되어야 하며, 이에 따라 세포의 액피티컬 측면을 직접 노출시키거나,마이크로주입(22,23)을통해서이다. 둘째, 감염된 생물학적 시료의 scRNAseq를 수행하기 위해, 그들의 전염성 특성을 고려하는 것이 중요하다. 후속 RNAeq에 대한 단일 세포 격리 이전에 세포를 고치고 병원균을 비활성화하는 방법이 제안되었지만, 이러한 방법은 종종 시퀀싱 품질18의감소로 이어진다. 아래 의정서는 감염측(apical 대 바소포탈 감염)을 고려한 장 내 유기성 기관지(asolateral 감염)를 고려한 장 기관가를 감염시키는 몇 가지 접근법을 설명할것이다(그림 1). 추가적으로, 프로토콜은 scRNAseq를 위한 고병원성 바이러스에 감염된 오르가노이드에서 단 하나 세포를 해리하고 격리하는 워크플로우를 포함할 것입니다. 이 프로토콜은 에어로졸 생성 및 잠재적 오염을 방지하기 위해 생물 안전 수준-3(BSL-3) 봉쇄 조건하에서 작업할 때 구현해야 하는 주요 단계를 강조합니다.
프로토콜
인간 조직은 다음 프로토콜을 위해 대학 병원 하이델베르크에서 결장 절제술 또는 일루 생검으로부터 수신되었습니다. 이 연구는 헬싱키 선언에 따라 모든 과목의 서면 동의와 대학 병원 하이델베르크의 권고에 따라 수행되었다. 모든 샘플을 익명화 방식으로 수신 및 유지관리하였다. 프로토콜S-443/2017에 따라 대학 병원 하이델베르크의 윤리위원회에 의해 승인되었습니다.
1. 장 및 결장 오르가노이드의 유지 보수 및 패시징
주의: 인간 장 가구는 인간 조직또는 유도된 다능성/배아 줄기 세포로부터 유래되며, 따라서 윤리적 승인이 요구된다. 국가별 규정을 준수해야 합니다. 인간 물질은 일반적으로 테스트되지 않으므로 종종 BSL-2 물질로 간주됩니다. 실험이 이루어지는 국가에서 적절한 봉쇄 조건을 확인해야 합니다.
- 이전에 설명된 방법2를사용하여 격리된 조직 및/또는 생검으로부터 장 및 결장 오르간노이드를 준비한다. 또한, 환자 유래 물질 또는 iPSC로부터 오가노이드를 준비하는 방법에 대한 보다 기술적 인 세부 사항은 Lees 외 및 Mahe 외.24,25에서찾을 수 있습니다.
- 오르가노이드 배양이 확립되면, 오르가노이드가 장내 병원균으로 감염을 수행하도록 준비하기 위해 아래 설명된 분할 루틴을 따르십시오.
- 24웰 비조직 배양소에서 100% ECM 용액의 50 μL에서 20-100개의 오르가노이드를 종자 24-잘 비조직 배양처리 플레이트에 종자 20-100. 잘 성장 매체(표 1)의500 μL을 추가합니다.
- 기존 미디어의 250 μL을 제거하고 각각 의 새로운 성장 매체의 250 μL을 각 우물에 추가하여 2일마다 미디어를 변경합니다. 미디어를 변경하기 전에 미디어를 실온으로 데우습니다.
주의: 콜드 미디어는 유기체를 포함하는 ECM 솔루션을 액화합니다. - 죽은 세포의 축적으로 인해 내부가 어두워지기 시작할 때 일주일에 한 번 오르가노이드를 통과합니다. 이 예제는 그림 2에서찾을 수 있습니다.
- 분할 당일, ECM 용액을 -20°C에서 제거하고 얼음 위에서 해동하십시오.
- 37°C에서 분할한 후 오르가노이드를 시드하는 데 사용될 새로운 빈 세포 배양판을 놓습니다(이것은 적어도 1h가 필요하며 밤새 따뜻해질 수 있음). 문화 매체를 실온으로 데워보실 수 있습니다.
- P1000 파이펫으로 성장 매체를 제거하고 감기 1x 인산완충식식염(PBS)의 500 μL을 각 웰에 3분 동안 추가하여 ECM 용액을 부분적으로 액화하고 플레이트에서 분리한다.
- ECM 솔루션의 완전한 중단을 보장하려면 P1000 파이펫(450 μL에 설정)을 사용합니다. 파이펫은 PBS, ECM 용액 및 오르가노이드를 10번 위아래로 재보일시 중단하고, 재중단된 오르가노이드를 15mL 원문 튜브로 옮기고 얼음 위에 놓습니다.
- 동일한 원식 튜브에 동일한 오르가노이드의 여러 우물을 수집합니다.
- 여러 가지 다른 오르가노이드 (다른 기증자, 다른 섹션, 다른 사전 처리 등)가 동시에 분할되는 경우, 다른 원색 튜브에서 수집합니다. 수집하는 동안 얼음에 원추형 튜브를 유지합니다.
- 샘플을 500 x g에서 4°C에서 5분 동안 회전시. 바닥에 오르가노이드 펠릿을 유지하기 위해 파이펫으로 PBS를 조심스럽게 제거합니다.
- 오가노이드의 펠릿이 매우 느슨하고 PBS를 너무 빨리 제거할 때 쉽게 흡인 될 수 있기 때문에 장착 된 파이펫이있는 진공 폐기물 시스템을 사용하지 마십시오.
- 원추형 튜브에 0.05% 트립신 1mL을 추가하고 P1000 파이펫으로 10번 위아래로 피펫을 사용하여 오르가노이드를 재일시 중단합니다. 37°C에서 오르가노이드를 함유한 원문관을 3분 동안 배양한다.
- 10% 태아 소 혈청(FBS)을 포함하는 DMEM/F12 미디어 2mL과 1% 페니실린/연쇄절제술을 첨가하여 소화를 멈추고 P1000 파이펫으로 10번 위아래로 파이프를 사용하여 오르가노이드를 방해합니다.
- 샘플을 500 x g에서 4°C에서 5분 동안 회전시. 원심분리기에서 원물 튜브를 제거하고 얼음에 보관하십시오.
- 5mL 일회용 파이펫으로 미디어/트립신을 조심스럽게 제거하여 바닥에 오르가노이드 펠릿을 유지합니다. 약 500 μL의 미디어를 그대로 두고 P1000 파이펫으로 제거하십시오.
- 모든 원추형 튜브에서 배지/트립신이 제거되면, 37°C 인큐베이터에서 24웰 비세포 배양 처리 플레이트를 제거하고 세포 배양 후드 아래에 놓는다.
- 개별 기증자 오르가노이드의 성장 습관에 따라 1:3 ~ 1:5 비율로 분할 오르가노이드를 가진 원식 튜브에 100% ECM 용액(얼음에 보관)을 추가합니다. 예를 들어, ECM 용액의 50 μL 방울에 20-100 개의 오르가노이드를 잘 함유 한 개가 통과 된 경우, 오르가노이드 펠릿을 얼음 차가운 ECM 용액의 150-250 μL로 재연하십시오.)
- 종자 50 μL 의 ECM 용액/오가노이드 혼합은 24웰비세포 배양처리 플레이트의 웰당 37°C로 예열하였다.
참고: ECM 솔루션이 따뜻해지면 매우 빠르게 중합됩니다. 사용 중에 ECM 용액을 항상 차갑게 유지하십시오(얼음에 보관됨). 오르가노이드가 다시 중단되었을 때, 새 접시에 즉시 씨앗을 드세요. 초보자의 경우 파종에 대한 추가 시간을 허용하려면 -20 °C의 파이펫 팁 상자를 저장하는 것이 좋습니다. - ECM 용액이 중합할 수 있도록 10-15분 동안 37°C에서 24웰 플레이트를 배양한다.
- 중합화 에 이어, 각 웰에 500 μL(표1)26을 추가하고 37°C에서 오르가노이드를 배양한다. 현미경 검사법으로 매일 오가노이드를 확인하십시오. 1.4 단계와 같이 2 일마다 미디어를 변경합니다.
2. 정압 감염에 대한 2 차원 (2D)의 오르가노이드 준비
참고: 다음 프로토콜은 장 상피 세포를 자신의 정문 측에서 감염시키기 위해 세포 배양 판에 있는 세포의 단층으로 장 기관가노이드를 종자하는 방법을 설명합니다. 48웰 플레이트를 사용하여 시퀀싱 실험과 8웰 유리 바닥 챔버 슬라이드를 사용하여 면역 형광 접근법을 사용하여 감염을 제어하십시오.
- 1항에 설명된 대로 오르가노이드를 재배하고 유지합니다.
- 2D의 파종 오르가노이드에 앞서 48웰 플레이트와 8웰 유리 바닥 챔버 슬라이드를 37°C에서 1시간 동안 우물당 2.5%의 인간 콜라겐200 μL로 코팅합니다.
참고: 장 내 오르가노이드는 48웰 플레이트와 8웰 유리 바닥 챔버 슬라이드에서 가장 잘 시드됩니다. 경험은 그들이 96 잘 접시에 잘 감염되지 않는 것으로 나타났습니다. 트랜스웰 인서트도 2D에서 정압 및 바소포탈 감염을 모두 허용하는 데 사용할 수 있습니다. 트랜스웰이 사용되는 경우 감염 전에 트랜스 상피 전기 저항(TEER)을 모니터링하여 컨플루천 모노레이어를 확인합니다. 일반적으로 장 가구는 450-600 Ohm/cm 2의 TEER로 단단한 장벽을 가지고있습니다. - 48웰 플레이트의 각 웰 또는 8웰 유리 바닥 챔버 슬라이드의 한 웰에 100-150 개의 오르가노이드를 시드하십시오.
- 오르가노이드의 수를 추정하기 위해, 섹션 1에 준비된 24웰 플레이트의 ECM 용액 낙하 50 μL에 존재하는 오르가노이드의 수를 계산한다. 평균적으로 1-2 개의 우물이 필요하며 약 15,000-30,000 개의 세포를 제공합니다.
- ECM 용액을 방해하고 오르가노이드를 트립시화하려면 1.8-1.17 단계를 따르십시오.
- 48웰 플레이트와 8웰 유리 바닥 챔버 슬라이드에서 인간의 콜라겐을 제거합니다.
- 원내 튜브내 의 오르간노이드 펠릿을 250μL의 성장 미디어/웰에 재중단하고 콜라겐 코팅 된 우물에 혼합물을 추가합니다. 플레이트를 37°C 인큐베이터에 놓습니다.
참고: 실험을 수행할 때 여러 조건이 비교됩니다(모의 대 감염된 +/- 관심 의 치료). 2D 시드 오르가노이드의 각 웰 사이의 가변성을 최소화하려면 동일한 원적 튜브에 필요한 오르가노이드의 총 수를 수집합니다. 24웰 플레이트의 최대 12개의 우물에서 오가노이드를 수집하면 트립신 1mL및 중화 미디어를 사용할 수 있습니다. 12-24 개의 우물을 사용하는 경우 트립신 2 mL 및 중화 매체의 4 mL로 증가하십시오. - 48h 후, 인큐베이터에서 플레이트를 제거하고 세포 배양 후드에 놓습니다. 성장 매체를 제거하고 차별화매체(표 1)의웰당 250 μL로 교체한다. 48시간 후에 이 미디어 변경을 반복합니다.
- 48h 후, RNA를 추출하여 분화(4일 후 전환 후 분화 매체로 전환) RNA를 추출하고, RNA250ng로 cDNA를 만들고, 줄기세포(OLFM4 및/또는 SMOC2), 잔세포(MUC2), 장내세포(CHGA), 장외세포(CHGA), 장외세포(CHGA),장내세포(CHGA), 장신세포(CHGA), 장내세포(CHGA) 및 CY4(3)를 위한 프라이머를 사용하여 SYBR 그린 기반 qPCR을 수행하였다.
참고: 성장 매체에서 분화 매체로 전환하면 오르가노이드는 줄기 세포 마커(OLFM4 및/또는 SMOC2)의 발현을 감소시키고 잔 세포(MUC2), 장내분비 세포(CHGA), 및 장신구(SI 및/또는 CYP3A4) 마커를 qPCR에 의한 마커를 증가시합니다. 성장 매체와 차별화된 각 세포 형 별 마커의 발현 수준을 비교하기 위해 성장 매체와 함께 추가적인 양호한 준비를 하고 유지한다. - 차별화가 확인되면, 오르가노이드는 정색 감염에 대한 준비가되어 있습니다. 선택의 병원체에 필요한 생물 안전 수준 봉쇄로 오르가노이드를 이동합니다.
주의: BSL-2 또는 BSL-3 봉쇄하에서 병원균을 취급할 때 연구소의 현지 규정 및 표준 운영 절차를 참조하십시오. - 그들의 apical 측에서 2D로 자란 장 기관가노이드를 감염시키기 위하여는, P1000 파이펫을 가진 매체를 제거하고 분화 매체에 있는 실험에 요구되는 감염의 복합성에서 희석된 병원체를 추가합니다 (병원체/미디어 혼합의 최소 부피는 우물 당 50 μL이고 최대 부피는 잘 당 250 μL입니다).
- 감염이 세포 배양 인큐베이터에 있는 로커 테이블과 함께 37°C에서 2시간 동안 진행하거나 15-20분마다 수동으로 플레이트를 흔들어 서도록 한다. 선택의 병원체에 기초하여이 시간을 최적화합니다.
- 2시간 후 P1000 파이펫으로 미디어를 제거하고 신선한 분화 매체당 250 μL로 교체하십시오. 단일 세포 염기서열 분석의 시점까지 37°C에서 세포를 배양한다.
- 단세포 시퀀싱을 위해 세포를 준비하려면 섹션 4로 진행하십시오.
3. 기형 및 바소포측 감염에 대한 3차원(3D)으로 오가노이드 를 준비
- 24개의 잘, 비세포 배양 처리 플레이트에서 제1항에 설명된 바와 같이 오르가노이드를 성장시한다.
- 2 일 후 통과, 인큐베이터에서 플레이트를 제거하고 세포 배양 후드에 배치.
- P1000 파이펫으로 성장 매체를 제거하고, 실온으로 미리 데온된 분화 매체의 500 μL/웰으로 대체하고 플레이트를 37°C 인큐베이터에 놓습니다.
- 48h 후, 신선한 분화 매체 (500 μL / 웰)로 대체합니다.
참고: 오르가노이드는 감염 전 총 4일 동안 분화 매체에서 유지됩니다. - 2.9 단계에서 설명된 바와 같이 분화를 확인합니다.
- 차별화가 발생했다는 것을 확인하면 오르가노이드는 감염할 준비가 되어 있습니다.
- 얼음에 ECM을 해동. 분화 매체를 실온으로 데우고 24웰 플레이트를 37°C에서 따뜻하게 합니다.
- 감염을 수행하려면 ECM 용액에서 오르가노이드를 제거합니다.
참고: 바이러스가 세포가 아닌 ECM 솔루션에 충실하는 것을 선호하기 때문에 가능한 한 많은 ECM 솔루션을 제거합니다. 오르가노이드 주위에 남아 있는 ECM 해결책이 너무 많은 경우에, 그 때 감염성은 가혹하게 영향을 받을 것입니다. - 감기 1x PBS 500 μL을 추가하고 3분 동안 배양하여 ECM을 방해합니다. P1000을 사용하여 10배 위아래로 파이펫을 사용하십시오. 튜브에 오르가노이드와 원심분리기를 500 x g로 5분 간 결합합니다. P1000으로 PBS를 제거합니다.
참고: 각 감염 조건 간의 가변성을 최소화하려면 24웰 플레이트의 여러 우물에서 나오는 오르가노이드를 동일한 원문 튜브로 결합합니다. 예를 들어, 감염을 위한 8개의 조건이 필요한 경우에, 24웰 플레이트의 8개의 우물(각각 ~100개의 오르가노이드 포함)를 결합하고 그 후에 바늘 중단 다음 새로운 24웰 플레이트의 8개의 우물로 나뉩니다(단계 3.12 참조). - 분화 매체의 1 mL에서 오르가노이드를 다시 중단합니다. 정압 및 바소포탈 감염의 경우 3.10.1단계를 따르고 바소포측 감염은 3.10.2단계를 따르십시오.
- 27 G 바늘을 1mL 주사기에 부착하고 펠릿을 6번 다시 분리하여 오르가노이드의 붕괴를 허용하고 감염이 정문 및 바식사이드 모두에서 발생하도록 합니다. 3.11 단계로 진행합니다.
참고: 오르가노이드는 바늘 붕괴 전에 관찰 될 때 어두운 중심을 가진 고전적인 낭종 모양과 문어 로이건이어야합니다. 중단 후, 이러한 오르가노이드는 어두운 내부가 적어 작게 나타납니다. 감염을 수행 할 때, 항상 두 가지 조건 (모의 및 감염)의 최소가있을 것이다, 24 웰 플레이트의 최소 2 개의 우물은 처음에 바늘 기반 의 중단을위한 15 mL 원추형 튜브로 결합될 것입니다 (최소 1 mL가 재서스펜션에 사용되는 이유를 설명). 2개 이상의 조건을 수행할 때, 단일 15mL 원추형 튜브에 24웰 플레이트의 최대 10개의 우물을 결합하고 바늘 붕괴를 위한 분화 매체의 1mL에서 재주중단한다. 중단 후, n + 1당 분화 매체의 500 μL을 추가합니다(예: 10개의 우물을 사용하는 경우 4.5mL로 위로 올려 합계 5.5mL). 10개 이상의 조건이 필요한 경우 여러 원문 튜브를 사용합니다. 1 mL 주사기는 오르가노이드가 주사기의 이 부피로 더 잘 중단되기 때문에 권장됩니다. 주사기의 대안은 잘 평평해진 P1000 팁을 사용하는 것입니다. - 잘 당 분화 매체의 500 μL에서 오르가노이드를 다시 중단합니다. 오르가노이드를 방해하지 않도록주의하고 apical 측에 접근 할 수 없습니다 있는지 확인하십시오. 3.11 단계로 진행합니다.
- 27 G 바늘을 1mL 주사기에 부착하고 펠릿을 6번 다시 분리하여 오르가노이드의 붕괴를 허용하고 감염이 정문 및 바식사이드 모두에서 발생하도록 합니다. 3.11 단계로 진행합니다.
- P1000 파이펫을 사용하여 24웰 세포 배양 판에 잘 당 500 μL의 요도형 현탁액을 전달하고 선택된 병원체에 필요한 생체 안전 수준 봉쇄로 플레이트를 이동한다.
주의: BSL-2 또는 BSL-3 봉쇄하에서 병원균을 취급할 때 현지 규정 및 연구소의 표준 운영 절차를 참조하십시오. 항상 바늘과 잠재적인 사고를 피하기 위해 BSL-3 외부 오르가노이드의 바늘 중단을 수행합니다. 현지 규정은 또한 BSL-3에서 바늘의 사용을 방지할 수 있습니다. - 분화 매체에 희석된 병원균을 추가하여 실험에 필요한 감염의 복합성에 도달한다. 총 부피 500 μL을 초과하지 마십시오 (24 웰 플레이트에 총 1 mL을 가지려면).
- 감염이 세포 배양 인큐베이터에 위치하거나 15-20 분마다 수동으로 플레이트를 흔들어 37 °C에서 (이 시간은 선택의 병원체에 적응해야합니다)에 대한 진행을 허용합니다.
- 2h 인큐베이션에 이어, 조건당 1.5mL 튜브로 오르가노이드를 수집하고 4°C에서 5분 동안 500 x g에서 회전한다.
- P1000 파이펫으로 병원균이 함유된 미디어를 제거하고 얼음 에 저장합니다. PBS로 오가노이드 펠릿을 한 번 씻으십시오.
- 100% ECM 용액(이전에 얼음에 해동되었던) 50 μL에서 오르가노이드를 재연하여 플레이트를 37°C로 예온한 24웰 비세포 배양판으로 플레이트를 재침하고 ECM 용액이 중합할 수 있도록 37°C에서 24웰 플레이트를 배양한다.
- 중합에 이어, 실온에서 분화 매체의 500 μL을 각 우물에 넣고 단일 세포 시퀀싱을 위해 수확할 때까지 37°C에서 배양한다.
참고: 수확후 48시간 이상 발생해야 하는 경우, 기존 미디어를 제거하고 500μL의 신선한 분화 매체로 대체하여 2일마다 미디어를 변경합니다. 그러나, 경험은 오르가노이드가 분화 매체에서 성장하기 때문에, 그들은 48 h보다 훨씬 더 오래 살아남지 않을 것이라는 점을 보여주었습니다.
4. 생물안전 수준 3(BSL-3) 조건에서 단일 세포 용액 의 제조 및 젤 비드 인 에멀젼(GEM) 제제
참고: 다음 단계의 완료는 BSL-3 시설 내부에 100 μL 반응을 처리할 수 있는 단일 셀 시퀀싱장비(재료 표)와PCR 기계가 있어야 합니다. 오르가노이드는 1항에 설명된 대로 재배되고 병원체 및 진입 경로에 따라 섹션 2-3에 기재된 대로 감염된다. 감염 후 미리 결정된 시간에 오르가노이드를 수확합니다. 소장 오르가노이드를 수확하는 데 사용되는 방법 아래에 설명되어 있습니다.
- 감염된 오르가노이드를 수확하기 전에 단일 세포 젤구슬(재료 표)을-80°C에서 제거하고 실온(최소 30분 이전)으로 따뜻하게 제거하십시오.
- 또한 RT 시약, 감소제 B 및 RT 효소 C(모두 -20°C에 저장됨)를 실온에 평형화합니다. 제조업체의 지침에 설명된 대로 템플릿 스위치 올리고를 다시 일시 중지합니다.
참고: 고려된 병원체에 대한 확립된 표준 운영 절차에 따라 지역 생물안전 규정에 대하여 다음의 모든 단계를 수행해야 합니다. BSL-3 작업에 대한 엄지 손가락의 규칙으로, 세포 배양 후드를 빠져나가는 모든 혈관 (플레이트, 튜브 등)의 외관이 제대로 제거되도록해야합니다. 실험을 수행하는 사람의 손/장갑도 마찬가지입니다. - 2D(섹션 2)에서 시드된 오르가노이드에 대한 감염을 수행하려면 4.4단계로 진행된다. 3D 오르가노이드(섹션 3)에 감염을 수행하려면 섹션 4.5로 진행됩니다.
- 2D 오르가노이드의 감염의 경우, 세포 배양판을 후드에 넣고 P1000 파이펫으로 분화 매체를 제거한다.
- 실온에 1x PBS의 250 μL을 각 우물에 추가합니다.
- P1000 파이펫으로 PBS를 제거하고 48웰 플레이트의 각 웰에 실온 해리 효소(예: 트립LE 익스프레스)를 250 μL을 추가합니다. 장갑을 변경하고, 접시를 청소하고, 37°C 인큐베이터에 해리 효소로 접시를 놓습니다.
- 5분마다 현미경으로 세포 해리를 관찰하십시오.
참고: 2D로 배양된 장 오르가노이드를 단일 세포로 해리하는 데는 약 15분이 걸립니다. 이 시간은 얼마나 많은 오르가노이드가 처음에 씨앗과 감염되었는지뿐만 아니라 병원균에 따라 달라지므로 일부 병원균이 더 세포병증이며 오르가노이드가 다른 병원균보다 훨씬 빨리 해리되도록 할 필요가 있습니다. - 명백한 단세포 현탁액의 확인에 따라, 48웰 플레이트의 웰당 10%의 FBS를 포함하는 DMEM/F12 배지의 250 μL을 추가하여 플레이트를 다시 세포 배양 후드로 가져와 소화를 중지한다.
- P1000 파이펫을 사용하여 세포를 15mL 원상 관으로 수집합니다.
- 장갑을 변경하고 튜브를 청소하고 샘플을 500 x g에서 4 °C에서 5 분 동안 회전시.
- P1000을 사용하여 미디어/해리 효소를 조심스럽게 제거하여 하단에 세포 펠릿을 유지합니다. 0.1% BSA를 포함하는 PBS의 최소 부피에서 단일 세포를 다시 중단합니다. 장 가루노이드의 경우 48웰 플레이트의 각 웰에 대해 250 μL로 재중단하십시오.
- 큰 덩어리를 제거하고 얼음에 세포를 포함하는 FACS 튜브를 배치하는 필터와 FACS 튜브에 세포 서스펜션을 전달합니다.
- 4.6단계로 진행하여 마스터 믹스의 셀 계산 및 준비를 계속한다.
- 3D 오르가노이드의 감염의 경우 인큐베이터에서 플레이트를 제거하고 세포 배양 후드에 놓습니다.
- P1000 파이펫으로 24웰 플레이트의 각 웰에서 분화 매체를 제거합니다. 500 μL의 얼음 차가운 1x PBS를 각 우물에 넣고 얼음에 3분 동안 배양합니다.
- ECM 솔루션의 완전한 중단을 보장하려면 P1000 파이펫(450 μL으로 설정)을 사용합니다. 파이펫 을 위아래로 10 번 PBS, ECM 용액 및 오르가노이드를 재일시 중단; 재중단된 오르가노이드를 15mL 원물 튜브로 옮기고 얼음 위에 놓습니다. 자신의 15 mL 원문 튜브에서 각 감염 상태를 수집합니다.
참고: 15mL 원상관을 사용하면 50mL 원상 관 또는 1.5mL 튜브보다 더 좋고 더 뚜렷한 세포 펠릿을 제공합니다. - 장갑을 변경하고 세포 배양 후드에서 튜브를 제거합니다. 튜브의 외부를 청소합니다.
- 샘플을 500 x g에서 4°C에서 5분 동안 회전시.
- 튜브를 다시 세포 배양 후드로 이동하고 P1000 파이펫으로 PBS를 제거하여 튜브 바닥에서 오르가노이드 펠릿을 다시 중단하지 않도록하십시오.
- 절단 효소 (예를 들어, 트립LE 익스프레스)의 1 mL에서 펠릿을 다시 중단합니다. 장갑을 변경하고 튜브를 청소하고 샘플을 37 °C에서 배양합니다.
- 30분마다 10분마다 튜브를 세포 배양 후드로 다시 이동하고 P1000 파이펫으로 위아래로 파이프를 10번 배양하여 오르가노이드를 다시 중단합니다.
참고: 일반적으로 장 내장 은 3D에 감염 될 때 단일 세포 현탁액을 형성 하기 위해 약 30 분 필요. - 오르가노이드가 단일 세포로 해리되는 시기를 확인하려면 p10 파이펫을 사용하여 오가노이드 서스펜션의 10 μL을 복용하십시오.
- 일회용 플라스틱 셀 카운터 슬라이드에 서스펜션을 놓습니다. 명확한 테이프로 샘플 입력 포트를 밀봉합니다.
- 장갑을 변경하고 셀 카운터의 외부를 청소합니다. 밝은 필드 현미경을 사용하여 단일 세포 현탁액이 이루어지는지 여부를 결정합니다.
- 단일 셀 서스펜션의 확인에 따라, P1000 파이펫으로 10% FBS 및 파이펫을 10배 위아래로 포함하는 DMEM/F12 매체 1mL을 추가하여 소화를 중지합니다.
- 장갑을 변경하고 튜브를 청소하고 샘플을 500 x g에서 4 °C에서 5 분 동안 회전시.
- 조심스럽게 튜브의 바닥에서 세포 펠릿을 다시 중단하지 않도록 P1000 파이펫으로 미디어 / 해리 효소를 제거합니다.
- 0.1% BSA를 포함하는 PBS의 최소 부피에서 단일 세포를 다시 중단합니다. 장 내장 의 경우 250 μL에서 재중단.
- 큰 덩어리를 제거하고 얼음에 세포를 포함하는 FACS 튜브를 배치하는 필터와 FACS 튜브에 세포 서스펜션을 전달합니다.
- 4.6단계로 진행하여 마스터 믹스의 셀 계산 및 준비를 계속한다.
- 일회용 플라스틱 셀 카운팅 챔버에 셀 서스펜션의 10 μL을 추가하여 μL당 세포 수를 결정합니다.
- 이 단계에서와 같이 세포 배양 후드에서 샘플을 제거하기 전에 명확한 테이프로 샘플 입력 포트를 밀봉, 이 단계에서와 같이, 세포 현탁액은 여전히 전염성이 있다.
- 장갑을 변경하고, 세포 계수 챔버를 청소하고, 밝은 필드 현미경을 사용하여 세포 수를 계산합니다.
- 세포 배양 후드 내부에는 실험시 샘플 수에 따라 제조업체의 지침에 따라 RT 시약, 템플릿 스위치 올리고, 감소제 B 및 RT 효소 C의 마스터 믹스를 제조업체의 지침에 따라 1.5mL 튜브로 준비한다. 각 샘플에 대해 마스터 믹스 33.4 μL을 PCR 튜브에 넣고 얼음 위에 보관합니다.
- 제조업체의 지침에 설명된 대로 대상 세포 수에 따라 셀과 물을 마스터 믹스에 추가합니다.
참고: 세포의 50%-60%는 일반적으로 복구됩니다(즉, 칩에 10,000개의 셀을 로드할 때, 5,000-6,000개의 세포가 분석에 사용됩니다). 따라서 항상 10,000개의 셀을 로드합니다. 세포 밀도가 이를 허용하지 않으면 세포를 원심분리하고 더 낮은 부피로 다시 중단합니다. 이 칩의 막힘 귀착될 것이기 때문에 칩을 과부하하지 않도록주의하십시오. 추가적으로, 세포가 제대로 해리되지 않는 경우에, 비드 당 다중 세포를 얻기의 증가한 리스크가 있을 것입니다, 다운스트림 생물정보학 처리에서 제거될 필요가 있을 것입니다. - 장갑을 변경하고, 단일 셀 컨트롤러를 세포 배양 후드로 이동하고, 칩이 밀봉되지 않은 개스킷으로만 덮여 있기 때문에 칩을 준비한다.
참고: 기계는 감염된 세포 현탁액 및 잠재적인 에어로졸에 노출되는 것을 방지하기 위하여 후드 안에 있어야 합니다. - 단일 셀 칩을 칩 홀더에 넣고 사용하지 않은 차선을 50% 글리세롤로 채웁니다.
- 제조업체의 지침에 따라 샘플에 사용되는 레인에 마스터 믹스, 비즈 및 분할 오일을 추가합니다.
- 개스킷으로 칩을 덮고 칩을 컨트롤러에 로드하고 프로그램을 시작합니다.
참고: 8개의 레인 중 6개만 로드하는 것이 좋습니다. 부적절한 에멀젼 문제가 종종 차선 1과 8차선에서 발생합니다. 회사는 모든 차선이 독립적이며, 이것은 발생하지 않아야한다고 말한다; 그러나 가능하다면 이 두 차선을 피하고 8개의 샘플이 필요한 경우 두 개의 칩을 실행합니다. - 프로그램이 완료되면 칩과 개스킷을 제거합니다.
- 멀티채널 파이펫을 사용하고 에멀젼의 100 μL을 깨끗한 PCR 튜브로 옮기십시오. 각 우물에 완전한 에멀젼이 발생했음을 나타내는 균일한 흰색 색이 있는지 확인합니다.
- 장갑을 교체하고 튜브를 청소하고 PCR 튜브를 PCR 기계로 전송하여 100 μL 반응을 지원할 수 있습니다. 프로그램 실행: 45분 동안 53°C; 85 °C 5 분 동안.
- 완료되면 샘플을 4°C로 저장합니다. 이 시점에서, 제조업체의 지시에 따라 반응을 처리하거나 3일 동안 4°C 또는 -20°C에서 1주일 동안 저장한다.
- 85°C에서 5분 후, 대부분의 봉투 바이러스는 정상적인 작동 절차에 따라 BSL-3로부터 cDNA를 제거하고 BSL-1 실험실에서 라이브러리 준비를 수행한다.
참고: 이 실험은 각 세포 유형의 분화 정도가 각 실험 사이에 약간 다를 수 있기 때문에 3개의 생물학적 복제(예를 들어, 3일)로 수행될 필요가 있다. 결과 시퀀싱 라이브러리는 하나의 시퀀싱 실행에서 서로 다른 인덱싱 및 시퀀싱될 수 있습니다.
결과
단세포 시퀀싱을 위한 오르가노이드 준비
단일 셀 염기 서열 결과는 양질의 셀 사용에 크게 의존합니다. 오르가노이드가 양호한 지 확인하려면, 분할할 준비가 되었는지 결정하기 위해 매일 제대로 유지 관리되고 관찰되어야한다(그림 2). 분리 오르가노이드의 타이밍은 기증자 의존적입니다. 일부 기증자는 더 빨리 성장하고 5 일마다 분할될 필요가 있는 반면, 다른 기증자는 느리고 10 일마다 분할될 필요가 있습니다. 평균적으로, 오르가노이드는 센터가 어두워지면 일주일에 한 번 분할됩니다(그림 2B). 오르가노이드가 너무 커지고 중앙에 너무 많은 죽은 세포를 축적할 수 있다면 오르가노이드가 죽게 됩니다.
오르가노이드는 Wnt3A의 높은 양을 포함하는 매체에서 유지됩니다. 이것은 줄기 세포 틈새 시장을 지원하고 성장하고 확산하기 위하여 오르가노이드를 승진시다. 이러한 성장 조건 하에서, 오르가노이드는 고량의 줄기 세포와 통과 증폭 세포와 성숙한 장신구, 잔성 세포 및 장내 세포와 같은 분화세포 집단의 더 적은 양을 함유하고 있다. 그러나, 인간 장 내에서 발견 되는 세포 복잡성을 모방 하기 위해, 세포 분화를 밀어 이러한 세포의 더 많은 생산 하는 것이 중요 하다. 이는 미디어 조건을 변경하고 Wnt3A를 제거하고 R-스폰딘과 노긴(표1)을줄임으로써 달성된다. 일반적으로, 장신구, 잔성 세포 및 장내 분비 세포를 향한 세포 분화는 4일간의 분화매체(도 3)를필요로 한다. 좋은 차별화를 얻는 것이 핵심입니다. 그렇지 않으면 병원체 트로피즘 과 세포 유형 별 반응을 평가하는 것이 어려워집니다.
BSL-3 병원균 불활성화 확인
완전한 불활성화는 선택의 병원체로 확인되어야 하며 BSL-3에서 cDNA를 제거하는 것이 안전하다는 것을 검증해야 합니다. SARS-CoV-2의 경우, SARS-CoV-2의 100 μL을 복용하고 85°C에서 5분 동안 PCR 기계로 배양함으로써 바이러스의 완전한 비활성화가 검증되었다. 바이러스는 그 때 순진한 Vero 세포에 다시 추가되고, 바이러스 감염은 모든 입자가 더 이상 전염되지 않았는지 확인하기 위하여 24 시간, 48 시간 및 72 시간 감염에 면역 형광 및 플라크 분석에 의해 비열 처리된 바이러스와 비교되었습니다. 이러한 결과는 현지 규제 기관에 보내졌으며, 승인시 단일 세포 실험 및 cDNA 처리가 수행되었다.
단일 셀 염기서열 분석 결과
SARS-CoV-2가 인간 결장 및 ileum organoids를 어떻게 감염시키는지 평가하기 위해 단세포 시퀀싱이 수행되었습니다. 오르가노이드는 위에서 설명한 대로 제조되었고 SARS-CoV-2에 의한 정압 감염을 허용하기 위해 2D 형식으로 감염되었다. 감염된 세포는 감염 후 12시간 및 24시간에서 수확되었고 위에서 설명한 바와 같이 단일 세포 염기서열분석용으로 처리되었다. 단세포 염기서열 분석으로 인간 장상피세포의 하위집단(미성숙 장신구 2)만이 SARS-CoV-2(도4)의감염을 지원한다는 것을 확인할 수 있었습니다. 또한, 인구내의 모든 세포가 감염되지 않았기 때문에 감염된 세포와 비감염방관세포(도 5)를분석하였다. 이러한 결과는 SARS-CoV-2가 감염된 세포에서 프로 염증 신호 캐스케이드를 유도한 반면 비감염방관 세포는 인터페론 매개 면역 반응을 보였다는 것을 보여주었다. 또한, scRNA-Seq는 감염된 세포가 통로의 바이러스 매개 막힘으로 인해 인터페론을 감지할 수 없음을보여주었다(도 5). 벌크 RNA 염기서열 분석 사용 시 이 정보를 얻을 수 없었다.

도 1: 장내 병원균감염에 대한 인간 장 가구노이드를 준비하는 세 가지 방법을 묘사한 회로도. Apical 감염은 2D에 있는 장 기관가노이드를 파종하여 달성될 수 있습니다. 3D 오르간노이드를 방해하여 기형 및 바식자 감염이 수행될 수 있습니다. 마지막으로, 바소포탈 전용 감염은 3D 장 내장 내장을 감염시킴으로써 수행될 수 있다. 이러한 각 메서드는 단일 셀 시퀀싱을 위한 샘플을 생성하는 데 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
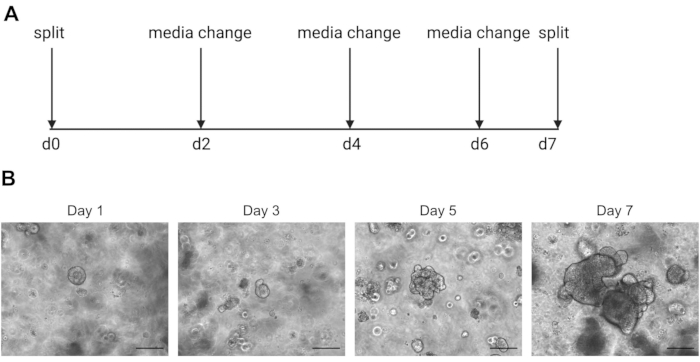
그림 2: 오르가노이드 유지 보수 회로도 및 대표적인 브라이트 필드 이미지. (A)인간 장 가구의 유지 보수 및 패시징을위한 회로도. (B).대표 브라이트필드 이미지 1일, 3, 5, 7 후 분할. 7일째가 되면 오르가노이드는 죽은 세포의 축적으로 인해 크고 어두워지고 분할될 준비가 되어 있습니다. 스케일 바는 25 μm을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
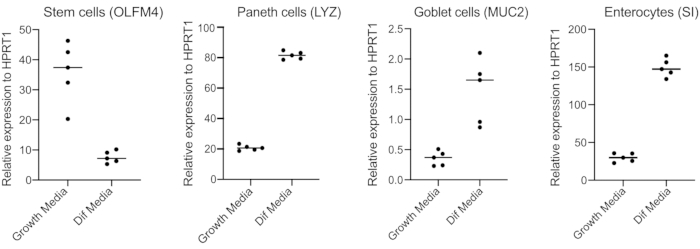
그림 3: 인간 장 가구형의 대표적인 qPCR 4일 후 분화 매체로 전환. 장 내 오르가노이드는 성장 매체에서 유지되거나 4일 동안 분화 매체로 전환되었다. RNA는 줄기 세포(OLFM4), 창세포(LYZ), 잔류 세포(MUC2), 및 장신구(SI)의 마커를 위해 기재되었다. N = 5. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
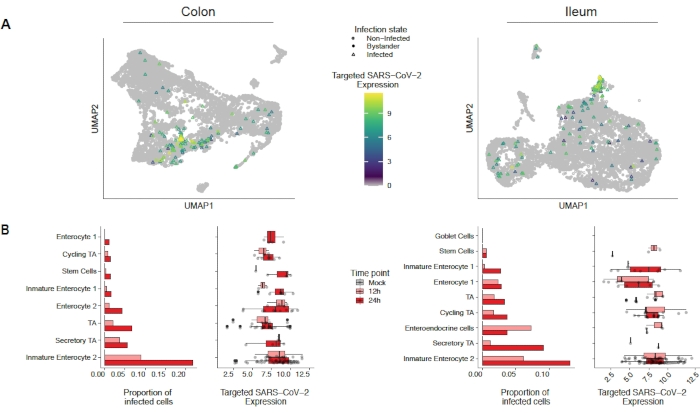
그림 4: SARS-CoV-2에 의해 감염된 세포 집단의 식별. 인간 결장 및 일루 유래 오르가노이드는 SARS-CoV-2에 감염되었다. 12 및 24 h 후 감염 후 세포가 수확되고 SARS-CoV-2 감염을 지원하는 세포 집단을 확인하기 위해 단세포 RNA 염기서열분석을 실시하였다. 바이러스 감염은 시간이 지남에 따라 증가하고 주로 미성숙 장내 2를 감염시키는 것으로 나타났습니다. 이 수치는 트리아나 외19에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
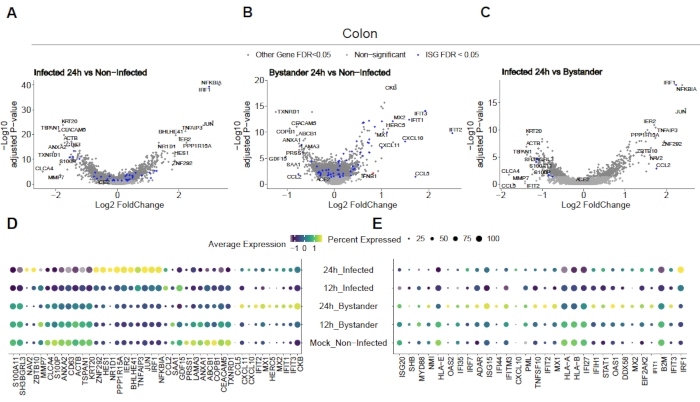
그림 5: 본질적인 타고난 면역 반응의 결정. 인간 결장 유래 오르가노이드는 SARS-CoV-2에 감염되었다. 12 및 24h 감염 후 세포가 수확되고 바이러스 감염 및 비감염 방관자 세포 모두에서 본질적인 타고난 면역 반응을 결정하기 위해 단일 세포 RNA 시퀀싱을 실시하였다. SARS-CoV-2 감염된 세포는 강력한 프로 염증 반응을 보였고 비감염방관 세포는 인터페론 매개 반응을 표시하였다. 트리아나 외19에서수정된 그림. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 성장 미디어 | |
| 화합물 | 최종 농도 |
| 광고 DMEM/F12 | 글루타맥스 (1X) |
| +글루타맥스 | 헤페스 1 mM |
| +헤페 | 펜 10 U/mL |
| +P/S | 스트렙 10 μg/mL |
| L-WRN | 볼륨별 50% |
| B27 | 01:50 |
| N-아세틸 시스테인 | 1 mM |
| EGF | 50 ng/mL |
| A83-01 | 500 nM |
| IGF-1 | 100 ng/mL |
| FGF 기본 | 50 ng/mL |
| 가스트린 | 10mM |
| 차별화 미디어 | |
| 화합물 | 최종 농도 |
| 광고 DMEM/F12 | 글루타맥스 (1x) |
| +글루타맥스 | 헤페스 1 mM |
| +헤페 | 펜 10 U/mL |
| +P/S | 스트렙 10 μg/mL |
| B27 | 01:50 |
| N-아세틸 시스테인 | 1 mM |
| R-스폰딘 | 볼륨별 5% |
| 머리 | 50 ng/mL |
| EGF | 50 ng/mL |
| 가스트린 | 10mM |
| A83-01 | 500 nM |
표 1: 성장 및 차별화 미디어를 위한 미디어 구성.
토론
장내 병원균은 가장 자주 장의 루멘을 마주보고 있는 그들의 정액 측에서 장 상피 세포를 감염시킴으로써 그들의 수명 주기를 시작합니다. 오르가노이드는 장 상피의 세포 복잡성과 조직을 재현하는 좋은 모델로 잘 인식되지만, 3차원, 폐쇄형 구조로 조직된 조직은 항문 막을 병원균에 접근할 수 없게 만듭니다. 이 프로토콜은 그들의 apical 측, 그들의 basolateral 측, 또는 BLS-3 병원체둘다에서 장 기관가노이드를 감염시키는 방법을 기술했습니다. 이러한 프로토콜은 BSL-2 또는 BLS-3 봉쇄 또는 아래에 강조되는 몇 가지 중요한 단계를 수행하여 다른 오르가노이드 모델 하에서 모든 장내 병원균을 연구하도록 쉽게 적응할 수 있습니다. 상술한 방법은 독일의 규정에 따라 단세포 물방울의 격리 및 준비를 위한 것입니다. 면책 조항으로, 이 프로토콜은 BSL-3 조건하에서 작업하는 동안 취해야 할 생물 안전 처리 조치 (표준 운영 절차)를 설명하지 않습니다. 또한 규제가 다른 나라에서 다를 수 있으며 모든 현지 규정이 존중되도록 지방 당국에 연락해야 한다고 주장하는 것도 중요합니다.
apical 감염을 위한 2개의 차원에서 유기체를 종자하는 중요한 단계의 한개는 세포가 고전적인 3차원 오르가노이드로 성장할 때와 비교될 것이라는 것을 통제하고 있습니다. 장 내 병원체에 따라, 트로피즘은 매우 희소한 세포 또는 높게 분화될 필요가 있는 세포에 제한될 수 있었습니다. 이 경우 완전히 분화하지 않은 2차원 오르가노이드를 사용하면 이 장 병원체가 장 가구를 감염시킬 수 없다는 잘못된 결론을 초래할 수 있습니다. 가능하면 이 프로토콜의 세 가지 구성을 사용하여 감염을 수행하는 것이 좋습니다: apical 감염을 위한 2D 오르간성 (섹션 2), apical 및 basolateral 감염을 위한 오픈 3D 오르노이드 (섹션 3), 그리고 바소포 감염전용 전체 3D 오르가노이드 (섹션 3). 이 접근법은 병원체 (apical 대 바소포탈)의 진입 경로를 분별하는 데 도움이되며 유사한 수준의 차별화가 달성되었음을 제어 할 것입니다. 2D 정형 감염에 대한 대안은 3D 오르간로이드를 사용하지만 병원균을 apical 측으로 직접 전달하는 미세 주입입니다 (자세한 내용은 Bartfeld 외27 참조). 이 방법은 병원체가 제대로 배치되고 오르가노이드가 그대로 유지되도록 숙련 된 인젝터가 필요합니다. 미세 주입은 일반적으로 BSL-2 봉쇄에서 사용되며 BSL-3 봉쇄에 적합하지 않을 수 있습니다.
2D 시드 오르가노이드에서 감염 실험을 수행할 때 추가적인 중요한 고려 사항은 최종 세포 밀도입니다. 2.3 단계에서 언급했듯이, 100-150 개의 오르가노이드는 48 웰 플레이트 또는 8 웰 유리 바닥 챔버 슬라이드의 한 우물에서 시드됩니다. 오르가노이드 라인과 오르가노이드를 처리하는 사람에 따라, 이러한 오르가노이드의 크기는 크게 다를 수 있습니다. 이것은 48 웰 플레이트 또는 8 웰 유리 바닥 챔버 슬라이드에서 매우 다른 세포 밀도귀착될 수 있습니다. 장 내 바이러스에 따라, 일부 바이러스는 더 희소 한 세포를 선호, 다른 사람은 또한 confluent 세포를 감염시킬 수 있을 것입니다 동안. 다른 세포 합류에 대한 감염성의 이러한 차이의 분자 기원은 명확하지 않다; 따라서, 선택의 장내 병원체에 대한 최상의 세포 밀도를 찾는 것을 목표로 하는 파일럿 실험은 추가 하류 특성화를 수행하기 전에 수행되어야 한다.
종종 FACS 정렬은 단일 셀 액적 에멀젼을 수행하기 전에 수행됩니다. 이 단계는 종종 이중에서 살아있는 세포 및 단하나 세포에서 죽은 분리하는 데 사용됩니다. BSL-3 병원균과 함께 작업할 때, 시설에 적절한 FACS 선별기가 장착되어 있어야 하는데, 이는 종종 그렇지 않습니다. 또한, 오르가노이드의 모든 세포가 동일한 크기를 갖는 것은 아니며, 종종 이중 또는 더 큰 세포 를 구별하기 어렵기 때문에 특정 세포 유형에 대해 부정적으로 선택할 위험이 있습니다. 또한, 각 샘플에 대해 5,000-10,000 사이의 정렬에 필요한 시간이 개별 세포의 성적 증명서 프로파일을 크게 수정할 수 있는지 여부에 대해 여전히 논의되고 있다. 단일 셀 시퀀싱(예를 들어, 메탄올 및 RNAassist)과 호환되는 세포 고정 방법이 기재되었지만, 이는 시퀀싱18의품질 저하로 이어지는 것으로 관찰되었다. 마지막으로, 세포 사멸 마커를 사용하여 세포를 분류하는 것도 편견으로 이어질 수 있다고 의심된다. 지하실-빌리 축을 통해 세포의 방향 증식 및 분화를 감안할 때, 가장 분화 된 세포, 창고 및 방출 될 것 이다, villi의 끝에 위치 하 고 있습니다. 이 세포는 세포 죽음 통로의 다른 마커에 대 한 종종 긍정적인 (예를들어, 세포 사 멸, 괴 사, 그리고 necroptosis); 그러나, 마우스 장의 로타바이러스 감염을 볼 때, 빌리의 끝은 가장 감염된영역(28)이다. 따라서, 죽음 마커에 대 한 긍정적인 보일 수 있는 세포를 필터링 생리 감염을 나타낼 수 있는 감염 된 세포의 부정적인 선택 귀착 될 것 이다. 현재 단일 셀 시퀀싱 전에 오르가노이드를 분류하고 고정하는 데 좋은 솔루션이 없습니다. 적합한 대체 프로토콜을 찾기 위해 추가 연구가 필요하므로 라이브, 분류되지 않은 세포를 사용하는 것이 좋습니다.
단세포 시퀀싱은 세포 반응을 평가하는 방법에 혁명을 일으켰습니다. 이 기술은 기저 조건 과 병원체 감염의 밑에 세포 혈통 특정 반응의 확인을 허용합니다. 이 메서드는 이전에 대량 판독에 의해 제한 된 많은 필드에 문을 열었습니다. 이 방법은 매우 강력하지만 한계가 있습니다. 주요 제한사항은 시퀀싱의 하류에 필요한 광범위한 생물정보 분석입니다. 조직을 분석하고 현재 주석이없는 세포 유형을 할당 할 때 이것은 특히 중요합니다. 숙련 된 생물 정보 학자를 갖는 것은 모든 단세포 연구를 지원하기 위해 필요합니다.
이 프로토콜은 인간 장 가구를 종자 및 처리하는 방법을 설명하고, 장 내 병원균으로 감염시키고, scRNAseq을 수행하는 방법을 설명합니다. 오르가노이드 모델 시스템이 대부분의 장기를 위해 개발되었기 때문에 다른 장기에 이 접근법을 적응시킬 수 있습니다. 폐와 간 오르가노이드는 장 가내장에 비해 유사하게 조직되며, 유사하게 이 오르가노이드로 전이될 수 있습니다. 중요한 제어는 2차원으로 성장하거나 금이 간 때 이러한 오르가노이드가 3D 오르가노이드와 유사한 분화를 달성한다는 것을 확인하는 것입니다. 분화된 상태를 정의하는 특정 특징 및 유전자는 각 기관 모형에 대해 특이합니다. 신장 과 혈관 오르가노이드, 큰 조밀 한 구조와 같은 다른 오르간성 모델은 이러한 구조를 단일 세포로 연속적으로 해리하는 추가 방법이 필요합니다.
공개
저자는 경쟁 적인 재정적 이익을 선언하지 않습니다.
감사의 말
메건 스타니퍼와 스티브 불란트는 도이치 포르스충스게마인샤프트(DFG)의 연구 보조금으로 지원되었다: (프로젝트 번호 240245660, 278001972, 415089553, 272983813 베이브 불란트와 메건 스타니퍼로 416072091), 바덴뷔르템베르크 와 분데스장관 빌둥 und Forschung BMBF 01KI20239B와 MS 및 01KI20198A 및 (NUM-COVID 19, 오가노-0 Strat1KX201) 바이오 프로틱스에 설립되었다.
자료
| Name | Company | Catalog Number | Comments |
| Recombinant mouse noggin | Peprotech | Cat#250-38 | |
| [Leu15]-Gastrin I | Sigma-Aldrich | Cat# G9145 | |
| 0.05% Trypsin-EDTA | Thermo Fischer Scientific | Cat#25300054 | |
| 24-well non-cell culture treated plate | Corning | Cat#3738 | |
| 8-well glass bottom chamber slide | iBIDI | Cart#80827 | |
| A83-01 | Tocris | Cat#2939 | |
| Advanced DMEM/F12 | Thermo Fischer Scientific | Cat# 12634010 | |
| B27 | Thermo Fischer Scientific | Cat#17504-044 | |
| Chromium Controller & Next GEM Accessory Kit | 10X Genomics | Cat#1000202 | Used in the preparation of single cell solution and preparation of Gel beads-in-emulsion (GEM) |
| Chromium Next GEM Chip G Single Cell Kit | 10X Genomics | Cat #1000127 | Used in the preparation of single cell solution and preparation of Gel beads-in-emulsion (GEM) |
| Chromium Next GEM Single Cell 3′ Kit v3.1 | 10X Genomics | Cat#1000268 | Used in the preparation of single cell solution and preparation of Gel beads-in-emulsion (GEM) |
| Collagen from human placenta | Sigma Aldrich | Cat#C5533-5MG | |
| CYP34A forward | Eurofins | GATGGCTCTCATCCCAGACTT | Primers used to check for differentiation |
| CYP3A4 reverse | Eurofins | AGTCCATGTGAATGGGTTCC | Primers used to check for differentiation |
| DMEM/F12 | Thermo Fischer Scientific | Cat#11320074 | |
| EDTA | Sigma Aldrich | Car#E9884 | |
| Fast Read 102 counting slides | Biosigma | Cat# BVS100 | |
| Fetal Bovein Serum (FBS) | Capricorn | Cat#FBS-12A | |
| GlutaMAX | Thermo Fischer Scientific | Cat# 35050061 | |
| HEPES | Thermo Fischer Scientific | Cat3 15630080 | |
| L-WRN cells | ATCC | CRL-3276 | This cell line is used to make the conditioned media containg Wnt 3A, R-Spondin and Noggin. The protocol for the production of the conditioned media can be found on the manufacterures site. |
| MatriGel. GFR, LDEV free | Corning | Cat#354230 | |
| MUC-2 forward | Eurofins | TGTAGGCATCGCTCTTCTCA | Primers used to check for differentiation |
| MUC-2 reverse | Eurofins | GACACCATCTACCTCACCCG | Primers used to check for differentiation |
| N-acetyl-cysteine | Sigma Aldrich | Cat# A9165 | |
| OLMF4 forward | Eurofins | ACCTTTCCCGTGGACAGAGT | Primers used to check for differentiation |
| OLMF4 reverse | Eurofins | TGGACATATTCCCTCACTTTGGA | Primers used to check for differentiation |
| Penicillin/Streptomycin | Thermo Fischer Scientific | Cat#15140122 | |
| Recombinant human FGF basic | Peprotech | Cat#100-18B | |
| Recombinant human IGF-1 | BioLegend | Cat#590904 | |
| Recombinant mouse EGF | Thermo Fischer Scientific | Cat# PMG8043 | |
| SI forward | Eurofins | AATCCTTTTGGCATCCAGATT | Primers used to check for differentiation |
| SI reverse | Eurofins | GCAGCCAAGAATCCCAAT | Primers used to check for differentiation |
| TrypLE Express | Thermo Fischer Scientific | Cat#12605036 | |
| Y-27632 | Caymann Chemicals | Cat#10005583 |
참고문헌
- Kretzschmar, K., Clevers, H. Organoids: Modeling development and the stem cell niche in a dish. Developmental Cell. 38, 590-600 (2016).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Tekes, G., Ehmann, R., Boulant, S., Stanifer, M. L. Development of feline ileum- and colon-derived organoids and their potential use to support feline coronavirus infection. Cells. 9, (2020).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375, 409-424 (2019).
- Zhou, J., et al. Infection of bat and human intestinal organoids by SARS-CoV-2. Nature Medicine. 26, 1077-1083 (2020).
- Sato, T., Clevers, H. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications. Science. 340, 1190-1194 (2013).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470, 105-109 (2011).
- de Graaf, M., van Beek, J., Koopmans, M. P. Human norovirus transmission and evolution in a changing world. Nature Reviews Microbiology. 14, 421-433 (2016).
- Leshem, E., et al. Real-world effectiveness of pentavalent rotavirus vaccine among bedouin and jewish children in southern Israel. Clinical Infectious Diseases : An Official Publication of the Infectious Diseases Society Of America. 62, 155-160 (2016).
- Karst, S. M. The influence of commensal bacteria on infection with enteric viruses. Nature Reviews Microbiology. 14, 197-204 (2016).
- Ettayebi, K., et al. Replication of human noroviruses in stem cell-derived human enteroids. Science. 353, 1387-1393 (2016).
- de Wit, E., van Doremalen, N., Falzarano, D., Munster, V. J. SARS and MERS: recent insights into emerging coronaviruses. Nature Reviews Microbiology. 14, 523-534 (2016).
- Scaldaferri, F., et al. The thrilling journey of SARS-CoV-2 into the intestine: From pathogenesis to future clinical implications. Inflammatory Bowel Diseases. 26, 1306-1314 (2020).
- Kipkorir, V., Cheruiyot, I., Ngure, B., Misiani, M., Munguti, J. Prolonged SARS-CoV-2 RNA detection in anal/rectal swabs and stool specimens in COVID-19 patients after negative conversion in nasopharyngeal RT-PCR test. Journal of Medical Virology. 92, 2328-2331 (2020).
- Lamers, M. M., et al. SARS-CoV-2 productively infects human gut enterocytes. Science. 369, 50-54 (2020).
- Stanifer, M. L., et al. Critical role of type III interferon in controlling SARS-CoV-2 Infection in human intestinal epithelial cells. Cell Reports. 32, 107863 (2020).
- Triana, S., et al. Single-cell transcriptomics reveals immune response of intestinal cell types to viral infection. bioRxiv. , (2020).
- Triana, S., et al. Single-cell analyses reveal SARS-CoV-2 interference with intrinsic immune response in the human gut. Molecular Systems Biology. 17, 10232 (2021).
- Tang, F., et al. mRNA-Seq whole-transcriptome analysis of a single cell. Nature Methods. 6, 377-382 (2009).
- Hwang, B., Lee, J. H., Bang, D. Single-cell RNA sequencing technologies and bioinformatics pipelines. Experimental & Molecular Medicine. 50, 1-14 (2018).
- García-Rodríguez, I., Sridhar, A., Pajkrt, D., Wolthers, K. C. Put some guts into it: Intestinal organoid models to study viral infection. Viruses. 12, 1288 (2020).
- Stanifer, M. L., et al. Asymmetric distribution of TLR3 leads to a polarized immune response in human intestinal epithelial cells. Nature Microbiology. 5, 181-191 (2020).
- Lees, E. A., et al. Using human induced pluripotent stem cell-derived intestinal organoids to study and modify epithelial cell protection against salmonella and other pathogens. Journal of Visualized Experiments: JoVE. (147), e59478 (2019).
- Mahe, M. M., Sundaram, N., Watson, C. L., Shroyer, N. F., Helmrath, M. A. Establishment of human epithelial enteroids and colonoids from whole tissue and biopsy. Journal of Visualized Experiments: JoVE. (97), e52483 (2015).
- Fujii, M., et al. Human Intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Bartfeld, S., Clevers, H. Organoids as model for infectious diseases: Culture of human and murine stomach organoids and microinjection of Helicobacter Pylori. Journal of Visualized Experiments: JoVE. (105), e53359 (2015).
- Hernandez, P. P., et al. Interferon-lambda and interleukin 22 act synergistically for the induction of interferon-stimulated genes and control of rotavirus infection. Nature Immunology. 16, 698-707 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유