Method Article
Adaptation des organoïdes gastro-intestinaux à l’infection pathogène et au séquençage unicellulaire dans des conditions de biosécurité de niveau 3 (BSL-3)
Dans cet article
Résumé
Ce protocole décrit comment infecter les organoïdes intestinaux humains de leur côté apical ou basolatéral pour caractériser les interactions hôte/pathogène au niveau de la cellule unique à l’aide de la technologie de séquençage de l’ARN unicellulaire (scRNAseq).
Résumé
Les organoïdes intestinaux humains constituent le meilleur modèle cellulaire pour étudier les infections pathogènes du tractus gastro-intestinal. Ces organoïdes peuvent être dérivés de toutes les sections du tractus gastro-intestinal (gastrique, jéjunum, duodénum, iléon, côlon, rectum) et, lors de la différenciation, contiennent la plupart des types de cellules que l’on trouve naturellement dans chaque section individuelle. Par exemple, les organoïdes intestinaux contiennent des entérocytes absorbant les nutriments, des cellules sécrétoires (Goblet, Paneth et entéroendocrinien), des cellules souches, ainsi que tous les intermédiaires de différenciation spécifiques à la lignée (par exemple, les types de cellules précoces ou immatures). Le plus grand avantage de l’utilisation d’organoïdes dérivés du tractus gastro-intestinal pour étudier les maladies infectieuses est la possibilité d’identifier avec précision quel type de cellule est ciblé par l’agent pathogène entérique et de déterminer si les différentes sections du tractus gastro-intestinal et leurs types de cellules spécifiques répondent de la même manière aux défis pathogènes. Au cours des dernières années, des modèles gastro-intestinaux, ainsi que des organoïdes d’autres tissus, ont été utilisés pour étudier le tropisme viral et les mécanismes de la pathogenèse. Cependant, l’utilisation de tous les avantages de l’utilisation d’organoïdes lors de l’utilisation de virus hautement pathogènes représente un défi technique et nécessite des considérations strictes de biosécurité. De plus, comme les organoïdes sont souvent cultivés en trois dimensions, le côté basolatéral des cellules est orienté vers l’extérieur de l’organoïde tandis que leur côté apical est orienté vers l’intérieur (lumen) des organoïdes. Cette organisation pose un défi pour les agents pathogènes entériques, car de nombreuses infections entériques se déclenchent du côté apical/luminal des cellules après l’ingestion. Le manuscrit suivant fournira un protocole complet pour préparer les organoïdes intestinaux humains à l’infection par des agents pathogènes entériques en tenant compte du côté infectieux (apical vs basolatéral) pour effectuer un séquençage de l’ARN unicellulaire afin de caractériser les interactions hôte/pathogène spécifiques au type cellulaire. Cette méthode détaille la préparation des organoïdes ainsi que les considérations nécessaires pour effectuer ces travaux dans des conditions de confinement de niveau de biosécurité 3 (BSL-3).
Introduction
L’étude du tropisme spécifique au type cellulaire et de la réponse immunitaire spécifique au type cellulaire aux virus entériques humains a été historiquement difficile en raison de l’absence de modèles cellulaires humains primaires. Cette limitation a maintenant été partiellement éradiquée avec le développement d’organoïdes1. Dans le cas du tractus gastro-intestinal, des modèles organoïdes gastriques et intestinaux ont été développés pour les humains et plusieurs autres espèces (parexemple, murin, bovin, félin, chauve-souris)2,3,4,5,6. Les organoïdes intestinaux reproduisent l’architecture structurelle de l’épithélium intestinal humain et contiennent des structures ressemblant à des cryptes et des villosités, des lignées intestinales fonctionnelles et ont même été utilisés pour identifier des lignées cellulaires auparavant inconnues. Deux approches différentes peuvent être utilisées pour développer des organoïdes intestinaux. Tout d’abord, les cellules souches intestinales contenant des cryptes sont isolées à partir de résections tissulaires ou de biopsies et cultivées dans des conditions de culture spécifiques (par exemple, Wnt3A, R-spondine, Noggin et EGF) pour se dilater, puis différencient les cellules souches de la plupart des lignées cellulaires intestinales (parexemple, les entérocytes, les cellules Paneth, les cellules Gobelet, les cellules entéroendocrines)7. Cette méthode permet d’isoler les organoïdes de toutes les sections du tractus gastro-intestinal(parexemple, l’estomac, le duodénum, le jéjunum, l’iléon et le côlon). La deuxième méthode repose sur des cellules souches pluripotentes ou embryonnaires induites par l’homme, qui sont ensuite différenciées par étapes en cellules épithéliales intestinales8. Ces organoïdes induits à base de cellules souches sont souvent décrits comme étant de nature plus embryonnaire que les organoïdes dérivés du patient. Bien que tous ces modèles organoïdes aient été essentiels pour démêler les signaux de développement nécessaires à la formation du tractus intestinal, leur utilisation dans la recherche sur les maladies infectieuses en est encore à ses balbutiements.
Le virus entérique est un terme général couvrant tous les virus qui infectent par le tractus gastro-intestinal, tels que les picornavirus(parexemple, EV-71), les réovirus (par exemple, le rotavirus) et les calicivirus (par exemple, le norovirus)9. Les virus entériques initient leur cycle de vie infectieux par l’ingestion d’aliments et d’eau contaminés, ce qui expose les populations des pays en développement à un risque élevé en raison du rejet de déchets non traités dans l’environnement et du manque de soins médicaux après l’apparition de l’infection10. Selon le type d’agent pathogène, l’infection peut entraîner une gastro-entérite, des vomissements et / ou une diarrhée aqueuse en raison d’une fuite de la muqueuse intestinale. Les norovirus humains sont un agent pathogène entérique très répandu et hautement infectieux, qui entraîne plus de 600 millions d’infections et 15 millions d’hospitalisations dans le monde11. Les organoïdes ont joué un rôle clé dans la recherche sur les norovirus car ils soutiennent l’infection et la réplication du norovirus humain, qui ne pouvait auparavant pas être cultivé dans des modèles de culture cellulaire standard12.
Au cours des deux dernières décennies, les coronavirus sont devenus des agents pathogènes humains clés13. Cette famille comprend le MERS hautement pathogène, le SARS-CoV-1 et le SARS-CoV-2, qui nécessitent des confinements stricts des niveaux de sécurité lors de la recherche sur ces virus. Fait intéressant, bien que ces trois agents pathogènes soient principalement reconnus pour leurs symptômes respiratoires induits et leur détresse, il est maintenant évident que ces virus n’infectent pas seulement les voies respiratoires, mais aussi d’autres organes. Une pathologie importante induite chez les patients infectés par le SARS-CoV-2 en plus de la détresse respiratoire est la présence de symptômes gastro-intestinaux14. Une fraction des patients infectés par le SRAS-CoV-2 présente de tels symptômes, allant d’une diarrhée très légère à une diarrhée sévère. De plus, les génomes du SRAS-CoV-2 peuvent être détectés dans les biopsies des selles et du tractus gastro-intestinal de patients infectés15. Il est important de noter que la présence de symptômes gastro-intestinaux ne se limite pas au SRAS-CoV-2, car ils ont également été observés chez des patients infectés par le MERS et le SARS-CoV-1. Pour comprendre comment le SRAS-CoV-2 induit la détresse gastro-intestinale et identifier précisément le tropisme du SARS-CoV-2 dans le tractus gastro-intestinal, les organoïdes intestinaux humains ont été un outil clé et sont maintenant exploités pour démêler les réponses spécifiques au type cellulaire à cet agent pathogène16,17.
Le profilage transcriptionnel d’une population cellulaire (séquençage de l’ARN en vrac) est une pratique courante lors de l’évaluation des infections pathogènes des lignées cellulaires immortalisées ainsi que des organoïdes. Bien que cela nous permette de déterminer les changements globaux en réponse aux agents pathogènes (par exemple, la régulation à la hausse des cytokines), l’ARNiq en vrac ne nous permet pas de déterminer pourquoi des cellules spécifiques d’une population sont plus sujettes à l’infection que d’autres. Le séquençage de l’ARN unicellulaire (scRNAseq) est devenu un outil puissant pour démêler les programmes transcriptionnels spécifiques à la lignée cellulaire et peut être utilisé pour déterminer comment ces programmes soutiennent ou répriment l’infection virale18,19. La première description de scRNAseq date de 2009 et a été utilisée pour évaluer les profils de transcription des différentes cellules trouvées dans un blastomère de souris20. Ces technologies ont maintenant été étendues et peuvent être mises en œuvre via plusieurs plates-formes différentes. Les premières versions de cette technologie utilisaient un trieur de cellules activé par fluorescence (FACS) pour séparer les cellules individuelles pour le séquençage, qui était souvent limité à des plaques de 96 ou 384 puits, donnant ainsi 300 cellules individuelles à analyser par échantillon21. Ces méthodes ont maintenant été avancées par les plates-formes de séquençage unicellulaire, qui utilisent un dispositif microfluidique pour encapsuler des cellules individuelles dans des gouttelettes individuelles avec des billes contenant un code-barres. Cette technologie permet de capturer jusqu’à 10 000 cellules par condition d’échantillon.
La combinaison de la technologie organoïde avec scRNAseq nous permet d’étudier l’impact des agents pathogènes entériques sur le tractus gastro-intestinal d’une manière spécifique au type de cellule. Cependant, plusieurs considérations techniques et de biosécurité doivent être prises en compte. Tout d’abord, les méthodes classiques de culture d’organoïdes (organoïdes 3 dimensionnels (3D), intégrés dans une matrice extracellulaire (ECM)) exposent le côté basolatéral des cellules épithéliales à l’extérieur de l’organoïde. Comme les agents pathogènes entériques initient leur infection par l’ingestion d’aliments / d’eau contaminés, l’infection commence le plus souvent par le côté apical des cellules, qui n’est pas accessible dans ces organoïdes intestinaux 3D. Par conséquent, les organoïdes doivent être préparés à rendre le côté apical accessible à l’infection pathogène soit par ensemencement 2D, exposant ainsi directement le côté apical des cellules, soit par microinjection22,23. Deuxièmement, pour effectuer scRNAseq d’échantillons biologiques infectés, il est important de considérer leur nature infectieuse. Bien que des méthodes permettant de fixer les cellules et d’inactiver les agents pathogènes avant l’isolement unicellulaire pour l’ARSQ ultérieur aient été proposées, ces méthodes entraînent souvent une diminution de la qualité du séquençage18. Le protocole ci-dessous décrira plusieurs approches pour infecter les organoïdes intestinaux avec des virus entériques en tenant compte du côté infectieux (infection apicale vs basolatérale) (Figure 1). En outre, le protocole comprendra un flux de travail pour dissocier et isoler des cellules individuelles d’organoïdes infectés par des virus hautement pathogènes pour scRNAseq. Le protocole mettra en évidence les étapes clés qui doivent être mises en œuvre lorsque l’on travaille dans des conditions de confinement de niveau de biosécurité 3 (BSL-3) afin d’éviter la génération d’aérosols et la contamination potentielle.
Protocole
Le tissu humain a été reçu de la résection du côlon ou des biopsies de l’iléon de l’hôpital universitaire de Heidelberg pour le protocole suivant. Cette étude a été réalisée selon les recommandations de l’hôpital universitaire de Heidelberg avec le consentement écrit éclairé de tous les sujets conformément à la Déclaration d’Helsinki. Tous les échantillons ont été reçus et conservés de manière anonyme. Le protocole a été approuvé par la commission d’éthique de l’hôpital universitaire de Heidelberg en vertu du protocole S-443/2017.
1. Entretien et passage des organoïdes intestinaux et du côlon
ATTENTION : Les organoïdes intestinaux humains sont dérivés de tissus humains ou de cellules souches pluripotentes/embryonnaires induites, et à ce titre, une approbation éthique est requise. Les réglementations spécifiques à chaque pays doivent être suivies. Le matériel humain n’est généralement pas testé et est donc souvent considéré comme du matériel BSL-2. Des conditions de confinement appropriées doivent être confirmées dans le pays dans lequel l’expérience a lieu.
- Préparer les organoïdes intestinaux et colonaux à partir de tissus isolés et/ou de biopsies en utilisant les méthodes décrites précédemment2. En outre, des détails plus techniques sur la façon de préparer des organoïdes à partir de matériel dérivé du patient ou de CSPi peuvent être trouvés dans Lees et al. et Mahe et al.24,25.
- Une fois les cultures organoïdes établies, suivez la routine de fractionnement décrite ci-dessous pour préparer les organoïdes à effectuer des infections par des agents pathogènes entériques.
- Semer 20-100 organoïdes dans 50 μL de solution ECM à 100% dans des plaques traitées par culture non tissulaire à 24 puits. Ajouter 500 μL de milieu de croissance (Tableau 1) par puits.
- Changez le média tous les 2 jours en retirant 250 μL de l’ancien milieu et en ajoutant 250 μL du nouveau milieu de croissance à chaque puits. Réchauffez le support à la température ambiante avant de changer le support.
ATTENTION : Les milieux froids liquéfient la solution ECM contenant des organoïdes. - Passage des organoïdes une fois par semaine lorsque l’intérieur commence à devenir sombre en raison de l’accumulation de cellules mortes. Un exemple de ceci peut être trouvé dans la figure 2.
- Le jour du fractionnement, retirer la solution ECM de -20 °C et décongeler sur la glace.
- Placez la nouvelle plaque de culture cellulaire vide qui sera utilisée pour ensemencer les organoïdes après la scission à 37 °C (cela nécessite un minimum de 1 h pour être chaud et pourrait être réchauffé pendant la nuit). Réchauffer le milieu de culture à la température ambiante.
- Retirer le milieu de croissance avec une pipette P1000 et ajouter 500 μL de solution saline tamponnée au phosphate (PBS) froide 1x à chaque puits pendant 3 min pour liquéfier partiellement la solution ECM et se dissocier de la plaque.
- Pour éviter une perturbation complète de la solution ECM, utilisez une pipette P1000 (configurée à 450 μL). Pipette de haut en bas 10 fois pour remettre en suspension le PBS, la solution ECM et les organoïdes, transférer les organoïdes remis en suspension dans un tube conique de 15 mL et les placer sur la glace.
- Collectez plusieurs puits des mêmes organoïdes dans le même tube conique.
- Si plusieurs organoïdes différents (différents donneurs, différentes sections, différents prétraitements, etc.) sont divisés en même temps, collectez-les dans différents tubes coniques. Pendant la collecte, maintenez les tubes coniques sur la glace.
- Faire tourner les échantillons à 500 x g pendant 5 min à 4 °C. Retirez soigneusement le PBS à l’aide d’une pipette pour maintenir la pastille organoïde au fond.
- Évitez d’utiliser un système de déchets sous vide avec une pipette ajustée car la pastille d’organoïdes est très lâche et peut facilement être aspirée lorsque vous retirez le PBS trop rapidement.
- Ajouter 1 mL de trypsine à 0,05 % au tube conique et remettre en suspension les organoïdes en pipetant de haut en bas 10 fois avec une pipette P1000. Incuber le tube conique contenant des organoïdes à 37 °C pendant 3 min.
- Ajouter 2 mL de milieuX DMEM/F12 contenant 10 % de sérum fœtal bovin (FBS) et 1 % de pénicilline/streptomycine pour arrêter la digestion et remettre en suspension pour perturber les organoïdes en pipetant de haut en bas 10 fois avec une pipette P1000.
- Faire tourner les échantillons à 500 x g pendant 5 min à 4 °C. Retirez les tubes coniques de la centrifugeuse et stockez-les sur de la glace.
- Retirez soigneusement le média/trypsine à l’aide d’une pipette jetable de 5 mL pour maintenir la pastille organoïde au fond. Laissez environ 500 μL de média et retirez-le avec une pipette P1000.
- Une fois que le milieu/trypsine a été retiré de tous les tubes coniques, retirez la plaque traitée par culture non cellulaire de 24 puits de l’incubateur à 37 °C et placez-la sous le capot de culture cellulaire.
- Ajouter la solution ECM à 100% (conservée sur glace) au tube conique avec les organoïdes divisés au rapport 1:3 à 1:5 en fonction des habitudes de croissance des organoïdes du donneur individuel. (Par exemple, si un puits contenant de 20 à 100 organoïdes dans une goutte de 50 μL de solution ECM a été passé, remettre en suspension la pastille organoïde dans 150 à 250 μL de solution ECM glacée.)
- Semence 50 μL de solution ECM/mélange organoïde par puits de la plaque traitée par culture non cellulaire de 24 puits préchauffée à 37 °C.
REMARQUE: La solution ECM se polymérise très rapidement une fois qu’elle s’est réchauffée. Gardez la solution ECM froide en tout temps (stockée sur de la glace) pendant l’utilisation. Lorsque les organoïdes ont été remis en suspension, semer immédiatement sur une nouvelle plaque. Pour les débutants, il est recommandé de stocker une boîte d’embouts de pipette à -20 °C pour laisser plus de temps pour l’ensemencement. - Incuber la plaque de 24 puits à 37 °C pendant 10-15 min pour permettre à la solution ECM de polymériser.
- Après polymérisation, ajouter 500 μL de milieu de croissance (Tableau 1)26 à chaque puits et incuber les organoïdes à 37 °C. Vérifiez les organoïdes quotidiennement par microscopie. Changez le support tous les 2 jours comme à l’étape 1.4.
2. Préparation des organoïdes en deux dimensions (2D) pour l’infection apicale
REMARQUE: Le protocole suivant décrira comment ensemencer des organoïdes intestinaux en tant que monocouche de cellules dans une plaque de culture cellulaire pour infecter les cellules de l’épithélium intestinal de leur côté apical. Utilisez la plaque de 48 puits pour les expériences de séquençage et la glissière de chambre à fond de verre de 8 puits pour contrôler l’infection à l’aide d’approches d’immunofluorescence.
- Cultiver et maintenir les organoïdes comme décrit à la section 1.
- Avant d’ensemencer les organoïdes en 2D, enduisez les plaques de 48 puits et la glissière de la chambre à fond de verre à 8 puits avec 200 μL de collagène humain à 2,5 % dans de l’eau par puits pendant 1 h à 37 °C.
REMARQUE: Les organoïdes intestinaux sont mieux ensemencés dans des plaques de 48 puits et dans une glissière de chambre à fond de verre à 8 puits. L’expérience a montré qu’ils n’infectent pas bien dans les plaques de 96 puits. Les inserts Transwell peuvent également être utilisés pour permettre l’infection apicale et basolatérale en 2D. Si des transpuits sont utilisés, surveillez la résistance électrique trans-épithéliale (TEER) avant l’infection pour confirmer une monocouche confluente. Normalement, les organoïdes intestinaux ont une barrière serrée avec un TEER de 450-600 Ohm/cm2. - Ensemencez 100 à 150 organoïdes dans chaque puits d’une plaque de 48 puits ou pour un puits d’une glissière de chambre à fond de verre de 8 puits.
- Pour estimer le nombre d’organoïdes, compter le nombre d’organoïdes présents dans la goutte de solution ECM de 50 μL de la plaque de 24 puits préparée à la section 1. En moyenne, 1 à 2 puits sont nécessaires, ce qui donnera environ 15 000 à 30 000 cellules.
- Pour perturber la solution ECM et essayer les organoïdes, suivez les étapes 1.8-1.17.
- Retirez le collagène humain des plaques à 48 puits et de la glissière de la chambre à fond de verre à 8 puits.
- Remettre en suspension la pastille organoïde dans le tube conique dans 250 μL de milieu de croissance/puits et ajouter le mélange aux puits recouverts de collagène. Placez la plaque dans un incubateur à 37 °C.
REMARQUE: Lors de la réalisation des expériences, plusieurs conditions sont comparées (simulation vs traitement infecté +/- d’intérêt). Pour minimiser la variabilité entre chaque puits d’organoïdes ensemencés en 2D, collectez le nombre total d’organoïdes nécessaires dans le même tube conique. La collecte d’organoïdes dans jusqu’à 12 puits d’une plaque de 24 puits peut utiliser 1 mL de trypsine et 2 mL de milieu neutralisant. Lorsque vous utilisez 12 à 24 puits, augmentez ce nombre à 2 mL de trypsine et à 4 mL de milieu neutralisant. - Après 48 h, retirez la plaque de l’incubateur et placez-la dans la hotte de culture cellulaire. Retirez le milieu de croissance et remplacez-le par 250 μL par puits de milieu de différenciation (tableau 1). Répétez ce changement de média 48 h plus tard.
- Après 48 h, confirmer la différenciation (quatre jours après le passage au milieu de différenciation) en extrayant de l’ARN, en fabriquant de l’ADNc avec 250 ng d’ARN et en effectuant une qPCR à base de vert SYBR à l’aide d’amorces pour les cellules souches (OLFM4 et / ou SMOC2), les cellules gobelet (MUC2), les cellules entéroendocrines (CHGA) et les entérocytes (SI et / ou CYP3A4) (Figure 3).
REMARQUE: En passant des milieux de croissance aux milieux de différenciation, les organoïdes diminueront leur expression de marqueurs de cellules souches (OLFM4 et / ou SMOC2) et augmenteront l’expression des cellules de gobelet (MUC2), des cellules entéroendocrines (CHGA) et des marqueurs d’entérocytes (SI et / ou CYP3A4) par qPCR. Préparez un puits supplémentaire et maintenez avec le milieu de croissance pour comparer le niveau d’expression de chaque marqueur spécifique au type de cellule dans le milieu de croissance par rapport au milieu de différenciation. - Après confirmation de la différenciation, les organoïdes sont prêts pour l’infection apicale. Déplacez les organoïdes vers le niveau de confinement de biosécurité requis pour l’agent pathogène de votre choix.
ATTENTION : Veuillez consulter les règlements locaux et les procédures d’exploitation normalisées de l’institut lorsque vous manipulez des agents pathogènes sous confinement BSL-2 ou BSL-3. - Pour infecter les organoïdes intestinaux cultivés en 2D de leur côté apical, prélever le milieu avec une pipette P1000 et ajouter l’agent pathogène dilué à la multiplicité d’infection requise pour l’expérience dans les milieux de différenciation (le volume minimum de mélange pathogène/milieu est de 50 μL par puits et le volume maximal est de 250 μL par puits).
- Laissez l’infection se poursuivre pendant 2 h à 37 °C avec une table à bascule située dans l’incubateur de culture cellulaire ou en berçant manuellement la plaque toutes les 15-20 minutes. Optimisez ce temps en fonction de l’agent pathogène de votre choix.
- Après 2 h, retirer le média avec une pipette P1000 et le remplacer par 250 μL par puits de fluide de différenciation frais. Incuber les cellules à 37 °C jusqu’au point temporel du séquençage unicellulaire.
- Pour préparer les cellules au séquençage unicellulaire, passez à la section 4.
3. Préparation des organoïdes en trois dimensions (3D) pour l’infection apicale et basolatérale
- Cultiver des organoïdes comme décrit à la rubrique 1 dans une plaque traitée par culture non cellulaire de 24 puits.
- Deux jours après le passage, retirez la plaque de l’incubateur et placez-la dans une hotte de culture cellulaire.
- Retirez le milieu de croissance à l’aide d’une pipette P1000, remplacez-le par 500 μL/puits de milieu de différenciation préchauffé à température ambiante et placez la plaque dans l’incubateur à 37 °C.
- Après 48 h, remplacer par un nouveau milieu de différenciation (500 μL/puits).
REMARQUE: Les organoïdes sont maintenus dans des milieux de différenciation pendant un total de 4 jours avant l’infection. - Confirmer la différenciation comme décrit à l’étape 2.9.
- Après confirmation que la différenciation s’est produite, les organoïdes sont prêts pour l’infection.
- Décongeler l’ECM sur la glace. Réchauffer le milieu de différenciation à la température ambiante et réchauffer une plaque de 24 puits à 37 °C.
- Pour effectuer des infections, retirez les organoïdes de la solution ECM.
REMARQUE: Retirez autant de solution ECM que possible car les virus préfèrent coller à la solution ECM plutôt qu’aux cellules. S’il reste trop de solution ECM autour des organoïdes, l’infectiosité sera gravement affectée. - Perturbez l’ECM en ajoutant 500 μL de PBS froid 1x et en incubant pendant 3 min. Utilisez un P1000 pour pipeter de haut en bas 10x. Mélanger les organoïdes dans un tube et centrifuger à 500 x g pendant 5 min. Retirez PBS avec un P1000.
REMARQUE: Pour minimiser la variabilité entre chaque condition d’infection, combinez les organoïdes provenant de plusieurs puits d’une plaque de 24 puits dans le même tube conique. Par exemple, si huit conditions d’infection sont requises, huit puits d’une plaque de 24 puits (contenant environ 100 organoïdes chacun) seront combinés et ensuite divisés en huit puits d’une nouvelle plaque de 24 puits à la suite d’une perturbation de l’aiguille (voir l’étape 3.12). - Remettre en suspension les organoïdes dans 1 mL de milieu de différenciation. Pour l’infection apicale et basolatérale, suivez l’étape 3.10.1 et pour l’infection basolatérale, suivez uniquement l’étape 3.10.2.
- Fixez une aiguille de 27 G à une seringue de 1 mL et remettez la pastille six fois pour permettre la perturbation des organoïdes et pour que l’infection se produise à la fois sur les côtés apical et basolatéral. Passez à l’étape 3.11.
REMARQUE: Les organoïdes doivent être les organoïdes classiques ressemblant à des kystes et à bourgeons de poulpe avec un centre sombre lorsqu’ils sont observés avant la perturbation de l’aiguille. Après la perturbation, ces organoïdes apparaîtront plus petits avec moins ou pas d’intérieur sombre. Lors de l’infection, il y aura toujours un minimum de deux conditions (simulacre et infection), un minimum de deux puits d’une plaque de 24 puits sera initialement combiné dans un tube conique de 15 mL pour la perturbation à l’aiguille (expliquant pourquoi un minimum de 1 mL est utilisé pour la remise en suspension). Lorsque vous effectuez plus de deux conditions, combinez jusqu’à 10 puits d’une plaque de 24 puits dans un seul tube conique de 15 mL et remettez en suspension dans 1 mL de milieu de différenciation pour la perturbation de l’aiguille. Après la perturbation, ajoutez 500 μL de milieux de différenciation par n + 1 (par exemple, si vous utilisez 10 puits, puis complétez avec 4,5 mL pour avoir un total de 5,5 mL). Si plus de 10 conditions sont nécessaires, utilisez plusieurs tubes coniques. Une seringue de 1 mL est recommandée car les organoïdes sont mieux perturbés avec ce volume de la seringue. Une alternative à une seringue consiste à utiliser une pointe P1000 bien aplatie. - Remettre en suspension les organoïdes dans 500 μL de milieux de différenciation par puits. Veillez à ne pas perturber les organoïdes et assurez-vous que le côté apical n’est pas accessible. Passez à l’étape 3.11.
- Fixez une aiguille de 27 G à une seringue de 1 mL et remettez la pastille six fois pour permettre la perturbation des organoïdes et pour que l’infection se produise à la fois sur les côtés apical et basolatéral. Passez à l’étape 3.11.
- Transférer 500 μL de suspensions organoïdes par puits sur une plaque de culture cellulaire de 24 puits à l’aide d’une pipette P1000 et déplacer la plaque vers le niveau de confinement de biosécurité requis pour l’agent pathogène de son choix.
ATTENTION : Se référer aux réglementations locales et aux procédures opérationnelles normalisées de l’institut lors de la manipulation d’agents pathogènes sous confinement BSL-2 ou BSL-3. Effectuez toujours la perturbation de l’aiguille des organoïdes à l’extérieur du BSL-3 pour éviter les accidents potentiels avec l’aiguille. Les réglementations locales peuvent également empêcher l’utilisation d’aiguilles dans le BSL-3. - Ajouter l’agent pathogène dilué dans un milieu de différenciation pour atteindre la multiplicité d’infection requise pour l’expérience. Ne pas dépasser un volume total de 500 μL (pour avoir 1 mL au total dans la plaque de 24 puits).
- Laisser l’infection se poursuivre pendant 2 h (ce temps devra être adapté à l’agent pathogène de votre choix) à 37 °C avec une table à bascule située dans l’incubateur de culture cellulaire ou en berçant manuellement la plaque toutes les 15-20 minutes.
- Après 2 h d’incubation, recueillir les organoïdes dans un tube de 1,5 mL par condition et tourner à 500 x g pendant 5 min à 4 °C.
- Retirez le milieu contenant l’agent pathogène à l’aide d’une pipette P1000 et conservez-le sur de la glace. Lavez les pastilles organoïdes une fois avec PBS.
- Remettre en suspension les organoïdes dans 50 μL de solution ECM à 100 % (qui a été précédemment décongelée sur de la glace), plaquer dans une plaque traitée par culture non cellulaire à 24 puits préchauffée à 37 °C et incuber la plaque de 24 puits à 37 °C pendant 10-15 min pour permettre à la solution ECM de polymériser.
- Après polymérisation, ajouter 500 μL de milieux de différenciation à température ambiante à chaque puits et incuber à 37 °C jusqu’à la récolte pour le séquençage unicellulaire.
REMARQUE: Si la récolte doit avoir lieu plus de 48 heures après l’ensemencement, changez le milieu tous les 2 jours en retirant l’ancien milieu et en le remplaçant par 500 μL de milieu de différenciation frais. Cependant, l’expérience a montré que puisque les organoïdes sont cultivés sous des milieux de différenciation, ils ne survivront pas beaucoup plus longtemps que 48 h.
4. Préparation d’une solution unicellulaire et préparation de billes de gel en émulsion (GEM) dans des conditions de biosécurité de niveau 3 (BSL-3)
REMARQUE: L’achèvement des étapes suivantes nécessite que l’équipement de séquençage à cellule unique(Table des matériaux)et une machine pcr capable de gérer des réactions de 100 μL soient présents à l’intérieur d’une installation BSL-3. Les organoïdes sont cultivés comme décrit dans la rubrique 1 et infectés comme décrit dans les rubriques 2-3 en fonction de l’agent pathogène et de la voie d’entrée. À un moment prédéterminé après l’infection, les organoïdes sont prélevés. Ci-dessous, la méthode utilisée pour prélever des organoïdes intestinaux est décrite.
- Avant de prélever les organoïdes infectés, retirer les billes de gel unicellulaire (Table des matériaux) de -80 ° C et les réchauffer à température ambiante (au moins 30 minutes avant).
- De plus, équilibrez le réactif RT, l’agent réducteur B et l’enzyme RT C (tous stockés à -20 °C) à la température ambiante. Remettez en suspension l’oligo du commutateur de gabarit comme décrit dans les instructions du fabricant.
REMARQUE : Toutes les étapes suivantes doivent être effectuées en ce qui concerne les règlements locaux sur la prévention des risques biotechnologiques conformément à la procédure d’exploitation normalisée établie pour l’agent pathogène considéré. En règle générale, pour le travail BSL-3, il faut s’assurer que l’extérieur de tous les récipients (plaques, tubes, etc.) sortant d’une hotte de culture cellulaire est correctement désinfecté. Il en va de même pour les mains/gants de la personne qui effectue les expériences. - Pour effectuer des infections sur des organoïdes ensemencés en 2D (section 2), passez à l’étape 4.4. Pour effectuer des infections sur organoïdes 3D (section 3), passez à la rubrique 4.5.
- Pour les infections d’organoïdes 2D, apportez la plaque de culture cellulaire dans le capot et retirez le support de différenciation avec une pipette P1000.
- Ajouter 250 μL de 1x PBS à température ambiante à chaque puits.
- Retirez le PBS avec une pipette P1000 et ajoutez 250 μL d’enzyme de dissociation à température ambiante (p. ex. TrypLE Express) à chaque puits d’une plaque de 48 puits. Changez de gants, nettoyez la plaque et placez la plaque avec l’enzyme de dissociation dans l’incubateur à 37 °C.
- Observez la dissociation cellulaire par microscopie toutes les 5 minutes.
REMARQUE: Environ 15 minutes pour dissocier les organoïdes intestinaux cultivés en 2D en cellules individuelles. Ce temps devra être ajusté car il dépendra du nombre d’organoïdes initialement ensemencés et infectés ainsi que de l’agent pathogène car certains agents pathogènes sont plus cytopathiques et provoquent la dissociation des organoïdes beaucoup plus rapidement que d’autres. - Après confirmation d’une suspension monocellulaire apparente, ramener la plaque dans la hotte de culture cellulaire et arrêter la digestion en ajoutant 250 μL de milieu DMEM/F12 contenant 10 % de FBS par puits d’une plaque de 48 puits.
- Recueillir les cellules dans un tube conique de 15 mL à l’aide d’une pipette P1000.
- Changez de gants, nettoyez le tube et faites tourner les échantillons à 500 x g pendant 5 min à 4 °C.
- Retirez soigneusement l’enzyme de milieu/dissociation avec un P1000 pour maintenir la pastille cellulaire au fond. Remettre en suspension des cellules individuelles dans un volume minimal de PBS contenant 0,1 % de BSA. Pour les organoïdes intestinaux, remettre en suspension 250 μL pour chaque puits de la plaque de 48 puits.
- Passez les suspensions cellulaires dans un tube FACS avec un filtre pour enlever les gros amas et placez le tube FACS contenant des cellules sur de la glace.
- Passez à l’étape 4.6 pour continuer avec le comptage des cellules et la préparation du mélange maître.
- Pour les infections d’organoïdes 3D, retirez la plaque de l’incubateur et placez-la dans la hotte de culture cellulaire.
- Retirez le support de différenciation de chaque puits de la plaque de 24 puits à l’aide d’une pipette P1000. Ajouter 500 μL de PBS glacé 1x à chaque puits et incuber pendant 3 min sur de la glace.
- Pour éviter une perturbation complète de la solution ECM, utilisez une pipette P1000 (réglée sur 450 μL). Pipette de haut en bas 10 fois pour remettre en suspension le PBS, la solution ECM et les organoïdes; transférer les organoïdes remis en suspension dans un tube conique de 15 mL et les placer sur de la glace. Recueillir chaque condition d’infection dans son propre tube conique de 15 mL.
REMARQUE: L’utilisation d’un tube conique de 15 mL donne une pastille cellulaire meilleure et plus distincte qu’un tube conique de 50 mL ou un tube de 1,5 mL. - Changez de gants et retirez le tube de la cagoule de culture cellulaire. Nettoyez l’extérieur du tube.
- Faire tourner les échantillons à 500 x g pendant 5 min à 4 °C.
- Replacez le tube dans la hotte de culture cellulaire et retirez le PBS avec une pipette P1000 pour éviter de remettre en suspension les pastilles organoïdes du fond du tube.
- Remettre la pastille dans 1 mL d’enzyme de dissociation (p. ex. TrypLE Express). Changez de gants, nettoyez le tube et incubez les échantillons à 37 °C.
- Toutes les 10 minutes pendant 30 minutes, replacez le tube dans la hotte de culture cellulaire et remettez en suspension les organoïdes en pipetant de haut en bas avec une pipette P1000 10 fois.
REMARQUE: Normalement, les organoïdes intestinaux ont besoin d’environ 30 minutes pour former une suspension cellulaire unique lorsqu’ils sont infectés en 3D. - Pour déterminer quand les organoïdes sont dissociés en cellules individuelles, prélever 10 μL de la suspension organoïde à l’aide d’une pipette p10.
- Placez la suspension dans une glissière de comptoir de cellule en plastique jetable. Scellez le port d’entrée de l’échantillon avec du ruban adhésif transparent.
- Changez de gants et nettoyez l’extérieur du comptoir cellulaire. Utilisez un microscope à fond clair pour déterminer si une suspension à cellule unique est faite.
- Après confirmation d’une suspension à cellule unique, arrêtez la digestion en ajoutant 1 mL de milieu DMEM/F12 contenant 10 % de FBS et pipette de haut en bas 10 fois avec une pipette P1000.
- Changez de gants, nettoyez le tube et faites tourner les échantillons à 500 x g pendant 5 min à 4 °C.
- Retirez soigneusement l’enzyme de milieu/dissociation à l’aide d’une pipette P1000 pour éviter de remettre en suspension la pastille de cellule du fond du tube.
- Remettre en suspension les cellules individuelles dans un volume minimal de PBS contenant 0,1% de BSA. Pour les organoïdes intestinaux, remettre en suspension dans 250 μL.
- Passez les suspensions cellulaires dans un tube FACS avec un filtre pour enlever les gros amas et placez le tube FACS contenant des cellules sur de la glace.
- Passez à l’étape 4.6 pour continuer avec le comptage des cellules et la préparation du mélange maître.
- Déterminez le nombre de cellules par μL en ajoutant 10 μL de la suspension cellulaire à une chambre de comptage de cellules en plastique jetable.
- Scellez le port d’entrée de l’échantillon avec du ruban adhésif transparent avant de retirer l’échantillon de la hotte de culture cellulaire, car à ce stade, la suspension cellulaire est toujours infectieuse.
- Changez de gants, nettoyez la chambre de comptage des cellules et comptez le nombre de cellules à l’aide d’un microscope à fond clair.
- À l’intérieur de la hotte de culture cellulaire, préparez un mélange maître de réactif RT, d’oligo de commutateur de gabarit, d’agent réducteur B et d’enzyme RT C dans un tube de 1,5 mL conformément aux instructions du fabricant en fonction du nombre d’échantillons dans l’expérience. Pour chaque échantillon, aliquote 33,4 μL de mélange maître dans un tube PCR et conserver sur de la glace.
- Ajouter les cellules et l’eau au mélange maître en fonction du numéro de cellule cible décrit dans les instructions du fabricant.
REMARQUE: 50% à 60% des cellules sont normalement récupérées (c’est-à-dire que lors du chargement de 10 000 cellules sur la puce, 5 000 à 6 000 cellules sont utilisées pour l’analyse). Par conséquent, chargez toujours 10 000 cellules. Si la densité de la cellule ne le permet pas, centrifugez les cellules et remettez-les en suspension dans un volume inférieur. Veillez à ne pas surcharger la puce car cela entraînerait un colmatage de la puce. De plus, si les cellules ne sont pas correctement dissociées, il y aura un risque accru d’obtenir plusieurs cellules par perle, qui devront être éliminées dans le traitement bioinformatique en aval. - Changez les gants, déplacez le contrôleur à cellule unique dans la hotte de culture cellulaire et préparez la puce car la puce n’est recouverte que d’un joint qui n’est pas scellé.
REMARQUE: La machine doit être à l’intérieur de la hotte pour éviter l’exposition aux suspensions cellulaires infectées et aux aérosols potentiels. - Ajoutez la puce à cellule unique au porte-puce et remplissez les voies inutilisées avec 50% de glycérol.
- Ajoutez le mélange principal, les perles et l’huile de cloisonnement aux voies utilisées pour les échantillons conformément aux instructions du fabricant.
- Couvrez la puce avec le joint, chargez la puce dans le contrôleur et démarrez le programme.
REMARQUE: Il est recommandé de ne charger que six des huit voies. Des problèmes d’émulsions inappropriées se produisent souvent dans les voies un et huit. L’entreprise affirme que toutes les voies sont indépendantes et que cela ne devrait pas se produire; cependant, si possible, évitez ces deux voies et faites fonctionner deux puces si huit échantillons sont nécessaires. - À la fin du programme, retirez la puce et le joint.
- Utilisez une pipette multicanal et transférez 100 μL des émulsions dans un tube PCR propre. Assurez-vous que chaque puits a une couleur blanche uniforme indiquant qu’une émulsion complète s’est produite.
- Changez de gants, nettoyez les tubes et transférez le tube PCR sur une machine PCR pouvant prendre en charge des réactions de 100 μL. Exécutez le programme : 53 °C pendant 45 min ; 85 °C pendant 5 min.
- Une fois terminé, conservez les échantillons à 4 °C. À ce stade, traiter la réaction selon les instructions du fabricant ou conserver à 4 °C pendant 3 jours ou à -20 °C pendant 1 semaine.
- Après 5 min à 85 °C, la plupart des virus enveloppés seront inactivés, retireront l’ADNc du BSL-3 selon la procédure normale de fonctionnement et effectueront les préparations de la bibliothèque dans un laboratoire BSL-1.
REMARQUE: Cette expérience doit être réalisée sous la forme de trois répliques biologiques (par exemple, sur trois jours différents) parce que l’étendue de la différenciation de chaque type de cellule peut varier légèrement entre chaque expérience. Les bibliothèques de séquençage résultantes peuvent être indexées et séquencées différemment en une seule exécution de séquençage.
Résultats
Préparation d’organoïdes pour le séquençage unicellulaire
Les résultats du séquençage unicellulaire dépendent fortement de l’utilisation de cellules de bonne qualité. Pour s’assurer que les organoïdes sont de bonne qualité, ils doivent être correctement entretenus et observés quotidiennement pour déterminer quand ils sont prêts à être divisés (Figure 2). Le moment de la division des organoïdes dépend du donneur; certains donneurs se développent plus rapidement et doivent être divisés tous les 5 jours, tandis que d’autres sont plus lents et doivent être divisés tous les 10 jours. En moyenne, les organoïdes sont divisés une fois par semaine lorsque les centres deviennent sombres(Figure 2B). Si les organoïdes sont autorisés à devenir trop gros et à accumuler trop de cellules mortes au centre, l’organoïde mourra.
Les organoïdes sont maintenus dans un milieu qui contient de grandes quantités de Wnt3A. Cela soutient la niche des cellules souches et favorise la croissance et la prolifération des organoïdes. Dans ces conditions de croissance, les organoïdes contiennent de grandes quantités de cellules souches et de cellules amplifiant le transit et une quantité plus faible de populations cellulaires différenciées telles que les entérocytes matures, les cellules Gobelet et les cellules entéroendocrines. Cependant, pour imiter la complexité cellulaire trouvée dans l’intestin humain, il est important de pousser la différenciation cellulaire et de produire plus de ces cellules. Ceci est accompli en modifiant les conditions du support et en supprimant Wnt3A, et en réduisant R-Spondin et Noggin (Tableau 1). Normalement, la différenciation cellulaire vers les entérocytes, les cellules gobelets et les cellules entéroendocrines nécessite 4 jours de milieu de différenciation(Figure 3). Il est essentiel d’obtenir une bonne différenciation; sinon, l’évaluation du tropisme des agents pathogènes et des réponses spécifiques au type cellulaire deviendra difficile.
Confirmation de l’inactivation de l’agent pathogène BSL-3
L’inactivation complète doit être confirmée avec l’agent pathogène de votre choix et validée qu’il est sûr d’éliminer l’ADNc du BSL-3. Pour le SARS-CoV-2, l’inactivation complète du virus a été validée en prenant 100 μL de SARS-CoV-2 et en l’incubant dans un appareil pcr pendant 5 min à 85 °C. Le virus a ensuite été rajouté aux cellules Vero naïves, et l’infection virale a été comparée au virus non traité thermiquement par immunofluorescence et tests de plaque à 24 h, 48 h et 72 h après l’infection pour s’assurer que toutes les particules n’étaient plus infectieuses. Ces résultats ont été envoyés à l’organisme de réglementation local et, après leur approbation, l’expérience à cellule unique et le traitement de l’ADNc ont été effectués.
Résultats du séquençage unicellulaire
Pour évaluer comment le SRAS-CoV-2 infecte les organoïdes du côlon et de l’iléon humains, un séquençage unicellulaire a été effectué. Les organoïdes ont été préparés comme décrit ci-dessus et infectés dans un format 2D pour permettre l’infection apicale par le SARS-CoV-2. Les cellules infectées ont été prélevées 12 h et 24 h après l’infection et ont été traitées pour le séquençage unicellulaire comme décrit ci-dessus. L’analyse des données de séquençage unicellulaire nous a permis de déterminer que seule une sous-population (entérocyte 2 immature) de cellules épithéliales intestinales humaines soutenait l’infection par le SRAS-CoV-2(Figure 4). De plus, comme toutes les cellules d’une population n’étaient pas infectées, les cellules infectées et les cellules témoins non infectées ont été analysées(figure 5). Ces résultats ont montré que le SRAS-CoV-2 induisait une cascade de signaux pro-inflammatoires dans les cellules infectées, tandis que les cellules témoins non infectées présentaient une réponse immunitaire médiée par l’interféron. De plus, scRNA-Seq a montré que les cellules infectées étaient incapables de détecter les interférons en raison d’un blocage de la voie médié par le virus (Figure 5). Il n’a pas été possible d’obtenir cette information lors de l’utilisation du séquençage d’ARN en vrac.

Figure 1: Schéma illustrant les trois différentes méthodes pour préparer les organoïdes intestinaux humains à l’infection par des agents pathogènes entériques. L’infection apicale peut être obtenue en ensemençant des organoïdes intestinaux en 2D. Une infection apicale et basolatérale peut être réalisée en perturbant l’organoïde 3D. Enfin, une infection basolatérale seule peut être réalisée en infectant des organoïdes intestinaux 3D intacts. Chacune de ces méthodes peut être utilisée pour générer des échantillons pour le séquençage d’une seule cellule. Veuillez cliquer ici pour voir une version agrandie de cette figure.
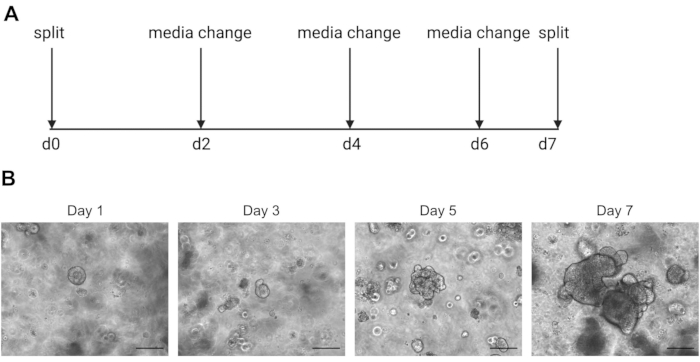
Figure 2: Schéma de maintenance organoïde et images représentatives en champ lumineux. (A) Schéma pour l’entretien et le passage des organoïdes intestinaux humains. (B). Images représentatives en champ lumineux des jours 1, 3, 5 et 7 après le fractionnement. Au jour 7, les organoïdes deviennent gros et sombres en raison de l’accumulation de cellules mortes et sont prêts à être divisés. La barre d’échelle indique 25 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
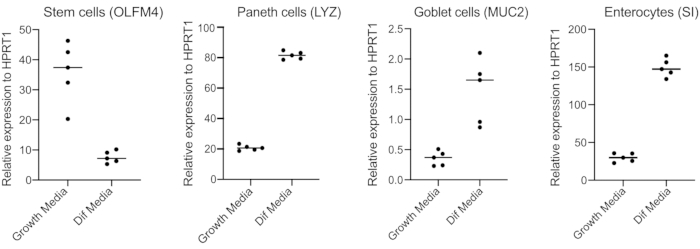
Figure 3: QPCR représentative des organoïdes intestinaux humains 4 jours après le passage aux milieux de différenciation. Les organoïdes intestinaux ont été maintenus dans des milieux de croissance ou passés à des milieux de différenciation pendant 4 jours. L’ARN a été récolté et la qPCR a été réalisée pour les marqueurs des cellules souches (OLFM4), des cellules paneth (LYZ), des cellules Goblet (MUC2) et des entérocytes (SI). N = 5. Veuillez cliquer ici pour voir une version agrandie de cette figure.
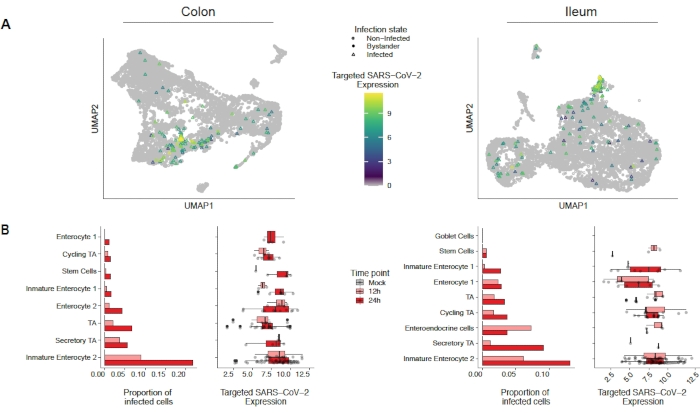
Figure 4: Identification de la population cellulaire infectée par le SRAS-CoV-2. Des organoïdes du côlon humain et de l’iléon ont été infectés par le SRAS-CoV-2. Après 12 et 24 heures après l’infection, des cellules ont été prélevées et soumises à un séquençage de l’ARN unicellulaire afin d’identifier les populations cellulaires qui soutenaient l’infection par le SRAS-CoV-2. On a constaté que l’infection virale augmentait avec le temps et infectait principalement l’entérocyte 2 immature. Ce chiffre a été modifié à partir de Triana et al.19. Veuillez cliquer ici pour voir une version agrandie de cette figure.
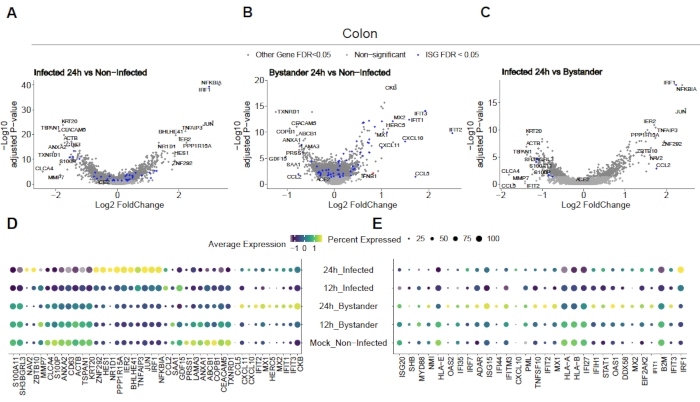
Figure 5: Détermination de la réponse immunitaire innée intrinsèque. Des organoïdes du côlon humain ont été infectés par le SRAS-CoV-2. Après 12 et 24 heures après l’infection, les cellules ont été prélevées et soumises à un séquençage de l’ARN unicellulaire afin de déterminer la réponse immunitaire innée intrinsèque dans les cellules témoins infectées par le virus et non infectées. Les cellules infectées par le SRAS-CoV-2 ont montré une forte réponse pro-inflammatoire tandis que les cellules témoins non infectées ont montré une réponse médiée par l’interféron. Figure modifiée à partir de Triana et al.19. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Supports de croissance | |
| Composé | Concentration finale |
| Annonce DMEM/F12 | GlutaMAX (1X) |
| +GlutaMAX | HEPES 1 mM |
| +HEPES | Stylo 10 U/mL |
| +P/S | Streptocoque 10 μg/mL |
| L-WRN | 50 % en volume |
| B27 | 01:50 |
| N-acétyl-cystéine | 1 mM |
| Le FEM | 50 ng/mL |
| A83-01 | 500 nM |
| IGF-1 | 100 ng/mL |
| FGF de base | 50 ng/mL |
| Gastrine | 10 mM |
| Médias de différenciation | |
| Composé | Concentration finale |
| Annonce DMEM/F12 | GlutaMAX (1x) |
| +GlutaMAX | HEPES 1 mM |
| +HEPES | Stylo 10 U/mL |
| +P/S | Streptocoque 10 μg/mL |
| B27 | 01:50 |
| N-acétyl-cystéine | 1 mM |
| R-spondine | 5 % en volume |
| Noggin | 50 ng/mL |
| Le FEM | 50 ng/mL |
| Gastrine | 10 mM |
| A83-01 | 500 nM |
Tableau 1 : Composition des milieux pour les milieux de croissance et de différenciation.
Discussion
Les agents pathogènes entériques initient le plus souvent leur cycle de vie en infectant les cellules épithéliales intestinales de leur côté apical face à la lumière de l’intestin. Alors que les organoïdes sont bien connus pour être un bon modèle pour reproduire la complexité cellulaire et l’organisation de l’épithélium intestinal, leur organisation en tant que structures tridimensionnelles fermées rend leur membrane apicale inaccessible à l’agent pathogène. Ce protocole décrivait des méthodes pour infecter les organoïdes intestinaux de leur côté apical, de leur côté basolatéral ou des deux avec des agents pathogènes BLS-3. Ces protocoles peuvent facilement être adaptés pour étudier tout agent pathogène entérique sous confinement BSL-2 ou BLS-3 ou tout autre modèle organoïde en suivant quelques étapes critiques qui sont mises en évidence ci-dessous. La méthode décrite ci-dessus est pour l’isolement et la préparation de gouttelettes unicellulaires conformément à la réglementation en Allemagne. À titre de clause de non-responsabilité, ce protocole ne décrit pas les mesures de manipulation de la biosécurité (procédures d’exploitation normalisées) qui doivent être prises dans les conditions BSL-3. Il est également important d’insister sur le fait que les réglementations peuvent varier d’un autre pays et que les autorités locales doivent être contactées pour s’assurer que toutes les réglementations locales sont respectées.
L’une des étapes critiques de l’ensemencement d’organoïdes en deux dimensions pour l’infection apicale consiste à contrôler que les cellules se différencient de la même manière que lorsqu’elles sont cultivées en tant qu’organoïdes tridimensionnels classiques. Selon l’agent pathogène entérique, le tropisme pourrait être limité à des cellules très rares ou à des cellules qui doivent être très différenciées. Dans ce cas, l’utilisation d’un organoïde bidimensionnel qui ne se différencie pas complètement pourrait entraîner la conclusion erronée que cet agent pathogène entérique ne peut pas infecter les organoïdes intestinaux. Il est suggéré, si possible, d’effectuer des infections en utilisant les trois configurations de ce protocole : organoïde 2D pour l’infection apicale uniquement (section 2), organoïdes 3D ouverts fissurés pour l’infection apicale et basolatérale (rubrique 3), et organoïdes 3D complets pour l’infection basolatérale uniquement (rubrique 3). Cette approche aidera à discerner la voie d’entrée de l’agent pathogène (apical vs basolatéral) et permettra également de contrôler qu’un niveau de différenciation similaire a été atteint. Une alternative à l’infection apicale 2D est la microinjection, qui utilisera un organoïde 3D mais délivrera l’agent pathogène directement dans le côté apical (voir Bartfeld et al.27 pour plus de détails). Cette méthode nécessite un injecteur qualifié pour s’assurer que l’agent pathogène est correctement placé et que les organoïdes restent intacts. La microinjection est couramment utilisée dans le confinement BSL-2 et peut ne pas convenir au confinement BSL-3.
Une autre considération importante lors de la réalisation d’expériences d’infection dans des organoïdes ensemencés en 2D est la densité cellulaire finale. Comme mentionné à l’étape 2.3, 100 à 150 organoïdes seront ensemencés dans un puits d’une plaque de 48 puits ou un puits d’une glissière de chambre à fond de verre de 8 puits. Selon la ligne organoïde et la personne qui manipule les organoïdes, la taille de ces organoïdes peut être significativement différente. Cela pourrait entraîner des densités de cellules très différentes dans la glissière de la plaque de 48 puits ou de la chambre à fond de verre de 8 puits. Selon le virus entérique, certains virus préfèrent des cellules plus clairsemées, tandis que d’autres seront également capables d’infecter les cellules confluentes. L’origine moléculaire de telles différences d’infectiosité pour différentes confluences cellulaires n’est pas claire; par conséquent, des expériences pilotes visant à trouver la meilleure densité cellulaire pour l’agent pathogène entérique de choix devraient être effectuées avant d’effectuer une caractérisation plus poussée en aval.
Souvent, le tri FACS est effectué avant d’effectuer l’émulsion de gouttelettes unicellulaire. Cette étape est souvent utilisée pour séparer les cellules mortes des cellules vivantes et les cellules simples des doublets. Lorsque vous travaillez avec des agents pathogènes BSL-3, il faut que l’installation soit équipée d’un trieur FACS approprié, ce qui n’est pas souvent le cas. De plus, toutes les cellules d’un organoïde n’ont pas la même taille et il est souvent difficile de faire la distinction entre un doublet ou une cellule plus grande, ce qui entraîne un risque de sélection négative contre un type de cellule spécifique. En outre, il y a encore des discussions sur le terrain pour savoir si le temps nécessaire pour trier entre 5 000 et 10 000 pour chaque échantillon pourrait entraîner une modification significative du profil de transcription des cellules individuelles. Bien que des méthodes de fixation cellulaire compatibles avec le séquençage unicellulaire (p. ex. méthanol et ARNaassique) aient été décrites, il a été observé que cela entraînait une diminution de la qualité du séquençage18. Enfin, on soupçonne que le tri des cellules à l’aide de marqueurs de mort cellulaire peut également conduire à un biais. Compte tenu de la prolifération directionnelle et de la différenciation des cellules à travers l’axe crypte-villosités, les cellules les plus différenciées, qui vont être éliminées et libérées, sont situées à l’extrémité des villosités. Ces cellules sont souvent positives pour différents marqueurs des voies de mort cellulaire(p. ex., apoptose, nécrose et nécroptose); cependant, lorsque l’on examine l’infection à rotavirus de l’intestin de la souris, la pointe des villosités est la zone la plus infectée28. Ainsi, filtrer les cellules qui peuvent sembler positives pour les marqueurs de mort entraînerait une sélection négative des cellules infectées qui peuvent représenter l’infection physiologique. Actuellement, il n’existe pas de bonne solution pour trier et fixer les organoïdes avant le séquençage unicellulaire. L’utilisation de cellules vivantes et non triées est recommandée car d’autres études sont nécessaires pour trouver des protocoles alternatifs appropriés.
Le séquençage unicellulaire a révolutionné la façon dont les réponses cellulaires peuvent être évaluées. Cette technique permet d’identifier les réponses spécifiques à la lignée cellulaire à la fois dans les conditions basales et sous les infections pathogènes. Cette méthode a ouvert des portes dans de nombreux domaines qui étaient auparavant limités par des lectures en vrac. Bien que cette méthode soit très puissante, elle a ses limites. Une limitation clé est l’analyse bioinformatique approfondie qui est nécessaire en aval du séquençage. Ceci est particulièrement important lors de l’analyse des tissus et de l’attribution de types de cellules où il n’y a actuellement aucune annotation. Avoir un bioinformaticien qualifié est nécessaire pour soutenir toutes les études unicellulaires.
Ce protocole décrit comment ensemencer et manipuler les organoïdes intestinaux humains, les infecter avec des agents pathogènes entériques et effectuer scRNAseq. L’adaptation de cette approche à d’autres organes est maintenant possible, car des systèmes de modèles organoïdes ont été développés pour la plupart des organes. Les organoïdes pulmonaires et hépatiques sont organisés de la même manière que les organoïdes intestinaux et, en tant que tels, l’utilisation d’une approche analogue pourrait être transposée à ces organoïdes. Le contrôle critique sera de valider que lorsqu’ils sont cultivés en deux dimensions ou fissurés, ces organoïdes atteignent une différenciation similaire à celle de leurs homologues organoïdes 3D. Les caractéristiques spécifiques et les gènes qui définissent un statut différencié sont spécifiques à chaque modèle d’organe. D’autres modèles organoïdes tels que les organoïdes rénaux et vasculaires, de grandes structures denses, nécessiteront des méthodes supplémentaires pour dissocier en série ces structures en cellules uniques.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Megan Stanifer et Steeve Boulant ont été soutenus par des subventions de recherche de la Deutsche Forschungsgemeinschaft (DFG): (Numéro de projet 240245660, 278001972, 415089553 et 272983813 à Steeve Boulant et 416072091 à Megan Stanifer), l’État du Bade-Wurtemberg et le Bundesministerium für Bildung und Forschung BMBF 01KI20239B à MS et 01KI20198A et (NUM-COVID 19, Organo-Strat 01KX2021) à SB. Des schémas ont été créés dans BioRender.
matériels
| Name | Company | Catalog Number | Comments |
| Recombinant mouse noggin | Peprotech | Cat#250-38 | |
| [Leu15]-Gastrin I | Sigma-Aldrich | Cat# G9145 | |
| 0.05% Trypsin-EDTA | Thermo Fischer Scientific | Cat#25300054 | |
| 24-well non-cell culture treated plate | Corning | Cat#3738 | |
| 8-well glass bottom chamber slide | iBIDI | Cart#80827 | |
| A83-01 | Tocris | Cat#2939 | |
| Advanced DMEM/F12 | Thermo Fischer Scientific | Cat# 12634010 | |
| B27 | Thermo Fischer Scientific | Cat#17504-044 | |
| Chromium Controller & Next GEM Accessory Kit | 10X Genomics | Cat#1000202 | Used in the preparation of single cell solution and preparation of Gel beads-in-emulsion (GEM) |
| Chromium Next GEM Chip G Single Cell Kit | 10X Genomics | Cat #1000127 | Used in the preparation of single cell solution and preparation of Gel beads-in-emulsion (GEM) |
| Chromium Next GEM Single Cell 3′ Kit v3.1 | 10X Genomics | Cat#1000268 | Used in the preparation of single cell solution and preparation of Gel beads-in-emulsion (GEM) |
| Collagen from human placenta | Sigma Aldrich | Cat#C5533-5MG | |
| CYP34A forward | Eurofins | GATGGCTCTCATCCCAGACTT | Primers used to check for differentiation |
| CYP3A4 reverse | Eurofins | AGTCCATGTGAATGGGTTCC | Primers used to check for differentiation |
| DMEM/F12 | Thermo Fischer Scientific | Cat#11320074 | |
| EDTA | Sigma Aldrich | Car#E9884 | |
| Fast Read 102 counting slides | Biosigma | Cat# BVS100 | |
| Fetal Bovein Serum (FBS) | Capricorn | Cat#FBS-12A | |
| GlutaMAX | Thermo Fischer Scientific | Cat# 35050061 | |
| HEPES | Thermo Fischer Scientific | Cat3 15630080 | |
| L-WRN cells | ATCC | CRL-3276 | This cell line is used to make the conditioned media containg Wnt 3A, R-Spondin and Noggin. The protocol for the production of the conditioned media can be found on the manufacterures site. |
| MatriGel. GFR, LDEV free | Corning | Cat#354230 | |
| MUC-2 forward | Eurofins | TGTAGGCATCGCTCTTCTCA | Primers used to check for differentiation |
| MUC-2 reverse | Eurofins | GACACCATCTACCTCACCCG | Primers used to check for differentiation |
| N-acetyl-cysteine | Sigma Aldrich | Cat# A9165 | |
| OLMF4 forward | Eurofins | ACCTTTCCCGTGGACAGAGT | Primers used to check for differentiation |
| OLMF4 reverse | Eurofins | TGGACATATTCCCTCACTTTGGA | Primers used to check for differentiation |
| Penicillin/Streptomycin | Thermo Fischer Scientific | Cat#15140122 | |
| Recombinant human FGF basic | Peprotech | Cat#100-18B | |
| Recombinant human IGF-1 | BioLegend | Cat#590904 | |
| Recombinant mouse EGF | Thermo Fischer Scientific | Cat# PMG8043 | |
| SI forward | Eurofins | AATCCTTTTGGCATCCAGATT | Primers used to check for differentiation |
| SI reverse | Eurofins | GCAGCCAAGAATCCCAAT | Primers used to check for differentiation |
| TrypLE Express | Thermo Fischer Scientific | Cat#12605036 | |
| Y-27632 | Caymann Chemicals | Cat#10005583 |
Références
- Kretzschmar, K., Clevers, H. Organoids: Modeling development and the stem cell niche in a dish. Developmental Cell. 38, 590-600 (2016).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Tekes, G., Ehmann, R., Boulant, S., Stanifer, M. L. Development of feline ileum- and colon-derived organoids and their potential use to support feline coronavirus infection. Cells. 9, (2020).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375, 409-424 (2019).
- Zhou, J., et al. Infection of bat and human intestinal organoids by SARS-CoV-2. Nature Medicine. 26, 1077-1083 (2020).
- Sato, T., Clevers, H. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications. Science. 340, 1190-1194 (2013).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470, 105-109 (2011).
- de Graaf, M., van Beek, J., Koopmans, M. P. Human norovirus transmission and evolution in a changing world. Nature Reviews Microbiology. 14, 421-433 (2016).
- Leshem, E., et al. Real-world effectiveness of pentavalent rotavirus vaccine among bedouin and jewish children in southern Israel. Clinical Infectious Diseases : An Official Publication of the Infectious Diseases Society Of America. 62, 155-160 (2016).
- Karst, S. M. The influence of commensal bacteria on infection with enteric viruses. Nature Reviews Microbiology. 14, 197-204 (2016).
- Ettayebi, K., et al. Replication of human noroviruses in stem cell-derived human enteroids. Science. 353, 1387-1393 (2016).
- de Wit, E., van Doremalen, N., Falzarano, D., Munster, V. J. SARS and MERS: recent insights into emerging coronaviruses. Nature Reviews Microbiology. 14, 523-534 (2016).
- Scaldaferri, F., et al. The thrilling journey of SARS-CoV-2 into the intestine: From pathogenesis to future clinical implications. Inflammatory Bowel Diseases. 26, 1306-1314 (2020).
- Kipkorir, V., Cheruiyot, I., Ngure, B., Misiani, M., Munguti, J. Prolonged SARS-CoV-2 RNA detection in anal/rectal swabs and stool specimens in COVID-19 patients after negative conversion in nasopharyngeal RT-PCR test. Journal of Medical Virology. 92, 2328-2331 (2020).
- Lamers, M. M., et al. SARS-CoV-2 productively infects human gut enterocytes. Science. 369, 50-54 (2020).
- Stanifer, M. L., et al. Critical role of type III interferon in controlling SARS-CoV-2 Infection in human intestinal epithelial cells. Cell Reports. 32, 107863 (2020).
- Triana, S., et al. Single-cell transcriptomics reveals immune response of intestinal cell types to viral infection. bioRxiv. , (2020).
- Triana, S., et al. Single-cell analyses reveal SARS-CoV-2 interference with intrinsic immune response in the human gut. Molecular Systems Biology. 17, 10232 (2021).
- Tang, F., et al. mRNA-Seq whole-transcriptome analysis of a single cell. Nature Methods. 6, 377-382 (2009).
- Hwang, B., Lee, J. H., Bang, D. Single-cell RNA sequencing technologies and bioinformatics pipelines. Experimental & Molecular Medicine. 50, 1-14 (2018).
- García-Rodríguez, I., Sridhar, A., Pajkrt, D., Wolthers, K. C. Put some guts into it: Intestinal organoid models to study viral infection. Viruses. 12, 1288 (2020).
- Stanifer, M. L., et al. Asymmetric distribution of TLR3 leads to a polarized immune response in human intestinal epithelial cells. Nature Microbiology. 5, 181-191 (2020).
- Lees, E. A., et al. Using human induced pluripotent stem cell-derived intestinal organoids to study and modify epithelial cell protection against salmonella and other pathogens. Journal of Visualized Experiments: JoVE. (147), e59478 (2019).
- Mahe, M. M., Sundaram, N., Watson, C. L., Shroyer, N. F., Helmrath, M. A. Establishment of human epithelial enteroids and colonoids from whole tissue and biopsy. Journal of Visualized Experiments: JoVE. (97), e52483 (2015).
- Fujii, M., et al. Human Intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Bartfeld, S., Clevers, H. Organoids as model for infectious diseases: Culture of human and murine stomach organoids and microinjection of Helicobacter Pylori. Journal of Visualized Experiments: JoVE. (105), e53359 (2015).
- Hernandez, P. P., et al. Interferon-lambda and interleukin 22 act synergistically for the induction of interferon-stimulated genes and control of rotavirus infection. Nature Immunology. 16, 698-707 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon