Method Article
Gastrointestinal Organoidlerin Biyogüvenlik Seviye 3 (BSL-3) Koşullarında Patojen Enfeksiyonu ve Tek Hücre dizilimi için uyarlandırılması
Bu Makalede
Özet
Bu protokol, tek hücreli RNA dizileme (scRNAseq) teknolojisini kullanarak tek hücreli düzeyde konakçı/patojen etkileşimlerini karakterize etmek için insan bağırsak organoidlerinin apikal veya bazolateral tarafından nasıl enfekte olduğunu açıklar.
Özet
İnsan bağırsak organoidleri gastrointestinal sistemin patojen enfeksiyonlarını incelemek için en iyi hücresel modeli oluşturur. Bu organoidler GI sisteminin tüm bölümlerinden (mide, jejunum, duodenum, ileum, kolon, rektum) türetilebilir ve farklılaşma üzerine her bir bölümde doğal olarak bulunan hücre tiplerinin çoğunu içerir. Örneğin, bağırsak organoidleri besin emici enterositler, salgı hücreleri (Goblet, Paneth ve enteroendokrin), kök hücrelerin yanı sıra tüm soylara özgü farklılaşma aralarını (örneğin, erken veya olgunlaşmamış hücre tipleri) içerir. Bulaşıcı hastalıkları incelemek için gastrointestinal sistem kaynaklı organoidlerin kullanılmasındaki en büyük avantaj, enterik patojen tarafından hangi hücre tipinin hedeflendiğini tam olarak belirleme ve gastrointestinal sistemin farklı bölümlerinin ve spesifik hücre tiplerinin patojen zorluklarına benzer şekilde yanıt verip vermediğini ele alma olasılığıdır. Son yıllarda, gastrointestinal modellerin yanı sıra diğer dokulardan organoidler, viral tromizm ve patogenez mekanizmalarını incelemek için bunların yanı sıra bunların yanı sıra 2015'ten beri 2008'de 100'den fazla kişi kullanıldı. Bununla birlikte, son derece patojenik virüsler kullanırken organoid kullanmanın tüm avantajlarından yararlanmak teknik bir zorluğu temsil eder ve sıkı biyogüvenlik hususları gerektirir. Ek olarak, organoidler genellikle üç boyutta yetiştirildiği için, hücrelerin bazolateral tarafı organoidin dışına, apikal tarafı ise organoidlerin iç kısmına (lümen) bakmaktadır. Bu organizasyon, birçok enterik enfeksiyonun yutulması takiben hücrelerin apikal/aydınlık tarafından başlaması nedeniyle enterik patojenler için bir zorluk teşkil eder. Aşağıdaki makale, hücre tipine özgü konakçı/patojen etkileşimlerini karakterize etmek için tek hücreli RNA dizilimini gerçekleştirmek için enfeksiyon tarafını (apikal vs. bazolateral) göz önünde bulundurarak insan bağırsak organoidlerini enterik patojenlerle enfeksiyona hazırlamak için kapsamlı bir protokol sağlayacaktır. Bu yöntem, organoidlerin hazırlanmasının yanı sıra biyogüvenlik düzeyi 3 (BSL-3) muhafaza koşulları altında bu işi gerçekleştirmek için gereken hususları detaylandırıyor.
Giriş
hücre tipine özgü tromizm ve insan enterik virüslerine karşı hücre tipine özgü immün yanıtın incelenmesi, birincil insan hücresel modellerinin eksikliği nedeniyle tarihsel olarak zor olmuştur. Bu sınırlama şimdi organoidlerin gelişimi ile kısmen ortadan kaldırılmıştır1. Gastrointestinal sistem durumunda, insanlar ve diğer birkaç tür (örneğin,murine, sığır, kedi, yarasa) 2 , 3,4,5,6için mide ve bağırsak organoid modelleri geliştirilmiştir. Bağırsak organoidleri insan bağırsak epitelinin yapısal mimarisini yeniden üretir ve mahzen ve villi benzeri yapılar, fonksiyonel bağırsak soyları içerir ve hatta daha önce bilinmeyen hücre soylarını tanımlamak için kullanılmıştır. Bağırsak organoidlerini büyütmek için iki farklı yaklaşım kullanılabilir. İlk olarak, mahzen içeren bağırsak sapları hücreleri doku reeksiyonlarından veya biyopsilerden izole edilir ve genişlemek için belirli kültür koşulları altında (örneğin, Wnt3A, R-spondin, Noggin ve EGF) yetiştirilir ve daha sonra kök hücreleri çoğu bağırsak hücresi soyuna(örneğin, enterositler, Paneth hücreleri, Goblet hücreleri, enteroendokrin hücreler) ayırt eder7. Bu yöntem, organoidlerin gastrointestinal sistemin tüm bölümlerinden (örneğin, mide, duodenum, jejunum, ileum ve kolon) izolasyonusağlar. İkinci yöntem, daha sonra adım adım bir işlemde bağırsak epitel hücrelerine farklılaştırılan insan kaynaklı pluripotent veya embriyonik kök hücrelere dayanır8. Bu indüklenen kök hücre bazlı organoidler genellikle hasta kaynaklı organoidlere kıyasla doğada daha embriyonik olarak tanımlanır. Tüm bu organoid modeller bağırsak sistemini oluşturmak için gereken gelişimsel ipuçlarını çözmek için kritik öneme sahip olsa da, bulaşıcı hastalık araştırmalarında kullanımları henüz emekleme aşamasındadır.
Enterik virüs, pikornavirüsler(örneğin,EV-71), reovirüsler (örneğin rotavirüs) ve calicivirüsler (örneğin, norovirüs)9gibi gastrointestinal sistem yoluyla enfekte olan tüm virüsleri kapsayan geniş bir terimdir. Enterik virüsler, bulaşıcı yaşam döngülerini kontamine gıda ve suyun yutulması yoluyla başlatır, bu da gelişmekte olan ülkelerdeki insanları, arıtılmamış atıkların çevreye boşaltılması ve enfeksiyonun başlangıcından sonra tıbbi bakım eksikliği nedeniyle yüksek risk altında bırakır10. Patojenin türüne bağlı olarak, enfeksiyon bağırsak astarının sızması nedeniyle gastroenterit, kusma ve / veya sulu ishale yol açabilir. İnsan norovirüsleri,dünyaçapında 600 milyondan fazla enfeksiyona ve 15 milyon hastaneye yatmaya yol açan son derece yaygın ve son derece bulaşıcı bir enterik patojendir. Organoidler, daha önce standart hücre kültürü modellerinde kültürlenemeyen insan norovirüslerinin enfeksiyonunu ve replikasyonunu destekledikleri için norovirüs araştırmalarının anahtarı olmuştur12.
Son yirmi yılda, koronavirüsler önemli insan patojenleri olarak ortaya çıktı13. Bu aile, bu virüsler üzerinde araştırma yaparken sıkı güvenlik seviyesi muhafazaları gerektiren son derece patojenik MERS, SARS-CoV-1 ve SARS-CoV-2'yi içerir. İlginçtir ki, bu patojenlerin üçü de çoğunlukla indüklenmiş solunum semptomları ve sıkıntıları ile tanınırken, bu virüslerin sadece solunum yollarını değil, diğer organları da enfekte ettiği açıktır. SARS-CoV-2 enfekte hastalarda solunum sıkıntısının yanı sıra indüklenen önemli bir patoloji gastrointestinal semptomların varlığıdır14. SARS-CoV-2 enfekte hastaların bir kısmı, çok hafif ila şiddetli ishal arasında değişen bu tür semptomlar gösterir. Ayrıca enfekte hastaların dışkı ve gastrointestinal sistem biyopsilerinde SARS-CoV-2 genomları saptanabilir15. Daha da önemlisi, gastrointestinal semptomların varlığı, MERS ve SARS-CoV-1 enfekte hastalarda da gözlendiği gibi SARS-CoV-2 ile sınırlı değildir. SARS-CoV-2'nin gastrointestinal sıkıntıya nasıl yol açtığını ve gastrointestinal sistemde SARS-CoV-2'nin tropizmini tam olarak tanımlamak için, insan bağırsak organoidleri önemli bir araç olmuştur ve şimdi bu patojene hücre tipine özgü yanıtları çözmek için16,17.
Bir hücre popülasyonunun transkripsiyonel profillemesi (toplu RNA dizilimi), hem ölümsüzleştirilmiş hücre hatlarının hem de organoidlerin patojen enfeksiyonlarını değerlendirirken standart bir uygulama olmuştur. Bu, patojenlere yanıt olarak küresel değişiklikleri belirlememize izin verirken (örneğin, sitokinlerin yukarıgülasyonu), toplu RNAseq, bir popülasyondaki belirli hücrelerin neden diğerlerinden daha fazla enfeksiyona eğilimli olduğunu belirlememize izin vermez. Tek hücreli RNA dizilimi (scRNAseq), hücre soyuna özgü transkripsiyonel programları çözmek için güçlü bir araç haline gelmiştir ve bu programların virüs enfeksiyonunu nasıl desteklediğini veya bastırdığını belirlemek için kullanılabilir18,19. scRNAseq'in ilk açıklaması 2009 yılındaydı ve bir fare blastomere20'debulunan farklı hücrelerin transkripsiyon profillerini değerlendirmek için kullanıldı. Bu teknolojiler artık genişletildi ve birkaç farklı platform üzerinden uygulanabilir. Bu teknolojinin ilk sürümleri, genellikle 96 veya 384 kuyu plakalarıyla sınırlı olan sıralama için tek tek hücreleri ayırmak için floresanla aktive edilmiş hücre sıralayıcısı (FACS) uyguladı, böylece örnek başına analiz etmek için 300 bireysel hücre verdi21. Bu yöntemler artık tek hücreli dizileme platformları tarafından gelişmiştir, bu platformlar tek hücreleri boncuk içeren barkodlu tek damlacıklara kapsüllemek için mikroakışkan bir cihaz kullanmaktadır. Bu teknoloji, örnek durum başına 10.000'e kadar hücrenin yakalanmasını sağlar.
Organoid teknolojisini scRNAseq ile birleştirmek, enterik patojenlerin gastrointestinal sistemi hücre tipine özgü bir şekilde nasıl etkilediğini incelememizi sağlar. Bununla birlikte, çeşitli teknik ve biyogüvenlik hususlarına dikkat edilmelidir. Her şeyden önce, klasik organoid kültür yöntemleri (hücre dışı matrise (ECM) gömülü 3 boyutlu (3D) organoidler, epitel hücrelerinin bazolateral tarafını organoidin dışına maruz bırakır. Enterik patojenler enfeksiyonlarını kontamine gıda / suyun yutulması yoluyla başlattıkça, enfeksiyon en sık bu 3D bağırsak organoidlerinde erişilemeyen hücrelerin apikal tarafından başlar. Bu nedenle, organoidlerin apikal tarafı patojen enfeksiyonu için erişilebilir hale getirmek için hazırlanması gerekir ya 2D tohumlama yoluyla, böylece hücrelerin apikal tarafını doğrudan açığa çıkarmak veya mikroenjeksiyonyoluyla 22,23. İkincisi, enfekte biyolojik örneklerin scRNAseq'ini gerçekleştirmek için, bulaşıcı doğalarını göz önünde bulundurmak önemlidir. Sonraki RNAseq için tek hücreli izolasyondan önce hücreleri düzeltmek ve patojenleri inaktive etmek için yöntemler önerilmiş olsa da, bu yöntemler genellikle sıralama kalitesinde bir düşüşe yol açar18. Aşağıdaki protokol, enfeksiyon tarafını (apikal ve bazolateral enfeksiyon) göz önünde bulundurarak bağırsak organoidlerini enterik virüslerle enfekte etmek için çeşitli yaklaşımları açıklayacaktır (Şekil 1). Ayrıca, protokol, scRNAseq için yüksek patojenik virüslerle enfekte olmuş organoidlerden tek hücreleri ayrıştırmak ve izole etmek için bir iş akışı içerecektir. Protokol, aerosollerin ve potansiyel kontaminasyonun üretilmesini önlemek için biyogüvenlik seviye-3 (BSL-3) muhafaza koşulları altında çalışırken uygulanması gereken temel adımları vurgulayacaktır.
Protokol
Aşağıdaki protokol için Heidelberg Üniversite Hastanesi'nden kolon rezeksiyonu veya ileum biyopsilerinden insan dokusu alındı. Bu çalışma Helsinki Bildirgesi uyarınca tüm deneklerden bilgilendirilmiş yazılı onay ile Heidelberg Üniversite Hastanesi'nin önerileri altında gerçekleştirilmiştir. Tüm örnekler anonim bir şekilde alındı ve muhafaza edildi. Protokol, S-443/2017 protokolü kapsamında Heidelberg Üniversite Hastanesi Etik komisyonu tarafından onaylandı.
1. Bağırsak ve kolon organoidlerinin bakımı ve geçişi
DİkKAT: İnsan bağırsak organoidleri insan dokusundan veya indüklenmiş pluripotent/embriyonik kök hücrelerden elde edilir ve bu nedenle etik onay gereklidir. Ülkeye özgü düzenlemelere uyulması gerekiyor. İnsan materyali genellikle test değildir ve bu nedenle genellikle BSL-2 malzemesi olarak kabul edilir. Deneyin gerçekleştiği ülkede uygun muhafaza koşullarının onaylanması gerekir.
- Daha önce açıklanan yöntemleri kullanarak izole dokulardan ve/veya biyopsilerden bağırsak ve kolon organoidleri hazırlayın2. Ayrıca, organoidlerin hasta kaynaklı materyalden veya iPSC'lerden nasıl hazırlanacağına dair daha teknik ayrıntılar Leesve ark.
- Organoid kültürleri kurulduktan sonra, organoidleri enterik patojenlerle enfeksiyonları gerçekleştirmeye hazırlamak için aşağıda açıklanan bölme rutinini izleyin.
- Tohum 20-100 organoid 50 μL%100 ECM çözeltisinde 24-kuyu doku dışı kültür tedavi plakaları. Kuyu başına 500 μL büyüme ortamı (Tablo 1) ekleyin.
- Eski ortamın 250 μL'lik kısmını çıkararak ve her kuyuya 250 μL taze büyüme ortamı ekleyerek ortamı her 2 günde bir değiştirin. Ortamı değiştirmeden önce ortamı oda sıcaklığına ısıtın.
DİkKAT: Soğuk ortam organoid içeren ECM çözeltisini sıvılaştıracaktır. - Organoidleri haftada bir kez, iç kısım ölü hücrelerin birikmesi nedeniyle karanlık olmaya başladığında geçirin. Bunun bir örneğini Şekil 2'de bulabilirsiniz.
- Bölünme gününde, ECM çözeltisini -20 °C'den çıkarın ve buzda çözün.
- 37 °C'de bölündükten sonra organoidleri tohumlamak için kullanılacak yeni boş hücre kültür plakasını yerleştirin (bu, ılık olması için en az 1 saat gerektirir ve gece boyunca ısıtılabilir). Kültür medyasını oda sıcaklığına ısıtın.
- Büyüme ortamını bir P1000 pipetle çıkarın ve ECM çözeltisini kısmen sıvılaştırmak ve plakadan ayrışmak için her kuyuya 3 dakika boyunca 500 μL soğuk 1x fosfat tamponlu salin (PBS) ekleyin.
- ECM çözümünün tam olarak bozulmasını sağlamak için bir P1000 pipet kullanın (450 μL'de kurulum). PBS, ECM çözeltisi ve organoidleri yeniden dürtmek için 10 kez yukarı ve aşağı pipet, yeniden sulandırılmış organoidleri 15 mL konik bir tüpe aktarın ve buza yerleştirin.
- Aynı organoidlerin birden fazla kuyularını aynı konik tüpe toplayın.
- Birden fazla farklı organoid (farklı donörler, farklı bölümler, farklı ön tedavi vb.) aynı anda bölünürse, bunları farklı konik tüplerde toplayın. Toplarken, konik tüpleri buz üzerinde muhafaza edin.
- Numuneleri 500 x g'da 4 °C'de 5 dakika döndürün. Organoid peleti altta tutmak için PBS'yi bir pipetle dikkatlice çıkarın.
- Organoidlerin peleti çok gevşek olduğundan ve PBS'yi çok hızlı çıkarırken kolayca aspire edilebildiğinden, takılı bir pipet ile vakumlu bir atık sistemi kullanmaktan kaçının.
- Konik tüpe 1 mL%0,05 trypsin ekleyin ve P1000 pipet ile 10 kez yukarı ve aşağı pipetleme yaparak organoidleri yeniden hayata geçirdiniz. Organoid içeren konik tüpü 37 °C'de 3 dakika kuluçkaya yatırın.
- Sindirimi durdurmak için %10 fetal sığır serumu (FBS) ve %1 penisilin/streptomisin içeren 2 mL DMEM/F12 ortamı ekleyin ve P1000 pipet ile 10 kez yukarı ve aşağı pipetle pipetle organoidleri bozmak için yeniden biriktirin.
- Numuneleri 500 x g'da 4 °C'de 5 dakika döndürün. Konik tüpleri santrifüjden çıkarın ve buzda saklayın.
- Organoid peletin altta tutmak için 5 mL'lik tek kullanımlık pipet ile media/tripsin dikkatlice çıkarın. Yaklaşık 500 μL ortam bırakın ve bunu bir P1000 pipetle çıkarın.
- Tüm konik tüplerden media/tripsin çıkarıldıktan sonra, 24 kuyulu hücre dışı kültür işlenmiş plakayı 37 °C inkübatörden çıkarın ve hücre kültürü kaputunun altına yerleştirin.
- Bireysel donör organoidlerin büyüme alışkanlıklarına bağlı olarak 1:3 ila 1:5 oranında bölünmüş organoidlerle konik tüpe% 100 ECM çözeltisi (buzda tutulur) ekleyin. (Örneğin, 50 μL ECM çözeltisi damlasında 20-100 organoid içeren bir kuyu geçtiyse, organoid peletini 150-250 μL buz gibi ECM çözeltisine yeniden depolar.)
- 24 kuyulu hücre dışı kültür işlenmiş plakanın kuyusu başına 50 μL ECM çözeltisi/ organoid karışımı 37 °C'ye kadar önceden ısıtılır.
NOT: ECM çözeltisi ısındıktan sonra çok hızlı bir şekilde polimerize olacaktır. ECM sokumini kullanım sırasında her zaman soğuk tutun (buzda saklanır). Organoidler yeniden depolandığında, hemen yeni bir tabağa tohum koyun. Yeni başlayanlar için, tohumlama için ekstra zaman tanımak için bir kutu pipet ucunun -20 ° C'de saklanması önerilir. - ECM çözeltisinin polimerize olmasını sağlamak için 24 kuyu plakasını 37 °C'de 10-15 dakika kuluçkaya bırakın.
- Polimerizasyondan sonra, her kuyuya 500 μL büyüme ortamı (Tablo 1)26 ekleyin ve organoidleri 37 °C'de kuluçkaya yatırın. Organoidleri günlük olarak mikroskopi ile kontrol edin. 1.4. adımda olduğu gibi medyayı her 2 günde bir değiştirin.
2. Organoidlerin apikal enfeksiyon için iki boyutlu (2D) hazırlanması
NOT: Aşağıdaki protokol, bağırsak epitel hücrelerini apikal tarafından enfekte etmek için bir hücre kültürü plakasındaki hücrelerin monolayer'ı olarak bağırsak organoidlerinin nasıl tohumlanacağını açıklayacaktır. Dizileme deneyleri için 48 kuyu plakasını ve immünofiloresans yaklaşımlarını kullanarak enfeksiyonu kontrol etmek için 8 kuyulu cam tabanlı hazne slaydını kullanın.
- Bölüm 1'de açıklandığı gibi organoidleri yetiştirin ve koruyun.
- Organoidlerin 2D olarak tohumlanmasının öncesinde, 48 kuyu plakalarını ve 8 kuyulu cam tabanlı hazne slaydı, kuyu başına 37 °C'de 1 saat boyunca su içinde% 2,5 insan kollajeninin 200 μL'si ile kaplayın.
NOT: Bağırsak organoidleri en iyi 48 kuyulu plakalarda ve 8 kuyulu cam tabanlı hazne kaydırağı ile tohumlanır. Deneyim, 96 kuyu plakalarında iyi enfekte olmadıklarını göstermiştir. Transwell kesici uçlar, 2D olarak hem apikal hem de bazolateral enfeksiyona izin vermek için de kullanılabilir. Transwells kullanılırsa, birleştiği monolayer'ı doğrulamak için enfeksiyondan önce trans-epitel elektrik direncini (TEER) izleyin. Normalde, bağırsak organoidleri 450-600 Ohm / cm2TEER ile sıkı bir bariyere sahiptir. - Tohum 100-150 organoid her kuyuda 48 kuyulu bir plaka veya bir kuyu için 8-well cam tabanlı oda kaydırağı.
- Organoid sayısını tahmin etmek için, bölüm 1'de hazırlanan 24 kuyu plakasının 50 μL ECM çözelti damlasında bulunan organoid sayısını sayın. Ortalama olarak, yaklaşık 15.000-30.000 hücre verecek 1-2 kuyuya ihtiyaç vardır.
- ECM çözeltisini bozmak ve organoidleri denemek için 1.8-1.17 adımlarını izleyin.
- İnsan kollajenini 48 kuyu plakalarından ve 8 kuyulu cam tabanlı hazne slaydından çıkarın.
- Organoid peleti konik tüpte 250 μL büyüme ortamı / kuyusunda yeniden atın ve karışımı kolajen kaplı kuyulara ekleyin. Plakayı 37 °C'lik bir inkübatöre yerleştirin.
NOT: Deneyler yapılırken birden fazla koşul karşılaştırılır (mock vs. enfekte +/- ilginin tedavisi). 2D tohumlu organoidlerin her kuyusu arasındaki değişkenliği en aza indirmek için, gerekli organoidlerin toplam sayısını aynı konik tüpte toplayın. Organoidleri 24 kuyulu bir plakanın 12 kuyusundan toplamak 1 mL tripsin ve 2 mL nötralize edici ortam kullanabilir. 12-24 kuyu kullanırken, bunu 2 mL tripsin ve 4 mL nötralize edici ortama çıkarın. - 48 saat sonra, plakayı inkübatörden çıkarın ve hücre kültürü başlığına yerleştirin. Büyüme medyasını çıkarın ve farklılaşma ortamı kuyusu başına 250 μL ile değiştirin (Tablo 1). Bu ortam değişikliğini 48 saat sonra yineleyin.
- 48 saat sonra, RNA çıkararak, 250 ng RNA ile cDNA yaparak ve kök hücreler (OLFM4 ve/ veya SMOC2), kadeh hücreleri (MUC2), enteroendokrin hücreler (CHGA) ve enterositler (SI ve / veya CYP3A4) için astarlar kullanarak SYBR yeşil tabanlı qPCR gerçekleştirerek farklılaşmayı (farklılaştırma ortamına geçişten dört gün sonra) onaylayın (Şekil 3).
NOT: Büyüme medyasından farklılaşma ortamına geçtikten sonra organoidler kök hücre belirteçlerinin (OLFM4 ve/veya SMOC2) ifadelerini azaltacak ve goblet hücrelerinin (MUC2), enteroendokrin hücrelerin (CHGA) ve enterositlerin (SI ve/veya CYP3A4) ifadelerini qPCR ile artıracaktır. Büyüme ve farklılaşma ortamlarındaki her hücre türüne özgü işaretleyicinin ifade düzeyini karşılaştırmak için ekstra bir kuyu hazırlayın ve büyüme ortamıyla koruyun. - Farklılaşmanın onaylanması üzerine organoidler apikal enfeksiyona hazırdır. Organoidleri, tercih edilen patojen için gerekli olan biyogüvenlik seviyesi muhafazasına taşıyın.
DİkKAT: BSL-2 veya BSL-3 muhafazası altındaki patojenleri işlerken enstitünün yerel yönetmeliklerine ve standart çalışma prosedürlerine bakın. - 2D olarak yetiştirilen bağırsak organoidlerini apikal yanlarından enfekte etmek için, bir P1000 pipet ile ortamı çıkarın ve farklılaşma ortamlarında deney için gereken enfeksiyonun çokluğunda seyreltilmiş patojen ekleyin (minimum patojen / ortam karışımı hacmi kuyu başına 50 μL ve maksimum hacim kuyu başına 250 μL'dir).
- Enfeksiyonun 37 °C'de 2 saat boyunca hücre kültürü inkübatörde bulunan bir rocker masasıyla veya plakayı her 15-20 dakikada bir manuel olarak sallayarak ilerlemesine izin verin. Bu süreyi tercih eden patojene göre optimize edin.
- 2 saat sonra, ortamı bir P1000 pipetle çıkarın ve taze farklılaşma ortamı kuyusu başına 250 μL ile değiştirin. Hücreleri tek hücreli sıralamanın zaman noktasına kadar 37 °C'de kuluçkaya yatırın.
- Hücreleri tek hücreli sıralamaya hazırlamak için bölüm 4'e geçin.
3. Organoidlerin apikal ve bazolateral enfeksiyon için üç boyutlu (3D) olarak hazırlanması
- Organoidleri bölüm 1'de açıklandığı gibi 24 kuyulu, hücre dışı kültür tedavi tabağında yetiştirin.
- Geçtiktan iki gün sonra, plakayı inkübatörden çıkarın ve bir hücre kültürü başlığına yerleştirin.
- Büyüme medyasını bir P1000 pipetle çıkarın, oda sıcaklığına önceden ısıtılmış 500 μL / kuyu farklılaşma ortamı ile değiştirin ve plakayı 37 ° C inkübatöre yerleştirin.
- 48 saat sonra, taze farklılaşma ortamı (500 μL / kuyu) ile değiştirin.
NOT: Organoidler enfeksiyondan önce toplam 4 gün boyunca farklılaşma ortamlarında tutulur. - Adım 2.9'da açıklandığı gibi farklılaşmayı onaylayın.
- Farklılaşmanın meydana geldiğinin doğrulanması üzerine organoidler enfeksiyona hazırdır.
- ECM'yi buzda eritin. Farklılaşma ortamını oda sıcaklığına ısıtın ve 37 °C'de 24 kuyulu bir plakayı ısıtın.
- Enfeksiyonları gerçekleştirmek için organoidleri ECM çözeltisinden çıkarın.
NOT: Virüslerin hücreler yerine ECM çözümüne yapışmak yerine mümkün olduğunca çok ECM sokummasını çıkarın. Organoidlerin etrafında çok fazla ECM çözeltisi kalırsa, enfeksiyoloji ciddi şekilde etkilenecektir. - 500 μL soğuk 1x PBS ekleyerek ve 3 dakika kuluçkaya yatırarak ECM'yi bozun. 10x yukarı ve aşağı pipet için bir P1000 kullanın. Organoidleri bir tüpte birleştirin ve 5 dakika boyunca 500 x g'da santrifüj. PBS'yi P1000 ile çıkarın.
NOT: Her enfeksiyon durumu arasındaki değişkenliği en aza indirmek için, 24 kuyulu bir plakanın birkaç kuyusundan gelen organoidleri aynı konik tüpte birleştirin. Örneğin, enfeksiyon için sekiz koşul gerekiyorsa, 24 kuyulu bir plakanın sekiz kuyusu (her biri ~100 organoid içeren) birleştirilecek ve daha sonra iğne bozulmasından sonra yeni bir 24 kuyu plakasının sekiz kuyusuna bölünecektir (bkz. adım 3.12). - Organoidleri 1 mL farklılaşma ortamına yeniden sunun. Apikal ve bazolateral enfeksiyon için adım 3.10.1'i ve bazolateral enfeksiyon için sadece 3.10.2 adımlarını izleyin.
- 1 mL şırıngaya 27 G'lik bir iğne takın ve organoidlerin bozulmasına ve enfeksiyonun hem apikal hem de bazolateral taraflarda ortaya çıkmasına izin vermek için peleti altı kez yeniden biriktirin. 3.11. adıma geçin.
NOT: Organoidler, iğne bozulmasından önce gözlendiğinde karanlık bir merkeze sahip klasik kist görünümlü ve ahtapot tomurcuklu organoidler olmalıdır. Kesintiden sonra, bu organoidler daha az veya hiç karanlık iç mekan olmadan daha küçük görünecektir. Enfeksiyon gerçekleştirirken, her zaman en az iki durum (mock ve enfeksiyon) olacaktır, 24 kuyulu bir plakanın en az iki kuyusu başlangıçta iğne bazlı bozulma için 15 mL konik bir tüpte birleştirilecektir (resüspenzyon için neden en az 1 mL kullanıldığını açıklar). İkiden fazla koşul gerçekleştirirken, 24 kuyulu bir plakanın 10 kuyusını tek bir 15 mL konik tüpte birleştirin ve iğne bozulması için 1 mL farklılaşma medyasında yeniden dirin. Kesintinin ardından, n + 1 başına 500 μL farklılaşma ortamı ekleyin (örneğin, 10 kuyu kullanıyorsanız, toplam 5,5 mL'ye sahip olmak için 4,5 mL ile yükleme yapın). 10'dan fazla koşul gerekiyorsa, birkaç konik tüp kullanın. Organoidler bu şırınna hacmi ile daha iyi bozulduğu için 1 mL şırınna önerilir. Şırındıya alternatif olarak iyi düzleştirilmiş bir P1000 ucu kullanarak kullanılabilir. - Organoidleri kuyu başına 500 μL farklılaşma ortamına yeniden sunun. Organoidleri bozmamaya dikkat edin ve apikal tarafa erişilmediğinden emin olun. 3.11. adıma geçin.
- 1 mL şırıngaya 27 G'lik bir iğne takın ve organoidlerin bozulmasına ve enfeksiyonun hem apikal hem de bazolateral taraflarda ortaya çıkmasına izin vermek için peleti altı kez yeniden biriktirin. 3.11. adıma geçin.
- Kuyu başına 500 μL organoid süspansiyonu P1000 pipet kullanarak 24 kuyu hücreli bir kültür plakasına aktarın ve plakayı tercih edilen patojen için gerekli olan biyogüvenlik seviyesi muhafazasına taşıyın.
DİkKAT: BSL-2 veya BSL-3 muhafazası altında patojenleri işlerken yerel düzenlemelere ve enstitünün standart çalışma prosedürlerine bakın. İğne ile olası kazaları önlemek için her zaman BSL-3 dışındaki organoidlerin iğne bozulmasını gerçekleştirin. Yerel düzenlemeler BSL-3'te iğne kullanımını da engelleyebilir. - Deney için gerekli olan enfeksiyonun çokluğuna ulaşmak için farklılaşma ortamlarında seyreltilmiş patojeni ekleyin. Toplam 500 μL hacmi aşmayın (24 kuyu plakasında toplam 1 mL olması gerekir).
- Enfeksiyonun 37 °C'de hücre kültürü inkübatöründe bulunan bir rocker masasıyla veya plakayı her 15-20 dakikada bir manuel olarak sallayarak 2 saat boyunca (bu sefer tercih edilen patojene uyarlanmış olması gerekecektir) devam etmesine izin verin.
- 2 saat inkübasyonu takiben, organoidleri durum başına bir 1,5 mL tüp halinde toplayın ve 4 °C'de 5 dakika boyunca 500 x g'da döndürün.
- Patojen içeren ortamı P1000 pipetle çıkarın ve buzda saklayın. Organoid peletini PBS ile bir kez yıkayın.
- Organoidleri 50 μL%100 ECM çözeltisinde (daha önce buzda çözülmüş), plakayı önceden 37 °C'ye ısıtılmış 24 kuyulu hücre dışı kültür işlenmiş bir plakaya yeniden koyun ve ECM çözeltisinin polimerize olmasını sağlamak için 24 kuyu plakasını 37 °C'de 10-15 dakika kuluçkaya bırakın.
- Polimerizasyondan sonra, her kuyuya oda sıcaklığında 500 μL farklılaşma ortamı ekleyin ve tek hücreli sıralama için hasat olana kadar 37 ° C'de kuluçkaya yatın.
NOT: Hasatın tohumlama sonrası 48 saatten fazla gerçekleşmesi gerekiyorsa, eski ortamı çıkararak ve 500 μL taze farklılaşma ortamıyla değiştirerek medyayı her 2 günde bir değiştirin. Bununla birlikte, deneyim organoidlerin farklılaşma ortamı altında yetiştirildiği için, 48 saatten fazla hayatta kalamayacaklarını göstermiştir.
4. Biyogüvenlik seviye 3 (BSL-3) koşullarında tek hücreli çözeltinin hazırlanması ve Jel boncuk emülsiyonunun (GEM' ler) hazırlanması
NOT: Aşağıdaki adımların tamamlanması, tek hücreli dizilemeekipmanının (Malzeme Masası)ve 100 μL reaksiyonları işleyebilen bir PCR makinesinin bir BSL-3 tesisinde bulunmasını gerektirir. Organoidler bölüm 1'de açıklandığı gibi yetiştirilir ve patojene ve giriş yoluna bağlı olarak 2-3. Enfeksiyon sonrası önceden belirlenmiş bir zamanda organoidler toplanır. Bağırsak organoidlerini toplamak için kullanılan yöntemin altında açıklanmıştır.
- Enfekte organoidleri hasat etmeden önce, Tek Hücreli Jel boncuklarını (Malzeme Tablosu) -80 ° C'den çıkarın ve oda sıcaklığına (en az 30 dakika önce) ısıtın.
- Ek olarak, RT reaktifini, Azaltıcı B ve RT enzimI C'yi (hepsi -20 °C'de saklanır) oda sıcaklığına dengeler. Üreticinin talimatlarında açıklandığı gibi şablon anahtarı oligosunu yeniden uygulayın.
NOT: Düşünülen patojen için belirlenen standart çalışma prosedürünü takiben yerel biyogüvenlik yönetmelikleri ile ilgili olarak aşağıdaki tüm adımların gerçekleştirilmesi gerekmektedir. BSL-3 çalışması için bir kural olarak, bir hücre kültürü başlığından çıkan tüm damarların (plakalar, tüpler vb.) dış yüzeyinin uygun şekilde dezenfekte edilmesi sağlanmalıdır. Aynı durum deneyleri yapan kişinin elleri/eldivenleri için de geçerlidir. - 2D olarak tohumlanan organoidler üzerinde enfeksiyonlar gerçekleştirmek için (bölüm 2) adım 4.4'e geçin. 3D organoidler üzerinde enfeksiyonlar yapmak için (bölüm 3) bölüm 4.5'e geçin.
- 2D organoid enfeksiyonları için, hücre kültürü plakasını kaputa getirin ve farklılaşma medyasını bir P1000 pipetle çıkarın.
- Her kuyuya oda sıcaklığında 250 μL 1x PBS ekleyin.
- PBS'yi bir P1000 pipetle çıkarın ve 48 kuyulu bir plakanın her kuyusuna 250 μL oda sıcaklığı ayrıştırma enzimi (örneğin, TrypLE Express) ekleyin. Eldivenleri değiştirin, plakayı temizleyin ve plakayı 37 °C inkübatöre ayrışma enzimi ile yerleştirin.
- Her 5 dakikada bir mikroskopi ile hücre ayrışması gözlemleyin.
NOT: 2D olarak kültürlenmiş bağırsak organoidlerinin tek hücreye ayrıştırılmak yaklaşık 15 dakika sürer. Bu sürenin, başlangıçta kaç organoidin tohumlanıp enfekte olduğuna ve patojene bağlı olacağı için ayarlanması gerekecektir, çünkü bazı patojenler daha sitopatiktir ve organoidlerin diğerlerinden çok daha hızlı dağılmasına neden olur. - Görünür bir tek hücre süspansiyonunun onaylanmasından sonra, plakayı hücre kültürü kaputuna geri getirin ve 48 kuyu plakasının kuyusu başına% 10 FBS içeren 250 μL DMEM / F12 ortamı ekleyerek sindirimi durdurun.
- P1000 pipet kullanarak hücreleri 15 mL konik bir tüpe toplayın.
- Eldivenleri değiştirin, tüpü temizleyin ve numuneleri 4 °C'de 5 dakika boyunca 500 x g'da döndürün.
- Hücre peletini altta tutmak için medya/ayrışma enzimini bir P1000 ile dikkatlice çıkarın. Tek hücreleri %0,1 BSA içeren en az PBS hacminde yeniden biriktirin. Bağırsak organoidleri için, 48 kuyu plakasının her kuyusu için 250 μL'de yeniden dirildi.
- Hücre süspansiyonlarını, büyük kümeleri çıkarmak ve hücre içeren FACS tüpünü buza yerleştirmek için filtreli bir FACS tüpüne geçirin.
- Hücre sayımına ve ana karışımın hazırlanmasına devam etmek için 4.6 adımına geçin.
- 3D organoidlerin enfeksiyonları için, plakayı inkübatörden çıkarın ve hücre kültürü başlığına yerleştirin.
- Farklılaşma medyasını P1000 pipet ile 24 kuyu plakasının her kuyusundan çıkarın. Her kuyuya 500 μL buz gibi 1x PBS ekleyin ve buz üzerinde 3 dakika kuluçkaya yatırın.
- ECM çözümünün tam olarak bozulmasını sağlamak için bir P1000 pipet kullanın (450 μL'ye ayarlayın). PBS, ECM çözeltisi ve organoidleri yeniden kullanmak için pipet 10 kez yukarı ve aşağı; yeniden süzülen organoidleri 15 mL konik bir tüpe aktarın ve buza yerleştirin. Her enfeksiyon durumunu kendi 15 mL konik tüpünde toplayın.
NOT: 15 mL konik tüp kullanmak, 50 mL konik tüp veya 1,5 mL tüpten daha iyi, daha belirgin bir hücre peleti verir. - Eldivenleri değiştirin ve tüpü hücre kültürü başlığından çıkarın. Tüpün dışını temizleyin.
- Numuneleri 500 x g'da 4 °C'de 5 dakika döndürün.
- Tüpü hücre kültürü başlığına geri taşıyın ve organoid peletini tüpün altından yeniden canlandırmamak için PBS'yi P1000 pipetle çıkarın.
- Peletin 1 mL ayrışma enziminde (örneğin, TrypLE Express) yeniden süzülür. Eldivenleri değiştirin, tüpü temizleyin ve numuneleri 37 °C'de kuluçkaya yatırın.
- 30 dakika boyunca her 10 dakikada bir, tüpü hücre kültürü başlığına geri taşıyın ve 10 kez P1000 pipetle yukarı ve aşağı pipetle pipetleyarak organoidleri yeniden biriktirin.
NOT: Normalde, bağırsak organoidlerinin 3D olarak enfekte edildiğinde tek bir hücre süspansiyonu oluşturmak için yaklaşık 30 dakika gerekir. - Organoidlerin ne zaman tek hücrelere dağıldırılmalarını belirlemek için, bir p10 pipet kullanarak organoid süspansiyonunun 10 μL'sini alın.
- Süspansiyonu tek kullanımlık plastik hücre sayacı kaydıranasına yerleştirin. Numune giriş portlarını şeffaf bantla kapatın.
- Eldivenleri değiştirin ve hücre sayacının dışını temizleyin. Tek bir hücre süspansiyonu yapılıp yapılmadığını belirlemek için parlak alan mikroskobu kullanın.
- Tek hücreli süspansiyonun onaylanmasının ardından, %10 FBS içeren 1 mL DMEM/F12 ortamı ekleyerek sindirimi durdurun ve P1000 pipet ile 10 kat yukarı ve aşağı pipet.
- Eldivenleri değiştirin, tüpü temizleyin ve numuneleri 4 °C'de 5 dakika boyunca 500 x g'da döndürün.
- Hücre peletini tüpün dibinden yeniden canlandırmamak için medya/ ayrışma enzimini bir P1000 pipetle dikkatlice çıkarın.
- Tek hücreleri %0,1 BSA içeren en az PBS hacminde yeniden biriktirin. Bağırsak organoidleri için 250 μL'de resüspend.
- Hücre süspansiyonlarını filtreli bir FACS tüpüne geçirerek büyük kümeleri çıkarın ve hücre içeren FACS tüpünü buza yerleştirin.
- Hücre sayımına ve ana karışımın hazırlanmasına devam etmek için 4.6 adımına geçin.
- Tek kullanımlık plastik hücre sayım odasına 10 μL hücre süspansiyonu ekleyerek μL başına hücre sayısını belirleyin.
- Bu aşamada hücre süspansiyonu hala bulaşıcı olduğu için, numuneyi hücre kültürü davlumbazından çıkarmadan önce numune giriş portunu şeffaf bantla kapatın.
- Eldivenleri değiştirin, hücre sayım odasını temizleyin ve brightfield mikroskobu kullanarak hücre numarasını sayın.
- Hücre kültürü başlığının içinde, deneydeki numune sayısına bağlı olarak üreticinin talimatlarına göre 1,5 mL'lik bir tüpte RT Reaktif, Şablon Anahtarı Oligo, Azaltıcı Ajan B ve RT enzim C'nin ana karışımını hazırlayın. Her örnek için, aliquot 33.4 μL ana karışım bir PCR tüpüne karıştırın ve buz üzerinde saklayın.
- Üreticinin talimatlarında açıklandığı gibi, hedef hücre numarasına göre ana karışıma hücreleri ve suyu ekleyin.
NOT: Hücrelerin % 50-60'ı normalde kurtarılmıştır (yani, çipe 10.000 hücre yüklenirken, analiz için 5.000-6.000 hücre kullanılır). Bu nedenle, her zaman 10.000 hücre yükleyin. Hücre yoğunluğu buna izin vermezse, hücreleri santrifüj edin ve daha düşük bir hacimde yeniden biriktirin. Çipin tıkanmasıyla sonuçlanacağından çipi aşırı yüklememeye dikkat edin. Ek olarak, hücreler düzgün bir şekilde ayrışmazsa, aşağı akış biyoinformatik işlemede çıkarılması gereken boncuk başına birden fazla hücre alma riski artacaktır. - Eldivenleri değiştirin, tek hücreli kontrol cihazını hücre kültürü başlığına taşıyın ve çip sadece sızdırmaz bir conta ile kaplandığı için çipi hazırlayın.
NOT: Enfekte hücre süspansiyonlarına ve potansiyel aerosollere maruz kalmayı önlemek için makinenin kaputun içinde olması gerekir. - Tek hücreli çipi talaş tutucusuna ekleyin ve kullanılmayan şeritleri% 50 gliserol ile doldurun.
- Ana karışım, boncuklar ve bölme yağını, üreticinin talimatlarına göre numuneler için kullanılan şeritlere ekleyin.
- Çipi conta ile örtün, çipi denetleyiciye yükleyin ve programı başlatın.
NOT: Sekiz şeritten sadece altısının yüklenmesi önerilir. Yanlış emülsiyonlarla ilgili sorunlar genellikle bir ve sekiz şeritlerinde ortaya çıkar. Şirket, tüm şeritlerin bağımsız olduğunu ve bunun gerçekleşmemesi gerektiğini söylüyor; ancak, mümkünse, bu iki şeritten kaçının ve sekiz numune gerekiyorsa iki yonga çalıştırın. - Programın tamamlanmasından sonra çipi ve contayı çıkarın.
- Çok kanallı bir pipet kullanın ve emülsiyonların 100 μL'lik kısmını temiz bir PCR tüpüne aktarın. Her kuyuda tam bir emülsiyon oluştuğunu gösteren tekdüze beyaz bir renge sahip olduğundan emin olun.
- Eldivenleri değiştirin, tüpleri temizleyin ve PCR tüpünü 100 μL reaksiyonları destekleyebilen bir PCR makinesine aktarın. Programı çalıştırın: 45 dakika boyunca 53 °C; 5 dakika için 85 °C.
- Tamamlandığında, numuneleri 4 °C'de saklayın. Bu noktada, reaksiyonun üreticinin talimatlarına göre işlenmesi veya 3 gün boyunca 4 °C'de veya 1 hafta boyunca -20 °C'de saklanması.
- 85 °C'de 5 dakika sonra, çoğu zarflı virüs inaktive edilecek, normal çalışma prosedürüne göre CDNA'yı BSL-3'ten çıkaracak ve kütüphane hazırlıklarını bir BSL-1 laboratuvarında gerçekleştirecektir.
NOT: Bu deneyin üç biyolojik çoğaltma olarak (örneğin, üç farklı günde) yapılması gerekir, çünkü her hücre tipinin farklılaşma kapsamı her deney arasında biraz değişebilir. Elde edilen sıralama kitaplıkları farklı şekilde dizine eklenebilir ve bir sıralama çalıştırmasında birlikte sıralanabilir.
Sonuçlar
Tek hücreli dizileme için organoidlerin hazırlanması
Tek hücreli sıralama sonuçları, kaliteli hücreler kullanmaya oldukça bağlıdır. Organoidlerin kaliteli olduğundan emin olmak için, ne zaman bölünmeye hazır olduklarını belirlemek için günlük olarak uygun şekilde korunmalı ve gözlemlenmelidir (Şekil 2). Organoidlerin bölünmesinin zamanlaması donöre bağlıdır; bazı bağışçılar daha hızlı büyür ve her 5 günde bir bölünmeleri gerekirken, diğerleri daha yavaştır ve her 10 günde bir bölünmeleri gerekir. Ortalama olarak, organoidler merkezler karanlık olduğunda haftada bir kez bölünür (Şekil 2B). Organoidlerin çok büyük olmasına ve merkezde çok fazla ölü hücre biriktirmesine izin verilirse, organoid ölür.
Organoidler, yüksek miktarda Wnt3A içeren bir ortamda tutulur. Bu, kök hücre nişini destekler ve organoidlerin büyümeye ve çoğalmaya devam etmesini teşvik eder. Bu büyüme koşullarında organoidler yüksek miktarda kök hücre ve geçiş yükseltici hücreler ve olgun enterositler, Kadeh hücreleri ve enteroendokrin hücreler gibi daha az miktarda farklılaştırılmış hücre popülasyonu içerir. Bununla birlikte, insan bağırsaması içinde bulunan hücresel karmaşıklığı taklit etmek için hücre farklılaşması itmek ve bu hücrelerden daha fazlasını üretmek önemlidir. Bu, ortam koşullarını değiştirerek ve Wnt3A'yı kaldırarak ve R-Spondin ve Noggin'i azaltarak gerçekleştirilir (Tablo 1). Normalde, enterositlere, Goblet hücrelerine ve enteroendokrin hücrelere doğru hücresel farklılaşma 4 günlük farklılaşma ortamı gerektirir (Şekil 3). İyi bir farklılaşma elde etmek anahtardır; aksi takdirde, patojen tromizmi ve hücre tipine özgü yanıtları değerlendirmek zorlaşacaktır.
BSL-3 patojen inaktivasyonunun teyidi
Tam inaktivasyon, tercih edilen patojen ile onaylanmalıdır ve cDNA'nın BSL-3'ten çıkarılmasının güvenli olduğu doğrulanmalıdır. SARS-CoV-2 için, 100 μL SARS-CoV-2 alınarak ve 85 ° C'de 5 dakika boyunca bir PCR makinesinde inkübe edilerek virüsün tam inaktivasyonu doğrulandı. Virüs daha sonra naif Vero hücrelerine geri eklendi ve virüs enfeksiyonu, tüm parçacıkların artık bulaşıcı olmadığından emin olmak için 24 saat, 48 saat ve 72 h'de immünofluoresans ve plak tahlilleri ile ısıl işlem görmemiş virüsle karşılaştırıldı. Bu sonuçlar yerel düzenleyici kuruma gönderildi ve onayları alındıktan sonra tek hücreli deney ve cDNA işleme yapıldı.
Tek hücreli sıralama sonuçları
SARS-CoV-2'nin insan kolonu ve ileum organoidlerini nasıl enfekte ettiğini değerlendirmek için tek hücreli dizileme yapıldı. Organoidler yukarıda açıklandığı gibi hazırlandı ve SARS-CoV-2 tarafından apikal enfeksiyona izin vermek için 2D formatta enfekte edildi. Enfekte hücreler enfeksiyon sonrası 12 saat 24 saat olarak hasat edildi ve yukarıda açıklandığı gibi tek hücreli dizileme için işlendi. Tek hücreli dizileme verilerinin analizi, insan bağırsak epitel hücrelerinin sadece bir alt nüfusunun (olgunlaşmamış enterosit 2) SARS-CoV-2 enfeksiyonunu desteklediğini belirlememizi sağladı (Şekil 4). Ek olarak, bir popülasyondaki tüm hücreler enfekte olmadığı için, hem enfekte hücreler hem de enfekte olmayan seyirci hücreler analiz edilmiştir (Şekil 5). Bu sonuçlar SARS-CoV-2'nin enfekte olmuş hücrelerde pro-enflamatuar bir sinyal basamaklama indüklerken, enfekte olmayan seyirci hücrelerinin interferon aracılı bir immün yanıt gösterdiğini göstermiştir. Ek olarak, scRNA-Seq enfekte hücrelerin yolun virüs aracılı tıkanması nedeniyle interferonları hissedemediğini göstermiştir (Şekil 5). Toplu RNA dizilimi kullanırken bu bilgileri elde etmek mümkün değildi.

Şekil 1: İnsan bağırsak organoidlerini enterik patojenlerle enfeksiyona hazırlamak için üç farklı yöntemi gösteren şematik. Apikal enfeksiyon, bağırsak organoidlerinin 2D olarak tohumlenmesiyle elde edilebilir. 3D organoidi bozarak apikal ve bazolateral bir enfeksiyon yapılabilir. Son olarak, bazolateral sadece enfeksiyon bozulmamış 3D bağırsak organoidlerini enfekte ederek yapılabilir. Bu yöntemlerin her biri tek hücre dizilimi için örnekler oluşturmak için kullanılabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
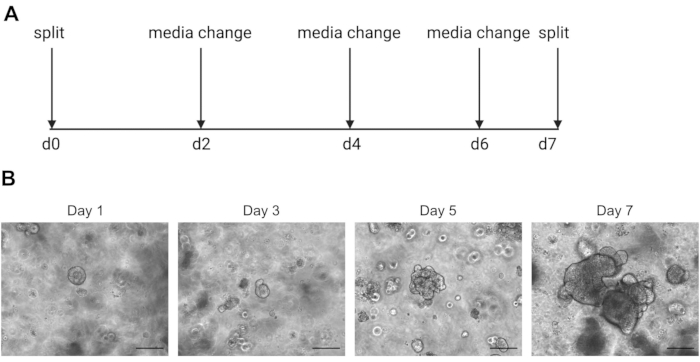
Şekil 2: Organoid bakım şeması ve temsili brightfield görüntüleri. (A) İnsan bağırsak organoidlerinin bakımı ve geçişi için şematik. (B). 1, 3, 5 ve 7. 7. güne kadar organoidler ölü hücrelerin birikmesi nedeniyle büyük ve karanlık hale gelir ve bölünmeye hazırdır. Ölçek çubuğu 25 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
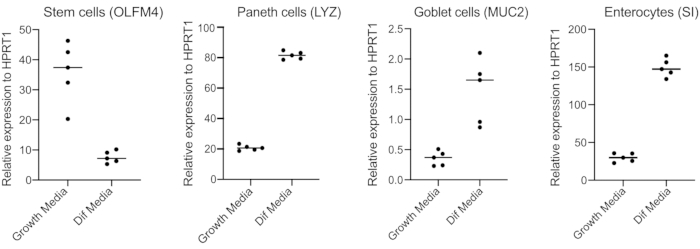
Şekil 3: İnsan bağırsak organoidlerinin temsili qPCR'si, farklılaşma ortamına geçtikten 4 gün sonra. Bağırsak organoidleri büyüme ortamlarında muhafaza edildi veya 4 gün boyunca farklılaşma ortamına geçildi. Kök hücre (OLFM4), Paneth hücreleri (LYZ), Goblet hücreleri (MUC2) ve enterositlerin (SI) belirteçleri için RNA hasat edildi ve qPCR yapıldı. N = 5. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
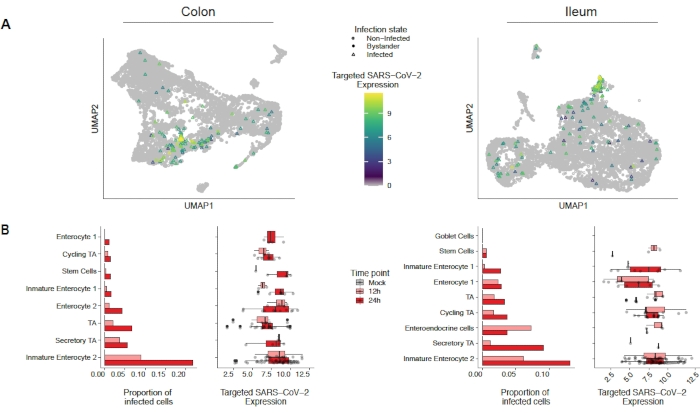
Şekil 4: SARS-CoV-2 ile enfekte olan hücre popülasyonunun tanımlanması. İnsan kolonu ve ileum türevi organoidler SARS-CoV-2 ile enfekte oldu. 12 ve 24 saat enfeksiyon sonrası hücreler hasat edildikten ve hangi hücre popülasyonlarının SARS-CoV-2 enfeksiyonunu desteklediğini belirlemek için tek hücreli RNA dizilimi yapıldı. Virüs enfeksiyonlarının zamanla arttığı ve esas olarak olgunlaşmamış enterosit 2'yi enfekte olduğu bulunmuştur. Bu rakam Triana ve ark.19'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
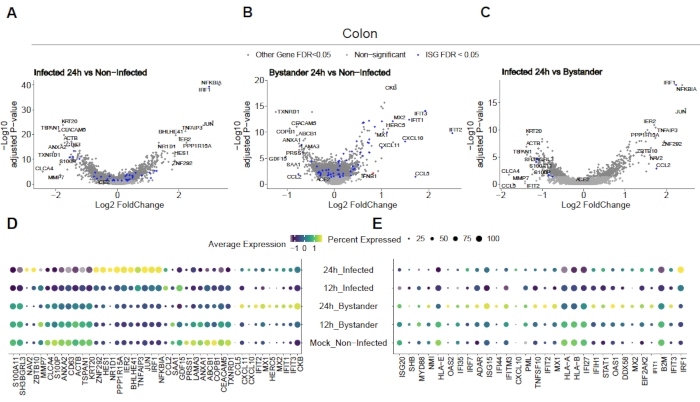
Şekil 5: Doğuştan gelen immün yanıtın belirlenmesi. İnsan kolonu türevi organoidler SARS-CoV-2 ile enfekte oldu. 12 ve 24 saat enfeksiyon sonrası hücreler hasat edildikten ve hem viral olarak enfekte olmuş hem de enfekte olmayan seyirci hücrelerinde doğuştan gelen immün yanıtı belirlemek için tek hücreli RNA dizilimine tabi tutuldu. SARS-CoV-2 enfekte hücreler güçlü bir pro-enflamatuar yanıt gösterirken, enfekte olmayan seyirciler interferon aracılı bir yanıt gösterdi. Şekil Triana ve ark.19'dandeğiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Büyüme Medyası | |
| Bileşik | Son konsantrasyon |
| Reklam DMEM/F12 | GlutaMAX (1X) |
| +GlutaMAX | HEPES 1 mM |
| +HEPES | Kalem 10 U/mL |
| +P/S | Strep 10 μg/mL |
| L-WRN | Hacme göre %50 |
| B27 | 01:50 |
| N-asetil-sistein | 1 mM |
| EGF | 50 ng/mL |
| A83-01 | 500 nM |
| IGF-1 | 100 ng/mL |
| FGF temel | 50 ng/mL |
| Gastrin | 10 mM |
| Farklılaşma Ortamı | |
| Bileşik | Son konsantrasyon |
| Reklam DMEM/F12 | GlutaMAX (1x) |
| +GlutaMAX | HEPES 1 mM |
| +HEPES | Kalem 10 U/mL |
| +P/S | Strep 10 μg/mL |
| B27 | 01:50 |
| N-asetil-sistein | 1 mM |
| R-spondin | Ses seviyesine göre %5 |
| Kafa | 50 ng/mL |
| EGF | 50 ng/mL |
| Gastrin | 10 mM |
| A83-01 | 500 nM |
Tablo 1: Büyüme ve farklılaşma ortamı için medya kompozisyonu.
Tartışmalar
Enterik patojenler en sık bağırsak epitel hücrelerini apikal tarafından bağırsak lümenine bakacak şekilde enfekte ederek yaşam döngülerini başlatırlar. Organoidler, bağırsak epitelinin hücresel karmaşıklığını ve organizasyonunu yeniden üretmek için iyi bir model olarak kabul edilirken, üç boyutlu, kapalı yapılar olarak organizasyonları apikal zarlarını patojene erişilemez hale getirir. Bu protokol, bağırsak organoidlerini apikal yanlarından, bazolateral taraflarından veya her ikisinden de BLS-3 patojenleriyle enfekte etme yöntemlerini tanımladı. Bu protokoller, aşağıda vurgulanan birkaç kritik adımı izleyerek BSL-2 veya BLS-3 muhafazası veya başka bir organoid modeli altında herhangi bir enterik patojeni incelemek için kolayca uyarlanabilir. Yukarıda açıklanan yöntem, Almanya'daki düzenlemelere uygun olarak tek hücreli damlacıkların izolasyonu ve hazırlanması içindir. Bir feragatname olarak, bu protokol BSL-3 koşulları altında çalışırken alınması gereken biyogüvenlik işleme önlemlerini (standart işletim prosedürleri) açıklamaz. Düzenlemelerin diğer ülkelerde de değişebileceği ve tüm yerel düzenlemelere uyulacağından emin olmak için yerel makamlarla irtibata geçilmesi gerektiği konusunda ısrar etmek de önemlidir.
Apikal enfeksiyon için organoidlerin iki boyutlu tohumlamada kritik adımlardan biri, hücrelerin klasik üç boyutlu organoidler olarak yetiştirildiğinde benzer şekilde farklılaşacağını kontrol etmektir. Enterik patojene bağlı olarak, tromizm çok nadir hücrelerle veya çok farklılaşması gereken hücrelerle sınırlandırılabilir. Bu durumda, tam olarak ayırt edilemeyen iki boyutlu bir organoid kullanmak, bu enterik patojenin bağırsak organoidlerini enfekte edemeyeceği konusunda yanlış birlgıya neden olabilir. Mümkünse, bu protokolün üç konfigürasyonunu kullanarak enfeksiyonların gerçekleştirilmesi önerilir: sadece apikal enfeksiyon için 2D organoid (bölüm 2), apikal ve bazolateral enfeksiyon için çatlak açık 3D organoidler (bölüm 3) ve sadece bazolateral enfeksiyon için tam 3D organoidler (bölüm 3). Bu yaklaşım, patojenin giriş yolunun (apikal ve bazolateral) ayırt edilmesine yardımcı olacak ve aynı zamanda benzer bir farklılaşma seviyesine ulaşıldığını kontrol edecektir. 2D apikal enfeksiyon için bir alternatif, 3D organoid kullanacak ancak patojeni doğrudan apikal tarafa ulaştıracak mikroenjeksiyondur (ayrıntılar için Bartfeld ve ark.27'ye bakın). Bu yöntem, patojenin düzgün yerleştirildiğından ve organoidlerin bozulmadan kaldığından emin olmak için yetenekli bir enjektör gerektirir. Mikroenjeksiyon genellikle BSL-2 muhafazasında kullanılır ve BSL-3 muhafazası için uygun olmayabilir.
2D tohumlu organoidlerde enfeksiyon deneyleri yapılırken ek bir önemli husus son hücre yoğunluğudur. Adım 2.3'te belirtildiği gibi, 100-150 organoid 48 kuyulu bir plakanın bir kuyusunda veya 8 kuyulu bir cam tabanlı hazne kaydırağından bir kuyuda tohumlanacaktır. Organoid çizgisine ve organoidleri işleyen kişiye bağlı olarak, bu organoidlerin büyüklüğü önemli ölçüde farklı olabilir. Bu, 48 kuyu plakasında veya 8 kuyulu cam tabanlı hazne kaydırasında çok farklı hücre yoğunluklarına neden olabilir. Enterik virüse bağlı olarak, bazı virüsler daha seyrek hücreleri tercih ederken, diğerleri de birleştiği hücreleri enfekte edebilecektir. Farklı hücre izdihamları için enfeksiyozitedeki bu tür farklılıkların moleküler kökeni açık değildir; bu nedenle, daha fazla aşağı akış karakterizasyonu gerçekleştirmeden önce, tercih edilen enterik patojen için en iyi hücre yoğunluğunu bulmayı amaçlayan pilot deneyler yapılmalıdır.
Genellikle FACS sıralama, tek hücreli damlacık emülsiyonunu gerçekleştirmeden önce gerçekleştirilir. Bu adım genellikle ölüleri canlı hücrelerden ve tek hücreleri çiftlerden ayırmak için kullanılır. BSL-3 patojenleri ile çalışırken, tesisin uygun bir FACS sıralayıcısı ile donatılmayı gerektirir, bu genellikle böyle değildir. Ayrıca, bir organoiddeki tüm hücreler aynı boyuta sahip değildir ve genellikle bir çift veya daha büyük bir hücre arasında ayrım yapmak zordur, böylece belirli bir hücre tipine karşı olumsuz seçim yapma riskine neden olur. Ayrıca, her örnek için 5.000-10.000 arasında sıralama için gereken sürenin tek tek hücrelerin transkript profilinin önemli bir şekilde değiştirilmesine neden olup olmayacağı hala tartışlanmaktadır. Tek hücreli dizileme ile uyumlu hücre sabitleme yöntemleri (örneğin, metanol ve RNAassist) açıklanmış olsa da, bunun sıralama kalitesinde bir düşüşe yol açtığı gözlenmiştir18. Son olarak, hücre ölüm işaretleyicileri kullanarak hücreleri sıralamanın da bir önyargıya yol açabileceği şüphelidir. Hücrelerin şifreli villi ekseninden yönlü çoğalması ve farklılaşması göz önüne alındığında, dökülecek ve serbest bırakılacak olan en farklılaştırılmış hücreler villinin ucunda bulunur. Bu hücreler genellikle hücre ölüm yollarının farklı belirteçleri için pozitiftir(örneğin, apoptoz, nekroz ve nekroptoz); bununla birlikte, fare bağırsağının rotavirüs enfeksiyonuna bakıldığında, villinin ucu en enfekte bölgedir28. Bu nedenle, ölüm belirteçleri için pozitif görünebilecek hücreleri filtrelemek, fizyolojik enfeksiyonu temsil edebilecek enfekte hücrelerin olumsuz bir şekilde seçilmesine neden olacaktır. Şu anda, tek hücreli sıralamadan önce organoidleri sıralamak ve sabitlemek için iyi bir çözüm yoktur. Uygun alternatif protokolleri bulmak için daha fazla çalışmaya ihtiyaç duyulduğu için canlı, sıralanmamış hücrelerin kullanılması önerilir.
Tek hücreli sıralama, hücresel yanıtların nasıl değerlendirilebileceği konusunda devrim yaratmamıştır. Bu teknik, hem bazal koşullarda hem de patojen enfeksiyonları altında hücre soyuna özgü yanıtların tanımlanmasını sağlar. Bu yöntem, daha önce toplu okumalarla sınırlı olan birçok alanda kapılar açmıştır. Bu yöntem çok güçlü olsa da, sınırlamaları vardır. Önemli bir sınırlama, sıralamanın aşağı akışı için gerekli olan kapsamlı biyoinformatik analizdir. Bu, özellikle dokuları analiz ederken ve şu anda ek açıklamanın olmadığı hücre tiplerini atarken anahtardır. Yetenekli bir biyoinformatikçiye sahip olmak, tüm tek hücreli çalışmaları desteklemek için gereklidir.
Bu protokol, insan bağırsak organoidlerinin nasıl tohumlanıp ele alınacağını, enterik patojenlerle nasıl enfekte olunabileceğini ve scRNAseq'in nasıl gerçekleştirildiğini açıklar. Organoid model sistemleri çoğu organ için geliştirildiği için bu yaklaşımın diğer organlara uyarlanabilir olması artık mümkündür. Akciğer ve karaciğer organoidleri bağırsak organoidlerine göre benzer şekilde organize edilir ve bu nedenle benzer bir yaklaşım kullanılarak bu organoidlere aktarılabilir. Kritik kontrol, iki boyutta yetiştirildiğinde veya açık çatladığında, bu organoidlerin 3D organoid meslektaşlarıyla benzer farklılaşma elde ettiğini doğrulamak olacaktır. Farklılaştırılmış bir durumu tanımlayan spesifik özellikler ve genler her organ modeli için özeldir. Böbrek ve damar organoidleri, büyük yoğun yapılar gibi diğer organoid modelleri, bu yapıları seri olarak tek hücrelere ayrıştırmak için ek yöntemlere ihtiyaç duyacaktır.
Açıklamalar
Yazarlar rakip finansal çıkarlar beyan etmemektedir.
Teşekkürler
Megan Stanifer ve Steeve Boulant, Deutsche Forschungsgemeinschaft'ın (DFG) araştırma hibeleriyle desteklendi: (Proje numarası 240245660, 278001972, 415089553 ve Steeve Boulant'a 272983813 ve Megan Stanifer'e 416072091), Baden-Wuerttemberg eyaleti ve Bundesministerium für Bildung und Forschung BMBF 01KI20239B'den MS ve 01KI20198A'ya ve (NUM-COVID 19, Organo-Strat 01KX2021) için SB. Şemalar BioRender oluşturuldu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Recombinant mouse noggin | Peprotech | Cat#250-38 | |
| [Leu15]-Gastrin I | Sigma-Aldrich | Cat# G9145 | |
| 0.05% Trypsin-EDTA | Thermo Fischer Scientific | Cat#25300054 | |
| 24-well non-cell culture treated plate | Corning | Cat#3738 | |
| 8-well glass bottom chamber slide | iBIDI | Cart#80827 | |
| A83-01 | Tocris | Cat#2939 | |
| Advanced DMEM/F12 | Thermo Fischer Scientific | Cat# 12634010 | |
| B27 | Thermo Fischer Scientific | Cat#17504-044 | |
| Chromium Controller & Next GEM Accessory Kit | 10X Genomics | Cat#1000202 | Used in the preparation of single cell solution and preparation of Gel beads-in-emulsion (GEM) |
| Chromium Next GEM Chip G Single Cell Kit | 10X Genomics | Cat #1000127 | Used in the preparation of single cell solution and preparation of Gel beads-in-emulsion (GEM) |
| Chromium Next GEM Single Cell 3′ Kit v3.1 | 10X Genomics | Cat#1000268 | Used in the preparation of single cell solution and preparation of Gel beads-in-emulsion (GEM) |
| Collagen from human placenta | Sigma Aldrich | Cat#C5533-5MG | |
| CYP34A forward | Eurofins | GATGGCTCTCATCCCAGACTT | Primers used to check for differentiation |
| CYP3A4 reverse | Eurofins | AGTCCATGTGAATGGGTTCC | Primers used to check for differentiation |
| DMEM/F12 | Thermo Fischer Scientific | Cat#11320074 | |
| EDTA | Sigma Aldrich | Car#E9884 | |
| Fast Read 102 counting slides | Biosigma | Cat# BVS100 | |
| Fetal Bovein Serum (FBS) | Capricorn | Cat#FBS-12A | |
| GlutaMAX | Thermo Fischer Scientific | Cat# 35050061 | |
| HEPES | Thermo Fischer Scientific | Cat3 15630080 | |
| L-WRN cells | ATCC | CRL-3276 | This cell line is used to make the conditioned media containg Wnt 3A, R-Spondin and Noggin. The protocol for the production of the conditioned media can be found on the manufacterures site. |
| MatriGel. GFR, LDEV free | Corning | Cat#354230 | |
| MUC-2 forward | Eurofins | TGTAGGCATCGCTCTTCTCA | Primers used to check for differentiation |
| MUC-2 reverse | Eurofins | GACACCATCTACCTCACCCG | Primers used to check for differentiation |
| N-acetyl-cysteine | Sigma Aldrich | Cat# A9165 | |
| OLMF4 forward | Eurofins | ACCTTTCCCGTGGACAGAGT | Primers used to check for differentiation |
| OLMF4 reverse | Eurofins | TGGACATATTCCCTCACTTTGGA | Primers used to check for differentiation |
| Penicillin/Streptomycin | Thermo Fischer Scientific | Cat#15140122 | |
| Recombinant human FGF basic | Peprotech | Cat#100-18B | |
| Recombinant human IGF-1 | BioLegend | Cat#590904 | |
| Recombinant mouse EGF | Thermo Fischer Scientific | Cat# PMG8043 | |
| SI forward | Eurofins | AATCCTTTTGGCATCCAGATT | Primers used to check for differentiation |
| SI reverse | Eurofins | GCAGCCAAGAATCCCAAT | Primers used to check for differentiation |
| TrypLE Express | Thermo Fischer Scientific | Cat#12605036 | |
| Y-27632 | Caymann Chemicals | Cat#10005583 |
Referanslar
- Kretzschmar, K., Clevers, H. Organoids: Modeling development and the stem cell niche in a dish. Developmental Cell. 38, 590-600 (2016).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Tekes, G., Ehmann, R., Boulant, S., Stanifer, M. L. Development of feline ileum- and colon-derived organoids and their potential use to support feline coronavirus infection. Cells. 9, (2020).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375, 409-424 (2019).
- Zhou, J., et al. Infection of bat and human intestinal organoids by SARS-CoV-2. Nature Medicine. 26, 1077-1083 (2020).
- Sato, T., Clevers, H. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications. Science. 340, 1190-1194 (2013).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470, 105-109 (2011).
- de Graaf, M., van Beek, J., Koopmans, M. P. Human norovirus transmission and evolution in a changing world. Nature Reviews Microbiology. 14, 421-433 (2016).
- Leshem, E., et al. Real-world effectiveness of pentavalent rotavirus vaccine among bedouin and jewish children in southern Israel. Clinical Infectious Diseases : An Official Publication of the Infectious Diseases Society Of America. 62, 155-160 (2016).
- Karst, S. M. The influence of commensal bacteria on infection with enteric viruses. Nature Reviews Microbiology. 14, 197-204 (2016).
- Ettayebi, K., et al. Replication of human noroviruses in stem cell-derived human enteroids. Science. 353, 1387-1393 (2016).
- de Wit, E., van Doremalen, N., Falzarano, D., Munster, V. J. SARS and MERS: recent insights into emerging coronaviruses. Nature Reviews Microbiology. 14, 523-534 (2016).
- Scaldaferri, F., et al. The thrilling journey of SARS-CoV-2 into the intestine: From pathogenesis to future clinical implications. Inflammatory Bowel Diseases. 26, 1306-1314 (2020).
- Kipkorir, V., Cheruiyot, I., Ngure, B., Misiani, M., Munguti, J. Prolonged SARS-CoV-2 RNA detection in anal/rectal swabs and stool specimens in COVID-19 patients after negative conversion in nasopharyngeal RT-PCR test. Journal of Medical Virology. 92, 2328-2331 (2020).
- Lamers, M. M., et al. SARS-CoV-2 productively infects human gut enterocytes. Science. 369, 50-54 (2020).
- Stanifer, M. L., et al. Critical role of type III interferon in controlling SARS-CoV-2 Infection in human intestinal epithelial cells. Cell Reports. 32, 107863 (2020).
- Triana, S., et al. Single-cell transcriptomics reveals immune response of intestinal cell types to viral infection. bioRxiv. , (2020).
- Triana, S., et al. Single-cell analyses reveal SARS-CoV-2 interference with intrinsic immune response in the human gut. Molecular Systems Biology. 17, 10232 (2021).
- Tang, F., et al. mRNA-Seq whole-transcriptome analysis of a single cell. Nature Methods. 6, 377-382 (2009).
- Hwang, B., Lee, J. H., Bang, D. Single-cell RNA sequencing technologies and bioinformatics pipelines. Experimental & Molecular Medicine. 50, 1-14 (2018).
- García-Rodríguez, I., Sridhar, A., Pajkrt, D., Wolthers, K. C. Put some guts into it: Intestinal organoid models to study viral infection. Viruses. 12, 1288 (2020).
- Stanifer, M. L., et al. Asymmetric distribution of TLR3 leads to a polarized immune response in human intestinal epithelial cells. Nature Microbiology. 5, 181-191 (2020).
- Lees, E. A., et al. Using human induced pluripotent stem cell-derived intestinal organoids to study and modify epithelial cell protection against salmonella and other pathogens. Journal of Visualized Experiments: JoVE. (147), e59478 (2019).
- Mahe, M. M., Sundaram, N., Watson, C. L., Shroyer, N. F., Helmrath, M. A. Establishment of human epithelial enteroids and colonoids from whole tissue and biopsy. Journal of Visualized Experiments: JoVE. (97), e52483 (2015).
- Fujii, M., et al. Human Intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Bartfeld, S., Clevers, H. Organoids as model for infectious diseases: Culture of human and murine stomach organoids and microinjection of Helicobacter Pylori. Journal of Visualized Experiments: JoVE. (105), e53359 (2015).
- Hernandez, P. P., et al. Interferon-lambda and interleukin 22 act synergistically for the induction of interferon-stimulated genes and control of rotavirus infection. Nature Immunology. 16, 698-707 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır