A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
משלוח תרופות מבוסס משאבה אוסמוטי למחקר רמיאלינציה In Vivo על מערכת העצבים המרכזית
In This Article
Summary
Demyelination מתרחשת במחלות מרובות של מערכת העצבים המרכזית. טכניקה אמינה של אספקת תרופות vivo נחוצה לבדיקות רמיאלין של תרופות. פרוטוקול זה מתאר שיטה מבוססת משאבה אוסמוטית המאפשרת אספקת תרופות לטווח ארוך ישירות לתוך parenchyma המוח ומשפר את הזמינות הביולוגית של התרופה, עם יישום רחב במחקר רמיאלינציה.
Abstract
Demyelination זוהה לא רק טרשת נפוצה (טרשת נפוצה), אלא גם מחלות אחרות של מערכת העצבים המרכזית כגון מחלת אלצהיימר ואוטיזם. כמו ראיות עולה כי remyelination יכול ביעילות לשפר את תסמיני המחלה, יש התמקדות גוברת בפיתוח תרופות כדי לקדם את תהליך התחדשות המיאלין. לכן, טכניקת אספקת תרופות הניתנת לבחירה ותוצאה אמינה באזור נדרשת כדי לבדוק את היעילות והספציפיות של תרופות אלה ב vivo. פרוטוקול זה מציג את שתל המשאבה האוסמוטי כגישה חדשה להעברת תרופות במודל העכבר demyelination המושרה lysolecithin. המשאבה האוסמוטית היא מכשיר מושתל קטן שיכול לעקוף את מחסום הדם - מוח (BBB) ולספק תרופות בהתמדה וישירות לאזורים ספציפיים של מוח העכבר. זה יכול גם לשפר ביעילות את הזמינות הביולוגית של תרופות כגון פפטידים וחלבונים עם זמן מחצית חיים קצר. לכן, שיטה זו היא בעלת ערך רב לתחום של מערכת העצבים המרכזית מיאלין התחדשות המחקר.
Introduction
המשאבה האוסמוטית היא מכשיר קטן ומושתל לשחרור פתרונות. זה יכול לשמש למסירה מערכתית כאשר מושתל תת עורית או בחלל הבטן. פני השטח של המשאבה האוסמוטית הם קרום חדיר למחצה, והצד הפנימי שלה הוא שכבה חדירה. המשאבה האוסמוטית פועלת באמצעות הפרש הלחץ האוסמוטי בין השכבה האוסמוטית לסביבת הרקמה שבה המשאבה מושתלת. האוסמולליות הגבוהה של השכבה האוסמוטית גורמת למים ברקמה לזרום לשכבה האוסמוטית דרך הממברנה החדירה למחצה על משטח המשאבה. השכבה האוסמוטית מרחיבה ודוחסת את המאגר הגמיש בתוך המשאבה, ובכך מוציאה את הפתרון מהמאגר הגמיש בקצב מסוים למשך זמן ארוך1. המשאבה כוללת שלושה נפחי מאגר שונים, 100 μL, 200 μL, ו 2 מ"ל, עם שיעורי המסירה שלהם משתנים מ 0.11 μL / h ל 10 μL / h. בהתאם לסוג המשאבה שנבחר, ההתקן יכול לפעול מיום אחד עד 6 שבועות2. בפרוטוקול זה, משאבה אוסמוטית 100 μL עם קצב העברה של 0.25 μL / h שיכול לפעול במשך 14 ימים משמש.
בשנות ה-70, המשאבה האוסמוטית שימשה במחקר מדעי המוח 3,4. לדוגמה, וויי ואח ' אימץ את גישת המשאבה האוסמוטית להזריק פפטידים אופיואידים לחדר במחקר של התמכרות לסמים3. לאחר שיפור מתמשך, המשאבה האוסמוטית שימשה כעת במחקר של משלוח מבוקר של אלפי תרופות, כולל פפטידים, גורמי גדילה, תרופות ממכרות, הורמונים, סטרואידים, נוגדנים, וכן הלאה. בנוסף, עם צנתרים מיוחדים (ערכות עירוי המוח) מחוברים, זה יכול לשמש עירוי ממוקד לרקמות או איברים ספציפיים, כולל חוט השדרה, המוח, הטחול, הכבד 5,6,7.
במחקר של רמיאלינציה, תרופות רבות הוכחו לקדם התחדשות מיאלין במבחנה, אבל רובם לא השיגו השפעות משמעותיות vivo, אולי בשל היעדר שיטת ניהול מתאימה. שיטות ניהול מסורתיות כגון הזרקה תוך-פריטונית, הזרקה תת עורית, וניהול תוך-גסטרי יש מגבלות הזמינות הביולוגית של התרופות. בנוסף, כמה תרופות יש חדירות מחסום דם - מוח לקוי, אשר מערער את הגישה שלהם parenchyma המוח. יחד, מגבלות אלה דורשות שיטת אספקה יעילה חדשנית. בשילוב עם ערכות עירוי המוח, משאבות אוסמוטיות יכולות לעקוף את מחסום הדם - מוח ולספק תרופות ישירות לקורפוס קאלוזום, אשר משפר ביעילות את הזמינות הביולוגית של תרופות, במיוחד עבור כמה תרופות פוליפפטיד וחלבון עם מחצית חיים קצרה. לכן, המשאבה האוסמוטית כטכניקת אספקת תרופות חדשה היא בעלת ערך רב לתחום של מערכת העצבים המרכזית מיאלין התחדשות המחקר. היישום של טכניקה זו יוצג בפירוט להלן.
Protocol
כל ההליכים בבעלי החיים נערכו תחת הנחיות ופרוטוקולים מוסדיים שאושרו על ידי ועדת הרווחה והאתיקה של בעלי החיים של האוניברסיטה הצבאית השלישית לרפואה.
1. הקמת מודל העכבר demyelination המושרה על ידי ליזולציתין
- הכן 1% lysolecithin (נקרא גם L-α-Lysophosphatidylcholine) פתרון עם PBS סטרילי.
- לחטא מספריים, מלקחיים, hemostat מעוקל, ומכשירים כירורגיים אחרים על ידי עיקור autoclave. לחטא את האזור הכירורגי ולהניח סדינים סטריליים. כל החומרים והריאגנטים המשמשים לניתוח צריכים להיות מוכנים בצורה אספטית. חשוב לשמור על האזור הכירורגי סטרילי לאורך כל ההליך.
- מרדים עכבר C57BL6 של יום לאחר הלידה 56 (P56) (P56) כדלקמן.
- מניחים את העכבר בתא האיזופלוריין של מכונת ההרדמה הקטנה לבעלי חיים. התאם את זרימת O2 ל-300-500 מ"ל/דקה ואיזופלוראן ל-3%-4%. לאחר הרדמה מספקת, כאשר העכבר הופך להיות חסר תנועה עם נשימה איטית ויציבה, להעביר את העכבר למנגנון סטריאוטקסי עם כרית חימום.
- מעבירים את תפוקת הגז מהתא למסכת ההרדמה ומתאימים איזופלוריין ל-1% עד 1.5% כדי לשמור על העכבר במצב ההרדמה. חכה עד העכבר הוא מרדים לחלוטין, להזריק ketoprofen (3 – 5 מ"ג /ק"ג) תוך-פעילות כדי להקל על הכאב. לפני הניתוח, לצבוט את הבהונות של העכבר ולבדוק את התגובה שלה כדי לאשר הרדמה מוצלחת8.
- כאשר העכבר מורדם, הוא אינו יכול לווסת את טמפרטורת הגוף שלו. לכן, לפקח ולווסת את טמפרטורת הגוף של העכבר במהלך הניתוח. כדי לשמור על העיניים של העכבר לחות בזמן הרדמה, לכסות את פני השטח של גלגלי העיניים עם משחת עיניים אריתרומיצין.
- אבטחו את ראש העכבר במנגנון הסטריאוטקסי עם מוט שיניים וחטיפי אוזניים. (איור 1א).
- השתמש תער כדי להסיר שיער מהחלק העליון של הראש. לחטא את עור הראש עם שלושה מחזורים של בטדין ו 75% אתנול. עבור חששות אתיים, לכסות את גוף החיה למעט אתר הניתוח. בעזרת אזמל, יוצרים חתך ארוך של 1 ס"מ באמצע הסגיטלי של העור מבסיס הצוואר ועד בין העיניים כדי לחשוף את הגולגולת (איור 1B).
- נגב בעדינות את פני השטח של הגולגולת עם צמר גפן סטרילי המכיל 30% מי חמצן כדי לדמיין את התפרים הגולגולתיים (איור 1C). התאם את הגובה של מוט השיניים וחטיפי האוזן כדי למקם את נקודת למבדה ואת נקודת bregma באותו גובה (כלומר, עם קואורדינטות ציר z זהה כאשר קצה המחט נוגע בנקודות), כך התפר קשתי הוא אופקי.
- הניחו בעדינות את קצה מחט המזרק המיקרוליטר (10 μL, 33 G) בנקודת הברגמה ואיפסו את הקואורדינטות x, y ו- z ל- 0 (איור 1D). העבר את המזרק לאתר ההזרקה (x: 1.04; y: 1.0, כלומר, 1.04 מ"מ לרוחב לקו האמצע ו-1.0 מ"מ אחורי לנקודת הברגמה) בהתאם לבקשת הקריאה הדיגיטלית (איור 1E).
- לקדוח לאט חור בר קטן דרך הגולגולת באתר ההזרקה מבלי לחדור את הדורה עם מחט מזרק 1 מ"ל (26 G, 0.45 מ"מ) (איור 1F). הכנס באיטיות את מחט המזרק המיקרוליטר לרקמת המוח דרך החור עד להגעה לעומק מסוים (z = -1.62 מ"מ עבור רוב עכברי P56) (איור 1G).
הערה: מבחינה אמפירית, עומק ההחדרה של -1.62 מ"מ מאפשר לקצה המחט להגיע לאמצע הקורפוס קאלוסום של רוב עכברי P56, כך שהליזולציתין יכול להיות מועבר ישירות לתוך קורפוס קאלוזום כדי לגרום לדמיאלינציה. - להזריק 1.5 μL של 1% lysolecithin במהירות של 0.3 μL / min. לאחר הזריקה, לחכות 5 דקות לפני לאט לשלוף את מזרק microliter כדי למנוע את דליפת נוזל לאורך נתיב מחט ההזרקה.
- תפרו את העור עם 5-0 תפרים כירורגיים (איור 1H).
- מניחים את העכבר על כרית חימום כדי למנוע ירידה בטמפרטורת הגוף. תן זריקה תת עורית של 5 מ"ג / קילוגרם carprofen כל 24 שעות כדי להקל על הכאב. החל משחה אריתרומיצין על החתך כל יום כדי להבטיח כי הפצע מרפא כראוי. מניחים את העכבר שעבר ניתוח בכלוב לבד ולהאכיל אותו עם מזון לח עד התאושש לחלוטין. נטר את העכבר מדי יום לאחר הניתוח.
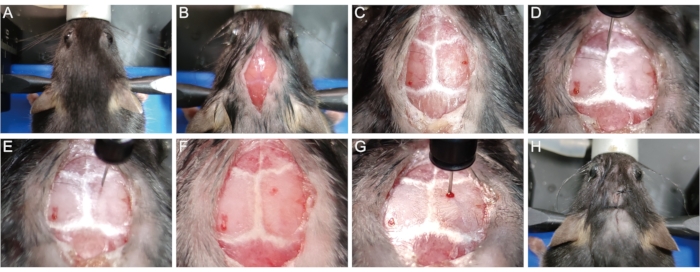
איור 1: הקמת מודל העכבר המושרה על-ידי ליזולציתין. (A) אבטח את העכבר במנגנון הסטריאוטקסי. (B) פתח חתך בגודל 1 ס"מ באמצע קשת כדי לחשוף את הגולגולת. (ג) דמיין את התפרים הגולגולתיים. (D) אפס את הקואורדינטות x, y ו- z ל- 0 בנקודת Bregma. (ה) העבר את המזרק לאתר ההזרקה. (ו) לקדוח חור בגולגולת באתר ההזרקה. (ז) הכנס את המחט לרקמת המוח לאט והזריק ליזולציתין. (ח) תפר את העור. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. הכנת המשאבה האוסמוטית
הערה: רכיבי המפתח של המשאבה מוצגים באיור 2A.
- לקבוע את עומק החדרת צינורית עירוי המוח לתוך המוח. ודא כי המחט של צינורית עירוי המוח בשימוש הוא 3 מ"מ ארוך וכל מרווח התאמת עומק הוא 0.5 מ"מ. כדי להשיג עומק הזרקה של 1.5 מ"מ (קרוב לקאלוזום), חברו שלושה מרווחי כוונון עומק למחט של צינורית עירוי המוח עם דבק רקמות (איור 2B, C).
- כדי למלא את המשאבה האוסמוטית, חבר את מחט המזרק שמגיעה עם חבילת המשאבה למזרק של 1 מ"ל ושאף את התרופה. החזק את המשאבה זקופה, הכנס את המזרק לפתח בחלק העליון של המשאבה, והזריק לאט את התרופה, נזהר שלא ליצור בועות9 (ראה איור 2D). כאשר הנוזל זורם מתוך הפתח, לשלוף לאט את המזרק.
- הסר את האוגן הלבן מווסת הזרימה עם מספריים או צבת להיזהר לא לכופף או למחוץ את מנחה הזרימה. לאחר מכן, הכנס את מנחה הזרימה למשאבה (איור 2E). כדי לקבוע אם יש בועות במשאבה האוסמוטית, לשקול את המשאבה האוסמוטית בנפרד לפני ואחרי המילוי.
- חותכים את הצנתר לאורך מסוים בהתאם לגודל החיה (20-25 מ"מ קטטרים לעכברי P56 השוקלים כ -25 גרם). חבר את הצנתר לשלולית עירוי המוח.
- מלאו את הצנתר בסמים באמצעות המזרק מבלי להכניס אוויר (איור 2F).
- חבר את הצנתר למנחה הזרימה. לאחר ההחזקה, ודאו שהצנתר מכסה כ-4 מ"מ של מנחה הזרימה החשוף (איור 2G).
- כדי להבטיח שהמשאבה האוסמוטית תוכל לפעול באופן מיידי לאחר ההשתלה, טבול את המשאבות הממולאות בתמיסת מלח סטרילית של 0.9% או PBS בטמפרטורה של 37 °C (לפחות 4 עד 6 שעות (רצוי להאריך עד הלילה) כדי להרטיב מראש את הממברנה החדירה למחצה על פני המשאבה עם פתרונות בעלי לחץ אוסמוטי זהה לסביבת הרקמה (איור 2H).
- כל הפתרונות שנטענו למשאבות צריכים להיות סטריליים. משאבות ALZET מסופקות סטריליות, לאחר שנחשפו למינון עיקור של 60Co. עם זאת, אם מתרחש זיהום חיצוני, ניתן לנקות את פני השטח של המשאבה על ידי ניגובו עם אלכוהול איזופרופיל (70% במים).

איור 2: הכנת המשאבה האוסמוטית. (א) רכיבי מפתח במשאבה האוסמוטית. (ב,ג) חבר מרווחי כוונון עומק למחט של צינורית עירוי המוח. (D) מלא את המשאבה האוסמוטית באמצעות מזרק 1 מ"ל. (ה) הכנס את מנחה הזרימה למשאבה. (ו) מלאו את הצנתר באמצעות המזרק. (ז) חבר את הצנתר למנחה הזרימה. (H) לטבול את המשאבות הממולאות סטרילי 0.9% מלוחים או PBS ב 37 °C (50 °F) אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
3. השתלת המשאבה האוסמוטית
- המתן 3 ימים לאחר הקמת מודל corpus callosum demyelination. הפעל את מערכת ההרדמה הקטנה לבעלי חיים. לחטא מספריים, פינצטה, צבת hemostatic ולשרות אותם בתמיסת אלכוהול 75%. הנח סדינים סטריליים באזור הניתוח.
- להרדים ולאבטח את העכברים על המנגנון הסטריאוטקסי שוב. לכסות את פני השטח של גלגלי העיניים עם משחת עיניים כדי למנוע יובש.
- לחטא את הפצע המקורי עם 75% אלכוהול. פתחו את החתך הכירורגי שנתפר בעבר (איור 3A) והרחיבו את החתך לשכמות (איור 3B).
- הפרד את העור מרקמת החיבור התת עורית באמצעות צבת המוסטטית או פינצטה בעצם השכם כדי לפתוח חלל (איור 3C). הכניסו את המשאבה האוסמוטית לחלל (איור 3D,E).
- עם צמר גפן, לנגב בעדינות ולחשוף את חור הסיכה על פני השטח של הגולגולת שנוצר בעת הקמת מודל demyelination (ראה שלב 1.8). הכנס את צינורית עירוי המוח דרך חור הסיכה הזה בניצב ואבטח אותה על הגולגולת במהירות באמצעות דבק רקמות (איור 3F).
- הסירו את הכרטיסייה הנשלפת מעל צינורית עירוי המוח עם זוג מספריים (איור 3G, H). לחלופין, הסר את הכרטיסיה תחילה לפני הוספת הצינורית כדי למנוע רעד בתהליך זה.
- תפרו את החתך או חברו אותו לדבק ברקמות (איור 3I).
- לאחר הניתוח, מניחים את העכבר על כרית חימום כדי למנוע ירידה בטמפרטורת הגוף. תן זריקה תת עורית של 5 מ"ג / קילוגרם carprofen כל 24 שעות כדי להקל על הכאב. החל משחה אריתרומיצין על החתך כל יום כדי להבטיח כי הפצע מרפא כראוי. מניחים את החיה בכלוב לבד ולהאכיל עם מזון לח עד התאושש לחלוטין. נטר את העכברים כל יום ובדוק אם צינורית עירוי המוח הייתה מחוברת היטב.
- המתת חסד העכבר 11 ימים לאחר הניתוח על ידי הזרקת 150-200 מ"ג / קילוגרם נתרן פנטוברביטל תוך-אפריטוני באופן תוך-אפריטוני ואחריו זלוף transfusing transcardially עם 4% פורמלדהיד.
- כדי לוודא שהפתרון מועבר כרגיל, הסר בזהירות את המשאבה האוסמוטית ומדוד את שאריות הנפח במאגר המשאבה לפני ניתוח המוח.
- כדי למדוד את נפח השיורי, להסיר את צינורית עירוי המוח, לצרף מזרק 1 מ"ל לצנתר, ולאחר מכן לשאוף את הפתרון הנותר כדי לקבוע את נפחו. השווה את הנפח השיורי בפועל לנפח השיורי התיאורטי (נפח ראשוני - ממוצע קצב שאיבה * משך עירוי).
הערה: נפח שיורית מופרז מציין עירוי לא מוצלח, אשר עשוי להיות עקב חסימת קטטר או תקלה במשאבה.
- כדי למדוד את נפח השיורי, להסיר את צינורית עירוי המוח, לצרף מזרק 1 מ"ל לצנתר, ולאחר מכן לשאוף את הפתרון הנותר כדי לקבוע את נפחו. השווה את הנפח השיורי בפועל לנפח השיורי התיאורטי (נפח ראשוני - ממוצע קצב שאיבה * משך עירוי).
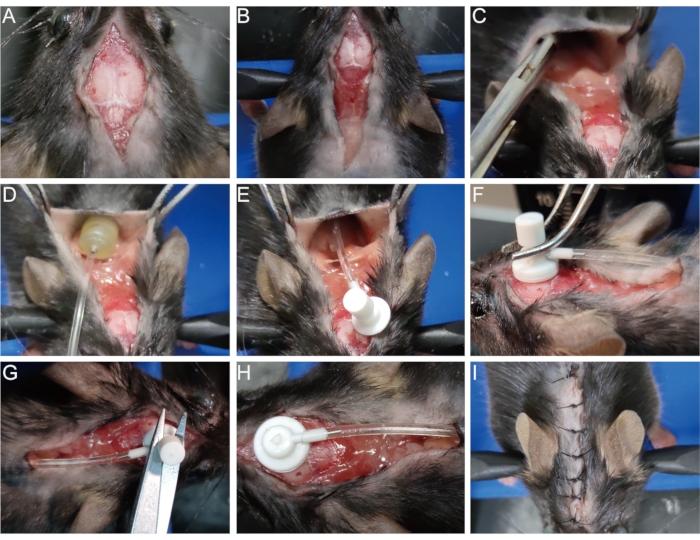
איור 3: השתלת המשאבה האוסמוטית. (א) פתח את החתך הכירורגי. (ב) להרחיב את החתך לשכמות הכתפיים. (ג) הפרד את העור מרקמת חיבור תת עורית כדי ליצור חלל. (ד, ה) מניחים את המשאבה האוסמוטית לתוך החלל. (F) הכנס את צינורית עירוי המוח לחור הסיכה על פני השטח של הגולגולת ואבטח אותה בחוזקה על הגולגולת. (ז, ח) הסר את הכרטיסיה הנשלפת מהצינורית. (I) לתפור את החתך. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוצאות
כדי לאמת את ההשפעה של המשאבה האוסמוטית במחקר התחדשות המיאלין, מודל demyelination המושרה lysolecithin נוצר בעכברים P56, ואחריו השתלה של משאבות אוסמוטיות המכילות UM206 (1 מ"ג ב 1.5 מ"ל 0.9% מלוחים), פפטיד עם מחצית חיים קצרה וחדירות BBB עניים שדווח לאחרונה כדי לקדם רמיאלינציה10 . 0.9% תמיסת מלח שימשה כבקרה....
Discussion
פרוטוקול זה מתאר את המשאבה האוסמוטית כטכניקת אספקת תרופות חדשנית למחקר התחדשות מיאלין, אשר יכול לספק תרופות ישירות לאתר הטיפול ולאפשר אספקת תרופות עקבית לתקופה ממושכת, יצירת ריכוז תרופות יציב בסביבה מיקרו של מערכת העצבים המרכזית בכל משך הניסוי. בהשוואה לשיטות אחרות להעברת תרופות, המשאבה...
Disclosures
המחברים מצהירים שאין ניגודי עניינים.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מהקרן הלאומית למדעי הטבע של סין (NSFC 32070964, 31871045) ל- J.N. ולקרן המחקר הבסיסית של שנזן (JCYJ20210324121214039) ל- Y.S.
Materials
| Name | Company | Catalog Number | Comments |
| Anesthesia Air Pump | RWD | R510-29 | E05818-006 |
| Brain Infusion kit 3 | ALZET | 0008851 | 1-3 mm |
| Carprofen | Macklin | C830557-1g | 5 mg/kg every 24 h |
| Erythromycin eye ointment | Along technology | YCKJ-RJ-024780 | Cover the surface of the eyeballs during anesthesia |
| Erythromycin ointment | pythonbio | RG180 | |
| Gas Evacuation Apparatus | RWD | R546W | E05518-002 |
| L-α-Lysophosphatidylcholine | Sigma | L0906 | Dissolve at 1% with sterile PBS |
| Microliter Syringe | Hamilton | 65460-05 | Syringe Series:1700, 10 µL, 33 gauge |
| Micro-smotic pump model 1002 | ALZET | 0004317 | 0.25 µL per hour, 14 days |
| PBS (pH = 7.3) | ORIGENE | ZLI-9061 | |
| Pentobarbital sodium | Shanghai Civi | CAS NO: 57-33-0 | 150-200 mg/kg intraperitoneal injection for euthanasia |
| Small Animal Anesthesia Machine | RWD | R520IE | E05807-006 M |
| Stereotaxic Equipment | RWD | E06382 | |
| STERI 250 sterilizer | Keller | 31101 | Rapid sterilization of surgical instruments |
| Surgical sutures | Shanghai jinhuan | F504 | 5-0 |
| Syringe needle (1 mL) | Shanghai KDL | 6930197811018 | 26 gauge (0.45 mm x 16 mm) |
| Testing drug and solvent | Experiment dependent | N/A | |
| ThermoStar Homeothermic Monitoring System | RWD | 69026 | Maintain body temperature during anesthesia |
| Vetbond Tissue adhesive | 3M | 1469SB | Secure the brain infusion cannula , Adhere the skin incision |
References
- Theeuwes, F., Yum, S. I. Principles of the design and operation of generic osmotic pumps for the delivery of semisolid or liquid drug formulations. Annals of Biomedical Engineering. 4 (4), 343-353 (1976).
- Herrlich, S., Spieth, S., Messner, S., Zengerle, R. Osmotic micropumps for drug delivery. Advanced Drug Delivery Reviews. 64 (14), 1617-1627 (2012).
- Wei, E., Loh, H. Physical dependence of opiate-like peptides. Science. 193 (4259), 1262-1263 (1976).
- Pettigrew, J. D., Kasamatsu, T. Local perfusion of noradrenaline maintains visual cortical plasticity. Nature. 271 (5647), 761-763 (1978).
- Wang, Y., et al. Reduced oligodendrocyte precursor cell impairs astrocytic development in early life stress. Advanced Science (Weinheim). 8 (16), 2101181 (2021).
- Tang, C., et al. Neural stem cells behave as a functional niche for the maturation of newborn neurons through the secretion of PTN. Neuron. 101 (1), 32-44 (2019).
- Watanabe, S., Komine, O., Endo, F., Wakasugi, K., Yamanaka, K. Intracerebroventricular administration of Cystatin C ameliorates disease in SOD1-linked amyotrophic lateral sclerosis mice. Journal of Neurochemistry. 145 (1), 80-89 (2018).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments: JoVE. , e50326 (2013).
- Tang, C., Guo, W. Implantation of a mini-osmotic pump plus stereotactical injection of retrovirus to study newborn neuron development in adult mouse hippocampus. STAR Protocols. 2 (1), 100374 (2021).
- Niu, J., et al. Oligodendroglial ring finger protein Rnf43 is an essential injury-specific regulator of oligodendrocyte maturation. Neuron. 109 (19), 3104-3118 (2021).
- Breitschopf, H., Suchanek, G., Gould, R. M., Colman, D. R., Lassmann, H. In situ hybridization with digoxigenin-labeled probes: sensitive and reliable detection method applied to myelinating rat brain. Acta Neuropathologica. 84 (6), 581-587 (1992).
- Cree, B. A. C., et al. Clemastine rescues myelination defects and promotes functional recovery in hypoxic brain injury. Brain. 141 (1), 85-98 (2018).
- Eckenhoff, B., Yum, S. I. The osmotic pump: novel research tool for optimizing drug regimens. Biomaterials. 2 (2), 89-97 (1981).
- Thoenen, H., Sendtner, M. Neurotrophins: from enthusiastic expectations through sobering experiences to rational therapeutic approaches. Nature Neuroscience. 5, 1046-1050 (2002).
- Hagg, T. Intracerebral infusion of neurotrophic factors. Methods in Molecular Biology. 399, 167-180 (2007).
- Bittner, B., Thelly, T., Isel, H., Mountfield, R. J. The impact of co-solvents and the composition of experimental formulations on the pump rate of the ALZET osmotic pump. International Journal of Pharmaceutics. 205 (1-2), 195-198 (2000).
- Arnot, M. I., Bateson, A. N., Martin, I. L. Dimethyl sulfoxide/propylene glycol is a suitable solvent for the delivery of diazepam from osmotic minipumps. Journal of Pharmacological and Toxicological Methods. 36 (1), 29-31 (1996).
- Gullapalli, R., et al. Development of ALZET osmotic pump compatible solvent compositions to solubilize poorly soluble compounds for preclinical studies. Drug Delivery. 19 (5), 239-246 (2012).
- White, J. D., Schwartz, M. W. Using osmotic minipumps for intracranial delivery of amino acids and peptides. Methods in Neurosciences. 21, 187-200 (1994).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved