このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
中枢神経系の In Vivo 髄鞘再形成研究のための浸透圧ポンプベースの薬物送達
要約
脱髄は、複数の中枢神経系疾患において起こる。信頼性の高い インビボ 薬物送達技術は、薬物試験を再髄するために必要である。このプロトコルは、脳実質への長期的な薬物送達を直接可能にし、薬物バイオアベイラビリティを改善し、髄鞘再形成研究に広く適用する浸透圧ポンプベースの方法を記述している。
要約
脱髄は、多発性硬化症(MS)だけでなく、アルツハイマー病や自閉症などの他の中枢神経系疾患でも確認されています。髄鞘再形成が疾患症状を効果的に改善できることを示唆する証拠として、ミエリン再生プロセスを促進するための薬物開発への関心が高まっている。したがって、 インビボでこれらの薬物の効率および特異性を試験するためには、領域選択可能で結果的に信頼性の高い薬物送達技術が必要である。このプロトコールは、リゾレシチン誘導脱髄マウスモデルにおける新しい薬物送達アプローチとして浸透圧ポンプインプラントを導入する。浸透圧ポンプは、血液脳関門(BBB)をバイパスし、マウス脳の特定の領域に薬物を着実に直接送達することができる小型の埋め込み型装置である。また、半減期が短いペプチドやタンパク質などの薬物の生物学的利用能を効果的に改善することもできます。したがって、この方法は、中枢神経系ミエリン再生研究の分野にとって大きな価値がある。
概要
浸透圧ポンプは、小型の埋め込み型溶液放出装置です。これは、皮下または腹腔内に移植された場合の全身送達に使用することができる。浸透圧ポンプの表面は半透膜であり、その内側は透過層である。浸透圧ポンプは、浸透層とポンプが注入される組織環境との間の浸透圧差を利用して動作する。浸透層の高い浸透圧は、組織内の水をポンプ表面上の半透膜を介して浸透層に流入させる。浸透層は、ポンプ内の可撓性リザーバを膨張および圧縮し、それによって、可撓性リザーバから溶液を一定の速度で長期間にわたって変位させる1。ポンプには、100 μL、200 μL、および 2 mL の 3 つの異なるリザーバ容量があり、その送達速度は 0.11 μL/h から 10 μL/h までさまざまです。選択したポンプタイプに応じて、装置は1日から6週間2まで動作することができます。このプロトコルでは、14日間動作できる0.25μL/hの転送速度の100μL浸透圧ポンプが使用されます。
1970年代には、浸透圧ポンプは神経科学研究で使用されていました3,4。例えば、Weiらは、薬物中毒の研究において、オピオイドペプチドを心室に注入するために浸透圧ポンプアプローチを採用した3。継続的な改善の後、浸透圧ポンプは現在、ペプチド、成長因子、中毒性薬物、ホルモン、ステロイド、抗体などを含む何千もの薬物の制御された送達の研究に使用されています。さらに、特別なカテーテル(脳注入キット)が取り付けられているため、脊髄、脳、脾臓、肝臓を含む特定の組織または臓器への標的注入に使用できます5,6,7。
髄鞘再形成の研究において、多くの薬物がインビ トロでミエリン再生を促進することが示されているが、それらのほとんどは、おそらく適切な投与方法の欠如のために、 インビボで有意な効果を達成していない。腹腔内注射、皮下注射、および胃内投与などの従来の投与方法は、薬物の生物学的利用能に限界がある。さらに、いくつかの薬物は血液脳関門透過性が悪く、脳実質へのアクセスを損なう。これらの制限が組み合わさって、新しい効率的な配信方法が必要になります。脳注入キットと組み合わせて、浸透圧ポンプは血液脳関門をバイパスし、脳梁に直接薬物を送達することができ、これは薬物の生物学的利用能、特に半減期の短いポリペプチドおよびタンパク質薬物に対して効果的に改善する。従って、新たなドラッグデリバリー技術としての浸透圧ポンプは、中枢神経系ミエリン再生研究の分野において大きな価値がある。この手法の応用については、以下で詳しく紹介する。
プロトコル
すべての動物の手続きは、第三軍事医科大学の動物福祉倫理委員会によって承認された制度的ガイドラインとプロトコルの下で実施されました。
リゾレシチン誘導脱髄マウスモデルの確立
- 滅菌PBSで1%リゾレシチン(L-α-リゾホスファチジルコリンとも呼ばれる)溶液を調製する。
- はさみ、鉗子、湾曲した止血器、その他の手術器具をオートクレーブ滅菌で滅菌します。手術領域を滅菌し、滅菌シートを敷く。手術に使用されるすべての材料および試薬は、無菌的に調製されるべきである。手術領域を処置全体を通して無菌に保つことが重要です。
- 出生後56日目(P56)C57BL6マウスを以下のように麻酔する。
- マウスを小動物麻酔機のイソフルランチャンバーに入れる。O2流量を300〜 500mL/分に、イソフルランを3%〜4%に調整します。十分な麻酔の後、マウスがゆっくりと安定した呼吸で動かなくなったら、マウスを加熱パッド付きの定位装置に移す。
- チャンバーからのガス出力を麻酔マスクに切り替え、イソフルランを1%〜1.5%に調整して、マウスを麻酔状態に維持します。マウスが完全に麻酔されるまで待ってから、ケトプロフェン(3 – 5 mg / kg)を腹腔内に注射して痛みを和らげます。手術前に、マウスのつま先をつまみ、その反応をチェックして麻酔が成功したことを確認します8.
- マウスが麻酔をかけられるとき、それはその体温を調節することができません。したがって、手術中にマウスの体温を監視し、調節する。麻酔下でマウスの眼球を湿らせておくために、眼球の表面をエリスロマイシン眼軟膏で覆う。
- マウスヘッドを歯の棒とイヤーバーで定位装置に固定します。(図1A)。
- カミソリを使って頭のてっぺんから脱毛します。ベタジンと75%エタノールの3サイクルで頭の皮膚を消毒する。倫理的な懸念のために、手術部位を除いて動物の体を覆ってください。メスを用いて、首の付け根から目の間まで皮膚の長さ1cmの矢状中切開を行い、頭蓋骨を露出させる(図1B)。
- 頭蓋骨の縫合糸を可視化するために、30%過酸化水素を含む滅菌綿棒で頭蓋骨の表面を優しく拭きます(図1C)。歯の棒とイヤーバーの高さを調整して、ラムダ点とブレグマ点を同じ高さ(つまり、針先が点に触れたときに同じz軸座標)に配置して、矢状縫合糸が水平になるようにします。
- マイクロリットルのシリンジ針(10 μL、33 G)の先端をブレグマポイントにそっと置き、x、y、z座標を0にリセットします(図1D)。デジタル読み出しのプロンプトに従って、シリンジを注射部位(x:1.04;y:1.0、すなわち正中線に対して横方向に1.04mm、ブレグマ点に対して後方1.0mm)に移動します(図1E)。
- 1 mLのシリンジ針(26 G、0.45 mm)で硬膜を貫通せずに、注射部位の頭蓋骨に小さなバリ穴をゆっくりとあけます(図1F)。マイクロリットルのシリンジ針を、一定の深さに達するまでゆっくりと穴を通して脳組織に挿入する(z=ほとんどのP56マウスで-1.62mm)(図1G)。
注:経験的には、-1.62mmの挿入深さは、針先がほとんどのP56マウスの脳梁の中央に達することを可能にするので、リゾレシチンを脳梁に直接送達して脱髄を誘導することができる。 - 1.5 μL の 1% リゾレシチンを 0.3 μL/minの速度で注入する。注射後、5分間待ってからマイクロリットルのシリンジをゆっくりと引き出し、注射針経路に沿って液体が漏れるのを防ぎます。
- 5-0の外科用縫合糸で皮膚をステッチする(図1H)。
- 体温の低下を避けるために、マウスを加熱パッドの上に置きます。痛みを和らげるために24時間ごとに5mg / kgカルプロフェンの皮下注射を投与する。エリスロマイシン軟膏を毎日切開部に塗布して、創傷が適切に治癒するようにする。手術を受けたマウスをケージに入れ、完全に回復するまで湿った食べ物を餌にします。操作後に毎日マウスを監視します。
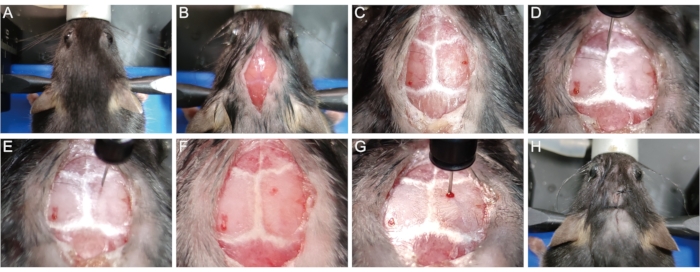
図1:リゾレシチン誘導脱髄マウスモデルの確立。(B)1cmの矢状骨中部切開部を開き、頭蓋骨を露出させる。(C)頭蓋縫合糸を可視化する。(D) ブレグマ点の x、y、z 座標を 0 にリセットします。(E)注射器を注射部位に移動する。(F)注射部位の頭蓋骨に穴を開ける。(G)ゆっくりと脳組織に針を挿入し、リゾレシチンを注入する。(H)皮膚を縫い合わせる。この図の拡大版を表示するには、ここをクリックしてください。
浸透ポンプの準備
メモ: ポンプの主要コンポーネントを 図 2A に示します。
- 脳への脳注入カニューレの挿入の深さを決定する。使用する脳注入カニューレの針の長さが3mmで、各深さ調整スペーサーが0.5mmであることを確認してください。1.5mm(脳梁に近い)の注射深さを達成するために、組織接着剤で脳注入カニューレの針に3つの深さ調整スペーサーを取り付ける(図2B、C)。
- 浸透圧ポンプを充填するには、ポンプパッケージに付属のシリンジ針を1mLシリンジに取り付け、薬物を吸引します。ポンプを直立させ、ポンプ上部の開口部にシリンジを挿入し、泡9 を作らないように注意しながら、ゆっくりと薬物を注入する( 図2D参照)。液体が開口部から流出したら、ゆっくりとシリンジを引き抜きます。
- はさみやペンチでフローレギュレータから白いフランジを取り外し、フローモデレータを曲げたり押しつぶしたりしないように注意してください。次に、フローモデレータをポンプに挿入します(図2E)。浸透圧ポンプに気泡があるかどうかを判断するには、充填の前後に浸透圧ポンプを別々に計量します。
- 動物の大きさに応じてカテーテルを一定の長さにトリミングします(体重約25gのP56マウスの場合は20〜25mmのカテーテル)。カテーテルを脳注入カニューレに取り付けます。
- 空気を導入せずにシリンジを使用してカテーテルに薬物を充填する(図2F)。
- カテーテルをフローモデレーターに接続します。取り付け後、カテーテルが露出した流量モデレータの約4mmを覆っていることを確認します(図2G)。
- 浸透圧ポンプが移植後すぐに機能するようにするには、充填したポンプを滅菌した0.9%生理食塩水またはPBSに37°Cで少なくとも4〜6時間(好ましくは一晩まで延長)浸漬し、組織環境と同じ浸透圧を有する溶液でポンプ表面の半透膜を予備湿潤させる(図2H)。
- ポンプに装填されるすべての溶液は無菌でなければなりません。ALZETポンプは無菌で供給され、 60Coの滅菌用量に曝された。ただし、外部汚染が発生した場合は、イソプロピルアルコール(水中70%)で拭くことでポンプの表面を清掃することができます。

図2:浸透圧ポンプの調製 。(A)浸透圧ポンプの主要構成要素(B,C)深さ調整スペーサーを脳注入カニューレの針に取り付けます。(D)1mLシリンジを使用して浸透圧ポンプを充填する。(E) フローモデレーターをポンプに挿入します。(F)シリンジを用いてカテーテルを充填する。(G)カテーテルをフローモデレーターに接続します。(H) 充填したポンプを滅菌 0.9% 生理食塩水または PBS (37 °C) に浸します。 この図の拡大版を表示するには、ここをクリックしてください。
3. 浸透圧ポンプの注入
- 脳梁脱髄モデルの確立後3日間待つ。小動物麻酔システムをオンにします。はさみ、ピンセット、止血ペンチを消毒し、75%アルコール溶液に浸します。手術領域に滅菌シートを敷く。
- 麻酔し、マウスを再び定位装置上に固定する。乾燥を防ぐために眼球の表面を眼軟膏で覆う。
- 元の傷を75%のアルコールで消毒する。以前に縫合しておいた外科的切開部を開き(図3A)、切開部を肩甲骨まで広げます(図3B)。
- 肩甲骨の止血ペンチまたはピンセットで皮膚を皮下結合組織から分離し、空洞を開きます(図3C)。浸透圧ポンプをキャビティ内に配置します(図3D、E)。
- 綿棒で、脱髄モデルを確立するときに作成された頭蓋骨の表面のピンホールを優しく拭き取り、露出させます(ステップ1.8を参照)。このピンホールに脳注入カニューレを垂直に挿入し、組織接着剤で頭蓋骨に素早く固定します(図3F)。
- 脳注入カニューレの上にある取り外し可能なタブを、一対のはさみで取り外します(図3G、H)。または、このプロセスで揺れを避けるために、カニューレを挿入する前に最初にタブを取り外します。
- 切開部を縫い合わせるか、組織接着剤で取り付けます(図3I)。
- 手術後、体温の低下を避けるためにマウスを加熱パッドの上に置きます。痛みを和らげるために24時間ごとに5mg / kgカルプロフェンの皮下注射を投与する。エリスロマイシン軟膏を毎日切開部に塗布して、創傷が適切に治癒するようにする。動物をケージに一人で入れ、完全に回復するまで湿った食べ物を餌にします。毎日マウスを監視し、脳注入カニューレがしっかりと付着しているかどうかを確認します。
- 手術後11日目にペントバルビタールナトリウム150~200mg/kgを腹腔内に注射し、その後4%ホルムアルデヒドで経心線を灌流してマウスを安楽死させる。
- 溶液が正常に送達されることを確認するには、浸透圧ポンプを慎重に取り外し、脳解剖前にポンプリザーバ内の残留体積を測定する。
- 残留体積を測定するには、脳注入カニューレを取り出し、1mLシリンジをカテーテルに取り付け、残りの溶液を吸引してその体積を決定する。実際の残留量を理論的な残留量(初期体積 - 平均ポンピング率*注入持続時間)と比較します。
注:過剰な残留量は、カテーテル閉塞またはポンプの誤動作が原因の可能性がある注入の失敗を示します。
- 残留体積を測定するには、脳注入カニューレを取り出し、1mLシリンジをカテーテルに取り付け、残りの溶液を吸引してその体積を決定する。実際の残留量を理論的な残留量(初期体積 - 平均ポンピング率*注入持続時間)と比較します。
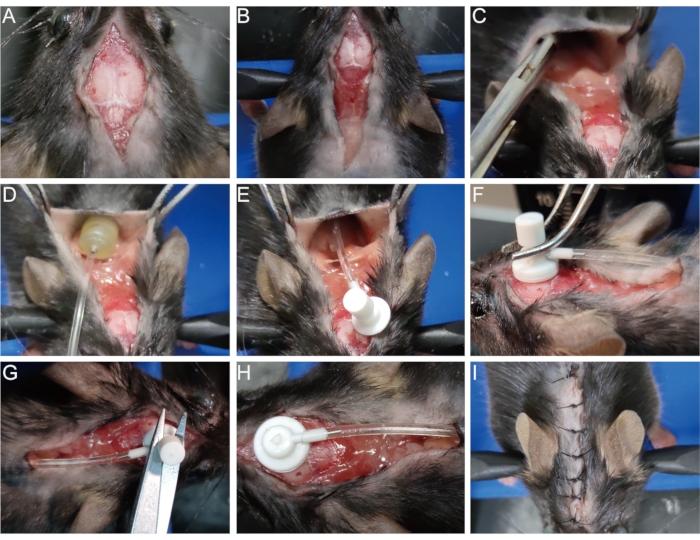
図3:浸透圧ポンプの注入。 (A)外科的切開部を開く。(B)肩甲骨の切開部を広げる。(C)皮膚を皮下結合組織から分離して空洞を作る。(D,E)浸透圧ポンプをキャビティ内に置きます。(F)頭蓋骨表面のピンホールに脳注入カニューレを挿入し、頭蓋骨にしっかりと固定する。(G,H)カニューレから取り外し可能なタブを取り外します。(I)切開部を縫い合わせる。 この図の拡大版を表示するには、ここをクリックしてください。
結果
ミエリン再生研究における浸透圧ポンプの効果を検証するために、P56マウスにおいてリゾレシチン誘導脱髄モデルを作成し、続いてUM206(1.5mL中1mg、0.9%生理食塩水中1mg)、半減期が短くBBB透過性が悪いペプチドを含む浸透圧ポンプを移植し、髄鞘再形成を促進することが最近報告されている10.9%生理食塩水を対照として用いた。モデル確立の14日後、マウスを4%ホルムアルデヒド...
ディスカッション
このプロトコルは、浸透圧ポンプをミエリン再生研究のための新しい薬物送達技術として記述し、薬物を治療部位に直接送達し、長期間にわたって一貫した薬物送達を可能にし、実験期間全体において中枢神経系の微小環境において安定した薬物濃度を作り出すことができる。他の薬物送達方法と比較して、浸透圧ポンプは、脱髄病変13における薬物濃度の維持をより有益?...
開示事項
著者らは利益相反がないと宣言しています。
謝辞
この研究は、中国国家自然科学財団(NSFC 32070964、31871045)からJ.N.への助成金と深セン基礎研究財団(JCYJ2021032412121214039)からY.S.への助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Anesthesia Air Pump | RWD | R510-29 | E05818-006 |
| Brain Infusion kit 3 | ALZET | 0008851 | 1-3 mm |
| Carprofen | Macklin | C830557-1g | 5 mg/kg every 24 h |
| Erythromycin eye ointment | Along technology | YCKJ-RJ-024780 | Cover the surface of the eyeballs during anesthesia |
| Erythromycin ointment | pythonbio | RG180 | |
| Gas Evacuation Apparatus | RWD | R546W | E05518-002 |
| L-α-Lysophosphatidylcholine | Sigma | L0906 | Dissolve at 1% with sterile PBS |
| Microliter Syringe | Hamilton | 65460-05 | Syringe Series:1700, 10 µL, 33 gauge |
| Micro-smotic pump model 1002 | ALZET | 0004317 | 0.25 µL per hour, 14 days |
| PBS (pH = 7.3) | ORIGENE | ZLI-9061 | |
| Pentobarbital sodium | Shanghai Civi | CAS NO: 57-33-0 | 150-200 mg/kg intraperitoneal injection for euthanasia |
| Small Animal Anesthesia Machine | RWD | R520IE | E05807-006 M |
| Stereotaxic Equipment | RWD | E06382 | |
| STERI 250 sterilizer | Keller | 31101 | Rapid sterilization of surgical instruments |
| Surgical sutures | Shanghai jinhuan | F504 | 5-0 |
| Syringe needle (1 mL) | Shanghai KDL | 6930197811018 | 26 gauge (0.45 mm x 16 mm) |
| Testing drug and solvent | Experiment dependent | N/A | |
| ThermoStar Homeothermic Monitoring System | RWD | 69026 | Maintain body temperature during anesthesia |
| Vetbond Tissue adhesive | 3M | 1469SB | Secure the brain infusion cannula , Adhere the skin incision |
参考文献
- Theeuwes, F., Yum, S. I. Principles of the design and operation of generic osmotic pumps for the delivery of semisolid or liquid drug formulations. Annals of Biomedical Engineering. 4 (4), 343-353 (1976).
- Herrlich, S., Spieth, S., Messner, S., Zengerle, R. Osmotic micropumps for drug delivery. Advanced Drug Delivery Reviews. 64 (14), 1617-1627 (2012).
- Wei, E., Loh, H. Physical dependence of opiate-like peptides. Science. 193 (4259), 1262-1263 (1976).
- Pettigrew, J. D., Kasamatsu, T. Local perfusion of noradrenaline maintains visual cortical plasticity. Nature. 271 (5647), 761-763 (1978).
- Wang, Y., et al. Reduced oligodendrocyte precursor cell impairs astrocytic development in early life stress. Advanced Science (Weinheim). 8 (16), 2101181 (2021).
- Tang, C., et al. Neural stem cells behave as a functional niche for the maturation of newborn neurons through the secretion of PTN. Neuron. 101 (1), 32-44 (2019).
- Watanabe, S., Komine, O., Endo, F., Wakasugi, K., Yamanaka, K. Intracerebroventricular administration of Cystatin C ameliorates disease in SOD1-linked amyotrophic lateral sclerosis mice. Journal of Neurochemistry. 145 (1), 80-89 (2018).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments: JoVE. , e50326 (2013).
- Tang, C., Guo, W. Implantation of a mini-osmotic pump plus stereotactical injection of retrovirus to study newborn neuron development in adult mouse hippocampus. STAR Protocols. 2 (1), 100374 (2021).
- Niu, J., et al. Oligodendroglial ring finger protein Rnf43 is an essential injury-specific regulator of oligodendrocyte maturation. Neuron. 109 (19), 3104-3118 (2021).
- Breitschopf, H., Suchanek, G., Gould, R. M., Colman, D. R., Lassmann, H. In situ hybridization with digoxigenin-labeled probes: sensitive and reliable detection method applied to myelinating rat brain. Acta Neuropathologica. 84 (6), 581-587 (1992).
- Cree, B. A. C., et al. Clemastine rescues myelination defects and promotes functional recovery in hypoxic brain injury. Brain. 141 (1), 85-98 (2018).
- Eckenhoff, B., Yum, S. I. The osmotic pump: novel research tool for optimizing drug regimens. Biomaterials. 2 (2), 89-97 (1981).
- Thoenen, H., Sendtner, M. Neurotrophins: from enthusiastic expectations through sobering experiences to rational therapeutic approaches. Nature Neuroscience. 5, 1046-1050 (2002).
- Hagg, T. Intracerebral infusion of neurotrophic factors. Methods in Molecular Biology. 399, 167-180 (2007).
- Bittner, B., Thelly, T., Isel, H., Mountfield, R. J. The impact of co-solvents and the composition of experimental formulations on the pump rate of the ALZET osmotic pump. International Journal of Pharmaceutics. 205 (1-2), 195-198 (2000).
- Arnot, M. I., Bateson, A. N., Martin, I. L. Dimethyl sulfoxide/propylene glycol is a suitable solvent for the delivery of diazepam from osmotic minipumps. Journal of Pharmacological and Toxicological Methods. 36 (1), 29-31 (1996).
- Gullapalli, R., et al. Development of ALZET osmotic pump compatible solvent compositions to solubilize poorly soluble compounds for preclinical studies. Drug Delivery. 19 (5), 239-246 (2012).
- White, J. D., Schwartz, M. W. Using osmotic minipumps for intracranial delivery of amino acids and peptides. Methods in Neurosciences. 21, 187-200 (1994).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved