È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Somministrazione di farmaci a base di pompa osmotica per la ricerca sulla rimielinizzazione in vivo sul sistema nervoso centrale
In questo articolo
Riepilogo
La demielinizzazione avviene in più malattie del sistema nervoso centrale. Una tecnica affidabile di somministrazione di farmaci in vivo è necessaria per i test antidroga rimielinizzanti. Questo protocollo descrive un metodo basato su pompa osmotica che consente la somministrazione di farmaci a lungo termine direttamente nel parenchima cerebrale e migliora la biodisponibilità del farmaco, con ampia applicazione nella ricerca sulla rimielinizzazione.
Abstract
La demielinizzazione è stata identificata non solo nella sclerosi multipla (SM), ma anche in altre malattie del sistema nervoso centrale come il morbo di Alzheimer e l'autismo. Poiché l'evidenza suggerisce che la rimielinizzazione può migliorare efficacemente i sintomi della malattia, c'è una crescente attenzione allo sviluppo di farmaci per promuovere il processo di rigenerazione della mielina. Pertanto, è necessaria una tecnica di somministrazione di farmaci selezionabile a livello regionale e affidabile in termini di risultati per testare l'efficienza e la specificità di questi farmaci in vivo. Questo protocollo introduce l'impianto della pompa osmotica come un nuovo approccio di somministrazione del farmaco nel modello murino di demielinizzazione indotta da lisolecitina. La pompa osmotica è un piccolo dispositivo impiantabile in grado di bypassare la barriera emato-encefalica (BBB) e fornire farmaci in modo costante e diretto ad aree specifiche del cervello del topo. Può anche migliorare efficacemente la biodisponibilità di farmaci come peptidi e proteine con una breve emivita. Pertanto, questo metodo è di grande valore per il campo della ricerca sulla rigenerazione della mielina del sistema nervoso centrale.
Introduzione
La pompa osmotica è un piccolo dispositivo impiantabile per il rilascio di soluzioni. Può essere utilizzato per la consegna sistemica quando impiantato per via sottocutanea o nella cavità addominale. La superficie della pompa osmotica è una membrana semipermeabile e il suo lato interno è uno strato permeabile. La pompa osmotica funziona utilizzando la differenza di pressione osmotica tra lo strato osmotico e l'ambiente tissutale in cui viene impiantata la pompa. L'elevata osmolalità dello strato osmotico fa fluire l'acqua nel tessuto nello strato osmotico attraverso la membrana semipermeabile sulla superficie della pompa. Lo strato osmotico si espande e comprime il serbatoio flessibile all'interno della pompa, spostando così la soluzione dal serbatoio flessibile ad una certa velocità per una lunga durata1. La pompa ha tre diversi volumi di serbatoio, 100 μL, 200 μL e 2 mL, con velocità di mandata variabili da 0,11 μL/h a 10 μL/h. A seconda del tipo di pompa selezionato, il dispositivo può funzionare da 1 giorno a 6 settimane2. In questo protocollo viene utilizzata una pompa osmotica da 100 μL con una velocità di trasferimento di 0,25 μL/h che può funzionare per 14 giorni.
Nel 1970, la pompa osmotica era stata utilizzata nella ricerca neuroscientifica 3,4. Ad esempio, Wei et al. hanno adottato l'approccio della pompa osmotica per iniettare peptidi oppioidi nel ventricolo in uno studio sulla tossicodipendenza3. Dopo il miglioramento continuo, la pompa osmotica è stata ora utilizzata nello studio della somministrazione controllata di migliaia di farmaci, tra cui peptidi, fattori di crescita, farmaci che creano dipendenza, ormoni, steroidi, anticorpi e così via. Inoltre, con cateteri speciali (Brain Infusion Kits) collegati, può essere utilizzato per infusioni mirate a tessuti o organi specifici, tra cui il midollo spinale, il cervello, la milza e il fegato 5,6,7.
Nello studio della rimielinizzazione, molti farmaci hanno dimostrato di promuovere la rigenerazione della mielina in vitro, ma la maggior parte di essi non ha ottenuto effetti significativi in vivo, probabilmente a causa della mancanza di un metodo di somministrazione appropriato. I metodi di somministrazione tradizionali come l'iniezione intraperitoneale, l'iniezione sottocutanea e la somministrazione intragastrica hanno limitazioni nella biodisponibilità dei farmaci. Inoltre, alcuni farmaci hanno una scarsa permeabilità alla barriera emato-encefalica, che mina il loro accesso al parenchima cerebrale. Insieme, queste limitazioni richiedono un nuovo metodo di consegna efficiente. In combinazione con i kit di infusione cerebrale, le pompe osmotiche possono bypassare la barriera emato-encefalica e fornire farmaci direttamente al corpo calloso, il che migliora efficacemente la biodisponibilità dei farmaci, specialmente per alcuni polipeptidi e farmaci proteici con una breve emivita. Pertanto, la pompa osmotica come nuova tecnica di somministrazione di farmaci è di grande valore per il campo della ricerca sulla rigenerazione della mielina del sistema nervoso centrale. L'applicazione di questa tecnica sarà introdotta in dettaglio di seguito.
Protocollo
Tutte le procedure sugli animali sono state condotte secondo linee guida e protocolli istituzionali approvati dal comitato per il benessere degli animali e l'etica della Terza Università Medica Militare.
1. Istituzione del modello murino di demielinizzazione indotta da lisolecitina
- Preparare la soluzione di lysolecitina all'1% (chiamata anche L-α-Lysophosphatidylcholine) con PBS sterile.
- Sterilizzare forbici, pinze, emostato curvo e altri strumenti chirurgici mediante sterilizzazione in autoclave. Sterilizzare l'area chirurgica e stendere fogli sterili. Tutti i materiali e i reagenti utilizzati per la chirurgia devono essere preparati in modo asettico. È importante mantenere l'area chirurgica sterile durante tutta la procedura.
- Anestetizzare un topo C57BL6 del giorno postnatale 56 (P56) come segue.
- Posizionare il mouse nella camera isoflurano della macchina per anestesia di piccoli animali. Regolare il flusso O2 a 300-500 ml/min e l'isoflurano al 3%-4%. Dopo un'anestesia sufficiente, quando il mouse diventa immobile con un respiro lento e stabile, trasferire il mouse all'apparato stereotassico con una piastra riscaldante.
- Commutare l'uscita del gas dalla camera alla maschera di anestesia e regolare l'isoflurano all'1% - 1,5% per mantenere il mouse nello stato di anestesia. Attendere che il topo sia completamente anestetizzato, iniettare ketoprofene (3 – 5 mg / kg) per via intraperitoneale per alleviare il dolore. Prima dell'operazione, pizzicare le dita dei piedi del mouse e controllare la sua reazione per confermare l'anestesia8 riuscita.
- Quando il mouse viene anestetizzato, non può regolare la sua temperatura corporea. Pertanto, monitorare e regolare la temperatura corporea del topo durante l'intervento chirurgico. Per mantenere umidi i bulbi oculari del topo durante l'anestesia, coprire la superficie dei bulbi oculari con unguento oculare all'eritromicina.
- Fissare la testa del mouse nell'apparecchio stereotassico con barra dei denti e barre auricolari. (Figura 1A).
- Usa un rasoio per rimuovere i peli dalla parte superiore della testa. Igienizzare la pelle della testa con tre cicli di betadina e etanolo al 75%. Per motivi etici, coprire il corpo animale ad eccezione del sito chirurgico. Usando un bisturi, fare un'incisione medio-sagittale lunga 1 cm della pelle dalla base del collo a tra gli occhi per esporre il cranio (Figura 1B).
- Pulire delicatamente la superficie del cranio con un batuffolo di cotone sterile contenente il 30% di perossido di idrogeno per visualizzare le suture craniche (Figura 1C). Regolare l'altezza della barra dei denti e delle barre auricolari per posizionare il punto lambda e il punto bregma alla stessa altezza (cioè con le stesse coordinate dell'asse z quando la punta dell'ago tocca i punti), in modo che la sutura sagittale sia orizzontale.
- Posizionare delicatamente la punta dell'ago della siringa microlitri (10 μL, 33 G) nel punto bregma e ripristinare le coordinate x, y e z su 0 (Figura 1D). Spostare la siringa sul sito di iniezione (x: 1,04; y: 1,0, cioè 1,04 mm lateralmente alla linea mediana e 1,0 mm posteriore al punto bregma) secondo il prompt della lettura digitale (Figura 1E).
- Praticare lentamente un piccolo foro di bava attraverso il cranio nel sito di iniezione senza penetrare nella dura con un ago per siringa da 1 mL (26 G, 0,45 mm) (Figura 1F). Inserire lentamente l'ago della siringa del microlitro nel tessuto cerebrale attraverso il foro fino a raggiungere una certa profondità (z = -1,62 mm per la maggior parte dei topi P56) (Figura 1G).
NOTA: Empiricamente, la profondità di inserimento di -1,62 mm consente alla punta dell'ago di raggiungere il centro del corpo calloso della maggior parte dei topi P56 in modo che la lisolecitina possa essere consegnata direttamente nel corpo calloso per indurre demielinizzazione. - Iniettare 1,5 μL di 1% di linfosolecitina ad una velocità di 0,3 μL/min. Dopo l'iniezione, attendere 5 minuti prima di estrarre lentamente la siringa del microlitro per evitare la fuoriuscita di liquido lungo il percorso dell'ago di iniezione.
- Cucire la pelle con suture chirurgiche 5-0 (Figura 1H).
- Posizionare il mouse su una piastra riscaldante per evitare un calo della temperatura corporea. Somministrare un'iniezione sottocutanea di 5 mg/kg di carprofene ogni 24 ore per alleviare il dolore. Applicare l'unguento all'eritromicina sull'incisione ogni giorno per garantire che la ferita guarisca correttamente. Metti il topo che ha subito un intervento chirurgico in una gabbia da solo e nutrilo con cibo umido fino a completo recupero. Monitorare il mouse ogni giorno dopo l'operazione.
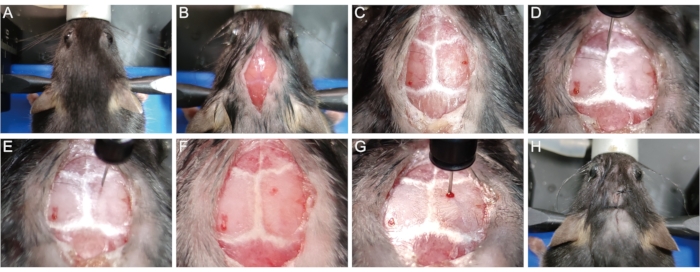
Figura 1: Istituzione del modello murino di demielinizzazione indotta dalla lisolecitina. (A) Fissare il mouse nell'apparato stereotassico. (B) Aprire un'incisione medio-sagittale di 1 cm per esporre il cranio. (C) Visualizzare le suture craniche. (D) Reimpostare le coordinate x, y e z su 0 sul punto di Bregma. (E) Spostare la siringa nel sito di iniezione. (F) Praticare un foro nel cranio nel sito di iniezione. (G) Inserire lentamente l'ago nel tessuto cerebrale e iniettare lysolecitina. (H) Cucire la pelle. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Preparazione della pompa osmotica
NOTA: i componenti chiave della pompa sono mostrati nella Figura 2A.
- Determinare la profondità di inserimento della cannula di infusione cerebrale nel cervello. Assicurarsi che l'ago della cannula per infusione cerebrale utilizzata sia lungo 3 mm e che ogni distanziatore di regolazione della profondità sia di 0,5 mm. Per ottenere una profondità di iniezione di 1,5 mm (vicino al calloso), collegare tre distanziatori di regolazione della profondità all'ago della cannula per infusione cerebrale con adesivo tissutale (Figura 2B, C).
- Per riempire la pompa osmotica, collegare l'ago della siringa fornito con la confezione della pompa a una siringa da 1 mL e aspirare il farmaco. Tenere la pompa in posizione verticale, inserire la siringa nell'apertura nella parte superiore della pompa e iniettare lentamente il farmaco, facendo attenzione a non creare bolle9 (vedere Figura 2D). Quando il liquido fuoriesce dall'apertura, estrarre lentamente la siringa.
- Rimuovere la flangia bianca dal regolatore di flusso con forbici o pinze facendo attenzione a non piegare o schiacciare il moderatore di flusso. Quindi, inserire il moderatore di flusso nella pompa (Figura 2E). Per determinare se ci sono bolle nella pompa osmotica, pesare la pompa osmotica separatamente prima e dopo il riempimento.
- Tagliare il catetere a una certa lunghezza in base alle dimensioni dell'animale (cateteri da 20-25 mm per topi P56 che pesano circa 25 g). Attaccare il catetere alla cannula dell'infusione cerebrale.
- Riempire il catetere con farmaci usando la siringa senza introdurre aria (Figura 2F).
- Collegare il catetere al moderatore del flusso. Dopo il fissaggio, assicurarsi che il catetere copra circa 4 mm del moderatore di flusso esposto (Figura 2G).
- Per garantire che la pompa osmotica possa funzionare immediatamente dopo l'impianto, immergere le pompe riempite in soluzione salina sterile allo 0,9% o PBS a 37 °C per almeno 4-6 ore (preferibilmente estendere fino a notte) per pre-bagnare la membrana semipermeabile sulla superficie della pompa con soluzioni che hanno la stessa pressione osmotica dell'ambiente tissutale (Figura 2H).
- Tutte le soluzioni caricate nelle pompe devono essere sterili. Le pompe ALZET vengono fornite sterili, essendo state esposte ad una dose sterilizzante di 60Co. Tuttavia, se si verifica una contaminazione esterna, la superficie della pompa può essere pulita pulendola con alcool isopropilico (70% in acqua).

Figura 2: Preparazione della pompa osmotica. (A) Componenti chiave della pompa osmotica. (B,C) Attaccare distanziali di regolazione della profondità all'ago della cannula per infusione cerebrale. (D) Riempire la pompa osmotica utilizzando una siringa da 1 mL. (E) Inserire il moderatore di flusso nella pompa. (F) Riempire il catetere usando la siringa. (G) Collegare il catetere al moderatore del flusso. (H) Immergere le pompe riempite in soluzione salina sterile allo 0,9% o PBS a 37 °C. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Impianto della pompa osmotica
- Attendere 3 giorni dopo l'istituzione del modello di demielinizzazione del corpo calloso. Accendere il sistema di anestesia per piccoli animali. Disinfettare forbici, pinzette e pinze emostatiche e immergerle in una soluzione alcolica al 75%. Posare fogli sterili nell'area chirurgica.
- Anestetizzare e fissare nuovamente i topi sull'apparato stereotassico. Coprire la superficie dei bulbi oculari con un unguento per gli occhi per prevenire la secchezza.
- Disinfettare la ferita originale con alcol al 75%. Aprire l'incisione chirurgica precedentemente cucita (Figura 3A) ed espandere l'incisione alle scapole (Figura 3B).
- Separare la pelle dal tessuto connettivo sottocutaneo con pinze emostatiche o pinzette alla scapola per aprire una cavità (Figura 3C). Posizionare la pompa osmotica nella cavità (Figura 3D,E).
- Con un batuffolo di cotone, pulire delicatamente ed esporre il foro stenopeico sulla superficie del cranio creato quando si stabilisce il modello di demielinizzazione (vedere il passaggio 1.8). Inserire la cannula per infusione cerebrale attraverso questo foro stenopeico perpendicolarmente e fissarla rapidamente sul cranio con adesivo tissutale (Figura 3F).
- Rimuovere la linguetta rimovibile sopra la cannula per infusione cerebrale con un paio di forbici (Figura 3G, H). In alternativa, rimuovere la linguetta prima di inserire la cannula per evitare di scuotere in questo processo.
- Cucire l'incisione o attaccarla con adesivo tissutale (Figura 3I).
- Dopo l'intervento chirurgico, posizionare il mouse su una piastra riscaldante per evitare un calo della temperatura corporea. Somministrare un'iniezione sottocutanea di 5 mg/kg di carprofene ogni 24 ore per alleviare il dolore. Applicare l'unguento all'eritromicina sull'incisione ogni giorno per garantire che la ferita guarisca correttamente. Metti l'animale in una gabbia da solo e nutriti con cibo umido fino a completo recupero. Monitorare i topi ogni giorno e verificare se la cannula per infusione cerebrale era saldamente attaccata.
- Eutanasia del topo 11 giorni dopo l'intervento chirurgico iniettando 150-200 mg/kg di Pentobarbital sodico per via intraperitoneale seguita da perfondendo transcardialmente con il 4% di formaldeide.
- Per verificare che la soluzione venga erogata normalmente, rimuovere con attenzione la pompa osmotica e misurare il volume residuo nel serbatoio della pompa prima della dissezione cerebrale.
- Per misurare il volume residuo, rimuovere la cannula dell'infusione cerebrale, collegare una siringa da 1 mL al catetere e quindi aspirare la soluzione rimanente per determinarne il volume. Confrontare il volume residuo effettivo con il volume residuo teorico (volume iniziale - velocità media di pompaggio * durata dell'infusione).
NOTA: un volume residuo eccessivo indica un'infusione non riuscita, che potrebbe essere dovuta all'occlusione del catetere o al malfunzionamento della pompa.
- Per misurare il volume residuo, rimuovere la cannula dell'infusione cerebrale, collegare una siringa da 1 mL al catetere e quindi aspirare la soluzione rimanente per determinarne il volume. Confrontare il volume residuo effettivo con il volume residuo teorico (volume iniziale - velocità media di pompaggio * durata dell'infusione).
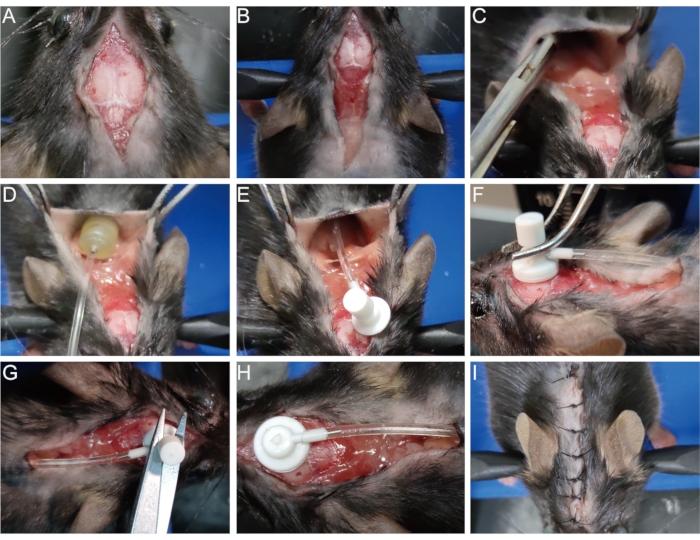
Figura 3: Impianto della pompa osmotica. (A) Aprire l'incisione chirurgica. (B) Espandere l'incisione alle scapole. (C) Separare la pelle dal tessuto connettivo sottocutaneo per creare una cavità. (D,E) Posizionare la pompa osmotica nella cavità. (F) Inserire la cannula per infusione cerebrale nel foro stenopeico sulla superficie del cranio e fissarla saldamente sul cranio. (G,H) Rimuovere la linguetta rimovibile dalla cannula. (I) Cucire l'incisione. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Per verificare l'effetto della pompa osmotica nella ricerca sulla rigenerazione della mielina, è stato creato un modello di demielinizzazione indotta da lisolecitina nei topi P56, seguito dall'impianto di pompe osmotiche contenenti UM206 (1 mg in 1,5 ml 0,9% di soluzione salina), un peptide con una breve emivita e scarsa permeabilità BBB che è stato recentemente segnalato per promuovere la rimielinizzazione10 . Lo 0,9% di soluzione salina è stato utilizzato come controllo. Quattordici giorni d...
Discussione
Questo protocollo descrive la pompa osmotica come una nuova tecnica di somministrazione di farmaci per la ricerca sulla rigenerazione della mielina, che può fornire farmaci direttamente al sito di trattamento e consentire la somministrazione costante di farmaci per un periodo prolungato, creando una concentrazione stabile di farmaco nel microambiente del sistema nervoso centrale per l'intera durata sperimentale. Rispetto ad altri metodi di somministrazione del farmaco, la pompa osmotica è più favorevole al manteniment...
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni della National Nature Science Foundation of China (NSFC 32070964, 31871045) a J.N. e dalla Shenzhen Basic Research Foundation (JCYJ20210324121214039) a Y.S.
Materiali
| Name | Company | Catalog Number | Comments |
| Anesthesia Air Pump | RWD | R510-29 | E05818-006 |
| Brain Infusion kit 3 | ALZET | 0008851 | 1-3 mm |
| Carprofen | Macklin | C830557-1g | 5 mg/kg every 24 h |
| Erythromycin eye ointment | Along technology | YCKJ-RJ-024780 | Cover the surface of the eyeballs during anesthesia |
| Erythromycin ointment | pythonbio | RG180 | |
| Gas Evacuation Apparatus | RWD | R546W | E05518-002 |
| L-α-Lysophosphatidylcholine | Sigma | L0906 | Dissolve at 1% with sterile PBS |
| Microliter Syringe | Hamilton | 65460-05 | Syringe Series:1700, 10 µL, 33 gauge |
| Micro-smotic pump model 1002 | ALZET | 0004317 | 0.25 µL per hour, 14 days |
| PBS (pH = 7.3) | ORIGENE | ZLI-9061 | |
| Pentobarbital sodium | Shanghai Civi | CAS NO: 57-33-0 | 150-200 mg/kg intraperitoneal injection for euthanasia |
| Small Animal Anesthesia Machine | RWD | R520IE | E05807-006 M |
| Stereotaxic Equipment | RWD | E06382 | |
| STERI 250 sterilizer | Keller | 31101 | Rapid sterilization of surgical instruments |
| Surgical sutures | Shanghai jinhuan | F504 | 5-0 |
| Syringe needle (1 mL) | Shanghai KDL | 6930197811018 | 26 gauge (0.45 mm x 16 mm) |
| Testing drug and solvent | Experiment dependent | N/A | |
| ThermoStar Homeothermic Monitoring System | RWD | 69026 | Maintain body temperature during anesthesia |
| Vetbond Tissue adhesive | 3M | 1469SB | Secure the brain infusion cannula , Adhere the skin incision |
Riferimenti
- Theeuwes, F., Yum, S. I. Principles of the design and operation of generic osmotic pumps for the delivery of semisolid or liquid drug formulations. Annals of Biomedical Engineering. 4 (4), 343-353 (1976).
- Herrlich, S., Spieth, S., Messner, S., Zengerle, R. Osmotic micropumps for drug delivery. Advanced Drug Delivery Reviews. 64 (14), 1617-1627 (2012).
- Wei, E., Loh, H. Physical dependence of opiate-like peptides. Science. 193 (4259), 1262-1263 (1976).
- Pettigrew, J. D., Kasamatsu, T. Local perfusion of noradrenaline maintains visual cortical plasticity. Nature. 271 (5647), 761-763 (1978).
- Wang, Y., et al. Reduced oligodendrocyte precursor cell impairs astrocytic development in early life stress. Advanced Science (Weinheim). 8 (16), 2101181 (2021).
- Tang, C., et al. Neural stem cells behave as a functional niche for the maturation of newborn neurons through the secretion of PTN. Neuron. 101 (1), 32-44 (2019).
- Watanabe, S., Komine, O., Endo, F., Wakasugi, K., Yamanaka, K. Intracerebroventricular administration of Cystatin C ameliorates disease in SOD1-linked amyotrophic lateral sclerosis mice. Journal of Neurochemistry. 145 (1), 80-89 (2018).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments: JoVE. , e50326 (2013).
- Tang, C., Guo, W. Implantation of a mini-osmotic pump plus stereotactical injection of retrovirus to study newborn neuron development in adult mouse hippocampus. STAR Protocols. 2 (1), 100374 (2021).
- Niu, J., et al. Oligodendroglial ring finger protein Rnf43 is an essential injury-specific regulator of oligodendrocyte maturation. Neuron. 109 (19), 3104-3118 (2021).
- Breitschopf, H., Suchanek, G., Gould, R. M., Colman, D. R., Lassmann, H. In situ hybridization with digoxigenin-labeled probes: sensitive and reliable detection method applied to myelinating rat brain. Acta Neuropathologica. 84 (6), 581-587 (1992).
- Cree, B. A. C., et al. Clemastine rescues myelination defects and promotes functional recovery in hypoxic brain injury. Brain. 141 (1), 85-98 (2018).
- Eckenhoff, B., Yum, S. I. The osmotic pump: novel research tool for optimizing drug regimens. Biomaterials. 2 (2), 89-97 (1981).
- Thoenen, H., Sendtner, M. Neurotrophins: from enthusiastic expectations through sobering experiences to rational therapeutic approaches. Nature Neuroscience. 5, 1046-1050 (2002).
- Hagg, T. Intracerebral infusion of neurotrophic factors. Methods in Molecular Biology. 399, 167-180 (2007).
- Bittner, B., Thelly, T., Isel, H., Mountfield, R. J. The impact of co-solvents and the composition of experimental formulations on the pump rate of the ALZET osmotic pump. International Journal of Pharmaceutics. 205 (1-2), 195-198 (2000).
- Arnot, M. I., Bateson, A. N., Martin, I. L. Dimethyl sulfoxide/propylene glycol is a suitable solvent for the delivery of diazepam from osmotic minipumps. Journal of Pharmacological and Toxicological Methods. 36 (1), 29-31 (1996).
- Gullapalli, R., et al. Development of ALZET osmotic pump compatible solvent compositions to solubilize poorly soluble compounds for preclinical studies. Drug Delivery. 19 (5), 239-246 (2012).
- White, J. D., Schwartz, M. W. Using osmotic minipumps for intracranial delivery of amino acids and peptides. Methods in Neurosciences. 21, 187-200 (1994).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon