Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Osmotische pumpbasierte Wirkstoffabgabe für die In-vivo-Remyelinisierungsforschung am zentralen Nervensystem
In diesem Artikel
Zusammenfassung
Die Demyelinisierung findet bei multiplen Erkrankungen des zentralen Nervensystems statt. Eine zuverlässige In-vivo-Arzneimittelabgabetechnik ist für remyelinisierende Arzneimitteltests erforderlich. Dieses Protokoll beschreibt eine osmotische pumpbasierte Methode, die eine langfristige Arzneimittelabgabe direkt in das Gehirnparenchym ermöglicht und die Bioverfügbarkeit des Arzneimittels verbessert, mit breiter Anwendung in der Remyelinisierungsforschung.
Zusammenfassung
Demyelinisierung wurde nicht nur bei Multipler Sklerose (MS), sondern auch bei anderen Erkrankungen des zentralen Nervensystems wie Alzheimer und Autismus identifiziert. Da Beweise darauf hindeuten, dass die Remyelinisierung die Krankheitssymptome wirksam lindern kann, liegt der Schwerpunkt zunehmend auf der Arzneimittelentwicklung, um den Myelin-Regenerationsprozess zu fördern. Daher ist eine regional wählbare und ergebnissichere Arzneimittelabgabetechnik erforderlich, um die Wirksamkeit und Spezifität dieser Arzneimittel in vivo zu testen. Dieses Protokoll führt das osmotische Pumpenimplantat als neuen Drug-Delivery-Ansatz im Lysolecithin-induzierten Demyelinisierungs-Mausmodell ein. Die osmotische Pumpe ist ein kleines implantierbares Gerät, das die Blut-Hirn-Dämpfung (BHS) umgehen und Medikamente stetig und direkt an bestimmte Bereiche des Mäusegehirns abgeben kann. Es kann auch die Bioverfügbarkeit von Medikamenten wie Peptiden und Proteinen mit einer kurzen Halbwertszeit effektiv verbessern. Daher ist diese Methode von großem Wert für das Gebiet der Myelinregenerationsforschung des zentralen Nervensystems.
Einleitung
Die osmotische Pumpe ist ein kleines implantierbares lösungslösendes Gerät. Es kann für die systemische Entbindung verwendet werden, wenn es subkutan oder in der Bauchhöhle implantiert wird. Die Oberfläche der osmotischen Pumpe ist eine semipermeable Membran und ihre Innenseite ist eine durchlässige Schicht. Die osmotische Pumpe arbeitet unter Verwendung der osmotischen Druckdifferenz zwischen der osmotischen Schicht und der Gewebeumgebung, in der die Pumpe implantiert wird. Die hohe Osmolalität der osmotischen Schicht lässt das Wasser im Gewebe durch die semipermeable Membran auf der Pumpenoberfläche in die osmotische Schicht fließen. Die osmotische Schicht dehnt sich aus und komprimiert das flexible Reservoir in der Pumpe, wodurch die Lösung für eine lange Dauer mit einer bestimmten Rate aus dem flexiblen Reservoir verdrängtwird 1. Die Pumpe hat drei verschiedene Reservoirvolumina, 100 μL, 200 μL und 2 ml, wobei ihre Förderraten von 0,11 μL/h bis 10 μL/h variieren. Je nach gewähltem Pumpentyp kann das Gerät von 1 Tag bis 6 Wochen2 betrieben werden. In diesem Protokoll wird eine 100 μL osmotische Pumpe mit einer Übertragungsrate von 0,25 μL/h verwendet, die 14 Tage lang betrieben werden kann.
In den 1970er Jahren wurde die osmotische Pumpe in der neurowissenschaftlichen Forschungeingesetzt 3,4. Zum Beispiel übernahmen Wei et al. den osmotischen Pumpansatz, um Opioidpeptide in den Ventrikel in eine Studie über Drogenabhängigkeit zu injizieren3. Nach kontinuierlicher Verbesserung wurde die osmotische Pumpe nun bei der Untersuchung der kontrollierten Abgabe von Tausenden von Medikamenten eingesetzt, darunter Peptide, Wachstumsfaktoren, Suchtmittel, Hormone, Steroide, Antikörper und so weiter. Darüber hinaus kann es mit speziellen Kathetern (Brain Infusion Kits) für die gezielte Infusion in bestimmte Gewebe oder Organe, einschließlich Rückenmark, Gehirn, Milz und Leberverwendet werden 5,6,7.
In der Studie zur Remyelinisierung wurde gezeigt, dass viele Medikamente die Myelinregeneration in vitro fördern, aber die meisten von ihnen haben in vivo keine signifikanten Wirkungen erzielt, möglicherweise aufgrund des Fehlens einer geeigneten Verabreichungsmethode. Traditionelle Verabreichungsmethoden wie intraperitoneale Injektion, subkutane Injektion und intragastrische Verabreichung haben Einschränkungen in der Bioverfügbarkeit der Medikamente. Darüber hinaus haben einige Medikamente eine schlechte Durchlässigkeit der Blut-Hirn-Schranke, was ihren Zugang zum Gehirnparenchym untergräbt. Zusammen erfordern diese Einschränkungen eine neuartige effiziente Bereitstellungsmethode. In Kombination mit den Gehirninfusionskits können osmotische Pumpen die Blut-Hirn-Schranke umgehen und Medikamente direkt an das Corpus callosum abgeben, was die Bioverfügbarkeit von Medikamenten effektiv verbessert, insbesondere für einige Polypeptid- und Proteinmedikamente mit einer kurzen Halbwertszeit. Daher ist die osmotische Pumpe als neue Drug-Delivery-Technik von großem Wert für das Gebiet der Myelin-Regenerationsforschung des zentralen Nervensystems. Die Anwendung dieser Technik wird im Folgenden ausführlich vorgestellt.
Protokoll
Alle Tierverfahren wurden nach institutionellen Richtlinien und Protokollen durchgeführt, die von der Tierschutz- und Ethikkommission der Dritten Militärmedizinischen Universität genehmigt wurden.
1. Etablierung des Lysolecithin-induzierten Demyelin-Mausmodells
- Bereiten Sie 1% ige Lysolecithin-Lösung (auch L-α-Lysophosphatidylcholin) mit sterilem PBS vor.
- Sterilisieren Sie Scheren, Pinzetten, gekrümmte Hämostaten und andere chirurgische Instrumente durch Autoklavensterilisation. Sterilisieren Sie den Operationsbereich und legen Sie sterile Laken ab. Alle Materialien und Reagenzien, die für die Operation verwendet werden, sollten aseptisch vorbereitet werden. Es ist wichtig, den Operationsbereich während des gesamten Eingriffs steril zu halten.
- Anästhesien Sie eine postnatale Tag 56 (P56) C57BL6 Maus wie folgt.
- Legen Sie die Maus in die Isoflurankammer des Kleintieranästhesiegeräts. Passen Sie denO2-Durchfluss auf 300-500 ml/min und Isofluran auf 3%-4% an. Nach ausreichender Anästhesie, wenn die Maus mit einem langsamen und stabilen Atemzug unbeweglich wird, übertragen Sie die Maus mit einem Heizkissen auf das stereotaktische Gerät.
- Schalten Sie die Gasabgabe von der Kammer auf die Anästhesiemaske um und stellen Sie den Isofluran auf 1% - 1,5% ein, um die Maus im Anästhesiezustand zu halten. Warten Sie, bis die Maus vollständig betäubt ist, injizieren Sie Ketoprofen (3 – 5 mg / kg) intraperitoneal, um Schmerzen zu lindern. Kneifen Sie vor der Operation die Zehen der Maus ein und überprüfen Sie ihre Reaktion, um eine erfolgreiche Anästhesie zu bestätigen8.
- Wenn die Maus betäubt wird, kann sie ihre Körpertemperatur nicht regulieren. Überwachen und regulieren Sie daher die Körpertemperatur der Maus während der Operation. Um die Augäpfel der Maus unter Narkose feucht zu halten, bedecken Sie die Oberfläche der Augäpfel mit Erythromycin-Augensalbe.
- Befestigen Sie den Mauskopf im stereotaktischen Gerät mit Zahnstange und Ohrstangen. (Abbildung 1A).
- Verwenden Sie einen Rasierer, um Haare von der Oberseite des Kopfes zu entfernen. Desinfizieren Sie die Kopfhaut mit drei Zyklen Betadin und 75% Ethanol. Aus ethischen Gründen decken Sie den Tierkörper mit Ausnahme der Operationsstelle ab. Machen Sie mit einem Skalpell einen 1 cm langen mittleren sagittalen Schnitt der Haut von der Basis des Halses bis zwischen den Augen, um den Schädel freizulegen (Abbildung 1B).
- Wischen Sie die Oberfläche des Schädels vorsichtig mit einem sterilen Wattestäbchen ab, das 30% Wasserstoffperoxid enthält, um die Schädelnähte sichtbar zu machen (Abbildung 1C). Passen Sie die Höhe der Zahnstange und der Ohrstangen an, um den Lambda-Punkt und den Bregma-Punkt auf der gleichen Höhe zu platzieren (d. h. mit den gleichen Z-Achsenkoordinaten, wenn die Nadelspitze die Punkte berührt), so dass die sagittale Naht horizontal ist.
- Platzieren Sie vorsichtig die Spitze der Mikroliter-Spritzennadel (10 μL, 33 G) am Bregmapunkt, und setzen Sie die x-, y- und z-Koordinaten auf 0 zurück (Abbildung 1D). Bewegen Sie die Spritze an die Injektionsstelle (x: 1,04; y: 1,0, d. h. 1,04 mm seitlich zur Mittellinie und 1,0 mm posterior zum Bregmapunkt) entsprechend der Eingabeaufforderung der digitalen Anzeige (Abbildung 1E).
- Bohren Sie langsam ein kleines Gratloch durch den Schädel an der Injektionsstelle, ohne die Dura mit einer 1 ml Spritzennadel (26 G, 0,45 mm) zu durchdringen (Abbildung 1F). Führen Sie die Mikroliter-Spritzennadel langsam durch das Loch in das Hirngewebe ein, bis eine bestimmte Tiefe erreicht ist (z = -1,62 mm bei den meisten P56-Mäusen) (Abbildung 1G).
HINWEIS: Empirisch gesehen ermöglicht die Einführtiefe von -1,62 mm der Nadelspitze, die Mitte des Corpus callosum der meisten P56-Mäuse zu erreichen, so dass das Lysolecithin direkt in das Corpus callosum abgegeben werden konnte, um eine Demyelinisierung zu induzieren. - Injizieren Sie 1,5 μL 1% Lysolecithin bei einer Geschwindigkeit von 0,3 μL/min. Warten Sie nach der Injektion 5 Minuten, bevor Sie die Mikroliterspritze langsam herausziehen, um das Austreten von Flüssigkeit entlang des Injektionsnadelpfades zu verhindern.
- Heften Sie die Haut mit 5-0 chirurgischen Nähten (Abbildung 1H).
- Legen Sie die Maus auf ein Heizkissen, um einen Abfall der Körpertemperatur zu vermeiden. Verabreichen Sie alle 24 Stunden eine subkutane Injektion von 5 mg/kg Carprofen, um die Schmerzen zu lindern. Tragen Sie jeden Tag Erythromycin-Salbe auf den Einschnitt auf, um sicherzustellen, dass die Wunde richtig heilt. Legen Sie die Maus, die operiert wurde, allein in einen Käfig und füttern Sie sie mit feuchtem Futter, bis sie vollständig genesen ist. Überwachen Sie die Maus täglich nach der Bedienung.
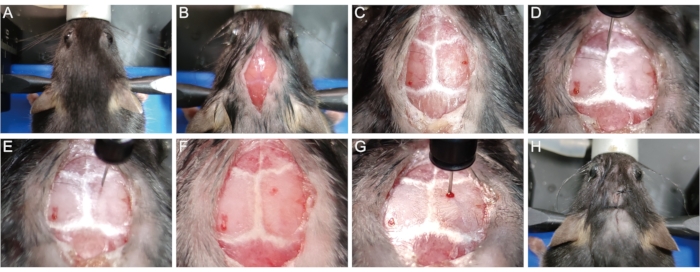
Abbildung 1: Etablierung des Lysolecithin-induzierten Demyelinisierungs-Mausmodells . (A) Befestigen Sie die Maus in der stereotaktischen Vorrichtung. (B) Öffnen Sie einen 1 cm langen mittleren sagittalen Einschnitt, um den Schädel freizulegen. (C) Visualisieren Sie die Schädelnähte. (D) Setzen Sie die x-, y- und z-Koordinaten auf 0 am Bregma-Punkt zurück. (E) die Spritze an die Injektionsstelle zu bringen. (F) Bohren Sie ein Loch in den Schädel an der Injektionsstelle. (G) Führen Sie die Nadel langsam in das Hirngewebe ein und injizieren Sie Lysolecithin. (H) Nähen Sie die Haut. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Vorbereitung der osmotischen Pumpe
HINWEIS: Die wichtigsten Komponenten der Pumpe sind in Abbildung 2A dargestellt.
- Bestimmen Sie die Tiefe der Einführung der Gehirninfusionskanüle in das Gehirn. Stellen Sie sicher, dass die Nadel der verwendeten Gehirninfusionskanüle 3 mm lang ist und jeder Abstandshalter für die Tiefeneinstellung 0,5 mm beträgt. Um eine Injektionstiefe von 1,5 mm (nahe dem Callosum) zu erreichen, befestigen Sie drei Abstandshalter zur Tiefenanpassung mit Gewebekleber an der Nadel der Hirninfusionskanüle (Abbildung 2B, C).
- Um die osmotische Pumpe zu füllen, befestigen Sie die Spritzennadel, die mit dem Pumpenpaket geliefert wird, an einer 1-ml-Spritze und saugen Sie das Arzneimittel ab. Halten Sie die Pumpe aufrecht, führen Sie die Spritze in die Öffnung an der Oberseite der Pumpe ein und injizieren Sie das Arzneimittel langsam, wobei Sie darauf achten, keine Blasen9 zu erzeugen (siehe Abbildung 2D). Wenn die Flüssigkeit aus der Öffnung fließt, ziehen Sie die Spritze langsam heraus.
- Entfernen Sie den weißen Flansch mit einer Schere oder Zange vom Durchflussregler und achten Sie darauf, den Strömungsmoderator nicht zu biegen oder zu zerquetschen. Setzen Sie dann den Strömungsmoderator in die Pumpe ein (Abbildung 2E). Um festzustellen, ob sich Blasen in der osmotischen Pumpe befinden, wiegen Sie die osmotische Pumpe vor und nach dem Befüllen separat.
- Schneiden Sie den Katheter entsprechend der Größe des Tieres auf eine bestimmte Länge (20-25 mm Katheter für P56-Mäuse, die etwa 25 g wiegen). Befestigen Sie den Katheter an der Gehirninfusionskanüle.
- Füllen Sie den Katheter mit der Spritze mit Medikamenten, ohne Luft einzuführen (Abbildung 2F).
- Verbinden Sie den Katheter mit dem Strömungsmoderator. Stellen Sie nach dem Anbringen sicher, dass der Katheter etwa 4 mm des freiliegenden Strömungsmoderators bedeckt (Abbildung 2G).
- Um sicherzustellen, dass die osmotische Pumpe nach der Implantation sofort arbeiten kann, tauchen Sie die gefüllten Pumpen mindestens 4 bis 6 h (vorzugsweise über Nacht) in sterile 0,9% Kochsalzlösung oder PBS bei 37 °C (vorzugsweise über Nacht), um die semipermeable Membran auf der Pumpenoberfläche mit Lösungen vorzubenetzen, die den gleichen osmotischen Druck wie die Gewebeumgebung haben (Abbildung 2H).
- Alle Lösungen, die in die Pumpen geladen werden, sollten steril sein. ALZET-Pumpen werden steril geliefert, nachdem sie einer Sterilisationsdosis von 60Co. ausgesetzt waren. Wenn jedoch eine äußere Kontamination auftritt, kann die Oberfläche der Pumpe gereinigt werden, indem sie mit Isopropylalkohol (70% in Wasser) abgewischt wird.

Abbildung 2: Vorbereitung der osmotischen Pumpe. (A) Schlüsselkomponenten der osmotischen Pumpe. (B,C) Befestigen Sie Abstandshalter zur Tiefenanpassung an der Nadel der Gehirninfusionskanüle. (D) Befüllen Sie die osmotische Pumpe mit einer 1-ml-Spritze. (E) Setzen Sie den Strömungsmoderator in die Pumpe ein. (F) Füllen Sie den Katheter mit der Spritze. (G) Verbinden Sie den Katheter mit dem Strömungsmoderator. (H) Tauchen Sie die gefüllten Pumpen in sterile 0,9% Kochsalzlösung oder PBS bei 37 °C. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Implantation der osmotischen Pumpe
- Warten Sie 3 Tage nach der Etablierung des Corpus callosum Demyelinisierungsmodells. Schalten Sie das Anästhesiesystem für Kleintiere ein. Desinfizieren Sie Schere, Pinzette und hämostatische Zange und tränken Sie sie in 75% iger Alkohollösung. Legen Sie sterile Laken in den Operationsbereich.
- Anästhesieren und sichern Sie die Mäuse wieder am stereotaktischen Apparat. Bedecken Sie die Oberfläche der Augäpfel mit einer Augensalbe, um Trockenheit zu verhindern.
- Desinfizieren Sie die ursprüngliche Wunde mit 75% Alkohol. Öffnen Sie den chirurgischen Schnitt, der zuvor genäht wurde (Abbildung 3A), und erweitern Sie den Schnitt auf die Schulterblätter (Abbildung 3B).
- Trennen Sie die Haut vom subkutanen Bindegewebe mit einer hämostatischen Zange oder Pinzette am Schulterblatt, um einen Hohlraum zu öffnen (Abbildung 3C). Setzen Sie die osmotische Pumpe in den Hohlraum ein (Abbildung 3D,E).
- Wischen Sie mit einem Wattestäbchen vorsichtig ab und legen Sie das Loch auf der Oberfläche des Schädels frei, das bei der Erstellung des Demyelinisierungsmodells entstanden ist (siehe Schritt 1.8). Führen Sie die Gehirninfusionskanüle senkrecht durch dieses Loch ein und befestigen Sie sie schnell mit Gewebekleber am Schädel (Abbildung 3F).
- Entfernen Sie die herausnehmbare Lasche über der Gehirninfusionskanüle mit einer Schere (Abbildung 3G, H). Alternativ können Sie zuerst die Lasche entfernen, bevor Sie die Kanüle einsetzen, um ein Schütteln bei diesem Vorgang zu vermeiden.
- Heften Sie den Schnitt oder befestigen Sie ihn mit Gewebekleber (Abbildung 3I).
- Legen Sie die Maus nach der Operation auf ein Heizkissen, um einen Abfall der Körpertemperatur zu vermeiden. Verabreichen Sie alle 24 Stunden eine subkutane Injektion von 5 mg/kg Carprofen, um die Schmerzen zu lindern. Tragen Sie jeden Tag Erythromycin-Salbe auf den Einschnitt auf, um sicherzustellen, dass die Wunde richtig heilt. Legen Sie das Tier allein in einen Käfig und füttern Sie es mit feuchtem Futter, bis es sich vollständig erholt hat. Überwachen Sie die Mäuse jeden Tag und überprüfen Sie, ob die Gehirninfusionskanüle fest befestigt war.
- Euthanasieren Sie die Maus 11 Tage nach der Operation, indem Sie 150-200 mg / kg Pentobarbitalnatrium intraperitoneal injizieren, gefolgt von einer transkardialen Perfusion mit 4% Formaldehyd.
- Um zu überprüfen, ob die Lösung normal geliefert wird, entfernen Sie vorsichtig die osmotische Pumpe und messen Sie das Restvolumen im Pumpenreservoir vor der Dissektion des Gehirns.
- Um das Restvolumen zu messen, entfernen Sie die Gehirninfusionskanüle, befestigen Sie eine 1-ml-Spritze am Katheter und saugen Sie dann die verbleibende Lösung ab, um ihr Volumen zu bestimmen. Vergleichen Sie das tatsächliche Restvolumen mit dem theoretischen Restvolumen (Anfangsvolumen - mittlere Pumprate * Infusionsdauer).
HINWEIS: Übermäßiges Restvolumen weist auf eine erfolglose Infusion hin, die auf einen Katheterverschluss oder eine Fehlfunktion der Pumpe zurückzuführen sein kann.
- Um das Restvolumen zu messen, entfernen Sie die Gehirninfusionskanüle, befestigen Sie eine 1-ml-Spritze am Katheter und saugen Sie dann die verbleibende Lösung ab, um ihr Volumen zu bestimmen. Vergleichen Sie das tatsächliche Restvolumen mit dem theoretischen Restvolumen (Anfangsvolumen - mittlere Pumprate * Infusionsdauer).
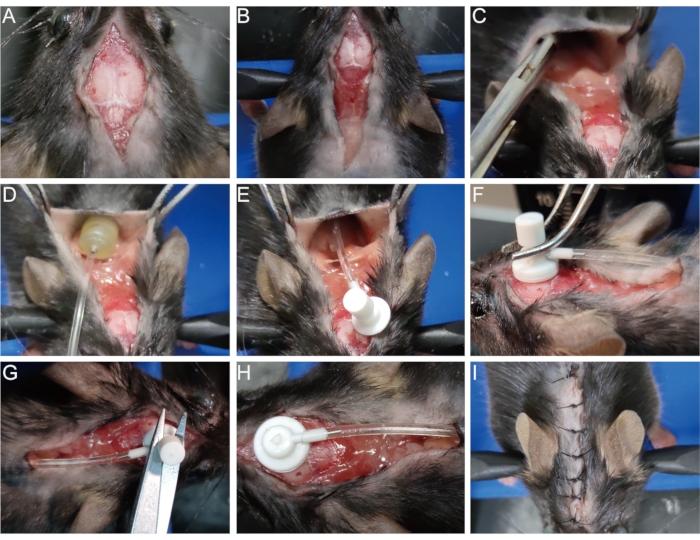
Abbildung 3: Implantation der osmotischen Pumpe. (A) Öffnen Sie den chirurgischen Schnitt. (B) Erweitern Sie den Schnitt auf die Schulterblätter. (C) Trennen Sie die Haut vom Unterhautbindegewebe, um eine Höhle zu bilden. (D,E) Setzen Sie die osmotische Pumpe in den Hohlraum ein. (F) Führen Sie die Gehirninfusionskanüle in das Loch auf der Oberfläche des Schädels ein und befestigen Sie sie fest am Schädel. (G,H) Entfernen Sie die abnehmbare Lasche aus der Kanüle. (I) Nähen Sie den Einschnitt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Um die Wirkung der osmotischen Pumpe in der Myelinregenerationsforschung zu überprüfen, wurde ein Lysolecithin-induziertes Demyelinisierungsmodell in P56-Mäusen erstellt, gefolgt von der Implantation osmotischer Pumpen, die UM206 (1 mg in 1,5 ml 0,9% Kochsalzlösung) enthielten, einem Peptid mit kurzer Halbwertszeit und schlechter BBB-Permeabilität, von dem kürzlich berichtet wurde, dass es die Remyelinisierung fördert10 . 0,9% Kochsalzlösung wurden als Kontrolle verwendet. Vierzehn Tage na...
Diskussion
Dieses Protokoll beschreibt die osmotische Pumpe als eine neuartige Arzneimittelabgabetechnik für die Myelinregenerationsforschung, die Medikamente direkt an die Behandlungsstelle abgeben und eine konsistente Arzneimittelabgabe über einen längeren Zeitraum ermöglichen kann, wodurch eine stabile Arzneimittelkonzentration in der Mikroumgebung des zentralen Nervensystems während der gesamten experimentellen Dauer erzeugt wird. Im Vergleich zu anderen Methoden der Arzneimittelabgabe ist die osmotische Pumpe förderliche...
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Diese Arbeit wurde durch Zuschüsse der National Nature Science Foundation of China (NSFC 32070964, 31871045) an J.N. und der Shenzhen Basic Research Foundation (JCYJ20210324121214039) an Y.S.
Materialien
| Name | Company | Catalog Number | Comments |
| Anesthesia Air Pump | RWD | R510-29 | E05818-006 |
| Brain Infusion kit 3 | ALZET | 0008851 | 1-3 mm |
| Carprofen | Macklin | C830557-1g | 5 mg/kg every 24 h |
| Erythromycin eye ointment | Along technology | YCKJ-RJ-024780 | Cover the surface of the eyeballs during anesthesia |
| Erythromycin ointment | pythonbio | RG180 | |
| Gas Evacuation Apparatus | RWD | R546W | E05518-002 |
| L-α-Lysophosphatidylcholine | Sigma | L0906 | Dissolve at 1% with sterile PBS |
| Microliter Syringe | Hamilton | 65460-05 | Syringe Series:1700, 10 µL, 33 gauge |
| Micro-smotic pump model 1002 | ALZET | 0004317 | 0.25 µL per hour, 14 days |
| PBS (pH = 7.3) | ORIGENE | ZLI-9061 | |
| Pentobarbital sodium | Shanghai Civi | CAS NO: 57-33-0 | 150-200 mg/kg intraperitoneal injection for euthanasia |
| Small Animal Anesthesia Machine | RWD | R520IE | E05807-006 M |
| Stereotaxic Equipment | RWD | E06382 | |
| STERI 250 sterilizer | Keller | 31101 | Rapid sterilization of surgical instruments |
| Surgical sutures | Shanghai jinhuan | F504 | 5-0 |
| Syringe needle (1 mL) | Shanghai KDL | 6930197811018 | 26 gauge (0.45 mm x 16 mm) |
| Testing drug and solvent | Experiment dependent | N/A | |
| ThermoStar Homeothermic Monitoring System | RWD | 69026 | Maintain body temperature during anesthesia |
| Vetbond Tissue adhesive | 3M | 1469SB | Secure the brain infusion cannula , Adhere the skin incision |
Referenzen
- Theeuwes, F., Yum, S. I. Principles of the design and operation of generic osmotic pumps for the delivery of semisolid or liquid drug formulations. Annals of Biomedical Engineering. 4 (4), 343-353 (1976).
- Herrlich, S., Spieth, S., Messner, S., Zengerle, R. Osmotic micropumps for drug delivery. Advanced Drug Delivery Reviews. 64 (14), 1617-1627 (2012).
- Wei, E., Loh, H. Physical dependence of opiate-like peptides. Science. 193 (4259), 1262-1263 (1976).
- Pettigrew, J. D., Kasamatsu, T. Local perfusion of noradrenaline maintains visual cortical plasticity. Nature. 271 (5647), 761-763 (1978).
- Wang, Y., et al. Reduced oligodendrocyte precursor cell impairs astrocytic development in early life stress. Advanced Science (Weinheim). 8 (16), 2101181 (2021).
- Tang, C., et al. Neural stem cells behave as a functional niche for the maturation of newborn neurons through the secretion of PTN. Neuron. 101 (1), 32-44 (2019).
- Watanabe, S., Komine, O., Endo, F., Wakasugi, K., Yamanaka, K. Intracerebroventricular administration of Cystatin C ameliorates disease in SOD1-linked amyotrophic lateral sclerosis mice. Journal of Neurochemistry. 145 (1), 80-89 (2018).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments: JoVE. , e50326 (2013).
- Tang, C., Guo, W. Implantation of a mini-osmotic pump plus stereotactical injection of retrovirus to study newborn neuron development in adult mouse hippocampus. STAR Protocols. 2 (1), 100374 (2021).
- Niu, J., et al. Oligodendroglial ring finger protein Rnf43 is an essential injury-specific regulator of oligodendrocyte maturation. Neuron. 109 (19), 3104-3118 (2021).
- Breitschopf, H., Suchanek, G., Gould, R. M., Colman, D. R., Lassmann, H. In situ hybridization with digoxigenin-labeled probes: sensitive and reliable detection method applied to myelinating rat brain. Acta Neuropathologica. 84 (6), 581-587 (1992).
- Cree, B. A. C., et al. Clemastine rescues myelination defects and promotes functional recovery in hypoxic brain injury. Brain. 141 (1), 85-98 (2018).
- Eckenhoff, B., Yum, S. I. The osmotic pump: novel research tool for optimizing drug regimens. Biomaterials. 2 (2), 89-97 (1981).
- Thoenen, H., Sendtner, M. Neurotrophins: from enthusiastic expectations through sobering experiences to rational therapeutic approaches. Nature Neuroscience. 5, 1046-1050 (2002).
- Hagg, T. Intracerebral infusion of neurotrophic factors. Methods in Molecular Biology. 399, 167-180 (2007).
- Bittner, B., Thelly, T., Isel, H., Mountfield, R. J. The impact of co-solvents and the composition of experimental formulations on the pump rate of the ALZET osmotic pump. International Journal of Pharmaceutics. 205 (1-2), 195-198 (2000).
- Arnot, M. I., Bateson, A. N., Martin, I. L. Dimethyl sulfoxide/propylene glycol is a suitable solvent for the delivery of diazepam from osmotic minipumps. Journal of Pharmacological and Toxicological Methods. 36 (1), 29-31 (1996).
- Gullapalli, R., et al. Development of ALZET osmotic pump compatible solvent compositions to solubilize poorly soluble compounds for preclinical studies. Drug Delivery. 19 (5), 239-246 (2012).
- White, J. D., Schwartz, M. W. Using osmotic minipumps for intracranial delivery of amino acids and peptides. Methods in Neurosciences. 21, 187-200 (1994).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten