Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Осмотическая помповая доставка лекарств для исследований in vivo Remyelination в центральной нервной системе
В этой статье
Резюме
Демиелинизация происходит при множественных заболеваниях центральной нервной системы. Надежная техника доставки лекарств in vivo необходима для повторного тестирования лекарств. Этот протокол описывает метод на основе осмотического насоса, который позволяет осуществлять долгосрочную доставку препарата непосредственно в паренхиму головного мозга и улучшает биодоступность препарата, с широким применением в исследованиях ремиелинизации.
Аннотация
Демиелинизация была выявлена не только при рассеянном склерозе (РС), но и при других заболеваниях центральной нервной системы, таких как болезнь Альцгеймера и аутизм. Поскольку данные свидетельствуют о том, что ремиелинизация может эффективно улучшать симптомы заболевания, все больше внимания уделяется разработке лекарств для содействия процессу регенерации миелина. Таким образом, для проверки эффективности и специфичности этих препаратов in vivo требуется метод доставки лекарств с возможностью выбора региона и получения результата. Этот протокол вводит имплантат осмотического насоса в качестве нового подхода к доставке лекарств в мышиной модели демиелинизации, индуцированной лизолецитином. Осмотический насос представляет собой небольшое имплантируемое устройство, которое может обходить гематоэнцефалический барьер (ГЭБ) и доставлять лекарства стабильно и непосредственно в определенные области мозга мыши. Он также может эффективно улучшить биодоступность лекарств, таких как пептиды и белки с коротким периодом полувыведения. Поэтому данный метод представляет большую ценность для исследования регенерации миелина центральной нервной системы.
Введение
Осмотический насос представляет собой небольшое имплантируемое устройство, высвобождающее раствор. Его можно использовать для системных родов при имплантации подкожно или в брюшную полость. Поверхность осмотического насоса представляет собой полупроницаемую мембрану, а его внутренняя сторона представляет собой проницаемый слой. Осмотический насос работает с использованием разницы осмотического давления между осмотическим слоем и тканевой средой, в которую имплантируется насос. Высокая осмоляльность осмотического слоя заставляет воду в ткани течь в осмотический слой через полупроницаемую мембрану на поверхности насоса. Осмотический слой расширяется и сжимает гибкий резервуар внутри насоса, тем самым вытесняя раствор из гибкого резервуара с определенной скоростью на длительный срок1. Насос имеет три различных объема резервуара, 100 мкл, 200 мкл и 2 мл, причем скорость их подачи варьируется от 0,11 мкл/ч до 10 мкл/ч. В зависимости от выбранного типа насоса, устройство может работать от 1 дня до 6 недель2. В этом протоколе используется осмотический насос объемом 100 мкл со скоростью передачи 0,25 мкл/ч, который может работать в течение 14 дней.
Еще в 1970-х годах осмотический насос использовался в исследованиях нейробиологии 3,4. Например, Wei et al. приняли подход осмотического насоса для инъекции опиоидных пептидов в желудочек в исследовании наркомании3. После непрерывного совершенствования осмотическая помпа теперь используется при изучении контролируемой доставки тысяч лекарств, включая пептиды, факторы роста, вызывающие привыкание препараты, гормоны, стероиды, антитела и так далее. Кроме того, с прикрепленными специальными катетерами (Brain Infusion Kits) он может быть использован для целенаправленной инфузии в определенные ткани или органы, включая спинной мозг, головной мозг, селезенку и печень 5,6,7.
При изучении ремиелинизации было показано, что многие препараты способствуют регенерации миелина in vitro, но большинство из них не достигли значительных эффектов in vivo, возможно, из-за отсутствия соответствующего метода введения. Традиционные методы введения, такие как внутрибрюшинная инъекция, подкожная инъекция и внутрижелудочное введение, имеют ограничения в биодоступности препаратов. Кроме того, некоторые препараты имеют плохую проницаемость гематоэнцефалического барьера, что подрывает их доступ к паренхиме головного мозга. Вместе эти ограничения требуют нового эффективного метода доставки. В сочетании с наборами для инфузии мозга осмотические насосы могут обходить гематоэнцефалический барьер и доставлять лекарства непосредственно в мозолистое тело, что эффективно улучшает биодоступность лекарств, особенно для некоторых полипептидных и белковых препаратов с коротким периодом полувыведения. Поэтому осмотический насос как новый метод доставки лекарств имеет большое значение для исследований регенерации миелина центральной нервной системы. Применение этого метода будет подробно представлено ниже.
протокол
Все процедуры для животных проводились в соответствии с институциональными руководящими принципами и протоколами, утвержденными комитетом по благополучию и этике животных Третьего военно-медицинского университета.
1. Создание мышиной модели демиелинизации, индуцированной лизолецитином
- Готовят 1% раствор лизолецитина (также называемого L-α-лизофосфатидилхолин) со стерильным PBS.
- Стерилизуйте ножницы, щипцы, изогнутый гемостат и другие хирургические инструменты путем автоклавной стерилизации. Стерилизуют хирургическую область и укладывают стерильные листы. Все материалы и реагенты, используемые для хирургии, должны быть подготовлены асептически. Важно, чтобы хирургическая область была стерильной на протяжении всей процедуры.
- Обезболить мышь на 56-й послеродовой день (P56) C57BL6 следующим образом.
- Поместите мышь в изофлурановую камеру анестезиологического аппарата для мелких животных. Отрегулируйте расходO2 до 300-500 мл/мин и изофлурана до 3%-4%. После достаточного обезболивания, когда мышь становится неподвижной при медленном и стабильном дыхании, переведите мышь к стереотаксическому аппарату с грелкой.
- Переключите выход газа из камеры на анестезиологическую маску и отрегулируйте изофлуран до 1% - 1,5% для поддержания мыши в состоянии анестезии. Подождите, пока мышь будет полностью обезболена, введите кетопрофен (3 – 5 мг / кг) внутрибрюшинно, чтобы облегчить боль. Перед операцией ущипните пальцы мыши и проверьте ее реакцию, чтобы подтвердить успешную анестезию8.
- Когда мышь подвергается анестезии, она не может регулировать температуру своего тела. Поэтому контролируйте и регулируйте температуру тела мыши во время операции. Чтобы глазные яблоки мыши оставались влажными, находясь под наркозом, закройте поверхность глазных яблок глазной мазью эритромицина.
- Закрепите головку мыши в стереотаксическом аппарате зубчатым стержнем и ушными вкладышами. (Рисунок 1А).
- Используйте бритву для удаления волос с макушки головы. Дезинфицируйте кожу головы тремя циклами бетадина и 75% этанола. По этическим соображениям накройте тело животного, за исключением места операции. Используя скальпель, сделайте 1 см длинный средний сагиттальный разрез кожи от основания шеи до промежутка между глазами, чтобы обнажить череп (рисунок 1B).
- Аккуратно протрите поверхность черепа стерильным ватным тампоном, содержащим 30% перекиси водорода, чтобы визуализировать черепные швы (рисунок 1C). Отрегулируйте высоту зубной перекладины и ушных стержней, чтобы поместить точку лямбда и точку брегмы на одну и ту же высоту (т. Е. С одинаковыми координатами оси Z, когда кончик иглы касается точек), чтобы сагиттальный шов был горизонтальным.
- Аккуратно поместите наконечник микролитровой шприцевой иглы (10 мкл, 33 G) в точку брегмы и сбросьте координаты x, y и z до 0 (рисунок 1D). Переместите шприц к месту инъекции (x: 1,04; y: 1,0, т.е. 1,04 мм сбоку до средней линии и 1,0 мм сзади к точке брегмы) в соответствии с подсказкой цифрового считывания (рисунок 1E).
- Медленно просверлите небольшое отверстие для заусенцев через череп в месте инъекции, не проникая в твердую мозговую оболочку с помощью шприцевой иглы 1 мл (26 г, 0,45 мм) (рисунок 1F). Медленно вставляйте микролитровую шприцевую иглу в ткань мозга через отверстие до тех пор, пока не будет достигнута определенная глубина (z = -1,62 мм для большинства мышей P56) (рисунок 1G).
ПРИМЕЧАНИЕ: Эмпирически глубина введения -1,62 мм позволяет кончику иглы достигать середины мозолистого тела большинства мышей P56, так что лизолецитин может быть непосредственно доставлен в мозолистое тело, чтобы вызвать демиелинизацию. - Вводят 1,5 мкл 1% лизолецитина со скоростью 0,3 мкл/мин. После инъекции подождите 5 минут, прежде чем медленно вытащить микролитровый шприц, чтобы предотвратить утечку жидкости по пути инъекционной иглы.
- Сшить кожу 5-0 хирургическими швами (рисунок 1Н).
- Поместите мышь на грелку, чтобы избежать падения температуры тела. Вводите подкожную инъекцию 5 мг / кг карпрофена каждые 24 ч, чтобы облегчить боль. Наносите эритромициновую мазь на разрез каждый день, чтобы убедиться, что рана заживает должным образом. Поместите мышь, перенесшую операцию, в клетку в одиночестве и кормите ее влажной пищей до полного выздоровления. Следите за мышью ежедневно после операции.
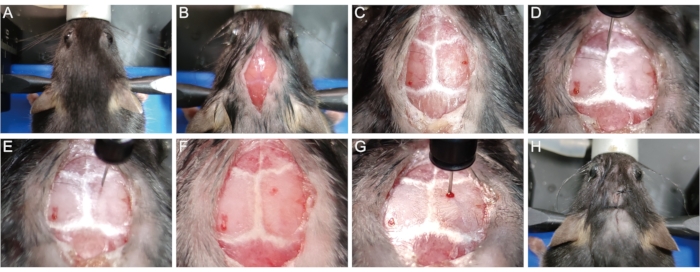
Рисунок 1: Создание мышиной модели демиелинизации, индуцированной лизолецитином. (А) Закрепите мышь в стереотаксическом аппарате. (B) Откройте 1 см средний сагиттальный разрез, чтобы обнажить череп. (C) Визуализируйте черепные швы. (D) Сбросьте координаты x, y и z до 0 в точке Брегма. (E) Переместите шприц в место инъекции. (F) Просверлить отверстие в черепе в месте инъекции. (G) Медленно вводить иглу в ткани мозга и вводить лизолецитин. (H) Сшить кожу. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Подготовка осмотического насоса
ПРИМЕЧАНИЕ: Ключевые компоненты насоса показаны на рисунке 2А.
- Определяют глубину введения мозговой инфузии канюли в мозг. Убедитесь, что используемая игла инфузионной канюли мозга имеет длину 3 мм, а каждая распорка для регулировки глубины составляет 0,5 мм. Чтобы достичь глубины инъекции 1,5 мм (близко к мозоли), приложите три корректирующие глубину распорки к игле мозговой инфузионной канюли с тканевым клеем (рисунок 2B, C).
- Чтобы заполнить осмотический насос, прикрепите иглу шприца, которая поставляется с пакетом насоса, к шприцу 1 мл и аспирируйте препарат. Держите насос в вертикальном положении, вставьте шприц в отверстие в верхней части насоса и медленно вводите препарат, стараясь не создавать пузырьки9 (см. Рисунок 2D). Когда жидкость вытечет из отверстия, медленно вытащите шприц.
- Снимите белый фланец с регулятора потока ножницами или плоскогубцами, стараясь не согнуть и не раздавить замедлитель потока. Затем вставьте замедлитель потока в насос (рисунок 2E). Чтобы определить, есть ли пузырьки в осмотическом насосе, взвесьте осмотический насос отдельно до и после наполнения.
- Обрежьте катетер до определенной длины в соответствии с размером животного (катетеры 20-25 мм для мышей P56, которые весят около 25 г). Прикрепите катетер к мозговой инфузионной канюле.
- Наполните катетер лекарственными препаратами с помощью шприца без введения воздуха (рисунок 2F).
- Подключите катетер к замедлителю потока. После прикрепления убедитесь, что катетер покрывает около 4 мм открытого замедлителя потока (рисунок 2G).
- Чтобы убедиться, что осмотический насос может работать мгновенно после имплантации, погружайте заполненные насосы в стерильный 0,9% физиологический раствор или PBS при 37 °C в течение по меньшей мере 4-6 ч (предпочтительно до ночи) для предварительного смачивания полупроницаемой мембраны на поверхности насоса растворами, которые имеют такое же осмотическое давление, как и тканевая среда (фиг.2H).
- Все растворы, загружаемые в насосы, должны быть стерильными. Насосы ALZET поставляются стерильными, подвергаясь воздействию стерилизующей дозы 60Co. Однако при наружном загрязнении поверхность насоса можно очистить, протерев его изопропиловым спиртом (70% в воде).

Рисунок 2: Подготовка осмотического насоса. (А) Ключевые компоненты осмотического насоса. (В,С) Прикрепите корректирующие глубину прокладки к игле мозговой инфузионной канюли. (D) Заполните осмотический насос с помощью шприца объемом 1 мл. (E) Вставьте замедлитель потока в насос. (F) Заполните катетер с помощью шприца. (G) Подключите катетер к замедлителю потока. (H) Погрузите заполненные насосы в стерильный 0,9% физиологический раствор или PBS при 37 °C. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Имплантация осмотического насоса
- Подождите 3 дня после установления модели демиелинизации мозолистого тела. Включите систему анестезии мелких животных. Продезинфицируйте ножницы, пинцет и плоскогубцы и замочите их в 75% спиртовом растворе. Уложите стерильные листы в хирургической зоне.
- Снова обезболивайте и закрепляйте мышей на стереотаксическом аппарате. Накройте поверхность глазных яблок глазной мазью, чтобы предотвратить сухость.
- Продезинфицируйте оригинальную рану 75% спиртом. Откройте хирургический разрез, который был предварительно сшит (рисунок 3A) и разверните разрез до лопаток (рисунок 3B).
- Отделите кожу от подкожной соединительной ткани плоскогубцами или пинцетом в лопатке, чтобы открыть полость (рисунок 3C). Поместите осмотический насос в полость (рисунок 3D,E).
- Ватным тампоном аккуратно протрите и обнажите точечное отверстие на поверхности черепа, созданное при установлении модели демиелинизации (см. шаг 1.8). Вставьте канюлю для инфузии мозга через это точечное отверстие перпендикулярно и быстро закрепите ее на черепе с помощью тканевого клея (рисунок 3F).
- Снимите съемную вкладку над канюлей для инфузии мозга ножницами (рисунок 3G, H). Кроме того, сначала удалите вкладку перед вставкой канюли, чтобы избежать тряски в этом процессе.
- Сшить разрез или прикрепить его тканевым клеем (рисунок 3I).
- После операции поместите мышь на грелку, чтобы избежать падения температуры тела. Вводите подкожную инъекцию 5 мг / кг карпрофена каждые 24 ч, чтобы облегчить боль. Наносите эритромициновую мазь на разрез каждый день, чтобы убедиться, что рана заживает должным образом. Поместите животное в клетку в одиночку и кормите влажной пищей до полного восстановления. Наблюдайте за мышами каждый день и проверяйте, была ли прикреплена канюля для инфузии мозга.
- Усыпляют мышь через 11 дней после операции путем введения 150-200 мг/кг пентобарбитала натрия внутрибрюшинно с последующей перфузией транскардиально с 4% формальдегидом.
- Чтобы убедиться, что раствор подается нормально, осторожно извлеките осмотический насос и измерьте остаточный объем в резервуаре насоса перед рассечением мозга.
- Чтобы измерить остаточный объем, удалите канюлю инфузии мозга, прикрепите к катетеру шприц объемом 1 мл, а затем аспирируйте оставшийся раствор для определения его объема. Сравните фактический остаточный объем с теоретическим остаточным объемом (начальный объем - средняя скорость перекачки * продолжительность инфузии).
ПРИМЕЧАНИЕ: Чрезмерный остаточный объем указывает на неудачную инфузию, которая может быть вызвана окклюзией катетера или неисправностью насоса.
- Чтобы измерить остаточный объем, удалите канюлю инфузии мозга, прикрепите к катетеру шприц объемом 1 мл, а затем аспирируйте оставшийся раствор для определения его объема. Сравните фактический остаточный объем с теоретическим остаточным объемом (начальный объем - средняя скорость перекачки * продолжительность инфузии).
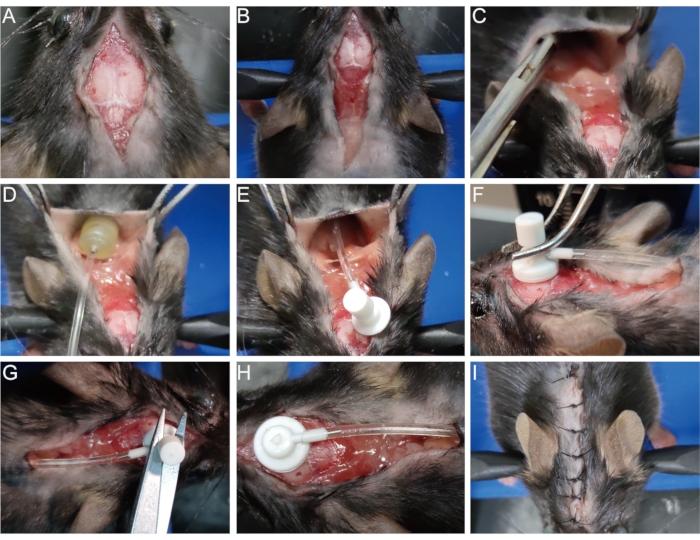
Рисунок 3: Имплантация осмотического насоса. (A) Откройте хирургический разрез. (B) Разверните разрез до лопаток. (C) Отделите кожу от подкожной соединительной ткани, чтобы создать полость. (Д,Д) Поместите осмотический насос в полость. (F) Вставьте инфузионную канюлю головного мозга в точечное отверстие на поверхности черепа и прочно закрепите ее на черепе. (Г,Ч) Снимите съемную вкладку с канюли. (I) Сшить разрез. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Чтобы проверить влияние осмотического насоса на исследования регенерации миелина, у мышей P56 была создана модель демиелинизации, индуцированная лизолецитином, с последующей имплантацией осмотических насосов, содержащих UM206 (1 мг в 1,5 мл 0,9% физиологического раствора), пептид с коротким ?...
Обсуждение
Этот протокол описывает осмотический насос как новый метод доставки лекарств для исследования регенерации миелина, который может доставлять лекарства непосредственно в место лечения и обеспечивать последовательную доставку лекарств в течение длительного периода, создавая стабильн...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана грантами Национального научного фонда природы Китая (NSFC 32070964, 31871045) J.N. и Шэньчжэньского фонда фундаментальных исследований (JCYJ20210324121214039) Y.S.
Материалы
| Name | Company | Catalog Number | Comments |
| Anesthesia Air Pump | RWD | R510-29 | E05818-006 |
| Brain Infusion kit 3 | ALZET | 0008851 | 1-3 mm |
| Carprofen | Macklin | C830557-1g | 5 mg/kg every 24 h |
| Erythromycin eye ointment | Along technology | YCKJ-RJ-024780 | Cover the surface of the eyeballs during anesthesia |
| Erythromycin ointment | pythonbio | RG180 | |
| Gas Evacuation Apparatus | RWD | R546W | E05518-002 |
| L-α-Lysophosphatidylcholine | Sigma | L0906 | Dissolve at 1% with sterile PBS |
| Microliter Syringe | Hamilton | 65460-05 | Syringe Series:1700, 10 µL, 33 gauge |
| Micro-smotic pump model 1002 | ALZET | 0004317 | 0.25 µL per hour, 14 days |
| PBS (pH = 7.3) | ORIGENE | ZLI-9061 | |
| Pentobarbital sodium | Shanghai Civi | CAS NO: 57-33-0 | 150-200 mg/kg intraperitoneal injection for euthanasia |
| Small Animal Anesthesia Machine | RWD | R520IE | E05807-006 M |
| Stereotaxic Equipment | RWD | E06382 | |
| STERI 250 sterilizer | Keller | 31101 | Rapid sterilization of surgical instruments |
| Surgical sutures | Shanghai jinhuan | F504 | 5-0 |
| Syringe needle (1 mL) | Shanghai KDL | 6930197811018 | 26 gauge (0.45 mm x 16 mm) |
| Testing drug and solvent | Experiment dependent | N/A | |
| ThermoStar Homeothermic Monitoring System | RWD | 69026 | Maintain body temperature during anesthesia |
| Vetbond Tissue adhesive | 3M | 1469SB | Secure the brain infusion cannula , Adhere the skin incision |
Ссылки
- Theeuwes, F., Yum, S. I. Principles of the design and operation of generic osmotic pumps for the delivery of semisolid or liquid drug formulations. Annals of Biomedical Engineering. 4 (4), 343-353 (1976).
- Herrlich, S., Spieth, S., Messner, S., Zengerle, R. Osmotic micropumps for drug delivery. Advanced Drug Delivery Reviews. 64 (14), 1617-1627 (2012).
- Wei, E., Loh, H. Physical dependence of opiate-like peptides. Science. 193 (4259), 1262-1263 (1976).
- Pettigrew, J. D., Kasamatsu, T. Local perfusion of noradrenaline maintains visual cortical plasticity. Nature. 271 (5647), 761-763 (1978).
- Wang, Y., et al. Reduced oligodendrocyte precursor cell impairs astrocytic development in early life stress. Advanced Science (Weinheim). 8 (16), 2101181 (2021).
- Tang, C., et al. Neural stem cells behave as a functional niche for the maturation of newborn neurons through the secretion of PTN. Neuron. 101 (1), 32-44 (2019).
- Watanabe, S., Komine, O., Endo, F., Wakasugi, K., Yamanaka, K. Intracerebroventricular administration of Cystatin C ameliorates disease in SOD1-linked amyotrophic lateral sclerosis mice. Journal of Neurochemistry. 145 (1), 80-89 (2018).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments: JoVE. , e50326 (2013).
- Tang, C., Guo, W. Implantation of a mini-osmotic pump plus stereotactical injection of retrovirus to study newborn neuron development in adult mouse hippocampus. STAR Protocols. 2 (1), 100374 (2021).
- Niu, J., et al. Oligodendroglial ring finger protein Rnf43 is an essential injury-specific regulator of oligodendrocyte maturation. Neuron. 109 (19), 3104-3118 (2021).
- Breitschopf, H., Suchanek, G., Gould, R. M., Colman, D. R., Lassmann, H. In situ hybridization with digoxigenin-labeled probes: sensitive and reliable detection method applied to myelinating rat brain. Acta Neuropathologica. 84 (6), 581-587 (1992).
- Cree, B. A. C., et al. Clemastine rescues myelination defects and promotes functional recovery in hypoxic brain injury. Brain. 141 (1), 85-98 (2018).
- Eckenhoff, B., Yum, S. I. The osmotic pump: novel research tool for optimizing drug regimens. Biomaterials. 2 (2), 89-97 (1981).
- Thoenen, H., Sendtner, M. Neurotrophins: from enthusiastic expectations through sobering experiences to rational therapeutic approaches. Nature Neuroscience. 5, 1046-1050 (2002).
- Hagg, T. Intracerebral infusion of neurotrophic factors. Methods in Molecular Biology. 399, 167-180 (2007).
- Bittner, B., Thelly, T., Isel, H., Mountfield, R. J. The impact of co-solvents and the composition of experimental formulations on the pump rate of the ALZET osmotic pump. International Journal of Pharmaceutics. 205 (1-2), 195-198 (2000).
- Arnot, M. I., Bateson, A. N., Martin, I. L. Dimethyl sulfoxide/propylene glycol is a suitable solvent for the delivery of diazepam from osmotic minipumps. Journal of Pharmacological and Toxicological Methods. 36 (1), 29-31 (1996).
- Gullapalli, R., et al. Development of ALZET osmotic pump compatible solvent compositions to solubilize poorly soluble compounds for preclinical studies. Drug Delivery. 19 (5), 239-246 (2012).
- White, J. D., Schwartz, M. W. Using osmotic minipumps for intracranial delivery of amino acids and peptides. Methods in Neurosciences. 21, 187-200 (1994).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены